-
Články
- Vzdělávání
- Časopisy
Top články
Nové číslo
- Témata
- Kongresy
- Videa
- Podcasty
Nové podcasty
Reklama- Kariéra
Doporučené pozice
Reklama- Praxe
Role transthyretinu v rozvoji amyloidózy
20. 12. 2022
Transthyretin (TTR), jeden z transportních proteinů, má sklon tvořit extracelulární depozita, jež se akumulují v klíčových orgánech, jako jsou srdce a nervy. Tvorba depozit TTR vede až k rozvoji systémové amyloidózy, onemocnění se značně heterogenními klinickými projevy. Mezi varovné známky může patřit například i syndrom karpálního tunelu. Jaká je fyziologická úloha TTR v organismu a jakou roli hraje jeho struktura v rozvoji amyloidózy?
Fyziologická funkce TTR
TTR byl poprvé objeven v cerebrospinální tekutině (CSF) a séru. Jeho funkcí je transport hormonu thyroxinu (T4). V plazmě TTR zprostředkovává přenos 15 % T4, v CSF je to až 80 %. TTR se také specificky váže na retinol vázající protein (RBP). Předpokládá se, že vazba TTR na RBP zabraňuje ztrátě RBP během glomerulární filtrace v ledvinách.
TTR je syntetizován v různých tkáních, například játrech, choroidálním plexu mozku, alfa-buňkách pankreatu a retinálních pigmentových epitelových buňkách. Koncentrace TTR se v jednotlivých tkáních liší, v CSF potom představuje 25 % celkového proteinu. Plazmatická koncentrace TTR je vyšší v dospělosti než v dětství a u mužů než u žen. TTR se používá jako indikátor dostatku energie a proteinů.
InzerceStruktura TTR
Gen pro protein TTR kóduje 147 aminokyselin, z nichž prvních 20 obsahuje signální sekvenci, která se před extracelulárním transportem odštěpí. Maturovaný TTR obsahuje 127 aminokyselin a tvoří homotetramer s centrálním kanálem. Ačkoliv jsou na tetrameru TTR přítomná 2 vazebná místa pro T4, z důvodu jejich negativní kooperace dochází k vazbě pouze jedné molekuly T4 na tetramer. Obdobná je situace i v případě RBP, na tetramer TTR se mohou současně navázat 2 molekuly RBP s navázaným retinolem.
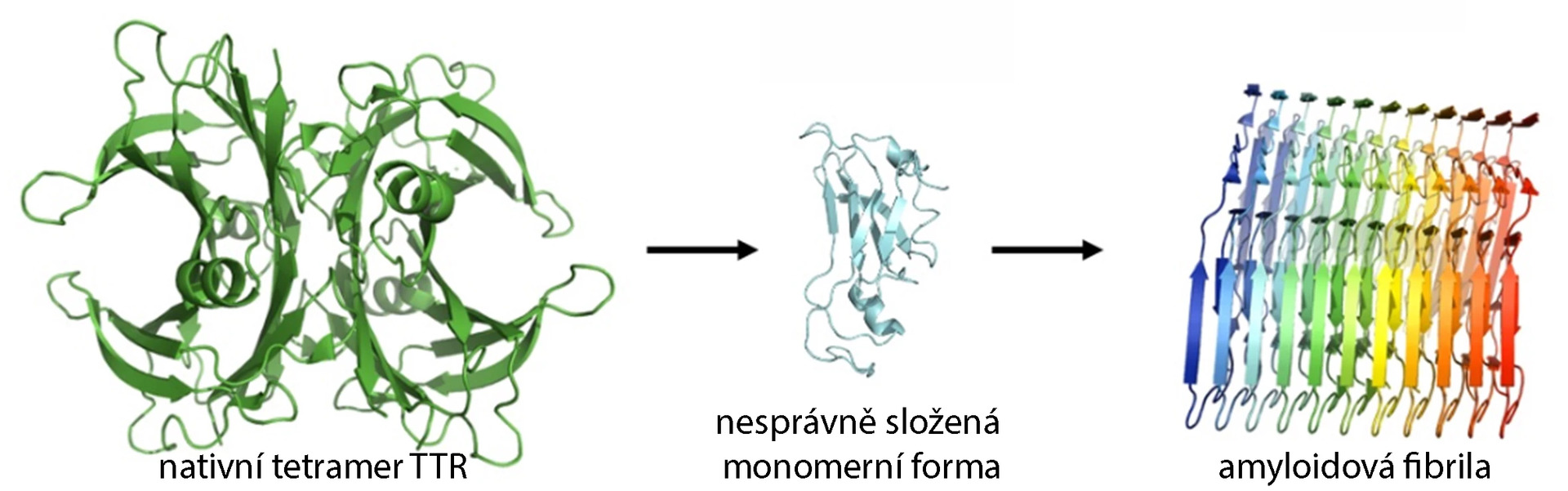
Primární struktura TTR je evolučně velmi konzervovaná. Mutace v genu TTR v drtivé většině případů způsobují destabilizaci tetrameru TTR, což je považováno za klíčový krok v tvorbě amyloidu a rozvoji amyloidózy. Tetramer samotný depozita netvoří, jeho disociace na monomery však může vést ke tvorbě amyloidu a rozvoji amyloidózy.
Obr. Disociace tetrameru TTR a tvorba amyloidní fibrily (převzato ze Saponaro et al.)
Systémová amyloidóza a její projevy
Jsou popsané dva druhy systémové amyloidózy − dědičná familiární ATTR amyloidóza způsobená mutací v genu TTR a tzv. ATTR-wt amyloidóza, která se projevuje u jedinců bez patologických mutací TTR ve vyšším věku.
U pacientů s dědičnou systémovou amyloidózou nacházíme senzomotorické polyneuropatie, autonomní dysfunkce, srdeční selhání, poruchy gastrointestinálního traktu a další symptomy, které ve většině případů vedou k úmrtí do 10 let od počátku onemocnění. Onemocnění se obvykle manifestuje u osob starších 40 let (v závislosti na typu mutace), medián přežití od diagnózy u neléčených pacientů činí asi 2 roky.
Mezi součásti symptomatologie senilní systémové amyloidózy patří kardiomyopatie, syndrom karpálního tunelu, stenóza páteřního kanálu a neuropatie u seniorů. Onemocnění se obvykle projeví po 65 letech věku a o něco více jsou ohroženi muži. U neléčených pacientů je medián přežití od stanovení diagnózy přibližně 43 měsíců.
Kardiomyopatie způsobená transthyretinovou amyloidózou (ATTR-CM) představuje závažnou chorobu, jež se v Česku vyskytuje nejčastěji v získané formě. Pro zlepšení prognózy nemocných je klíčová časná diagnostika a následná terapie.
(eko)
Zdroje:
1. Ueda M. Transthyretin: its function and amyloid formation. Neurochem Int 2022; 155 : 105313, doi: 10.1016/j.neuint.2022.105313.
2. Saponaro F., Kim J. H., Chiellini G. Transthyretin stabilization: an emerging strategy for the treatment of Alzheimer's disease? Int J Mol Sci 2020; 21 (22): 8672, doi: 10.3390/ijms21228672.
3. Cardiac amyloidosis program. UC Davis Health, 2022. Dostupné na: https://health.ucdavis.edu/internalmedicine/cardio/cardiac-amyloidosis-program/more-info.html#Familial
Líbil se Vám článek? Rádi byste se k němu vyjádřili? Napište nám − Vaše názory a postřehy nás zajímají. Zveřejňovat je nebudeme, ale rádi Vám na ně odpovíme.
Štítky
Neurologie
Nejnovější kurzy
Autoři: MUDr. Radim Mazanec, Ph.D.
Přejít do kurzů
Nejčtenější tento týden Celý článekPřihlášení#ADS_BOTTOM_SCRIPTS#Zapomenuté hesloZadejte e-mailovou adresu, se kterou jste vytvářel(a) účet, budou Vám na ni zaslány informace k nastavení nového hesla.
- Vzdělávání



