-
Medical journals
- Career
Simultánní ipsilaterální nefrektomie a transplantace ledviny u pacientů s polycystickým onemocněním ledviny
Authors: K. Morita; T. Hirose; H. Sasaki; M. Masayoshi; T. Tanabe; D. Iwami; K. Hotta; N. Fukuzawa; K. Nonomura
Published in: Urol List 2013; 11(1): 27-30
Overview
Při transplantaci ledviny postižené onemocněním v konečném stadiu (ESRD) u pacientů s polycystickým onemocněním ledvin (PKD) je naprosto nezbytná prevence peroperačních komplikací souvisejících se zvětšenou polycystickou ledvinou. Autoři studie retrospektivně hodnotí klinický průběh a výsledky transplantace ledviny u pacientů s ESRD a PKD. Do studie bylo zařazeno 11 pacientů (šest mužů a pět žen; střední věk v době transplantace 54 let, rozmezí 37–67 let). Pacienti byli po operaci sledováni po střední dobu 35 měsíců (9–134 měsíců). Ipsilaterální ledvina byla odstraněna současně s transplantací kromě jediného případu, kdy bylo nutné ledvinu odstranit dříve z důvodu infekce. Všichni pacienti jsou naživu s funkčním transplantátem. Střední hodnota kreatininu při posledním měření činila 1,08 (0,67–3,17) mg/dl. Celkem u čtyř pacientů došlo k akutní rejekci, u dvou pacientů se vyskytla virová infekce, u dalších dvou bakteriální infekce ve vlastní ledvině (u jednoho provedena nefrektomie) a u jednoho pacienta ileus. U šesti pacientů došlo ke zmenšení velikosti zbývající ledviny, u čtyř pacientů nebyla zaznamenána žádná změna a pouze u jednoho došlo k jejímu zvětšení, v důsledku čehož byla 11 let po transplantaci indikována nefrektomie. U většiny pacientů dochází po úspěšné transplantaci ledviny ke zmenšení vlastní ledviny s PKD. Ipsilaterální nefrektomie představuje bezpečnou techniku volby pro zajištění místa pro implantaci alograftu.
Klíčová slova:
komplikace, onemocnění ledviny v konečném stadiu, transplantace ledviny, nefrektomie vlastní ledviny, polycystické onemocnění ledvin
U pacientů s polycystickým onemocněním ledvin (PKD), u nichž dojde k chronickému selhání ledvin, se vyskytují specifické komorbidity, jako např. infekce renální cysty, krvácení v ledvině, komprese v důsledku rezistence (dyskomfort, bolest), systémové aneuryzmatické postižení a divertikly kolon. Řešení peroperačních komplikací souvisejících se zvětšenou polycystickou ledvinou je při transplantaci ledviny postižené onemocněním v konečném stadiu (ESRD) u pacientů s polycystickým onemocněním ledvin (PKD) naprosto nezbytné. Možnost dárcovství orgánů mezi partnery umožnila v Japonsku provádět od počátku tohoto tisíciletí transplantaci ledviny u pacientů s PKD. V roce 2010 činil v Japonsku počet transplantací ledviny u pacientů s PKD 76 případů z 1 332 transplantací celkem [1]. Ačkoli transplantace ledviny u pacientů s PKD není spojena s žádným významným imunologickým rizikem, je nutné před výkonem zohlednit všechny výše uváděné faktory (infekce, komprese a aneuryzma). Uvádí se, že bilaterální simultánní nefrektomie (před transplantací i po ní) vlastní ledviny je spojena s významnou morbiditou [2]. V našem centru proto provádíme odstranění ipsilaterální ledviny současně s transplantací ledviny, abychom zabezpečili prostor pro alograft. Autoři retrospektivně hodnotí klinický průběh a výsledný stav zbývající ledviny po transplantaci u pacientů s ESRD a PKD.
PACIENTI A METODY
Retrospektivně jsme hodnotili lékařské záznamy 11 pacientů, u nichž došlo v důsledku PKD k selhání ledviny a kteří podstoupili transplantaci ledviny v našem centru v letech 2000–2011. Tab. 1 uvádí seznam předoperačních faktorů a komorbidit u jednotlivých pacientů. V anamnéze pacientů se vyskytovaly čtyři případy onemocnění mozku (mozkový infarkt u dvou a cerebrální aneuryzma u dalších dvou pacientů), dva případy srdečního onemocnění (hypertrofická kardiomyopatie (HCM) a regurgitace aortální chlopně (AVR)) a dva případy benigní prostatické hyperplazie. Pacient číslo tři (53letý muž) měl anamnézu konkrementu ve společném žlučovodu (CBD) a chronickou infekci HBV a HCM. Pacientka číslo devět (47letá žena) s anamnézou AVR (léčeno implantací umělé chlopně a trvalou profylaktickou medikací antikoagulancií) byla rovněž léčena pro prolaktinom.
Table 1. Předoperační parametry (komorbidity). 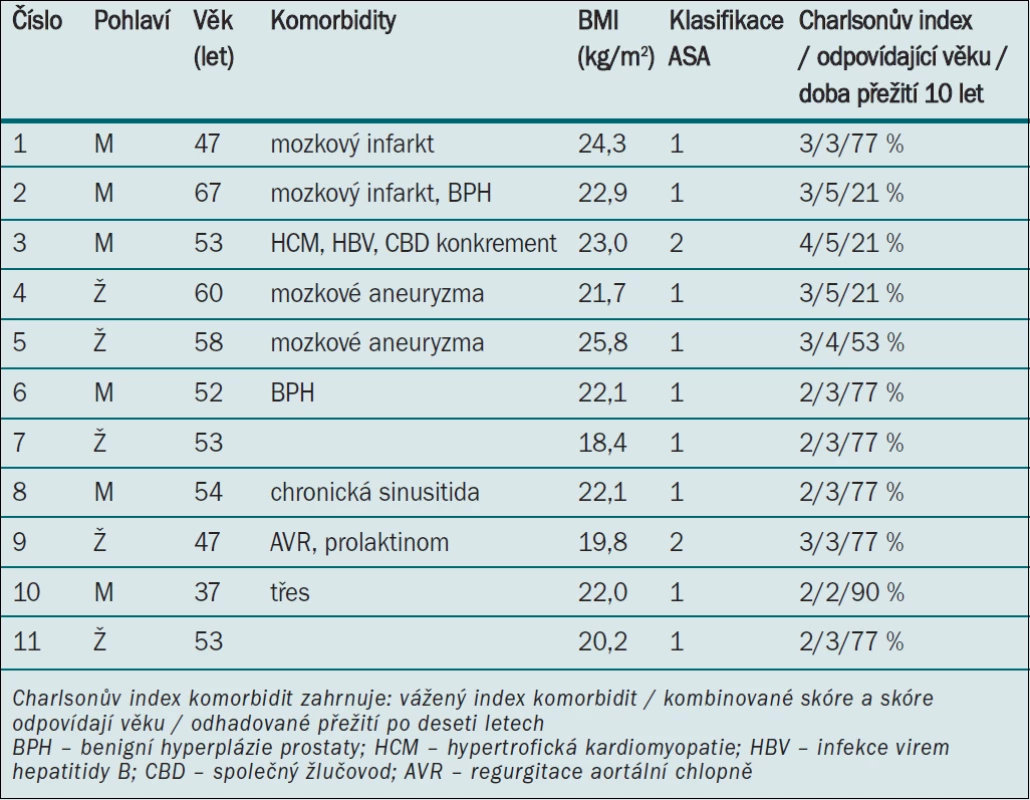
Střední index tělesné hmotnosti (BMI) pacientů činil 22,1 (rozmezí 18,4–25,8) kg/m2. Fyzický stav pacienta před operací podle klasifikace Americké anesteziologické společnosti (ASA) byl hodnocen jako 1 nebo 2. Byl spočítán Charlsonův index/ /skóre komorbidit [3] a uváděn jako vážený index komorbidity (číslo 2–4), kombinované skóre stavu a skóre odpovídající věku (2–5) a odhadovaná míra přežití po 10 letech (21–90 %). Tři pacienti (2–4) měli poměrně vysoké riziko (kombinované skóre a skóre odpovídající věku a 21% odhadovaná míra přežití 10 let).
Tab. 2 uvádí demografické údaje pacientů související s dialýzou a transplantací. Všichni pacienti měli autozomálně dominantní PKD, vyjma pacienta se sporadickým PKD (číslo 9). V pěti případech byla provedena preemptivní transplantace ledviny. V polovině případů z deseti transplantací od živého dárce byl dárcem partner/ /partnerka pacienta. V pěti případech se jednalo o transplantaci s nekompatibilní krevní skupinou ABO, pacienti užívali rituximab a podstoupili plazmaferézu v rámci desenzitizačního protokolu. Všichni pacienti podstoupili čtyřnásobnou imunosupresi zahrnující aplikaci basiliximabu, inhibitoru kalcineurinu, mykofenolátu mofetilu a steroidů. Jedna pacientka (číslo 7) vyžadovala současně s transplantací ledviny provedení splenektomie z důvodu přítomnosti protilátky proti HLA antigenům dárce i protilátky proti ABO.
Table 2. Předoperační parametry (dialýza a transplantace). 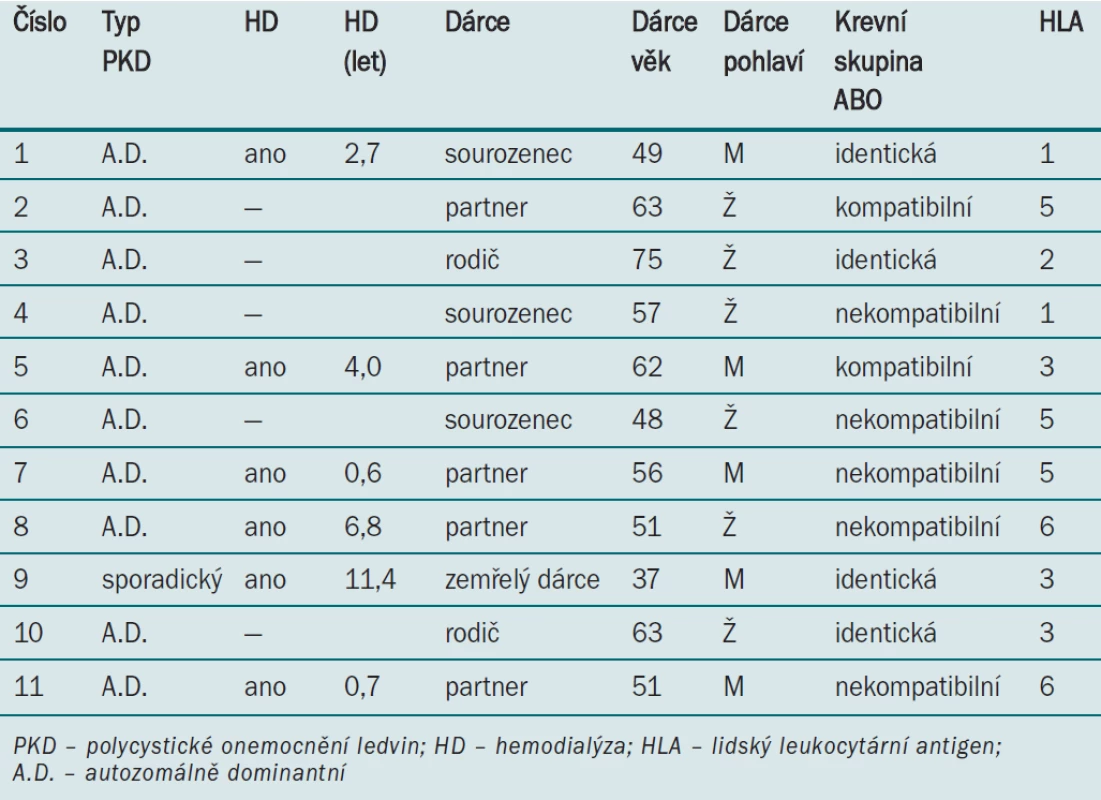
VÝSLEDKY
Tab. 3 uvádí data týkající se operace a pooperačního průběhu. Deset pacientů podstoupilo transplantaci ledviny okamžitě po ipsilaterální nefrektomii vlastní ledviny (prostřednictvím jediné incize ve třech případech a samostatnou incizí v sedmi případech). Jedna pacientka (číslo 9) podstoupila pouze levostrannou transplantaci, neboť její ledvina byla odstraněna 11 let před výkonem z důvodu symptomatické infekce PKD. Střední délka operace v deseti případech činila (nefrektomie vlastní ledviny a transplantace) 9,05 hod (rozmezí 7,09–11,51). Střední krevní ztráta činila 600 ml (rozmezí 530–1 510 ml), u pěti pacientů byla nutná krevní transfuze. Ve třech případech byla nutná ex vivo renální arterioplastika, neboť alograft měl větší počet arterií. U pacientky číslo 7 byla provedena nefrektomie vlastní ledviny a transplantace na levé straně, neboť bylo z důvodu protilátek proti HLA antigenům nezbytné provedení splenektomie. Pacienti byli propuštěni v rozmezí 20–49 dnů po operaci (střední hodnota 31 dnů). U dvou pacientů se vyskytly závažné operační komplikace (komplikace stupně IIIb podle Clavienovy klasifikace 4). U jednoho pacienta (číslo 6, 52 let) byla provedena otevřená laparotomie a hemostáza z důvodu krvácení v renálním parenchymu po biopsii (26. den po operaci). U další pacientky (číslo 9, 47 let) byla provedena otevřená laparotomie a hemostáza z důvodu krvácení z oblasti kolem alograftu (5. den po operaci). U této pacientky bylo rovněž nutné provedení transsafenoidální hemostázy hypofýzy z důvodu krvácení z prolaktinomu (7. den po operaci). U obou pacientů byla nasazena agresivní antikoagulační léčba s cílem zabránit trombóze v alograftu (rejekce vyvolaná protilátkami) a trombóze umělé aortální chlopně. U čtyř pacientů byla v průběhu 14–74 dnů po operaci nutná antirejekční terapie (s přechodnou hemodialýzou u jednoho pacienta). Patologické vyšetření odstraněné vlastní ledviny prokázalo u pacienta číslo 8 (54 let) přítomnost incidentálního papilárního karcinomu z renálních buněk (11 mm v průměru).
Table 3. Operační údaje (záznam operace a pooperačního průběhu). 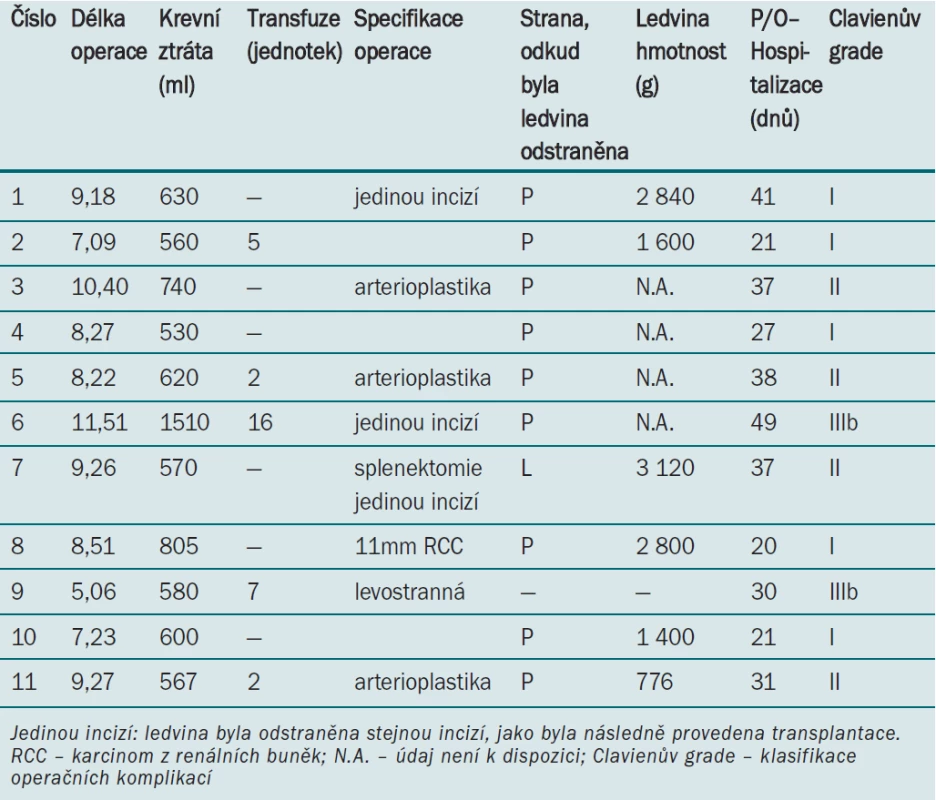
Tab. 4 uvádí data týkající se dlouhodobého pooperačního průběhu. Všichni pacienti jsou naživu s funkčním alograftem. Pacienti byli po operaci sledováni po střední dobu 35 měsíců (9–134 měsíců). Střední hodnota nadir hladiny kreatininu v séru činila 0,92 (rozmezí 0,5–1,9) mg/dl. Střední hodnota hladiny kreatininu v séru činila 1,08 (rozmezí 0,67–3,17) mg/dl. Celkem u dvou pacientů došlo k akutní buněčné rejekci, u dvou pacientů k akutní protilátkami vyvolané rejekci, u dvou pacientů se vyskytla virová infekce a u dvou bakteriální infekce ve vlastní ledvině (u jednoho z nich byla provedena nefrektomie). U jedné pacientky, která podstoupila nefrektomii vlastní ledviny 11 let po transplantaci, došlo ke zvětšení zbývající ledviny, u šesti pacientů došlo ke zmenšení ledviny a u čtyř pacientů nedošlo k žádné změně.
Table 4. Pooperační průběh (dlouhodobě). 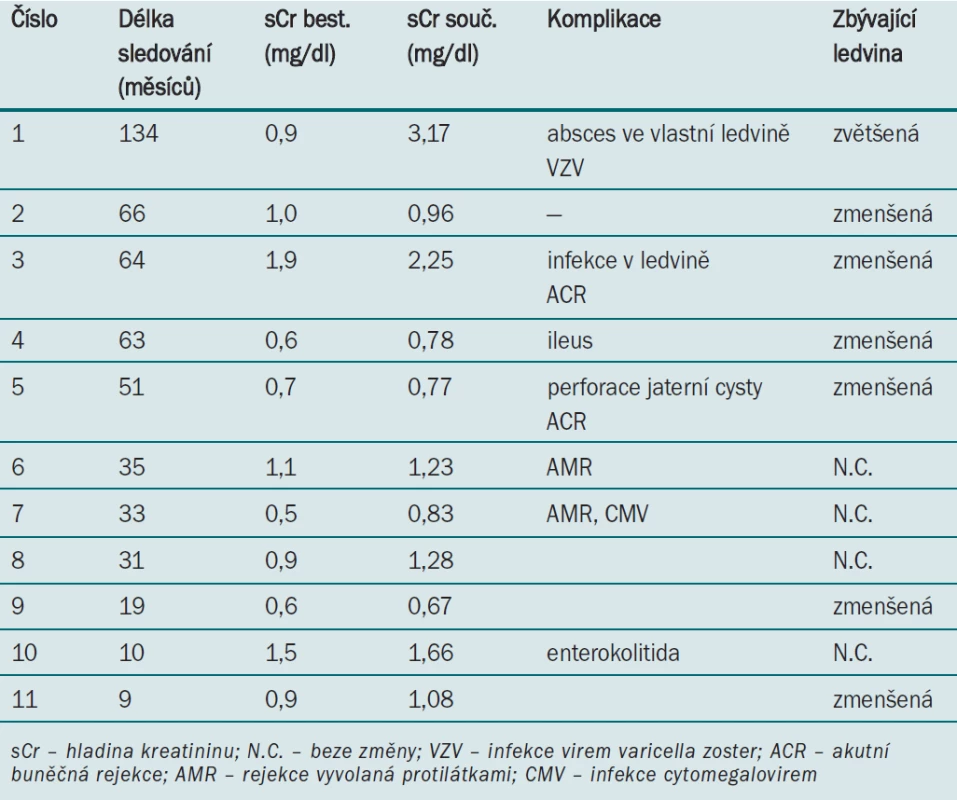
DISKUZE
Největší počet případů nefrektomie u pacientů s PKD v analýze jediného centra popisují Kirkman et al [2]. Autoři prezentují 35 případů (20 před transplantací, 12 po transplantaci a 3 s použitím sendvičové techniky), kdy 3 pacienti zemřeli v důsledku komplikací po simultánní bilaterální nefrektomii a 7 pacientů bylo hospitalizováno na jednotce intenzivní péče. Autoři dospěli k závěru, že nejbezpečnější je unilaterální nefrektomie po transplantaci ledviny. Desai et al provedli laparoskopickou nefrektomii před transplantací u 13 pacientů s ADPKD s cílem zajistit prostor pro alograft [5]. Pooperační komplikace zahrnovaly poranění sleziny, pleury, vena cava a střeva. Konverze k otevřené operaci byla nutná u dvou pacientů. Autoři zdůrazňují, že laparoskopická technika před transplantací je minimálně invazivní a vyžaduje kratší interval do samotné transplantace než po nefrektomii (průměrně o 9,14 dnů). I přes pozitivní výsledky, jako např. v případě ledviny extrémní velikosti vážící 22 kg [6], je ve skutečnosti nefrektomie u pacientů s PKD spojena s vysokou incidencí operační morbidity, jak uvádějí větší série [2,5].
Na základě těchto skutečností bylo u našich pacientů indikováno současné provedení nefrektomie a transplantace ledviny, protože vlastní ledvina s PKD nevykazovala žádné symptomy a její odstranění bylo nezbytné pro zajištění místa pro alograft. Pacienti v naší studii měli (ve srovnání s výše uváděnými studiemi) poměrně nízký index tělesné hmotnosti a nižší stupeň předoperačních komorbidit na stupnici ASA i Charlsonově indexu [3]. Ačkoli délka operace i krevní ztráta při transplantaci ledviny byly větší než ve výše uváděných studiích [5], samotná nefrektomie nebyla spojena s žádnými pooperačními komplikacemi. Komplikace v podobě krvácení zaznamenané u dvou pacientů (Clavienův grade IIIb) byly vyvolány biopsií alograftu a peroperační aplikací antikoagulancií. Rozsáhlé zmenšení masy tkáně v důsledku nefrektomie může způsobit střevní ischemii s následnou sepsí a syndromem mnohačetné dysfunkce orgánů, které může vést až k úmrtí pacienta, zejména při simultánní bilaterální nefrektomii [2].
Zamýšleli jsme provést ipsilaterální nefrektomii přímo před transplantací a pouhé sledování kontralaterální ledviny. U většiny pacientů došlo ke zmenšení kontralaterální vlastní ledviny (6 pacientů), pouze u jediné pacientky bylo nutné 10 let po transplantaci provedení nefrektomie z důvodu infekce. Pakliže je v iliacké jámě dostatečný prostor pro transplantaci, není provedení nefrektomie během transplantace nezbytné. V nedávné době byla jako alternativa k nefrektomii testována arteriální embolizace při katetrizaci tepny (TAE) s cílem redukovat hmotu vlastní polycystické ledviny [7]. Pacientka číslo 11 podstoupila TAE šest měsíců před transplantací; došlo ke zmenšení vlastní PKD ledviny, pro získání dostatečného prostoru však bylo nutné provedení pravostranné nefrektomie (pravá ledvina menší než levá ledvina). S cílem dále minimalizovat výskyt operačních komplikací při transplantaci ledviny se v budoucnu bude doporučovat postup bez nefrektomie vlastní ledviny.
VYSVĚTLIVKY
ACR – akutní buněčná rejekce
ADPKD – autozomálně dominantní polycystické onemocnění ledviny
AMR – protilátkami zprostředkovaná rejekce
ASA – Americká anesteziologická společnost
AVR – regurgitace aortální chlopně
BMI – index tělesné hmotnosti
BPH – benigní hyperplazie prostaty
CBD – společný žlučovod
CMV – cytomegalovirus
EDRD – onemocnění ledviny v konečném stadiu
HBV – infekce virem hepatitidy B
HCM – hypertrofická kardiomyopatie
HD – hemodialýza
HLA – lidský leukocytární antigen
PKD – polycystické onemocnění ledvin
RCC – karcinom z jasných buněk
TAE – transarteriální embolizace
Sources
1. Annual progress report from the Japanese renal transplant registry: Number of renal transplantation in 2010, part 2. The Japanese Society for Clinical Renal Transplantation. Ishoku 2011; 46(6): 506–523.
2. Kirkman MA, van Dellen D, Mehra S et al. Native nephrectomy for autosomal dominant polycystic kidney disease: before or after kidney transplantation? BJU Int 2011; 108(4): 590–594.
3. Charlson ME, Pompei P, Ales KL et al. A new method of classifying prognostic comorbidity in longitudinal studies: Development and validation. J Chron Dis 1987; 40(5): 373–383.
4. Dindo D, Demartines N, Clavien P. Classification of surgical complications. A new proposal with evaluation in a cohort of 6,336 patients and results of a survey. Ann Surg 2004; 240(2): 205–213.
5. Desai MR, Nandkishore SK, Ganpule A et al. Pretransplant laparoscopic nephrectomy in adult polycystic kidney disease: a single centre experience. BJU Int 2008; 101(1): 94–97.
6. Ekser B, Rigotti P. Autosomal dominant polycystic kidney disease. Images in clinical medicine. N Engl J Med 2010; 363(1): 71.
7. Cornelis F, Couzi L, Le Bras Y et al. Embolization of polycystic kidneys as an alternative to nephrectomy before renal transplantation: A pilot study. Am J Transpl 2010; 10(10): 2363–2369.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2013 Issue 1-
All articles in this issue
- Využití inhibitorů fosfodiesterázy v urologii při léčbě erektilní dysfunkce
- Tadalafil v léčbě LUTS/BPH a ED
- Léčba zanořeného penisu
- Varikokéla a smysl jejího řešení
- Laparoskopická nefrektomie při léčbě atrofické ledviny postižené vážnou infekcí
- Simultánní ipsilaterální nefrektomie a transplantace ledviny u pacientů s polycystickým onemocněním ledviny
- Retroperitoneální laparoskopická nefrektomie u pacientů léčených pomocí peritoneální dialýzy
- Předběžné výsledky transperitoneální laparoendoskopické radikální nefrektomie s užitím improvizovaného čínského zařízení s jedním portem
- Hodnocení současných trendů a kontroverzních otázek při užívání ureterálních stentů
- Vede časná ESWL po PCNL k uvíznutí konkrementů v přístupovém kanále? Mýtus nebo skutečnost
- Preference pacientů pro pokročilé urologické techniky: vodítko pro budoucí vývoj chirugické léčby?
- Bipolární plazmatická vaporizace prostaty při léčbě symptomatického zvětšení prostaty: klinické výsledky po dvou letech sledování
- Pohlavie ako faktor ovplyvňujúci klinicko-patologické ukazovatele a prognózu karcinómu obličky
- Guidelines EAU pro léčbu zakřivení penisu
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Léčba zanořeného penisu
- Varikokéla a smysl jejího řešení
- Guidelines EAU pro léčbu zakřivení penisu
- Hodnocení současných trendů a kontroverzních otázek při užívání ureterálních stentů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

