-
Medical journals
- Career
Současné přístupy k inguinální lymfadenektomii při léčbě karcinomu penisu
Authors: T. Kim; T. Hakky; P. E. Spiess
Authors‘ workplace: Department of Genitourinary Oncology ; Tampa, FL 33612
Published in: Urol List 2010; 8(4): 25-27
Overview
Léčba metastáz do lymfatických uzlin (LNM) u pacientů s karcinomem penisu ze skvamózních buněk představuje výzvu jak z pohledu medikamentózní, tak chirurgické léčby. Vhodná léčba inguinálních a pánevních lymfatických uzlin však může sloužit nejen jako prognostický indikátor, ale u mnoha pacientů nabízí také šanci na vyléčení onemocnění [1]. V tomto přehledu prezentujeme možnosti léčby inguinálních a pánevních lymfatických uzlin a různé aspekty ilioinguinální lymfadenektomie (ILND).
KLINICKÉ VYŠETŘENÍ
U každého pacienta, u něhož máme podezření na přítomnost karcinomu penisu ze skvamózních buněk, se doporučuje provedení fyzikálního vyšetření inguinálních lymfatických uzlin. Hmatnou adenopatii lze po dobu prvních 3–6 týdnů léčit pomocí antibiotik. Remise po ukončení léčby antibiotiky však nezaručuje absenci LNM [2]. Pro stanovení definitivní diagnózy se doporučuje provedení cytologického vyšetření vzorku ze hmatné inguinální uzliny odebraného pomocí perkutánní aspirace jemnou jehlou [9].
Doposud nemáme k dispozici žádné zobrazovací vyšetření, které by umožňovalo přesně stanovit stadium nehmatné LNM. Ultrazvukové vyšetření, CT ani MRI neumožňují spolehlivou diagnostiku LNM. Alternativní diagnostickou modalitou je kombinace pozitronové emisní tomogra-fie a CT s aplikací fluorodeoxyglukózy (18F-FDG) [3].
Bylo prokázáno, že časnější provedení ILND (do šesti týdnů po resekci primárního tumoru) má zejména u pacientů s lokálně pokročilým onemocněním benefit v době přežití [4]. Na základě patologického stadia primárního tumoru penisu stanovil Solsona následující rizikové skupiny: tumory ve stadiu T1G1 jsou spojeny s nízkým rizikem vzniku LNM, tumory ve stadiu pT1G2-3 nebo pT2-3G1 jsou spojeny se středním rizikem vzniku LNM (36,4% pravděpodobnost LNM) a tumory ve stadiu pT2-3G2-3 s vysokým rizikem (80% pravděpodobnost LNM). Evropská urologická asociace dále uvádí následující klasifikaci: nízké riziko (pTis, pTaG1-2, pT1G1), střední riziko (pT1G2) a vysoké riziko (pT2, nebo vyšší, nebo G3) vzniku LNM [5].
ASPIRAČNÍ CYTOLOGIE POMOCÍ JEMNÉ JEHLY
Aspirační cytologii pomocí jemné jehly lze provádět buď pomocí ultrazvukového, nebo CT navádění, obvykle se užívá pro vyšetření hmatných inguinálních uzlin. V případě, že je výsledek cytologického vyšetření pozitivní, je okamžitě indikována ILND. Uvádí se, že tato technika má 93% senzitivitu a 91% specifitu [9].
Mezi další minimálně invazivní techniky patří vyšetření nehmatných inguinálních uzlin (s podezřelým nálezem na ultrazvukovém vyšetření) pomocí aspirační cytologie naváděné pomocí US. V případě pozitivního výsledku je okamžitě indikována ILND, v případě negativního výsledku je provedena dynamická biopsie sentinelové uzliny. Pomocí této techniky byly pozitivní uzliny detekovány u 39 % pacientů [12].
DYNAMICKÁ BIOPSIE SENTINELOVÉ UZLINY
Na techniku biopsie sentinelové uzliny se obrací stále více pozornosti ve snaze minimalizovat morbiditu spojenou s ILND. Zatímco zpočátku se biopsie sentinelové uzliny řídila anatomickými zákonitostmi [11], v současné době lze dosáhnout přesnějších výsledků pomocí užívání lymfoscintigrafie a ultrazvukového vyšetření.
K izolaci sentinelové uzliny pro účely excizní biopsie je před operací injekčně aplikována směs technecia-99m a izosulfanové modři. Biopsie sentinelové uzliny dosahuje 71–80% senzitivity a je spojena s až 20% výskytem falešně negativních výsledků [7]. Lepšího výsledku lze docílit při užití MRI s lymfotropickými nanočásticemi (ferumonstran-10) a následnou ILND. Malá studie zahrnující pouze sedm pacientů uvádí 100% senzitivitu a 97% specifitu [3]. U pacientů s klinicky hmatnými uzlinami se biopsie sentinelové uzliny obvykle nedoporučuje.
INGUINÁLNÍ LYMFANEDENKTOMIE (ILND)
Radikální inguinofemorální lymfadenektomie podle Daselera je ohraničena ze čtyř stran [6]:
- superiorně: anteriorní superiorní spina kosti ilické až po zevní inguinální prstenec
- laterálně: 20cm linie směřující dolů směrem od anteriorní superiorní spina kosti ilické
- mediálně: 15cm linie směřující dolů směrem od hrbolku kosti stydké
- inferiorně: linie spojující spodní strany laterální a mediální hranice
Tyto hranice umožňují preparaci superficiálních inguinálních lymfatických uzlin, které jsou uloženy hluboko pod Scarpovou fascií nad f. lata, a hluboko lokalizovaných inguinálních lymfatických uzlin, které jsou uloženy hluboko pod f. lata a mediálně směrem k femorální žíle (včetně Cloquetovy uzliny).
Pro minimalizaci morbidity se doporučuje modifikovaná technika ILND s provedením kratší kožní incize bez preparace laterálně směrem k femorální arterii nebo kaudálně k fossa ovalis. Safenózní žíla je rovněž zachována, čímž eliminujeme nutnost transpozice m. sartorius [13].
Novým přístupem, který může snížit výskyt pooperačních komplikací při současném zachování dobrých výsledků (srovnatelných s ILND), je videoendoskopická inguinální lymfadenektome (VEIL), jak ji popisují Tobias-Machado et al [8].
KONTRALATERÁLNÍ ILND A PÁNEVNÍ LYMFADENEKTOMIE
Při zjištění pozitivních lymfatických uzlin během operace zde existuje 20–60% pravděpodobnost, že budou tyto přítomny i na kontralaterální straně. Při detekci dvou pozitivních uzlin na jedné straně se doporučuje provedení alespoň povrchové ILND na kontralaterální straně. V případě, že biopsie „nazmrzlo“ prokáže pozitivní výsledek, je třeba přistoupit k totální ILND [12].
Přítomnost metastáz do pánevních lymfatických uzlin je indikátorem špatné prognózy s celkovou dobou přežití po dobu pěti let 0–66 % [13]. V případě, že jsou během ILND identifikovány pozitivní inguinální uzliny, měla by být indikována pánevní lymfadenektomie vzhledem k tomu, že pacient má v tomto případě 30% riziko LNM (zejména v případě, že je zasažena nejproximálnější inguinální uzlina – Cloquetova uzlina). Další rizikové faktory pro vznik pánevních LNM zahrnují pozitivní výsledek CT, rozšíření onemocnění mimo kapsulu, onemocnění 3 grade a pozitivní výsledek testu p53 [32].
V případě, že jsou při ILND identifikovány minimálně dvě pozitivní uzliny, doporučuje se provedení pánevní lymfadenektomie [23]. Pánevní LND je vhodné provádět pomocí samostatné incize, obvykle ve spodní části střední čáry, nebo laparoskopicky [13].
KOMPLIKACE SPOJENÉ S PÁNEVNÍ LYMFADENEKTOMIÍ
Pooperační komplikace jsou poměrně časté, ale naštěstí obvykle neohrožují život pacienta. Patří sem nekróza kůže, infekce rány, serom, lymfokéla, lymforhea, otok dolní končetiny a trombóza/tromboflebitida hluboko uložených žil [15]. Tab. 1 uvádí přehled míry výskytu jednotlivých komplikací zaznamenaných ve studiích testujících různé typy léčby ILND.
Table 1. Míra výskytu komplikací v nejnovějších studiích zabývajících se ILND (modifikovaná, superficiální, laparoskopická ILND a DSNB). 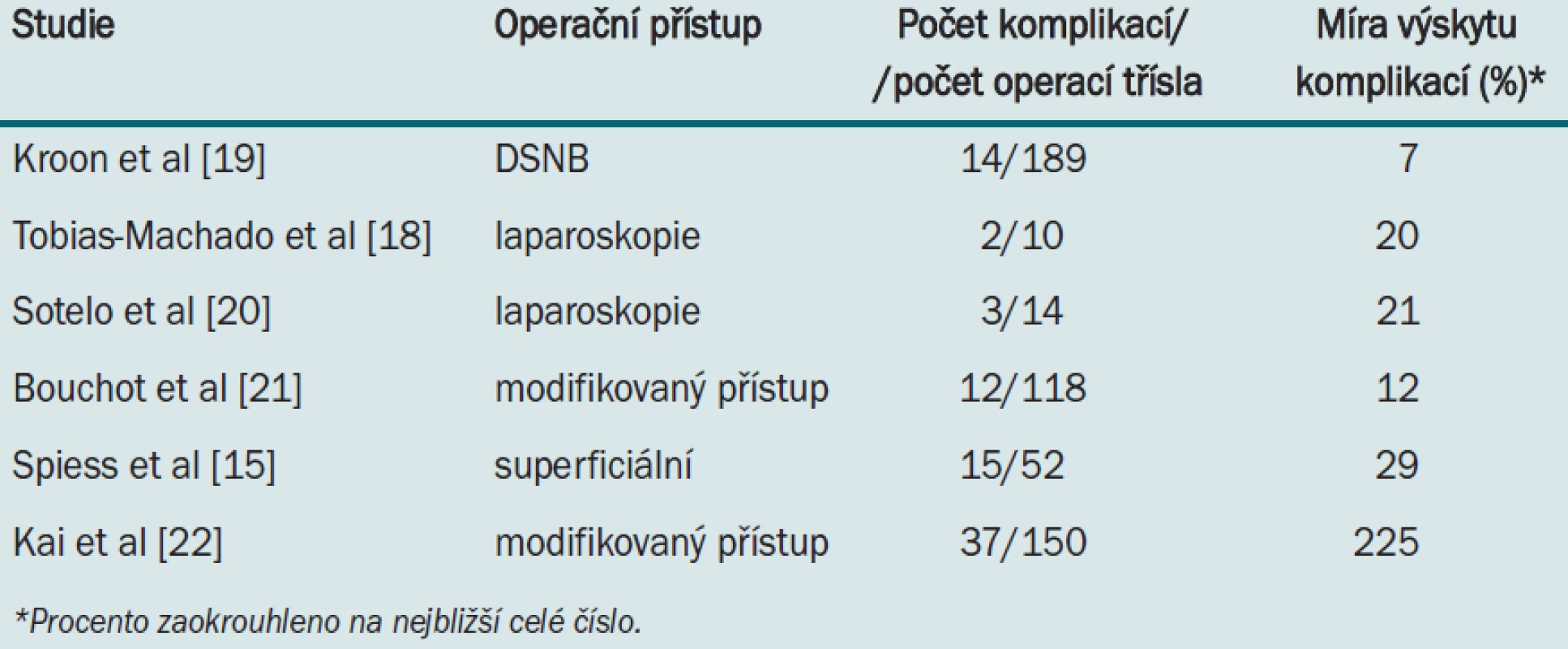
Vzhledem k tomu, že v této oblasti doposud nebyly provedeny žádné komparativní studie, zdá se logické aplikovat během operace antibiotika a antikoagulancia jako prevenci vzniku hluboké žilní trombózy [13].
Kožní nekróza vzniká obvykle v důsledku operační techniky. Byly popsány nejrůznější techniky umožňující zachování povrchového krevního zásobení kůže. Zachování podkožní tkáně nad Camperovou fascií umožní zabezpečit dostatečnou tloušťku kožního laloku. Příliš tenký lalok zvyšuje riziko kožní ischemie a nekrózy [16].
Pečlivá technika preparace a ligace lymfatik umožní předejít vzniku lymforhey a seromu. Jako užitečné se v klinické praxi ukázalo provádění ligace pomocí vstřebatelné sutury, užívání kovových svorek a instrumentů pro tepelné scelení. Neuropraxie v důsledku poranění nervů je vzácně se vyskytující komplikace, při retrakci je však nutné dbát zvýšené opatrnosti [17].
Většina urologů ponechá v rámci prevence vzniku lymforhey a seromu zavedenu uzavřenou sací drenáž. Drén je odstraněn ve chvíli, kdy je celkový objem odsáté tekutiny za 24 hod < 35–50 ml. Sací drenáž však může zhoršovat zánětlivou fázi a bránit adekvátnímu uzavření lymfatik, což zvyšuje riziko vzniku bakteriální infekce [17,18].
ZÁVĚR
Léčba LNM u pacientů s karcinomem penisu ze skvamózních buněk představuje náročný úkol – dosáhnout optimálních výsledků za současné prevence časných pooperačních komplikací. Vhodná indikace ILND a pečlivá chirurgická technika zajišťují významné omezení morbidity a mortality.
Philippe E. Spiess, MD, MS, FACS
Assistant Professorof Urologic Oncology
Department of Genitourinary Oncology
12902 Magnolia Drive Office 12538
Tampa, FL 33612
philippe.spiess@moffitt.org
Sources
1. Pow-Sang JE, Benavente V, Pow-Sang JM et al. Bilateral ilioinguinal lymph node dissection in the management of cancer of the penis. Semin Surg Oncol 1990; 6(4): 241–242.
2. Virseda Rodriguez JA, Salinas Sanchez A, Hernandez Millan I. Carcinoma of the penis: what to do with the regional lymph nodes? Arch Esp Urol 1994; 47(4): 349–362.
3. Scher B, Seitz M, Albinger W et al. Value of PET and PET/CT in the diagnostics of prostate and penile cancer. Recent Results Cancer Res 2008; 170 : 159–179.
4. Kroon BK, Horenblas S, Lont AP et al. Patients with penile carcinoma benefit from immediate resection of clinically occult lymph node metastases. J Urol 2005; 173(3): 816–819.
5. Solsona E, Iborra I, Ricos JV et al. Corpus cavernosum invasion and tumor grade in the prediction of lymph node condition in penile carcinoma. Eur Urol 1992; 22(2): 115–118.
6. Daseler EH, Barry JA, Reimann AF. Radical excision of the inguinal and iliac lymph glands (a study based upon 450 anatomic dissections and upon supportive clinical observation). Surg Gynecol Obstet 1948; 87 : 679–694.
7. Spiess PE, Izawa JI, Bassett R et al. Preoperative lymphoscintigrapy and dynamic sentinel node biopsy for staging penile cancer: results with pathological correlation. J Urol 2007; 177(6): 2157–2161.
8. Tobias-Machado M, Tavares A, Silva MN et al. Can video endoscopic inguinal lymphadenectomy achieve a lower morbidity than open lymph node dissection in penile cancer patients? J Endourol 2008; 22(8): 1687–1891.
9. Saisorn I, Lawrentschuk N, Leewansangtong S et al. Fine-needle aspiration cytology predicts inguinal lymph node metastasis without antibiotic pretreatment in penile carcinoma BJU Int 2005; 97(6): 517–521.
10. Kroon, BK, Horenblas S, Deurloo EE et al. Ultrasonography-guided fine-needle aspiration cytology before sentinel node biopsy in patients with penile carcinoma. BJU Int 2005; 95(4): 517–521.
11. Cabanas RM. An approach for the treatment of penile carcinoma. Cancer 1977; 39(2): 456–466.
12. Grabstald H. Controversies concerning lymph node dissection for cancer of the penis. Urol Clin North Am 1980; 7(3): 793–799.
13. Heyns CF, Fleshner N, Sangar V et al. Management of the Lymph Nodes in Penile Cancer. Urology 2010; 76 (2 Suppl 1): S43–57.
14. Ravi R. Correlation between the extent of nodal involvement and survival following groin dissection for carcinoma of the penis. BJU 1993; 72 (5 Pt 2): 817–819.
15. Spiess PE, Hernandez MS, Pettaway CA. Contemporary inguinal lymph node dissection: minimizing complications. World J Urol 2009; 27(2): 205–212.
16. Ornellas AA, Seixas AL, de Moraes JR. Analyses of 200 lymphadenectomies in patients with penile carcinoma. J Urol 1991; 146(2): 330–332.
17. Crawford ED, Daneshgari F. Management of regional lymphatic drainage in carcinoma of the penis. Urol Clin North Am 1992; 19(2): 305–317.
18. Jain PK, Sowdi R, Anderson AD et al. Randomized clinical trial investigating the use of drains and fibrin sealant following surgery for breast cancer. Br J Surg 2004; 91(1): 54–60.
19. Kroon BK, Lont AP, Valdes Olmos RA et al. Morbidity of dynamic sentinel node biopsy in penile carcinoma. J Urol 2005; 173(3): 813–815.
20. Sotelo R, Sanchez-Sala R, Carmano O et al. Endoscopic lymphadenectomy for penile carcinoma. J Endourol 2007; 21(4): 364–367.
21. Bouchot O, Rigaud J, Maillet F et al. Morbidity of inguinal lymphadenectomy for invasive penile carcinoma. Eur Urol 2004; 45(6): 761–765.
22. Yao K, Hu T, Li YH et al. Modified Technique of Radical Inguinal Lymphadenectomy for Penile Carcinoma: Morbidity and Outcome. J Urol 2010; 184(2): 546–552.
23. Lont AP, Kroon BK, Gallee MPW et al. Pelvic lymph node dissection for penile carcinoma: extent of inguinal lymph node involvement as an indicator for pelvic lymph node involvement and survival. J Urol 2007; 177(3): 947–952.
Labels
Paediatric urologist Urology
Article was published inUrological Journal

2010 Issue 4-
All articles in this issue
- Léčba lokoregionálního onemocnění karcinomu penisu
- Léčba tumoru varlete v časném stadiu
- Karcinom penisu v populaci nigerijských mužů
- Současné přístupy k inguinální lymfadenektomii při léčbě karcinomu penisu
- Karcinom penisu: terapeutická výzva
- Substituční terapie testosteronem po léčbě karcinomu prostaty: nové koncepty v současné urologické praxi
- Moderní endokrinologické vyšetření infertilního muže
- Co je považováno za erotické v neverbální komunikaci
- Vyšetřování a medikamentózní léčba benigní hyperplazie prostaty: přehledový článek
- Význam inhibice RANK ligandu v léčbě kostních komplikací u pacientů s metastazujícím karcinomem prostaty
- Urological Journal
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Co je považováno za erotické v neverbální komunikaci
- Léčba lokoregionálního onemocnění karcinomu penisu
- Substituční terapie testosteronem po léčbě karcinomu prostaty: nové koncepty v současné urologické praxi
- Moderní endokrinologické vyšetření infertilního muže
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

