-
Medical journals
- Career
Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
Authors: R. Greksák
Authors‘ workplace: Národný onkologický ústav, Oddelenie klinickej onkológie, Bratislava
Published in: Transfuze Hematol. dnes,16, 2010, No. 3, p. 158-165.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Diagnostika a liečba vlasatobunkovej leukémie prekonala za posledných 25 rokov významný pokrok, ktorý sa prejavil v počte dosiahnutých odpovedí nielen na interferón-α (IFN-α), ale najmä po terapii purínovými analógmi 2-deoxykoformycínom a 2-chlórodeoxyadenozínom (2-dCF, 2-CdA). Stala sa u väčšiny pacientov dobre liečiteľnou s dlhodobým prežívaním bez príznakov choroby. U časti pacientov je leukémia rezistentná na štandardnú liečbu, alebo dochádza k relapsom po krátkej dobe remisie. Hľadajú sa nové liečebné modality, ktoré by dokázali zabezpečiť elimináciu vlasatých buniek aj v prípade relapsovanej a refraktérnej leukémie. Do pozornosti sa dostali monoklonové protilátky (rituximab), a rekombinantné imunotoxíny pozostávajúce z časti jedného reťazca imunoglobulínu s naviazaným pseudomonádovým toxínom (BL22, LMB-2). Mechanizmus účinku týchto liekov sa odlišuje od chemoterapie a IFN-α a prináša efektivitu u predliečených pacientov. HCL v dnešnej dobe patrí medzi onkologické choroby s pomerne dobrou prognózou, a vďaka viacerým účinným terapeutickým možnostiam väčšina pacientov dosahuje dlhodobé prežívanie v remisii.
Kľúčové slová:
imunotoxíny, interferón-α, monoklonové protilátky, purínové analógy, vlasatobunková leukémiaÚvod
Vlasatobunková leukémia (HCL), v minulosti známa ako leukemická retikuloendotelióza (histiocytová leukémia, malígna retikulóza, lymfoidná myelofibróza), je zriedkavá chronická, pomaly postupujúca lymfoproliferatívna choroba, ktorú prvýkrát ako samostatnú klinickopatologickú jednotku v roku 1958 definovala Bouronclová a kol. (1). Pre diagnózu je typická prítomnosť cirkulujúcich B-lymfocytov vyplavených z kostnej drene, a na ich povrchu svetelným i elektrónovým mikroskopom viditeľné nápadné výbežky cytoplazmy. Vlasaté B-lymfocyty vytvárajú charakteristický obraz infiltrácie kostnej drene a parenchýmu sleziny. Pre ich mikroskopický vzhľad vo fázovom kontraste sa v roku 1966 upustilo od pôvodného názvu leukemická retikuloendotelióza a nahradilo ho viac opisné pomenovanie vlasatobunková leukémia (HCL) (2).
Tento druh leukémie predstavuje približne 2 % z výskytu všetkých leukémií. Je prevažne chorobou mužov stredného veku s mediánom 52 rokov v čase potvrdenia diagnózy. Existuje predominancia výskytu u mužov oproti ženám v pomere 4 : 1. Dosiaľ nebola zistená jednoznačná etiológia HCL. Predchádzajúca expozícia ionizujúcemu žiareniu, drevnému prachu a organickým chemikáliám v pracovnom prostredí zvyšuje frekvenciu výskytu medzi niektorými súbormi pacientov oproti zdravej kontrolnej skupine (3, 4). Možný podiel na vzniku choroby sa predpokladá po opakovanom styku s benzénom, organickými fosforylovanými insekticídmi, alebo niektorými organickými rozpúšťadlami, avšak iné zdroje takúto súvislosť nepotvrdili. Uvažuje sa aj o asociácii medzi prekonanou infekčnou mononukleózou v minulosti.
Diagnostika a diferenciálna diagnostika
Vlasaté bunky (hairy cells) získali svoje pomenovanie podľa cytoplazmatických výbežkov, ktoré možno ako drobné vlásky, pseudopódie alebo mikrovili, pozorovať v krvnom nátere pomocou klasického mikroskopu, vo fázovom kontraste, alebo pod elektrónovým mikroskopom. I keď normálna funkcia a miesto pôsobenia bunky, z ktorej HCL vzniká nie sú presne známe, molekulovo-genetickými štúdiami sa potvrdil B-lymfocytový pôvod malígneho klonu. Existujú len raritné údaje, ktoré by potvrdzovali existenciu T-bunkovej varianty. HCL je odvodená od klonálnej expanzie buniek, ktoré vývojovo stoja medzi B-chronickou lymfocytovou leukémiou (CLL) alebo prolymfocytovou leukémiou (PLL) (variantná forma) na jednej strane, a bunkami plazmocytómu na strane druhej (5). Bunky sú zrelé, ale chýba im terminálna diferenciácia. Patria medzi mononukleárne elementy s excentricky alebo centrálne uloženým jadrom. Jadierko býva nápadné pri variantnej forme a nie je typické pre klasickú HCL. Cytoplazma môže pri bežnom farbení pod svetelným mikroskopom zriedka obsahovať granule alebo hrubšie paličkovité inklúzie, ktoré sa zhodujú s ribozomálnym lamelárnym komplexom (6).
U väčšiny pacientov je prítomná pancytopénia, leukopénia je zvýraznená ťažkou monocytopéniou, preto medzi prvými diagnostickými testami nesmie chýbať vyšetrenie krvného obrazu a náteru periférnej krvi. Leukopénia je spojená s granulocytopéniou. Do 20 % prípadov prichádza s leukocytózou, kedy treba myslieť na variantnú formu. U viac ako 80 % býva trombocytopénia, často ťažkého stupňa. Zriedkavo sa pozoruje i kvalitatívna porucha agregácie trombocytov, ktorá sa môže upraviť efektívnou terapiou (7, 8, 9). Anémia, môže byť i ťažkého stupňa, obyčajne s normálnou hodnotou stredného objemu erytrocytov (MCV) a miernou anizocytózou a poikilocytózou. V 95 % sa podarí dokázať cirkulujúce vlasaté bunky v periférnej krvi.
V náteri z aspirátu kostnej drene chýbajú vločky pre retikulínovú fibrózu, tzv. suchá punkcia. Príležitostne sa však i pri „suchých punkciách“ môžu v chudobnom náteri zobraziť vlasaté bunky. Presnejšou metódou na diagnostiku je trepanobiopsia. Už pri malom zväčšení je obraz infiltrácie HCL charakteristický. V bioptickom materiáli bunky strácajú vlasatý povrch, prítomná je difúzna alebo fokálna infiltrácia jednotvárnymi bunkami s okrúhlymi, elipsovitými alebo vretenovito stočenými jadrami, oddelenými od seba bohatým množstvom svetlej cytoplazmy v jemnej fibrilárnej sieti, ktorá oddeľuje jednotlivé bunky, a vytvára tak obraz podobný praženým vajciam tzv. volským okám. Cytoplazma je bledá a možno pozorovať jemnú sieť fibríl oddeľujúcu každú z vlasatých buniek najmä pri farbení PAS (periodic acid-Schiff) a farbení na retikulín. Retikulínová fibróza je vždy evidentná a často veľmi nápadná. Je spôsobená extracelulárnou sekréciou fibronektínu. Infiltrácia v kostnej dreni môže vytvárať dilatované sínusy naplnené extravazálnymi erytrocytmi obdobne ako aj erytrocytárne jazierka a sínusy viditeľné na preparátoch zo sleziny. Infiltráty kostnej drene sa môžu šíriť a prerastať z medulárnej dutiny do povrchovej kortikális a spôsobiť kortikálne osteolytické lézie. Difúzny typ infiltrácie kostnej drene s minimálnou alebo úplne chýbajúcou reziduálnou krvotvorbou je spojený s nepriaznivým priebehom ochorenia, v porovnaní s intersticiálnym postihnutím a perzistujúcou krvotvorbou (p < 0,01) (10).
Slezina je zväčšená s mediánom hmotnosti 1,300 g (11). Vlasaté bunky osídľujú červenú pulpu sleziny a biela pulpa časom atrofuje a zaniká. Včasné postihnutie sa vyznačuje fokálnou infiltráciou trabekúl a subendoteliálnymi infiltrátmi trabekulárnych venúl. Charakteristickým nálezom sú erytrocytárne „červené” jazierka, ktoré predstavujú červenými krvinkami naplnené priestory lemované vlasatými bunkami, ktoré narušili normálnu architektúru sínusov sleziny. Vo výnimočných prípadoch môže HCL postihovať iba slezinu. Infiltrácia pečene môže byť obojaká a to v oblastiach sínusov i v portálnych častiach. Postihnutie lymfatických uzlín je nápadné sínusoidálnou a intersticiálnou infiltráciou. Pre potvrdenie morfologických nálezov je dôležité cytochemické alebo imunocytochemické vyšetrenie. HCL prejavuje silnú cytoplazmatickú pozitivitu pri farbení na tartarát-rezistentnú kyslú fosfatázu (TRAP). Izoenzým 5 kyslej fosfatázy je na rozdiel od ostatných izoenzýmov rezistentný na L-tartarát (kyselinu vínnu) (12).
Pri identifikácii vlasatých buniek pomôže i elektrónová mikroskopia, ktorá zobrazí cytoplazmatické vláskovité výbežky lemujúce celý povrch buniek, ako jemné brázdy alebo chĺpky. Ribozomálny lamelárny komplex vytvára membránovitú štruktúru zloženú z koncentrických prstencov lamiel spojených ribozómami. Môže byť rozpoznateľný u približne polovice pacientov.
Vlasaté bunky majú na svojom povrchu fenotyp zrelého B-lymfocytu s expresiou jedného alebo početných ťažkých reťazcov imunoglobulínu s monotypickými ľahkými reťazcami. Prítomné sú receptory pre Fc fragment imunoglobulínov IgG a IgM, ale chýbajú väzbové miesta pre zložky komplementu. Na povrchu sa nachádzajú pan-B-lymfocytové antigény CD19, CD20 a CD22. Neprítomný je antigén CD21, ktorý sa stráca v neskoršom štádiu B-bunkovej ontogenézy. Zvyčajne tiež obsahujú i včasný antigén plazmatických buniek PCA-1. Diagnostický profil je najlepšie definovaný s použitím kombinácie pan-B-bunkových protilátok naväzovaných na antigény CD11c (LeuM5), CD25 a CD103 (Bly-7). Monoklonová protilátka Bly-7 vykazuje vysokú senzitivitu a špecificitu. Viaže sa na antigén CD103, ktorý je asociovaný s podjednotkou α integrínovej molekuly B7, ktorá je zodpovedná za tzv. homing a adhéziu lymfocytov (13). HCL bola prvou B-bunkovou lymfoproliferatívnou chorobou, u ktorej sa rozpoznala expresia receptora pre interleukín-2 (IL-2), ktorým je antigén CD25. Hodnoty sérovej hladiny solubilného IL-2 receptoru (IL-2R) sú vysoké u pacientov postihnutých HCL a výška hladiny koreluje s aktivitou choroby (14, 15). Použitím panelu piatich monoklonových protilátok, pomocou ktorých stanovujeme pri chronickej lymfocytovej leukémii tzv. CLL-skóre (16), získame pri HCL nízke skóre (0-1), kým pri CLL je skóre 4–5 (tab. 1.). Obdobne určujeme tzv. HCL-skóre. Panel pre vlasaté bunky pozostáva z protilátok voči antigénom CD11c, CD25, CD103 a HC2 (17). Pokiaľ sa dosiahne pozitivita u 3 alebo 4 znakov, je možné odlíšiť HCL (skóre 3-4) od ostatných B-bunkových lymfoproliferácií (skóre 0–1) (tab. 2).
Table 1. Skórovací systém pre CLL. 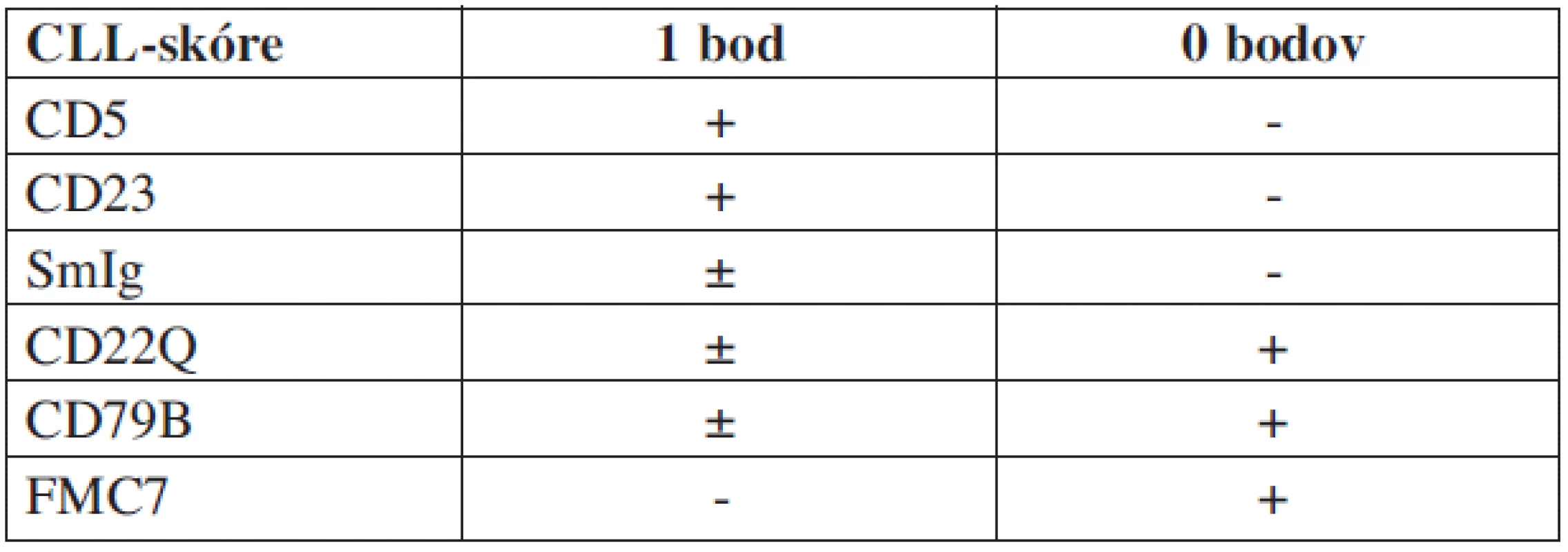
CLL: skóre často 4–5, zriedka 3 HCL, HCL-V: skóre často 1–3 B-NHL: skóre často 0–2 Table 2. Skórovací systém pre HCL. 
HCL: skóre 3–4 (98 %); 4 (86 %) HCL-V: skóre 3 (13 %); 4 (0 %); 1–2 (87 %) SLVL: skóre 3–4 (0 %); 0–1 (96 %) Pri imunohistochemickom vyšetrení trepanobiopsie sa vlasaté bunky farbia použitím protilátok viazaných antigénom CD20 (L26) a DBA.44. Pomocou L26 sa zobrazí povrchová membrána a zvýrazní sa strapatá bohatá cytoplazma. DBA.44 je bližšie nedefinovaný antigén. Jeho farbením sa identifikuje subpopulácia vlasatých buniek a ich granulárna cytoplazmatická, ako aj membránová štruktúra. DBA.44 je pozitívny aj u 30 % lymfómov nízkeho stupňa malignity. Kvalitná trepanobioptická vzorka je nevyhnutná nielen pre stanovenie diagnózy, ale aj pre monitorovanie odpovede na terapiu. Detekcia a kvantifikácia minimálnej reziduálnej choroby (MRD) je pomocou hematoxylín-eozínového farbenia všeobecne nedostatočná a ťažko interpretovateľná. Preto sa na jej stanovenie využívajú imunocytochemické metódy s použitím aspoň jednej monoklonovej protilátky voči CD20, DBA.44 alebo TRAP. Intenzívna pozitivita farbených buniek v súlade s morfologickými charakteristikami, ktoré týmto vyniknú, sa považuje s vysokou istotou za dôkaz reziduálnej choroby.
Diagnózu HCL je možné stanoviť aj histologickým vyšetrením sleziny. V slezine sa dokáže infiltrácia červenej pulpy s tvorbou erytrocytárnych „červených” jazierok s rozšírením sínusov a atrofiou bielej pulpy. Tento charakteristický obraz nie je možné nájsť u žiadnej inej B-lymfoproliferatívnej diagnózy, kde typicky dominuje postihnutie bielej pulpy.
Z cytogenetických nálezov viaceré zdroje poukazujú na nešpecifické neklonálne, alebo oligoklonálne abnormality, niektoré na klonálne poruchy zahrňujúce translokáciu 14q32 miesto pre IgH lokus, prestavbu 14q22-24 a boli zistené aj zmeny na chromozómoch 11 a 12. V jednej štúdii zaznamenali 40 % incidenciu zmien na 5 chromozóme. Prítomný je zvýšený prepis génu annexin-A1 (ANXA1) a jeho produkt ANXA1-proteín. Zvýšená expresia ANXA1 je špecifická pre HCL (18). Pomocou testu na ANXA1 je možné odlíšiť lymfoproliferatívne choroby ako sú splenický lymfóm z vilóznych lymfocytov (SLVL), variantná HCL (HCL-V), prolymfocytová leukémia (PLL), lymfóm z marginálnej zóny (MZL) a lymfoplazmocytoidný lymfóm (LPL) (19).
Variantná forma (HCL-V) máva oproti klasickej forme zložitejší nález v karyotype. Okrem translokácie t(14;18)(q32;q21) charakteristickej pre folikulový lymfóm, sa pozorovala aj translokácia t(2;8)(p12;q24) vyskytujúca sa pri variantnej forme Burkittovho lymfómu. Pri variantnej HCL sa s vysokou incidenciou vyskytuje delécia p53 tumor supresorového génu, lokalizovaného na chromozóme 17p13. Medzi oboma formami existuje signifikantný rozdiel výskytu delécie tejto alely (p < 0,01) v prospech variantnej leukémie, čo koreluje s tendenciou k transformácii do blastickej formy a nedostatočnej odpovedi na terapiu (20).
Variantná forma
Variantná forma HCL (HCL-V) predstavuje hybridnú klinickú jednotku medzi prolymfocytovou leukémiou a klasickou HCL, pričom jadro je podobné jadru prolymfocytu a cytoplazma je obdobná ako u typických vlasatých buniek. Reprezentuje približne 20 % prípadov HCL. Odlíšenie tejto variantnej formy je dôležité z dôvodu všeobecnej rezistencie na terapiu IFN-α a zriedkavé dosiahnutie kompletnej remisie (KR) po liečbe purínovými analógmi.
U pacientov s variantnou formou býva masívna splenomegália a výrazná leukocytóza s hodnotami leukocytov 40 až 60 x 109/l. Bunky variantnej formy sú TRAP negatívne alebo len slabo pozitívne. Pri imunofenotypickej analýze je obyčajne znak CD25 a HC2 negatívny, CD103 (Bly-7) je v nízkej miere niekedy exprimovaný, CD11c je takmer vždy pozitívny, prítomná je i expresia IgG ťažkých reťazcov na povrchu buniek (17) (tab. 3.). Rozlíšenie oboch foriem je založené na odlišnej štruktúre jadra, ktoré je okrúhle a centrálne uložené, so zreteľným jadierkom, prítomnosti leukocytózy a chýbaní monocytopénie. Nález v biopsii kostnej drene a slezine je rovnaký ako pri klasickej HCL (tab. 4.). Pre nízky stupeň retikulárnej fibrózy je kostná dreň ľahko aspirovateľná. HCL-skóre vychádza pre väčšinu variantných foriem na 1-2, pri klasickej forme je 3–4 (tab. 2.) (17). Pre variantnú formu neexistuje dosiaľ adekvátna liečebná stratégia. Len zriedkavo sa docieli KR, a to zvyčajne po 3 až 4 cykloch liečby 2-CdA. Zatiaľ sa nedokázala lepšia efektivita a dosiahnutie dlhodobej KR iným liekom ako 2-CdA (21). U pacientov s veľkou splenomegáliou je možné ako paliatívnu liečbu zvoliť splenektómiu, ktorá môže byť klinicky prínosná.
Table 3. Imunofenotypové a morfologické rozdiely medzi HCL a HCL-V. 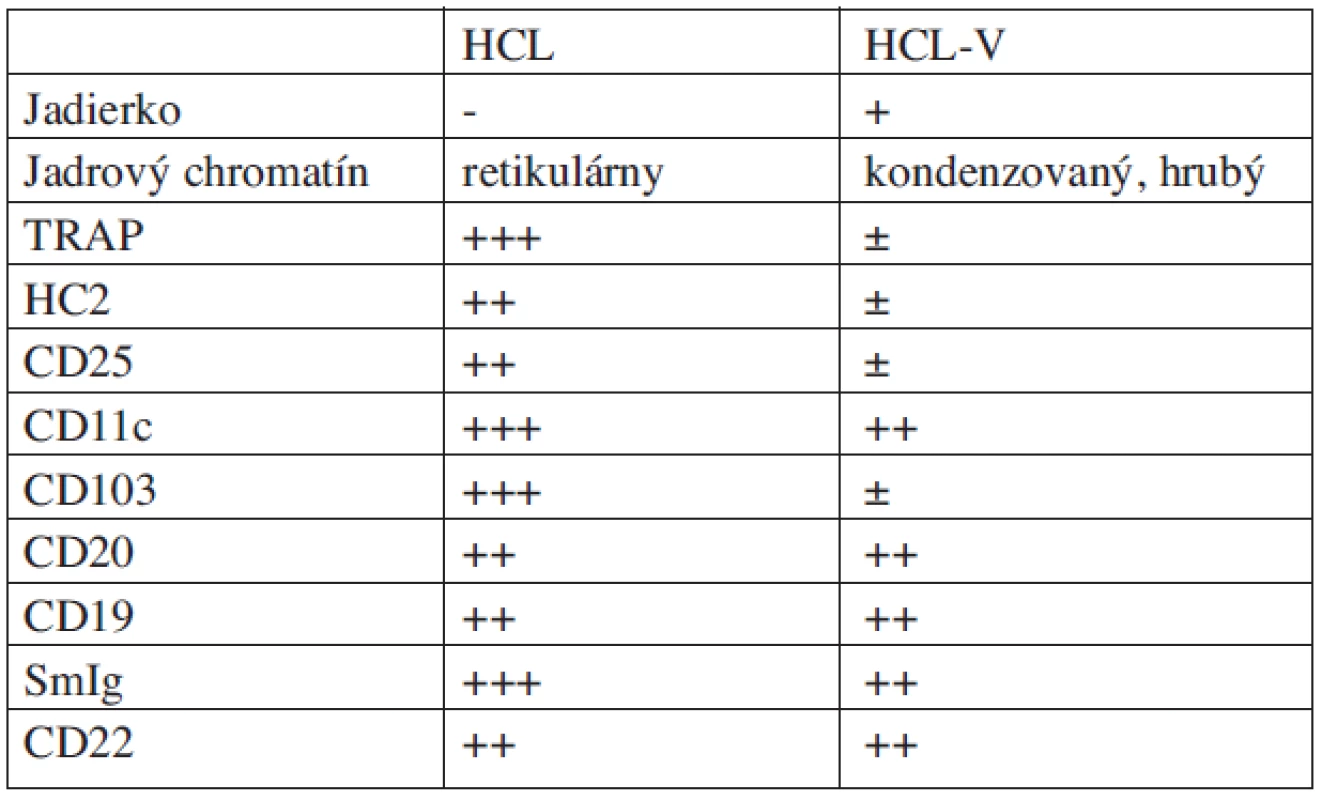
Table 4. Niektoré charakteristické laboratórne a patologické nálezy v diferenciálnej diagnostike. 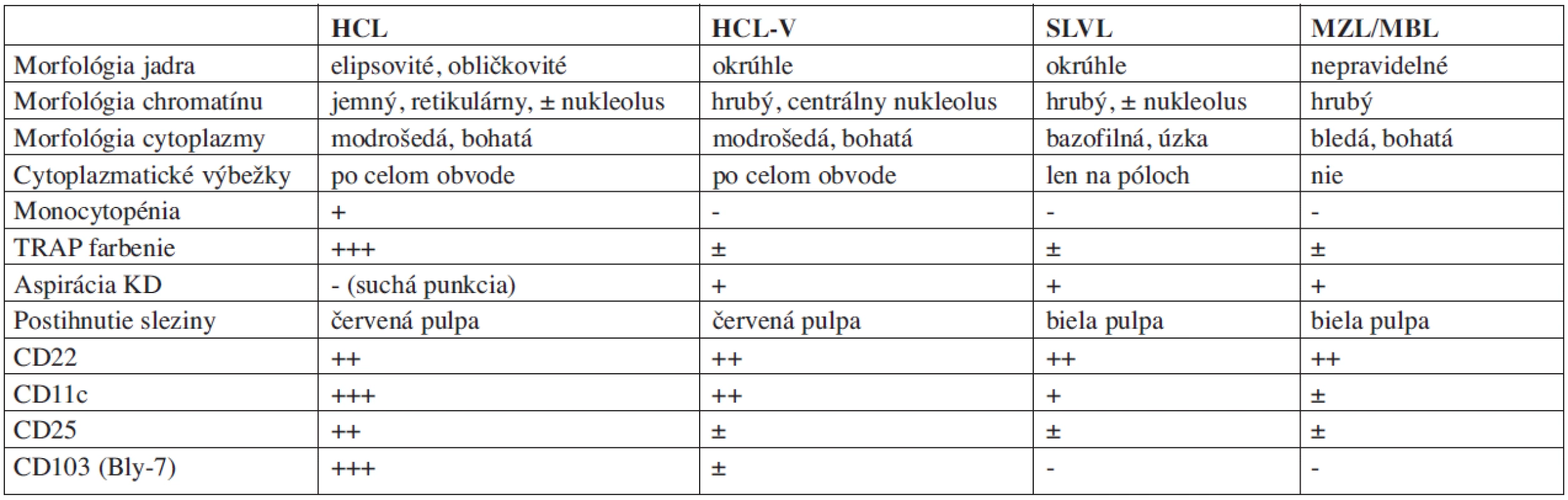
Klinický obraz
V klinickom obraze sa zvyčajne manifestujú príznaky súvisiace s hematologickými abnormalitami vyplývajúcimi z podstaty choroby. Cirkulujúce vlasaté bunky sa v periférnej krvi identifikujú u 95 %, pancytopénia je prítomná u 70 %, splenomegália u 60–70 % (90 % u pokročilých štádií), hepatomegália u 40–50 % a abdominálna lymfadenopatia u 15–20 % chorých. Približne 25 % pacientov má zvýšenú únavnosť, malátnosť, celkovú slabosť, často v spojitosti s prebiehajúcou infekciou, nálezom splenomegálie, alebo abnormálnym počtom krviniek v krvnom obraze. Pri progresii a pretrvávaní leukémie narastá i počet krvácavých a infekčných komplikácií. Menej ako 10 % pacientov má periférne lymfatické uzliny väčšie ako 2 cm. Počítačovou tomografiou (CT) je možné pri vstupnom vyšetrení zobraziť mediastinálnu alebo retroperitoneálnu lymfadenopatiu až u jednej tretiny prípadov. Klasická HCL je charakteristická výskytom leukopénie, do 20 % pacientov prichádza s leukocytózou a niekedy sa v periférnom nátere vlasaté bunky nepodarí nájsť pod mikroskopom.
Pacienti sú náchylní na bakteriálne infekcie, mykotické, aj atypické mykobakteriálne zápaly. Výskyt infekcií nekoreluje s predchádzajúcou splenektómiou alebo systémovou terapiou, ale je závislý od stupňa neutropénie a monocytopénie (22). Prítomná je porucha T-bunkovej imunity, ťažká monocytopénia, neutropénia a pokles antigén-prezentujúcich dendritických buniek.
HCL býva niekedy asociovaná s imunologickými poruchami prebiehajúcimi pod obrazom leukocytoklastickej vaskulitídy alebo polyartritis nodosa, ktoré sa manifestujú už vo včasnom štádiu leukémie horúčkou, artralgiami, nodóznym erytémom, kožným nálezom a periférnou neuropatiou. Z autoimunitných porúch (15 % chorých) možno pozorovať i temporálnu arteritídu, kryoglobulinémiu, glomerulonefritídu, autoimúnnu hemolytickú anémiu, imúnnu trombocytopéniu, reumatoidnú artritídu, tyroiditídu, pernicióznu anémiu, ulceratívnu kolitídu, antikardiolipínový syndróm a výskyt protilátky voči faktoru VIII (22). Raritne sa nájdu kožné manifestácie v podobe nodulov, plakov alebo makulopapulárného exantému. Častejšie sa pozorujú infekcie kože vrátane fascitídy, celulitídy a pustulóznych lézií spôsobených pyogénnymi baktériami, mykotické lézie, ale aj prejavy vaskulitídy, Sweetovho syndrómu a pyoderma gangrenosum. V súvislosti s HCL sa našli i autoimunitné prípady výskytu sklerodermie, polymyozitídy, sarkoidózy, vitiliga a Lambert-Eatonovho myastenického syndrómu. Postihnutie skeletu patrí medzi menej frekventované komplikácie. Manifestuje sa ako difúzna osteoporóza, alebo častejšie ako lytické lézie axiálneho skeletu, najmä proximálneho femuru.
Liečba
Pacienti s HCL vyžadujú liečbu za účelom korekcie cytopénie a úpravy klinických ťažkostí v súvislosti s anemickým syndrómom, opakovanými infekciami a krvácaním. U niektorých asymptomatických prípadov, pri menej závažnej cytopénii, s miernou splenomegáliou, je možné zaujať stratégiu „watch-and-wait”, kedy sa pacient pozoruje a terapia sa zaháji až pri progresii choroby. Odklad liečby v tomto prípade nezhoršuje jej výsledky ani dobu prežívania. Hematologické kritériá pre začatie liečby zahŕňajú signifikantnú anémiu vyjadrenú prinajmenšom stredným stupňom hladiny hemoglobínu (Hg < 80–100 g/l), trombocytopéniu (Tr < 50–100x109/l), alebo neutropéniu (Neu < 0,5–1,0x109/l). Na zahájenie terapie má vplyv okrem počtu krvných elementov aj evidentná tendencia ich poklesu v časovom slede. Medzi menej časté indikácie k liečbe patrí leukocytóza v periférnej krvi s vysokým zastúpením vlasatých lymfocytov, opakujúce sa infekcie, symptomatická splenomegália, masívna tzv. bulky alebo bolestivá lymfadenopatia (23), B-symptómy (zvýšená telesná teplota, nočné potenie, strata na hmotnosti o 10 % za obdobie posledných 6 mesiacov), autoimúnne poruchy vrátane vaskulitídy a osteolytické postihnutie skeletu.
Splenektómia bola v minulosti jediná štandardná liečebná modalita, a to pred rokom 1980, pred érou IFN-α a purínových analógov. Po splenektómii dochádza takmer u všetkých pacientov k určitej korekcii cytopénie (11). Úplná normalizácia hematologických parametrov je možná u približne 40 % a 5-ročné prežívanie dosahuje okolo 75 % chorých. Vzhľadom na možnosť použiť efektívne systémové lieky a fakt, že 50 % pacientov po splenektómii vyžaduje systémovú liečbu v priebehu doby s mediánom 8,3 mesiaca (24) sa splenektómia ako primárna liečba uplatňuje len v ojedinelých prípadoch. Vybratím sleziny nie je možné dosiahnuť patologickú remisiu v kostnej dreni a po čase dochádza k progresii choroby.
IFN-α predstavuje historicky prvú systémovú liečbu, ktorá dokáže parciálne eradikovať vlasaté bunky z kostnej drene. Prvá správa o úspešnom použití čiastočne purifikovaného humánneho leukocytárneho IFN-α v tejto indikácii bola publikovaná v roku 1984 (25). Celkový počet odpovedí na terapiu IFN-α je 80–90 %, väčšinu tvoria parciálne remisie (PR), kompletné remisie (KR) predstavujú 5–30 %. Celkové prežívanie v 5 roku po liečbe presahuje 85 % (26, 27) a typ odpovede, či sa jedná o PR alebo KR, neovplyvňuje percento prežívania (28). U väčšiny sa relaps vyskytne po priemernom intervale 18–25 mesiacov od ukončenia podávania IFN-α. Malé percento pacientov s nízkym stupňom infiltrácie kostnej drene môže dlhodobo prežívať bez príznakov choroby (29). Aj keď je IFN-α pri HCL účinným liekom, jeho potenciál nie je kuratívny a v prvej línii liečby je nahradený podávaním purínových analógov. IFN-α stráca na význame i pre nutnosť niekoľkomesačnej parenterálnej aplikácie a nepriaznivé spektrum nežiadúcich účinkov.
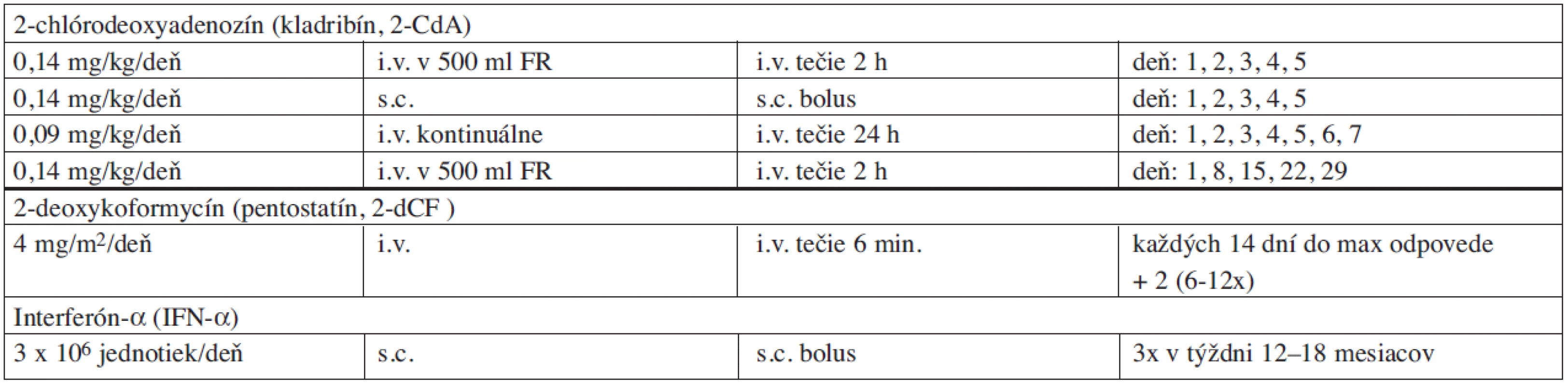
2-deoxykoformycín (pentostatín, 2-dCF) bol prvým purínovým analógom, ktorý sa použil v klinickej praxi. Úspešné použitie 2-dCF v dávke 5 mg/m2 u pacienta s diagnózou HCL bolo prvýkrát publikované v roku 1984 (30). Od toho roku prebehlo viacero štúdií s použitím 2-dCF v rôznych režimoch a dávkach. Počet celkových odpovedí na 2-dCF predstavuje 83–100 %, z toho KR 42–89 %. Odporúčaná dávka je 4 mg/m2 intravenózne každých 14 dní do maximálnej odpovede na liečbu (tab. 5). Počet podaní odporúčaných na dosiahnutie dostatočného efektu varíruje medzi 1–29, s priemerným počtom 8 cyklov terapie. Relapsy možno pozorovať u 10–48 % s mediánom 29–71 mesiacov po ukončení aplikácie 2-dCF (31, 32). Použitie 2-dCF je efektívne a dosahuje dostatočné odpovede aj u pacientov, ktorých choroba je rezistentná na IFN-α, alebo u ktorých nastal relaps po absolvovanej terapii IFN-α v minulosti (33). Pacienti, ktorí sú rezistentní alebo netolerujú 2-dCF môžu odpovedať na následne podávaný 2-CdA (z 5 prípadov 4 KR, 1 PR) (34).
Poznatok o efektivite 2-chlórodeoxyadenozínu (kladribín, 2-CdA) pri liečbe HCL pochádza z roku 1990 (35). Na základe predklinických testov sa zistilo, že na maximálnu eradikáciu vlasatých buniek je dôležitá prolongovaná expozícia lymfocytov voči 2-CdA. Z dosiahnutých pozorovaní vzniklo odporúčanie na aplikáciu 2-CdA formou kontinuálnej intravenóznej infúzie. Celkových odpovedí sa dosahuje v rozpätí 87–100 %, z toho KR 75–91 %. Dosiahnuté remisie sú dlhotrvajúce a výskyt relapsov sa udáva u 12–29 % pri mediáne doby sledovania pacientov v rozsahu 45–72 mesiacov (31, 36, 37). U 27 % pacientov s relapsom, ktorí dosiahli po iniciálnej liečbe 2-CdA kompletnú remisiu, medián prežívania do progresie predstavoval 37,4 mesiacov (38). Najčastejšie používaným režimom 2-CdA bola forma kontinuálnej 24-hodinovej intravenóznej infúzie v dávke 0,09–0,1 mg/kg/deň, 7 dní za sebou. V posledných rokoch sa dokázala identická efektivita aj u schém líšiacich sa dávkou, dĺžkou a formou podávania 2-CdA (tab. 5.). Denná dvojhodinová intravenózna infúzia 5 dní za sebou v dávke 0,14 mg/kg/deň je rovnako účinná ako kontinuálna 7-dňová infúzna schéma, s celkovým počtom odpovedí u 96 %, z toho KR 77 %. Subkutánna aplikácia 2-CdA má obdobnú biologickú dostupnosť a polčas eliminácie (AUC) ako intravenózna infúzia a zdá sa byť rovnako efektívna. Po subkutánnom podaní sa nepozorovali lokálne reakcie a ani celková toxicita nie je výraznejšia (39). 2-CdA je dobre tolerovaný liek s minimálnym výskytom nežiadúcich účinkov. Febrility sa dostavia u 40 % pacientov, identifikácia infekčného agens je však zriedkavá. Febrility koincidujú s apoptózou a vymiznutím vlasatých buniek a vznikajú dôsledkom uvoľnenia bunkových cytokínov. Pátranie po infekčnom agens však nie je v čase leukopénie zanedbaniahodné. Väčšina pacientov dosiahne kompletnú patologickú remisiu do 3 mesiacov, protrahovaná odpoveď na liečbu však môže pokračovať až do 6 mesiacov. Pacienti s relapsom odpovedajú aj na ďalšiu terapiu 2-CdA (40), avšak trvanie odpovede býva s každým nasledujúcim relapsom progresívne kratšie.
Liečba purínovými analógmi významne zlepšila prežívanie pacientov s HCL. Prítomnosť MRD u tých, ktorí dosiahli KR po liečbe IFN-α alebo purínovými analógmi, sa vyšetruje viacerými metódami so snahou identifikovať relevantnosť nálezu vo vzťahu k dĺžke trvania remisie a následnému priebehu choroby (41). V závislosti od použitej techniky je možné MRD v rôznej miere detegovať v kostnej dreni takmer u všetkých pacientov, u ktorých predpokladáme KR. PCR (polymerase chain reaction) vyšetrením je možné stanoviť infiltráciu vlasatými bunkami na úrovni 0,001 až 0,1 %. Prietoková cytometria dokáže odhaliť monoklonové B-bunky v rozsahu 0,01 až 0,05 %. V niektorých štúdiách sa použitie prietokovej cytometrie ukázalo ako vhodná alternatíva za účelom stanovenia MRD oproti IHC metóde (CD20+, DBA.44+, TRAP+). Prietoková cytometria vie rozpoznať reziduálne vlasaté bunky s vysokou špecifitou, negatívny nález v periférnej krvi nevylučuje prítomnosť MRD v kostnej dreni (42). Existuje súvislosť medzi prítomnosťou MRD a zvýšeným rizikom včasného relapsu u pacientov s KR po liečbe 2-dCF alebo 2-CdA. Stanovené štvorročné bezrelapsové prežívanie v skupine pacientov s MRD bolo 55 %, u pacientov MRD-negatívnych až 80 % (43). Pretrvávajúca prítomnosť MRD by tak vysvetľovala zvýšený výskyt relapsov do 5 rokov od ukončenia primárnej liečby, ďalšie relapsy sa pozorujú pri dlhodobom sledovaní pacientov.
Monoklonové protilátky
V dobe úspešného používania monoklonových protilátok pri liečbe lymfoproliferatívnych malignít (non-Hodgkinov lymfóm, CLL) predstavuje HCL ďalšiu z rady diagnóz, kde aplikácia cielených monoklonových protilátok a imunotoxínov môže pomôcť zvládnuť chorobu v prípadoch rezistencie na štandardnú liečbu, pri prepuknutí relapsu, alebo pri eliminácii MRD (44). Pri HCL sa stretávame s podstatne väčšou denzitou CD20 antigénu na povrchu buniek v porovnaní s CLL (45). Rituximab (anti-CD20, Rituxan, Mabthera) sa preto stal potenciálnym liekom aj pre liečbu HCL. Viaceré správy tento predpoklad o účinnosti rituximabu potvrdili (46, 47, 48). Optimálna schéma podávania zatiaľ nebola definovaná. Dostatočná by mala byť dávka 375 mg/m2 raz za týždeň, ale počet podaní sa v jednotlivých štúdiách líši od 4 po 8 cyklov. Zdá sa, že po 8 cykloch je väčší počet liečebných odpovedí než možno dosiahnuť 4 aplikáciami rituximabu (49). I po ukončení podávania je možné s odstupom pozorovať pokračujúcu liečebnú odpoveď potvrdenú vyšetrením kostnej drene a to i na molekulovej úrovni (50). U predliečených pacientov s relapsovanou alebo refraktérnou HCL sa v štúdiách pozorovalo po monoterapii rituximabom 25–80 % celkových liečebných odpovedí, z toho 10–55 % KR. Percento dosiahnutých odpovedí závisí od intenzity predliečenosti pacienta (49). Terapiu rituximabom je možné použiť u pacientov s relapsom alebo chorobou progredujúcou na purínových analógoch a IFN-α. Aj pri HCL ide o efektívny a dobre tolerovaný liek s nízkym spektrom nežiaducich účinkov. Za účelom stanovenia účinnosti v 1. línii, pri eliminácii MRD, a v kombinácii s purínovými analógmi, sú nutné výsledky ďalších štúdií (51).
Vychádzajúc z údajov literatúry o použití monoklonovej protilátky anti-CD52 (alemtuzumab, Campath-1H, Mabcampath) pri CLL, sa hľadá možnosť uplatniť tento liek i u pacientov s refraktérnou HCL (52). Prietokovou cytometriou sa podarilo pri klasickej i variantnej forme (HCL-V) stanoviť antigén CD52 na povrchu 92–100 % malígnych buniek všetkých vyšetrovaných pacientov (53). Pri CLL sa lepšia účinnosť alemtuzumabu pozorovala v infiltrovanej kostnej dreni a periférnej krvi oproti vplyvu na masívnu „bulky“ lymfadenopatiu. Rapídny pokles malígnych lymfocytov v periférnej krvi sa dosiahol u 97 %, vymiznutie lymfadenopatie len u 7 % pacientov (54). Táto skúsenosť by predurčovala použitie alemtuzumabu aj pri HCL. Otázny zostáva vplyv na vyskytujúcu sa splenomegáliu. Doteraz neexistujú výsledky štúdií, ktoré by odhalili rozsah odpovedí na túto monoklonovú protilátku pri HCL. Je možné sledovať raritné správy vo forme kazuistík kedy sa alemtuzumab ako experimentálny liek použil po zlyhaní viaclíniovej chemoterapie, IFN-α a rituximabu (52).
Imunotoxíny
Z experimentálnych rekombinantných imunotoxínov, zložených z variabilnej domény monoklonovej protilátky (anti-CD22, anti-CD25) naviazanej na exotoxín-A baktérie Pseudomonas, získali pozornosť v štúdiách fázy I imunotoxín BL22 a LMB-2. HCL je senzitívna na BL22 (anti-CD22) vzhľadom na vysokú expresiu antigénu na povrchu buniek (5000–70 000 na 1 bunku) oproti ostatným lymfoproliferatívnym diagnózam (CLL 350–1000 na 1 bunku) (55). Rekombinantný imunotoxín BL22 preukázal sľubné výsledky u ťažko predliečených pacientov. V štúdii fázy I priniesol u 80 % pacientov liečebnú odpoveď (61 % KR, 19 % PR) (56). Jeho efektivita vyplýva z odlišného mechanizmu účinku oproti purínovým analógom cestou internalizácie exotoxínu endocytózou do vnútra CD22-pozitívnej bunky. Tu je molekula rozštiepená oddelením exotoxínového fragmentu, ktorý v cytoplazme katalyzuje ADP-ribozyláciu elongačného faktora 2 (ADP-r-EF2) a zapríčiňuje apoptózu leukemickej bunky (57). Na povrchu chemorezistentných vlasatých buniek pretrváva vysoká pozitivita CD22 antigénu, čo vysvetľuje účinnosť aj u pacientov s variantnou formou, ktorá býva rezistentná na chemoterapiu, avšak intenzívne exprimuje CD22 (58). Indikácia LMB-2 je obdobná ako pri imunotoxíne BL22 u refraktérnych foriem HCL. V prípade parciálnych remisií sa pozorovala 98–99,8 % redukcia počtu vlasatých buniek v periférnej krvi. Klinická účinnosť sa u väčšiny prípadov prejavila do l týždňa. Odpovede na liečbu boli trvalejšieho charakteru, u pacienta v KR táto pretrvávala viac ako 20 mesiacov, u niekoľkých ďalších odpovedí (PR) sa ich trvanie pohybovalo nad 6 mesiacov. U pacientov s refraktérnou HCL sa napriek predliečeniu a chýbaniu účinnosti predchádzajúcich terapeutických postupov dostavila efektivita i keď profil nežiaducich účinkov oboch imunotoxínov je výrazne širší oproti rituximabu (59). Tieto monoklonové protilátky sú schopné doručiť toxín s cytotoxickým účinkom do vnútra bunky a zabezpečiť tak selektívnu deštrukciu malígnych buniek s minimálnym ovplyvnením zdravých buniek a tkanív. Naviac oproti klasickým monoklonovým protilátkam imunotoxíny nevyžadujú pre uplatnenie svojho účinku spoluúčasť pacientovho imunitného systému, ktorý je u ťažko predliečených pacientov oslabený. Pravdepodobne aj tento fakt môže byť vysvetlením, prečo imunotoxíny (BL22, LMB-2) dokážu navodiť odpoveď, či prinajmenšom klinické zlepšenie aj tam, kde zlyhala liečba klasickými monoklonovými protilátkami a chemoterapiou.
Záver
Od 80. rokov minulého storočia pokroky v oblasti diagnostiky a liečby HCL významne zlepšili prognózu pacientov trpiacich na túto chorobu. Klinický obraz so splenomegáliou, nález cytopénie v periférnej krvi, infiltrácia kostnej drene, charakteristické morfologické znaky spolu s typickým profilom CD antigénov na povrchu buniek dokážu pomerne rýchlo a jednoducho potvrdiť túto diagnózu. Liečba purínovými analógmi a IFN-α u väčšiny pacientov prináša dlhotrvajúce remisie a tak sa z nevyliečiteľnej a fatálnej choroby stala diagnóza s pomerne dobrou prognózou a dlhým prežívaním chorých. Nové metódy liečby sú stále predmetom výskumu za účelom zlepšenia prognózy u tých pacientov, ktorých HCL je rezistentná na terapiu alebo trpia jej včasným relapsom. Prebiehajúce klinické štúdie zaoberajúce sa monoklonovými protilátkami a rekombinantnými imunotoxínmi by mali ozrejmiť význam a postavenie týchto liekov. HCL tak predstavuje onkologickú chorobu, ktorá napriek stále nepresne známej biológii, patogenéze a etiológii, môže byť úspešne kontrolovaná a liečená pri použití adekvátnych liečebných postupov.
Doručeno do redakce: 5. 11. 2009
Přijato po recenzi: 16. 3. 2010
MUDr. Radoslav Greksák
Národný onkologický ústav
Oddelenie klinickej onkológie
Klenová 1
833 10 Bratislava
radoslav.greksak@nou.sk
Sources
1. Bouroncle BA, Wiseman BK, Doan CA. Leukemic reticuloendotheliosis. Blood 1958; 13 : 609-630.
2. Schrek R, Donnelly WJ. Hairy cells in blood in lymphoreticular neoplastic disease and flagellated cells of normal lymph nodes. Blood 1966; 27 : 199-211.
3. Oleske D, Golomb HM, Farber MD, Levy PS. A case-control inquiry into the etiology of hairy cell leukemia. Am J Epidemiol 1985; 121 : 675-683.
4. Stewart DJ, Keating MJ. Radiation exposure as a possible etiologic factor in hairy cell leukemia. Cancer 1980; 46 : 1577-1580.
5. Foroni L, Catovsky D, Luzzato L. Immunoglobulin gene rearrangements in hairy cell leukemia and other chronic B-cell lymphoproliferative disorders. Leukemia 1987; 4 : 389-392.
6. Katayama I. Bone marrow in hairy cell leukemia. Hematol Oncol Clin North Am 1988; 2 : 585-602.
7. Levine PH, Katayama I. The platelet in leukemic reticuloendotheliosis. Functional and morphological evidence of a qualitative disorder. Cancer 1975; 36 : 1353-1358.
8. Rosove MH, Naeim F, Harwig S, Sighelboim J. Severe platelet dysfunction in hairy cell leukemia with improvement after splenectomy. Blood 1980; 55 : 903-906.
9. Depuy E, Sigaux F, Brychaert MC, et al. Platelet acquired defect in PDGF and ß-thromboglobulin content in hairy cell leukemia: improvement after interferon therapy. Brit J Haematol 1987; 65 : 107-110.
10. Podzimek K, Kerekeš Z, Chrobák L, et al. The value of bone marrow biopsy in the prognosis of hairy cell leukemia. Neoplasma 1994; 41 : 325-330.
11. Golomb HM, Vardiman JW. Response to splenectomy in 65 patients with hairy cell leukemia: an evaluation of spleen weight and bone marrow involvement. Blood 1982; 61 : 349-352.
12. Li CY, Yam LT, Lam KW. Studies of acid phosphatase isoenzymes in human leukocytes: demonstration of isoenzyme specificity. J Histochem Cytochem 1970; 18 : 901-910.
13. Micklem KJ, Dong Y, Willis A, et al. HML-1 antigen on mucosa-associated T cells, activated cells, and hairy leukemic cells is a new integrin containing the ß7 subunit. Am J Pathol 1991; 139 : 1297-1301.
14. Steis RG, Marcon L, Clark J, et al. Serum solubile IL-2 receptor as a tumor marker in patients with hairy cell leukemia. Blood 1988; 71 : 1304-1309.
15. Chrobák L, Podzimek K, Plišková L, et al. Serum soluble IL-2 receptor as a reliable and noninvasive marker of disease activity in patients with hairy cell leukemia. Neoplasma 1996; 43 : 321-325.
16. Moreau EJ, Matutes E, A’Hern RP, et al. Improvement of the chronic lymphocytic leukemia scoring system with the monoclonal antibody SN8 (CD79b). Am J Clin Pathol 1997; 108 : 378-382.
17. Matutes E, Morilla R, Owusu-Ankomah K, Houlihan A, Meeus P, Catovsky D. The immunophenotype of hairy cell leukemia (HCL). Proposal for a scoring system to distinguish HCL from B-cell disorders with hairy or villous lymphocytes. Leukemia Lymph 1994; 14 : 57-61.
18. Basso K, Liso A, Tiacci E, et al. Gene expression profiling of hairy cell leukemia reveals a phenotype related to memory B cells with altered expression of chemokine and adhesion receptors. J Exp Med 2004; 199 : 59-68.
19. Falini B, Tiacci E, Liso A, et al. Simple diagnostic assay for hairy cell leukaemia by immunocytochemical detection of annexin A1 (ANXA1). Lancet 2004; 363 : 1869-1871.
20. Vallianatou K, Brito-Babapulle V, Matutes E, Atkinson S, Catovsky D. p53 deletion and trisomy 12 in hairy cell leukemia. Leukemia Res 1999; 23 : 1041-1045.
21. Palomera L, Domingo JM, Sola C, et al. Cladribine therapy in hairy cell leukemia variant. A report of three cases. Haematologica 2002; 87 : 107-108.
22. Polliack A. Hairy cell leukemia: biology, clinical diagnosis, unusual manifestations and associated disorders. Rev Clin Exp Hematol 2002; 6 : 366-388.
23. Žák P. Vlasatobuněčná leukemie (In: Leukemie, 1. vyd.), Avicenum, Grada Publishing, Praha 2002; 336-339, ISBN 80-7169-991-8.
24. Golde DW. Therapy of hairy-cell leukemia. N Engl J Med 1982; 307 : 495-496.
25. Quesada JR, Reuben J, Manning JT, Hersh EM, Gutterman JU. Alpha interferon for induction of remission in hairy cell leukemia. N Engl J Med 1984; 310 : 15-18.
26. Berman E, Heller G, Kempin S, Gee T, Tran LL, Clarkson B. Incidence of response and long-term follow-up in patients with hairy cell leukemia treated with recombinant interferon-alpha-2a. Blood 1990; 75 : 839-845.
27. Frassoldati A, Lamparelli T, Federico M, et al. Hairy cell leukemia: a clinical review based on 725 cases of the Italian Cooperative Group (ICGHCL). Leukemia Lymph 1994; 13 : 307-316.
28. Damasio EE, Clavio M, Masoudi B, et al. Alpha-interferon as induction and maintenance therapy in hairy cell leukemia: a long-term follow-up analysis. Eur J Haematol 2000; 64 : 47-52.
29. Zinzani PL, Lauria F, Salvucci M, et al. Hairy cell leukemia and α-interferon treatment: long term responders. Haematologica 1997; 82 : 152-155.
30. Spiers ASD, Parekh SJ, Bishop SJ. Hairy cell leukemia: Induction of complete remission with pentostatin (2-deoxycoformycin). J Clin Oncol 1984; 2 : 1336-1342.
31. Dearden CE, Matutes E, Hilditch BL, Swansbury GJ, Catovsky D. Long-term follow-up of patients with hairy cell leukemia after treatment with pentostatin or cladribine. Brit J Haematol 1999; 106 : 515-519.
32. Ribeiro P, Bouaffia F, Peaud PY, et al. Long-term outcome of patients with hairy cell leukemia treated with pentostatin. Cancer 1999; 85 : 65-71.
33. Golomb HM, Dodge R, Mick R, et al. Pentostatin treatment for hairy cell leukemia patients who failed initial therapy with recombinant alpha-interferon: a report of CALGB study 8515. Leukemia 1994; 8 : 2037-2040.
34. Saven A, Piro LD. Complete remissions in hairy cell leukemia with 2-chlorodeoxyadenosine after failure with 2-deoxycoformycin. Ann Intern Med 1993; 119 : 278-283.
35. Piro LD, Carrera CJ, Carson DA, Beutler E. Lasting remissions in hairy cell leukemia induced by a single infusion of 2-chlorodeoxyadenosine. N Engl J Med 1990; 322 : 1117-1121.
36. Saven A, Burian C, Koziol JA, Piro LD. Long term follow up of patients with hairy cell leukemia after cladribine treatment. Blood 1998; 92 : 1918-1926.
37. Chadha P, Rademaker AW, Mendiratta P, et al. Treatment of hairy cell leukemia with 2-chlorodeoxyadenosine (2-CdA): Long-term follow-up of the Northwestern University experience. Blood 2005; 106 : 241-246.
38. Robak T, Blasinska-Morawiec M, Blonski J, et al. 2-chlorodeoxyadenosine (cladribine) in the treatment of hairy cell leukemia and hairy cell leukemia variant: 7-year experience in Poland. Eur J Haematol 1999; 62 : 49-56.
39. Juliusson G, Heldal D, Hippe E, et al. Subcutaneous injections of 2-chlorodeoxyadenosine for symptomatic hairy cell leukemia. J Clin Oncol 1995; 13 : 989-995.
40. Žák P. Vlasatobuněčná leukemie a přínos 2-chlorodeoxyadenosinu v léčbě. Nucleus, Hradec Králové 2006, 44-45, ISBN 80-87009-03-7.
41. Žák P, Chrobák L, Dědic K. Minimal residual disease, its detection and significance in hairy cell leukemia. Acta Medica (Hradec Králové) 1999; 42 : 85-88.
42. Bengio R, Narbait MI, Sarmiento MA, Palacios MF, Scolnik MP. Comparative analysis of immunophenotypic methods for the assessment of minimal residual disease in hairy cell leukemia. Haematologica 2000; 85 : 1227-1229.
43. Tallman MS, Hakimian D, Kopecky KJ, et al. Minimal residual disease in patients with hairy cell leukemia in complete remission treated with 2-chlorodeoxyadenosine or 2-deoxycoformycin and prediction of early relapse. Clin Cancer Res 1999; 5 : 1665-1670.
44. Ravandi F, Jorgensen JL, et al. Eradication of minimal residual disease in hairy cell leukemia. Blood 2006; 107 : 4658-4662.
45. Ginaldi L, De Martinis M, Matutes E, et al. Levels of expression of CD19 and CD20 in chronic B cell leukaemias. J Clin Pathol 1998; 51 : 364-369.
46. Hagberg, G. Chimeric monoclonal anti-CD20 antibody (rituximab) – an effective treatment for a patient with relapsing hairy cell leukemia. Med Oncol 1999; 16 : 221-222.
47. Hoffman M, Auerbach L. Bone marrow remission of hairy cell leukaemia induced by rituximab in a patient refractory to cladribine. Brit J Haematol 2000; 109 : 900-901.
48. Hagberg H, Lundholm L. Rituximab, a chimaeric anti-CD20 monoclonal antibody, in the treatment of hairy cell leukemia. Brit J Haematol 2001; 115 : 609-611.
49. Thomas DA, O’Brien S, Bueso-Ramos C, et al. Rituximab in relapsed or refractory hairy cell leukemia. Blood 2003; 102 : 3906-3911.
50. Cervetti G, Galimberti S, Andreazzoli F, et al. Rituximab as treatment for minimal residual disease in hairy cell leukaemia. Eur J Haematol 2004; 73 : 412-417.
51. Zenhäusern R, Simcock M, et al. Rituximab in patients with hairy cell leukemia relapsing after treatment with 2-chlorodeoxyadenosine (SAKK 31/98). Haematol 2008; 93 : 1426-1428.
52. Fietz T, Rieger K, Schmittel A, Thiel E, Knauf W. Alemtuzumab (Campath-1H) in hairy cell leukaemia relapsing after rituximab treatment. Hematol J 2004; 5 : 451-452.
53. Quigley MM, Bethel KJ, Sharpe RW, Saven A. CD52 expression in hairy cell leukemia. Am J Hematol 2003; 74 : 227-230.
54. Schulz H, Winkler U, Staak JO, et al. The monoclonal antibodies Campath-1H and Rituximab in the therapy of chronic lymphocytic leukemia. Onkologie 2000; 23 : 526-532.
55. Kreitman RJ, Margulies I, Stetler-Stevenson M, et al. Cytotoxic activity of disulfide-stabilized recombinant immunotoxin RFB4(dsFv)-PE38 (BL22) towards fresh malignant cells from patients with B-cell leukemias. Clin Cancer Res 2000; 6 : 1476-1487.
56. Kreitman RJ, Squires DR, Stetler-Stevenson M, et al. Phase I trial of recombinant immunotoxin RFB4(dsFv)-PE38 (BL22) in patients with B-cell malignancies. J Clin Oncol 2005; 23 : 6719-6729.
57. Kreitman RJ. Immunotoxins in cancer therapy. Curr Opin in Immunol 1999; 11 : 570-578.
58. Matutes E, Wotherspoon A, Brito-Babapulle V, et al. The natural history and clinico-pathological features of the variant form of hairy cell leukemia. Leukemia 2001; 15 : 184-186.
59. Kreitman RJ, Wilson WH, Bergeron K, et al. Efficacy of the anti-CD22 recombinant imunotoxin BL22 in chemotherapy-resistant hairy cell leukemia. N Engl J Med 2001; 345 : 241-247.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2010 Issue 3-
All articles in this issue
- Globální hodnocení funkce hemostázy – část II. Vlastní zkušenosti s použitím trombin generačního testu u pacientů s trombofilií
- Přínos režimu CTD (cyklofosfamid, thalidomid, dexametazon) v léčbě relabujících a refrakterních forem mnohočetného myelomu
- Odlišné hladiny asparagin syntetázy nejsou zodpovědné za rozdílnou senzitivitu leukemických blastů k L-Asparagináze
- Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
- Folikulární lymfom a význam nádorového mikroprostředí
- Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
- Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vlasatobunková leukémia – diagnostika, liečba a monoklonové protilátky
- Folikulární lymfom a význam nádorového mikroprostředí
- Cytomegalovirus-specifická buněčná imunita: stanovení profilu imunitní funkce přináší klinicky relevantní odpověď
- Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career