-
Medical journals
- Career
Imunofenotypizace a diagnostika obtížně klasifikovatelných akutních leukemií – nová diagnostická skupina dle WHO klasifikace 2008
: I. Marinov 1,2; D. Mikulenková 1; A. Luxová 1; V. Tkáčová 1
: Ústav hematologie a krevní transfuze 1; Ústav klinické a experimentální hematologie ÚHKT a 1. LF UK, Praha 2
: Transfuze Hematol. dnes,16, 2010, No. 3, p. 166-171.
: Comprehensive Reports, Original Papers, Case Reports
Imunofenotypizace polychromatickou průtokovou cytometrií je v současné době standardem pro diagnostiku, klasifikaci a monitorování akutních leukemií. Patří k základním vyšetřovacím metodám i v diagnostice akutních obtížně klasifikovatelných leukemií. Nová revidovaná WHO klasifikace tumorů hematopoézy a lymfoidních tkání z r. 2008 rozdělila skupinu obtížně klasifikovatelných akutních leukemií na akutní nediferencovanou leukemii (AUL) a na leukemii se smíšeným fenotypem (MPAL). Cílem nově navržených kritérií je přesnější a komplexnější charakterizace onemocnění s ohledem na prognózu jednotlivých podskupin. Uvedená práce reflektuje vlastní zkušenost a současné možnosti imunologické diagnostiky u tohoto typu diagnózy.
Klíčová slova:
imunofenotypizace, průtoková cytometrie, obtížně klasifikovatelné leukemie, revidovaná WHO klasifikace 2008Úvod
Podskupina obtížně klasifikovatelných akutních leukemií je v rámci diagnostiky akutních leukemií dle WHO klasifikace 2008 definována jako heterogenní skupina leukemií, u kterých lze obtížně prokázat či nelze jednoznačně prokázat diferenciaci leukemických blastů v rámci jedné vývojové řady (obr. 1) (1, 2). Překlad názvu této leukemie z anglického jazyka je akutní leukemie těžko či obtížně klasifikovatelná, zařaditelná, nejednoznačná, či nejasná. Autoři dávají přednost názvu obtížně klasifikovatelné leukemie.
1. Rozdělení obtížně klasifikovatelných akutních leukemií dle revidované WHO 2008. 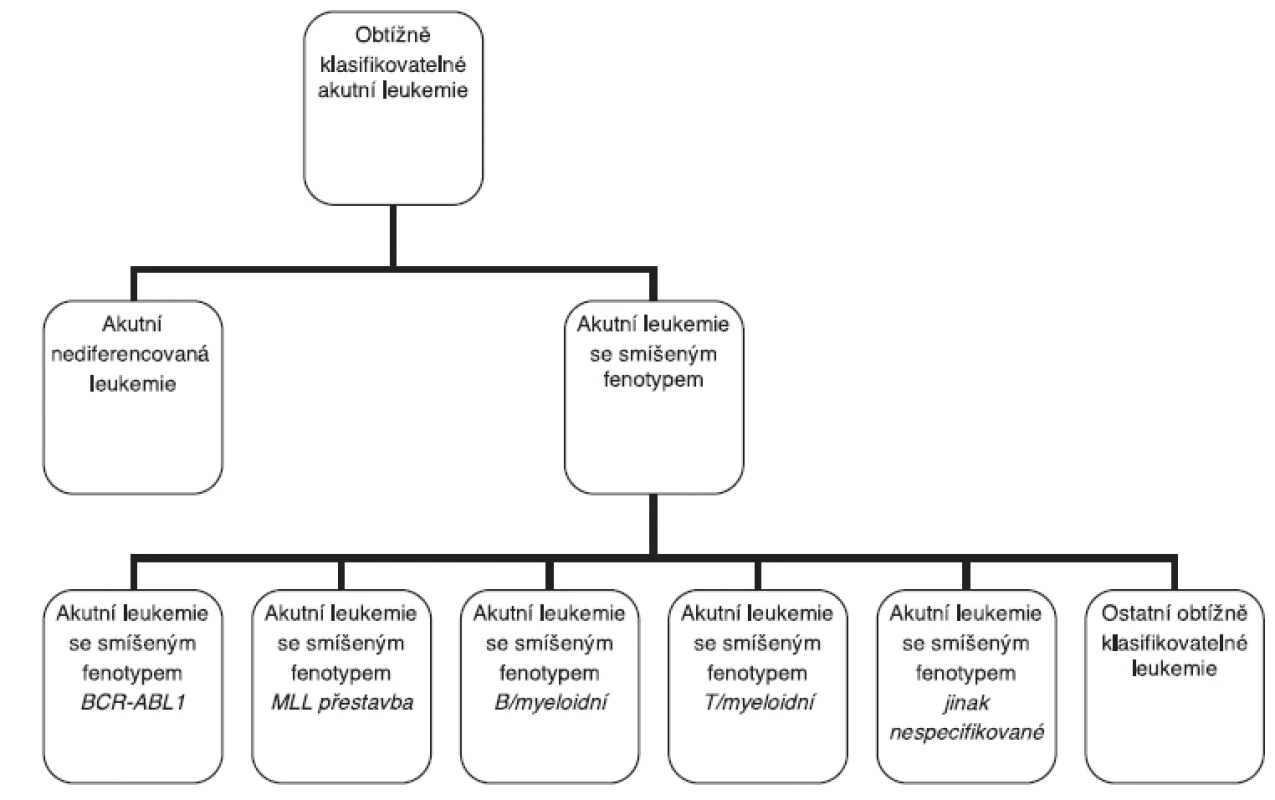
Imunofenotypizací průtokovou cytometrií rozlišujeme vzácné formy akutních leukemií, u kterých patologická populace neexprimuje markery specifické pro lymfoidní, myeloidní, erytroidní, megakaryocytární, NK (natural-killer), plazmocytární či dendritickou řadu, a akutní leukemie, u kterých patologická populace exprimuje více znaků z více vývojových řad. První podtyp obtížně klasifikovatelné leukemie je obecně znám jako akutní nediferencovaná leukemie (3), druhý zahrnuje akutní bifenotypovou a akutní bilineární leukemii z WHO klasifikace 2001 a začleňuje do této skupiny též řadu dalších nových podtypů (viz obr. 1).
Jelikož morfologické vyšetření má omezený význam pro charakterizaci fenotypové heterogenity leukemických blastů, imunofenotypizace průtokovou cytometrií hraje v diagnostice této podskupiny akutních leukemií zásadní roli.
Imunologické markery pro charakterizaci leukemických blastů
Výběr imunologických markerů pro charakterizaci leukemických blastů provádíme v souladu s doporučením mezinárodní konsensuální konference v Bethesdě z roku 2006, tab. 1 (6).
1. Konsenzuální doporučení na výběr primárních a sekundárních reagencií pro imunologickou charakterizaci jednotlivých vývojových řad průtokovou cytometrií (Bethesda International Consensus Conference, 14–15 July, 2006). 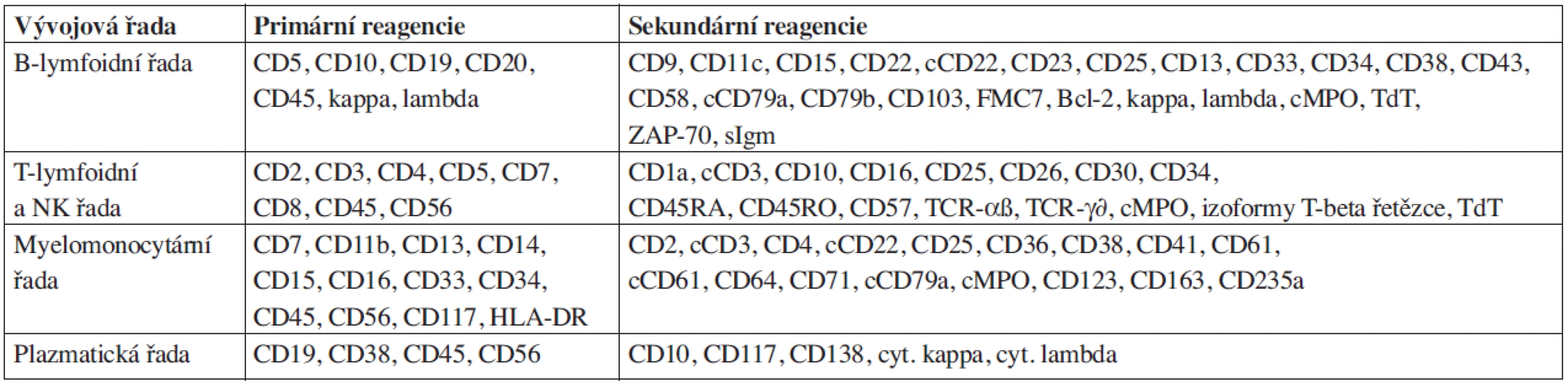
Myeloidní markery
Myeloidní řadu definujeme na základě exprese pan-myeloidních znaků CD13 a CD33. Je nutné vědět, že oba markery mohou být přítomny i u akutní lymfoblastické leukemie. Znaky CD34 a CD117 odlišují méně zralé myeloidní elementy, s vyzráváním se objevují znaky CD11b, CD15 a CD65. Největší význam pro průkaz myeloidní řady má detekce cytoplazmatické myeloperoxidázy (cMPO). Cytometricky lze cMPO však prokázat i v cytoplazmě monocytů (7, 8).
Monocytární markery
Monocytární řadu definujeme na základě exprese znaků CD4, CD11b (silná exprese), CD36, CD64 (silná exprese), CD68 a CD163. Imunohistochemicky lze prokázat lysozym, který se však nachází také v cytoplazmě granulocytů. Vyzrávající monocyty vykazují heterogenní expresi znaku CD14, zralé monocyty jsou CD14 silně pozitivní na rozdíl od vyzrávajících granulocytů, které jsou CD14 slabě pozitivní (9).
Erytroidní markery
Erytroidní řadu definujeme na základě silné exprese znaků CD36, CD71 a přiměřené exprese znaku CD235a (glykoforin). Exprese znaku CD36 není pro erytroidní řadu specifická, exprese znaku CD71 může být aberantně slabá. Exprese znaku CD235a může chybět na povrchu méně zralých forem erytroblastů, které jsou naopak často CD117 pozitivní (10).
Megakaryocytární markery
Megakaryocytární řadu definujeme na základě silné exprese znaku CD36 a exprese znaků CD41, CD42 a CD61. Na povrchu méně zralých forem se často vyskytuje znak CD117, zatímco znak CD45 může být negativní (11).
B-lymfoidní markery
B-lymfoidní řadu definujeme na základě silné exprese znaku CD19 a cytoplazmatické exprese znaků CD22 a IgM (12). Méně specifické markery na průkaz B-lymfoidní diferenciace jsou CD10, cytoplazmatická CD79a a jaderná TdT: expresi CD10 a cCD79a pozorujeme u akutní lymfoblastické leukemie z T-řady, zatímco TdT je pozitivní u některých forem akutní myeloidní leukemie.
T-lymfoidní markery
Největší význam pro průkaz T-lymfoidní diferenciace má povrchová nebo cytoplazmatická exprese znaku CD3, méně specifické jsou znaky CD2 a CD5, nejmenší specifitu mají znaky CD4 a CD7 (13).
Imunofenotypová kritéria pro stanovení akutní nediferencované leukemie
U akutní nediferencované leukemie obvykle prokazujeme nejvýše expresi jednoho markeru vývojové řady (viz výše), většinou ale není přítomen žádný marker. Cytoplazmatické znaky CD3, CD22, CD79a a MPO jsou vždy negativní. Patologická populace je často HLA-DR a/nebo CD34 a/nebo CD38 pozitivní, TdT může být pozitivní. Před definitivním stanovením diagnózy akutní nediferencované leukemie je nutné použít dostatečně široký panel monoklonálních protilátek k vyloučení akutní myeloidní leukemie s minimální diferenciací, akutní megakaryocytární a erytroidní leukemie, leukemie z plazmatických buněk a leukemie z blastických plazmocytoidních dendritických buněk.
U akutní myeloidní leukemie s minimální diferenciací jsou blastické buňky středně velké, mají kulaté či lehce vpáčené jádro s disperzním chromatinem s jadérky či bez nich. Cytoplazma je středně bazofilní, bez granul. Cytologicky v panoptickém barvení mohou též připomínat lymfoblasty či monoblasty. Cytochemicky je < 3 % blastů MPO pozitivních. Imunofenotypizačně ji definujeme na základě exprese znaku CD13 a/nebo CD117. Leukemické blasty jsou většinou CD33, CD34 a HLA-DR pozitivní, často jsou CD7 pozitivní. Cytoplazmatické znaky CD3, CD22 a CD79a jsou naopak negativní (14). Akutní erytroidní leukemii imunofenotypizačně definujeme na základě silné exprese znaku CD36, negativity myeloidních znaků a cytoplazmatické MPO. Glykoforin A a hemoglobin A mohou být pozitivní nebo negativní. Charakteristickým nálezem je populace CD117+, CD34-, HLA-DR - v „blastickém“ gate (CD45 slabě negativní / SSC nízký). Leukemii z plazmatických buněk definujeme na základě slabé či negativní exprese znaku CD45, silné exprese znaku CD38, exprese znaku CD138 a cytoplazmatických lehkých řetězců kappa nebo lambda. Leukemická populace může být CD33 a/nebo CD117 pozitivní a na rozdíl od myelomu je CD56 většinou negativní (9). Leukemie z blastických plazmocytoidních dendritických buněk určíme na základě exprese „dendritických“ znaků CD4, CD43, CD45RA, CD56 a silné exprese CD123. Částečnou expresi TdT nacházíme zhruba ve třetině případů, znaky CD7 a/nebo CD33 mohou být pozitivní. Znaky CD3, CD5, CD13, CD16, CD19, CD20, CD34, cCD79a, CD117, cMPO jsou negativní (15, 16).
Imunofenotypová kritéria pro stanovení akutní bifenotypové leukemie dle EGIL, použito ve WHO 2001
Akutní bifenotypová leukemie (ABL) byla v rámci WHO klasifikace 2001 definována v konceptu evropské skupiny pro imunologickou charakterizaci leukemií (EGIL). Podstatou konceptu bylo definovat skóre vyjadřující význam jednotlivých markerů pro určení vývojové řady na základě jejich specifity (tab. 2.). Akutní bifenotypová leukemie byla stanovena při skóre > 2 pro myeloidní a jednu lymfoidní řadu (obr. 2.).
2. Skórovací systém pro diagnostiku akutní bifenotypové leukemie podle EGIL. 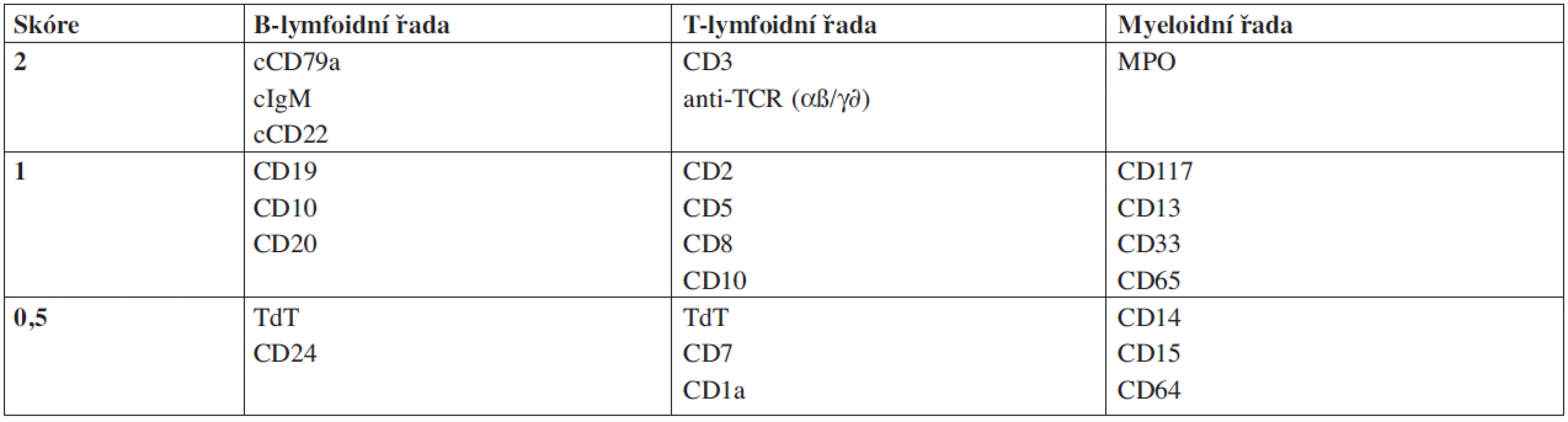
2. Akutní bifenotypová leukemie dle EGIL (WHO 2001). Fenotyp leukemické populace (červeně): CD45 slabě, CD19+, cCD22+, cCD79a+, CD33+, CD13slabě, CD117+. Skóre pro B-lymfoidní řadu- 3, skóre pro myeloidní řadu-3. 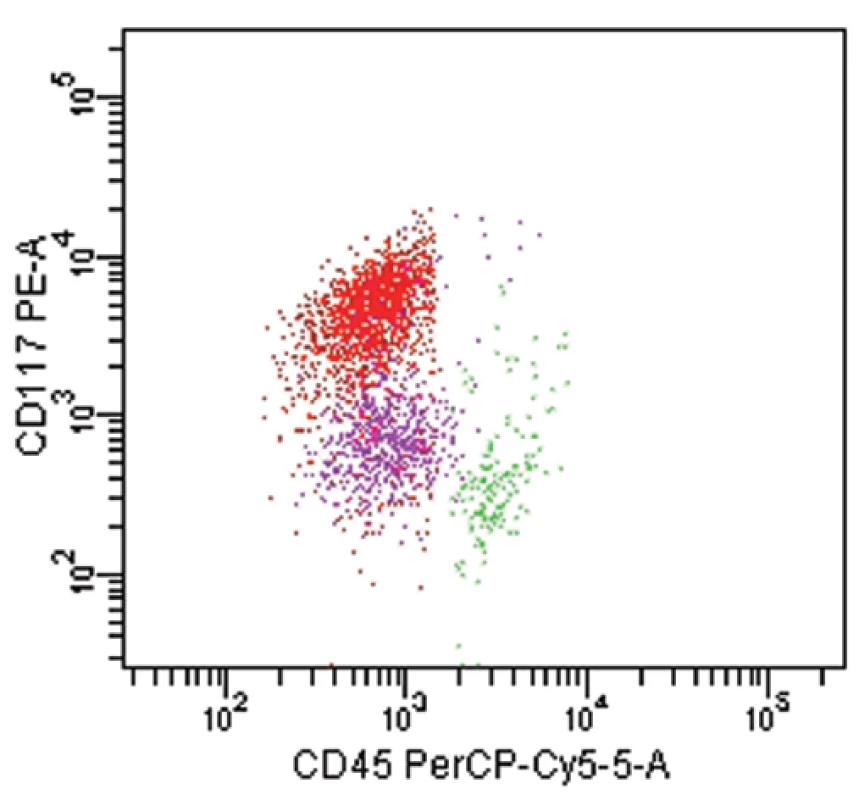
Imunofenotypová kritéria pro stanovení akutní leukemie se smíšeným fenotypem (MPAL)
Skóre na určení akutní bifenotypové leukemie je poměrně složité, navíc nedefinuje případy, u kterých nacházíme koexistenci více patologických klonů s odlišným původem, tzv. biklonální akutní leukemie (obr. 3.). WHO klasifikace 2008 nově definuje akutní leukemii se smíšeným fenotypem (MPAL), která zahrnuje obě předchozí formy. Zahrnuje též nové formy leukemie s molekulárně genetickým podkladem (viz dále).
3. Akutní leukemie se smíšeným fenotypem T/My (WHO 2008). T lymfoidní komponenta (červeně): CD1a+, cCD3+,CD7+, CD34+, CD45 slabě. Myeloidní komponenta (modře): CD13+ (zde nezobrazeno), CD33+, MPO+, CD45 slabě. 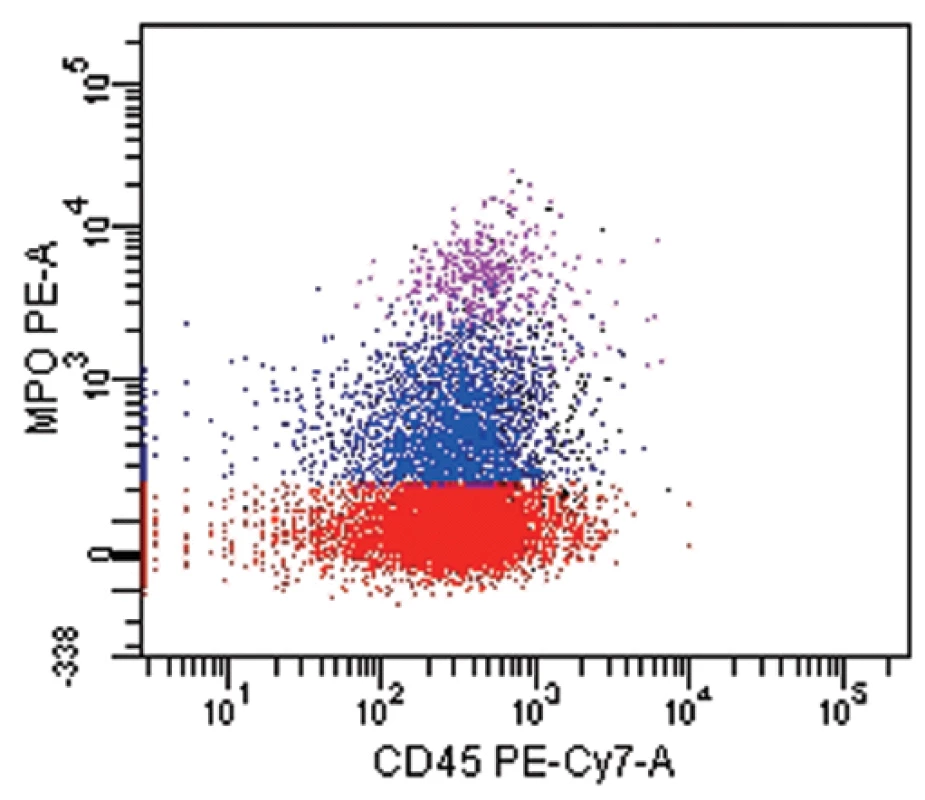
Morfologicky lze v některých případech u biklonální leukemie rozlišit dvě populace blastů – myeloidní s pozitivitou MPO (myeloblasty) či nespecifických esteráz (monoblasty) a lymfoidní s PAS (B - řada) či KF (T-řada) pozitivitou (obr. 4.).
4. Aspirát kostní dřeně biklonální akutní leukemie – myeloidní /T lymfoblastické, panoptické barvení, 1000 x zvětšení: tři shluky buněk s převahu blastů, jednou šipkou označené blasty myeloidního charakteru, dvěma šipkami blasty s lymfoidní morfologií, neoznačené blastické elementy jsou obtížně zařaditelné, četnější blastické jaderné stíny, ojediněle erytroblast, méně zralé granulocyty, zralé lymfocyty. 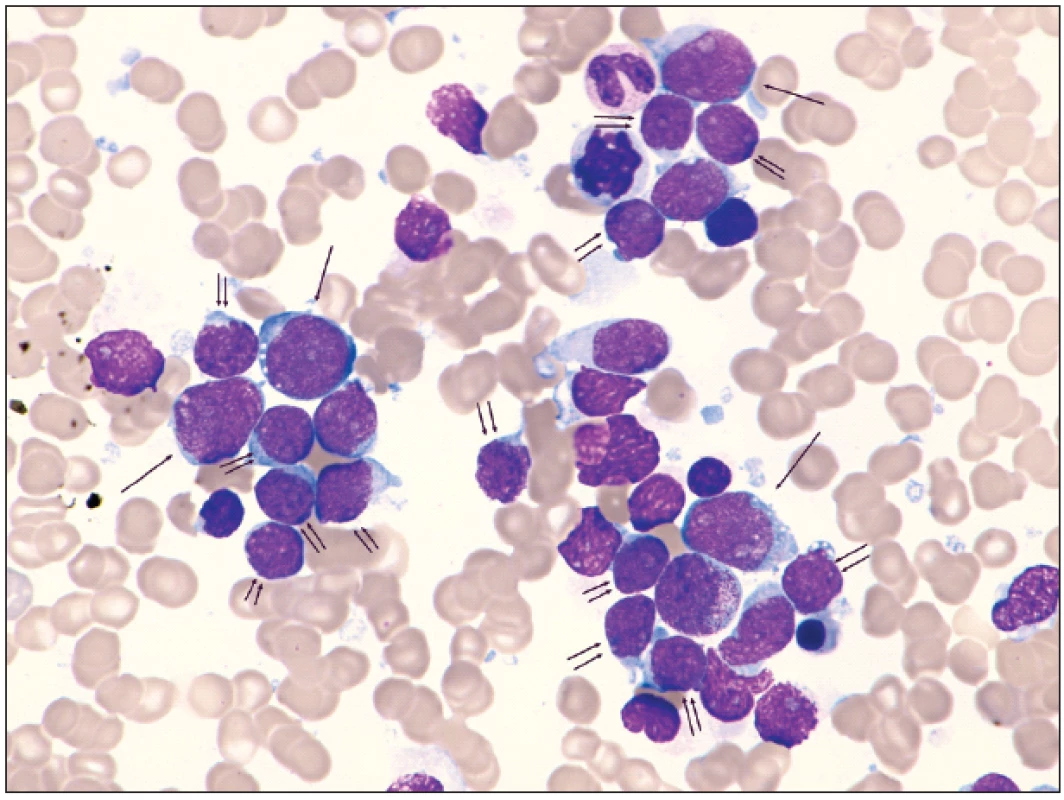
Průkaz myeloidní komponenty
Myeloidní komponenta může být součástí dvou nebo více leukemických klonů, ze kterých jeden splňuje imunofenotypová kritéria pro AML (populace může být zastoupena méně než 20 %). Myeloidní komponentu prokazujeme i v případě přítomnosti jednoho klonu leukemických blastů splňujícího kritéria pro B-ALL či T-ALL, pokud prokážeme koexpresi cMPO (CD13, CD33, CD117 nejsou dostatečně specifické), nebo koexpresi ≥2 monocytárních znaků (CD11c, CD14, CD34, CD64, lysozym).
Průkaz B-lymfoidní komponenty
B-lymfoidní komponentu prokazujeme na základě silné exprese znaku CD19 a exprese minimálně jednoho ze znaků cCD79a , cCD22, CD10, nebo na základě slabé exprese znaku CD19 a exprese minimálně dvou ze znaků cCD79a, cCD22, CD10.
Průkaz T-lymfoidní komponenty
T-lymfoidní komponentu prokazujeme na základě cytoplazmatické exprese znaku CD3-ε s intenzitou blížící se intenzitě exprese na povrchu normálních T-lymfocytů (CD3-ζ pozitivita může být pozorována v NK-buňkách) nebo zřídka, na základě povrchové exprese znaku CD3.
Jasně definované formy akutní leukemie se smíšeným fenotypem
Akutní leukemie se smíšeným fenotypem a t(9;22)(q34;q11.2), či BCR-ABL1
Jedná se o akutní leukemii, u které malignizace nastává na úrovni multipotentní kmenové buňky. Patologická populace splňuje kritéria pro akutní leukemii se smíšeným fenotypem a nese translokaci t(9;22) nebo přestavbu BCR-ABL1. Do této skupiny nezahrnujeme případy s předchozí anamnézou CML. Imunofenotypizačně leukemické blasty splňují kritéria pro B-lymfoidní a myeloidní komponentu: smíšený B-lymfoidní/myeloidní fenotyp nebo B-lymfoidní a myeloidní patologické klony.
Akutní leukemie se smíšeným fenotypem a t(v;11q23),(MLL přestavba)
Jedná se o akutní leukemii, u které malignizace též nastává na úrovni multipotentní kmenové buňky. Patologická populace splňuje kritéria pro akutní leukemii se smíšeným fenotypem a má translokaci t(v;11q23) zahrnující MLL gen.
Imunofenotypizačně leukemické blasty splňují kritéria pro B-lymfoidní a myeloidní komponentu: většinou jsou to B-lymfoidní a monoblastické patologické klony. Lymfoblasty jsou CD10 negativní, vykazují slabou expresi znaků CD19, CD22, cCD79a a často koexprimují CD15.
Vzácné formy akutní leukemie se smíšeným fenotypem
Do této skupiny zařazujeme velmi vzácné formy akutní leukemie se smíšeným fenotypem, u kterých blasty nevykazují výše uvedené cytogenetické ani molekulárně-biologické abnormality. Jsou známé formy akutní leukemie se smíšeným fenotypem, B/myeloidní (MPAL, B/myeloid, NOS), akutní leukemie se smíšeným fenotypem, T/myeloidní (MPAL, T/myeloid, NOS), akutní leukemie se smíšeným fenotypem dále nespecifikovaná a ostatní obtížně zařaditelné akutní leukemie (včetně leukemie z natural killer lymfocytů).
Závěr
Imunofenotypizační vyšetření akutní leukemie při vstupní diagnostice poskytuje klinickému lékaři informace ohledně přesného zařazení onemocnění a v některých případech též na základě aberantního fenotypu možnost monitorování choroby v průběhu terapie. Různorodost jednotlivých forem akutní leukemie je spojená se širokou škálou imunofenotypových a molekulárních abnormalit definovaných na základě doporučených postupů v rámci WHO. Imunofenotypizační diagnostické panely proto musí obsahovat poměrně široké spektrum monoklonálních protilátek. Diagnostiku podskupiny „akutní leukemie obtížně klasifikovatelné“, pod které nyní patří akutní nediferencovaná leukemie (AUL) a leukemie se smíšeným fenotypem (MPAL), by mělo provádět vysoce specializované pracoviště průtokové cytometrie. V konečné fázi je ale diagnóza komplexní, zahrnuje též morfologicko-cytochemické, cytogenetické a molekulárně-biologické vyšetření.
Doručeno do redakce: 25. 2. 2010
Přijato po recenzi: 30. 3. 2010
MUDr. Iuri Marinov, CSc.
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 20 Praha 2
e-mail: marinov@uhkt.cz
Sources
1. Swerdlow SH, Campo E, Harris NL, et al, eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon, France: IARC; 2008.
2. Craig FE, Foon KA. Flow cytometric immunophenotyping for hematologic neoplasms. Blood 2008; 111 : 3941-67.
3. Vardiman JW, Thiele J, Arber DA, et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood 2009; 114 : 937-51.
4. Béné MC, Castoldi G, Knapp W, Ludwig WD, Matutes E, Orfao A, van’t Veer MB. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). Leukemia 1995; 9 : 1783-6.
5. Stetler-Stevenson M, Davis B, Wood B, Braylan R. 2006 Bethesda international consensus conference on flow cytometric immunophenotyping of hematolymphoid neoplasia. Cytometry B Clin Cytom 2007; 72 Suppl 1: S3.
6. Brent L. Wood, Maria Arroz, David Barnett, et al. 2006 Bethesda International Consensus Recommendations on the Immunophenotypic Analysis of Hematolymphoid Neoplasia by Flow Cytometry: Optimal Reagents and Reporting for the Flow Cytometric Diagnosis of Hematopoietic Neoplasia. Cytometry Part B (Clinical Cytometry), 2007; 72B: S14-S22
7. Casasnovas RO, Slimane FK, Garand R, et al. Immunological classification of acute myeloblastic leukemias: relevance to patient outcome Leukemia 2003; 17 : 515-27.
8. Tallman MS. Relevance of pathologic classifications and diagnosis of acute myeloid leukemia to clinical trials and clinical practice. Cancer Treat Res 2004; 121 : 45-67.
9. Nguyen D, Diamond LW, Braylan RC. Flow Cytometry in Hematopathologylogy, Humana Press, 2008.
10. Domingo-Claros A, Larriba I, Rozman M, et al. Acute erythroid neoplastic proliferations. A biological study based on 62 patients. Haematologica 2002; 87 : 148-53.
11. Duchayne E, Fenneteau O, Pages MP, Sainty D, Arnoulet C, Dastugue N, Garand R, Flandrin G; Groupe Francais d’Hematologie Cellulaire; Groupe Francais de Cytogenetique Hematologique. Acute megakaryoblastic leukaemia: a national clinical and biological study of 53 adult and childhood cases by the Groupe Francais d’Hematologie Cellulaire (GFHC). Leuk Lymphoma 2003; 44 : 49-58.
12. Djokic M, Björklund E, Blennow E, Mazur J, Söderhäll S, Porwit A. Overexpression of CD123 correlates with the hyperdiploid genotype in acute lymphoblastic leukemia. Haematologica 2009; 94 : 1016-9.
13. Porwit-MacDonald A, Bjorklund E, Lucio P, et al. BIOMED-1 concerted action report: flow cytometric characterization of CD7+ cellsubsets in normal bone marrow as a basis for the diagnosis and follow-up of Tcell acute lymphoblastic leukemia (T-ALL). Leukemia 2000; 14 : 816-25.
14. Béné MC, Bernier M, Casasnovas RO, et al. Myeloid leukaemia M0: haematological, immunophenotypic and cytogenetic characteristics and their prognostic significance: an analysis in 241 patients. Br J Haematol 2001; 113 : 737-45.
15. Garnache-Ottou F, Feuillard J, Ferrand C, et al. GOELAMS and GEIL study. Extended diagnostic criteria for plasmacytoid dendritic cell leukaemia. Br J Haematol 2009; 145 : 624-36.
16. Klabusay M, Pevná M, Kissová J, Doubek M, Heidekerová M, Mayer J, Vorlíček J. Vzácná diagnóza: CD4+56+ leukemie z dendritických buněk typu DC2. Čas Lék čes 2008; 147(10): 511-515.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2010 Issue 3-
All articles in this issue
- Global assessment of haemostatic function - part II. Our experience with thrombin generation test using in thrombophilia patients
- The efficacy of the CTD regimen (cyclophosphamide, thalidomide, dexamethasone) in therapy of relapsed and refractory multiple myeloma
- Diverse asparagine synthetase expression in lymphoid blasts is not relevant to the sensitivity to L-Asparaginase
- Cytomegalovirus – specific cellular imunity: profile of immune function assesment provides clinically relevant answer
- Follicullar lymphoma and the significance of its tumour microenvironment
- Hairy cell leukemia – diagnostics, treatment and monoclonal antibodies
- Immunophenotypic characterization of acute leukemias of ambiguous lineage- new diagnostic entity of the revised WHO classification 2008
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hairy cell leukemia – diagnostics, treatment and monoclonal antibodies
- Follicullar lymphoma and the significance of its tumour microenvironment
- Cytomegalovirus – specific cellular imunity: profile of immune function assesment provides clinically relevant answer
- Immunophenotypic characterization of acute leukemias of ambiguous lineage- new diagnostic entity of the revised WHO classification 2008
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career











