-
Medical journals
- Career
MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
Authors: Š. Pospíšilová *; K. Malinová *; M. Mráz; J. Mayer
Authors‘ workplace: Centrum molekulární biologie a genové terapie, Interní hematoonkologická klinika, LF MU a FN Brno
Published in: Transfuze Hematol. dnes,14, 2008, No. 4, p. 180-187.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
MicroRNA jsou malé molekuly ribonukleotidové kyseliny, které se významně podílejí na regulaci genové exprese. Působení microRNA využívá mechanismu RNA interference (RNAi), který umožňuje cílené utlumení genové exprese na post-transkripční úrovni prostřednictvím krátkých dvouřetězcových RNA molekul. V lidském genomu bylo dosud nalezeno přibližně 750 microRNA genů, přičemž tento počet zatím není konečný (počítačové analýzy lidského genomu predikují existenci asi tisíce microRNA). Předpokládá se však, že tyto microRNA regulují expresi až třetiny protein-kódujících genů, což naznačuje jejich zásadní význam pro fungování buňky a buněčného cyklu. Deregulace microRNA byla popsána u většiny nádorů včetně hematologických malignit a přibývá stále více důkazů o tom, že microRNA hrají zásadní roli v maligní transformaci buňky. U řady hematologických malignit byl popsán jejich přímý význam v patogenezi onemocnění. Příkladem je delece microRNA miR-15a a miR-16-1, regulující expresi onkogenu BCL2 u přibližně 50 % pacientů s chronickou lymfocytární leukemií.
Klíčová slova:
microRNA, miRNA, RNA interference, regulace genové exprese, CLL – chronická lymfocytární leukemieVýznam microRNA
RNA byla po dlouhou dobu považována za molekulu, která funguje především jako prostředník mezi dědičnou informací, uloženou v DNA, a realizací informace uložené v genech – proteiny. Nedávná léta však ukazují, že funkce RNA významně zasahují do rozsáhlejšího okruhu buněčných pochodů. Byly totiž objeveny krátké dvouřetězcové molekuly RNA, schopné při své délce kolem 20 nukleotidů ovlivnit expresi velkého množství genů. Principem jejich působení je zpravidla inhibice translace mRNA do proteinu a byly označeny jako microRNA (1–3).
MicroRNA (miRNA) jsou schopny v buňce ovlivňovat celou řadu významných procesů. U živočichů se účastní procesů buněčné proliferace, buněčné smrti, metabolismu, embryogeneze, modulace diferenciace krvetvorných buněk savců a dalších pochodů (4, 5). U rostlin kontrolují vývoj listů a květů (6). Počítačové analýzy, vyhledávající cílové sekvence mRNA, ukazují, že tyto příklady představují pouze zlomek z celého množství pochodů, jichž se microRNA účastní (7). V lidském genomu již bylo charakterizováno více než 750 microRNA. Podle bioinformatických předpovědí jejich počet dosahuje tisíc nebo i více. Funkce však u většiny dosud objasněna nebyla. Je však zřejmé, že jejich nepřítomnost či nesprávná funkce může vést k vývojovým vadám či provázet rozvoj řady onemocnění. Bylo také prokázáno, že exprese microRNA v nádorových buňkách včetně leukemických vykazuje odlišný charakter od exprese ve zdravých buňkách a „expresní profily“ microRNA u jednotlivých pacientů mohou pomoci upřesnit diagnózu a prognózu onemocnění.
V nedávné době byly objeveny také miRNA kódované viry. Nejčastěji pocházejí z virů s genomem tvořeným dvouřetězcovou nukleovou kyselinou - byly detekovány u herpesvirů (EBV, KSHV, HCMV), polyomavirů (SV40) a retrovirů (HIV) (8), předpokládá se jejich přítomnost u adenovirů a poxvirů. Vztah mezi viry a miRNA je však dvoustranný. Kromě toho, že virové miRNA mohou svým nositelům pomáhat v infekci hostitelské buňky, mohou se buněčné microRNA účastnit procesu RNA interference zajišťujícího ochranu buňky proti virovým nákazám (9).
Proces RNA interference
MicroRNA využívají mechanismus tzv. RNA interference, který umožňuje post-transkripční utlumení exprese genů. K prvotnímu studiu procesu RNA interference byl využit modelový organismus hlísta Caenorhabditis elegans. Bylo zjištěno, že vnesení dvouřetězcové RNA s vhodnou sekvencí může mít za následek utlumení aktivity vybraného genu, a to s vyšší účinností než vnesení jednořetězcové protismyslné RNA (10). Brzy se ukázalo, že popsaný jev není vyhrazen pouze pro tento organismus. Regulace genové exprese pomocí RNAi byla zakrátko prokázána u mouchy octomilky, trypanozomy a především u velkého počtu genů obratlovců. Za objev RNA interference byla v roce 2006 udělena Nobelova cena, jejímiž nositeli se stali Andrew Z. Fire a Craig C. Mello.
Pro všechny typy procesu RNA interference je charakteristická přítomnost krátkých řetězců RNA, které jsou odvozeny od dvouřetězcové RNA (dsRNA). Lze je rozdělit do dobře definovaných skupin: endogenní microRNA (miRNA) a malé interferující RNA (siRNA). Kromě nich existují další skupiny krátkých RNA jako např. piRNA (Piwi interacting RNA) interagující s proteinem Piwi, který náleží do skupiny proteinů Argonaut. Funkce krátkých RNA souvisí zejména s transkripcí mRNA, se stabilitou mRNA a její translací. V některých případech mohou miRNA fungovat stejnými mechanismy jako siRNA a naopak. Rozhodujícím rysem, který určuje jejich schopnost ovlivňovat cílovou molekulu, je jejich sekvence. Podle míry komplementarity lze odhadnout, zda budou potlačovat genovou expresi prostřednictvím štěpení cílové RNA nebo potlačením translace. Jestliže je párování bází mezi malou RNA a cílovou mRNA úplné nebo téměř úplné, dochází ke štěpení mRNA. Takto působí převážně siRNA. Jestliže je komplementarita nižší, nastává potlačení translace. Tento mechanismus je spíše spojován s miRNA. Úroveň represe translace je pak závislá na množství mRNA i na množství dostupných miRNA, pro potlačení translace se často na cílovou mRNA naváže několik miRNA najednou. Jediný druh miRNA se může vázat až ke stovkám cílových mRNA. Ve všech případech je pro rozpoznávání cílové mRNA klíčové párování 2.–7. nukleotidu od 5ę konce malé RNA (7).
Biogeneze microRNA
Vznik tzv. zralé funkční microRNA je poměrně složitý proces a účastní se ho řada proteinových komplexů (obr. 1). MicroRNA působí ve formě jednořetězcových RNA molekul (ssRNA) o délce 18–24 nukleotidů (11), které vznikají transkripcí genů pro microRNA a jsou transkribovány za vzniku primárního transkriptu (pri-miRNA). Dozrávání miRNA začíná v jádře sestřihem pri-miRNA na 60 až 70 nukleotidů dlouhý meziprodukt, označovaný jako pre-miRNA. Sestřih provádí endonukleáza Drosha. Pre-miRNA je pak exportována do cytoplazmy za účasti exportního receptoru Exportin-5 s kofaktorem Ran-GTP. V cytoplasmě je pre-miRNA sestřižena enzymem Dicer, čímž je určen i druhý konec budoucí zralé miRNA (12). Výsledkem sestřižení pre-miRNA je krátký duplex miRNA. Jeden z řetězců duplexu je degradován, druhý představuje zralou miRNA, která je začleněna do efektorového komplexu RISC (RNA-Induced Silencing Complex). Tento efektorový komplex, zahrnující miRNA, bývá označován jako miRNP (miRNA ribonucleoprotein complex) a jeho jádrem je protein Argonaut. Do komplexu RISC je integrován pouze jeden řetězec z duplexu miRNA. Který řetězec bude do komplexu RISC začleněn, je rozhodnuto na základě porovnání relativní stability obou konců duplexu – do RISC je převážně začleněn řetězec s termodynamicky labilnějším 5ękoncem. Pokud je termodynamická stabilita řetězců duplexu miRNA přibližně stejná, jsou oba řetězce začleňovány do komplexu se stejnou frekvencí (13).
Image 1. Biogeneze microRNA je zahájena transkripcí primárního transkriptu pri-miRNA pomocí RNA polymerázy II (Pol II). Protein Drosha zajišťuje úpravu pri-miRNA na prekurzor pre-miRNA. Následně je premiRNA exportována z jádra za účasti exportního receptoru Exportin-5 s kofaktorem Ran-GTP (E). V cytoplazmě pokračuje úprava pre-miRNA enzymem Dicer na duplex miRNA, z něhož je jeden řetězec degradován a druhý je využit jako zralá funkční miRNA. Ta je začleněna do komplexu RISC, který umožňuje inhibici translace cílové mRNA nebo její degradaci. Jádro komplexu RISC tvoří protein Argonaut (AGO). 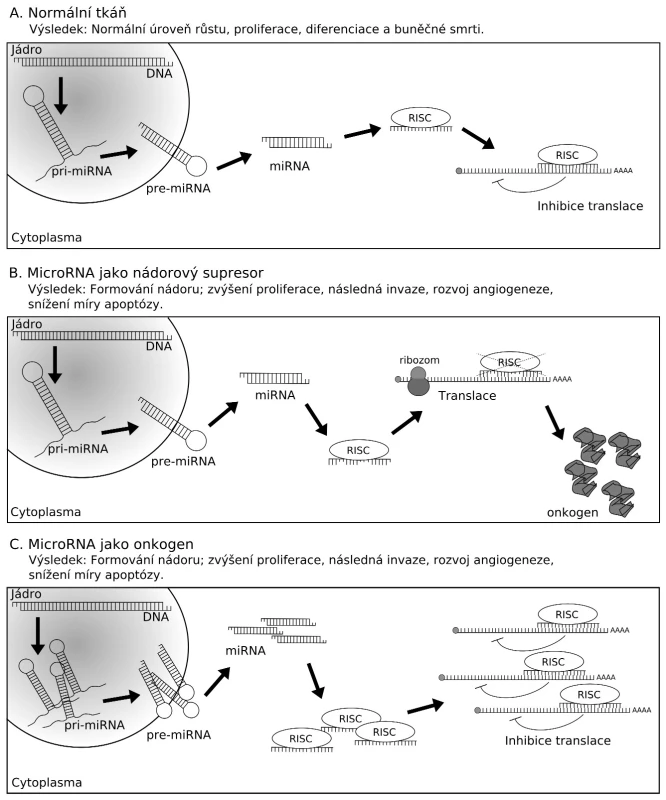
Geny kódující microRNA
Rozložení genů pro miRNA v rámci lidského genomu není náhodné. Bylo nalezeno 36 clusterů, které dohromady kódují devadesát miRNA (12). Ze srovnání s jinými organismy vyplývá, že rozložení clusterů miRNA po genomu je patrně u všech druhů obdobné. Tyto poznatky mohou sloužit pro identifikaci nových genů miRNA.
Lokalizace genů kódujících microRNA je různá. Z celkového počtu cca 750 dosud objevených lidských miRNA je asi 50 % uloženo v intronech – 40 % v intronech genů kódujících protein a desetina v intronech genů, které protein nekódují. Další desetina miRNA leží v exonech protein nekódujících genů a přibližně 5 % leží v oblastech, které podléhají alternativnímu sestřihu (14). Zbytek, tedy kolem 35 %, leží v exonech kódujících sekvencí. MiRNA v intronech jsou obvykle orientovány souhlasně s jejich hostitelskou mRNA a jsou obecně exprimovány společně s jejich hostitelským genem. MiRNA uložené v clusterech jsou typicky exprimovány současně (jako polycistronní) (15).
Experimenty využívající analýzu genové exprese v různých tkáních vedly ke zjištění, že exprese miRNA je tkáňově specifická – každá tkáň má charakteristický tzv. miRNom (celkový obsah miRNA v buňkách dané tkáně nebo v populaci buněk). K těmto analýzám jsou s výhodou využívány DNA čipy (microarrays), které umožnily stanovení tkáňově specifických profilů miRNA (16).
MicroRNA u nádorových onemocnění
Úloze miRNA při vzniku a rozvoji nádorových onemocnění je v posledních letech věnována značná pozornost. Spojitost exprese miRNA se stavem onkologických pacientů jsou sledovány jak u solidních nádorů, tak u hematologických malignit. Významná úloha miRNA u nádorů je podpořena skutečností, že asi 50 % genů kódujících miRNA je lokalizováno v místech, které často při nádorových onemocněních podléhají mutacím a zlomům (12). Také bylo prokázáno, že deletované oblasti spojované s kancerogenezí často obsahují geny pro miRNA (17).
MicroRNA v buňce zastávají řadu funkcí a mohou například působit jak v roli onkogenů, tak i nádorových supresorů (18) (obr. 2). Některé miRNA také hrají úlohu při vzniku chromozomálních aberací. Například miR-142 je spojována s translokací t(8; 17), což má za následek fúzi genů Bcl3 a c-myc a rozvoj agresivní formy akutní prolymfocytární leukemie. Narušení funkce miRNA v nádorové tkáni může být také zapříčiněno epigenetickými změnami jako je např. methylace DNA (19). Velmi zajímavá je také potenciální úloha microRNA u nádorů indukovaných virovou nákazou. Bylo prokázáno, že nejčastějším místem začlenění lidského papillomaviru 16 (HPV16) do genomu hostitelské buňky jsou geny pro miRNA. Začleňuje se tam asi třikrát častěji než do ostatních částí genomu hostitele (17).
Image 2. MicroRNA mohou fungovat jako onkogeny nebo nádorové supresory. (A) V normální tkáni napomáhá exprese miRNA udržovat optimální hladiny buněčných proteinů. Výsledkem je normální průběh buněčného cyklu, proliferace, diferenciace i apoptózy. (B) Narušení biogeneze nebo funkce miRNA fungujících jako nádorové supresory, které potlačují produkci onkoproteinů, může vést k rozvoji nádorového bujení. To může být provázeno nárůstem proliferace buněk, invazivity i angiogeneze, snížením úrovně apoptózy nebo morfologickými změnami v nádorové tkáni. (C) Amplifikace nebo nadměrná exprese onkogenních miRNA může mít také za následek rozvoj nádorového bujení. Důvodem je omezení produkce nádorových supresorů. Důsledky jsou podobné jako při snížení hladin supresorových miRNA. 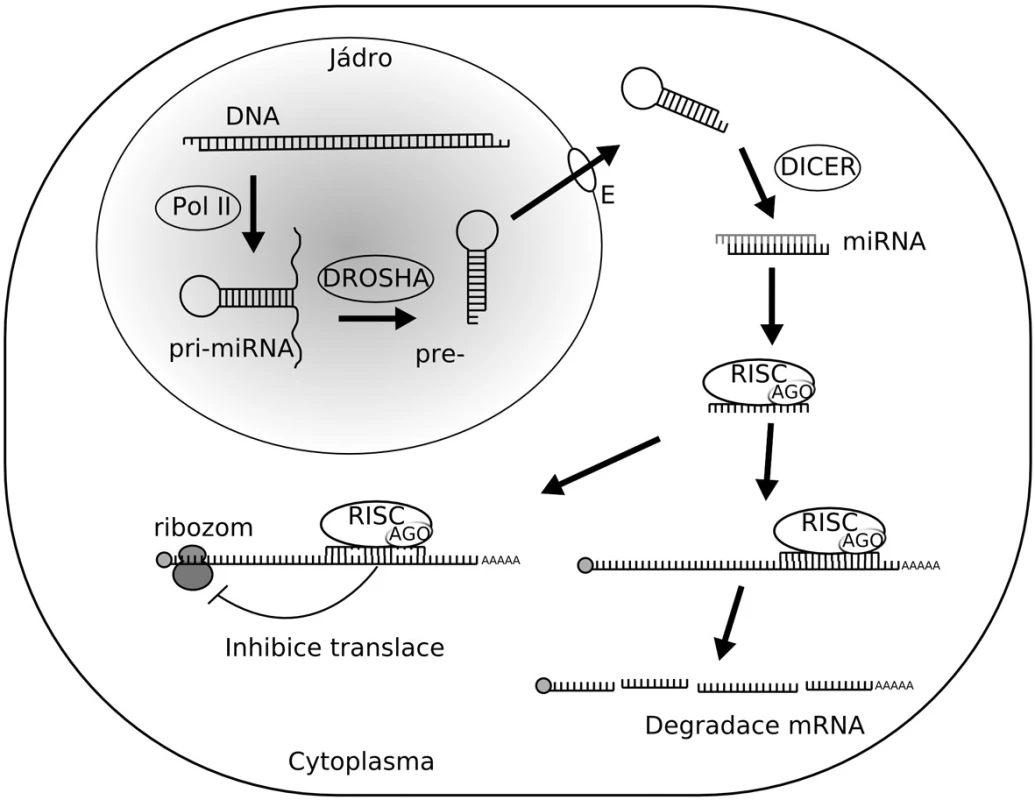
Podobně jako zdravá tkáň, má každá nádorová tkáň specifický expresní profil microRNA. Klasifikace nádorů podle exprese miRNA se jeví jako velmi užitečná, protože rozdíly v zastoupení miRNA mohou přinést obsáhlou informaci o vývojové fázi a stupni diferenciace tumorů. Sledování změn exprese miRNA tak umožňuje odhalit už velmi časná stadia rozvoje nádorového bujení (20). Současně může profilování exprese miRNA posloužit pro určení, případně zpřesnění prognózy choroby (21).
U řady typů nádorů již byly objeveny specifické miRNA, jejichž exprese se vlivem nádorového bujení výrazně mění (ve srovnání se zdravými buňkami klesá nebo narůstá). Například u glioblastomu byl detekován soubor miRNA, jejichž exprese v nádoru se významně odlišuje od exprese ve zdravé tkáni. Nejvýraznější jsou silně zvýšené hladiny miR-21 v glioblastomových buňkách. Je-li miR-21 vyřazena z funkce, dochází k aktivaci kaspáz a přechodu buněk do apoptózy. Předpokládá se tedy, že zvýšená exprese této miRNA se podílí na maligním stavu prostřednictvím blokování exprese genů nutných pro apoptózu buněk (22). Silně zvýšená exprese byla zaznamenána také u miR-221, naopak nižší exprese v glioblastomových buňkách byla nalezena u několika miRNA typických pro mozkovou tkáň (např. miR-128, a rodina miR-181)(23).
Exprese miRNA je významně změněna také u rakoviny prsu. Zvýšené hladiny byly registrovány u miR-21 a miR-155 (24), zatímco snížená exprese byla pozorována u miR-10b, miR-125b a miR-145. Gen pro miR-125b se nachází v oblasti 11q23-24, tedy v úseku velmi často deletovaném u nádorů prsu, vaječníku a plic (25). Podařilo se identifikovat také několik miRNA, které souvisí s mírou proliferace (miR-145), se stadiem nádoru (miR-21), mírou vaskularizace nebo metastázováním do mízních uzlin (miR-9-3) (24).
U rakoviny plic se setkáváme s přímou korelací exprese miRNA s prognostickými vyhlídkami pacienta. Nízká hladina exprese let-7 snižuje pravděpodobnost dlouhodobého přežití, nárůst hladiny let-7 má za následek potlačení proliferace nádorových buněk. Zvýšená exprese clusteru miR-17-92 je spojena s malobuněčným karcinomem plic (26).
Dalším často diskutovaným typem rakoviny je nádor kolorekta. Výzkumy potvrdily, že dvě miRNA, miR-143 a miR-145, vykazují nízkou expresi u žlaznatého (prekancerózního) a rakovinného stádia kolorektální neoplasie (27). To, že určitá miRNA vykazuje pozměněnou expresi již v prekancerózním stadiu, by mohlo posloužit jako potencionální diagnostický faktor. Další studium exprese miRNA u kolorektálního karcinomu potvrdilo snížené hladiny obou miRNA a odhalilo zvýšenou expresi miR-21 a miR-31. Obzvláště zvýšené hladiny miR-21 byly zaznamenány v případech s infiltrací lymfatických uzlin a rozvojem metastáz (28).
MicroRNA u hematologických malignit
Mezi prvními pracemi vůbec, které upozorňují na úlohu miRNA při nádorovém bujení, byly molekulárně biologické výzkumy B-buněčné chronické lymfocytární leukemie (B-CLL) (Tab.1). Delece v oblasti 13q14 se objevují ve více než polovině případů B-CLL, u poloviny lymfomů plášťové zóny a dále u mnohočetného myelomu (29). Oblast 13q14.3 kóduje dvě miRNA, které jsou uloženy v úseku o velikosti asi 30 kb mezi dvěma exony genu DLEU2. Delece v oblasti 13q14 je heterogenní a nové podrobné analýzy ukázaly, že rozsah delece umožňuje rozlišit B-CLL na subtypy s různými klinickými projevy (30). Pomocí experimentálních metod založených na analýze genové exprese expresními čipy se ukázalo, že snížená exprese miR-15a se vyskytuje v 25 % případů u a miR-16-1 u 45 % případů B-CLL (31). Ačkoliv se v chromozomální oblasti 3q25-26.1 vyskytuje cluster obsahující obdobné miRNA, snížení exprese se týká miRNA kódovanými na chromozomu 13. Podařilo se už také identifikovat jeden z cílů obou miRNA. Jedná se o gen BCL2, který je oběma miRNA negativně regulován na post-transkripční úrovni. Výzkumy vedou k závěru, že represe BCL2 těmito miRNA indukuje apoptózu buněk (32). Nízká exprese miR-15a a miR-16-1 byla zaznamenána také u některých jiných druhů nádorů (např. u rakoviny prostaty).
Table 1. MicroRNA se změněnou expresí ve srovnání se zdravými kontrolami u vybraných hematoonkologických diagnóz. 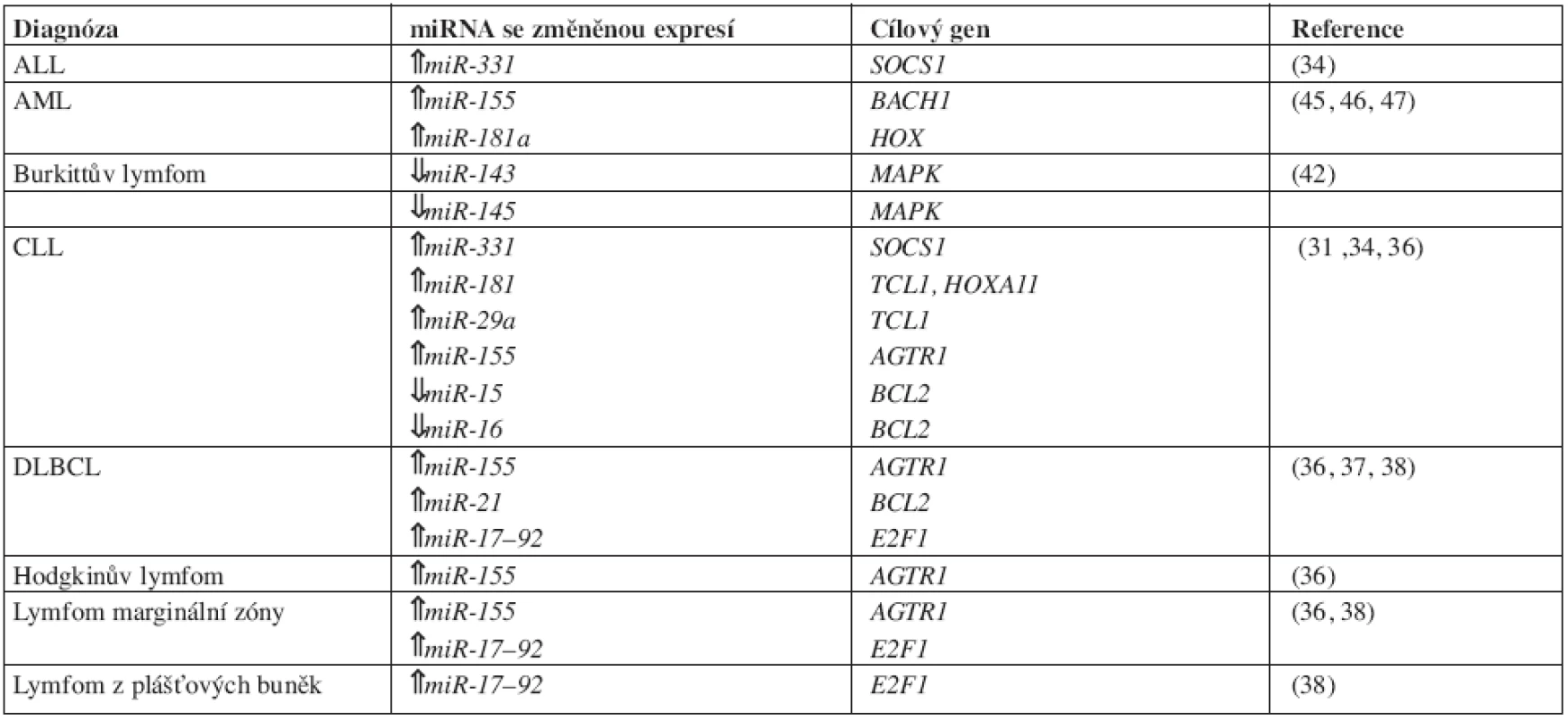
Kromě změn exprese byly v miR-15a a miR-16-1 identifikovány také sekvenční abnormality. Sledování mutací a jednonukleotidových polymorfismů (SNP) v miRNA vedlo k závěru, že tyto změny mohou být z části příčinou dědičné predispozice k rozvoji B-CLL (21). Dědičné změny v expresi a sekvenci mnoha dalších miRNA by tak mohly ovlivnit hladiny exprese u většího počtu tumor supresorových genů a onkogenů. Takové zjištění podporuje „kaskádový“ model, podle kterého je rozvoj nádorového bujení zapříčiněn komplexními změnami v expresi jak určitých proteinů, tak miRNA.
Kromě zmíněných podrobných analýz miR-15a a miR-16-1 bylo publikováno několik prací, které se zabývaly korelací změn microRNA s ostatními prognostickými faktory. Bylo například popsáno, že exprese 13 miRNA společně s hladinou exprese ZAP-70 a mutačním statusem IgVHumožňuje rozlišit pacienty s dobrou, resp. špatnou prognózou. Pomocí těchto markerů by mělo být možné také určit, jak dlouhý bude interval od stanovení diagnózy do začátku léčby (21). Mezi odlišně exprimované miRNA u pacientů s B-CLL dále patří miRNA lokalizované v oblastech často postižených strukturními aberacemi. V některých clusterech jsou chybně regulovány všechny obsažené miRNA, v jiných případech jsou špatně regulovány pouze některé miR geny (např. u clusteru miR-17-92 uloženém v oblasti 13q31) (31).
Dosud není podrobně prostudována souvislost hladin miRNA s funkčním stavem proteinu p53, který patří mezi nejvýznamnější prognostické markery u CLL i řady dalších malignit. Aktuální výsledky ukazují, že u pacientů s mutací či delecí v genu TP53 – tedy skupiny se špatnou prognózou – je významně snížena exprese miR-34a, která reguluje expresi BCL2. Tento fakt poukazuje na potenciální význam této miRNA v patogenezi sledovaného subtypu B-CLL (33).
V současnosti se také objevují studie, které poukazují na odlišnou expresi velkého počtu miRNA u B-CLL ve srovnání se zdravými lymfocyty. U akutní lymfocytární leukemie již byly také získány obdobné expresní profily miRNA. V tomto směru zajímavou je miR-331, která ovlivňuje expresi genu SOCS1, zapojeného do procesů proliferace a buněčného přežívání (34).
Řada změn exprese microRNA byla detekována také u lymfomů. V nádorové tkáni i lymfomových buněčných liniích byl prokázán velký nárůst exprese miR-155 (odvozené z BIC RNA – tj. sekvence nekódující protein s otevřeným čtecím rámcem, která nese informaci pro miR-155). Přestože je miR-155 považována za onkogen, její přítomnost v buňce je nezbytná pro rozvinutí optimální imunitní odpovědi buňky. Podílí se na regulaci produkce cytokinů, účastní se kontroly diferenciace Th buněk a je nezbytná pro funkci B a T lymfocytů i dendritických buněk (35). Na druhou stranu se předpokládá, že miR-155 indukuje polyklonální expanzi, která umožňuje vznik sekundárních genetických změn nezbytných pro maligní transformaci. Zvýšená exprese miR-155 byla nalezena u difuzního velkobuněčného buněčného lymfomu (DLBCL), lymfomu marginální zóny a u dalších typů B-buněčných lymfoproliferací včetně B-CLL, ale také u Hodgkinova lymfomu. Bylo ukázáno, že hladiny miR-155 i BIC RNA by mohly být vhodným nástrojem pro klasifikaci subtypů DLBCL a stanovování prognózy (36). Novým důležitým poznatkem je, že lze izolovat volné microRNA z krevního séra, což zvyšuje jejich dostupnost jako diagnostického markeru. Tyto výsledky byly získány u pacientů s DLBCL, u nichž byly zjištěny zvýšené hladiny miR-155, miR-210 a miR-21 v séru oproti zdravým kontrolám. Navíc se ukázalo, že zvýšené množství miR-21 v séru koreluje s lepší prognózou pacientů (37).
Často diskutovanými miRNA, jejichž pozměněná exprese souvisí s B-buněčnými lymfomy (a nádorovým bujením obecně), jsou miRNA lokalizované v clusteru miR-17-92 (13q31.3). Tento cluster obsahuje sedm miRNA, k nimž patří miR-17-5p, miR-17-3p, miR-18, miR-19a, miR-20, miR-19b1 a miR-92-1. Jeho abnormální exprese bývá spojována s DLBCL, folikulárním lymfomem, lymfomem plášťové zóny, primárním kožním B-buněčným lymfomem i jinými typy nádorů (38). Exprese miRNA z tohoto clusteru jsou ovlivňovány expresí c-myc, který se váže přímo k jeho genomickému lokusu a v důsledku vazby dochází k aktivaci exprese clusteru. c-myc ale ovlivňuje také expresi transkripčního faktoru E2F1, který podporuje postup buněčného cyklu. E2F1 je však negativně regulován dvěmi miRNA z clusteru. Tento mechanismus umožňuje jemně kontrolovat signály k proliferaci buňky (39).Nedávno bylo prokázáno, že promotor clusteru miR-17-92 obsahuje vazebná místa pro dva transkripční faktory E2F1 a E2F3. Zatímco první zmíněný má pro-apoptotickou funkci, druhý je antiapoptotický. Předpokládá se proto, že rozvoj proliferace tumorů může být částečně zapříčiněn posunutím rovnováhy ve vazbě E2F faktorů (40).
Přestože význam miR-16-1 byl nejprve odhalen u chronické lymfocytární leukemie, další studie přinášejí nové informace o její roli také u ostatních tumorů. Z výzkumů je patrné, že miR-16-1 ovlivňuje nejen antiapoptotický protein bcl2, ale i řadu dalších proteinů včetně Cyklinu D1. U lymfomu plášťové zóny (MCL) byla popsána souvislost zkráceného Cyklinu D1 se špatnou prognózou pacientů. Protein hraje úlohu v regulaci buněčného cyklu a jeho exprese je výrazně zvýšena u řady malignit včetně MCL. Detekovaná zkrácená mRNA Cyklinu D1 znemožňuje vazbu miR-16-1 a tím down-regulaci jeho exprese, což přispívá k vysoké hladině proteinu (41).
Stejně jako u B-CLL se u Burkittova lymfomu (BL) objevuje snížená exprese miR-143 a miR-145. Po vnesení prekurzorů obou miRNA do buněčné linie BL vykazující jejich nízkou expresi a zároveň zvýšenou proliferaci, byla pozorována výrazná inhibice růstu buněk závislá na množství vnesených prekurzorů. miR-143 a miR-145 tedy negativně ovlivňují buněčný růst ovlivněním exprese genů potřebných pro růst buňky (42). Na rozdíl od jiných lymfomů, u Burkittova lymfomu nebyly zaznamenány zvýšené hladiny miR-155, i když hladiny jeho hostitelské BIC RNA byly zvýšeny. Příčinou této skutečnosti je nejspíše regulace prekurzoru miR-155Protein kinázou C a jaderným faktorem NF-κB (43).
Výzkumy, které by sledovaly expresi miRNA v myeloidních typech leukemie, zatím nejsou tak rozsáhlé jako v oblasti lymfatických leukemií a lymfomů. Přesto se už objevilo několik prací, které se právě touto problematikou zabývají. U chronické myeloidní leukemie bylo zjištěno, že exprese clusteru miR-17-92 je indukována onkogeny BCR-ABL a c-MYC. Zvýšené hladiny miRNA tohoto clusteru byly zaznamenány u případů v chronické fázi, ale nikoliv v blastické krizi (44).
V případech akutní myeloidní leukemie s normálním karyotypem byla prokázána korelace mezi expresí miR-181a a morfologickými subtypy onemocnění (podle FAB klasifikace). Zvýšená exprese miR-181a byla detekována u AML subtypů M1 a M2, u nichž byl také identifikován soubor diferenciálně exprimovaných genů regulovaných touto microRNA (45). Snížené hladiny miR-181a byly naopak zaznamenány v případech AML s multilineární dysplazií, která pro pacienty představuje horší prognózu onemocnění (46). U AML subtypů M4 a M5 byla pozorována zvýšená exprese miR-155 v kostní dřeni. Ukazuje se tak, že její narušená exprese souvisí s rozvojem hematologických malignit lymfoidní i myeloidní řady (47). Exprese miR-155 je zvýšena také v nádorových buňkách s mutací FLT3-ITD. Při sledování pacientů se změnami v karyotypu byly nalezeny sady miRNA, jejichž exprese byla charakteristická pro jednotlivé skupiny s určitou aberací. Exprese miRNA tak může sloužit k podrobnější klasifikaci pacientů s AML a může napomoci k pochopení etiologie tohoto onemocnění (46).
V nedávné době se objevila také práce, která se zabývá studiem exprese miRNA u Polycytemia Vera. Popisuje pozměněnou expresi určitých miRNA v buňkách myeloidní řady u pacientů oproti zdravým kontrolám (48).
Moderní metody studia microRNA
Studium miRNA je komplikováno především čtyřmi faktory. Patří k nim délka miRNA, která se pohybuje kolem 20 nukleotidů. Ztěžuje nejen jejich izolaci, ale také další analýzu. miRNA nelze amplifikovat jako běžnou mRNA, protože jsou příliš krátké pro zpětnou transkripci, vyžadující nasednutí primeru. Dalším faktorem, který znesnadňuje jejich hybridizaci, je široké rozmezí teplot tání Tm jejich heteroduplexů s komplementárními řetězci DNA. Na třetím místě je třeba uvést, že jejich podíl v celkové buněčné RNA se pohybuje kolem 0,01 %, což opět přináší komplikace při jejich izolaci. Některé miRNA se navíc vzájemně odlišují pouze o jeden nukleotid.
Přesto byla vyvinuta řada metod, které zmíněné překážky překonaly. Jedná se hlavně o kvantitativní PCR v reálném čase, detekci hybridizace miRNA na nosných kuličkách (technologie Luminex) a analýzu miRNA na čipech (microarrays). Všechny dosud objevené miRNA včetně anotací jsou shromážděny v několika internetových databázích – např. miRBase (on-line přístup http://www.sanger.ac.uk/ Software/Rfam/mirna). Databáze poskytují nejen informaci o jejich sekvenci, ale umožňují na základě výpočetního algoritmu (např. miRanda nebo TargetScan) také předpověď cílových genů konkrétních miRNA (http://www.microrna.org nebo http://www.targets-can.org). Tyto poznatky podstatně rozšiřují možnosti analýzy exprese miRNA.
Kvantitativní PCR v reálném čase
V oblasti kvantitativní PCR v reálném čase (RQ-RT-PCR) byly vyvinuty metody, které jsou schopné kvantifikovat jak zralé miRNA, což je ztíženo jejich délkou, tak i prekurzory miRNA, což zase komplikuje jejich sekundární struktura. Ve většině případů se však dává přednost analýze exprese zralých miRNA. Na druhou stranu jsou prekurzory miRNA detekovatelné tehdy, když jsou hladiny odpovídajících zralých miRNA příliš nízké pro jejich zachycení (49). Celá analýza zahrnuje reverzní transkripci, po které následuje vlastní kvantitativní PCR. Aby mohly být do cDNA přepsány zralé miRNA, využívají se primery se smyčkou. K buzení fluorescenčního signálu během qPCR, který poskytuje informaci o množství sledovaných miRNA, je nejčastěji využívána technologie TaqMan sond. Fluorescence je emitována poté, co TaqMan sonda hybridizuje k odpovídající sekvenci cDNA. Jiná technologie přepisuje templát miRNA do cDNA genově specifickým primerem, který obsahuje přídatnou sekvenci. Vzniklá chiméra primeru s cDNA je následně využívána v kvantitativní PCR. V prvním cyklu je chiméra přepsána LNA (Locked Nucleic Acid) reverzním primerem, komplementárním k cDNA. V dalších cyklech je DNA amplifikována univerzálním primerem, komplementárním k přídatné sekvenci původního primeru. Průběh reakce je provázen fluorescencí SYBR green.
Detekce microRNA pomocí hybridizace na nosných kuličkách (Luminex)
Další metodou pro analýzu hladin exprese miRNA je detekce hybridizace na mikročásticích. Nejrozšířenější technologií je Luminex, která využívá polystyrenové mikrokuličky, pokryté oligonukleotidovými sondami, připojenými přes karboxylové skupiny. Navíc jsou mikrokuličky značeny dvěma fluorescenčními značkami, jejichž vlnová délka emitovaného záření je 635 nm, resp. 532 nm. Vhodnou kombinací těchto fluorescenčních značek lze dosáhnout jedinečné „spektrální adresy“, která mikrokuličku nesoucí určitou sondu identifikuje při analýze. V jediné reakci bývá směs takto označených mikrokuliček. Jsou schopny detekovat přítomnost až stovek molekul miRNA právě podle jejich spektrální příslušnosti (50).
Postup pro analýzu exprese miRNA zahrnuje tyto kroky: amplifikace miRNA polymerázovou řetězovou reakcí, využívající biotinylovaný primer, následuje hybridizace produktů PCR k sondám na povrchu mikrokuliček a nakonec obarvení mikrokuliček streptavidinem-fykoerytrinem (20). Mikrokuličky jsou pak v proudu nosné kapaliny jednotlivě hnány detektorem a na základě získaného signálu je lze podle jejich spektrální příslušnosti roztřídit a kvantifikovat reakci, která proběhla na jejich povrchu. Intenzita záření produkovaná fykoerytrinem navíc poskytuje informaci o množství navázané miRNA (50). Způsobem provedení analýzy se jedná v podstatě o analogii k průtokové cytometrii.
DNA čipy („miR-arrays“)
Rozšířenou metodou pro analýzu exprese miRNA jsou čipy (microarrays). Čipy umožňují hybridizaci miRNA ke stovkám oligonukleotidových sond současně. Jsou tvořeny skleněným nebo křemíkovým podkladem, na který jsou naneseny předem syntetizované sondy, nebo se sondy syntetizují přímo na podkladu fotochemicky.
MiRNA jsou vhodným způsobem obarveny a následně hybridizovány k sondám na čipu. Jako sondy slouží fragmenty cDNA či syntetické oligonukleotidy. Jsou navrhovány tak, aby byly schopny rozlišit jednotlivé zralé miRNA, které se mohou odlišovat jen o jeden nukleotid, a zralé miRNA od jejich prekurzorů. Analýza exprese miRNA na čipech (microarrays) zahrnuje postupy označení miRNA, hybridizace miRNA k sondám natištěným na čipu a analýzu získaných obrazových dat pomocí vhodného softwaru. Obecně jsou protokoly pro analýzu exprese miRNA oproti procedurám pro jiné expresní čipy (např. celogenomové) jednodušší, protože nezahrnují kroky pro přepisování vzorku RNA do cDNA a následně do cRNA.
Důležitým požadavkem je, aby všechny duplexy miRNA se sondami měly teplotu tání Tm přibližně stejnou. Tento problém byl překonán přípravou LNA oligonukleotidů (Locked Nucleic Acid). Jedná se o nukleové kyseliny, jejichž ribózový kruh je „uzamčen“ methylenovým můstkem mezi atomy 2ę-O a 4ę-C. V LNA jsou obsaženy všechny báze, které se obvykle vyskytují v nukleových kyselinách, čímž je zajištěno párování s komplementárními řetězci nukleových kyselin. Volbou vhodného uspořádání bází a délky sekvence lze navíc dosáhnout normalizované, takže komplementární miRNA hybridizují k LNA sondám v úzkém teplotním intervalu (51).
Závěr
Přestože nové poznatky o vztahu nádorových onemocnění s hladinami microRNA zatím plně nepronikly do klinické praxe, mají do budoucna velký význam v oblastech diagnostiky i stanovení prognózy pacientů. U B-CLL se už podařilo určit konkrétní microRNA, které jsou asociovány s mutovaným, resp. nemutovaným statusem genu pro IgVH, s hladinami tyrosinkinázy ZAP-70, antionkogenu p53 a dalšími aberantně produkovanými buněčnými faktory. Také u ostatních malignit výzkumy potvrzují rozsáhlé souvislosti exprese microRNA s průběhem onemocnění. Lze očekávat, že další podrobné studium microRNA přinese důležité informace o mechanismech, které ovlivňují vznik a rozvoj onemocnění, a významně přispěje k lepšímu pochopení jejich biologické podstaty.
SEZNAM ZKRATEK
bcl2 – antiapoptotický protein B-Cell CLL/Lymphoma 2
c-myc – myelocytomatosis oncogene
IgVH – variabilní oblast genu pro těžký řetězec imunoglobulinů
DLEU2 – Deleted in lymphocytic LEUkemia, 2
FLT3-ITD – FMS-related Tyrosine kinase 3 s interní tandemovou duplikací
miRNA – microRNA
piRNA – Piwi-Interacting RNA
PTGS – Post-Transcriptional Gene Silencing
RNAi – RNA interference
siRNA – small interfering RNA
ZAP-70 – Zeta chain Associated Protein 70 kDa
Poděkování: Práce byla podpořena grantem IGA MZ ČR NR9293-3/2007.
*Autorky se podílely na přípravě publikace stejným dílem.
RNDr. Šárka Pospíšilová, Ph.D.
Centrum molekulární biologie a genové terapie
Interní hematoonkologická klinika
LF MU a FN Brno,
Černopolní 9,
625 00 Brno
e-mail: sarka.pospisilova@fnbrno.cz
Doručeno do redakce: 26. 9. 2008
Přijato: 29. 10. 2008
Sources
1. Lee RC, Ambros V. An extensive class of small RNAs in Caenorhabditis elegans. Science 2001; 294 : 862–864.
2. Lau NC, Lim LP, Weinstein EG, Bartel DP. An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans. Science 2001; 294 : 858–862.
3. Lagos-Quintana M, Rauhut R, Lendeckel W, Tuschl T. Identification of novel genes coding for small expressed RNAs. Science 2001; 294 : 853–858.
4. Chen CZ, Li L, Lodish HF, Bartel DP. MicroRNAs modulate hematopoietic lineage differentiation. Science 2004; 303 : 83–86.
5. Ambros V. MicroRNA pathways in flies and worms: growth, death, fat, stress, and timing, Cell 2003; 113 : 673–676.
6. Aukerman MJ, Sakai H. Regulation of flowering time and floral organ identity by a microRNA and its APETALA2-like target genes. Plant Cell 2003; 15 : 2730–2741.
7. Lewis BP, Burge CB, Bartel DP. Conserved seed pairing, often flanked by adenosines, indicates that thousands of human genes are microRNA targets. Cell 2005; 120 : 15–20.
8. Sullivan CS, Ganem D. MicroRNAs and viral infection. Mol Cell 2005; 20 : 3–7.
9. Mak J. RNA interference: more than a research tool in the vertebrates’ adaptive immunity. Retrovirology 2005; 2 : 35–38.
10. Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature 1998; 391 : 806–811.
11. Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14. Cell 1993; 75 : 843–854.
12. Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function. Cell 2004; 116 : 281–297.
13. Schwarz DS, Hutvagner G, Du T, Xu Z, Aronin N, Zamore PD. Asymmetry in the assembly of the RNAi enzyme complex. Cell 2003; 115 : 199–208.
14. Rodriguez A, Griffiths-Jones S, Ashurst JL, Bradley A. Identification of mammalian microRNA host genes and transcription units. Genome Res 2004; 14 : 1902–1910.
15. Baskerville S, Bartel DP. Microarray profiling of microRNAs reveals frequent coexpression with neighboring miRNAs and host genes. RNA 2005; 11 : 241–247.
16. Liu CG, Calin GA, Meloon B, et al. An oligonucleotide microchip for genomewide microRNA profiling in human and mouse tissues. Proc Natl Acad Sci USA 2004; 101 : 9740–9744.
17. Calin GA, Sevignani C, Dumitru CD, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers. Proc Natl Acad Sci USA 2004; 101 : 2999–3004.
18. Zhang B, Pan X, Cobb GP, Anderson TA. microRNAs as oncogenes and tumor suppressors. Dev Biol 2007; 302 : 1–12.
19. Lehmann U, Hasemeier B, Christgen M, et al. Epigenetic inactivation of microRNA gene hsa-mir-9-1 in human breast cancer. J Pathol 2008; 214 : 17–24.
20. Lu J, Getz G, Miska EA, et al. MicroRNA expression profiles classify human cancers. Nature 2005; 435 : 834–838.
21. Calin GA, Ferracin M, Cimmino A, et al. A MicroRNA signature associated with prognosis and progression in chronic lymphocytic leukemia. N Engl J Med 2005; 353 : 1793–1801.
22. Chan JA, Krichevsky AM, Kosik KS. MicroRNA-21 Is an Antiapoptotic Factor in Human Glioblastoma Cells. Cancer Res 2005; 65 : 6029–6033.
23. Ciafre SA, Galardi S, Mangiola A, et al. Extensive modulation of a set of microRNAs in primary glioblastoma. Biochem Biophys Res Commun 2005; 334 : 1351–1358.
24. Iorio MV, Ferracin M, Liu CG, et al. MicroRNA gene expression deregulation in human breast cancer. Cancer Res 2005; 65 : 7065–7070.
25. Negrini M, Rasio D, Hampton GM, et al. Definition and refinement of chromosome 11 regions of loss of heterozygosity in breast cancer: identification of a new region at 11q23.3. Cancer Res 1995; 55 : 3003–3007.
26. Hayashita Y, Osada H, Tatematsu Y, et al. A polycistronic microRNA cluster, miR-17–92, is overexpressed in human lung cancers and enhances cell proliferation. Cancer Res 2005; 65 : 9628–9632.
27. Michael MZ, O’Connor SM, Pellekaan NGV, Young GP, James RJ. Reduced accumulation of specific microRNAs in colorectal neoplasia. Mol Cancer Res 2003; 1 : 882–891.
28. Slaby O, Svoboda M, Fabian P, et al. Altered Expression of miR-21, miR-31, miR-143 and miR-145 Is Related to Clinicopathologic Features of Colorectal Cancer. Oncology 2007; 72 : 397–402.
29. Stilgenbauer S, Nickolenko J, Wilhelm J, et al. Expressed sequences as candidates for a novel tumor suppressor gene at band 13q14 in B-cell chronic lymphocytic leukemia and mantle cell lymphoma. Oncogene 1998; 6 : 1891–1897.
30. Ouillette P, Erba H, Kujawski L, Kaminski M, Shedden K, Malek SN. Integrated genomic profiling of chronic lymphocytic leukemia identifies subtypes of deletion 13q14. Cancer Res 2008; 68 : 1012–1021.
31. Calin GA, Liu CG, Sevignani C, et al. MicroRNA profiling reveals distinct signatures in B cell chronic lymphocytic leukemias. Proc Natl Acad Sci USA 2004; 101 : 11755–11760.
32. Calin GA, Cimmino A, Fabbri M, et al. MiR-15a and miR-16-1 cluster functions in human leukemia. Proc Natl Acad Sci USA 2008; 105 : 5166–5171.
33. Mraz M, Kotaskova J, Tichy B, et al. MicroRNA-34a is significantly down-regulated in B-CLL patients with p53 abnormalities. Haematologica 2008; 93 : 213.
34. Zanette DL, Rivadavia F, Molfetta GA, Barbuzano FG, Proto-Siqueira R, Silva-Jr WA: miRNA expression profiles in chronic lymphocytic and acute lymphocytic leukemia. Braz J Med Biol Res 2007, 40 : 1435–1440.
35. Rodriguez A, Vigorito E, Clare S, et al. Requirement of bic/microRNA-155 for normal immune function. Science 2007; 316 : 608–611.
36. Eis PS, Tam W, Sun LP, et al. Accumulation of miR-155 and BIC RNA in human B cell lymphomas. Proc Natl Acad Sci USA 2005; 102 : 3627–3632.
37. Lawrie CH, Gal S, Dunlop HM, et al. Detection of elevated levels of tumour-associated microRNAs in serum of patients with diffuse large B-cell lymphoma. Br J Haematol 2008; 141 : 672–675.
38. Ota A, Tagawa H, Karnan S, et al. Identification and characterization of a novel gene, C13orf25, as a target for 13q31-q32 amplification in malignant lymphoma. Cancer Res 2004; 64 : 3087–3095.
39. O’Donnell KA, Wentzel EA, Zeller KI, Dang CV, Mendell JT: c-Myc-regulated microRNAs modulate E2F1 expression. Nature 2005; 435 : 839–843.
40. Woods K, Thomson JM, Hammond SM. Direct Regulation of an Oncogenic Micro-RNA Cluster by E2F Transcription Factors. J Biol Chem 2007; 282 : 2130–2134.
41. Chen RW, Bemis LT, Amato CM, et al. Truncation in CCND1 mRNA alters miR-16-1 regulation in mantle cell lymphoma. Blood 2008; 112 : 822–829.
42. Akao Y, Nakagawa Y, Kitade Y, Kinoshita T, Naoe T. Downregulation of microRNAs-143 and -145 in B-cell malignancies. Cancer Sci 2007; 98 : 1914–1920.
43. Kluiver J, van den Berg A, de Jong D, et al. Regulation of pri-microRNA BIC transcription and processing in Burkitt lymphoma. Oncogene 2007; 26 : 3769–3776.
44. Venturini L, Battmer K, Castoldi M, et al. Expression of the miR-17-92 polycistron in chronic myeloid leukemia (CML) CD34+ cells. Blood 2007; 109 : 4399–4405.
45. Debernardi S, Skoulakis S, Molloy G, Chaplin T, Dixon-McIver A, Young BD. MicroRNA miR-181a correlates with morphological sub-class of acute myeloid leukaemia and the expression of its target genes in global genome-wide analysis. Leukemia 2007; 21 : 912–916.
46. Garzon R, Volinia S, Liu Ch-G, et al. MicroRNA signatures associated with cytogenetics and prognosis in acute myeloid leukemia. Blood 2008; 111 : 3183–3189.
47. O’Connell RM, Rao SR, Chaudhuri AA, et al. Sustained expression of microRNA-155 in hematopoietic stem cells causes a myeloproliferative disorder. J Exp Med 2008; 205 : 585–594.
48. Bruchova H, Merkerova M, Prchal JT. Aberrant expression of microRNA in polycythemia vera. Haematologica 2008; 93 : 1009–1016.
49. Schmittgen TD, Lee EJ, Jiang J, et al. Real-time PCR quantification of precursor and mature microRNA. Methods 2008; 44 : 31–38.
50. Dunbar SA. Applications of Luminex xMAP technology for rapid, high-throughput multiplexed nucleic acid detection. Clin Chim Acta 2006; 363 : 71–82.
51. Castoldi M, Schmidt S, Benes V, et al. A sensitive array for microRNA expression profiling (miChip) based on locked nucleic acids (LNA). RNA 2006; 12 : 913–920.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2008 Issue 4-
All articles in this issue
- Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
- Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
- Druhá celostátní léčebná studie AML-BFM 98 zvýšila úspěšnost v dosažení remise a zlepšila celkové přežití dětí s akutní myeloidní leukemií v České republice
- Vyhledávání příbuzenského dárce krvetvorných buněk – koordinace procesu a výsledky jednoho centra
- MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
- DNA mikročipy (microarrays) v diagnostice folikulárního lymfomu: cesta k terapii „šité na míru“ nebo slepá ulička?
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- MicroRNA – malé molekuly s velkým významem (nejen) u hematologických malignit
- Imatinib v první linii léčby nemocných s nově diagnostikovanou chronickou myeloidní leukemií v chronické fázi
- Erytrocyty z aferézy – zhodnocení markerů apoptózy u přípravku ze dvou separátorů
- Druhá celostátní léčebná studie AML-BFM 98 zvýšila úspěšnost v dosažení remise a zlepšila celkové přežití dětí s akutní myeloidní leukemií v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

