-
Medical journals
- Career
Biologická léčba karcinomu prsu
Authors: Josef Chovanec 1; Z. Dostálová 2
Authors‘ workplace: Oddělení gynekologické onkologie, Masarykův onkologický ústav, Brno 1; Gynekologicko-porodnická klinika FN Brno 2
Published in: Prakt Gyn 2009; 13(4): 228-231
Overview
Karcinom prsu je nejčastější nádorové onemocnění žen. V posledních letech bylo objeveno mnoho nových různých inhibitorů kancerogeneze, souhrnně označovaných termínem cílená léčba. Jde o druh terapie, která pomocí monoklonálních protilátek nebo jiných částic vyhledává a napadá nádorové buňky. Obzvlášť slibnými prostředky cílené léčby se jeví monoklonální protilátky a inhibitory tyrosinkináz. Velkého pokroku v cílené léčbě karcinomu prsu bylo dosaženo použitím trastuzumabu, lapatinibu a bevacizumabu. V současnosti je cílená biologická léčba jednou z hlavních priorit protinádorového výzkumu.
Klíčová slova:
karcinom prsu – cílená léčba – inhibitory tyrosinkináz – monoklonální protilátkyÚvod
Karcinom prsu zařazujeme mezi „civilizační choroby“, jde však o onemocnění, které lidstvo doprovází po tisíciletí. První zmínky o této chorobě pochází již z doby starověkého Egypta [1]. Tato nemoc si mezi jinými zhoubnými nádory zaslouží výraznější pozornost ze dvou důvodů. Je nejčastějším zhoubným nádorem žen se stále rostoucí incidencí [2]. V současné době průměrně u jedné z devíti žen bude v průběhu jejího života diagnostikován karcinom prsu a jedna žena ze třiceti na tuto chorobu zemře. Proto karcinom prsu zařazujeme mezi tzv. civilizační choroby.
Druhý důvod spočívá v jeho výrazné heterogenitě a multifaktoriální etiologii, což vede k nevyzpytatelnému biologickému chování. Karcinom prsu je totiž na rozdíl od jiných nádorů schopen recidivovat i po dlouholetém období remise.
Léčebná strategie je určována dle klinického stadia nemoci a dle prognostických faktorů. Mezi obligátní prognostické faktory, které napovídají o možném vývoji karcinomu prsu patří:
- stav axilárních uzlin
- velikost tumoru
- histologický typ tumoru
- stupeň diferenciace tumoru
- hodnoty proliferačních indexů (mitotický index)
- stav hormonálních receptorů
- amplifikace nebo overexprese HER 2.
Bohužel, žádný z těchto faktorů nemůže naprosto přesně vyčlenit skupiny pacientek, které budou léčeny buď lokoregionální léčbou či terapií systémovou; rovněž nemůže určit skupinu, která je předurčena k fatálnímu konci bez ohledu na jakoukoliv léčebnou intervenci. Během posledních desetiletí došlo k výraznému posunu v léčbě karcinomu mammy [3]. Jedná se o několik na sobě nezávislých faktorů:
- změny v chápání biologického chování karcinomu prsu
- technicky dokonalejší přístroje detekují tumor již v jeho časných stadiích
- prohlubující se mezioborová spolupráce
- rostoucí důraz na systémovou léčbu
- rozvoj molekulární biologie
V léčbě tohoto zhoubného onemocnění se používají všechny léčebné modality typické pro nádorová onemocnění, tj. chirurgický výkon, radioterapie (léčba lokoregionální), dále chemoterapie a hormonoterapie (léčba systémová). V posledních letech byly do léčebných standardů karcinomu prsu zapracovány i metody cílené molekulární biologické léčby [4].
Graph 1. Incidence karcinomu prsu v České republice v posledních třech desetiletích. 
Cílená biologická léčba
Jednou z hlavních charakteristik maligní buňky je její schopnost autonomní proliferace, která se vymkla kontrole. To je způsobeno mutací genotypu, což se projeví změnami regulace signálních mechanizmů odpovídajících za proliferaci a přežívání buněk. Současný výzkum se posunul na molekulární a intramolekulární úroveň a jeho cílem je identifikovat zásadní nitrobuněčné procesy, které způsobují maligní vývoj dříve normálních buněk. Přesné popsání těchto procesů umožní najít cílové struktury, a ty pak terapeuticky ovlivnit. To je princip cílené (terčové) biologické léčby.
Table 1. Principy cílené bioregulační léčby 
Tím se tato léčba výrazně odlišuje od jiné, necílené systémové léčby, chemoterapie. Přínos nově vyvinuté biologické léčby spočívá v tom, že jsou selektivně napadány tumorózní buňky, zatímco zdravé buňky jsou ušetřeny. Rozdíl je tedy v mechanizmu účinku a samozřejmě i v profilu toxicity. Právě tím jsou výrazně redukovány vedlejší nežádoucí účinky léčby.
Rozvoj cílené molekulární léčby navazuje na zhruba dvě desetiletí intenzivní vědecké práce zabývající se výzkumem molekulárních mechanizmů nádorových buněk – jedná se především o inhibici růstových faktorů, inhibici membránových a cytoplazmatických receptorů, inhibici transdukční kaskády, zablokování angiogeneze nádorových buněk, modulaci apoptózy a potlačení mechanizmů týkajících se zakládání vzdálených metastáz [5]. V klinické praxi se již standardně využívá preparátů na bázi nízkomolekulárních látek, jež blokují tyrosinkinázy, a dále účinku monoklonálních protilátek.
Téměř u 20 % karcinomů prsu lze prokázat overexpresi HER 2 proteinu či amplifikaci HER 2 genu [6]. Význam tohoto genu spočívající v ovlivnění růstu a diferenciaci buňky mléčné žlázy byl objeven v osmdesátých letech minulého století. Lidský genom obsahuje několik set kinázových genů, které ovlivňují produkci tyrosinkináz. Tyto se dělí na receptorové a nereceptorové. Receptory HER (HER 1, HER 2, HER 3 a HER 4) náleží k tyrokinázovým receptorům. Jedná se o transmembránové proteiny ze skupiny EGFR (receptory pro epidermální růstové faktory). Receptory mají část extracelulární (zde se váže ligand) a část intracelulární, která disponuje tyrosinkinázovou aktivitou. Vlivem vazby s ligandem dojde k dimerizaci receptoru a následnou nitrobuněčnou fosforylací je spuštěna signální soustava, jež spustí negativní proces vedoucí k maligní transformaci buňky. Klinicky se tento proces projeví horší prognózou pro pacientku – agresivní chování nádoru, vyšší metastatický potenciál a zhoršená odpověď na chemoterapii. V současné době je nutné u každé pacientky stanovit expresi tohoto receptoru, stejně jako je již standardně prováděno vyšetření pozitivity estrogenních a progesteronových receptorů. Vyšetření může být provedeno imunohistochemicky, kdy jako pozitivní je akceptován výsledek 3+. Hodnotu 2+ (hraniční pozitivita) je potřeba doplnit metodou FISH (fluorescenční in situ hybridizace), která stanoví počet genových kopií.
Podstatného pokroku se dosáhlo i v oblasti výzkumu vaskulárního endoteliálního růstového faktoru (VEGF) jako silného stimulátoru růstu endoteliálních cév, které jsou pro růst nádoru životně důležité [7]. Nejvíce propracované látky cílené molekulární léčby jsou monoklonální protilátky a nízkomolekulové tyrosinkinázové inhibitory.
Přenos signálu
Tento velmi složitý proces můžeme stručně, zjednodušeně a velmi schematicky popsat v několika krocích. Receptorový protein provádí první transdukční krok. Přijímá externí signál, na který odpovídá vyvoláním následného intracelulárního signálu, který navozuje kaskádu přenosu prostřednictvím signálových molekul, jejichž funkcí je:
- přenést fyzikálně signál z místa, kde byl přijat, do nitra buňky a jejích intracelulárních systémů, které vyvolají odpověď, často lokalizovanou v jiné části buňky
- transformovat signál do molekulové formy, která je schopna stimulovat odpověď
- je li nutné – amplifikovat (znásobit) přijatý signál, který, i když má velmi malou intenzitu, může vyvolat výraznou odpověď
distribuovat signál tak, že ovlivní současně několik procesů. To znamená, že v určitém místě kaskády může být signál rozdělen (odkloněn), a pak působit na různých cílových místech, a vyvolat tak komplexní odpověď
Každý krok signální dráhy je otevřený zásahu i jiných faktorů, takže přenos může být modifikován podle určitých podmínek (stavu) uvnitř buňky nebo i mimo ni.
Image 1. Zjednodušené schéma přenosu signálu. 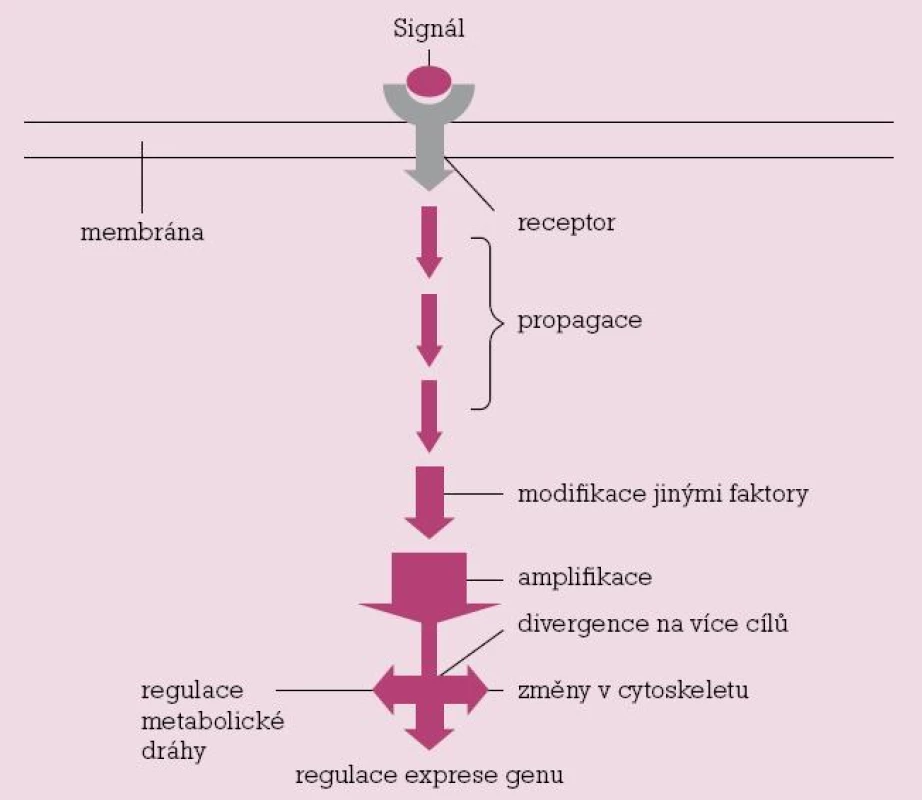
Éra současné cílené léčby (targeted therapy) byla vlastně započata objevením hormonálních receptorů a cíleným podáváním tamoxifenu u hormonálně dependentních tumorů prsu [8]. Klinické použití monoklonální protilátky proti HER 2 v kombinaci s chemoterapií zahájilo novou etapu bioregulační nehormonální léčby karcinomu prsu.
Trastuzumab (Herceptin®)
Jedná se o rekombinantní humanizovanou monoklonální protilátku (získaná rekombinantní technologií z buněk ovarií čínských křečků), která byla jako první schválena pro léčbu solidních tumorů. Na trh byl preparát uveden v roce 1998. V současné době je použití trastuzumabu zapracováno do standardů paliativní i adjuvantní léčby karcinomu prsu u žen s HER 2 pozitivními nádory. Protilátka se váže na extracelulární doménu receptoru HER 2, a tím blokuje vstup buněk do S fáze a zastavuje buněčný cyklus. Současně vazba protilátky na povrch buňky usnadní rozpoznání buňky imunokompetentními buňkami (makrofágy, cytotoxické NK buňky). Z těchto cytotoxických buněk se uvolňují působky jako perforin a granzym, které podporují indukci apoptózy. Trastuzumab se používá v monoterapii nebo v kombinaci s paklitaxelem (chemoterapie), eventuálně v kombinaci s inhibitory aromatáz (hormonální léčba).
Dávkovací schéma: 8 mg/ kg i.v. jako nasycovací dávka, pokračuje se v dávce udržovací 6 mg/ kg. Interval aplikace je 21 dnů. Léčba trvá 52 týdnů, eventuálně se ukončuje při zjištění progrese nebo nesnášenlivosti preparátu. Kontraindikací podání trastuzumabu jsou: nesnášenlivost preparátu, klidová dušnost nebo léčba kyslíkem jako komplikace karcinomu prsu.
Nežádoucí účinky: mezi nejčastější vedlejší účinky patří nausea, bolest svalů, průjem, kardiotoxicita, kožní vyrážka, zimnice a únava.
Lapatinib (Tyverb®)
Na trh nově uvedený preparát, v naší republice se používá od roku 2008, plně hrazen ze zdravotního pojištění, ve vybraných indikacích od srpna 2009. Jedná se o perorální reverzibilní duální inhibitor tyrosinkináz. Ve studiích in vitro bylo potvrzeno, že působí inhibici nádorového růstu a indukci apoptózy i u jiných nádorů (tumory orofaciální oblasti, plic, žaludku a karcinomu vulvy). V současnosti je indikován k léčbě pacientek s pokročilým nebo metastazujícícm karcinomem prsu s prokázanou pozitivitou HER 2 onkoproteinu po předchozí terapii antracykliny, taxany a trastuzumabem [9]. Jeho účinek spočívá v duální blokádě tyrosinkináz intracelulárních domén – blokuje fosforylaci a současně vlastní aktivaci intracelulárního receptoru, čímž zablokuje vznik dostředivého přenosu signálu. Tento signál je zapotřebí k aktivaci buněčného cyklu. Blokáda signálních cest tedy vede k inhibici angiogeneze, indukci apoptózy a inhibici nádorového růstu. Malé molekuly lapatinibu pronikají do cytoplazmy buňky a inhibují receptory HER 1 i HER 2, mají tedy teoretickou výhodu ve srovnámí s monoklonálními protilátkami, které působí pouze proti extraelulární doméně HER 2 (trastuzumab).
Výhodou lapatinibu, na rozdíl od trastuzumabu, je možnost prostupnosti hematoencefalické bariéry. Tento poznatek je významný, neboť pacientky s HER 2 pozitivním karcinomem prsu jsou vystaveny mnohem vyššímu riziku mozkových metastáz.
Další jeho výhoda spočívá v tom, že je vyráběn v 250mg tabletách pro perorální užití. Dávkovací schéma: 1 250 mg (5 tablet) per os, 1× denně, kontinuálně. Tablety se užívají hodinu před jídlem, nebo hodinu po jídle. Aplikuje se v kombinaci s capecitabinem.
Nežádoucí účinky: lapatinib je dobře snášen, mezi nejčastější vedlejší účinky (v sestupném pořadí) patří průjem (40 %), kožní vyrážka (30 %), nausea (13 %), únava (10 %) a kardiotoxicita (0,5 – 4 %) – většinou mírného stupně a zvládnutelné běžnými terapeutickými postupy.
Bevacizumab (Avastin®)
Další pokrok do léčby nádorových onemocnění přinášejí léky zaměřené nikoli na nádorovou buňku, ale na cévní síť nádoru. Nejlépe prostudovaným lékem s antiangiogenními účinky je nesporně bevacizumab, rekombinantní humanizovaná monoklonální protilátka proti endoteliálnímu růstovému faktoru (VEGF). Jeho základní indikací byla léčba kolorektálního karcinomu a postupně se indikace rozšířila i na jiné solidní tumory (karcinom ledviny, prsu). Přidání bevacizumabu k paclitaxelu u pacientek s metastatickým karcinomem prsu bez overexprese HER 2 v první linii zdvojnásobilo léčebnou odpověď a dobu do progrese onemocnění. Bevacizumab je tedy schválen pro první linii léčby metastatického karcinomu prsu v kombinaci s paclitaxelem, zatím však není hrazen ze zdravotního pojištění. Lék zabraňuje interakci mezi VEGF a tyrosinkinázovými receptory, které se nacházejí na povrchu endoteliálních buněk. Dávkovací schéma: 5 mg/ kg formou nitrožilní infuze. Interval aplikace je 14 dnů.
Nežádoucí účinky: pancytopenie, periferní neuropatie, hypertenze, průjem, nebezpečí krvácení, vznik gastroitestinálních píštělí, trombembolizmus. Kontraindikací podání bevacizumabu jsou: nesnášenlivost preparátu, gravidita.
Image 2. Schematické znázornění působení monoklonálních protilátek (trastuzumab, extracelulárně) a tyrosinkinázových inhibitorů (lapatinib, intracelulárně). 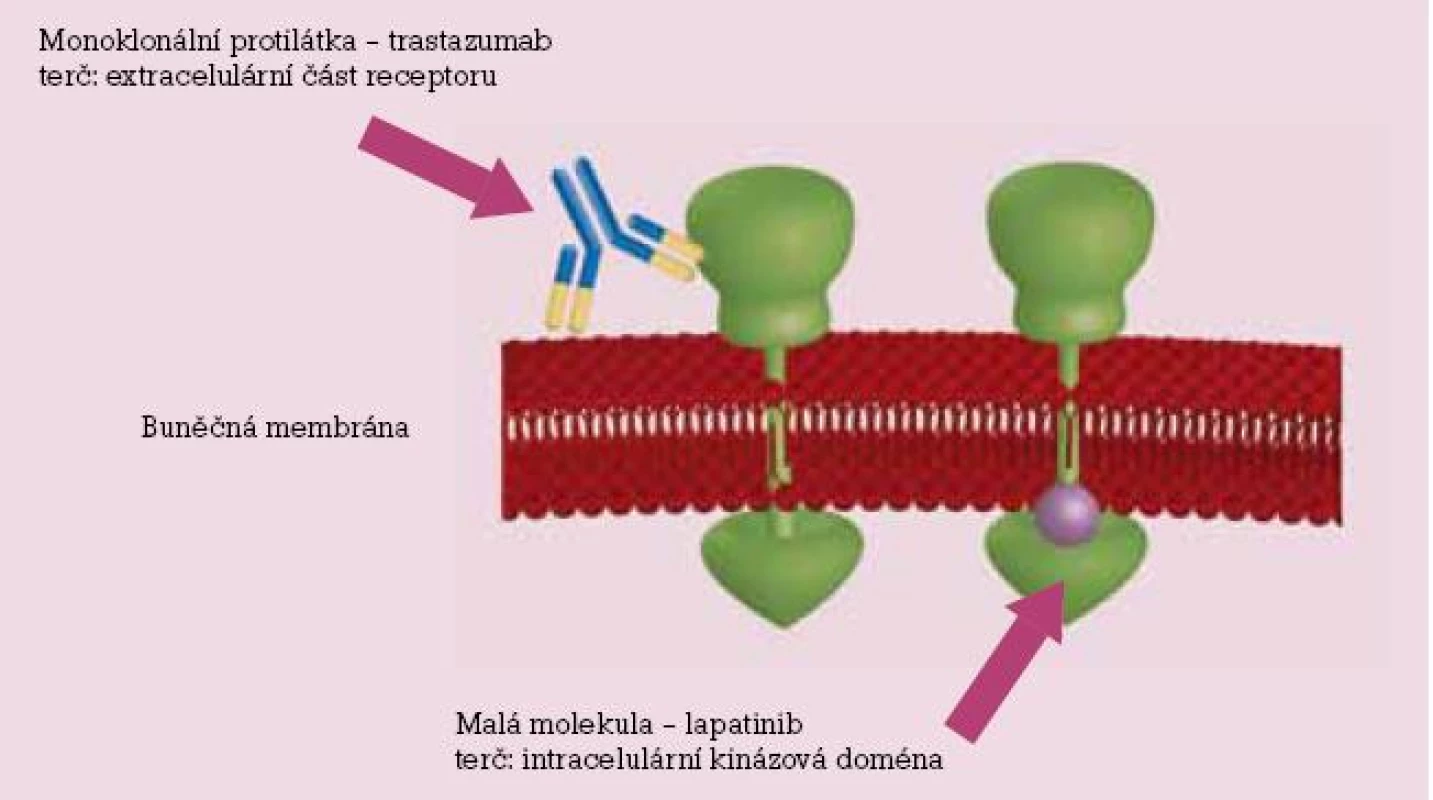
Závěr
Cílená biologická léčba se stává součástí standardní léčby nejčastěji se vyskytujících solidních nádorů – karcinom prsu, karcinom tlustého střeva a konečníku, plicní karcinomy, nádory ledviny. Předpokladem správného využití onkologické léčby je správný výběr nemocných na podkladě molekulární predikce. Aplikace biologické léčby vyžaduje odborně erudovaný personál a zároveň laboratorní zázemí umožňující bezodkladné vyšetření molekulárních prediktorů. Nové léčebné postupy budou pacientkám „šity na míru“ a přesně směrovány na konkrétní cíle na mikromolekulární úrovni. Je jasné, že i přes vývoj nových cytostatik účinnost chemoterapie dosáhla svých možností. I když jsou perspektivy klasické chemoterapie omezené, má tato léčba stále své místo. Výsledky klinických studií jasně ukazují, že právě kombinace těchto dvou léčebných modalit (biologická léčba s chemoterapií) je výhodná.
Publikováno s podporou vědecko výzkumného záměru MOU č.: MZ0MOU2005.
prim. MUDr. Josef Chovanec, Ph.D.1
MUDr. Zuzana Dostálová, Ph.D.2
1 Oddělení gynekologické onkologie, Masarykův onkologický ústav, Brno
2 Gynekologicko-porodnická klinika FN Brno
Sources
1. Abrhámová J, Povýšil J, Horák J et al. Atlas nádorů prsů. Grada Publishing, Praha 2000, 1 : 9.
2. Novotvary 2006 ČR. Zdravotnická statistika. Ústav zdravotnických informací a statistiky ČR, 2009 : 65.
3. Petruželka L. Karcinom prsu – jak dál v diagnostice a léčbě ve světle nových možností. Vnitř lék 2007; 53 : 22 – 23.
4. Petruželka L. Současné možnosti a nové perspektivy systémové léčby karcinomu prsu. Klin Farmakol 2007; 21 : 103 – 113.
5. Klener P. Cílená terapie v onkologii. Postgrad Med 2007; 9 : 128 – 134.
6. Walker RA, Dearing SJ. Expression of epidermal growth factor receptor mRNA and protein in primary breast carcinomas. Breast Cancer Res Treat 1999; 53 : 167 – 176.
7. Klener P. Bevacizumabum. Remedia 2005; 15 : 312 – 315.
8. Petruželka L. Hormonální léčba – současný stav a nové možnosti léčby postmenopauzálních žen s hormonálně dependentním karcinomem prsu. Referátorový výběr. 2007; 24 : 2 – 10.
9. Palácová M. Novinky v léčbě karcinomu prsu. Onkologie 2008; 2(1): 49 – 52.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2009 Issue 4-
All articles in this issue
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Molekulovo- genetická analýza tumorsupresorových génov PTEN a TP53 u pacientky s karcinómom endometria
- Biologická léčba karcinomu prsu
- Tradiční peruánská medicína v léčbě neplodnosti
- Rýchla prenatálna diagnostika chromozómových aneuploidií
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

