-
Medical journals
- Career
Chirurgická léčba Crohnovy nemoci u dětí v éře biologické léčby
Authors: V. Dotlačil 1; R. Škába 1; B. Rousková 1; L. Poš 1; B. Kučerová 1; Š. Coufal 2; T. Lerchová 3; M. Rygl 1
Authors‘ workplace: Klinika dětské chirurgie, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole, Praha 1; Laboratoř buněčné a molekulární imunologie, Mikrobiologický ústav, Akademie věd České republiky, v. v. i., Praha 2; Pediatrická klinika, 2. lékařská fakulta Univerzity Karlovy a Fakultní nemocnice v Motole, Praha 3
Published in: Rozhl. Chir., 2022, roč. 101, č. 2, s. 56-60.
Category: Review
doi: https://doi.org/10.33699/PIS.2022.101.2.56–60Overview
Úvod: Incidence Crohnovy choroby v dětské populaci stoupá a vedle konzervativní terapie vyžaduje i léčbu chirurgickou. Dříve byla chirurgická léčba až posledním krokem po selhání veškeré konzervativní terapie, dnes je standardní součástí komplexní léčby. Chirurgie může vstupovat do léčebného procesu v jakékoliv fázi onemocnění a při správné indikaci, načasování a předoperační optimalizaci dokáže u pacientů vyvolat okamžitou remisi. Na druhé straně při nedostatečné nebo nesprávné předoperační přípravě a indikaci může chirurgická léčba způsobit závažné až život ohrožující komplikace. V éře biologické léčby se spektrum operovaných pacientů mění. Cílem sdělení je shrnutí současných poznatků o vlivu biologické léčby (anti-TNF alpha) na rozvoj pooperačních komplikací u dětí a adolescentů operovaných pro Crohnovu chorobu.
Metody: Předkládáme přehledovou práci čerpající z literatury databází MEDLINE-PubMed a Embase.
Závěr: Podle současných poznatků nebyla nalezena asociace mezi biologickou léčbou v předoperačním období a rozvojem pooperačních komplikací u dětských pacientů. Chirurgická léčba dětských pacientů s Crohnovou chorobou patří mezi standardní modality léčby.
Klíčová slova:
biologická léčba – laparoskopie – Crohnova choroba – dětská chirurgie – nespecifický střevní zánět
ÚVOD
Crohnova choroba (CN) je chronické relabující zánětlivé onemocnění, které postihuje děti i dospělé. Incidence CN v dětské populaci je celosvětově na vzestupu (přibližně 25 % pacientů je diagnostikováno před 18. rokem věku) [1]. Fenotyp takto diagnostikovaného onemocnění je častěji charakterizován intenzivnějším a agresivnějším zánětem [2,3]. Během posledních desetiletí došlo díky biologické léčbě (BL) k významnému pokroku v konzervativní léčbě [4]. Efekt biologické léčby je však limitovaný: 15−30 % primárně na léčbu nereaguje [5,6−8] a až u třetiny pacientů dojde k sekundárnímu selhání léčby [9,10]. Přes adekvátní komplexní léčbu se až u třetiny dětských pacientů vyvinou komplikace (píštěl, striktura apod.), které vyžadují chirurgickou léčbu [11]. Chirurgická léčba pacientů s CN je zatížená větším počtem pooperačních komplikací oproti jiným typům kolorektální chirurgie, a to jak následkem přirozeného průběhu onemocnění, tak i následkem některých léčiv. Efekt nejnovější skupiny léčiv − biologické léčby – zatím nebyl v dětské populaci dostatečně prozkoumán, a proto jsou některá doporučení extrapolována z výsledků pro dospělou populaci.
Cílem sdělení je shrnutí současných poznatků o vlivu biologické léčby na rozvoj pooperačních komplikací u dětí a adolescentů operovaných pro Crohnovu chorobu.
METODA
Data byla získána z dostupné literatury za použití databáze MEDLINE − PubMed, Embase. Inkluzivní kritéria byla text v českém či anglickém jazyce, pacienti s věkem ≤18 let [1], kazuistiky byly ze studie vyřazeny. Sledované období bylo od roku 2002 do roku 2020.
VÝSLEDKY
Indikace k operaci
Zavedení BL do terapie CN u dětských pacientů přispělo k mírnému poklesu počtu operací a ke změně v jejich indikacích. Více se již setkáváme s elektivní indikací při selhání medikamentózní léčby či rozvoji komplikací onemocnění (striktura, píštěl, porucha růstu) než s indikací akutní (krvácení, obstrukční ileus, perforace střevní, nitrobřišní absces) [12]. Hlavním cílem chirurgické léčby je při elektivní indikaci navození okamžité, avšak dočasné remise a snížení morbidity pacienta. Elektivně se nejčastěji provádí ileocekální resekce (ICR). Dalšími výkony jsou hemikolektomie, subtotální kolektomie, stomie, proktektomie, strikturoplastiky, resekce píštělí, segmentální resekce tenkého střeva a ošetření perianální CN. Většinu těchto výkonů lze dnes provádět kompletně či laparoskopicky asistovaně [13].
Vyšetření před operací
Kompletní zhodnocení stavu pacienta (klinické a laboratorní vyšetření, stav nutrice, medikamentózní léčba), rozsahu a aktivity CN (gastrofibroskopie, koloskopie, magnetická rezonanční enterografie) je před operací velmi důležité k určení optimálního chirurgického výkonu, minimalizaci délky resekce střeva, snížení rizika perioperačních komplikací a také k dalšímu sledování a nastavení pooperační medikamentózní terapie.
Možnosti chirurgické léčby:
Operace na tenkém střevě
16 % dětských pacientů má izolované postižení tenkého střeva, 4 % postižení horní části GIT [3]. Standardně může být provedena resekce postiženého úseku střeva s následnou anastomózou či vyvedení stomie. Zejména při nálezu více kratších striktur nebo při riziku rozvoje syndromu krátkého střeva je vhodné zvážit provedení strikturoplastiky. Nejčastěji se provádí strikturoplastika dle Heineke-Mikulicze (<10 cm), pokud je striktura delší, je metodou volby provedení strikturoplastiky dle Finneyho (>10 cm <25 cm) nebo jiné nekonvenční strikturoplastiky (např. dle Michelassiho) [14].
Ileocekální resekce
Přibližně 53 % pacientů má při diagnóze CN postižení ileocekální oblasti a ileocekální resekce je nejčastějším typem výkonu u dětských pacientů CN [15].
Studie u dospělých pacientů poukazují na bezpečnost a efektivitu laparoskopického či laparoskopicky asistovaného přístupu u ileocekální resekce. Totéž platí i pro dětské pacienty. I zde je laparoskopický přístup bezpečný a s menším počtem komplikací oproti klasické laparotomii [16]. Anastomózu lze vytvořit buď klasicky vstřebatelným šicím materiálem, nebo staplerovou technikou. U dětských pacientů zatím nejsou pevná doporučení ve vztahu k typu anastomózy − principem by mělo být provedení co nejširší anastomózy. V posledních letech se i zde uplatňuje single port laparoskopicky asistovaný přístup [17], který je prováděn již standardně na pracovišti autora (Obr. 1, 2).
Image 1. Laparoskopicky mobilizovaná ileocekální oblast s Alexis retraktorem
Fig. 1: Laparoscopically mobilized ileocecal region with the Alexis retractor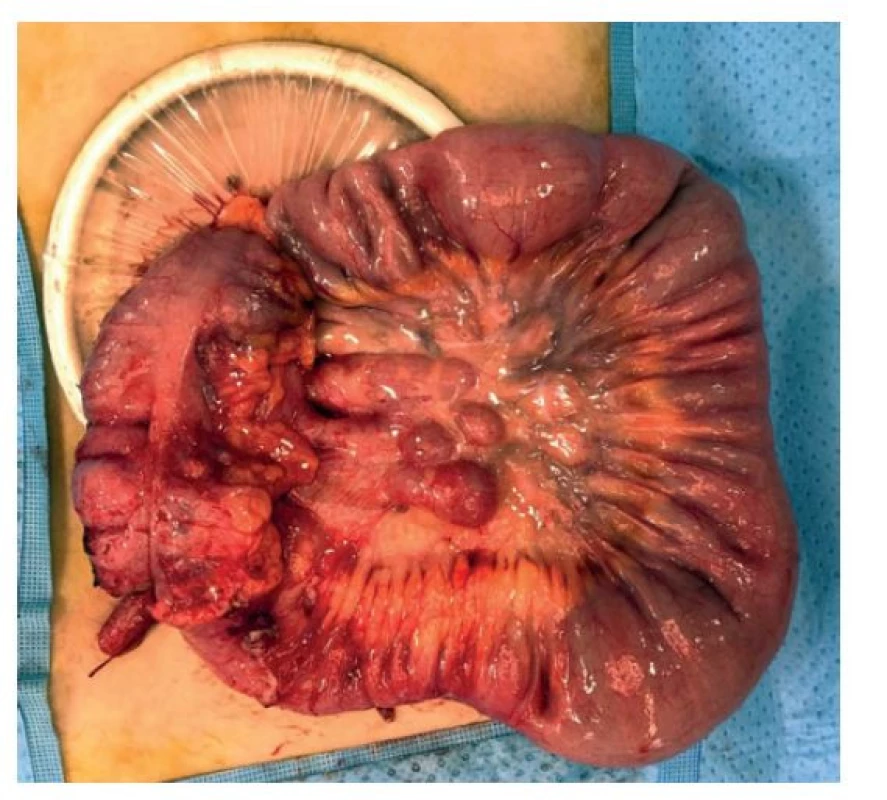
Image 2. Operační rána na konci operačního výkonu
Fig. 2: Surgical wound at the end of the operation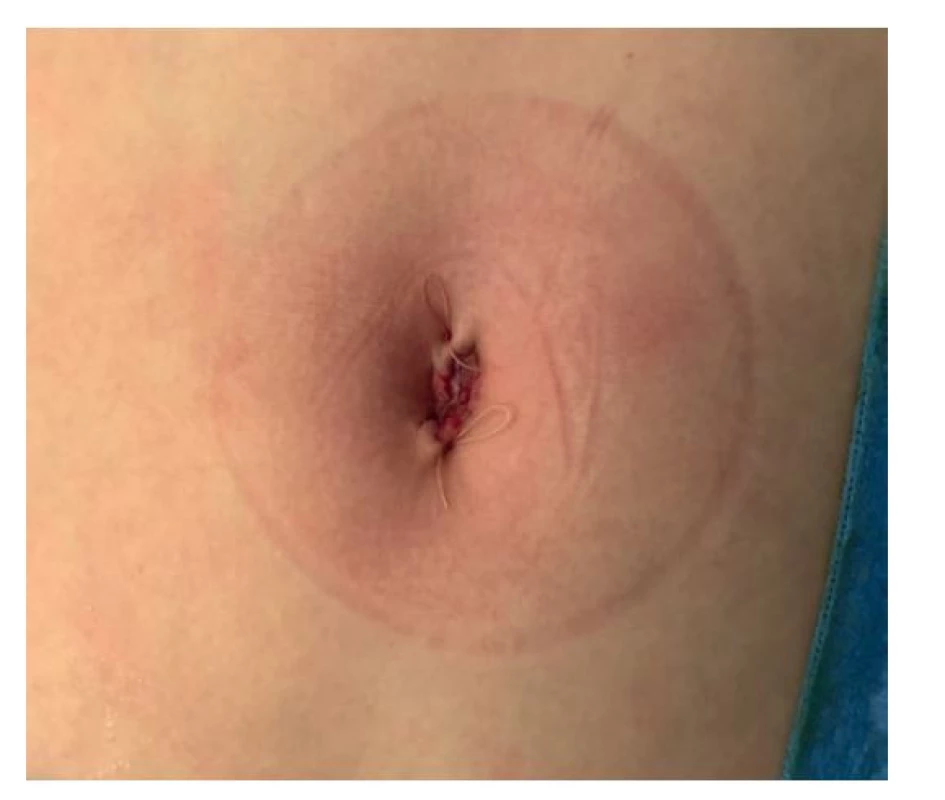
Operace na tlustém střevě
27 % dětí má izolovaně postiženo tlusté střevo [3]. Pokud je pro postižení tlustého střeva CN nutná operace, je možno volit segmentální resekci jednoho, maximálně 2 postižených úseků. Při postižení více etáží či celého tlustého střeva se volí subtotální kolektomie. Pokud se jedná o elektivní operaci, může se dle celkového stavu pacienta a lokálního nálezu rovnou vytvořit ileorekto anastomóza (IRA). Je-li operováno akutně, měla by být metodou volby vícedobá operace: nejdříve subtotální kolektomie s terminální ileostomií a v druhé době vytvoření IRA s/bez pojistné ileostomie. Vytvoření ileopouch-anální anastomózy (IPAA) není obecně u pacientů s CN doporučováno. Je možné o něm uvažovat jen u vysoce selektovaných pacientů s izolovaně postiženým tlustým střevem, kteří nemají perianální CN a nemají postižení tenkého střeva a s vědomím vyššího rizika selhání IPAA oproti pacientům s ulcerózní kolitidou [18].
Perianální Crohnova choroba (PACD)
PACD je formou Crohnovy choroby, která se velmi vzácně může vyskytovat izolovaně, avšak častěji v kombinaci s určitou formou luminálního postižení CN. Její výskyt je v dětské populaci uváděn v 10−62 % [19]. Může se vyskytovat od nezávažných skin tags až po abscesy a píštěle, které jsou závažné a vyžadují kombinovanou léčbu (medikamentózní + chirurgickou). Nejpřínosnější v diagnostice PACD je magnetická rezonance pánve a vyšetření dětským chirurgem se zkušeností v IBD chirurgii v celkové anestezii. Jednoduché asymptomatické píštěle nevyžadují chirurgickou intervenci, ale musejí být sledovány. Léčba symptomatické PACD je vždy kombinací chirurgické a medikamentózní léčby. V první fázi léčby je zapotřebí symptomatickou píštěl/píštěle a absces drénovat. Cílem léčby lokálního zánětlivého ložiska je prevence jeho možné progrese s ohrožením svěračového aparátu a zajištění sanace zánětlivého ložiska před započetím BL. Základní chirurgickou intervencí je zavedení trasovací ligatury do píštěle (drénování vnitřního a vnějšího ústí píštěle). Elastická ligatura může poranit anální svěrač a zvýšit riziko inkontinence, proto se používat nemá. Eradikace píštěle je „až sekundárním“ cílem v léčbě komplexní PACD a může k ní být přistoupeno, pokud je luminální a perianální forma CD pod kontrolou. Existuje mnoho metod eradikace píštělí: od prosté extrakce drénu s jejím spontánním uzávěrem až po chirurgické metody, jako např. advancement flap (uzávěr vnitřního ústí píštěle slizničním lalokem anorekta). Těžká refrakterní PACD postupně vede k destrukci svěračového komplexu a/nebo striktuře anorekta, často v možné kombinaci s pánevní sepsí. V těchto případech je indikována derivace stolice stomií a při ireverzibilním postižení až proktektomie [12]. Biologická léčba ze skupiny anti-TNF alpha (Infliximab, Adalimumab) je hlavním léčivem užívaným v léčbě symptomatické PACD. ATB mají efekt jen na zklidnění lokálního zánětu, ale nemají efekt na hojení PACD.
DISKUZE
Pooperační komplikace:
Při srovnání komplikací v dětské a dospělé IBD populaci je jejich výskyt u dětí menší. IBD chirurgie je však zatížená větším množstvím komplikací než srovnatelné výkony pro jiné patologie, přičemž se na jejich vzniku může podílet i předoperační medikamentózní léčba včetně recentně dostupné léčby biologické [20,12]. Dle literatury se časné pooperační komplikace vyskytují ve 20−30 % případů při operaci na tenkém střevě či v ileocekální oblasti a při subtotální kolektomii se pohybují v rozmezí 50−60 % (leak či dehiscence anastomózy, infekce v ráně (SSI), ileus, krvácení apod.) [21,22].
Současná doporučení na chirurgickou léčbu CN v dětském věku nedoporučují pokračovat s anti-TNF alpha léčbou v bezprostředním perioperačním období, protože je spojena s vyšším rizikem pooperačních komplikací. V samotných doporučeních je konstatováno, že vycházejí částečně z doporučení pro dospělou populaci, protože pro dětskou populaci neexistuje dostatek dat [12].
Po vzniku výše uvedených doporučení od IBD Porto Group vzniklo několik studií zabývajících se vztahem BL a pooperačních komplikací u dětských pacientů s CN, která ve shodě uvádějí, že se nezvyšuje počet pooperačních komplikací při neukončení BL před operací.
Nejrecentnější prací na toto téma je práce autora tohoto článku z roku 2019, která srovnávala riziko rozvoje pooperačních komplikací v návaznosti na podávání anti - TNF alpha léčby, kdy není signifikantní rozdíl v počtu pooperačních komplikací ve vztahu k perioperačnímu podávání anti-TNF alpha léčby (Clavien-Dindo minor 2,3 % vs. 4,6 %, p=1; Clavien-Dindo major 7 % vs. 9,1 %, p=1) [23].
Práce Lightner a kol. také z roku 2019 hodnotila 30denní pooperační morbiditu u 69 dětských pacientů; 54 pacientů bylo léčeno anti-TNF alpha léčbou do 12. týdne před operací se závěrem, že předoperační podávání anti-TNF alpha není asociováno s větším počtem pooperačních infekčních komplikací [24].
Obdobně práce kolektivu autorů z Houstonu, USA, z roku 2016 ukázala, že při léčbě anti-TNF alpha léčivem nedochází k vyššímu riziku rozvoje pooperačních komplikací [25].
Další prací, která hodnotila vztah anti-TNF alpha léčby a možného rozvoje pooperačních komplikací, je práce Zimmermana a kol. z roku 2016. Do studie bylo zařazeno 123 dětských pacientů (24 léčeno biologikem) se závěrem, že není signifikantní rozdíl v počtu pooperačních komplikací v těchto dvou skupinách (21 % vs. 11 %; p=0,2) [26].
Nejnovější doporučení na toto téma jsou guidelines od Evropské společnosti pro IBD (ECCO) z roku 2020, kde je uvedeno, že v perioperačním období nemusí být BL vysazena, protože není asociována s větším počtem pooperačních komplikací [27]. Jedná se však o doporučení pro dospělou populaci.
Z výše uvedeného vyplývá, že u léčiv ze skupiny anti - TNFa preparátů (IFX, ADA) nepanuje shoda ohledně jejich podávání v perioperačním období a u dětských pacientů nejsou zatím dostatečná data o vlivu těchto preparátů na rozvoj pooperačních komplikací. Využívání biologik v léčbě CN komplikuje jejich variabilní aktivita u jednotlivých pacientů, neboť současné hodnocení účinnosti biologik se odvíjí od jejich klinického efektu, endoskopické a histologické aktivity onemocnění, měření sérových hladin biologik a také sérových protilátek proti podávanému biologiku. Dalším možným krokem při objasňování efektu biologik a jejich efektu na možné pooperační komplikace je přímé měření koncentrace biologika v postižené tkáni (střevní stěně) a získání informací o farmakokinetice biologika v tkáni s různým stupněm zánětu a ve tkáni přímo v oblasti anastomózy s cílem optimalizace předoperační biologické léčby a predikce rizika chirurgických komplikací [GAUK projekt, 28].
ZÁVĚR
Podle současných poznatků není biologická léčba v předoperačním období asociována s rozvojem pooperačních komplikací u dětských pacientů. Chirurgická léčba IBD v dětském věku zůstává základní součástí komplexní péče o tyto pacienty. IBD pacienti vyžadující chirurgický výkon by se měli soustředit v centrech se zkušeností s IBD chirurgií a návazností na dětskou gastroenterologii. Laparoskopický přístup je preferovanou metodou i v dětském věku.
Práce vznikla s podporou projektu GA UK 512120.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Vojtěch Dotlačil
Klinika dětské chirurgie
2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
e-mail: vojtech.dotlacil@fnmotol.cz
ORCID: 0000-0002-7291-7323
Sources
1. Sýkora J, Pomahačová R, Kreslová M, et al. Current global trends in the incidence of pediatric-onset inflammatory bowel disease. World J Gastroenterol. 2018 Jul 7;24(25):2741−2763. doi: 10.3748/wjg. v24.i25.2741.
2. Gasparetto M, Guariso G. Highlights in IBD epidemiology and its natural history in the paediatric age. Gastroenterol Res Pract. 2013;829040. doi: 10.1155/2013/829040.
3. de Bie C, Paerregaard A, Kolacek S, et al. Disease phenotype at diagnosis in pediatric Crohn´s disease: 5-year analyses of the EUROKIDS Registry. Inflamm Bowel Dis. 2013;19(02):378–385. doi: 10.1002/ ibd.23008.
4. Mowat C, Cole A, Windsor A, et al. IBD Section of the British Society of Gastroenterology. Guidelines for the management of inflammatory bowel disease in adults. Gut 2011;60(05):571–607. doi: 10.1136/ gut.2010.224154.
5. Hyams JS, Griffiths A, Markowitz J, et al. Safety and efficacy of adalimumab for moderate to severe Crohn‘s disease in children. Gastroenterology 2012;143(2): 365−374. doi: 10.1053/j.gastro. 2012.04.046.
6. Hanauer SB, Feagan BG, Lichtenstein GR, et al. ACCENT I Study Group. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet 2002;359(9317):1541–1549. doi: 10.1016/ S0140-6736(02)08512-4.
7. Hanauer SB, Sandborn WJ, Rutgeerts P, et al. Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn’s disease: the CLASSIC-I trial. Gastroenterology 2006;130(02):323–333. doi: 10.1053/j.gastro.2005.11.030.
8. Colombel JF, Sandborn WJ, Rutgeerts P, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn’s disease: the CHARM trial. Gastroenterology 2007;132(01):52–65. doi: 10.1053/j.gastro.2006.11.041.
9. Rutgeerts P, Feagan BG, Lichtenstein GR, et al. Comparison of scheduled and episodic treatment strategies of infliximab in Crohn’s disease. Gastroenterology 2004;126(02):402–413. doi: 10.1053/j. gastro.2003.11.014.
10. Sandborn WJ, Rutgeerts P, Enns R, et al. Adalimumab induction therapy for Crohn disease previously treated with infliximab: a randomized trial. Ann Intern Med. 2007;146(12):829–838. doi: 10.7326/0003-4819-146-12-200706190 - 00159.
11. Vernier-Massouille G, Balde M, Salleron J, et al. Natural history of pediatric Crohn’s disease: a population-based cohort study. Gastroenterology 2008;135(04):1106–1113. doi: 10.1053/j. gastro.2008.06.079.
12. Amil-Dias J, Kolacek S, Turner D, et al. IBD Working Group of ESPGHAN (IBD Porto Group). Surgical management of Crohn disease in children: Guidelines from the paediatric IBD Porto Group of ESPGHAN. J Pediatr Gastroenterol Nutr. 2017 May;64(5):818−835. doi: 10.1097/ MPG.0000000000001562.
13. Pini-Prato A, Faticato MG, Barabino A, et al. Minimally invasive surgery for paediatric inflammatory bowel disease: Personal experience and literature review. World J Gastroenterol. 2015 Oct 28;21(40):11312−11320. doi: 10.3748/ wjg.v21.i40.11312. PMID: 26525138; PMCID: PMC4616207.
14. Neville JJ, Macdonald A, Fell J, et al. Therapeutic strategies for stricturing Crohn‘s disease in childhood: a systematic review. Pediatr Surg Int. 2021 May;37(5):569−577. doi: 10.1007/s00383 - 020-04848-0.
15. Stewart D. Surgical care of the pediatric Crohn‘s disease patient. Semin Pediatr Surg. 2017 Dec;26(6):373−378. doi: 10.1053/j.sempedsurg.2017.10.007.
16. Quiroz HJ, Perez EA, El Tawil RA, et al. Open versus laparoscopic right hemicolectomies in pediatric patients with Crohn‘s disease. J Laparoendosc Adv Surg Tech A. 2020 Jul;30(7):820−825. doi: 10.1089/lap.2019.0814.
17. Carvello M, de Groof EJ, de Buck van Overstraeten A, et al. Single port laparoscopic ileocaecal resection for Crohn‘s disease: a multicentre comparison with multi-port laparoscopy. Colorectal Dis. 2018 Jan;20(1):53−58. doi: 10.1111/codi.13777.
18. Fazio VW, Kiran RP, Remzi FH, et al. Ileal pouch anal anastomosis: analysis of outcome and quality of life in 3707 patients. Ann Surg. 2013 Apr;257(4):679−685. doi: 10.1097/SLA.0b013e31827d99a2.
19. Forsdick VK, Tan Tanny SP, King SK. Medical and surgical management of pediatric perianal Crohn‘s disease: A systematic review. J Pediatr Surg. 2019 Dec;54(12):2554−2558. doi: 10.1016/j. jpedsurg.2019.08.036.
20. Spencer EA, Jarchin L, Rolfes P, et al. Outcomes of primary ileocolic resection for pediatric Crohn‘s disease in the biologic era. J Pediatr Gastroenterol Nutr. 2021,73(6):710−716. doi: 10.1097/ MPG.0000000000003241. Epub ahead of print. PMID: 34292216.
21. Blackburn SC, Wiskin AE, Barnes C, et al. Surgery for children with Crohn‘s disease: indications, complications and outcome. Arch Dis Child. 2014 May;99(5):420−426. doi: 10.1136/archdischild - 2013-305214.
22. Hansen LF, Jakobsen C, Paerregaard A, et al. Surgery and postoperative recurrence in children with Crohn disease. J Pediatr Gastroenterol Nutr. 2015 Mar;60(3):347−351. doi: 10.1097/ MPG.0000000000000616.
23. Dotlacil V, Bronsky J, Hradsky O, et al. The impact of anti-tumor necrosis factor alpha therapy on postoperative complications in pediatric Crohn‘s disease. Eur J Pediatr Surg. 2020 Feb;30(1):27−32. doi: 10.1055/s-0039-1697909.
24. Lightner AL, McKenna NP, Alsughayer A, et al. Anti-TNF biologic therapy does not increase postoperative morbidity in pediatric Crohn’s patients. J Pediatr Surg. 2019;54(10):2162−2165. doi: 10.1016/j. jpedsurg.2019.01.006.
25. Abbas PI, Peterson ML, Fallon SC, et al. Evaluating the impact of infliximab use on surgical outcomes in pediatric Crohn’s disease. J Pediatr Surg. 2016 May;51(5):786−789. doi: 10.1016/j.jpedsurg.2016.02.023.
26. Zimmerman LA, Saites CG, Bairdain S, et al. Postoperative complications in children with Crohn disease treated with infliximab. J Pediatr Gastroenterol Nutr. 2016;63(03):352–356. doi: 10.1097/ MPG.0000000000001151.
27. Adamina M, Bonovas S, Raine T, et al. ECCO Guidelines on therapeutics in Crohn‘s disease: Surgical treatment. J Crohns Colitis. 2020 Feb 10;14(2):155−168. doi: 10.1093/ ecco-jcc/jjz187.
28. Pecere S, Petito V, Amatoet A, et al. Infliximab and tumor necrosis factor alpha measurement on intestinal mucosa: A new tool for the clinic? EMJ Gastroenterol. 2016;5[1]:107−115
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2022 Issue 2-
All articles in this issue
- Trendy v dětské chirurgii
- Chirurgická léčba Crohnovy nemoci u dětí v éře biologické léčby
- Iniciální zkušenosti se single incision laparoskopickou apendektomií
- Konzervativní versus operační léčba dislokovaných zlomenin střední části klíční kosti u adolescentů
- Retrospektivní analýza výskytu nekrotizující pneumonie u dětí v letech 2015−2019
- Robotická pyeloplastika u dětí – pilotní studie
- Ultrazvuková diagnostika raritního poranění neosifikovaného dětského skeletu – kazuistika
- Ileus jako komplikace nemoci motýlích křídel − kazuistika
- PragueOnco se letos konalo již potřinácté
- Specializace UEMS − abdominal wall surgery
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Konzervativní versus operační léčba dislokovaných zlomenin střední části klíční kosti u adolescentů
- Retrospektivní analýza výskytu nekrotizující pneumonie u dětí v letech 2015−2019
- Robotická pyeloplastika u dětí – pilotní studie
- Iniciální zkušenosti se single incision laparoskopickou apendektomií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

