-
Medical journals
- Career
Akutní mezenteriální ischemie s nekrózou celého tenkého střeva
: M. Bakalář
: Chirurgické oddělení Nemocnice Slaný
: Rozhl. Chir., 2019, roč. 98, č. 4, s. 174-177.
: Case Report
V kazuistice je popsán případ pacientky s akutní mezenteriální ischemií s nekrózou celého tenkého střeva. V následujícím textu je diskutována četnost akutní mezenteriální ischemie, její nejčastější etiologie, diagnostika a možnosti léčby tohoto závažného onemocnění.
Klíčová slova:
akutní mezenteriální ischemie
S pacientem s bolestmi břicha se setkávají lékaři v ambulancích všech chirurgických oddělení. Při vyšetřování takového pacienta, zvláště pokud je vyššího věku, by v rámci diferenciální diagnostiky náhlé příhody břišní mělo být pomýšleno na akutní mezenteriální ischemii, která mívá zpočátku nespecifické příznaky a může být zaměněna za jiné onemocnění, což může mít pro pacienta později fatální následky.
Kazuistika
Pacientka ve věku 68 let byla přijata na chirurgické oddělení pro půl dne trvající bolesti břicha, opakované zvracení a průjmy. Při přijetí byly při laboratorním vyšetření zjištěny tyto hodnoty: CRP 24,2 mg/l, leukocyty 23200/µl, amyláza v séru (AMS) 1,83 µkat/l. USG břicha bylo bez patologického nálezu. Následující den ráno již došlo k elevaci CRP na 114,9 mg/l a AMS na 4,75µkat/l amyláza v moči (U-AMS) byla 15,42 µkat/l. Byla zahájena léčba akutní pankreatitidy. Stav pacientky se nelepšil a bolesti břicha postupně progredovaly. Pátý den po přijetí došlo k rozvoji známek peritoneálního dráždění, hodnota CRP již byla 328,6 mg/l, bez elevace hodnot AMS a U-AMS. Bylo provedeno CT vyšetření břicha s nálezem rozšíření kliček tenkého střeva odpovídajícím ileóznímu stavu. Dále byly z vyšetření patrné pokročilé aterosklerotické změny v oblasti větví horní i dolní mezenterické tepny. Pacientka byla indikována k operační revizi. Peroperačně bylo nalezeno malé množství zapáchajícího výpotku v dutině břišní, rozšíření kliček tenkého střeva v celém rozsahu s ischemickými změnami, které začínaly 30 cm aborálně od Treitzova vazu a končily 10 cm orálně před ileocekálním přechodem. V mezenteriu ve větvích arteria mesenterica superior byla patrná obliterace mnohočetnými tromby. 30 cm aborálně od Treitzova vazu již byla patrná nekróza stěny střeva. Byla provedena excize nekrózy a sutura střeva. Další nekrotický úsek v délce 20 cm byl patrný na rozhraní jejuna a ilea, ten byl zresekován a daná klička byla vyvedena jako jejunostomie. Vzhledem k rozsahu ischemických změn nebylo možné provést resekci celého postiženého úseku, neboť by muselo být odstraněno prakticky celé tenké střevo. Bylo přistoupeno k dočasnému uzávěru dutiny břišní s plánovanou second look operací. Pooperačně byla pacientka hemodynamicky nestabilní s nutností podání vazopresorů, dále byla podávána trojkombinace antibiotik a zahájena intravenózní heparinizace. Dle anamnézy byla pacientka dlouhodobě sledována kardiologem pro paroxysmální fibrilaci síní, pro opakované krvácivé stavy však byla u pacientky antikoagulační léčba vysazena. Jako pravděpodobná příčina ischemie v povodí a. mesenterica superior se tedy jevila embolizace v kombinaci s pokročilými aterosklerotickými změnami. U pacientky bylo doplněno ECHO s nálezem trombu v levé komoře srdeční v oblasti akineze přední stěny, tento nález dále podporoval embolizační etiologii ischemie. Po 2 dnech byla u pacientky provedena second look operace, při které již byly patrné nekrotické změny v rozsahu téměř celého tenkého střeva začínající 30 cm aborálně od Treitzova vazu a končící 10 cm orálně od ileocekálního přechodu. S přihlédnutím k biologicky mladému věku pacientky a relativně stabilnímu stavu bylo zresekováno téměř celé tenké střevo, mezi orálním jejunem a aborálním ileem vytvořena anastomóza side-to-side. Dále byl ponechán jen dočasný uzávěr dutiny břišní. Pátý den po druhé operaci se v drénu z dutiny břišní objevil sterkorální obsah. Byla tedy provedena další operační revize s nálezem dehiscence anastomózy a nekrózou zbývajícího úseku terminálního ilea, vitálních zbývalo pouze 10 mm ilea orálně od céka. Byla provedena resekce nekrotického úseku ilea a cecum slepě uzavřeno. Zbývajících 30 cm jejuna bylo použito k vytvoření terminální jejunostomie. Po této poslední operaci došlo postupně ke stabilizaci celkového stavu pacientky.
Postupně byla vysazena vazopresorická podpora, kontinuální heparinizace byla převedena na nízkomolekulární heparin bolusově, pacientka byla na plné parenterální výživě. Po odeznění analgosedace se pacientka probudila k dobrému kontaktu. V klinickém obraze však dominovala těžká myoskeletální dysfunkce při protrahovaném kritickém onemocnění, pacientka byla závislá na umělé plicní ventilaci, proto bylo přistoupeno k založení tracheostomie.
Od první operace strávila pacientka na oddělení intenzivní medicíny a resuscitace celkem 39 dní. Vzhledem k závislosti na umělé plicní ventilaci byla pacientka přeložena na oddělení následné intenzivní péče, kde strávila dalších 6 týdnů. Následně byla přeložena na metabolickou jednotku jiného zařízení, kde byl zaveden Hickmanův katétr a nastavena individuální parenterální výživa. Dále strávila pacientka další 3 měsíce na oddělení následné péče, kde byla vyživována parenterálně, poté byla propuštěna do domácí péče. Půl roku po první operaci pacientka podstoupila kardiologický výkon − katetrizační uzávěr ouška levé síně, které bylo zdrojem trombu. Po roce od první operace podstoupila pacientka operační revizi břicha s vytvořením jejunocéko anastomózy, po které již pacientka může přijímat stravu i perorálně. Během celého léčení pacientka rehabilitovala, po 16 měsících byla schopna chůze bez opory, do té doby byla převážně na invalidním vozíku. Po 18 měsících od prvních příznaků onemocnění je pacientka soběstačná, trvale na individuálně připravované parenterální výživě, kterou si aplikuje pomocí pumpy sama doma (doba podání výživy je cca od 16 : 00 do 6 : 00). Pacientka s chutí jí, po každém jídle udává 3–6 kašovitých stolic. Váhu má pacientka stejnou jako před první operací. V plánu je pořízení volně přenosné infuzní pumpy s baterií.
1. CT vyšetření − dilatace kliček tenkého střeva, pokročilé aterosklerotické změny AMS s omezeným průtokem
Fig. 1: CT image − small intestine dilatation, advanced atherosclerotic changes of AMS with reduced flow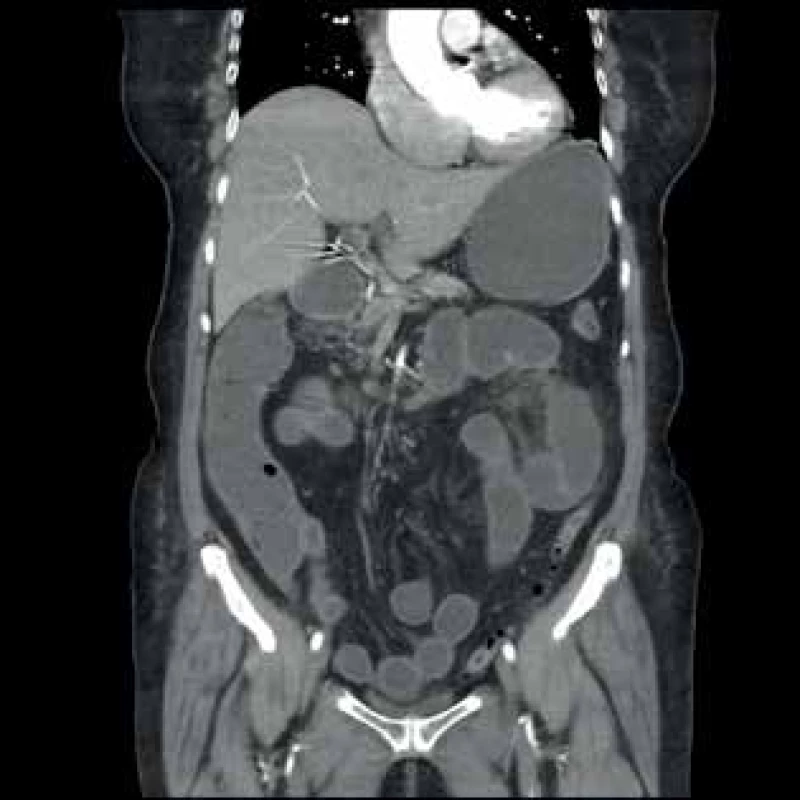
1. CT 3D rekonstrukce, omezený průtok AMS
Fig. 2: 3D reconstruction of CT Images, reduced flow of AMS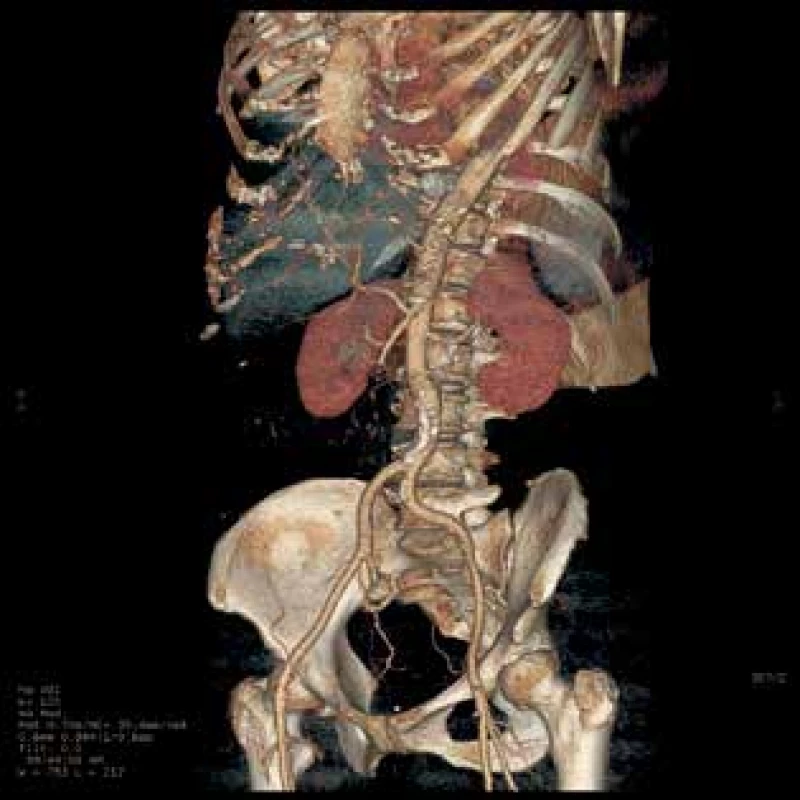
Diskuze
Akutní mezenteriální ischemie (AMI) je definována jako náhle vzniklá nedostatečná perfuze střeva, jejíž incidence v posledních 20 letech stoupla zejména kvůli vyšší průměrné délce života pacientů, ale také díky lepším diagnostickým metodám [1]. Jde o život ohrožující stav, u nějž je mortalita uváděna od 50 do 90 % [ 2].
Právě u starších pacientů by mělo být na AMI pomýšleno jako na možnou příčinu náhlé příhody břišní (NPB). U pacientů nad 75 let je prevalence AMI jako příčiny NPB vyšší než u akutní apendicitidy. U pacientů ve věku 80 let je výskyt AMI přibližně 10x častější než u pacientů ve věku 60 let [3].
AMI můžeme podle etiologie rozdělit do 4 základních skupin – akutní embolie do mezenteriální arterie (50 % případů), akutní trombóza mezenteriální arterie (15–25 % případů), neokluzivní mezenteriální ischemie (20–25 % případů), trombóza mezenteriální žíly (5–10 % případů) [1,4].
Nejčastěji je tedy AMI způsobena embolizací trombem vzniklým v levé srdeční síni nebo komoře. Ohroženi jsou tedy zejména pacienti s fibrilací síní, aneuryzmatem levé komory nebo poruchou její kinetiky způsobenou infarktem myokardu, dále pacienti s kardiomyopatiemi, bakteriální endokarditidou nebo chlopenními vadami [1,4]. Embolie postihuje nejčastěji a. mesenterica superior (AMS). Je to způsobeno jejím relativně širokým průsvitem a pozvolným odstupem z abdominální aorty. V největším procentu případů dochází k uvíznutí embolu v oblasti kmene AMS, což má za následek ischemické postižení většiny tenkého střeva a pravé poloviny colon [5,6,7].
Klinický obraz bývá velmi nespecifický, zejména v prvních několika hodinách bývá často přítomna náhle vzniklá krutá bolest břicha, která však bývá v rozporu s nevýrazným nálezem při fyzikálním vyšetření [1,4,5,7,8]. Později může docházet spíše k subjektivnímu zmírnění obtíží a k rozvoji ileózního stavu, který je v další fázi onemocnění následován obrazem peritonitidy [5]. Ta již svědčí pro irreverzibilní ischemické poškození s nekrózou střevní stěny [7]. Mnoho příznaků jako nauzea, zvracení, průjmy, příměs krve nebo hlenu ve stolici může být přítomno i u jiných břišních patologií, jako jsou pankreatitida, divertikulitida, cholecystitida, apendicitida nebo ileus [4,5]. S narůstající dobou od vzniku obtíží dochází k rozvoji dehydratace, úniku tekutiny do třetího prostoru, rozvoji šokového stavu a může docházet ke zmatenosti pacienta [4]. Všechny tyto skutečnosti spíše komplikují stanovení správné diagnózy.
V laboratorních vyšetřeních můžeme při AMI nalézt leukocytózu, metabolickou acidózu s elevací laktátu, elevaci hodnot D-dimeru. Žádné z těchto laboratorních vyšetření však není specifické pro AMI. Hodnota D-dimeru může být použita spíše jako vylučovací test, při negativním nálezu můžeme s největší pravděpodobností AMI vyloučit, pozitivní hodnoty mohou být spojeny s mnoha jinými patologickými stavy. Vysoká hladina laktátu bývá spojena již s pokročilým irreverzibilním ischemickým poškozením střeva [6,7]. U pacientů s AMI se často také setkáváme s elevací troponinu, amyláz a jaterních testů. To může mít opět za následek chybnou diagnózu [6]. Elevaci amyláz můžeme najít zhruba až u 50 % pacientů s AMI [7].
Ze zobrazovacích metod je pro diagnostiku AMI nejcennější CT. Prostý rentgenový nativní snímek břicha je nespecifický. Až u 25 % pacientů může být v časných fázích onemocnění nález bez patologie [1,4,5]. Pozitivní nález může být při rozvoji nekrózy střevní stěny s perforací a volným vzduchem v dutině břišní [7]. Hodnota ultrasonografického vyšetření je závislá na zkušenostech vyšetřujícího, může být komplikováno obezitou pacienta, plynem ve střevě nebo kalcifikacemi v cévní stěně [8]. U CT vyšetření v případě AMI je uváděna senzitivita kolem 90 %, zároveň může toto vyšetření odhalit i jiné patologie, které mohou být příčinou obtíží pacienta [2]. Mezi obrazy patrné na CT břicha u pacienta s AMI patří dilatace střeva a lumen vyplněné tekutinou nebo plynem, zesílení střevní stěny nebo plyn v portálním řečišti [7,8]. Bývá patrná samotná trombóza nebo embolie do mezenteriálních cév [7].
Pokud je stanovena diagnóza AMI, zahajujeme podle současných doporučení resuscitaci intravaskulárního objemu infuzemi krystaloidních roztoků k dosažení dostatečné perfuze střeva. Dále je nutné sledování hladin elektrolytů a acidobazické rovnováhy a jejich korekce, a to zejména u pacientů s rozvinutou metabolickou acidózou. Dekomprese gastrointestinálního traktu je dosaženo nasogastrickou sondou.
Vzhledem k porušení střevní slizniční bariéry způsobenému ischemií střeva by měla být zahájena terapie širokospektrými antibiotiky co nejdříve. Stejně tak by měla být zahájena časná antikoagulační terapie intravenózním podáním nefrakcionovaného heparinu, pokud není u pacienta kontraindikována.
V případě, že již došlo k rozvoji akutní peritonitidy na podkladě střevní nekrózy, měla by být provedena akutní laparotomie, která má tři hlavní cíle: 1) obnovení cévního zásobení střeva, 2) resekci nekrotických úseků střeva, 3) snahu o zachování co největší části viabilního střeva. Obnovení cévního zásobení může být dle patofyziologie AMI dosaženo různými způsoby – embolektomií z AMS, angioplastikou, v případě trombózy AMS při odstupu z aorty je vyžadováno ošetření bypassem, které s sebou však s užitím protetického materiálu v kontaminovaném terénu přináší vysoké riziko.
Endovaskulární metody je možné užít pouze u pacientů, u nichž nedošlo k rozvoji nekrózy střeva, v opačném případě je vyžadována akutní laparotomie. Endovaskulární embolektomie může být provedena aspirační embolektomií, trombolýzou nebo angioplastikou s eventuálním zavedením stentu. Tyto metody tedy mohou mít využití spíše u pacientů s parciální okluzí arteriálního řečiště.
U kriticky nemocných pacientů je využívána i metoda damage control surgery, kdy je v prvotní fázi provedeno jen nejnutnější chirurgické ošetření, např. i ošetření nekrotického střeva staplerem bez zachování kontinuity střeva. Definitivní ošetření v podobě anastomózy nebo stomie je potom provedeno v druhé době po stabilizaci celkového stavu pacienta na oddělení intenzivní péče [7].
Second look operace jsou využívány zejména ve snaze o zachování co největší části střeva. Je však nutné zvážit, zda second look vůbec provádět, neboť další operační výkon je značnou zátěží pro pacienta v již tak špatném stavu. Tyto výkony by tedy měly být zvažovány individuálně u každého pacienta [9].
V případě trombózy mezenteriální žíly nebo neokluzivní mezenteriální ischemie je před chirurgickou léčbou upřednostňována plná antikoagulační terapie nefrakcionovaným heparinem. V případě, že je vyžadováno akutní chirurgické řešení, má být provedena resekce jen jasně nekrotických úseků střeva a následná second look laparotomie s odstupem 24−48 hodin. Časné zahájení antikoagulační terapie je spojeno s vyšší mírou přežití. V případně neokluzivní mezenteriální ischemie je prioritou zejména léčba komorbidit, které vedou ke snížení mezenteriální perfuze [7].
Pokud je ischemií poškozena většina tenkého střeva a eventuálně i části tlustého střeva, je na zvážení, zda je pro pacienta skutečně přínosem resekce celého postiženého úseku s nejistým výsledkem a následným rozvojem syndromu krátkého střeva a nutností dlouhodobé parenterální výživy, nebo zda neprovádět rozsáhlý chirurgický zákrok a pacientovi poskytnout péči v souladu s principy paliativní (bazální) péče. Je nutné znovu připomenout skutečnost, že většinou se jedná o pacienty v pokročilém věku s četnými komorbiditami. Při tomto rozhodování je velmi cenný předoperační pohovor s pacientem a jeho rodinou a jejich seznámení s možnostmi léčby a jejími možnými následky [7,10].
Po chirurgickém výkonu bez ohledu na etiologii AMI by měla být zahájena terapie nízkomolekulárním heparinem jako prevence dalších tromboembolických komplikací. Následná antikoagulační terapie je zaváděna, když nehrozí další operační revize. U pacientů s AMI způsobenou trombózou mezenteriální arterie by měla být zahájena doživotní antiagregační terapie, u pacientů s embolií do mezenteriální arterie doživotní antikoagulační terapie a u pacientů s trombózou mezenteriální žíly antikoagulační terapie minimálně na půl roku, pokud pacient dosud neměl v anamnéze jiné trombotické stavy [10].
Po zvládnutí akutního stavu, ať už díky chirurgickým zákrokům, nebo dlouhodobé péči na odděleních intenzivní péče, následuje fáze rehabilitace a nutrice pacienta. Vzhledem k tomu, že ve většině případů se jedná o polymorbidní pacienty v pokročilém věku, bývá tato fáze mnohdy velmi zdlouhavá a náročná. Kvalita života pacientů se často již nevrátí na úroveň, jakou měla před tímto onemocněním.
Závěr
Akutní mezenteriální ischemie je i v dnešní době, kdy máme k dispozici vyspělé diagnostické metody, provázena velmi vysokou mortalitou. Klíčovou roli ve zvládnutí tohoto stavu hrají zejména časná diagnóza a rychlá léčba. Bohužel často tomu tak není, zejména právě kvůli pozdní diagnóze. Příznaky mohou často napodobovat jiné onemocnění, jako je například akutní pankreatitida, což poté vede ke špatné léčbě s fatálními následky. I v případě včasné a správné diagnostiky se jedná o léčbu velmi náročnou a nákladnou, vyžadující multioborovou spolupráci. V případě naší pacientky byla diagnóza stanovena až v pokročilé fázi onemocnění a došlo ke ztrátě téměř celého tenkého střeva. Po zdlouhavé léčbě má pacientka relativně dobrou kvalitu života. Případy jako tento jsou však spíše raritní.
Konflikt zájmů
Autor článku prohlašuje, že není v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Martin Bakalář
Nemocnice Slaný
Politických vězňů 756
274 01 Slaný
e-mail: martin.bakalar@nemsl.cz
Sources
-
Radwan K, Bátovský M, Acute mesenteric ischemia. Gastroent Hepatol 2011;65 : 9−14.
-
Furukawa A, Kanasaki S, Kono N, et al. CT diagnosis of acute mesenteric ischemia from various causes. AJR 2009;192 : 408–16. doi: 10.2214/AJR.08.1138.
-
Karkkainen JM. Acute mesenteric ischemia in elderly patients. Expert rev gastroenterol hepatol. 2016;10 : 985−8. doi: 10.1080/17474124.2016.1212657.
-
Oldenburg WA, Lau LL, Rodenberg TJ, et al. Acute mesenteric ischemia: a clinical review. Arch Intern Med. 2004;164 : 1054−62.
-
Balaz P, Rokosny S, Bafrnec J. Mesenteric ischemia, new trends, diagnostic methods and algorithms to significantly reduce mortality and morbidity. Bratisl Lek Listy. 2013;114 : 158−65.
-
Karkkainen JM, Acosta S. Acute mesenteric ischemia (part I) - Incidence, etiologies, and how to improve early diagnosis. Best Pract Res Clin Gastroenterol. 2017;31 : 15−25. doi: 10.1016/j.bpg.2016.10.018
-
Bala M, Kashuk J, Moore EE, et al. Acute mesenteric ischemia: guidlines of the World Society of Emergency Surgery. World Journal of Emergency Surgery 2017. doi.org/10.1186/s13017-017-0150-5
-
Clair DG, Beach JM. Mesenteric Ischemia. N Engl J Med. 2016;374 : 959-68. doi: 10.1056/NEJMra1503884.
-
Meng X, Liu L, Jiang H. Indications and procedures for second-look surgery in acute mesenteric ischemia. Surg Today 2010;40 : 700−5. doi: 10.1007/s00595-009-4140-4.
-
Karkkainen JM, Acosta S. Acute mesenteric ischemia (Part II) - Vascular and endovascular surgical approaches. Best Pract Res Clin Gastroenterol. 2017;31 : 27−38. doi: 10.1016/j.bpg.2016.11.003
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2019 Issue 4-
All articles in this issue
- Principles of antibiotic therapy
- The role of new antibiotics in intra-abdominal infections in the era of multi-resistant bacteria
- Negative pressure therapy with the ULTRAVAC instillation in the therapy of infected laparotomies with fascitis − temporary results of a prospective randomized study
- Acute mesenteric ischemia with necrosis of entire small intestine
- Hemangiomatosis of the greater omentum – a case report
- Growth of colorectal liver metastases is not accelerated by intraportal administration of stem cells after portal vein embolization
- Surgical treatment of alveolar echinococcosis: a single centre experience and systematic review of the literature
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Principles of antibiotic therapy
- Acute mesenteric ischemia with necrosis of entire small intestine
- The role of new antibiotics in intra-abdominal infections in the era of multi-resistant bacteria
- Hemangiomatosis of the greater omentum – a case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

