-
Medical journals
- Career
Role chirurgické embolektomie arteria pulmonalis a membránové mimotělní oxygenoterapie v léčbě masivní plicní embolie – přehled
Authors: M. Šimek 1; M. Hutyra 2; M. Gwozdziewicz 1; I. Fluger 1; A. Steriovský 1; J. Konečný 1
Authors‘ workplace: Kardiochirurgická klinika, FN a UP v Olomouci, přednosta: prof. MUDr. V. Lonský, PhD. 1; I. interní klinika – kardiologická, FN a UP v Olomouci, přednosta: prof. MUDr. M. Táborský, CSc. 2
Published in: Rozhl. Chir., 2015, roč. 94, č. 3, s. 103-110.
Category: Review
Overview
Mortalita nemocných s masivní plicní embolií se pohybuje mezi 25−53 %. V trombolytické éře je chirurgická embolektomie stále vnímána jako rescue léčba pro nemocné, kterým nelze absolutně podat trombolytikum nebo jeho podání nevede ke zlepšení hemodynamiky. Recentně publikované výsledky chirurgické léčby prolomily hranici 10 % hospitalizační mortality. Ve srovnání s 20−30% mortalitou nemocných operovaných před 20 lety to znamená významné zlepšení výsledků, za kterými stojí těsná mezioborová spolupráce, přesnější stratifikace nemocných k jednotlivým typům reperfuzní terapie, standardizace chirurgického přístupu a především zahrnutí mechanické srdeční podpory do léčebného algoritmu. Srdeční zástava společně s refrakterním kardiogenním šokem zůstávají i nadále negativními prediktory přežití masivní plicní embolie s 65−73% mortalitou. Veno-arteriální mimotělní membránová oxygenoterapie umožňuje rychlou stabilizaci pravostranné obstrukční hemodynamiky a zajištění adekvátní perfuze a oxygenace cílových orgánů. Následně je možné dokončit morfologickou diagnostiku a zvolit vhodnou reperfuzní strategii, eventuálně k ní nemocné transportovat. Tento souhrnný článek se zaměřuje na vymezení role chirurgické embolektomie arteria pulmonalis a mimotělní membránové oxygenoterapie v léčbě masivní plicní embolie a shrnuje současný pohled na indikace a kontraindikace těchto léčebných strategií a jejich výsledků.
Klíčová slova:
masivní plicní embolie – chirurgická embolektomie – mimotělní membránová oxygenoterapieÚvod
Masivní plicní embolie (PE) manifestující se oběhovou nestabilitou (pokles absolutní hodnoty STK pod 90 mm Hg nebo STK >40 mm Hg od jeho aktuální hodnoty po dobu nejméně 15 min. při vyloučení jiné možné příhody) je zatížena 25−53% mortalitou [1]. Dvě třetiny nemocných umírají do 2 hodin od prvních příznaků. Navíc přítomnost oběhové zástavy, u PE typicky pod obrazem asystolie nebo bezpulzové elektrické aktivity, predikuje až 65−73% mortalitu [1,2]. Oběhová nestabilita doprovází 10−15 % akutních PE dle dat z registrů [3,4]. Samotná dysfunkce pravé komory srdeční (PK) definovaná její dilatací (poměr diametru PK/LK >0,9), poruchou kinetiky (typicky volné stěny při zachování dobré funkce hrotu) či laboratorními známkami myocytární léze představuje nezávislý prediktor úmrtí, a to i u hemodynamicky stabilních nemocných s akutní PE, stratifikovaných do skupiny submasivní PE [5].
Metody
Patofyziologie
Historicky je známo, že náhlý uzávěr více než 50 % plicního řečiště vede u nemocných bez předchozího postižení plicní cirkulace či myokardiální funkce PK k hemodynamické nestabilitě [6]. Vztaženo k hodnotám tlaků v arteria pulmonalis (AP), náhlý vzestup systolického tlaku nad 50 mm Hg nebo středního tlaku nad 33 mm Hg v důsledku akutní obstrukce vede následně k poklesu srdečního výdeje [7]. Tyto hodnoty představují 75 % maximální akutní kompenzační schopnosti PK [8]. Takto významná obstrukce plicního řečiště limituje plnění a výdej levé srdeční komory (LK) do systémového a koronárního řečiště, na kterém se negativně uplatňují i dilatace a porucha kinetiky PK (ventrikulární interpedence) [5,8]. Bezprostřední kompenzační mechanismy, Frank-Starlingův mechanismus a aktivace sympatiku (pozitivně inotropní a chronotropní efekt, periferní vasokonstrikce) nejsou schopny zajistit dostatečný srdeční výdej a perfuzi cílových orgánů. Společně s perfuzí plic je alterována i plicní oxygenační funkce v důsledku ventilačně-perfuzního nepoměru. Kompenzační plicní hypoxická vasokonstrikce následně potencuje vzestup tlaků v AP [5].
Historie chirurgické embolektomie arteria pulmonalis
Technika chirurgické embolektomie arteria pulmonalis (CHPE) byla vypracována Fridrichem Trendelenburgem, který o ní referoval v roce 1908 na zasedání německé chirurgické společnosti [9]. Po sérii pokusů na zvířatech, kdy se nejdříve pokoušel aspirovat emboly z kmene plicnice incizí vedenou výtokovým traktem PK, navrhl přímé otevření kmene AP. Důraz byl kladen hlavně na rychlost, se kterou mělo být přistoupeno k výkonu od příznaků (<15 min), provedena incize kmene AP (90−120 s) a povolena komprese výtokového traktu PK (<45 s). Přístup byl proveden přes sternální úpony 2. anebo 3. žebra z levého parasternálního řezu ve tvaru ležícího T. Po vertikální incizi perikardu před bráničním nervem byla gumová hadička protažena za plicnicí a aortou příčným sinem. Kmen AP byl otevřen z 0,75−1 cm dlouhé incize vedené anterolaterálně. Tahem za hadičku byl omezen průtok plicnicí a vmetky byly vytaženy polypovými kleštěmi. Sutura incize byla provedena pokračujícím stehem na šikmo naložené svorce [10]. Trendelenburg operoval touto technikou dva nemocné, první zemřel bezprostředně po výkonu z důvodu masivní krevní ztráty a druhý 37 hodin od výkonu [10]. První dokumentovaný případ přežití výkonu a propuštění nemocného byl popsán až v roce 1924 Martinem Kirschnerem, Trendelenburgovým žákem [11]. Je nutné dodat, že výkony byly prováděny na moribundních nemocných, pouze na základě klinické diagnózy a prakticky bez jakéhokoliv zajištění či dokonce anestezie. Do roku 1957 bylo v literatuře popsáno 300 provedených chirurgických embolektomií, pouze 12 nemocných se dožilo propuštění domů [10]. Z popisu jednotlivých autorů je zřejmé, že nemalá část nemocných byla operována pro jinou příčinu kritického stavu, protože embolický materiál nebyl nalezen. CHPE byla v 50.−60. letech minulého století modifikována o uzávěr dutých žil (vtoková stáza) a přístup ze střední sternotomie [10]. Až s klinickou dostupností mimotělního oběhu (MTO) svitla naděje na zlepšení výsledků [12]. První úspěšnou embolektomii s použitím MTO provedl Sharp v roce 1962 [13].
Současná technika chirurgické embolektomie arteria pulmonalis
Standardně je CHPE prováděna ze střední podélné sternotomie s použitím mimotělního oběhu. Žilní drenáž a možnost přístupu do pravostranných oddílů je zajištěna separátní kanylací obou dutých žil, návratová arteriální kanyla je umístěna do proximální části vzestupné aorty. Výkon je veden v mírné nebo střední hypotermii. Mezi chirurgy není jednota v jeho provedení v kardioplegické zástavě nebo na bijícím či fibrilujícím srdci, kdy se předpokládá neprohloubení ischemie již dysfunkční PK. Na druhou stranu kardioplegická zástava zvyšuje operační komfort, usnadňuje extrakci embolů a především dovoluje preciznější inspekci plicního řečiště a pravostranných srdečních oddílů [14]. Data, která by srovnávala výsledky výkonů provedených na zastaveném nebo bijícím srdci, nejsou dostupná. Z větších publikovaných souborů vyplývá ekvivalentní četnost použití obou technik v jednotlivých souborech [14,15,16]. Přístup k centrálnímu pulmonálnímu řečišti je dnes volen podobně jako u endarterectomie AP. Kmen, levá AP a její lobární větve jsou revidovány z incize začínající asi 2 cm nad pulmonální chlopní a přecházející na levou AP. Pravostranné povodí je následně vizualizováno ze separátní incize vedené na pravé AP po mobilizaci horní duté žíly. Emboly jsou odstraněny mechanicky nebo šetrně s použitím chirurgického sání (Obr. 1). Nedoporučuje se ostrá instrumentace ani použití Fogartyho katétru pro extrakci periferně uložených vmetků, a to z důvodu rizika krvácení z bronchiálního stromu [14]. Někteří autoři doporučují použití flexibilního angioskopu pro revizi lobárních a segmentálních větví AP při výkonů s cílem odstranění všech dosažitelných embolů [17]. Manuální komprese obou plicních křídel nebo lépe retrográdní plicní perfuze mohou napomoci odstranit periferně uložené vmetky [18]. Retrográdní perfuze plic je vedena katétrem zavedeným do levé síně nebo jsou separátně kanylována jednotlivá ústí plicních žil [19]. Zastánci této techniky argumentují významnějším poklesem tlaků v AP nejen v perioperačním období, ale i v dlouhodobém sledování. Navíc poukazují i na pozitivní ovlivnění dlouhodobé mortality [20]. Pravostranné oddíly jsou přehlédnuty z pravostranné atriotomie, přítomná interatriální patologie (foramen ovale aperum – FOA, defekt septa síní – DSS) je uzavřena stehem nebo záplatou [14,16].
Image 1. Chirurgicky odstraněný žilní embolus Fig. 1. Surgically removed venous embolus 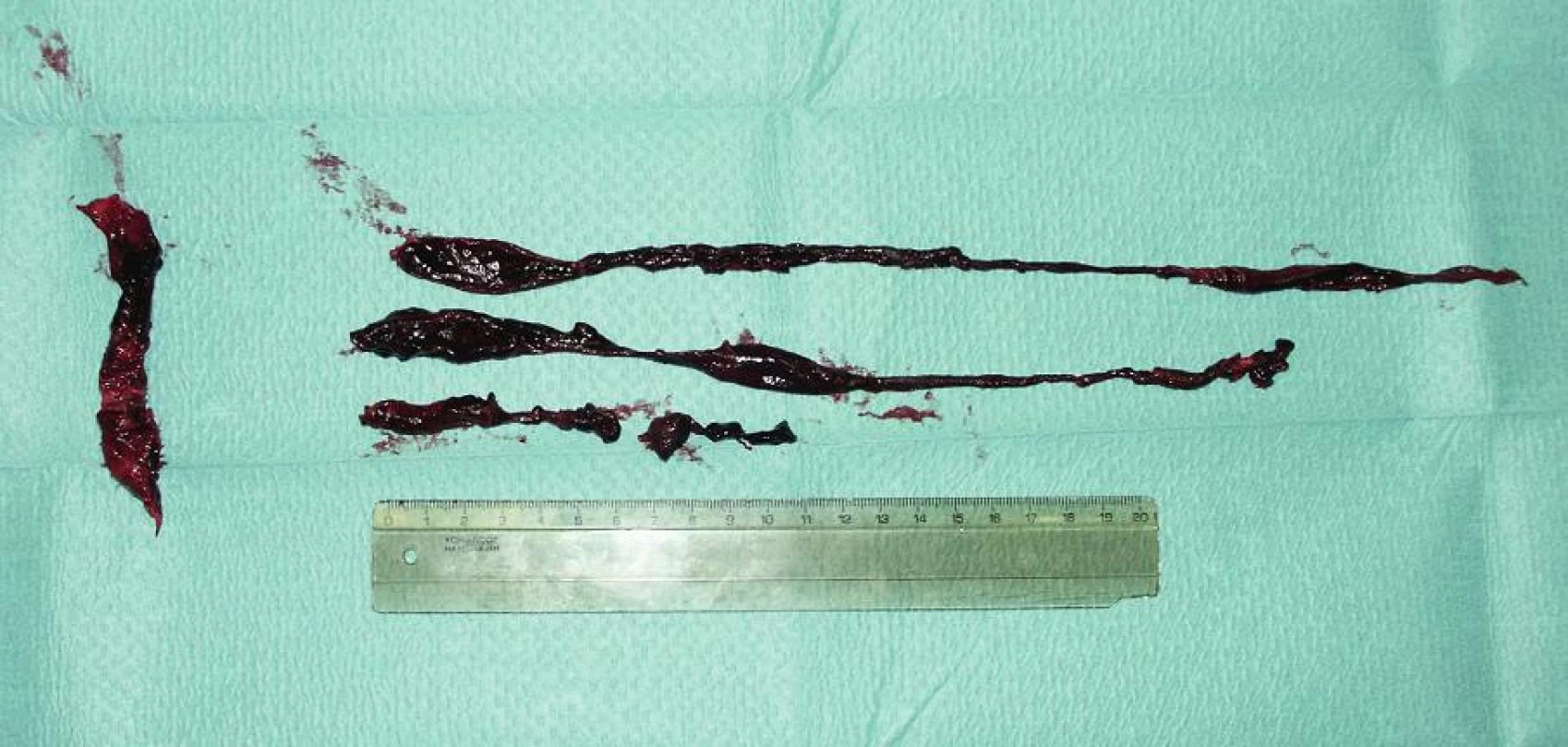
Hlavní komplikace výkonu představují krvácení a přetrvávající dysfunkce PK. Krvácení z chirurgických incizí je potencováno hypokoagulačním stavem v souvislosti s podáním heparinu. Navíc u 30−40 % nemocných je CHPE indikována s různým časovým intervalem od podání TL [14]. Účinek heparinu je antagonizován podáním protamin sulfátu, deplece srážecích faktorů a fibrinolýza jsou ovlivnitelné hemosubstitucí a podáním antifibrinolytik. Krvácení z bronchiálního stromu je velmi závažnou komplikací CHPE. K poranění dochází v souvislosti s chirurgickou instrumentací především při snaze odstranit periferně uložené vmetky. Svoji roli rovněž sehrává i hypoxicko-reperfuzní plicní postižení [14,17]. Masivní bronchiální krvácení vyžaduje selektivní plicní ventilaci, bronchoskopicky asistovaný uzávěr příslušného laloku nebo plicního křídla a vyšší hodnoty postexpiračního tlaku (PEEP). Pokud je třeba pro zabezpečení dostatečné výměny plynů volit velmi agresivní ventilační režim včetně vysokého hodnoty PEEP, která zhoršuje plnění PK, je třeba zvážit zavedení mimotělní membránové oxygenoterapie (ECMO) s preferencí veno-venózního napojení [14].
Pokles tlaků v AP po odstranění centrální obstrukce, inotropní podpora, plicní vasodilatace navozená inhibitory fosfodiesterázy nebo inhalací oxidu dusnatého jsou většinou dostatečné k podpoře funkce PK. Rozsáhlé periferní formy embolizace či těžká dysfunkce PK, která vyžadovala vysokou farmakologickou podporu nebo zavedení mechanické podpory před chirurgickým výkonem, si mohou vyžádat zavedení nebo pokračování v mechanické podpoře pro odpojení z MTO [14,16]. Prosté zavedení pravostranné mechanické podpory (RVAD) s výtokem neokysličené krve do AP se nejeví jako optimální, a to z důvodu rizika dalšího vzestupu tlaků v PA v důsledku přítomné periferní vaskulární obstrukce. Na této se mohou podílet jednak periferně lokalizované vmetky, tak i plicní hypoxicko-perfuzní postižení. Hrozí další zhoršení oxygenační funkce plic v důsledku rozvoje plicního edému nebo krvácení z bronchiálního stromu [21]. Vložení oxygenátoru do okruhu RVAD (RVAD-ECMO) vede ke zlepšení systémové oxygenace a poklesu tlaků v AP prostřednictvím ovlivnění hypoxické plicní vasokonstrikce. Pravděpodobně jako nejvýhodnější z hlediska ovlivnění pravostranné obstrukční hemodynamiky a plné oxygenační podpory se jeví ECMO ve veno-arteriální konfiguraci (V-A ECMO), které navíc při periferním zavedení umožní i trvalý uzávěr sternotomie [21,22]. Na druhou stranu použití oxygenátoru vyžaduje účinnou hodnotu antikoagulace a zvyšuje riziko krvácení [22].
Výsledky chirurgické embolektomie arteria pulmonalis s použitím MTO
Výsledky prvních souborů nemocných z konce 70. let minulého století ukázaly 50% hospitalizační mortalitu, bylo-li přistoupeno k výkonu za oběhové zástavy, úmrtnost dosáhla prakticky 100 % [23]. Samoukovic et al. metaanalyzoval publikované výsledky 1370 nemocných operovaných od roku 1968 do roku 2008 s kumulativní mortalitou 28 %. Ve srovnání mezi lety 1968−1989, 1990−1999 a 2000−2008 došlo k poklesu celkové mortality z 35 % na 30 %, respektive 19,1 %. V souboru bylo přibližně 30 % nemocných indikovaných v srdeční zástavě s 55% mortalitou [24]. K obdobným výsledkům došel i Stein et al. při obdobné metaanalýze dat mezi roky 1961 až 2006, kdy byl zaznamenán pokles mortality z 32 % na 20 %. Pouze u 19 % nemocných byla podána TL před provedením CHPE [25].
V posledních 15 letech lze i přes heterogenitu v publikovaných souborech dokumentovat agresivnější chirurgický přístup v léčbě masivní PE. Aklog et al. referoval v souboru 29 nemocných operovaných v letech 1999−2002 10,3 % 30denní a 13,7 % jednoroční mortalitu. Nicméně v souboru byli pouze 2 nemocní indikovaní po předchozím selhání TL a 1 nemocný se srdeční zástavou. U ostatních byly přítomné buď kontraindikace TL, nebo byla chirurgická léčba zvážena jako primární volba [26]. Lecche et al. publikoval data 47 chirurgicky embolektomovaných nemocných s 6% celkovou hospitalizační mortalitou. Dokumentovaná srdeční zástava nesla 33% mortalitu. Dvě třetiny nemocných byly indikovány z důvodu kontraindikace nebo selhání TL, u 81 % nemocných byl zaveden kavální filtr během vlastního výkonu [27]. Podobné výsledky ve skupině 25 nemocných publikoval Kadner et al. V souboru popsal 8% 30denní mortalitu, předoperační zástava oběhu byla shledána opět nezávislým prediktorem úmrtí s 25% mortalitou [28]. Vohra et al. publikoval výsledky 21 nemocných operovaných v rozmezí let 2001−2010 s 19% hospitalizační mortalitou. Nutno podotknout, že 80 % nemocných bylo operováno na MTO, u 20 % nemocných byla použita technika okluze dutých žil. Celkově přežívalo 77 % nemocných 5 let od výkonu [29]. Pozoruhodné výsledky SPE publikoval Fukuda et al. V souboru 19 nemocných, z nichž 4 (21 %) měli iniciálně dokumentovánu srdeční zástavu, dosáhl 5,3% kumulativní hospitalizační mortality. Dva nemocní (10 %) se zástavou oběhu byli k výkonu překlenuti na mechanické podpoře (V-A ECMO). Nicméně do souboru byli zahrnuti i nemocní se submasivní PE stratifikovaní do vysokého rizika a s vhodným morfologickým nálezem, kontraindikacemi nebo selháním TL. 83,5 % nemocných přežívalo 10 let od výkonu [30]. Recentně publikoval Zarrabi et al. v souboru 30 nemocných celkovou 6,6% hospitalizační mortalitu. Z 3 nemocných indikovaných v srdeční zástavě jeden zemřel (33% mortalita). U všech nemocných byla provedena retrográdní perfuze plic oxygenovanou krví z MTO. Byl dokumentován významný perioperační pokles systolického tlaku v AP (44,9±5,7 vs. 34,9±7,1 mm Hg, p <0,001) [18]. Během 10letého sledování bylo zaznamenáno 82,8% přežívání v souboru s dalším významným poklesem tlaku v AP (29,4±11,5 mmHg, p <0,001) [31]. Recentní výsledky v nejrizikovější skupině nemocných s masivní PE publikoval Takahashi al. U 24 nemocných, z nichž 19 (79,2 %) bylo v kardiogenním šoku a 11 (45,6 %) mělo zdokumentovanou srdeční zástavu, bylo dosaženo 12,5% hospitalizační mortality. 16 nemocných (66,7 %) bylo k výkonu přemostěno na mechanické podpoře (V-A ECMO), ve které bylo po výkonu pokračováno pro ireverzibilní dysfunkci PK u 10 nemocných (41,2 %). V rámci 5letého sledování nezemřel žádný nemocný (87,5% kumulativní přežívání) a rovněž byl dokumentován signifikantní pokles tlaku v AP během sledování (66,9 vs. 28,5 mm Hg, p <0,01) [32].
Indikace chirurgické embolektomie arteria pulmonalis
Primární indikaci představují nemocní s masivní PE mající absolutní kontraindikaci podání TL [1,5]. U 8 % nemocných nevede podání TL ke zlepšení hemodynamického stavu a jako druhá volba reperfuzní strategie by měla být preferována CHPE v logisticky nejkratší době [5,33]. Dále je třeba zvažovat CHPE u masivní PE s přítomností volných trombů v pravostranných srdečních oddílech, zvláště je-li přítomna patologie interatriálního septa (foramen ovale apertum – FOA, defekt septa síní – DSS) [14,34]. Data z recentně publikovaných souborech chirurgicky embolektovaných nemocných ukazují výraznou heterogenitu v četnosti jednotlivých indikací. 40−60 % nemocných bylo indikováno z důvodu kontraindikace TL, 10–40 % pro selhání této léčby, 5−10 % z jiné indikace [28,29,30]. Pro upřednostnění CHPE před opakovaným podáním TL mluví nižší hospitalizační (3,6 % vs. 26,5 %, p <0,02) a střednědobá mortalita (17,9 % vs. 36,4 %). I když je riziko závažných krvácení srovnatelné (3,6 % vs. 4,4 %, NS), opakované podání TL vede k signifikantně vyššímu riziku nezávažného krvácení (4,6 % vs. 26, 5%, p <0,01) ve srovnání s CHPE. Rovněž riziko recidivy PE u chirurgicky léčených nemocných je významně nižší ve srovnání s opakovaným podáním TL (0 % vs. 35 %, p <0,01) [35]. Přítomnost mobilních trombů v pravostranných srdečních oddílech predikuje až 80% mortalitu u masivní PE. FOA >4 mm či DSS významně zvyšují riziko úmrtí (RR 2,4), rozvoje ischemické CMP (RR 5,9) nebo periferní embolizace (RR 5,2) [36]. Většina autorů se z důvodu rizika paradoxní embolizace kloní při přítomnosti velkých mobilních intrakardiálních trombů či významné zkratové vadě k provedení CHPE i u nemocných se submasivní PE [14,34,35]. Indikace a kontraindikace reperfuzní léčby masivní plicní embolie shrnuje Tab. 1.
Table 1. Indikace a kontraindikace reperfuzní léčby akutní masivní plicní embolie Tab. 1. Reperfusion strategies of massive acute pulmonary embolism 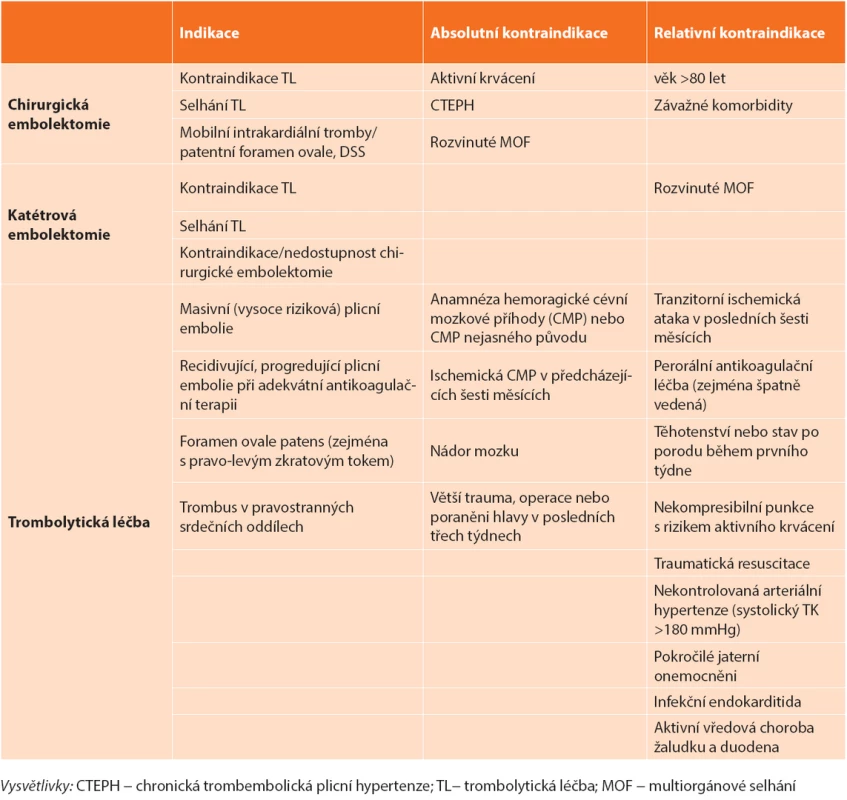
Z morfologického hlediska jsou k chirurgickému řešení indikovány centrální či paracentrální embolizace postihující kmen plicnice, plicní tepny, eventuálně odstupy lobárních tepen [14]. Typickým scénářem je parciální obstrukce kmene plicnice, sedlovitý trombus v místě bifurkace plicních tepen nebo kompletní obstrukce jedné hlavní plicní tepny (index obstrukce AP >0,5) (Obr. 2). V diagnostice sehrává ústřední roli CT angiografie (CTAG), která kromě přesného posouzení postižení plicního řečiště až po úroveň plicních subsegmentálních arterií umožňuje posoudit dysfunkci PK (LK/PK poměr >0,9), prokázat přítomnost intrakardiálních embolů či vyloučit jinou nitrohrudní patologii [37]. Na podkladě bed-side transtorakální echokardiografie (TTE) lze s vysokou pravděpodobností pomýšlet na PE při známkách plicní hypertenze a dysfunkce PK, nelze však indikovat CHPE bez doplnění CTAG, plicní angiografie, eventuálně transezofageální echokardiografie (TEE) [5]. Ta je schopna zobrazit centrální postižení plicnice (kmen, bifurkaci plicních tepen), ale hlavně vyloučit interatriální či intrakardiální patologii. Navíc ji lze použít k diagnostice perioperačně vzniklých PE a k hodnocení funkce a náplně PK při managementu odpojení od MTO [5].
Image 2. CT angiografie paracentrální formy plicní embolizace Fig. 2. CT angiography of centrally located pulmonary embolism 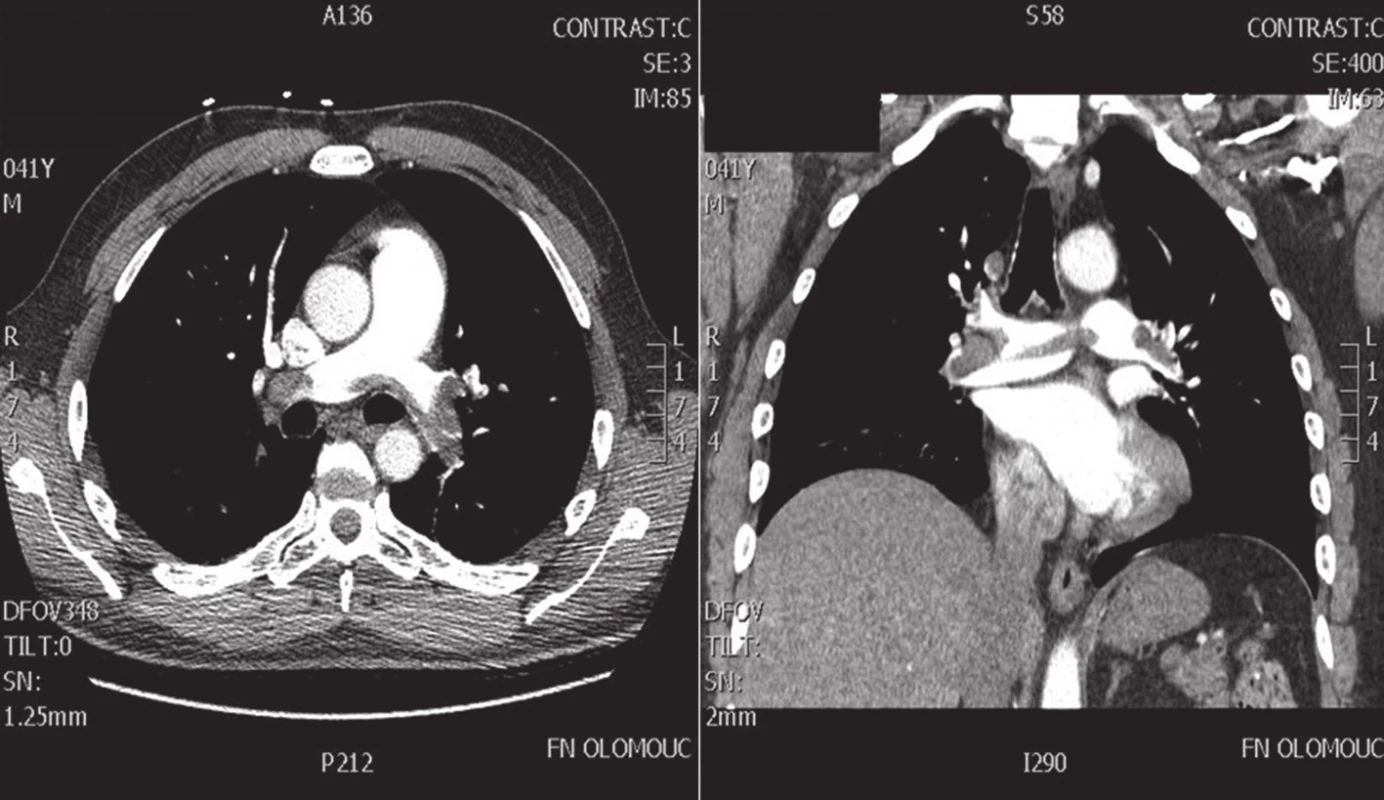
Za absolutní kontraindikaci CHPE je dnes považováno závažné aktivní krvácení z důvodu nutnosti plné antikoagulace heparinem pro vedení MTO a masivní PE vzniklé na podkladě chronické trombembolické plicní hypertenze (CTEPH) [34,35]. U nemocných se srdeční zástavou nebo refrakterním kardiogenním šokem s kontraindikací nebo selháním podání TL by mělo být primárně uvažováno o zavedení perkutánní mechanické podpory (V-A ECMO), zvláště pokud nebyla dokončena morfologická diagnostika či není možné bezprostřední provedení CHPE. Zástava oběhu a prolongovaná KPR představují nejvýznamnější negativní prognostické faktory výsledku CHPE [3,4]. K individuálnímu zvážení zůstává indikace u nemocných v pokročilém věku (>80 let), se známkami multiorgánové dysfunkce a závažnými komorbiditami. Neuspokojivé výsledky u těchto skupin nemocných nás nabádají spíše k volbě jiné reperfuzní strategie [24,25]. Na druhou stranu nemocní, kteří splňují indikaci, mají být bezprostředně konzultováni v příslušných kardiovaskulárních centrech, protože CHPE je prováděna dnes výhradně kardiochirurgickými pracovišti.
Role mimotělní membránové oxygenoterapie (ECMO) v managementu masivní PE
Masivní PE demonstrující se zástavou oběhu nebo refrakterním kardiogenním šokem nemá bez rychlé reperfuzní léčby větší naději na přežití. Konvenční léčba zahrnuje KPR, iniciační dávku heparinu, inotropní a vasopresorickou podporu a na základě vysokého klinického podezření nebo lépe bed-side TTE podání TL, nejsou-li přítomné absolutní kontraindikace jejího podání [1,34]. I tak se mortalita této skupiny nemocných pohybuje podle registrů v rozmezí 55−70 % [3,4].
Mimotělní membránová oxygenoterapie (ECMO) se vyvinula na podkladě miniaturizace a zjednodušení standardního přístroje pro MTO. Rozšířením o možnost periferní perkutánní kanylace cév a mobilnost systému je umožněno napojení nemocných i mimo operační sál a jejich intra - či interinstitucionální transport na podpoře. Pro oběhovou podporu (veno-arteriální konfigurace, V-A ECMO) je vstupní venózní kanyla zavedena cestou femorální žíly optimálně do místa odstupu dolní duté žíly z pravé síně. Žilní krev je do systému nasávána podtlakem centrifugální pumpy, která zároveň generuje i nepulzatilní dopředný tok. Krev je před návratem do tepenného řečiště cestou kanylované periferní tepny (arteria femoralis/subclavia) oxygenována v membránovém oxygenátoru. Ke smísení oxygenované krve z ECMO okruhu a krve nemocného dochází na úrovni aortálního oblouku v závislosti na velikosti srdečního výdeje LK a průtoku centrifugální pumpy (Obr. 3). Moderní maloobjemové centrifugální pumpy, antitrombotické potažení vnitřních povrchů a polymetylpentenová neporézní membrána oxygenátoru dedikují dlouhou životnost ECMO okruhu (14−28 dnů) a jeho nízkou trombogenitu. Při dostatečném žilním návratu je centrifugální pumpa schopna zabezpečit průtok mezi 4−6 l/min a prakticky nahradit funkci LK. Kapacita oxygenátoru je při tomto průtoku schopna plně nahradit oxygenační a dekarboxylační funkci plic. Plně funkční V-A ECMO zajistí nejen dostatečnou perfuzi, ale i oxygenaci cílových orgánů, což je velmi výhodné právě u pravostranné obstrukční hemodynamiky. Navíc V-A ECMO nezvyšuje tlaky v AP, jeho výkon není limitován omezením plnění LK a pozitivně ovlivňuje hypoxickou plicní vasokonstrikci [22]. Spuštění ECMO je podmíněno účinnou hodnotou antikoagulace (ACT 180−200s, aPTT >50 s), které je většinou spolehlivě dosaženo iniciálně podanou dávkou heparinu v rámci léčby PE.
Image 3. Schéma napojení V-A ECMO Fig. 3. Diagram of the V-A ECMO circuit 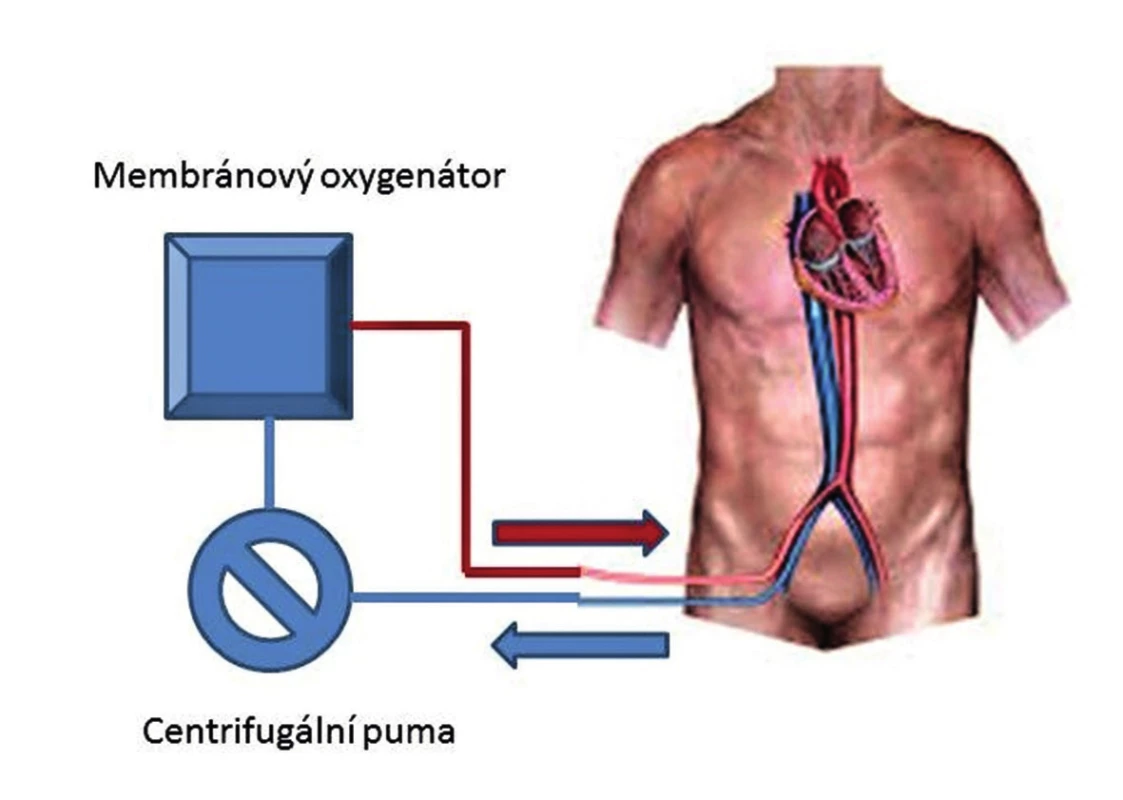
V-A ECMO není kauzální léčbou masivní PE. Umožňuje stabilizovat hemodynamiku a zajistit tkáňovou oxygenaci a tím získat čas potřebný k dokončení diagnostiky, k volbě a provedení reperfuzní terapie nebo úpravě funkce PK [38]. Historicky bylo V-A ECMO nejdříve použito u nemocných, kdy se po provedené CHPE nezdařilo odpojení od MTO z důvodu selhání funkce PK. Kanylace byla vedena centrálně cestou pravé síně a ascendentní aorty. Nevýhodou byla nutnost následné revize s odstraněním kanyl, vyšší riziko krvácení a infekce sternotomie [39].
Rozvíjející se zkušenost s periferně zavedeným V-A ECMO ukazuje na možnost ovlivnění mortality nejrizikovější skupiny nemocných s masivní PE demonstrující se refrakterním kardiogenním šokem nebo srdeční zástavou. V centrech s kardiochirurgickým zázemím je většina nemocných napojených na ECMO směřována při vhodném morfologickém nálezu k provedení CHPE [40]. Není-li CHPE dostupná nebo nemocný není její vhodný kandidát, nabízí se možnost provedení katetrizační plicní embolektomie (KPE) či ponechání nemocného na ECMO podpoře a antikoagulační léčbě heparinem [40]. Podání plné nebo i redukované dávky TL na ECMO je možné, nicméně velmi rizikové z hlediska závažného krvácení v místě zavedených kanyl nebo intracerebrálního krvácení [41]. Navíc je třeba respektovat kontraindikace napojení na ECMO podporu (Tab. 2).
Table 2. Indikace a kontraindikace V-A ECMO u nemocných s masivní plicní embolií Tab. 2. Indications and contraindications of V-A ECMO for the treatment of massive acute pulmonary embolism 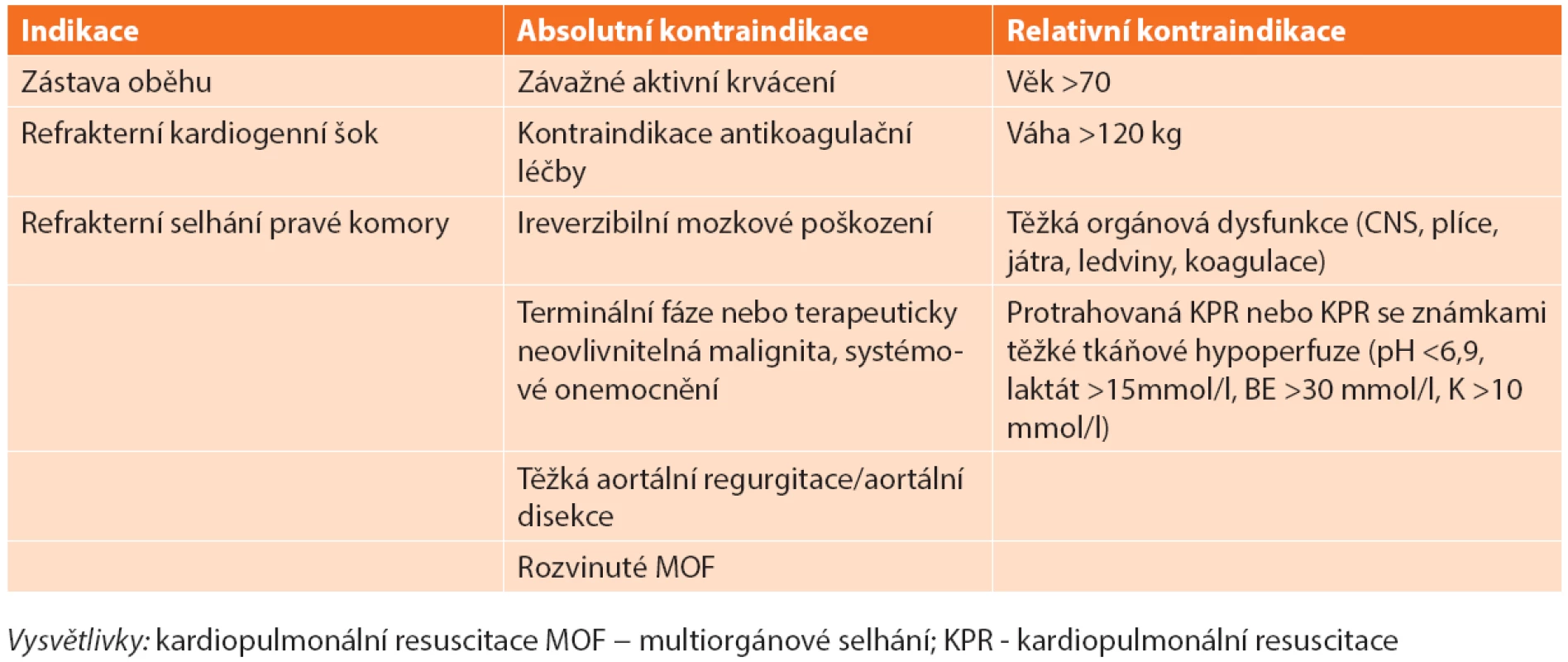
První větší zkušenost s použitím ECMO v managementu masivní PE publikoval Maggio et al. V nesourodém souboru 21 nemocných bylo 6 nemocných napojeno v srdeční zástavě, 13 v kardiogenním šoku z důvodu selhání TL, 2 nemocní byli napojeni po CHPE pro refrakterní selhání PK. Hospitalizační mortalita v souboru dosáhla 38 %. U 10 ze 13 přeživších došlo ke spontánní fibrinolýze trombembolů na antikoagulační terapii. U 3 nemocných byla provedena CHPE, dvakrát byl prokázán trombofilní stav a u jednoho nemocného šlo o embolizaci tumorózních hmot. Průměrná doba ECMO podpory dosáhla 5,4 dne. Použití ECMO bylo spojeno s významnými komplikacemi zahrnující 38 % krvácivých příhod včetně 18 % intracerebrálních hemorrhagií, 24 % nemocných vyžadovalo hemodialýzu [42]. Nejrozsáhlejší publikovaný soubor shrnuje výsledky 198 nemocných s masivní PE napojených na ECMO podporu v japonských centrech z důvodu srdeční zástavy nebo refrakterního kardiogenního šoku. 35 % nemocných bylo na ECMO překlenuto k CHPE a 24 % ke KPE. Celkem 76 % nemocných dostalo TL před nebo během napojení na ECMO a 10 % nemocných bylo ponecháno pouze na antikoagulační terapii. Kumulativní mortalita dosáhla v souboru 29 %, 14 % u nemocných napojených v kardiogenním šoku a 35 % v srdeční zástavě (p <0,001). Mezi jednotlivými reperfuzními strategiemi nebyl shledán statistický rozdíl v mortalitě. Krvácivé komplikace byly zaznamenány u 74 % nemocných, 38 % z míst kanylace a 19 % mozkových krvácení. U 56 % nemocných došlo k selhání renálních funkcí [41]. Hashiba et al. srovnával výsledky 36 nemocných napojených na ECMO v rámci resuscitace (mimotělní orgánová resuscitace, ECPR) pro masivní PE a akutní IM (AIM). Ve skupině PE byla signifikantně vyšší pravděpodobnost úspěšného odpojení od podpory (100 % vs. 37,5 %, p <0,01), nižší sledovaná hospitalizační mortalita (83,3 % vs. 12,5 %, pn <0,001) a lepší dosažení uspokojivého neurologického výsledku (58,3 % vs. 6,3 %, p <0,01) ve srovnání s AIM. 42 % nemocných bylo ponecháno pouze na antikoagulační léčbě heparinem, 42 % dostalo TL a 26 % nemocných podstoupilo CHPE. Ve skupině AIM všichni podstoupili urgentní PCI [43].
Závěr
I v trombolytické éře má chirurgická léčba pevné místo v managementu masivní PE. Nemocní s verifikovaným centrálním/paracentrálním postižením, kontraindikacemi podání TL (či její podání nevedlo ke zlepšení hemodynamiky) jsou hlavními kandidáty CHPE. Výsledky v posledních 10 letech ukazují na pokles v hospitalizační mortalitě chirurgicky embolektomovaných nemocných pod 10 %. Srdeční zástava společně s refrakterním kardiogenním šokem zůstávají i nadále negativními prediktory přežití masivní PE. Za zlepšením výsledků stojí těsná mezioborová spolupráce v rámci center, přesnější stratifikace nemocných k jednotlivým typům reperfuzní terapie a také zahrnutí mechanické srdeční podpory do léčebného algoritmu. Perkutánně zavedená V-A ECMO podpora umožňuje rychlou stabilizaci hemodynamiky, orgánové perfuze a oxygenace. Následně je možně dokončit morfologickou diagnostiku a zvolit vhodnou reperfuzní strategii, eventuálně k ní nemocné transportovat.
Práce byla podpořena programem institucionální podpory MZ ČR č.1 RVO-FNOL2014.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Martin Šimek, PhD.
Prof. Fuky 8
779 00 Olomouc
e-mail: martin.simek@fnol.cz
Sources
1. Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation 2011;26 : 123−60.
2. Kucher N, Rossi E, De Rosa M, et al. Massive pulmonary embolism. Circulation 2006;113 : 577–82.
3. Goldhaber SZ, Visani L, De Rosa M. Acute pulmonary embolism: Clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999;353 : 1386−9.
4. Kasper W, Konstantinides S, Geibel A, et al. Management strategies and determinants of outcome in acute major pulmonary embolism: results of a multicenter registry. J Am Coll Cardiol 1997;30 : 1165–71.
5. Belohlavek J, Dytrych V, Linhart A. Pulmonary embolism, part I: Epidemiology, risk factors and risk stratification, pathophysiology, clinical presentation, diagnosis and nonthrombotic pulmonary embolism. Exp Clin Cardiol 2013;18 : 129−38.
6. McIntyre KM, Sasaharra AA. The hemodynamic response to pulmonary embolism in patients without prior cardiopulmonary disease. Am J Cardiol 1971; 28 : 288−94.
7. Toosi MS, Merlino JD, Leeper KV. Prognostic value of the shock index along with transthoracic echocardiography in risk stratification of patients with acute pulmonary embolism. Am J Cardiol 2008;101 : 700−5.
8. Kudlička J, Mlček M, Hála P, et al. Pig model of pulmonary embolism: where is the hemodynamic break point? Physiol Res 2013;62:S173−9.
9. Trendelenburg F. über die operative Behandlung der Embolie der Lungenarterie. Archiv für Klinische Chirurgie 1908; 86 : 686−700.
10. Meyer JA. Friedrich Trendelenburg and the surgical approach to massive pulmonary embolism. Arch Surg 1990;125 : 1202−5.
11. Kirschner M. Ein durch die Trendelenburgische operation geheilter fall von embolie der art. pulmonalis. Archiv für klinische Chirurgie 1924;133 : 312−359.
12. Cooley DA, Beall AC, Alexander JK. Acute massive pulmonary embolism. Successful surgical treatment using temporary cardiopulmonary bypass. JAMA 1961;177 : 283−6.
13. Sharp EH. Pulmonary embolectomy: successful removal of a massive pulmonary embolus with the support of cardiopulmonary bypass. Ann Surg 1962;156 : 1−4.
14. Cheng He, Von Segesser L, Kappetein PA, et al. Acute pulmonary embolectomy. Eur J Cardiothorac Surg 2013;43 : 1087−95.
15. Clarke DB, Abrams LB. Pulmonary embolectomy: a 25 year experience. J Thorac Cardiovasc Surg 1986;92 : 442–5.
16. Stein PD, Alnas M, Beemath A, et al. Outcome of pulmonary embolectomy. Am J Cardiol 2007;99 : 421–3.
17. Eini ZM, Houri S, Cohen I, et al. Massive pulmonary emboli in children: does fiber-optic-guided embolectomy have a role? Review of the literature and report of two cases Chest 2013;143 : 544−9.
18. Nemec P, Uchytil B, Cerný J, et al. Surgical treatment of pulmonary embolism. Vnitr Lek 2009;55 : 779–82.
19. Spagnolo S, Grasso MA, Tesler UF. Retrograde pulmonary perfusion improves results in pulmonary embolectomy for massive pulmonaryembolism. Tex Heart Inst J 2006;33 : 473–6.
20. Zarrabi K, Yarmohammadi H, Ostovan MA, Retrograde pulmonary embolectomy in massive pulmonary embolism. Eur J Cardiothorac Surg 2005;28 : 897−9.
21. Berman M, Tsui S, Vuylsteke A, et al. Life-threatening right ventricular failure in pulmonary hypertension: RVAD or ECMO? J Heart Lung Transplant 2008;27 : 1188−9.
22. Belohlavek J, Rohn V, Jansa P, et al. Veno-arterial ECMO in severe acute right ventricular failure with pulmonary obstructive hemodynamic pattern. J Invasive Cardiol 2010;22 : 365−9.
23. Cooley DA, Beall AC. Embolectomy for acute massive pulmonary embolism. Surg Gynecol Obstet 1968;126 : 805−10.
24. Samoukovic G, Malas T, deVarennes B. The role of pulmonary embolectomy in the treatment of acute pulmonary embolism: a literature review from 1968 to 2008. Interact Cardiovasc Thorac Surg 2010;11 : 265−70.
25. Stein PD, Alnas M, Beemath A, et al. Outcome of pulmonary embolectomy. Am J Cardiol 2007;99 : 421–3.
26. Aklog L, Williams CS, Byrne JG, Et al. Acute pulmonary embolectomy: a contemporary approach. Circulation 2002;105 : 141−69.
27. Leacche M, Unic D, Goldhaber SZ, et al. Modern surgical treatment of massive pulmonary embolism: results in 47 consecutive patients afterrapid diagnosis and aggressive surgical approach. J Thorac Cardiovasc Surg 2005;129 : 1018−23.
28. Kadner A, Schmidli J, Schönhoff F, et al. Excellent outcome after surgical treatment of massive pulmonary embolism in critically ill patients. J Thorac Cardiovasc Surg 2008;136 : 448−51.
29. Vohra HA, Whistance RN, Mattam K, et al. Early and late clinical outcomes of pulmonary embolectomy for acute massive pulmonary embolism. Ann Thorac Surg 2010;90 : 1747−52.
30. Fukuda I, Taniguchi S, Fukui K, et al. Improved outcome of surgical pulmonary embolectomy by aggressive intervention for critically ill patients. Ann Thorac Surg 2011;91 : 728−32.
31. Zarrabi K, Zolghadrasli A, Ostovan MA, et al. Residual pulmonary hypertension after retrograde pulmonary embolectomy: long-term follow-up of 30 patients with massive and submassive pulmonary embolism. Interact Cardiovasc Thorac Surg 2013;17 : 242−6.
32. Takahashi H, Okada K, Matsumori M, et al. Aggressive surgical treatment of acute pulmonary embolism with circulatory collapse. Ann Thorac Surg 2012;94 : 785−91.
33. Meneveau N, Seronde MF, Blonde MC, et al. Management of unsuccessful thrombolysis in acute massive pulmonary embolism. Chest 2006;129 : 1043–50.
34. Belohlávek J, Dytrych V, Linhart A. Pulmonary embolism, part II: Management. Exp Clin Cardiol 2013;18 : 139−47.
35. Aymard T, Kadner A, Widmer A, et al. Massive pulmonary embolism: surgical embolectomy versus thrombolytic therapy – should surgical indications be revisited? Eur J Cardiothorac Surg 2013;43 : 90−5.
36. Konstantinides S, Geibel A, Kasper W, et al. Patent foramen ovale is an important predictor of adverse outcome in patients with major pulmonary embolism. Circulation 1998;97 : 1946–51.
37. Findik S, Erkan L, Light RW, et al. Massive pulmonary emboli and CT pulmonary angiography. Respiration 2008;76 : 403–12.
38. Misawa Y. Extracorporeal membrane oxygenation support for acute pulmonary embolism. Circulation 2004;109:e229.
39. Davies MJ, Arsiwala SS, Moore HM, et al. Extraporeal membrane oxygenation for the treatment of massive pulmonary embolism. Ann Thorac Surg 1995;60 : 1801−3.
40. Wu MY, Liu YC, Tseng YH, et al. Pulmonary embolectomy in high-risk acute pulmonary embolism: the effectiveness of a comprehensive therapeutic algorithm including extracorporeal life support. Resuscitation 2013;84 : 1365−70.
41. Sakuma M, Nakamura M, Yamada N, et al. Percutaneous cardiopulmonary support for the treatment of acute pulmonary embolism: summarized review of the literature in Japan including our own experience. Ann Vasc Dis 2009;2 : 7−16.
42. Maggio P, Hemmila M, Haft, J, et al. Extracorporeal life support for massive pulmonary embolism. J Trauma 2007;62 : 570−6.
43. Hashiba K, Okuda J, Maejima N, et al. Percutaneous cardiopulmonary support in pulmonary embolism with cardiac arrest. Resuscitation 2012;83 : 183−7.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2015 Issue 3-
All articles in this issue
- Funkční poruchy po resekci rekta
- Role chirurgické embolektomie arteria pulmonalis a membránové mimotělní oxygenoterapie v léčbě masivní plicní embolie – přehled
- Možnosti korekcie recidívy pectus excavatum u dospelých pacientov a adolescentov
- Vynechání disekce axily u karcinomu prsu při pozitivní sentinelové uzlině – pilotní studie
- Neúspěšná lymfoscintigrafie před sentinelovou biopsií u karcinomu prsu, možné příčiny a důsledky pro chirurgický výkon – analýza výsledků 3014 vyšetření
- Pozdní vznik hematomu jater po deceleračním traumatu
- První retransplantace plic v České republice
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Funkční poruchy po resekci rekta
- Možnosti korekcie recidívy pectus excavatum u dospelých pacientov a adolescentov
- Vynechání disekce axily u karcinomu prsu při pozitivní sentinelové uzlině – pilotní studie
- Pozdní vznik hematomu jater po deceleračním traumatu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

