-
Medical journals
- Career
Vynechání disekce axily u karcinomu prsu při pozitivní sentinelové uzlině – pilotní studie
: M. Černá 1; I. Zedníková 1; A. Ňaršanská 1; T. Svoboda 2; O. Hes 3; J. Záhlava 4; M. Hlaváčková 4
: Chirurgická klinika FN v Plzni, přednosta: prof. MUDr. V. Třeška, DrSc. 1; Onkologická a radioterapeutická klinika FN v Plzni, přednosta: prof. MUDr. J. Fínek, Ph. D. 2; Šiklův ústav patologie FN v Plzni, přednosta: prof. MUDr. M. Michal 3; Klinika zobrazovacích metod FN v Plzni, přednosta: prof. MUDr. B. Kreuzberg, CSc. 4
: Rozhl. Chir., 2015, roč. 94, č. 3, s. 117-125.
: Original articles
Úvod:
Disekce axily (ALND) představuje standardní postup zajišťující lokoregionální kontrolu při metastatickém postižení sentinelové uzliny (SN). Řada studií již dokazuje, že její vynechání nezhoršuje celkovou prognózu.Metody:
Retrospektivně zpracovaný soubor 249 pacientek v 3letém období s biopsií sentinelové uzliny byl rozdělen do 2 skupin – s negativní, resp. pozitivní SN. Ve sledované skupině s pozitivní SN byly pacientky rozděleny s, resp. bez ALND a hodnoceny další nonsentinelové uzliny při ALND a onkologická léčba. Předmětem bylo srovnání, zda ALND a onkologická léčba ovlivní bezpříznakový interval (DFI) a celkové přežití (OS) u pacientek s pozitivní SN a zda budou vykazovat rozdíly s kontrolní skupinou. Hodnocením histopatologických a biologických vlastností primárního nádoru, charakteru metastázy v SN a počtu metastatických SN bylo snahou určit ty faktory, které lze využít jako prediktory pozitivity nonsentinelových uzlin.Výsledky:
Pozitivní SN je zatížena vysokým procentem pozitivity nonsentinelových uzlin (63 %). Doplnění ALND neprodlužuje DFI ani DFS, není-li zajištěna lokoregionální kontrola pooperační radioterapií a systémovou léčbou, které ovšem dokážou zajistit srovnatelný DFI i DFS bez doplnění ALND. Pacientky s pozitivní SN s, resp. bez ALND dosahují 70, resp. 72 měsíců DFI, 5leté přežití 84 %, resp. 80 %. Za prediktory pozitivity nonsentinelových uzlin lze považovat tumory nad 2 cm, s vysokou proliferační aktivitou a vysokým gradem.Závěr:
Na malém souboru lze dokladovat, že vynechání ALND při metastatickém postižení 1−2 SN bez ohledu na prognostické ukazatele tumoru neovlivňuje DFI ani DFS při následném onkologickém zajištění. Nádory s vysokým gradem, vysokou proliferační aktivitou a rozměrem nad 2 cm mají významně vyšší riziko postižení nonsentinelových uzlin. Vynechání ALND při pozitivní SN není v současnosti léčebnou metodou lege artis, pro vytvoření odborných směrnic jsou požadovány další studie na velkých souborech.Klíčová slova:
pozitivní sentinelová uzlina – vynechání disekce axily – karcinom prsuÚvod
Východiska
Podíváme-li se na léčbu karcinomu mléčné žlázy, zaznamenala v posledních třech desetiletích značný vývoj. Z radikálních a mutilujících mastektomií se postupně v průběhu 80. let 20. století dospělo k převaze prs šetřících chirurgických výkonů (breast conserving surgery = BCS) a ukázalo se, že při onkologickém pooperačním zajištění nabízejí pacientkám stejné přežití jako rozsáhlé chirurgické výkony bez následné onkologické léčby při výrazně nižší morbiditě a nesrovnatelně lepší kvalitě života. Na začátku 90. let 20. století byl vytvořen koncept sentinelové biopsie (SNB), který byl poprvé uveden do praxe u maligního melanomu. V roce 1994 Giuliano poprvé popsal metodu lymfatického mapování a využití techniky při detekci sentinelové uzliny u karcinomu prsu, která představovala zásadní zlom v léčbě časného karcinomu prsu směrem k miniinvazivnímu zákroku v axile při zachování její podstaty jako stagingového výkonu poskytujícího dostatek informací k určení stadia nádorového onemocnění i prognózy. Další studie ukázaly, že pacientky s negativní sentinelovou uzlinou vykazují stejné přežití jako pacientky, které podstoupily disekci axily bez metastatického postižení axilárních uzlin, tzn. že disekce axily (ALND) nepředstavuje pro tyto pacientky žádný benefit, naopak zbytečně přináší riziko pozdních pooperačních komplikací (lymfedém, hypestezie, omezení hybnosti ramenního kloubu). V současné době je technika sentinelové biopsie obecně doporučeným postupem pro léčbu časného karcinomu mléčné žlázy s klinicky i sonograficky negativními uzlinami a absolutní indikace disekce axily zůstává vyhrazena pro pacientky s patologickými uzlinami.
Zároveň protokol histologického zpracování sentinelové uzliny (SN) na rozdíl od většího počtu uzlin získaných disekcí axily umožňuje velmi přesné prokrájení a vyšetření, jež zvyšuje citlivost detekce minimálních nálezů při postižení mikrometastázou či izolovanými nádorovými buňkami (ITC). Přesný axilární staging snižuje riziko podstážování nádorového onemocnění a jako hlavní nezávislý prognostický faktor indikuje nemocnou k adekvátní onkologické léčbě s cílem maximálně prodloužit bezpříznakové i dlouhodobé přežití.
V České republice od začátku fungování mamografického screeningu v roce 2002 je jednoznačně patrný nárůst incidence karcinomu prsu, ale zásadní obrat nastal v zastoupení jednotlivých stadií ve prospěch časných karcinomů. Ty jsou obecně provázeny minimálním postižením axilárních uzlin a ukazuje se, že i při postižení sentinelové uzliny (SN) nejsou po disekci axily v nonsentinelových uzlinách (nonSN) zjištěny další metastázy. To logicky směřuje ke snaze vyčlenit podskupinu pacientek, u nichž bychom při pozitivní sentinelové uzlině, tedy zachování její podstaty stagingového výkonu, nedoplňovali standardně disekci axily bez nepříznivého dopadu na vznik lokoregionální recidivy a celkového přežití [1].
Metody
Soubor pacientů
Byla provedena retrospektivní analýza vlastního souboru v 3letém období od 1. 1. 2006 do 31. 12. 2008, tak aby délka follow-up byla dostatečně dlouhá pro hodnocení bezpříznakového i celkového přežití, zhodnocení rekurence nemoci a vyhodnocení celkové prognózy pacientek s karcinomem prsu ve vztahu ke zvolené problematice. Do studie byly zařazeny všechny pacientky primárně operované pro karcinom prsu. Součástí operace byla biopsie sentinelové uzliny. Pro detekci sentinelové uzliny bylo použito radiofarmakum 99mTc. Vyřazeny byly ty pacientky, které podstoupily neoadjuvantní chemoterapii či byly operovány pro nádorovou recidivu. U každé pacientky byla hodnocena přítomnost metastáz/y v sentinelové uzlině, podle čehož byly pacientky rozděleny do 2 skupin. Hodnocenou skupinu tvořily nemocné s pozitivní sentinelovou uzlinou, srovnávací skupinou byly pacientky bez přítomnosti metastatického postižení. Ve sledované skupině byly dále pacientky rozděleny do 2 skupin, zda podstoupily či nepodstoupily následnou disekci axily (ALND). U pacientek, které podstoupily ALND, byl hodnocen podíl pozitivity nonsentinelových uzlin, jaká následovala adjuvantní onkologická léčba a jak disekce axily ovlivnila prognózu nemocných. Výsledky bezpříznakového a celkového přežití byly porovnávány v rámci sledované skupiny mezi pacientkami s, resp. bez ALND a mezi sledovanou a kontrolní skupinou pacientek bez metastatického postižení sentinelové uzliny.
Sledovanými faktory u všech pacientek byly histopatologické a biologické vlastnosti primárního nádoru; ve sledované skupině charakter metastázy v sentinelové uzlině a počet pozitivních sentinelových uzlin.
Podle patologem popsané velikosti tumoru byly pacientky děleny do skupin pT1a (do 5 mm), pT1b (6−10 mm), pT1c (11−20 mm), pT2 (2−5 cm); podle gradingu na G1 (dobře diferencovaný), G2 (středně diferencovaný) a G3 (špatně diferencovaný); podle přítomnosti exprese HER2/neu na pozitivní či negativní; podle proliferační aktivity (MIB1) na nízkou (do 20 %), středně vysokou (20−40 %) a vysokou (nad 40 %); podle exprese hormonálních receptorů na hormonálně dependentní či bez hormonální závislosti. Posledním sledovaným faktorem byl věk v době stanovení diagnózy.
Ve sledované skupině byly pacientky rozděleny podle počtu pozitivních sentinelových uzlin – s 1, resp. více než 1 pozitivní SN; podle velikosti metastázy – s makrometastázou (větší než 2 mm), mikrometastázou (0,2−2 mm) a izolovanými nádorovými buňkami (menší než 0,2 mm).
Snahou bylo zjistit, které faktory lze využít jako prediktivní ukazatele přítomnosti metastatického postižení sentinelové uzliny, jaké vlastnosti nádoru je možné považovat za nepříznivé pro metastatické postižení nonSN a které z těchto faktorů lze využít při plánování rozsahu chirurgického výkonu na spádových lymfatických uzlinách, tak aby byl zachován jeho prognostický význam a zajištěna řádná lokoregionální kontrola nemoci.
Výsledky
V uvedeném 3letém období bylo na Chirurgické klinice Fakultní nemocnice v Plzni primárně operováno 249 pacientek pro karcinom prsu s mediánem sledování 84 měsíců. U 142 z nich byla provedena biopsie sentinelové uzliny (57 %), u 96 z nich byla provedena primárně disekce axily (39 %), event. nepodstoupily žádný operační zákrok na spádových lymfatických uzlinách (4 %).
Pacientky, které podstoupily SNB, byly rozděleny do 2 skupin. Do sledované skupiny pacientek s metastatickým postižením SN bylo zařazeno 24 žen (17 % všech sentinelových biopsií), do kontrolní skupiny bez metastatického postižení SN bylo zařazeno 118 žen (83 % všech sentinelových biopsií). Ve sledované skupině byla u 6 pacientek nalezena mikrometastáza, což představuje 4 % všech sentinelových biopsií, resp. 17 % všech pozitivních sentinelových biopsií našeho souboru. U 4 pacientek s pozitivní SN byla nalezena metastáza ve 2 LU, u 2 z nich mikrometastáza a u 2 makrometastáza. Pacientky s mikrometastázou již nepodstoupily další operační výkon v axile, obě byly zajištěny adjuvantní radioterapií, hormonální léčbou antiestrogeny, jedna chemoterapií. Obě přežívají v remisi onemocnění s mediánem 84 měsíců. Pacientky s makrometastázou v obou SN podstoupily následně disekci axily, jedna bez dalších pozitivních nonsentinelových uzlin, jedna s postižením dalších 3 LU. Pacientka s negativními nonSN byla ozářena, bez systémové léčby a přežívá v remisi 96 měsíců; pacientka s pozitivními nonSN podstoupila po operaci pouze systémovou léčbu bez lokálního zajištění radioterapií, po 10 měsících došlo k lokální recidivě a po 37 měsících k systémové diseminaci s délkou přežití 39 měsíců. Zhodnocením fenotypových vlastností primárního nádoru se ukazuje, že při postižení více než 1 SN vysoká proliferační aktivita a vysoký grade zvyšují pravděpodobnost pozitivity dalších nonSN.
Ve sledované skupině 24 pacientek s pozitivní SN byla doplněna disekce axily v 19 případech (80 %), v 5 případech (20 %) nebyl výkon v axile extendován. Z 19 disekcí axily bylo ve 12 případech zjištěno postižení další minimálně jedné nonsentinelové uzliny (63 %), v 7 případech (37 %) nebyly zjištěny metastázy v žádné nonsentinelové uzlině. Průměrný počet pozitivních nonsentinelových uzlin byl 3,25 uzliny. V případě mikrometastázy (6 případů) se vždy jednalo o metastázu velikosti 1−2 mm a u 2 pacientek byla doplněna disekce axily (33 %), u zbylých 4 pacientek nebyl v axile proveden žádný další operační zákrok. U pacientek s ALND při mikrometastáze v SN byla nalezena jedna, resp. tři metastaticky postižené nonsentinelové uzliny, v obou případech se jednalo o nález makrometastázy. Nepříznivými vlastnostmi nádoru se v našem souboru ukázala velikost primárního nádoru větší než 2 cm, resp. víceložiskový tumor a vysoká proliferační aktivita. V případě postižení 3 nonSN se jednalo o nádor HER pozitivní a špatně diferencovaný. Obě ženy byly zajištěny pooperační radioterapií i systémovou léčbou, obě přežívají s mediánem 90 měsíců, u jedné byla zjištěna generalizace v intervalu 74 měsíců.
Ve sledované skupině pacientek s pozitivní SN došlo v průběhu sledovaného období 5x k relapsu (21 %), z čehož se 1x jednalo o lokální recidivu po 10 měsících u pacientky, která nepodstoupila pooperační radioterapii. K systémové diseminaci došlo u 5 pacientek s mediánem 51 měsíců. Regionální recidiva nebyla zaznamenána. Zemřely 4 pacientky, 3 z nich (75 %) na generalizaci karcinomu prsu, 1 (25 %) z jiné příčiny. Rozdělením pacientek s pozitivní SN na ty, které nepodstoupily, resp. podstoupily disekci axily, lze dokladovat, že zatímco v podskupině bez ALND s pooperační radioterapií nebyla zjištěna žádná lokální recidiva a medián systémové diseminace je 54 měsíců, v podskupině s doplněním ALND bez adjuvantní radioterapie došlo 1x k lokální recidivě do 1 roku od primární operace a medián generalizace je 40 měsíců. Celkové přežití v obou podskupinách je srovnatelné, pacientky 1. podskupiny bez ALND s radioterapií s mediánem 72 měsíců (6 let), ve 2. podskupině bez radioterapie s ALND 70 měsíců (5 a ¾ roku). Porovnáme-li 5leté přežití, ve sledované skupině pacientek s pozitivní SN v 1. podskupině bez ALND přežívá 80 %, ve 2. podskupině s následnou ALND 84 %; v kontrolní skupině s negativní SN přežívá 5letý interval 95 % pacientek (Tab. 1).
1. Přežití − shrnutí Tab. 1. Survival − summary 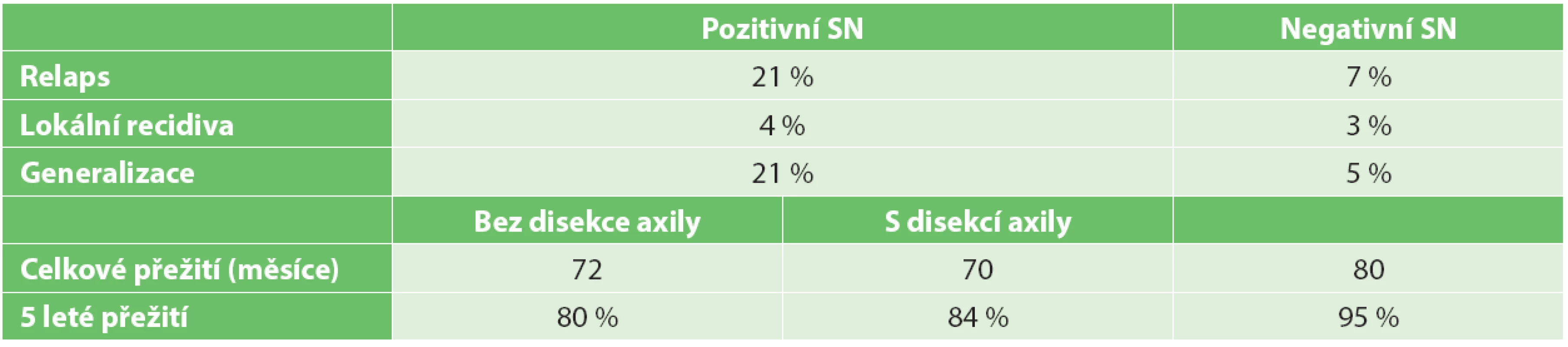
Ve sledované skupině pacientek s pozitivní SN bylo ve 22 případech aplikováno pooperační ozáření prsu a svodných lymfatik (92 %), 2 pacientky byly zajištěny systémovou léčbou bez ozáření (8 %). U pacientek bez adjuvantní radioterapie došlo k relapsu v 50 % s mediánem 64 měsíců lokální recidivy, resp. 50 měsíců generalizace s celkovým přežitím 65 měsíců. Naopak u pacientek s pooperačním ozářením nebyla zjištěna žádná progrese onemocnění s bezpříznakovým i celkovým přežitím 70 měsíců. Systémovou léčbu chemoterapií podstoupilo 17 pacientek s pozitivní SN (71 %), 7 pacientek bylo léčeno bez adjuvantní chemoterapie při zajištění systémovou hormonální terapií a ozářením (29 %). U pacientek bez chemoterapie došlo ve 14 % k relapsu s mediánem 76 měsíců, přežívají s mediánem 78 měsíců. Pacientky léčené adjuvantní chemoterapií přežívají s mediánem 65 měsíců bezpříznakově, resp. 68 měsíců celkově, k relapsu došlo ve 23 % případů. Horší bezpříznakové i celkové přežití (DFI, DFS) u žen s adjuvantní systémovou léčbou lze vysvětlit tím, že se obecně jednalo o nádory s horšími prognostickými vlastnostmi.
Srovnávací skupinu představuje 118 pacientek s negativní SN (83 %). V této skupině došlo 8x k relapsu (8 %), z čehož 4x k lokální recidivě s mediánem 45 měsíců a 6x ke vzdálené diseminaci s mediánem 38,5 měsíce. Zemřelo 5 žen, 1 z nich na generalizaci karcinomu prsu (20 %), 4 z nich z jiné příčiny (80 %). Celkové přežití pacientek bez metastatického postižení SN činí 80 měsíců (6 a ¾ roku).
U všech pacientek, u nichž byla provedena sentinelová biopsie, byly sledovány a hodnoceny vlastnosti nádoru – velikost tumoru, stupeň diferenciace (grading), exprese HER/neu, proliferační aktivita, exprese hormonálních receptorů a věk v době stanovení diagnózy.
Ve sledované skupině žen bylo zjištěno, že nepříznivými prediktivními ukazateli pozitivity SN je nádor velikosti větší než 2 cm (50 % pacientek), špatně diferencovaný – grade 3 (50 % pacientek), s vysokou proliferační aktivitou (50 % pacientek), hormonálně závislé (67 % pacientek). Nebyla zjištěna významnost exprese HER2/neu a průměrný věk žen v době stanovení diagnózy činil 54 let. Ve srovnávací skupině pacientek s negativním SN byly jako příznivé prediktivní faktory zjištěny nádory do velikosti 2 cm (81 % pacientek), dobře diferencované – grade 1 (63 % pacientek), s nízkou proliferační aktivitou (70 % pacientek), hormonálně dependentní (90 % pacientek) a bez přítomnosti exprese HER2/neu (70 % pacientek). Průměrný věk žen s negativní SN v době stanovení diagnózy činil 58 let (Tab. 2).
2. Fenotypové vlastnosti primárního nádoru ve vztahu k pozitivitě sentinelové uzliny Tab. 2. Primary tumour phenotype in relation to metastatic sentinel node positivity 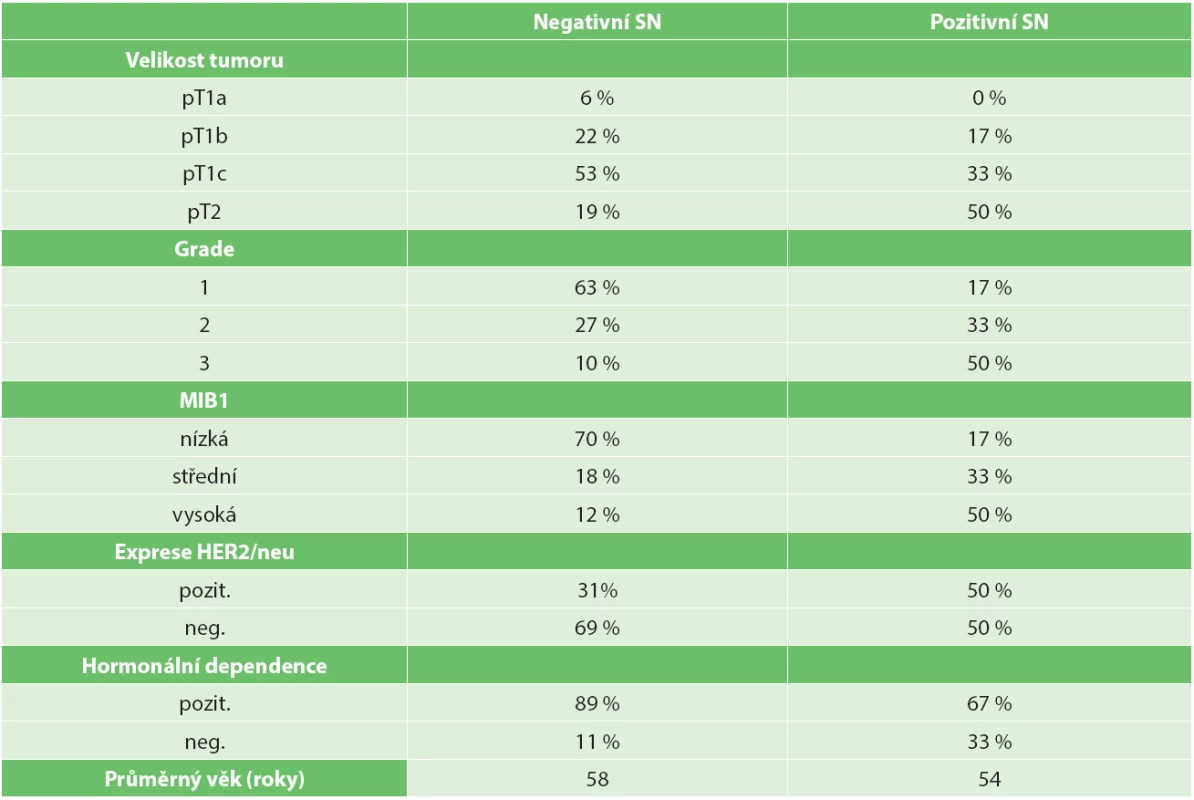
Hodnocením stejných fenotypových vlastností primárního nádoru bylo zjištěno, že nepříznivými prediktivními ukazateli pozitivity nonsentinelových uzlin při pozitivní SN jsou nádory větší než 2 cm (50 % pacientek), resp. větší než 1 cm (83 % pacientek), s vysokým gradem (50 % pacientek), resp. gradem vyšším než 1 (83 % pacientek), s vysokou proliferační aktivitou (50 % pacientek), resp. proliferační aktivitou nad 20 % (83 % pacientek), hormonálně dependentní (66,6 % pacientek). Věk v době stanovení diagnózy nebyl zjištěn jako statisticky významný faktor predikce pozitivity nonsentinelových uzlin (Tab. 3).
3. Fenotypové vlastnosti primárního nádoru ve vztahu k postižení nonsentinelových uzlin při pozitivní sentinelové uzlině Tab. 3. Primary tumour phenotype in relation to the status of non-sentinel lymph nodes in metastatic sentinel node 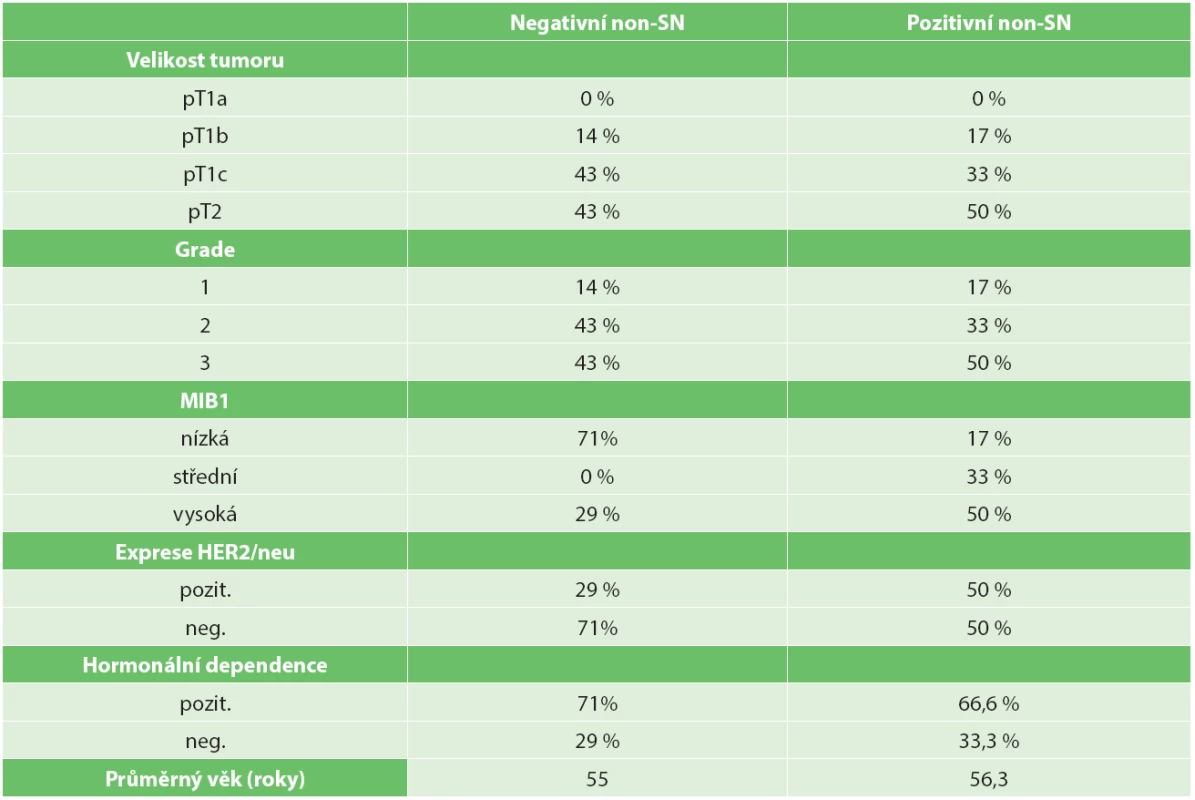
Diskuze
Biopsie sentinelové uzliny je u časného karcinomu prsu v současné době standardem v léčbě a stanovení axilárního stagingu při klinicky negativních uzlinách. Řadou studií a metaanalýz bylo prokázáno, že pacientky s negativní SN mají velmi nízké riziko lokoregionální rekurence (0,3 %) a v porovnání s pacientkami, které podstoupily ALND s negativními axilárními uzlinami, dosahují stejné délky bezpříznakového i celkového přežití při výrazně nižší morbiditě jako následek disekce axily [2]. Z přirozeného vývoje a pozorování výsledků léčby karcinomu prsu vyplývá další otázka: Zda existuje skupina pacientek s pozitivní sentinelovou uzlinou, která bude mít ostatní axilární uzliny bez metastatického postižení, tedy z následné axilární disekce nebude profitovat, a jak takové ženy již před zahájením léčby rozpoznat a neindikovat při pozitivní SN k dokončení disekce axily [3]. Udává se, že 40−70 % pacientek s časným karcinomem má nález axilární metastázy omezen pouze na SN, tedy že přibližně polovina pacientek podstupuje ALND při pozitivní SN zbytečně [4]. Další logickou otázkou je, zda i při metastatickém postižení dalších neexstirpovaných nonsentinelových axilárních uzlin bude v dané skupině pacientek signifikantně horší prognóza, či zda při zajištění lokoregionální kontroly pooperačním ozářením a systémovou onkologickou léčbou bude bezpříznakové a celkové přežití srovnatelné. Tato úvaha vychází z teorie, že přítomnost metastázy v SN je dostatečným kritériem k podání systémové chemoterapie a předpokládá eradikaci potenciálních nádorových buněk v nonSN, tedy zajištění i lokoregionální kontroly.
Na přelomu tisíciletí probíhaly 2 studie zabývající se danou problematikou. Dle Bilimoria et al. (1998−2006) nebyl zjištěn žádný rozdíl v bezpříznakovém intervalu a 5letém přežití u pacientek s pozitivní SN při nálezu makro - i mikrometastázy bez, resp. s dokončením ALND. Studie Yi et al. (1998−2004) přinesla podobné výsledky. Obě studie vnesly do léčby karcinomu prsu nový směr, tj. při nálezu mikrometastázy v SN lze vypustit ALND bez alterace celkové prognózy [5,6].
Ve 21. století navázaly další 3 klíčové studie – Z0011 organizovaná American College of Surgeons Oncology Group, jež randomizuje pacientky do skupin s axilární disekcí, resp. bez axilární disekce při pozitivní SN a porovnává celkové přežití (OS), přežití bez nádorové recidivy (DFS), lokoregionální kontrolu nemoci [7]. Druhá studie EORTC 10981-22023 AMAROS (After Mapping of the Axila: Radiotherapy or Surgery) porovnává efekt pooperačního ozáření vs. ALND v prevenci regionální recidivy při pozitivní SN [8]. Třetí studie organizovaná International Breast Cancer Study Group (IBCSG 23-01) vyhodnocuje prognostický význam mikrometastázy v SN a porovnává výsledky pacientek s, resp. bez ALND [9].
Studie Z0011 vychází z teorie, že až 70 % pacientek s pozitivní SN nebude mít pozitivní další nonsentinelové uzliny, tzn., že u 70 % pacientek nebude mít disekce axily žádný léčebný benefit. Studie randomizovala pacientky s nádory do 5 cm, s klinicky negativními axilárními uzlinami, ženy po konzervativním chirurgickém výkonu na prsu (BCS) a mající 1−2 pozitivní SN do 2 větví – s, resp. bez doplnění ALND při metastatickém postižení SN. Bylo zjištěno, že 27 % pacientek po ALND mělo pozitivní další nonSN, ale za 6leté sledování nebyl prokázán statisticky významný rozdíl ve výskytu lokální recidivy (3,6 %, resp. 1,9 %), regionální recidivy (0,5 %, resp. 0,9 %) při doplnění, resp. bez ALND. 5leté přežití bez projevů nemoci (82,2 %, resp. 83,9 %) i celkové přežití (91,8 %, resp. 92,5 %) jsou srovnatelné při disekci axily, resp. jejím vynechání [7]. Zřejmá nevýhoda celé studie spočívá ve výběru pacientek, které byly ve studii randomizovány. Jednalo se o výběr nemocných s velmi časným karcinomem s dobrými prognostickými vlastnostmi – až 70 % tumorů do 2 cm, 83 % hormonálně dependentní a ve skupině pacientek s vynecháním ALND mělo 45 % mikrometastázu. Všechny pacientky podstoupily pooperační radioterapii. Důsledkem je její omezená extrapolace na širokou populaci žen s karcinomem prsu, přestože její výsledky poměrně jednoznačně prokazují srovnatelné výsledky obou skupin pacientek a dokazují, že při pooperačním ozáření ALND nepřináší stran celkového i bezpříznakového přežití žádný benefit. V závěru studie Z0011 autoři připouštějí bezpečné vynechání disekce axily u prognosticky příznivých nádorů s pooperačním ozářením [10]. Přesto je v současné době stále disekce axily akceptována jako standard léčby při pozitivní SNB [11].
Studie AMAROS probíhající v letech 2001−2010 randomizovala 4806 pacientek s pozitivní SN do 2 větví – s dokončením ALND a pooperačním ozářením (RT) bez dalšího výkonu v axile. Otázkou bylo, zda pooperační radioterapie zajistí srovnatelnou lokální kontrolu jako standardní operační výkon, zda budou srovnatelné výsledky celkového i bezpříznakového intervalu a jaký vliv bude mít léčba na vznik lymfedému. U 1425 pacientek byla pozitivní SN (30 %), 744 (52 %) podstoupilo ALND, 681 (48 %) pooperační ozáření. V období sledování 6,1 roku byla zjištěna regionální rekurence v 0,54 %, resp. 1,03 % při ALND, resp. RT; při negativní SN byla 0,8 %. 5leté celkové přežití bylo 93,3 %, resp. 92,5 % při ALND, resp. RT; bezpříznakové přežití v 5letém období 86,9 %, resp. 82,6 % při ALND, resp. RT. Lymfedém horní končetiny se vyskytoval při ALND ve 40 %, resp. 28 % 1, resp. 5 let po operaci; po RT ve 22 %, resp. 14 %; 1, resp. 5 let po RT. Závěr studie dokladuje RT jako srovnatelnou alternativu ALND pro zajištění lokální kontroly u pacientek s pozitivní SN, ovšem s polovičním podílem lymfedému [8].
Studie IBCSG 23-01 se zabývala problematikou mikrometastáz v SN. Randomizovala 931 pacientek do dvou větví a porovnávala DFI a OS pacientek s ALND, resp. bez ALND. Ve sledovaném intervalu 57 měsíců zaznamenali srovnatelný DFI – 87 %, resp. 88 % i srovnatelné OS − 97,6 %, resp. 98 % ve skupině s, resp. bez ALND. Závěrem studie je možnost vynechat ALND v případě mikrometastatického postižení SN [9].
Obecně se udává přítomnost pozitivních nonSN při postižení SN makrometastázou 30−50 %, resp. 10−20 % mikrometastázou v závislosti na fenotypových vlastnostech nádoru. Snahou řady autorů je definovat, zda existují konkrétní histopatologické a biologické vlastnosti nádoru, a vytvořit nomogram, jenž bude predikovat přítomnost metastatického postižení nonSN [12].
Co do velikosti primárního nádoru se ukázalo, že existuje významný rozdíl v riziku postižení nonSN u nádorů menších, resp. větších než 2 cm. Joseph et al. popisuje významný nárůst pozitivity nonSN již u nádorů větších než 1 cm [13]. Jako nejsilnější nezávislý prognostický faktor byla vyhodnocena přítomnost lymfovaskulární invaze [14]. Celá řada studií hodnotila nálezy v SN, jednak počet pozitivních SN, jednak velikost metastázy ve vztahu k postižení nonSN. Wong et al. [15] a Chu et al. [16] shodně dokumentují vyšší podíl pozitivních nonSN u pacientek s více než 1 pozitivní SN (50 % a 51 %) než při postižení pouze 1 SN (32 % a 30 %). Ke stejným závěrům dochází i Viale et al., z jehož studie je patrné, že při pozitivitě více než 1 SN je pravděpodobnost 56,7% pozitivity nonSN vs. 31,4% při jedné metastatické SN [17]. Celá řada studií se zabývá problematikou velikosti metastázy v SN a jejího charakteru. Velká studie MIRROR zahrnující 2600 pacientek s karcinomem prsu porovnávala prognózu pacientek s negativní SN, s izolovanými nádorovými buňkami (ITC) a mikrometastázou bez ALND bez pooperační radioterapie či systémové léčby. V 5letém sledování byla zjištěna statisticky významně vyšší rekurence při mikrometastáze v SN bez ALND či pooperační radioterapie a jejím závěrem je jednoznačné doporučení pooperačního ozáření při vynechání ALND k zajištění lokální kontroly [18]. Metaanalýza autorů Rutledge et al. a Fournier et al. dospěla ke stejným závěrům, pozitivita nonSN při mikrometastáze byla zjištěna v 5 % vs. 64 % při makrometastáze [19,20]. Podrobněji tuto problematiku zpracoval Rahusen et al., jež rozdělil mikrometastázy do dvou skupin – menší než 1 mm a velikosti 1−2 mm. Popisuje významný rozdíl v incidenci postižení nonSN ve 27 %, resp. 50 % při mikrometastáze do 1 mm, resp. větší než 1 mm [21]. Obdobné výsledky prezentuje Viale et al. 13−17 %, resp. 33−35 % při mikrometastáze do 1 mm, resp. větší než 1 mm [17]. Van Deurzen et al. porovnává incidenci postižení nonSN při nálezu ITC, mikrometastázy a makrometastázy s výsledky incidence pozitivních nonSN 12,5 %, 23 % a 48 % [22]. Podobných výsledků dosahuje i Menes et al. s 46 % pozitivních nonSN při makrometastáze, 20 % při mikrometastáze menší než 2 mm a 19 % při ITC (menší než 0,2 mm) [23]. Boler et al. publikuje pozitivní nonSN v 50 %, 11,5 % a 10 % při makrometastáze, mikrometastáze a ITC [24].
Španělští autoři Pernas et al. a Langer et al. se zabývali ve své práci hodnocením lokální rekurence při vynechání ALND při mikrometastatickém postižení SN. V obou studiích nedošlo v době sledování 60 měsíců, resp. 42 měsíců k žádné lokoregionální recidivě [25,26]. Dutch MIRROR study a Park et al. publikují ve svých studiích 5% podíl regionální rekurence při makrometastáze v SN bez další chirurgické intervence v axile [18], obdobně Gatzemeier et al. (studie Z0011) uvádí 8% riziko regionální rekurence při vynechání ALND [7]. Extrakapsulárním šířením metastázy v SN se zabývali ve své studii Ozmen et al. a Boler et al. Jejich výsledky podporují teorii, že extrakapsulární šíření metastázy v SN představuje silně nepříznivý prognostický faktor pro přítomnost metastáz v nonSN (65,4 % a 70 % vs. 33,3 % a 23,6 %, neproniká-li metastáza přes pouzdro uzliny) [27,24].
Dengel et al. na velkém souboru 2157 pacientek podpořil poznatek, že při pozitivitě více než 3 SN a šíření metastázy extrakapsulárně dosahuje riziko postižení nonSN až 85 %. Naopak grading, hormonální status, HER pozitivita či věk nebyly shledány jako prediktivní ukazatelé vyžadující ALND při pozitivní SN [28].
Turner a den Bakker se zabývali problematiku stupně diferenciace primárního nádoru jako rizikového faktoru a z jejich závěrů je patrné, že vysoký grade statisticky významně zvyšuje riziko metastatického postižení nonSN [29].
Shrnutím dosavadních poznatků vytvořila pracovní skupina venezuelských autorů práci, jejíž podstatou je vytvoření guidelines, umožňujících vynechání ALND při pozitivní SN, resp. upravila pravidla z roku 2010, která považovala ALND při pozitivní SN za standardní léčebný postup. Současná doporučení dovolují vynechání ALND při klinicky negativních uzlinách a splnění všech následujících kritérií: tumor menší než 2 cm (pT1), 1−2 pozitivní SN, nepřítomnost lymfangioinvaze, hormonální dependence, zajištění pooperační radio - a chemoterapie. Vynechání ALND se obecně nedoporučuje u triple negativního karcinomu, při expresi HER 2/neu bez možnosti podání trastuzumabu (Herceptin) a u pacientek podstupujících primárně mastektomii [14].
Práce Harlow et al. z roku 2014 shrnuje indikace SLNB, která je absolutně indikována v léčbě karcinomu prsu při klinicky negativních axilárních uzlinách. Dovoluje ji zcela vynechat, pokud informace o axilárním stagingu nemá rozhodující význam pro adjuvantní léčbu (např. ženy nad 70 let s nádory do 2 cm, hormonálně dependentní). Nález ITC je považován za prognosticky srovnatelný s negativní SN a v současné době není indikace k ALND, RT ani adjuvantní chemoterapii. Nález mikrometastázy nevyžaduje ALND v případě pooperačního ozáření; bez RT vyžaduje ALND pro statisticky významně vyšší riziko lokální rekurence proti negativní SN či ITC. ALND je primárně indikována pro klinicky pozitivní axilární uzliny a nález mikro - i makrometastázy ve 3 a více SN. Diskutabilní a nedořešenou otázkou zůstává postižení 1−2 SN mikro - či makrometastázou. Vzhledem k tomu, že metastatické postižení axilárních uzlin je indikací k systémové léčbě postihující reziduální nádorovou nemoc včetně axilárních uzlin, není již pozitivní SN absolutní indikací k ALND při vyhodnocení fenotypových vlastností primárního nádoru a charakteru metastáz v SN [30].
Z našich výsledků vyplývá relativně vysoké procento pozitivity nonsentinelových uzlin při pozitivní SN (63 %), překvapivě i při mikrometastatickém postižení. Již při pozitivitě 2 SN makrometastázou byly v 50 % metastatické nonSN; při nálezu mikrometastázy ve 2 SN nebyla v našem souboru u žádné pacientky doplněna ALND, nicméně při pooperačním zajištění systémovou léčbou i ozářením nebyla zjištěna žádná rekurence.
Ve sledované skupině pacientek s pozitivním SN jsme zaznamenali celkově 3x častější rekurenci onemocnění vs. v kontrolní skupině pacientek s negativní SN; lokální recidiva byla pozorována v průměru o 3 roky později při negativní SN, systémová diseminace 4x častěji při pozitivní SN, ale v průměru byla diagnostikována o 1 rok později pravděpodobně v důsledku adjuvantní systémové onkologické léčby. U pacientek s pozitivní SN byla pozorována významně vyšší mortalita na generalizaci karcinomu prsu než v kontrolní skupině.
Pacientky s pozitivní SN, jenž nepodstoupily ALND, ale byly zajištěny adjuvantní RT, nezaznamenaly ve sledovaném období žádnou lokální recidivu – na rozdíl od pacientek s ALND bez pooperační RT, u nichž byla zjištěna v intervalu do 1 roku. V našem souboru nebyl potvrzen příznivý vliv ALND na prodloužení DFI, naopak pooperační radioterapie a systémová léčba prodloužily DFI o 14 měsíců. Celkové přežití v obou skupinách je srovnatelné − 72, resp. 70 měsíců bez, resp. s ALND; 5leté přežití 80 %, resp. 84 % bez, resp. s ALND. Patrný je rozdíl v celkovém, resp. 5letém přežití při srovnání s kontrolní skupinou 80 měsíců, resp. 95 % (Graf 1).
1. 5leté přežití – srovnání sledované a kontrolní skupiny Graph 1. 5-year survival – comparison of the studied and control group 
Můžeme potvrdit příznivý efekt pooperační RT na vznik lokální recidivy, jenž nebyla v našem souboru při pozitivní SN bez ALND zjištěna. Zajištění adjuvantní chemoterapií nepřineslo v našem souboru delší interval systémové diseminace ani prodloužení DFS při pozitivní SN, což předpokládáme jako důsledek prognosticky horších nádorů indikovaných k adjuvantní chemoterapii. Pacientky s prognosticky příznivějšími nádory bez pooperační chemoterapie při pozitivní SN, jenž byly zajištěny hormonální terapií a ozářením, vykazují o 11, resp. 10 měsíců delší DFI a DFS.
Histopatologické a biologické vlastnosti nádoru byly hodnoceny samostatně, nikoliv multivariační analýzou. Ve shodě s velkými studiemi můžeme potvrdit, že nepříznivými prediktivními ukazateli pozitivity nonSN při pozitivní SN jsou nádory větší než 2 cm, víceložiskové nádory s vysokým gradem a vysokou proliferační aktivitou. Stejné faktory byly prokázány jako rizikové pro predikci pozitivity SN.
Závěr
Naše výsledky na malém souboru pacientek mohou podpořit závěry studií na velkých souborech. Metastatické postižení axilárních uzlin je nesporně významným nepříznivým prognostickým faktorem stran bezpříznakového i celkového přežití, nicméně nám se nepodařilo prokázat, že doplnění ALND vede k prodloužení DFI a DFS, ba naopak skupina pacientek s pozitivní SN bez ALND s pooperačním zajištěním RT a systémovou léčbou vykazuje delší DFI i DFS. Vynechání ALND při pozitivní SN s pooperační RT a systémovou léčbou lze připustit u prognosticky příznivých nádorů (tumor menší než 2 cm, grade 1, proliferační aktivita do 20 %, hormonální dependence a nepřítomnost exprese HER2/neu), stejně jako při postižení 1−2 SN mikrometastázou. Ukazuje se, že ani negativní prediktivní ukazatelé nádoru (pT2, G3, vysoká proliferační aktivita) a metastatické postižení 1−2 SN makrometastázou nemusí být vždy absolutní indikací k ALND. Kratší DFI i DFS u těchto nádorů vychází z podstaty nepříznivých biologických vlastností a nám se nepodařilo prokázat prodloužení 5letého ani celkového přežití doplněním ALND u pacientek s pozitivní SN.
V současné době vynechání ALND při pozitivní SN není standardním postupem v léčbě karcinomu prsu a zajisté pro vytvoření odborných směrnic připouštějících tento léčebný postup jako lege artis bude zapotřebí dalších prospektivních studií na velkých souborech. V současné době lze připustit vynechání disekce axily u vybraných pacientek, je-li komplexní léčba plánována multioborově v čele s onkologem. Sbírání a zpracování těchto dat je nezbytné pro selekci skupiny pacientek, u nichž v budoucnu ALND při pozitivní SN nepřinese žádný léčebný benefit.
Seznam zkratek:
ALND − disekce axily
BCS − breast-conserving surgery = prs záchovný chirurgický výkon
DFI − disease free interval = bezpříznakový interval
DFS − disease free survival = bezpříznakové přežití
ITC − isolated tumour cells = izolované nádorové buňky
LU − vlymfatická uzlina/y
nonSN − nesentinelové uzliny
OS − overall survival = celkové přežití
RT − radioterapie
SN − sentinelová uzlina/y
SNB − biopsie sentinelové uzliny
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Monika Černá, Ph.D.
Jižní Svahy 805
330 27 Vejprnice
e-mail: cernamo@fnplzen.cz
Sources
1. Vrána D, Gatěk J, Cwiertka K, et al. Další postupný ústup od axilární disekce u časného karcinomu prsu. Klin Onkol 2014;27 : 143−5.
2. Wang Z, Wu LC, Chen JQ. Sentinel lymph node biopsy compared with axillary lymph node dissection in early breast cancer: a meta-analysis. Breast Cancer Res Treat 2011;129 : 675−89.
3. Guenther JM, Hansen NM, DiFronzo LA, et al. Axillary dissection is not required for all patients with breast cancer and positive sentinel nodes. Arch Surg 2003;138 : 52–6.
4. Kamath V, Giuliano R, Dauway E, et al. Characteristics of the sentinel lymph node in breast cancer predict further involvement of higher-echelon nodes in the axilla: a study to evaluate the need for complete axillary lymph node dissection. Arch Surg 2001;136 : 688–92.
5. Bilimoria KY, Bentrem DJ, Hansen NM, et al. Comparison of sentinel lymph node biopsy alone and completion axillary lymph node dissection for node-positive breast cancer. J Clin Oncol 2009;27 : 2946−53.
6. Yi M, Giordano SH, Meric-Bernstam F, et al. Trends in and outcomes from sentinel lymph node biopsy (SLNB) alone vs. SLNB with axillary lymph node dissection for node-positive breast cancer patients: experience from the SEER database. Ann Surg Oncol 2010;17 Suppl 3 : 343−51.
7. Gatzemeier W, Mann GB. Which sentinel lymph-node positive breast cancer patient needs an axillary lymph-node dissection ACOSOG Z0011 results and beyond. Breast 2013;22 : 211−6.
8. EORTC study shows radiotherapy and surgery provide excellent regional control for breast cancer patients. Dostupný z WWW: http://www.eortc.org/news/eortc-study-shows-radiotherapy-and-surgery-provide-excellent-regional-control-breast-cancer-pat.
9. Galimberti V, Cole BF, Zurrida S, et al. International Breast Cancer Study Group Trial 23-01 investigators. Axillary dissection versus no axillary dissection in patients with sentinel-node micrometastases (IBCSG 23-01): a phase 3 randomised controlled trial. Lancet Oncol 2013;14 : 297−305.
10. Krsička P, Coufal O, Zapletal O. Pozitivní sentinelová uzlina u karcinomu prsu – kdy a proč doplňovat axilární disekci? Rozhl Chir 2013;92 : 684−9.
11. Latosinsky S, Berrang TS, Cutter CS, et al. Axillary dissection versus no axillary dissection in women with invasive breast cancer and sentinel node metastasis. Can J Surg 2012;55 : 66−9.
12. Kotoč J, Kotočová K, Gatěk J, et al. Mikrometastáza v sentinelové uzlině – nutnost disekce axilárních uzlin? Prakt Lék 2009;89 : 587−90.
13. Joseph KA, El-Tamer M, Komenaka I, et al. Predictors of nonsentinel node metastasis in patients with breast cancer after sentinel node metastasis. Arch Surg 2004;139 : 648−51.
14. Abreu EB, Martinez P, Betancourt L, et al. Treatment plan for breast cancer with sentinel node metastasis. Ecancermedicalscience 2014;8 : 383.
15. Wong SL, Edwards MJ, Chao C, et al. Predicting the status of the nonsentinel axillary nodes. Arch Surg 2001;136 : 563−8.
16. Chu KU, Turner RR, Hansen NM, et al. Do all patients with sentinel node metastasis from breast carcinoma need komplete axillary node dissection? Ann Surg 1999;229 : 536–41.
17. Viale G, Maiorano E, Mazzarol G, et al. Histologic detection and clinical implications of micrometastasis in axillary sentinel lymph nodes for patiens with breast carcinoma. Cancer 2001;92 : 1378−84.
18. Tjan-Heijnen V, Pepels M, Boer M, et al. Impact of omission of completion axillaries lymph node dissection or axillaries radiotherapy in breast cancer patients with micro metastasis or isolated tumor cells in the sentinel lymph node: results from the MIRROR study. J Clin Oncol 2009;27 : 18.
19. Rutledge H, Davis J, Chiu R, et al. Sentinel node micrometastasis in breast carcinoma may not be an indication for komplete axillary dissection. Mod Pathol 2005;18 : 762−8.
20. Fournier K, Schiller A, Perry RR, et al. Micrometastasis in the sentinel lymph node of breast cancer does not mandate completion axillary dissection. Ann Surg 2004;239 : 859−65.
21. Rahusen FD, Torrenga H, van Diest PJ, et al. Predictive factors for metastatic involvement of nonsentinel nodes in patiens with breast cancer. Arch Surg 2001;136 : 1059−63.
22. van Deurzen CH, van Hillegersberg R, Hobbelink MG, et al. Predictive value of tumor load in breast cancer sentinel lymf nodes for second echelon lymph node metastases. Cell Oncol 2007;29 : 497−505.
23. Menes TS, Tartter PI, Mizrachi H, et al. Breast cancer patients with pN0(iţ) and pN1(mi) sentinel nodes have high rate of nonsentinel node metastases. J Am Coll Surg 2005;200 : 323−7.
24. Boler DE, Uras C, Ince U, et al. Factors predicting the non-sentinel lymph node involvement in breast cancer patients with sentinel lymph node metastases. Breast 2012;21 : 518−23.
25. Pernas S, Gil M, Benítez A, et al. Avoiding axillary treatment in sentinel lymph node micrometastases of breast cancer: a prospective analysis of axillary or distant recurrence. Ann Surg Oncol 2010;17 : 772–7.
26. Langer I, Marti WR, Guller U, et al. Axillary recurrence rate in breast cancer patients with negative sentinel lymph node (SLN) or SLN micrometastases: prospective analysis of 150 patients after SLN biopsy. Ann Surg 2005;241 : 152–8.
27. Ozmen V, Karanlik H, Cabioglu N, et al. Factors predicting the sentinel and non-sentinel lymph node metastases in breast cancer. Breast Cancer Res Treat 2006;95 : 1−6.
28. Dengel LT, Van Zee KJ, King TA, et al. Axillary dissection can be avoided in the majority of clinically node-negative patients undergoing breast-conserving therapy. Ann Surg Oncol 2014;21 : 22−7.
29. Turner RR, Ku Chu, Qi K, et al. Pathologic features associated with nonsentinel lymph node metastases in patients with metastatic breast carcinoma in a sentinel lymph node. Cancer 2000;89 : 574−81.
30. Harlow SP, Weaver DL. Sentinel lymph node dissection for breast cancer: Indications and outcomes. Dostupné z WWW: http://www.uptodate.com/contents/sentinel-lymph-node-dissection-for-breast-cancer-indications-and-outco
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2015 Issue 3-
All articles in this issue
- Low anterior resection syndrome
- The role of surgical embolectomy and extracorporeal membrane oxygen therapy in the treatment of massive pulmonary embolism – a review
- Surgical repair of recurrent pectus excavatum in adults and adolescents
- Avoidance of axillary lymph node dissection in breast cancer patients with metastatic sentinel node – a pilot study
- Failed preoperative lymphoscintigraphy for sentinel lymph node biopsy in breast cancer, possible causes and implications for the surgery – the analysis of 3014 procedures
- Delayed liver hematoma development following deceleration injury
- The first lung re-transplantation in the Czech Republic
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Low anterior resection syndrome
- Surgical repair of recurrent pectus excavatum in adults and adolescents
- Avoidance of axillary lymph node dissection in breast cancer patients with metastatic sentinel node – a pilot study
- Delayed liver hematoma development following deceleration injury
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

