-
Medical journals
- Career
Kombinovaný chirurgický management infekce hemodialyzačního cévního přístupu bakteriologickým agens Clostridium perfringens
Authors: MUDr. David Janák, Ph.D.; R. Novotný; M. Slavíková; T. Grus; J. Lindner
Authors‘ workplace: II. chirurgická klinika-kardiovaskulární chirurgie, 1. lékařská fakulta, Univerzita Karlova v Praze a Všeobecná fakultní nemocnice v Praze, přednosta: Prof. MUDr. J. Lindner, CSc.
Published in: Rozhl. Chir., 2014, roč. 93, č. 6, s. 325-327.
Category: Case Report
Overview
Infekce protetických hemodialyzačních (HD) píštělí je jedna z nejčastějších komplikací cévních přístupů u hemodialyzovaných pacientů. Výskyt anaerobní infekce je velmi vzácný. Management léčby je v tomto případě pro chirurga velkou výzvou. Referujeme komplikovaný případ infikované autologní hemodialyzační píštěle Clostridiem perfringens na pravém předloktí u polymorbidní pacientky s chronickým renálním selháním a myelodysplastickým syndromem. Pacientka po opakovaném založení HD píštěle s následnými polybakteriálními lokálními infekčními komplikacemi. V terénu infekčních komplikací se vyvinula destruktivní klostridiová infekce. U této velmi vzácné infekční komplikace netypickým bakt. agens je nutná včasná diagnostika a komplexní multimodalitní péče zahrnující chirurgickou, antibiotickou a podpůrnou terapii. Klinické implikace a optimální terapie u těchto případů nejsou přesně stanoveny.
Klíčová slova:
cévní přístup infekce – Clostridium perfringensÚvod
Celosvětová populace především v západních státech vyspělého světa stárne a tomu odpovídá i vzrůstající výskyt chronického renálního selhání a potřeba zajištění adekvátního cévního přístupu pro hemodialyzační procedury. V rozvinutých evropských zemích tvoří hemodialyzovaní pacienti 0,02–0,08 % celkové populace. Pro chronickou dialýzu je u pacientů indikováno založení arteriovenózního cévního hemodialyzačního přístupu. V dnešní době jsou přesně stanovena kritéria pro založení arteriovenózních (AV) píštělí, zahrnující komplexní pohled na pacienta vycházející z klinického stavu, úrovně renálního selhání, dominance končetiny a kvality použitelných autologních žilních štěpů versus protetických náhrad, jakožto štěpů druhé volby. Velké množství AV a protetických píštělí v celosvětové hemodialyzační populaci vede ke vzniku různorodých komplikací. Mezi komplikace provázející pacienty s HD AV píštělí patří intimální hyperplazie venózní anastomózy, krvácení z píštěle, stenóza píštěle, perigraft serom, otok končetiny, pseudoaneuryzma, tepenný steal fenomén, trombóza, neuropatie a infekční komplikace. Infekční komplikace protetických, ale i autologních píštělí mohou být velmi nepříjemné a mohou mít díky častým komorbiditám u pacientů s HD terapií fatální následky.
Kazuistika
72letá, obézní, polymorbidní, hemodialyzovaná pacientka, diabetička na inzulinoterapii s myelodysplastickým syndromem, arteriální hypertenzí, renálním selháním diabetické etiologie. Hemodialýza byla u pacientky zahájena v roce 2010 přes brachiobasilickou píštěl v levé kubitě. V květnu 2012 byla AV píštěl pro rozvoj pseudoaneuryzmatického postižení a stafylokokovou infekci zrušena. Pacientka byla od června 2012 dočasně dialyzována přes permanentní tunelizovaný HD katétr, přes vena jugularis interna vpravo. Na konci června 2012 založena radiocefalická píštěl na pravé končetině. V listopadu téhož roku došlo k infekčnímu poškození píštěle vedoucí k selhání funkce cévního přístupu a nemožnosti jeho použití k hemodialýze a bylo provedeno přesazení píštěle výše na předloktí. Tři dny po přesazení píštěle pacientka přichází s febriliemi, intermitentními třesavkami, flegmonózně prosáklým předloktím a rozvíjející se plošnou nekrózou cca 15x8 cm na pravém předloktí (Obr. 1). Pacientka s rozvíjejícím se septickým stavem. Provedeno zrušení píštěle a excize nekrotické kůže s chirurgickým debridementem rány s náběrem mikrobiologického materiálu. Nasazena intravenózní empirická terapie, hemokultury s následnou pozitivitou Klebsiella pneumonie. Z rány vykultivováno Clostridium perfringens, Enterococcus faecium, Acinetobacter, Enterobacter ESBL a kvasinky. Zahájena cílená kombinovaná antibiotická terapie zahrnující Linezolid, Oxacilin a Flukonazol. Pro febrilie, vysoké CRP a klinický stav provedena extrakce permanentního tunelizovaného HD katétru. Po iniciálním chirurgickém debridementu pokračujeme ve striktní lokální bariérové terapii monoterapeutickým neutrálním superoxidovým roztokem, převazy a lokální debridement provádíme 4krát denně (Obr. 2). Pro zlepšení hojení rány zahajujeme přetlakovou terapii kyslíkem v hyperbarické komoře po dobu 90 min. během 5 dnů s max. 2,5 ATA (absolute atmosfere). Během hospitalizace pokles zánětlivých markerů, ústup febrilií s následným zlepšením klinického stavu, hemodialýza nově zavedeným HD katétrem cestou vena femoralis l. dx. Po zlepšení lokálního nálezu zahájena terapie VAC (vacuum assisted closure) systémem. Dochází k vyčištění rány s granulací defektu (Obr. 3). Pacientka bez febrílií, v dobrém klinickém stavu s granulační tkání v plošném defektu předána na nefrologické pracoviště k další péči. Následné naše opakované kontroly pacientky se stále se zlepšujícím lokálním nálezem, čistou ránou s postupnou okrajovou epitelizací.
Image 1. Primární nález Fig. 1: Initial finding 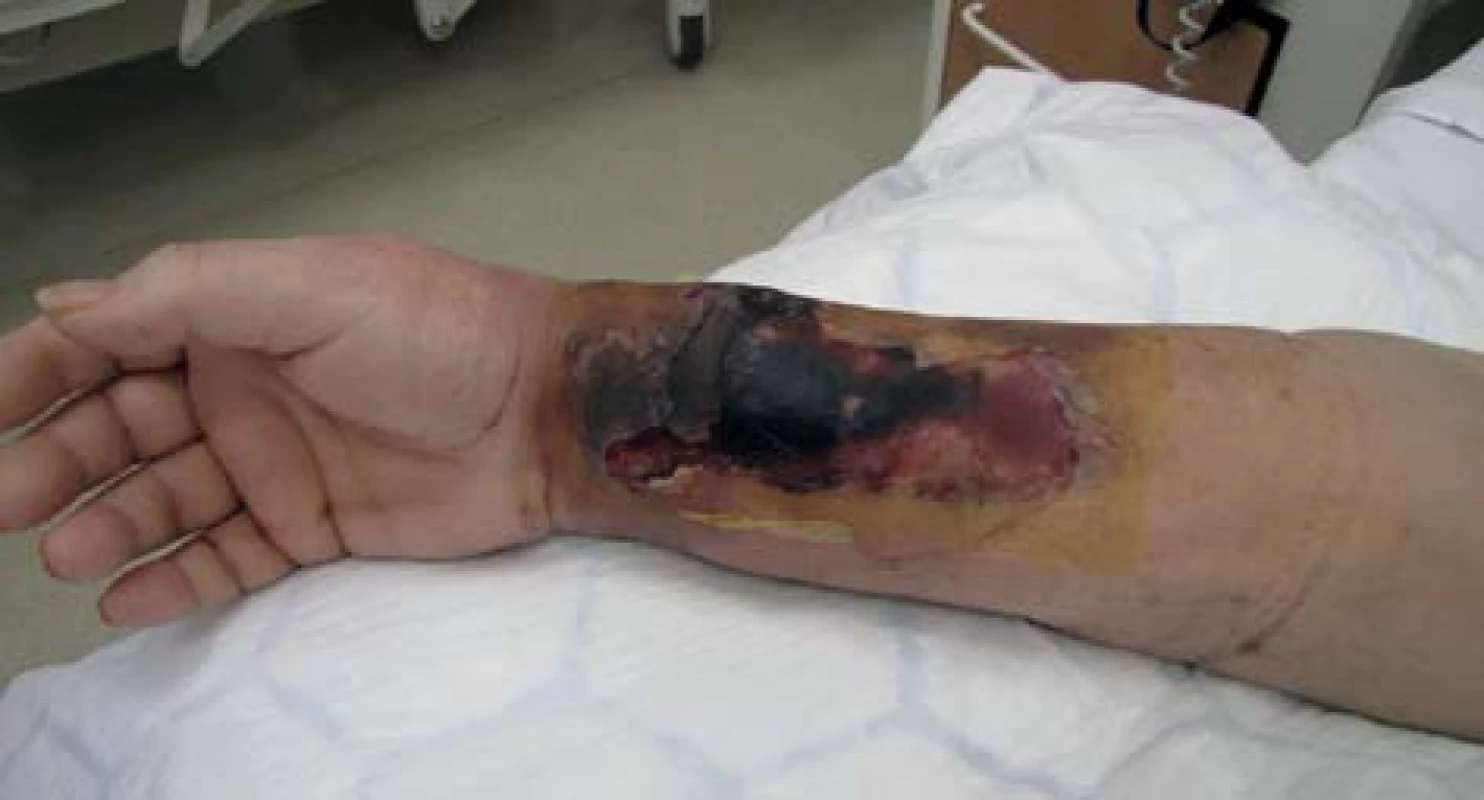
Image 2. Perioperační nález Fig. 2: Perioperative finding 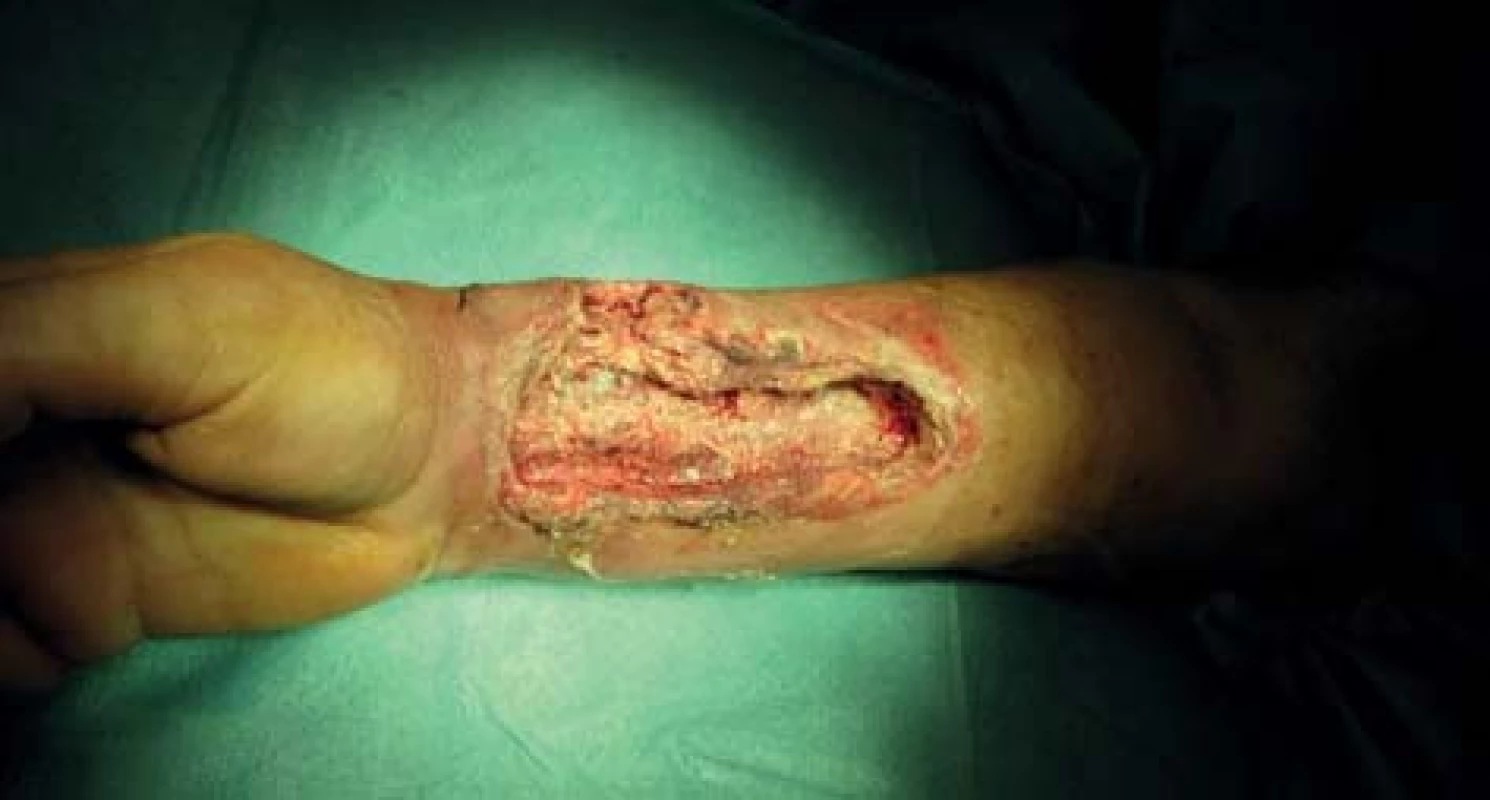
Image 3. Hojící se rána Fig. 3: Wound healing 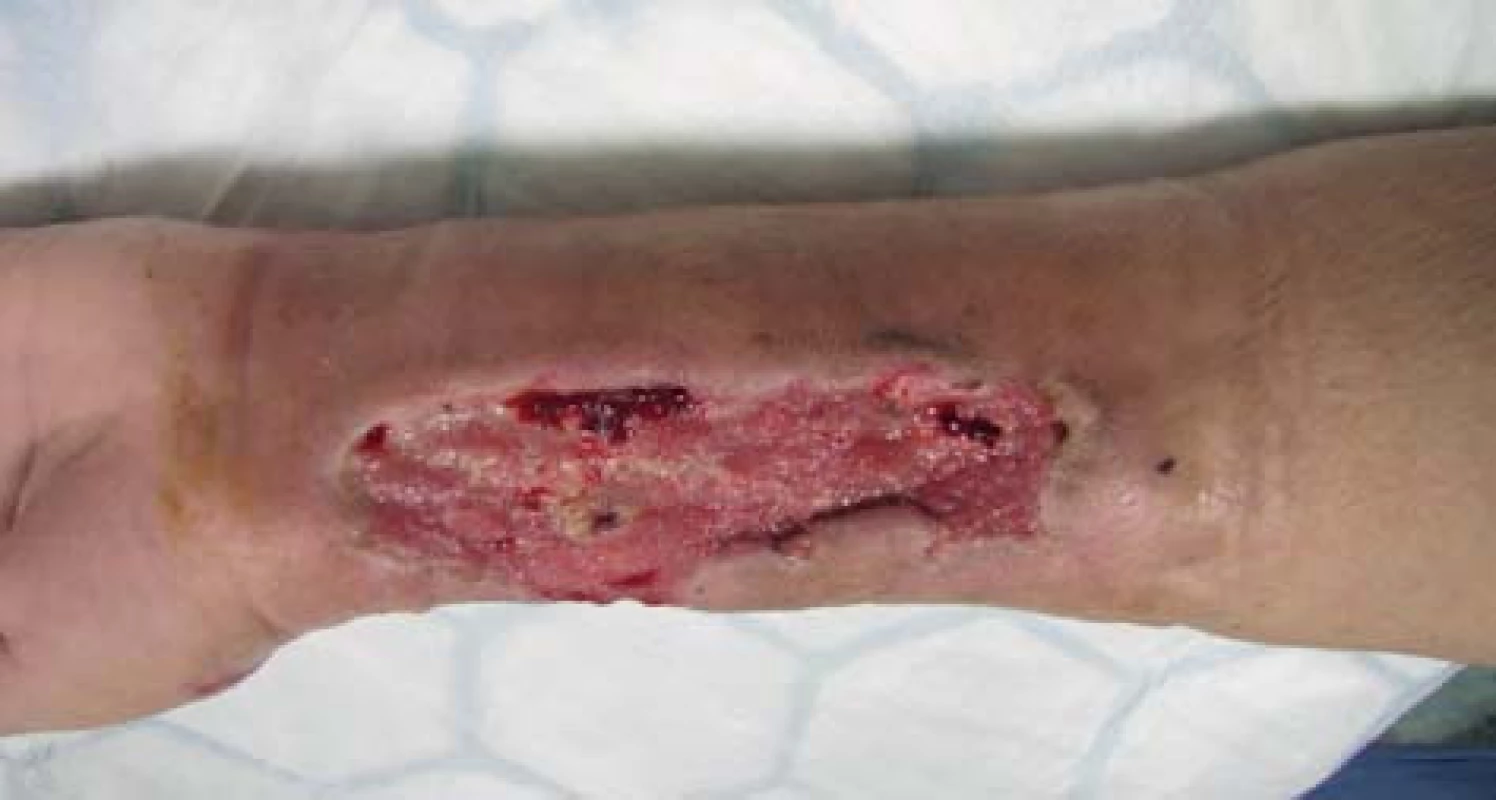
Diskuze
Infekce je nepříjemnou komplikací všech chronických dialyzovaných pacientů. Infekce signifikantně ohrožuje funkci píštěle a kvalitu života pacienta. Všeobecné faktory vedoucí ke vzniku infekce u všech typů píštělí jsou bakteremie, imunosuprese, špatná hygiena a technika opakované kanylace [1,2]. Vznik infekčních komplikací je u těchto pacientů vyšší a až 35 % z nich přijde o založený cévní zkrat pro jeho infekci v poměru 1 : 2 ve prospěch protetických píštělí [3]. Pacienti v HD programu často trpí nutričním a imunitním deficitem [4]. Infekce se nejčastěji manifestuje difuzní celulitidou nebo abscesy v místě napichování píštěle. Protetické píštěle jsou z hlediska náchylnosti rizikovější než autologní. Infekce protetických píštělí se vyskytuje u 5–20 % pacientů [5]. Velmi riziková je ruptura anastomózy z důvodu infekce protézy s následným krvácením [6]. V případě abscedující infekce je nutná chirurgická revize s prodlouženou antibiotickou terapií [5]. Ve spektru infekcí se setkáváme jak s grampozitivními bakteriemi, tak s gramnegativními bakteriemi a polymikrobiálními nálezy [7]. Nejčastější infekce jsou nálezy s grampozitivními bakteriemi, a to především Stafylococcus aureus [8]. Anaerobní infekce cévních přístupů je vzácná [9,10]. U hemodialyzovaných pacientů se předpokládá možnost potenciace anaerobních infekcí sníženým oxidačně redukčním potenciálem na buněčné úrovni [11]. Pro lokální růst Clostridium perfringens jsou důležité aminokyseliny a růstové faktory, které bakterie dokážou utilizovat z nekrotické tkáně. Specifikem klostridiových infekcí je pomalu se šířící infekce, bez časných systémových projevů [12]. Imunokompromitovaní pacienti, mezi které se pacienti v HD programu řadí, jsou k infekci náchylnější [13,14]. Inkubační doba plynaté sněti je od několika hodin až po 3 dny. Infekce se lokálně projevuje intenzivní bolestí v postižené ráně. Bolest je mnohem větší, než by se dalo očekávat vzhledem k velikosti a vzhledu rány. V okolí rány je tuhý edém, z rány vytéká řídký serózně hemoragický exsudát. Kůže v okolí rány je zprvu bledá a velmi citlivá na dotyk, během hodin dochází k třáskání. Posléze se na kůži objevují černě zbarvené puchýře a ložiska nekrózy. Z celkových příznaků dominují u pacienta neklid, horečka a hypotenze. Incidence plynaté sněti byla jedna z největších během první světové války a dosahovala u otevřených fraktur k 6 % a u otevřených ran k 1 % [15]. V dnešní době díky časné diagnostice a vhodné terapii incidence klesá, v USA je výskyt cca 3000 případů za rok [15]. Data pro Českou republiku nejsou. Mortalita je vysoká a dosahuje až 60–70 %, především tam, kde lokalizace infekce nedovoluje radikální excizi postižených tkání. Základním diagnostickým opatřením je odběr exsudátu, obsahu puchýře nebo vzorku tkáně na bakteriologické vyšetření, s následnou verifikací nálezu. Léčba musí být komplexní a musí být provedena neodkladně po stanovení diagnózy. Jejím základem jsou tři skupiny opatření, která všechna jsou pro úspěšnou léčbu nezbytná. Zahrnují chirurgický výkon, antibiotickou terapii a celkovou intenzivní podpůrnou terapii. Celková intenzivní léčba spočívá v oxygenoterapii, rehydrataci, monitoraci nemocného, dle potřeby podání oběhových podpor, transfuzí, diuretik a analgetik. V našem případě šlo o pacientku polymorbidní, imunokompromitovanou ještě myelodysplastickým syndromem. U této pacientky se potencovala imunokompetence jak z hlediska myelodysplastického syndromu, diabetu mellitu, tak i ze samotné nutnosti hemodialýzy. Přestože některé klostridiové infekce jsou exogenní, část infekcí může mít zdroj ve vlastní flóře pacientů. Rizikové je místo vpichu, a proto tedy základem prevence této infekce je dodržení pravidel asepse při napichovaní zkratu. Podkladem terapie je komplexní pohled na řešení těžkých infekcí, intravenózní cílená antibiotická terapie bránící progresi a šíření infekce. Pro lokální léčbu jsme využili hyperbarickou komoru pro zvýšení dodávky kyslíku do postižené tkáně a zvýšení oxidativně redukčního potenciálu. Klíčem je snížení produkce toxinů [17]. Dle výsledku prací zabývajících se problematikou anaerobních infekcí vyplývá, že morbidita i mortalita signifikantně klesají u kombinované terapie využívající hyperbarickou komoru, chirurgický debridement a antibiotickou terapii [18,19].
Důležitým faktorem léčby je časná a přesná diagnóza založená především na klinické symptomatologii a mikrobiologickém určení agens. Základem chirurgické intervence je opakovaný debridement, excize postižené tkáně a aplikace baktericidních látek. Pro zlepšení mikrocirkulace v tkáni jsme v našem případě po vyčištění rány použili podtlakový VAC (vacuum assisted closure) systém. Nedílnou součástí léčby pro zlepšení hojení rány po eliminaci infekce je adekvátní nutrice, korekce iontové dysbalance a diabetu mellitu.
MUDr. David Janák
Na Vrcholu 12
130 00 Praha
e-mail: David.Janak@vfn.cz
Sources
1. Bonomo RA, Rice D, Whalen C, et al. Risk factors associated with permanent access-site infections in chronic hemodialysis patiens. Infection Control and Hospital Epidemiology 1997;18 : 757–761.
2. Tordoir JH, Herman JM, Kwan TS, et al. Long-term follow-up of the polytetrafluoroethylene (PTFE) prosthesis as an arteriovenous fistula for haemodialysis. European Journal of Vascular Surgery 1988;2 : 3–7.
3. Schutte WP, Helmer SD, Salazar R, et al. Surgical treatment of infected prosthetic dialysis arteriovenosus grafts: total versus partial graft exciton. Am J Surg 2007;193 : 385–8, discussion 388.
4. Jaar BG, Hermann JA, Furth SL, et al. Septicemia in diabetic hemodyalisis patiens: comparison on incidence, risk factors, and mortality with non-diabetic hemodialysis patiens. Am J Kidney Dis 2000;35 : 282–92.
5. Palder SB, Kirkman RL, Whittemore AD, et al. Vascular accesss for hemodialysis: patency rates and results of revision. Ann Surg 1985;202 : 235–239.
6. Bennion RS, Wiliams RA, Wilson SE, et al. Vascular prosthetic infection. Infect Surg 1982;1 : 45–55.
7. Stevenson KB. Manamegent of hemodialysis vascular access infections. In Gray RJ. (ed): Dialysis access. Philadelphia, Lippincott Williams a Wilkins 2002;98–106.
8. Janoušek L, Baláž P, a kol. Hemodialyzační arteriovenózní přístupy. Praha, Grada Publishing 2008 : 117.
9. Marr KA, Sexton DJ, Conlon PJ, et al. Catheter related bactermia and outcome of attempted catheter salvage in patients undergoing hemodialysis. Ann Intern Med 1997;127 : 275–280.
10. Gorbach SL, Thadepalli H. Isolation of clostridium in human infections: evaluation of 114 cases. J Infect Dis 1975;131 : 581–585.
11. Brook I. Role of anaerobic bacteria in aortofemoral graft infection. Surgery 1988;104 : 843–845.
12. Oliveras A, Orfila A, Inigo V. Clostridium perfringens: an unusual pathogen infecting arteriovenous shunts for dialysis. Nephron 1998;80 : 479.
13. Kasper DL, Zaleznik lDF. Gasgangrene, antibiotic-associated colitis, and other Clostridial infections. Harrison’s principles of internal medicine. New York, McGraw-Hill 1998 : 906–910.
14. Meer RR, Songer JG, Park DL, et al. Human disease associated with Clostridium perfringens enterotoxin. Rev Environ Contam Toxicol 1997;150 : 75–94.
15. Chapnick EK, Abter EL, et al. Necrotizing soft-tissue infections. Infect Dis Clin North Am 1996;10 : 835–55.
16. Hitchcock CR, Demello FJ, Haglin JJ. Gangrene infection: New approaches to an old disease. Surg Clin North Am 1975;55 : 1403.
17. West M, Pirrene J, Chavers B, et al. Clostridium difficile colitis after kidney and kidney-pancreas transplantation. Clin Transplant 1999;13 : 318–323.
18. Thom SR. Functional inhibition of neutrophil B3 integrins by hyperbaric oxygen in car-bon monoxide mediated brain injury. Toxicol Appl Pharmacol 1993;123 : 248.
19. Heimbach R. Gas gangrene. In Kindwall E, Whelan H (eds): Hyperbaric Medicine Practice, 2nd ed. Revised. Flagstaff, AZ, Best Publishing Company 2004 : 549.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 6-
All articles in this issue
- Nová strategie chirurgické léčby mnohočetného nádorového postižení jater – ALPPS
- Studie morfologie r. descendens a. circumflexae femoris lateralis jako možné cévní náhrady pro rekonstrukci koronárního řečiště pomocí angio CT vyšetření
- Karcinom tlustého střeva – zhodnocení komplikací a rizik plánovaných resekčních výkonů
- Srovnání chirurgického bypassu a subintimální rekanalizace v léčbě kritické končetinové ischemie
- Primární volvulus tenkého střeva u mladého nemocného
- Kombinovaný chirurgický management infekce hemodialyzačního cévního přístupu bakteriologickým agens Clostridium perfringens
- Klostridiová myonekróza břišní stěny – kazuistika
- Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Základní principy diagnostiky a léčby sekundární peritonitidy – doporučení odborníků s podporou SIS
- Primární volvulus tenkého střeva u mladého nemocného
- Klostridiová myonekróza břišní stěny – kazuistika
- Nová strategie chirurgické léčby mnohočetného nádorového postižení jater – ALPPS
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

