-
Medical journals
- Career
Problematika diferenciální diagnostiky primárních nádorů jater
Authors: E. Honsová
Authors‘ workplace: Pracoviště klinické a transplantační patologie, Transplantcentrum IKEM Praha přednostka: Doc. MUDr. E. Honsová, Ph. D.
Published in: Rozhl. Chir., 2014, roč. 93, č. 3, s. 170-175.
Category: Various Specialization
Práce byla podpořena: MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“)
Práce je určena k postgraduálnímu vzdělávání lékařů.Overview
Nejčastějším primárním maligním nádorem jater je hepatocelulární karcinom, který představuje 80–85 % všech maligních nádorů jater. Druhým nejčastějším maligním tumorem je cholangiocelulární karcinom. V poslední době bylo dosaženo velkého pokroku v oblasti molekulární patologie nádorů jater, což vedlo k nové klasifikaci adenomů jater, kde vztah mezi genotypem a fenotypem lze snadno využít v rutinní histopatologické diagnostice. V oblasti diagnostiky časných neoplazií bylo dosaženo dohody v definování a odlišení dysplastických nodulů od časného hepatocelulárního karcinomu. V diferenciální diagnóze se využívá rozpoznání stromální invaze a imunohistochemického průkazu glypicanu-3. Mnoho problémů ale stále existuje v kategorii smíšených hepatocelulárních a cholangiocelulárních karcinomů. I když tato kategorie je zahrnuta ve WHO klasifikaci, diagnostická kritéria i terminologie jsou nejasné a zmatečné. Uvádíme problémy a nástrahy histopatologické diferenciální diagnostiky maligních nádorů jater.
Klíčová slova:
hepatocelulární karcinom – cholangiocelulární karcinom – adenom jater
Z pohledu každodenní praxe patologa zahrnují nádory v játrech neuvěřitelně širokou diferenciální diagnostiku. Obecně vzato, nejčastějším nádorem jater jsou metastázy, protože do jater běžně metastazují nádory z nejrůznějších primárních lokalit; od metastáz z GIT a mléčné žlázy přes neuroendokrinní nádory, hematologické malignity, mezenchymové i germinální tumory až po melanom. Protože mnohé z nich mohou být na úrovni rutinní histopatologie velmi podobné hepatocelulárnímu karcinomu, je prvním krokem v mikroskopické diagnostice nádorů diferenciálně diagnostické rozhodnutí, zda vyšetření směřovat k primárnímu tumoru nebo k metastáze. Již v tuto dobu mohou klinická data dramaticky ovlivnit výsledek vyšetření. Hepatocelulární karcinom (HCC) je totiž na úrovni morfologie extrémně pleomorfní tumor a je naprosto běžnou skutečností, že se v jednom nádorovém ložisku střídají velmi různorodé morfologické obrazy (které často morfologicky napodobují jiné nádory, zvl. jejich světlobuněčné varianty), což může činit značné diagnostické obtíže. Proto pokud patolog ví např., že pacient má fibrózu/cirhózu při virové hepatitidě, soustředí svoji pozornost na HCC (a podle toho vybírá imunohistochemické průkazy antigenů), a v případě, kdy ví, že pacient měl před několika roky odstraněný melanom, rozšíří vyšetření především tímto směrem. Je třeba také zmínit, že se přístup patologa k diagnóze nádoru v játrech bude lišit podle toho, jaký typ vzorku vyšetřuje (resekát jater nebo jehlová biopsie). V případě punkční/jehlové biopsie je vždy velmi omezené množství tkáně a tomu se musí přizpůsobit výběr vyšetření s racionálním využitím limitovaného počtu řezů.
Technická komponenta diagnózy nádoru v jehlové biopsii
Klíčem k úspěšné diagnóze nádoru v jehlové biopsii je kromě odbornosti a zkušenosti patologa také technika zpracování bioptického vzorku s optimálním využitím limitovaného množství tkáně. Odbornost a zkušenost je nezbytná vzhledem k neobvykle širokému spektru možností onkologických diagnóz, které lze v jaterní biopsii zachytit. Imunohistochemické průkazy antigenů (markery), které se dnes v diagnostice běžně používají, neurčují, zda jde nebo nejde o nádor, dokážou ale napomoci při určení histogeneze. Tj. určí, např. že tkáň je epitelová; jenže epitelových nádorů je velmi mnoho a mohou být benigní i maligní (v kategorii maligních jsou to všechny typy karcinomů). Proto patolog používá při identifikaci nádoru vždy určitou skupinu markerů, a protože v jehlové biopsii je jen limitované množství tkáně, musí být patologova rozvaha správná hned od počátku. Stručně řečeno, pokud by měl patolog nesprávný „odhad“ na úrovni H&E (hematoxylin-eosin) a vybral by markery, které k diagnóze nepomohou, celé invazivní bioptické vyšetření by znehodnotil.
Pro maximální využití tkáně v parafinovém bloku se obvykle v praxi používá jeden z následujících postupů:
- a) nejprve se ukrojí řezy pouze na 1–2 skla a na základě morfologických znaků se rozhodne o výběru dalších imunohistochemických průkazů;
- b) ukrojí se série řezů, které se v pásce uloží, z nich se vyberou okrajové řezy a řezy z centra a na základě morfologických znaků se pokračuje stejně jako v předchozím. Tato praxe se většinou používá v zahraničí, je totiž náročnější na prostor (skladování), na druhé straně šetří čas i tkáň při dalším vyšetření, protože se krájí pouze jednou a pro imunohistochemické průkazy lze cíleně využít okolní řezy.
Podle histogeneze zahrnují primární nádory jater u dospělých pouze 3 skupiny onkologických diagnóz (benigní a maligní hepatocelulární tumory, benigní a maligní cholangiocelulární nádory a vaskulární tumory, zvl. epiteloidní hemangioendoteliom). Mohlo by se zdát, že diferenciální diagnostika mezi 3 kategoriemi bude velmi snadná, opak je ale pravdou, nejen pro výše zmíněnou problematiku metastáz.
Podle histopatologických znaků řeší patolog nejčastěji následující diagnostické problémy:
- Nádor je hepatocelulární a jde o určení jeho biologické povahy (dysplastický nodulus v cirhóze versus časný HCC, adenom versus HCC).
- Nádor má hepatocelulární a tubulární/cholangiocelulární diferenciaci.
- Nádor představuje netypickou histologickou variantu nebo zahrnuje morfologii několika histologických typů. Otázkou je, zda jde o HCC, cholangiocelulární karcinom nebo metastázu.
- Epiteloidní hemangioendoteliom versus cholangiocelulární karcinom nebo metastáza.
1. Nádor je hepatocelulární a jde o určení jeho biologické povahy (dysplastický nodulus v cirhóze versus časný HCC, adenom versus HCC)
Shrnutí problematiky dobře diferencovaného časného HCC v cirhóze je součástí doporučeného postupu pro léčbu a diagnostiku HCC [1, 2]. Současná klasifikace v patologii zpřesnila definice některých znaků a přidala imunohistochemické markery, což významně snížilo počet problematických případů hodnocených v rutinním bioptickém provozu [3].
Základní znaky, které v praxi zlepšují histopatologickou diagnózu HCC jsou:
- stromální invaze,
- nepárové arterie,
- pozitivní průkaz glypicanu-3 (GPC3).
Stromální invaze charakterizuje časný HCC a představuje stav, kdy jednotlivé trámce nádorových hepatocytů pronikají do stromatu původních portálních polí nebo vazivových sept (obr. 1). Protože stromální invaze je dokladem invazivního růstu, stala se nejdůležitějším morfologickým znakem, který umožňuje rozlišení high-grade dysplastického uzlu od časného dobře diferencovaného HCC. Diagnostickou limitací je fakt, že okrsky stromální invaze se vyskytují fokálně a v jehlové biopsii nemusejí být zastiženy.
Image 1. HCC se stromální invazí Stromální invaze (označeno žlutě) je potvrzením malignity a představuje pronikání nádorových buněk do vaziva sept nebo portálních polí. Fig. 1: HCC with stromal invasion Stromal invasion (yellow line) confirms the process of malignancy and represents the invasion of the neoplastic cells in the fibrotic septum (here) or in the fibrotic tissue of the portal tract. 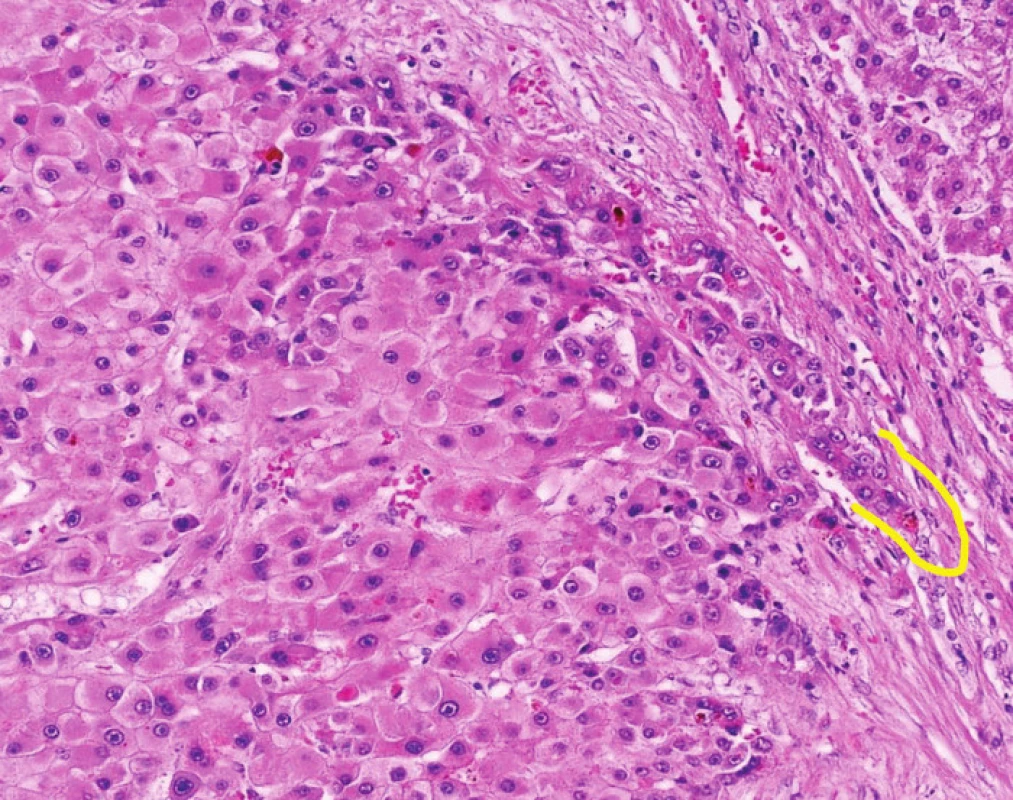
Nepárové arterie jsou arterie, které jsou zastiženy v jaterní tkáni izolovaně mezi hepatocyty. Jsou tedy lokalizované mimo portální pole, kde normálně doprovázejí žlučovod a jsou vlastně histologickým korelátem neovaskularizace, která představuje hlavní diagnostický znak HCC v průběhu zobrazovacích metod (Obr. 2). Nepárové arterie se na rozdíl od stromální invaze mohou vyskytovat i v benigních lézích (adenom) nebo v dysplastických nodulech.
Image 2. HCC s nepárovou arterií, tj. arterií samostatně ležící mimo portální pole mezi nádorovými buňkami Nepárové arterie jsou histologickým korelátem neovaskularizace, která představuje hlavní diagnostický znak HCC v průběhu zobrazovacích metod. Fig. 2: HCC with unpaired artery – such arteries are small arteries occurring outside the original portal tracts (unaccompanied by bile duct) Unpaired arteries are indicative of neovascularization and this characteristic feature is used for the diagnosis of HCC in radiological imaging. 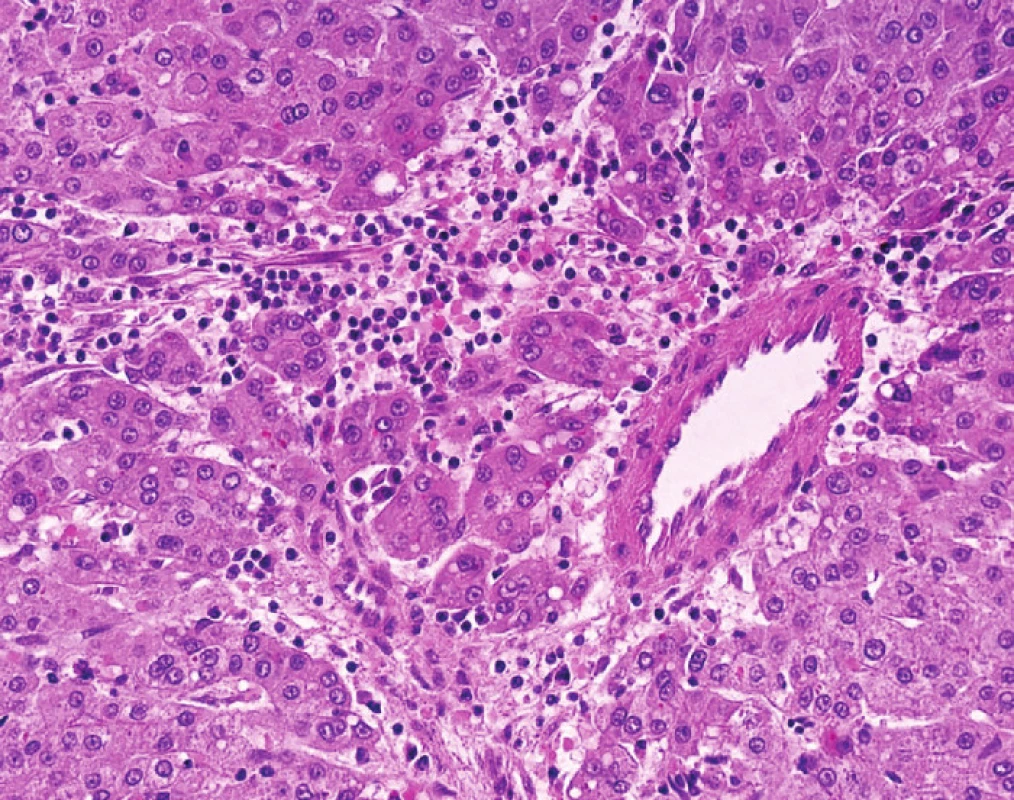
Imunohistochemický průkaz glypicanu-3 znamená téměř revoluci v diagnostice HCC. GPC3 je onkofetální protein ovlivňující morfogenezi a kontrolující růst, který je vysoce exprimován v játrech a střevu během fetálního vývoje [4]. U dospělých v normálních játrech exprimován není. Jeho exprese se znovu objevuje v buňkách HCC a může být cytoplazmatická, membránová nebo kanalikulární (Obr. 3). Prakticky ve všech případech je fokální a má různou intenzitu. Průkaz GPC3 má vysokou senzitivitu (77 %) a především specificitu (96 %), pozitivní výsledek s vysokou pravděpodobností predikuje maligní nádor z hepatocytů. Největší limitací průkazu GPC3 je jeho fokální exprese, která může vést k negativnímu výsledku, a také to, že průkaz je citlivý na fixaci a může být negativní i v morfologicky jasných HCC [5]. Pouze zřídka byl GPC3 detekován v jiných maligních tumorech např. v melanomu, nádoru ze žloutkového váčku [6].
Image 3. HCC s fokálně pozitivním imunohistochemickým průkazem glypicanu-3 (hnědě) Negativní úseky jsou též HCC, negativní průkaz nevylučuje diagnózu HCC. Fig. 3: Immunostaining for glypican-3 shows focal expression in the cytoplasm of tumor cells (brown) Negative cells here are also HCC; and negative glypican-3 staining does not rule out the diagnosis of HCC. 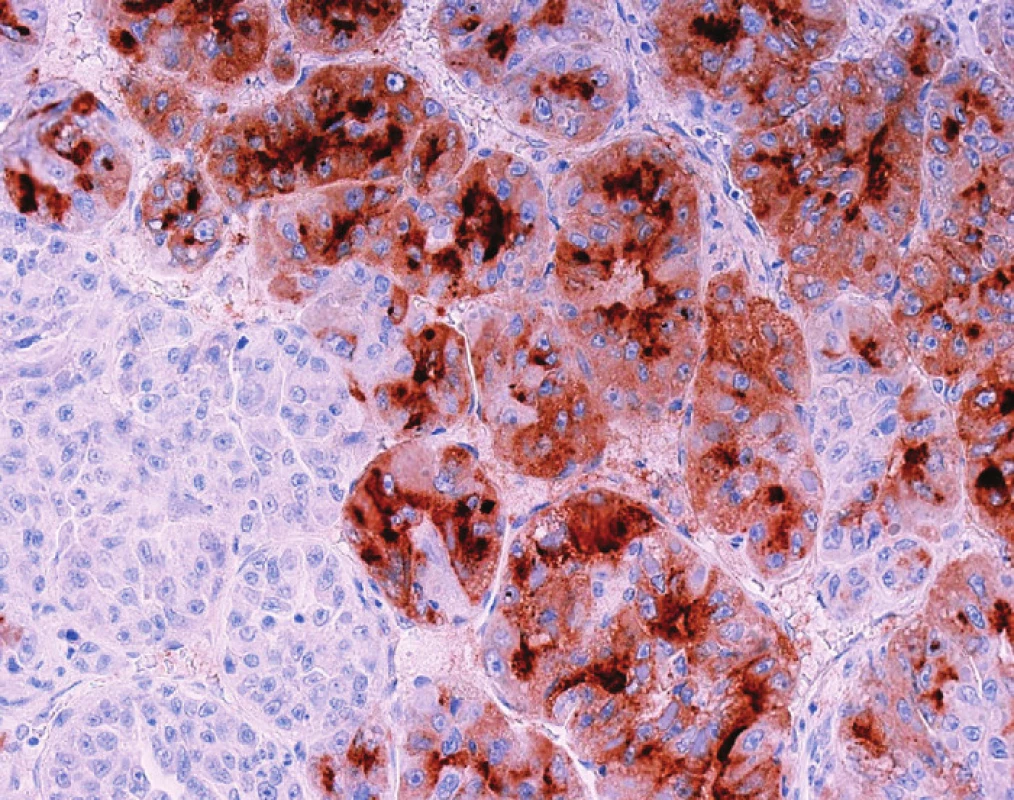
Další doporučované imunohistochemické znaky mají většinou významná omezení a jejich význam je popsán v komentáři doporučeného postupu pro patology [7].
Protože HCC vykazuje obdobnou heterogenitu jako v histopatologii i na úrovni genomických, genetických a epigenetických studií, neexistuje dosud subklasifikace HCC na molekulární úrovni.
V podstatě lze shrnout, že typické HCC lze diagnostikovat na úrovni základního barvení H&E. Komplikované případy vyžadují imunohistochemickou verifikaci, kdy diagnosticky nejpřínosnější je imunohistochemický průkaz glypicanu-3.
V případě diferenciálně diagnostické rozvahy mezi hepatocelulárním adenomem (HCA) a HCC do diagnostiky vstupuje ještě požadavek rozlišení adenomů s vysokým nebo nízkým rizikem přechodu do HCC.
Hepatocelulární adenomy jsou relativně vzácné tumory, které se nejčastěji objevují u žen v souvislosti s antikoncepcí. Podle fenotypu, který odpovídá molekulárním charakteristikám, byly HCA rozčleněny do 4 skupin, které se liší rizikem maligního zvratu. Proto je v současnosti určení subtypu nezbytnou součástí bioptické diagnózy. Zařazení do subtypů lze provést na základě detekce imunohistochemických markerů.
H-HCA (hepatocelulární adenom definovaný aktivací HNF1, tj. hepatocyte nuclear factor1) představuje 35 až 40 % všech HCA a objevuje se téměř výlučně u žen. V biopsiích je obvykle steatóza, bez zánětu a bez cytologických atypií. To, že nádorové buňky neexprimují L-FABP, lze využít v diagnostice. L-FABP je protein, který ovlivňuje metabolismus mastných kyselin a v normálních hepatocytech je L-FABP exprimován.
I-HCA (HCA se zánětlivou celulizací) představuje 50 % HCA, nemocní jsou často obézní muži, kuřáci s kladným vztahem k alkoholu. Jde o nejčastější variantu HCA vyskytující se u mužů. Zánět v histopatologii doprovází overexprese reaktantů akutní fáze včetně SAA, který lze prokázat imunohistochemicky a lze ho diagnosticky využít.
ß-HCA (HCA s aktivací ßcateninu) představuje cca 10 % adenomů. Tyto tumory jsou častější u mužů, v histopatologii jsou cytologické abnormality, což s sebou nese rozpaky v hodnocení biologického chování. Současně ß-HCA mají vysoké riziko maligního zvratu. V poslední době se objevují studie ukazující, že většina těchto tumorů představuje spíše dobře diferencované HCC než adenomy. V této oblasti je nezbytný další výzkum k objasnění toho, zda vůbec jde o dvě rozdílné onkologické kategorie.
HCA bez bližšího určení, zde jsou zařazeny nádory, které nesplňují kritéria žádné z předchozích kategorií. Jde o malou skupinu cca 5 % HCA.
Kromě typu HCA je nutné brát v úvahu také velikost ložiska, protože riziko maligního zvratu i event. život ohrožujícího krvácení stoupá s velikostí tumoru. Kritickou velikost mají ložiska velikosti přesahující 4 cm.
2. Nádor má hepatocelulární a tubulární/cholangiocelulární diferenciaci
Více než 90 % cholangiocelulárních karcinomů (CC) vzniká v hilu (tzv. Klatskinův tumor), zbývající postihují primárně nitrojaterní nebo extrahepatální žlučovody. V histopatologii je klasický cholangiocelulární karcinom charakterizovaný tubulárními strukturami a nápadnou fibroprodukcí (Obr. 4). Tato typická morfologie je snadno odlišitelná od klasického HCC, který až na fibrolamelární variantu nemá vazivové stroma. CC mají nepříznivé biologické chování a jejich diagnóza představuje ve většině center kontraindikaci k transplantaci jater. Naproti tomu HCC pokud nepřesahují definovaná kritéria, jsou naopak indikací k transplantaci. Proto má rozlišení obou typů nádorů závažné následky.
Image 4. Typická morfologie cholangiocelulárního karcinomu Jde o tubulární adenokarcinom s nápadnou fibroprodukcí. Fig. 4: Typical morphological features of cholangiocellular carcinoma are shown here Structures of tubular adenocarcinoma surrounded by dense fibrotic tissue. 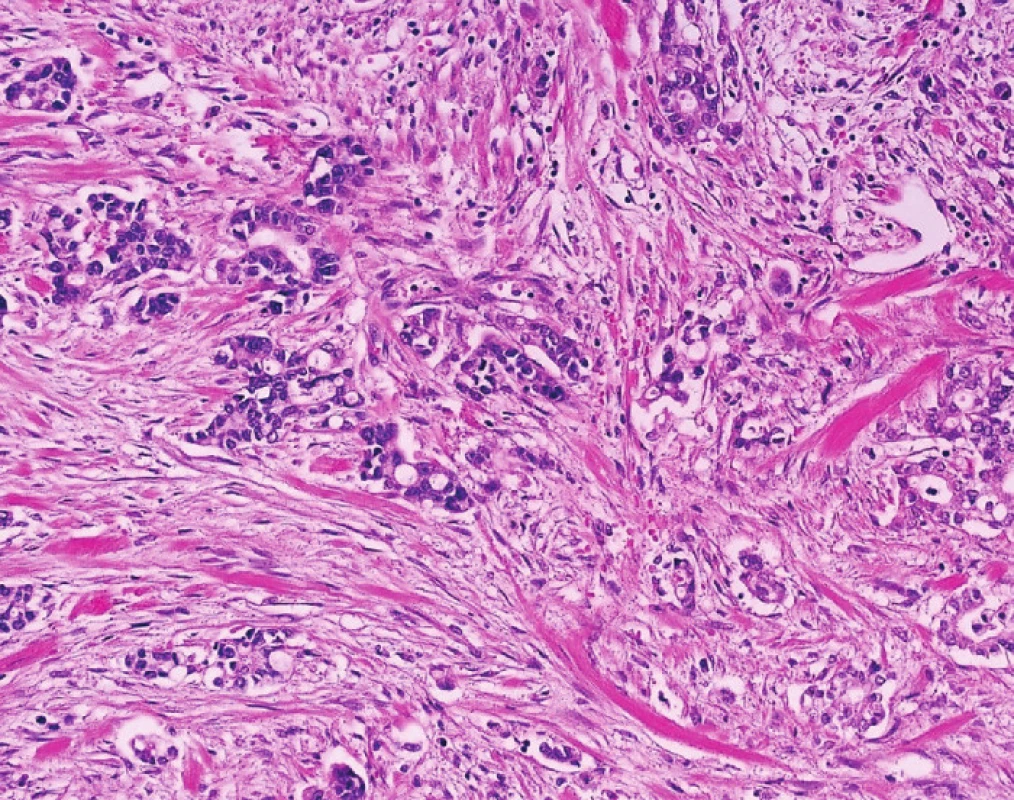
Rutinní používání imunohistochemických průkazů cytokeratinů exprimovaných v duktálním (zde biliárním) epitelu (CK19) odkrylo část HCC s okrsky drobných nezrale vypadajících nádorových buněk, často s různým stupněm tvorby tubulárních struktur a s pozitivním průkazem CK19. To postavilo histopatologickou diagnostiku před problém, jak zařadit takové nádory. Podle WHO klasifikace nádory, které mají komponenty odpovídající konvenčnímu HCC a současně komponenty s tvorbou CK19 pozitivních tubulů, jsou zařazeny jako smíšené HCC-CC karcinomy a obecně je těmto jednotkám přisuzována horší prognóza. Taková diagnóza nemá stanovená kritéria, kolik tubulární komponenty musí být přítomno, aby mohl být tento tumor diagnostikován, a také, jak velké množství tkáně bude imunohistochemicky vyšetřeno. Imunohistochemie ukázala, že velký počet HCC má různě objemné, nepravidelně rozložené okrsky CK19 pozitivních nádorových buněk. Vzhledem k jejich různé velikosti a fokální lokalizaci je zřejmé, že jedním ze základních požadavků na jejich identifikaci je pečlivé a extenzivní vyšetření. Otázkou je, zda má takové vyšetření nějaký přínos, obávám se, že v současnosti nemá. Bohužel to není jediný problém; i zde je otázek rozhodně víc než odpovědí, k jedné ze základních patří to, kde leží kritéria pro identifikaci biliární komponenty. Lze izolovaný pozitivní průkaz CK19 považovat za marker biliární diferenciace? Má být pozitivita CK19 doplněna fibroprodukcí? Část autorů se domnívá, že HCC i CC vznikají z tzv. progenitorových buněk v oblastech Heringových kanálků (odkud játra normálně regenerují). Tyto elementy se mohou dále vyvíjet směrem k hepatocytu (event. HCC) a na druhé straně směrem k buňkám žlučovodů (CC). To by znamenalo, že „čisté formy“ HCC a CC jsou vlastně okraje proliferativních procesů, uprostřed je pak velká část nádorů, které obsahují obě komponenty. Tato teorie se zdá být dobře akceptovatelná a dobře by vysvětlovala každodenní diagnostickou praxi [8]. Terminologický chaos je ještě hlubší, vezmeme-li v úvahu popisy nádorů pojmenovaných a zařazených jako karcinomy z progenitorových buněk. Jde o morfologicky stejné nebo velmi podobné typy nádorů s komponentou HCC a CK19 pozitivních buněk.
K tomu je třeba přidat fakt, že neexistují definovaná a akceptovaná kritéria, kdy by měl být nádor klasifikovaný jako smíšený HCC-CC. To vede k tomu, že každé centrum používá kritéria vlastní. Rámcová většinová shoda je v tom, že typické HCC a CC lze odlišit na základě morfologických znaků. V praxi panuje shoda, že smíšené HCC-CC by měly být diagnostikovány pouze v případě, že nádor obsahuje vedle struktur HCC plně vyvinutou komponentu CC včetně fibroprodukce a tubulární architektury. Typické HCC s fokálně pozitivním průkazem CK19 bez fibroprodukce jsou klasifikovány většinou jako HCC.
3. Nádor netypické histologické varianty nebo s několika histologickými typy. Otázkou je, zda jde o HCC, cholangiocelulární karcinom nebo metastázu.
HCC je extrémně pleomorfní tumor, což spolu s tím, že do jater mohou metastazovat tumory v podstatě jakékoli histogeneze a z jakékoli primární lokality, přináší do diferenciální diagnostiky nepřeberné množství možností. Proto klinická informace o předchozích diagnózách maligních onemocnění je jedním z klíčových údajů. Potřebuje-li patolog rozlišit HCC od metastázy jiného tumoru, je velmi užitečný imunohistochemický průkaz HepPar1 (HepPar1 je monoklonální protilátka, která reaguje s epitopem jaterních mitochondrií). Průkaz ale nepomůže v odlišení benigního a maligního tumoru z hepatocytů. Navíc HepPar1 může být negativní v relativně běžných světlobuněčných variantách HCC.
Dalším markerem pozitivním téměř výlučně v HCC je glypican-3 (viz dg. HCC).
Komplikovaná situace nastává, jsou-li zachyceny struktury tubulárního adenokarcinomu vývodového typu, kdy v diferenciální diagnóze jsou cholangiokarcinom nebo metastázy, nejčastěji karcinomu pankreatu nebo kolorektálního karcinomu. Extrahepatální žlučovody a pankreatické vývody mají společný vývojový základ a dosud není znám žádný marker, který by umožnil jejich odlišení.
Samostatnou kapitolou jsou peroperační biopsie k odlišení von Meyenburgova komplexu od metastázy karcinomu pankreatu. Diagnóza obvykle nečiní problém v parafinovém zpracování, ale v orientační peroperační biopsii může být její stanovení nemožné. V některých případech je nutno počkat na parafinové zpracování včetně následného využití proliferačních markerů.
V případě nejčastějších metastáz kolorektálního tubulárního adenokarcinomu lze vedle morfologie použít k podpoře diagnózy detekci různých typů cytokeratinů (kolorektální karcinom: CK20+, CK7-, CDX20+).
4. Epiteloidní hemangioendoteliom (EHE) versus cholangiocelulární karcinom nebo metastáza
EHE je cévní nádor, který roste relativně pomalu a vytváří jeden nebo více různě velikých bledých tuhých uzlů. Imunohistochemicky jsou nádorové buňky pozitivní v průkazech verifikujících endotel (CD31, CD34 a faktor VIII). V histopatologii se nádorové buňky šíří žílami a sinusy, hepatocyty atrofují a centrum ložiska se jizví, včetně žilního lumen. Nádor má zonální uspořádání s vazivem centrálně a dalším růstem na periferii. Růst nádoru ovlivňuje okolní hepatocyty, které mohou vytvářet reaktivní duktulární struktury, které budou imunohistochemicky pozitivní v průkazech CK7 a CK19. Navíc EHE vytváří v sinusech skupiny buněk, které luminizují a velmi věrně napodobují tubuly. To může vést k tomu, že tyto struktury jsou hodnoceny jako cholangiocelulární tubulární adenokarcinom nebo metastáza (Obr. 5). To se ještě více projeví v jehlové biopsii, kde nemusejí být zastiženy nádorem obliterované žilní větve (Obr. 6). Že jde o komplikovanou diagnózu, ukázalo několik zahraničních studií, kde pouze 25–40 % epiteloidních hemangioendoteliomů bylo diagnostikováno při prvním histopatologickém vyšetření [9].
Image 5. Epiteloidní hemangioendoteliom Nádor věrně napodobuje tubulární struktury (označeno červeně), které jsou typické pro karcinomy, a navíc cholangiokarcinom i EHE mají nápadnou fibroprodukci. To činí diferenciální diagnostiku velmi obtížnou. Fig. 5: Epithelioid hemangioendothelioma The tumor mimics the tubular architecture (red lines) which is typical for carcinoma. Moreover, cholangiocellular carcinoma also shares stromal fibrotic tissue around the tumor cells with EHE. Therefore the differential diagnosis can be very difficult. 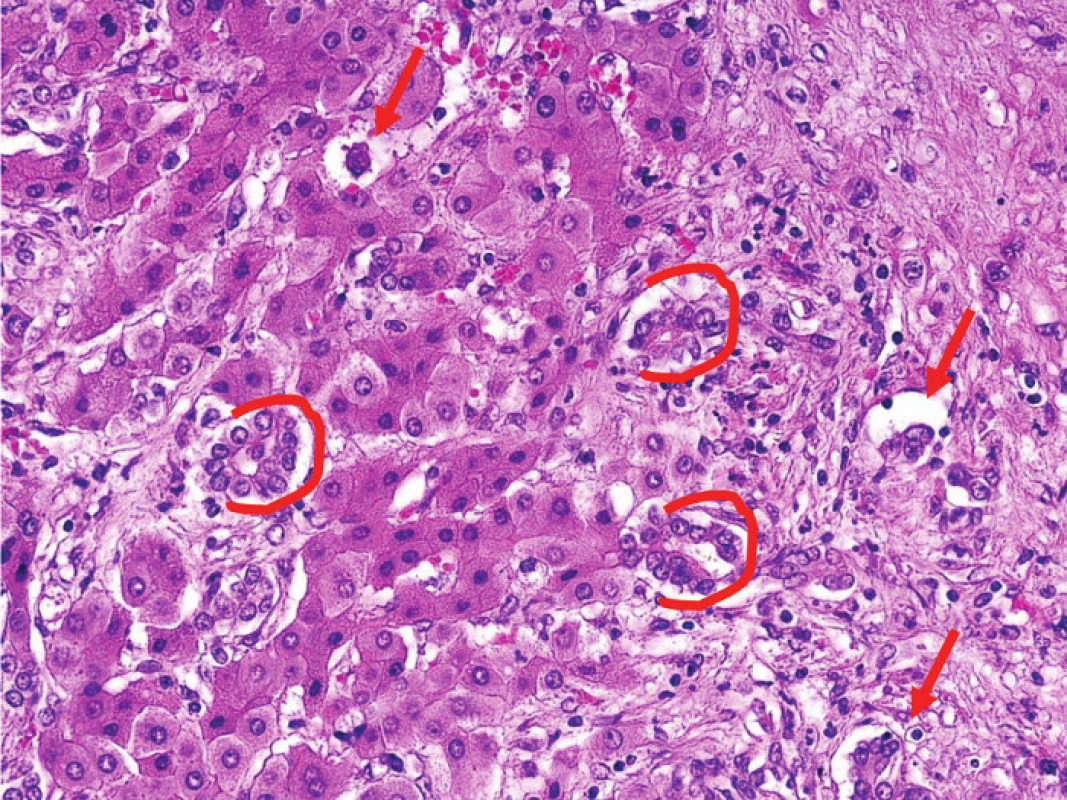
Image 6. Epiteloidní hemangioendoteliom s šířením cévami Větší portální pole s arterií (A) a žlučovodem (zeleně); ve větvi portální žíly i v drobných cévách jsou struktury epiteloidního hemangioendoteliomu (označeno červeně). Fig. 6: Epithelioid hemangioendothelioma within vascular channels Portal tract with an artery (A) and a bile duct (green). EHE is spreading in the small vessel channels and it is also visible in the branch of a portal vein (red arrows). 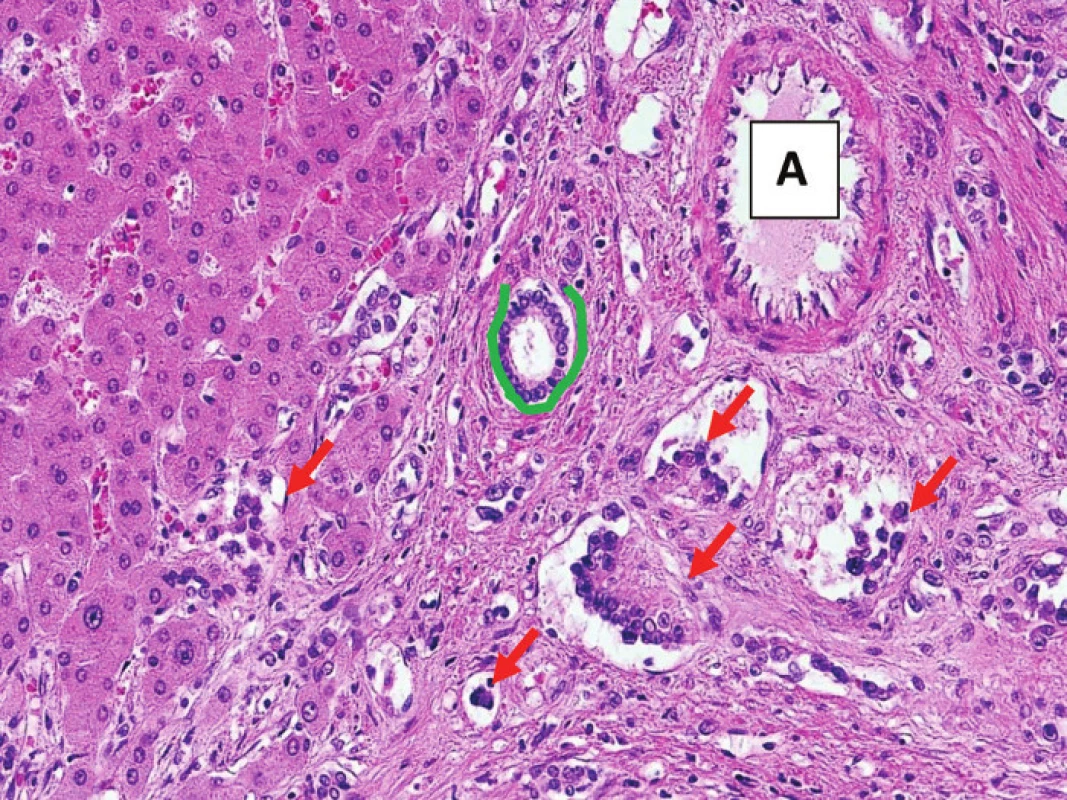
Angiosarkomy jsou v biopsii jater velmi raritní.
Závěrem lze shrnout, že histopatologická diagnostika nádorů v játrech se řadí především díky širokému spektru nejrůznějších metastáz k velmi komplikovaným diagnózám. V možnostech rozlišení HCC a benigních afekcí z hepatocytů přineslo značné zlepšení použití imunohistochemického průkazu glypicanu-3. Intrahepatální cholangiocelulární karcinomy klasické morfologie nečiní diagnostický problém, pokud si je klinik vědom faktu, že morfologicky je nelze odlišit od karcinomu pankreatu nebo karcinomu extrahepatálních žlučových cest. Skupina primárních nádorů jater s imunofenotypem progenitorových buněk je naopak velmi problematická. Nejen pokud jde o jejich klasifikaci, ale především pokud jde o terapeutické rozhodnutí o případné transplantaci jater.
Doc. MUDr. Eva Honsová, Ph.D.
Pracoviště klinické a transplantační patologie Transplantcentrum IKEM
Vídeňská 1958/9,
140 21 Praha 4e-mail: eva.honsova@ikem.cz
Sources
1. International Consensus group for hepatocellular neoplasia. Pathologic diagnosis of early hepatocellular carcinoma: a report of the international consensus group for hepatocellular neoplasia. Hepatology 2009;49 : 658–664.
2. Pracovní skupina HCC 2011. Doporučený postup pro léčbu a diagnostiku hepatocelulárního karcinomu. Gastroent Hepatol 2012;66 : 83–92.
3. Honsová E, Lodererová A, Franková S, et al. Glypican-3 immunostaining significantly improves histological diagnosis of hepatocellular carcinoma. Cas Lek Cesk 2011;150 : 37–40.
4. Filmus J. Glypican in growth control and cancer. Glycobiology 2001;11 : 19–23.
5. Takai H, Kato A, Ishiguro T, at al. Optimization of tissue processing for immunohitochemistry for the detection of human glypican-3. Acta Histochem 2010;112 : 240–250.
6. Zynger DL, Everton MJ, Dimov ND, et al. Expression of glypican-3 in ovarian and extragonadal germ cell tumors. Am J Clin Pathol 2008;130 : 224–230.
7. Honsová E. Histopatologická diagnóza hepatocelulárního karcinomu. Gastroent Hepatol 2012;66 : 93–98.
8. Walther Z, Jain D. Molecular Pathology of hepatic neoplasms: classification and clinical significance. Patholog Res Int 2011;7 : 1–15.
9. Mehrabi A, Kashfi A, Fonouni H, et al. Primary malignant hepatic epitheloid hemangioendothelioma. A comprehensive review of the literature with emphasis on the surgical therapy. Cancer 2006;107 : 2108–2121.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2014 Issue 3-
All articles in this issue
- Problematika diferenciální diagnostiky primárních nádorů jater
- Organizace a využívání tkáňové banky nádorů
- Poranenia extenzorového aparátu v zóne I – mallet deformita
- Analýza komplikací a klinicko-patologických faktorů ve vztahu k laparoskopické cholecystektomii
- Standardizace patologického vyšetření resekátu pankreatu
- Sagitální typ bércové amputace u pacientů se syndromem diabetické nohy
- GIST tenkého střeva v terénu neurofibromatózy jako zdroj masivního krvácení
- Patologická tekutinová kolekce mezenteria, diferenciální diagnostika mezenteriální cysty – kazuistika
- Obecné zásady práce s resekovanými tkáněmi a orgány určenými pro histopatologické vyšetření – požadavky patologů na chirurgy
- Lymfatické metastazování očima patologa
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lymfatické metastazování očima patologa
- Patologická tekutinová kolekce mezenteria, diferenciální diagnostika mezenteriální cysty – kazuistika
- Sagitální typ bércové amputace u pacientů se syndromem diabetické nohy
- Poranenia extenzorového aparátu v zóne I – mallet deformita
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

