-
Medical journals
- Career
Význam cytokeratinového markeru TPS v pooperačním sledování nemocných s kolorektálním karcinomem
Authors: K. Rupert; L. Holubec *; J. Nosek; K. Houdek; Topolčan O.#; V. Třeška
Authors‘ workplace: Chirurgická klinika FN Plzeň, prof. MUDr. V. Třeška, DrSc. ; Radioterapeutické a onkologické oddělení FN Plzeň, doc. MUDr. J. Fínek, Ph. D. #Oddělení nukleární medicíny, prof. MUDr. O. Topolčan, CSc. *
Published in: Rozhl. Chir., 2009, roč. 88, č. 8, s. 428-433.
Category: Monothematic special - Original
Overview
Cíl:
Stanovení vhodných markem pro follow up u pacientů s kolorektálním karcinomem.Materiál a metodika:
Nádorové markery byly vyšetřovány u souboru nemocných s primárně diagnostikovaným a histologicky verifikovaným adenokarcinomem tlustého střeva.Výsledky:
Resekční terapie vedla k poklesu pooperačních hodnot CEA. V případě nádorového markeru CA 19-9 nedošlo k žádné změně mezi hladinami před a pooperačních hodnot, u nádorového markeru TPS došlo naopak k výraznému vzestupu pooperačních hodnot, což bylo nejspíše spjato s reparačními pochody po provedené operaci. Lze konstatovat, že pro kontrolu úspěchu chirurgické léčby je nejvíce vhodné sledovat před - a pooperační hodnoty CEA. Při 95% specificitě pro zjištění recidivy onemocnění bylo nejvyšších senzitivit dosaženo u nádorového markeru TPS (83 %), senzitivity klasických nádorových markeru CEA a CA 19-9 byly podstatně nižší (41 % respektive 25 %). Výsledky je třeba interpretovat opatrně pro malý počet relapsů vzhledem ke krátkému follow-up, a pro spíše lokoregionální charakter recidiv.Závěr:
Přesto se TPS zdá jako slibný marker pro follow up pacientů s kolorektálním karcinomem. Jako ideální se proto jeví kombinace CEA a TPS.Klíčová slova:
kolorektální karcinom – nádorové markery – CEA – CA 19-9 – TPSÚVOD
Kolorektální karcinom je v civilizovaných zemích druhým nejčastějším karcinomem u mužů po karcinomu plic a u žen po karcinomu prsu. Mortalita spojená s tímto onemocněním je v České republice nejvyšší na světě a to u obou pohlaví. Jednou z příčin tohoto stavuje pozdní diagnostika kolorektálního karcinomu, kdy více než 50 % nádorů je diagnostikováno v pozdních stadiích choroby (stadium III a IV) [9]. Příčinami pozdní diagnostiky jsou jednak minimální obtíže v počátečních stadiích, jednak obava nemocných z této diagnózy, dále chyba v diagnostické rozvaze lékaře, kterému se nemocný svěří se svými obtížemi a v neposlední řadě i neexistence screeningové metody pro včasnou diagnostiku. Nádorové markery lze charakterizovat jako látky produkované maligními buňkami či organismem jako odpověď na nádorové bujení. Od látek produkovaných normálními buňkami se liší, buď kvalitativně (jsou nádorově specifické a normální buňky je proto neprodukují) či kvantitativně (s nádory asociované, přítomné i u normálních buněk). Může se jednat o antigeny lokalizované na povrchu buněčných membrán, enzymy metabolických drah či fragmenty cytoplazmatických struktur uvolňované do okolí při zániku buněk. Nádorové markery lze detekovat jednak imunohistochemicky či v cytosolu nádorové buňky (celulární nádorové markery) a jednak cirkulují v krvi či v jiných biologických tekutinách (humorální nádorové markery), které lze prokázat imunoanalytickými metodami [1, 3, 9, 15]. Přítomnost nádorových markerů v tělních tekutinách a tím i možnost jejich stanovení závisí na celé řadě faktorů. Nádorové markery jsou produkovány dělícími se buňkami nádoru a jejich produkce je proto závislá na diferenciaci buněk. Málo diferencované buňky produkují pouze chemicky jednoduché sloučeniny, což jsou látky, které jsou součástí buněčného skeletu (jako jsou cytokeratininy, především TPA a TPS) nebo ty, které jsou nezbytnou součásti enzymatického vybavení každé buňky, jako je timidinkináza. Většinou autorů jsou tyto markery označovány jako markery proliferace. Většina ostatních nádorových markerů obsahuje ve své molekule proteiny, glycidy, mucin a podobné látky, které musí být tvořeny složitým buněčným enzymatickým aparátem, tzn. vysoce diferencovanou nádorovou buňkou. Dalším předpokladem možnosti stanovení nádorových markerů v tělních tekutinách je vaskularizace nádoru. Avaskulární nádor sice může produkovat nádorový marker, ale při stanovení v biologických tekutinách jej nemáme možnost prokázat, pokud není do biologické tekutiny vyplaven. Vaskularizace nádoru tedy výrazně ovlivňuje přítomnost a prokazatelnost nádorových markerů v biologických tekutinách.
Přestože diagnostický práh nádorových markerů umožňuje v příznivých případech odhalit nádor o hmotnosti 1 mg (106 maligních buněk), zatímco klinická diagnóza bývá určena většinou až u nádoru, který obsahuje asi 109 buněk, neexistuje dosud vzhledem k širokému spektru nádorových onemocnění univerzální nádorový marker a ani senzitivita při dostatečné specificitě nedosahuje optimální spolehlivosti.
MATERIÁL A METODA
Nádorové markery byly vyšetřovány u souboru nemocných s primárně diagnostikovaným a histologicky verifikovaným adenokarcinomem tlustého střeva. Jednalo se o 52 pacientů (32 mužů, 20 žen) průměrný věk nemocných je 63,4 roku (40–79,1 let). Jednalo se o pacienty s lokoregionálním nádorovým onemocněním (stadia I.–stadia III.), pouze u dvou pacientů byly v průběhu operace diagnostikovány vzdálené metastázy na játrech, které před operací nebyly patrné pomocí zobrazovacích metod. Hodnoty nádorových markerů byly stanoveny pomocí komerčních diagnostických souprav podle doporučení výrobců. Jednalo se o následující komerční soupravy pro stanovení nádorových markerů: karcinoembryonální antigen (CEA, IRMA, Immunotech Česká republika), glykoproteinový antigen mucinosního typu: Carbohydrate antigen 19-9 (CA 19-9 Shering - CIS France) a tkáňového specifického polypeptidového antigenu (TPS, IRMA, IDL Sweden), fragment cytokeratininu 19 (CYFRA 21-1, Shering - CIS France). Sledované markery byly stanoveny v následujících intervalech:
- předoperačně (v intervalu 2 týdny až 1 den před operací),
- pooperačně (7. den po operaci),
- v průběhu dispenzární péče v 6 měsíčních intervalech, tj. 6, 12, 18 a 24 měsíců po operaci.
Statistická analýza dat byla provedena s využitím programu S.A.S. verze 6.12. Deskriptivní statistika (průměr, medián, směrodatná odchylka, maximum, minimum) byla počítána u celého souboru pacientů a dále v jednotlivých podskupinách. Korelace mezi parametry byly určovány pomocí výpočtu Spearmanova pořadového korelačního koeficientu. Porovnání podle různých kritérií byla prováděna pomocí Wilcoxonova nepárového testu a také analýzy rozptylu (ANO V A). Odhad funkcí přežití byl počítán metodou Kaplana-Meiera (life-product) a byl počítán Coxův model proporcionálních rizik podle různých kritérií.
VÝSLEDKY
V následujících tabulkách (tab. 1–tab. 6) je uvedena základní deskriptivní statistika pro výše uvedené intervaly odběrů nádorových markerů.
Table 1. Základní deskriptivní statistika předoperačních hodnot nádorových markerů Tab. 1. Basic descriptive statistics of preoperative tumor markers values 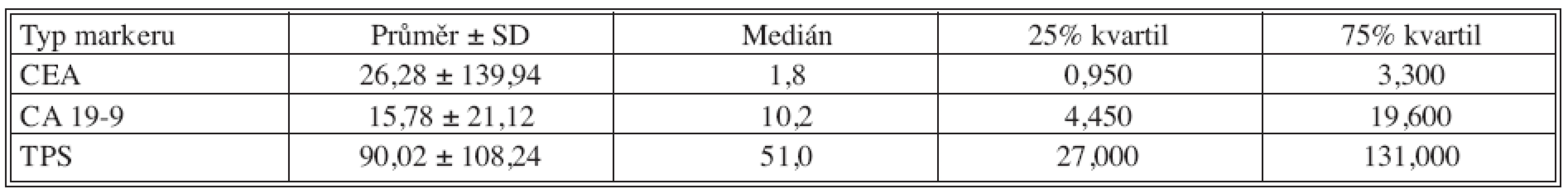
Table 2. Základní deskriptivní statistika pooperačních hodnot nádorových markerů Tab. 2. Basic descriptive statistics of postoperative tumor markers values 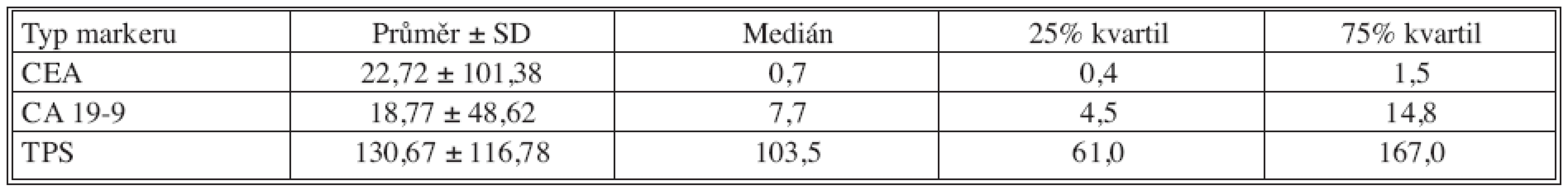
Table 3. Základní deskriptivní statistika hodnot nádorových markerů – 6 měsíců po operaci Tab. 3. Basic descriptive statistics of the tumor markers values– the postoperative Month 6 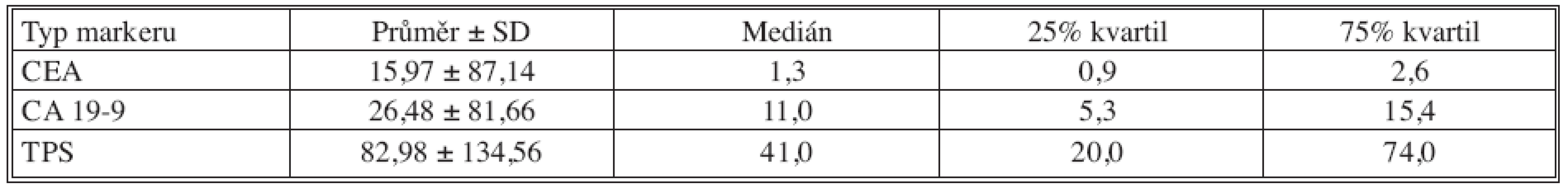
Table 4. Základní deskriptivní statistika hodnot nádorových markerů – 12 měsíců po operaci Tab. 4. Basic descriptive statistics of the tumor markers values – the postoperative Month 12 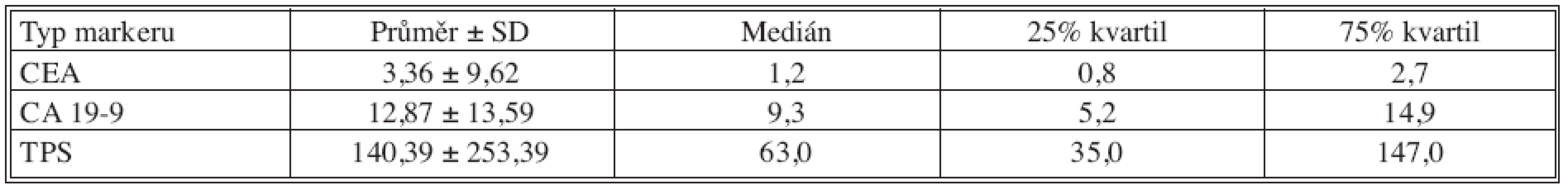
Table 5. Základní deskriptivní statistika hodnot nádorových markerů – 18 měsíců po operaci Tab. 5. Basic descriptive statistics of the tumor markers values – the postoperative Month 18 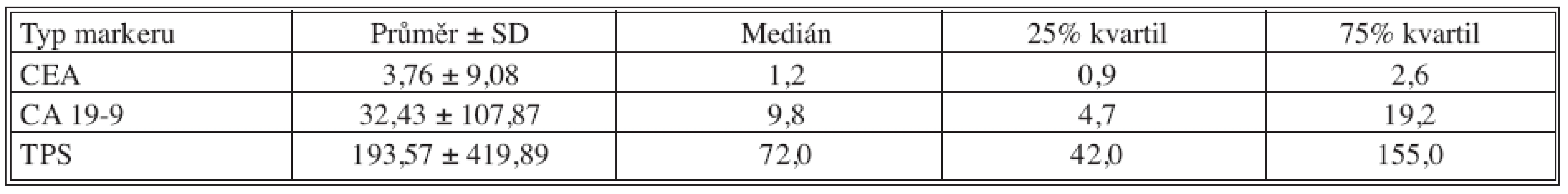
Table 6. Základní deskriptivní statistika hodnot nádorových markerů – 24 měsíců po operaci Tab. 6. Basic descriptive statistics of the tumor markers values – the postoperative Month 24 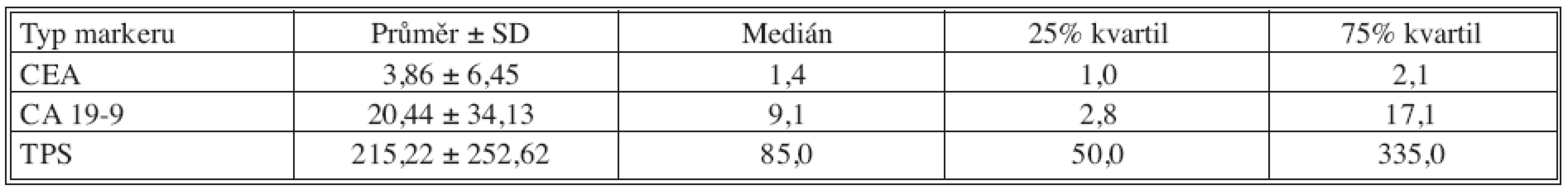
U klasických nádorových markerů došlo pooperačně k poklesu hodnot nádorových markerů, statisticky významný byl pouze pokles CEA. U TPS došlo k signifikantnímu nárůstu, což je nejpravděpodobněji spjato s reparačními pochody po provedené operaci (pooperační odběry byly provedeny 7. den po operaci).
Table 7. Srovnání před- a pooperačních hodnot nádorových markerů a jejich vzájemná korelace Tab. 7. Comparison between the pre- and postoperative tumor markers values and their intercorrelation 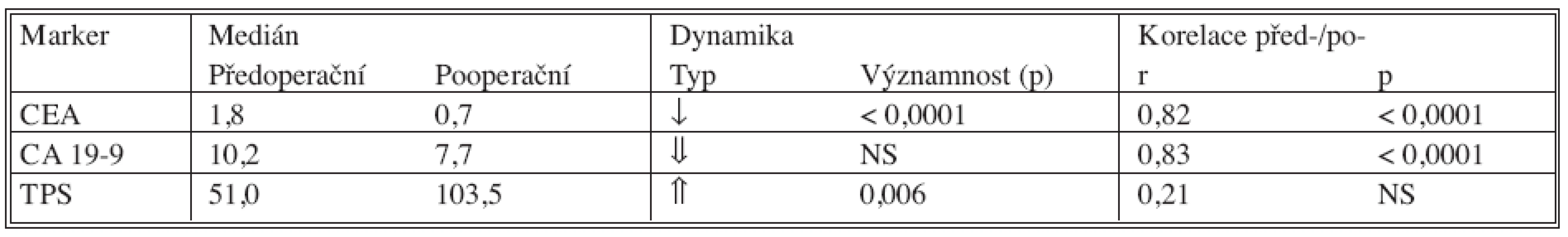
V tabulce 8 je porovnání mediánů hodnot nádorových markerů v klinické remisi nádorového onemocnění a hodnot nádorových markerů u pacientů v klinické progresi nádorového onemocnění. Do statistické analýzy byly zavzaty pouze hodnoty zjištěné při první progresi, která nastala po primární terapii.
Z tabulky 8. vyplývá, že u hodnot CEA a TPS se signifikantně liší remisní a progresní hodnoty nádorových markerů. Tento rozdíl nebyl signifikantní u nádorového markem CA 19-9.
Table 8. Porovnání remisních a progresních hodnot u nemocných s kolorektálním karcinomem Tab. 8. Comparison between the remission and the progression values in colorectal carcinoma patients 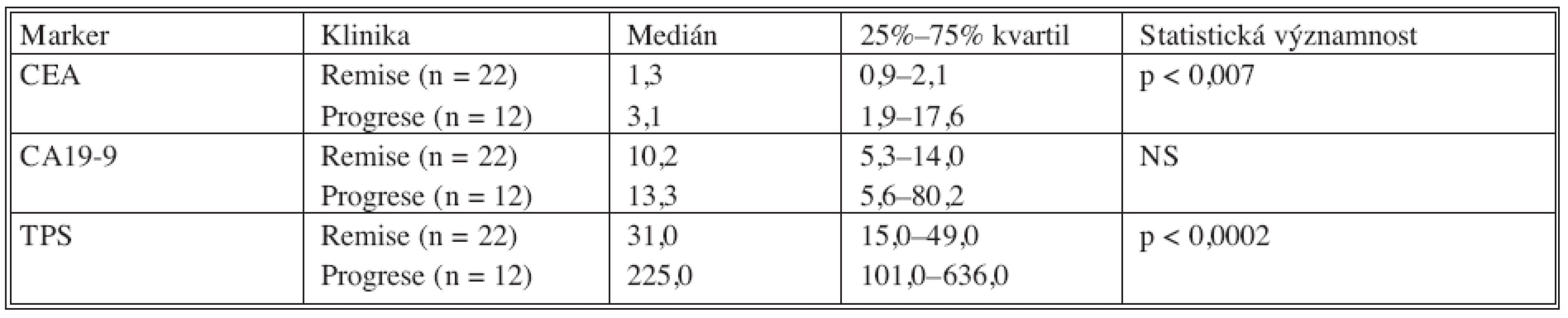
V tabulce 9 jsou uvedeny senzitivity jednotlivých nádorových markerů pro diagnostiku progrese (lokální recidiva, vzdálené metastázy) kolorektálního karcinomu při 95% specificitě vůči remisní skupině pacientů. Formou ROC křivek jsou senzitivity a specificity uvedené v grafu 1.
Table 9. Senzitivity jednotlivých nádorových markerů pro diagnostiku progrese (lokální recidiva, vzdálené metastázy) kolorektálního karcinomu při 95% specificitě Tab. 9. Sensitivity of the individual tumor markers for the colorectal carcinoma progression (local relaps, distant metastases) diagnostics, 95% specificity 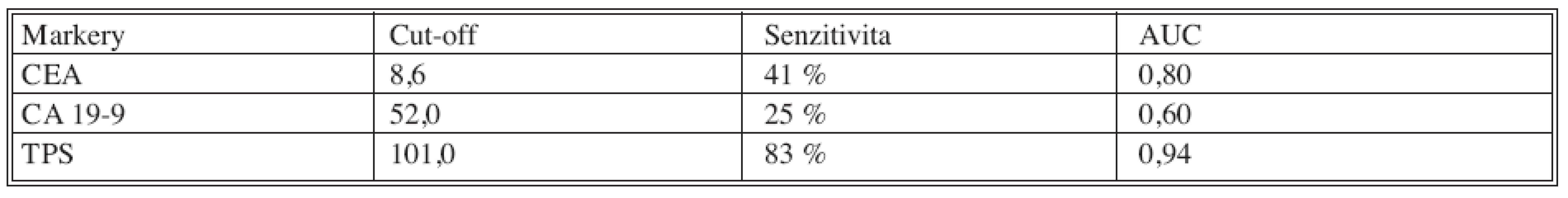
Z tabulky 9. a grafu 1. vyplývá, že nejvyšší senzitivity bylo dosaženo pro cytokeratininový marker TPS (senzitivita 83% při 95% specificitě), zatímco senzitivity klasických nádorových markerů byly nižší (CEA 41%, CA 19-9 25%).
Graph 1. ROC pro diagnostiku progrese kolorektálního karcinomu Graph 1. ROC curve for the colorectal carcinoma progression diagnostics 
DISKUSE
Stanovení pooperačních hodnot nádorových markerů má praktický význam především u CEA, kde můžeme podle poklesu hladin tohoto markerů hodnotit úspěšnost resekčního výkonu, popř. mohou elevované hladiny CEA upozornit na reziduální nádorovou masu, pokud jejich hodnoty neklesnou do 4–6 týdnů po operaci [7]. V jedné studii, kde bylo sledováno 90 pacientů po resekčním výkonu, došlo u všech k poklesu pooperačních hladin CEA. Pouze u 6 pacientů přetrvávaly zvýšené hladiny CEA a u všech těchto pacientů došlo k recidivě onemocnění [13]. Kim a kol. prezentovali práci, kde 23 ze 33 sledovaných pacientů (70 %) s elevací CEA do 2 týdnů po operaci, mělo později recidivu onemocnění, ve srovnání s 23 ze 113 pacientů (21 %), kteří měli hladinu CEA v normě [10]. Také v našem souboru pacientů nejlépe reagoval na resekční terapii pokles pooperačních hodnot CEA. V případě nádorového markem CA 19-9 nedošlo k žádné změně mezi hladinami před a pooperačních hodnot, u nádorového markerů TPS, který byl v našem souboru pooperačně sledován, došlo naopak k výraznému vzestupu pooperačních hodnot, což bylo nejspíše spjato s reparačními pochody po provedené operaci. Lze konstatovat, že pro kontrolu úspěchu chirurgické léčby je nejvíce vhodné sledovat před - a pooperační hodnoty CEA.
Dlouhodobé sledování hladin nádorových markerů u kolorektálních karcinomů, které jej produkují, je vhodným prostředkem pro sledování účinnosti nejen úspěchu chirurgické léčby, ale i pooperační radio - či chemoterapie. Sledování nádorových markerů za účelem včasné diagnostiky recidivy či progrese nádorového onemocnění je hlavní doménou indikace těchto vyšetření v průběhu follow up.
Ačkoliv je marker CEA v průběhu follow up považován za časný indikátor recidivy či progrese [1, 2, 11, 16], jsou názory autorů na stanovování dalších nádorových markerů, zejména CA 19-9, který je považován za marker druhé volby, [3, 14] značně kontroverzní. Některé práce udávají zvýšené hladiny CA 19-9 u 80 % pacientů s recidivou nádorového onemocnění [18]. Forslund a kol. prezentuje senzitivity CA 19-9 pro detekci relapsu v průběhu follow up pro stadia Dukes’A – D, kdy ve všech stadiích jsou dosažené senzitivity pro CA 19-9 vyšší než pro CEA [8] Nicméně tato data jsou v rozporu s výsledky, které publikují jiní autoři [2, 18, 19]. Například Carpelan a kol. uvádí, že senzitivity CA 19-9 byly pro diagnostiku relapsu nádoru v průběhu follow up o mnoho nižší (38 %) [2]. Podobné kontroverze jsou uváděny i pro CEA jako hlavní nádorový marker. Kromě doporučení ‘European Working Group on Tumour Markers‘ nebyla dosud standardizována kritéria pro výběr kontrolních skupin pacientů a to především pro retrospektivně získaná data, která jsou v metaanalýzách s výsledky prospektivních studií často srovnávána [4, 7, 12]. Při našem hodnocení jsme se drželi doporučení EGTM, kdy jako remisní hodnoty byly brány v úvahu pouze v případě, že pocházely od žijících nemocných, kteří nikdy neměli progresi a nebyly u nich nalezeny distanční metastázy. Kromě toho byly vyloučeny všechny výsledky v intervalu šesti až dvanácti měsíců po skončení primární terapie (nelze odhadnout vliv terapie, kdy především u adjuvantní léčby může být podáno až 12 cyklů chemoterapie). Zároveň byli vyloučeni pacienti, u kterých se v průběhu dispenzární péče vyskytovalo benigní, či zánětlivé onemocnění, které by mohlo nespecificky ovlivnit hodnoty nádorových markerů. Jako progresní byly brány v úvahu pouze hodnoty, které jako první odpovídaly klinické progresi zjištěné pomocí zobrazovacích či endoskopických metod. Při 95% specificitě bylo nejvyšších senzitivit dosaženo u nádorového markerů TPS (83 %), senzitivity klasických nádorových markerů CEA a CA 19-9 byly podstatně nižší (41 % respektive 25 %). Tyto hodnoty jsou poněkud překvapivé, především pro nízkou senzitivitu klasických nádorových markerů. Vysvětlením může být charakteristika souboru, kde do grantové studie vstupovali pacienti s lokálně pokročilým onemocněním střeva (stadia I-III, tzn. maximálně s nádorovým postižením lokoregionálních uzlin), pouze u dvou pacientů byly perioperačně zjištěny distální metastázy do jater. Dále jde i o charakter recidiv, kde se ve více než v 50 % jednalo o lokoregionální recidivu. Výsledky je třeba interpretovat opatrně pro malý počet relapsů vzhledem ke krátkému follow up, nicméně se TPS zdá jako slibný marker pro follow up pacientů s kolorektálním karcinomem. Jako ideální se proto zdá kombinace CEA a TPS. Toto zjištění je v souladu se zjištěním některých dalších autorů, kteří potvrzují význam sledování CEA a cytokeratininových nádorových markerů pro follow up kolorektálního karcinomu [5, 6, 17].
Z předchozí diskuse vyplývá, že systematická monitorace hladin nádorových markerů pro sledování účinnosti léčby a včasnou diagnostiku recidiv a progrese onemocnění je hlavní doménou indikace tohoto vyšetření. Je třeba ale dodržovat určitá pravidla, bez kterých monitorace nemá smysl.
V prvé řadě musíme brát v úvahu falešnou pozitivitu výsledků u některých benigních onemocnění, zánětlivých onemocnění, u kuřáků a při léčbě některými cytostatiky (fluorouracyl, levamizol) [7]. Lehce či kolísavě zvýšená pooperační hladina CEA může být často způsobena abúzem nikotinu, či v populaci se poměrně často vyskytujícím benigním onemocněním jater. Hodnoty TPS mohou být ovlivněny zánětlivým onemocněním, nebo pochody spojenými s reparací a regenerací tkání, např. po operaci. Pokud je detekována zvýšená hladina nádorového markeru u pacienta, který měl do té doby normální hodnoty, je třeba v prvé řadě nutno vyšetření zopakovat pokud možno ze stejného séra k vyloučení možné laboratorní chyby. Dále by měly být vzaty v úvahu výsledky jaterních testů a vyšetření ledvin, protože jaterní či renální insuficience mohou být příčinou nespecifického zvýšení nádorových markerů [7].
Další nespecifické ovlivnění hodnot může být způsobeno celou řadou chyb vznikajících v preanalytické a analytické fázi stanovení nádorových markerů. Ordinující lékař by měl zasílat vzorky k analýze do stejné laboratoře, která stanovuje nádorové markery jednou metodikou. Pouze tak se lze vyhnout nesprávné interpretaci výsledků, u kterých je rozdíl hodnot způsoben volbou metody stanovení. Pro kvalitní klinické zhodnocení vyšetření nádorových markerů je tedy nutná úzká interdisciplinární spolupráce, při které jsou pokud možno vyloučeny nespecifické vlivy, které mohou provedená stanovení ovlivnit. Další důležitou podmínkou je systematické sledování nádorových markerů. Teprve opakovaně zvýšená hodnota nádorového markeru (alespoň 3x za sebou) dává po vyloučení výše uvedených skutečností podezření na možnou přítomnost reziduální nádorové tkáně či na progresi onemocnění. Protože pro follow up je daleko důležitější dynamika procesu než absolutní hodnota markeru, je zcela nezbytné u nemocných, kde je toto vyšetření indikováno, sledovat hladiny nádorových markerů v pravidelných intervalech. Příležitostné ordinování nádorových markerů není smysluplné a je spíše finanční ztrátou, protože náhodná měření zcela ztrácejí svoji výpovědní hodnotu. Z výše uvedených skutečností vyplývá, že stanovení nádorových markerů má v diagnostice kolorektálního karcinomu nesporný význam. Je třeba však brát v úvahu, že se jedná o pomocnou diagnostickou metodu a proto je pro optimální klinické využití nezbytná nejen účelná indikace těchto vyšetření, ale i spolupráce mezi klinikem a laboratorními pracovníky. Pouze tak lze zajistit správnou interpretaci výsledků a eliminovat tak celou řadu nespecifických faktorů, které mohou výsledek vyšetření ovlivnit.
ZÁVĚR
Resekční terapie vedla k poklesu pooperačních hodnot CEA. V případě nádorového markeru CA 19-9 nedošlo k žádné změně mezi hladinami před a pooperačních hodnot, u nádorového markem TPS došlo naopak k výraznému vzestupu pooperačních hodnot, což je nejspíše spjato s reparačními pochody po provedené operaci. Lze konstatovat, že pro kontrolu úspěchu chirurgické léčby je nejvíce vhodné sledovat před - a pooperační hodnoty CEA. Při 95% specificitě pro zjištění recidivy onemocnění bylo nejvyšších senzitivit dosaženo u nádorového markem TPS (83%), kdy pooperační zvýšení hladin tohoto markeru je možno přisuzovat pooperačním reparačním procesům, pak v průběhu follow up by měla jeho hladina klesat, naopak mírně progredující tendence je podle naších výsledků známkou lokoregionální recidivy kolorektálního karcinomu. Senzitivity klasických nádorových markerů CEA a CA 19-9 byly podstatně nižší (41 % respektive 25 %). Výsledky je třeba interpretovat opatrně pro malý počet relapsů vzhledem ke krátkému follow up, a pro spíše lokoregionální charakter recidiv. Přesto se TPS zdá jako slibný marker pro follow up pacientů s kolorektálním karcinomem. Jako ideální se proto jeví kombinace CEA a TPS.
Stanovení nádorových markerů má v diagnostice kolorektálního karcinomu nesporný význam. Je třeba však brát v úvahu, že se jedná o pomocnou diagnostickou metodu a proto je pro optimální klinické využití nezbytná nejen účelná indikace těchto vyšetření, ale i spolupráce mezi klinikem a laboratorními pracovníky. Pouze tak lze zajistit správnou interpretaci výsledků a eliminovat tak celou řadu nespecifických faktorů, které mohou výsledek vyšetření ovlivnit.
MUDr. Karel Rupert, Ph.D.
Červenohrádecká 16D
314 00 Plzeň
e-mail: rupert@fnplzen.cz
Sources
1. Becker, H. D., Hohenberg, W., Junginger, T., Schlag, P. M. Chirurgická onkologie. Grada, 2005, p. 3–17, 29–35, 41–46, 457–545.
2. Carpelan-Holmstrom, M., Louhimo, J., Stenman, U. H., Alfthan, H., Jarvinen, H., Haglund, C. CEA, CA 242, CA 19-9, CA 72-4 and hCGbeta in the diagnosis of recurrent colorectal cancer. Tumour Biol., 2004, Sep-Dec; 25(5-6): 228–234.
3. Duffy, M. J., van Dalen, A., Haglund, C., Hansson, L., Klapdor, R., Lamerz, R., Nilsson, O., Sturgeon, C., Topolcan, O. Clinical utility of biochemical markers in colorectal cancer: European Group on Tumour Markers (EGTM) guidelines. Eur. J. Cancer, 2003 Apr; 39(6):718–727.
4. Fakih, M. G., Padmanabhan, A. CEA monitoring in colorectal cancer. What you should know. Oncology (Williston Park), 2006 May; 20(6): 579–587; discussion 588, 594, 596.
5. Fernandes, L. C., Kim, S. B., Matos, D. Cytokeratins and carcinoembryonic antigen in diagnosis, staging and prognosis of colorectal adenocarcinoma. World J. Gastroenterol., 2005 Feb7; 11(5): 645–648.
6. Fernandes, L. C., Kim, S. B., Saad, S. S., Matos, D. Value of carcinoembryonic antigen and cytokeratins for the detection of recurrent disease following curative resection of colorectal cancer. World J. Gastroenterol., 2006 Jun 28; 12(24): 3891–3894.
7. Fletcher, R. H. Successfull colorectal cancer screening starts with primary care. Rev. Gastroenterol. Disord. 2, Suppl. 1, 2002, p. 27–34.
8. Forslund, A., Engaras, B., Lonnroth, C., Lundholm, K. Prediction of postoperative survival by preoperative serum concentrations of anti-p53 compared to CEA, CA 50, CA 242 and conventional blood tests in patients with colorectal carcinoma. Int. J. Oncol., 2002 May; 20(5): 1013–1018.
9. Holubec, L., et al. Kolorektální karcinom – současné možnosti diagnostiky a léčby. Grada, 2004, p. 15–23, 15–18, 103–132.
10. Kim, S. B., Fernandes, L. C., Saad, S. S., Matos, D. Assessment of the value of preoperative sérum levels of CA 242 and CEA in the staging and postoperative survival of colorectal adenocarcinoma patients. Int. J. Biol. Markers, 2003 Jul-Sep; 18(3): 182–187.
11. Körner, H., Söeide, K., Stokkeland, P. J., Soreide, J. A. Diagnostic accuracy of serum-carcinoembryonic antigen in recurrent colorectal cancer: a receiver operating charakteristic curve analysis. Ann. Surg. Oncol., 2007 Feb; 14(2): 417–423.
12. Locker, G. Y., Hamilton, S., Harris, J., Jessup, J. M., Kemeny, N., Macdonald, J. S., Somerfield, M. R., Hayes, D. F., Bast, R. C. Jr., ASCO ASCO 2006 update of recommendations for the use of tumor markers in gastrointestinal cancer. J. Clin. Oncol., 2006 Nov 20; 24(33): 5313–5327. Epub 2006 Oct23.
13. Louhimo, J., Carpelan-Holmstrom, M., Alfthan, H., Stenman, U. H., Jarvinen, H. J., Haglund, C. Serum HCG beta, CA 72-4 and CEA are independent prognostic factors in colorectal cancer. Int. J. Cancer, 2002 Oct 20; 101(6): 545–548.
14. McWilliams, R. R., Erlichman, C. Novel therapeutics in colorectal cancer. Dis. Colon Rectum, 2005 Aug; 48(8): 1632–1650.
15. Nekulová, M., Šimíčková, M., Černoch, M. Charakteristika a využití jednotlivých nádorových markerů. V: Nádorové markery. Boehringer Mannheim Czech, 1996, 15–31.
16. Rejthar, A., Vojtěšek, B. Obecná patologie nádorového růstu. Praha, Grada 2002.
17. Sandelewski, A., Kokocinska, D., Partyka, R., Kocot, J., Starzewski, J., Chanek, I., Jalowiecki, P. Usefulness of evaluation of carcinoembryonic antigen (CEA) and soluble fragments of cytokeratin 18-th (TPS) in postoperative monitoring of patiens with colorectal cancer. Pol. Merkur Lekarski, 2005 Jun; 18(108): 647–650.
18. Schwartz, M. Screening for Colorectal Cancer. In: Topics in Primary Care. University Health Care Services, Chicago, 1998, pp 1–5.
19. von Kleist, S., Hesle, Y., Kananeeh, H. Comparative evaluation of four tumor markers, CA 242, CA 19-9 TPA and CEA in carcinomas of the colon. Anticancer Research. 1996; 16(4B): 2325–2331.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 8-
All articles in this issue
- Výsledky jednoročního přežití u nemocných po resekci hlavy slinivky břišní s resekcí žil portomezenterické oblasti (PMO)
- Optimální miniinvazivní přístup při náhradě jícnu žaludkem
- GIST jako příčina invaginace na tenkém střevě
- Význam cytokeratinového markeru TPS v pooperačním sledování nemocných s kolorektálním karcinomem
- Transarteriální chemoembolizace u hepatocelulárního karcinomu jater
- 120 laparoskopických adrenalektomií s harmonickým skalpelem
- PTA krurálnych tepien u diabetikov
- Poúrazová svalová hernia predlaktia
- Léze podkolenní jamky s neurologickou symptomatologií – kazuistiky, diagnostika a léčba
- Léčení seniorů na okresním chirurgickém oddělení
- Přínos magnetické rezonance pro diagnostiku a léčbu poranění torakolumbální páteře
- Přínos ultrasonografie břicha v diagnostice akutní apendicitidy – naše zkušenosti
- PCCP versus standardní proximální femorální hřeb při léčbě pertrochanterických zlomenin femoru
- Operační rizika a význam předoperační péče
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Operační rizika a význam předoperační péče
- Léze podkolenní jamky s neurologickou symptomatologií – kazuistiky, diagnostika a léčba
- Transarteriální chemoembolizace u hepatocelulárního karcinomu jater
- Výsledky jednoročního přežití u nemocných po resekci hlavy slinivky břišní s resekcí žil portomezenterické oblasti (PMO)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

