-
Medical journals
- Career
Transarteriální chemoembolizace u hepatocelulárního karcinomu jater
: M. Varga; A. Valsamis; I. Matia; J. Peregrin *; E. Honsová **; M. Šafanda ***; M. Oliverius
: Klinika transplantační chirurgie IKEM, přednosta: prof. MUDr. M. Adamec, CSc. ; Pracoviště radiodiagnostiky a intervenční radiologie IKEM, přednosta: prof. MUDr. J. Peregrin, CSc. *; Pracoviště klinické a transplantační patologie IKEM, přednostka: MUDr. E. Honsová, Ph. D. **; Oddělení klinické onkologie Nemocnice Na Homolce, primář: MUDr. M. Šafanda ***
: Rozhl. Chir., 2009, roč. 88, č. 8, s. 434-438.
: Monothematic special - Original
Úvod:
Hepatocelulární karcinom (HCC) je celosvětově pátý nejčastější zhoubný novotvar. Ve většině případů vzniká v terénu jaterní cirhózy. Incidence v České republice je kolem 250 případů za rok. Z toho jen u 15–20 % nemocných je možná kurabilní terapie – jaterní resekce nebo transplantace jater. U ostatních pacientů je indikována paliativní nebo symptomatická léčba. Paliativní terapie zahrnuje perkutánní ablační metody, transarteriální chemoembolizaci (TACE), systémovou chemoterapii a nebo biologickou léčbu sorafenibem. TACE je metodou volby u pacientů nevhodných k resekci a ablační léčbě. Jeho další využití je v zabránění progrese nádoru před transplantací, případně v kombinaci s jinými metodami k dosažení downstagingu nádoru a následného zařazení ke kurabilní léčbě.Cíl:
Cílem práce bylo zjistit přeživání a komplikace u pacientů po transarteriální chemoembolizaci inoperabilního hepatocelulárniho karcinomu.Materiál a metodika:
V období let 2004 až 2008 jsme provedli 30 TACE. Z toho jsme 28 výkonů provedli u 20 pacientů s diagnózou HCC. Chemoembolizace byla prováděná superselektivně cestou arteria femoralis směsí Doxorubicinu a Lipiodolu. Následovala ambulantní dispenzarizace s pravidelnými laboratorními kontrolami a kontrolami počítačovou tomografií (CT).Výsledky:
Po žádném výkonu se nevyskytly závažné komplikace. Po 10 výkonech (33 %) došlo k nezávazným komplikacím a to elevaci jaterních testů 6x, subfebríliím 6x a bolestem v pravém podžebří 4x. Jedno-, dvou - a tříleté přežívání pacientů je 53 %, 40 % a 20 %.Závěr:
Transarteriální chemoembolizace je bezpečná metoda prodlužující přežití pacientů s jinak neléčitelným HCC. Pacienti jsou k léčbě indikováni na základě multioborové spolupráce (chirurg, hepatolog, onkolog a invazivní radiolog). Podmínkou úspěšné léčby HCC je její koncentrace na specializovaném pracovišti s dostupností všech diagnostických a terapeutických metod.Klíčová slova:
hepatocelulární karcinom – transarteriální chemoembolizaceÚVOD
Hepatocelulární karcinom (HCC) je celosvětově pátý nejčastější zhoubný novotvar [1] a nejčastější primární zhoubný jaterní nádor. Až 90 % případů vzniká v terénu jaterní cirhózy. V etiologii existují endemické rozdíly. Zatímco v Evropě je výskyt o něco nižší a významnou roly hraje chronická hepatitida C a etylická jaterní cirhóza [2–4], v Asii a Africe se na jeho etiologii více podílí chronická hepatitida B a svoji roli zde hraje i expozice aflatoxinu z potravy. V České republice je incidence HCC kolem 250 případů za rok (podle údajů ÚZIS bylo v roce 2004 hlášeno 267 nových případů HCC). Z toho jen u 15–20 % nemocných je možná kurativní terapie – jaterní resekce nebo transplantace jater [5, 6]. U ostatních pacientů je indikována léčba paliativní nebo symptomatická. Paliativní terapie zahrnuje perkutánní ablační metody (radiofrekvenční ablaci, perkutánní alkoholizaci), transarteriální chemoembolizaci (TACE), systémovou chemoterapii a nebo biologickou léčbu sorafenibem. Podávání sorafenibu u nepředléčných nemocných mírně,ale statisticky významně prodlužuje čas do progrese i celkové přežití [7]. Neléčený HCC má velmi špatnou prognózu s mediánem přežití 1 až 8 měsíců [8]. TACE je metodou volby, která vede k signifikantnímu prodloužení přežití [9–11], u pacientů nevhodných k resekci nebo ablační léčbě. Další indikací je zabránění progrese tumoru u pacientů zařazených na čekací listinu k transplantaci, zejména když je očekávaná doba do transplantace delší něž půl roku [12].
MATERIÁL A METODA
Od prosince 2004 do prosince 2008 jsme provedli 30 TACE u 21 pacientů. Z toho 28 zákroků u 20 pacientů bylo provedeno pro HCC a u jednoho pacienta, který odmítal transplantaci, byla TACE dvakrát provedena pro hemangioendotheliom [13].
Tumor v terénu etylické cirhózy byl indikací k TACE u 9 pacientů (45 %), v terénu HCV cirhózy u 5 pacientů (25 %), v terénu HBV cirhózy u 5 pacientů (25 %) a primární HCC byl diagnostikován u jednoho pacienta (5 %). Průměrná velikost ložisek byla 7,6 cm (3–14 cm, medián 9 cm). U 5 pacientů byl nádor před TACE histologicky verifikován. U ostatních byla diagnóza stanovena na základě zobrazovacích metod a laboratorních výsledků (AFP). K paliativní TACE jsme indikovali pacienty s neresekabilním tumorem, nevhodným k ablaci, bez známek generalizace, s průchodnou vena portae a s dobrou funkcí jater (max. Child-Pugh B – 8 bodů). Dále byla TACE provedena u 6 pacientů na čekací listině před transplantací jater.
Chemoembolizaci jsme prováděli cestou a. femoralis, přes truncus coeliacus a a. hepatica (Obr. 1). Odtud jsme superselektivně kanylovali tepnu živící tumor. Následně jsme aplikovali směs Lipiodolu (max. 20 ml) s Doxorubicinem (max. 50 mg) (Obr. 2 a 3). Po výkonu následovala observace pacienta na standardním oddělení. Podle potřeby jsme podávali analgetika a antipyretika. Pacienta jsme propustili do domácí péče obvykle první až druhý den po výkonu. Následně byla u ambulantně dispenzarizovaného pacienta provedena s odstupem 2 týdnů kontrola laboratorních parametrů a CT kontrola ložiska za 1 až 3 měsíce. Podle výsledku CT jsme eventuálně indikovali opakování TACE (progrese nálezu, zachovalé arteriální zásobení).
1. Angiografie tr. coeliacus – tumor zásobený z levé a. hepatica Fig. 1. Angiography of the tr. coeliacus – a tumor supplied from the left hepatic artery 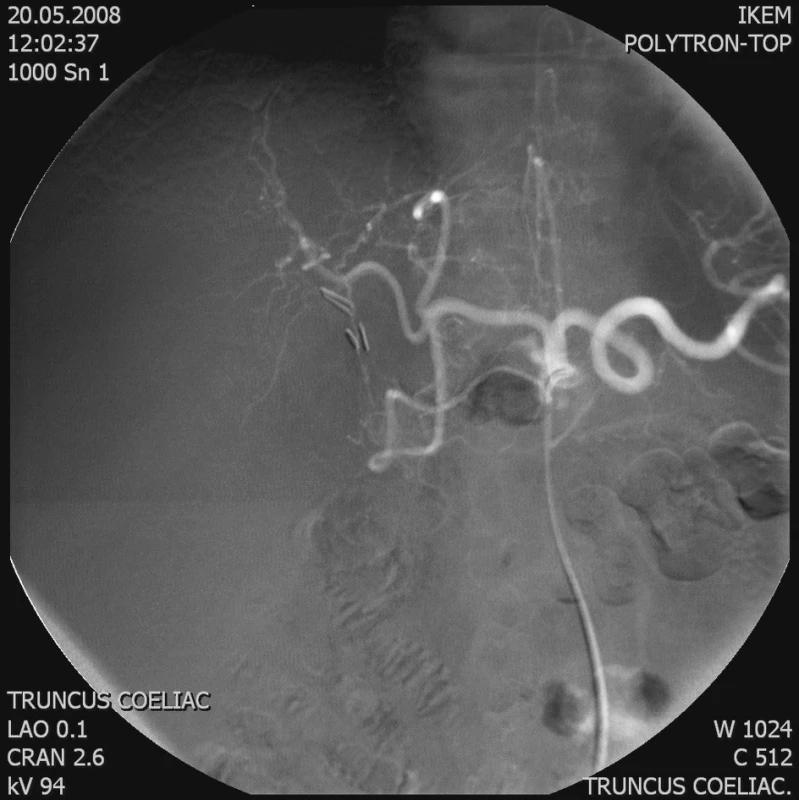
2. Po embolizaci je tumor vyplněn Lipiodolem Fig. 2. Following its embolization, the tumor is filled with Lipiodol 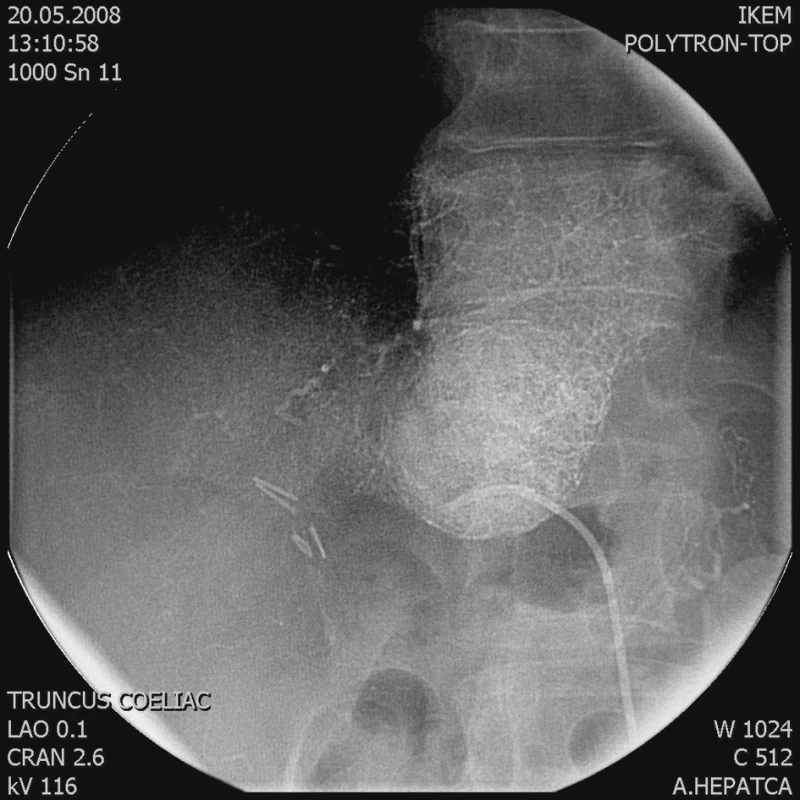
3. Kontrolní AG a. hepatica – větve zásobující tumor se neplní Fig. 3. Control AG of the hepatic artery – the branches supplying the tumor do not fill 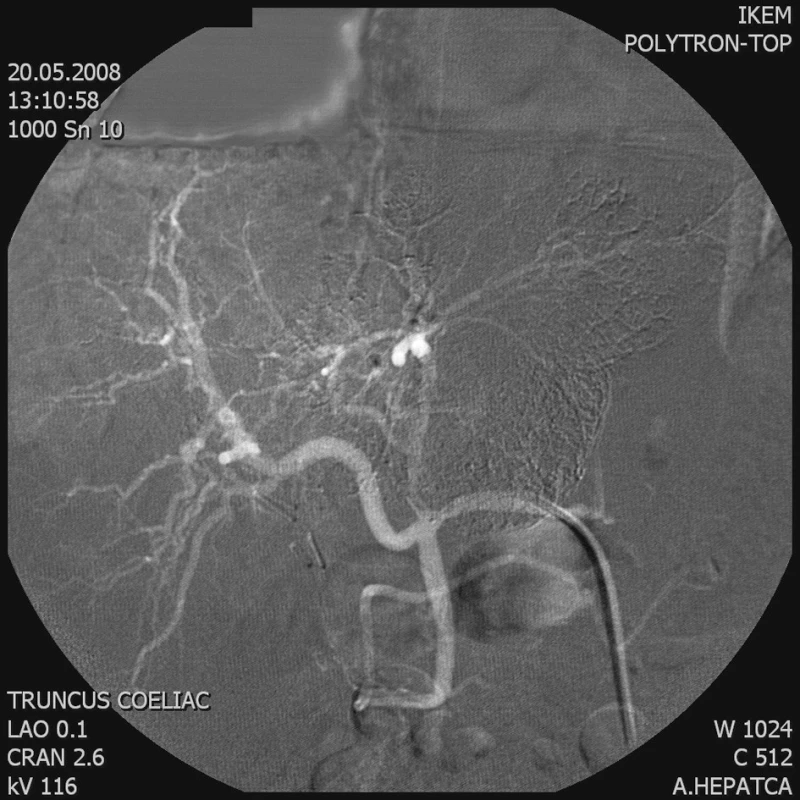
VÝSLEDKY
Závažné komplikace jsme nezaznamenali po žádném výkonu. Po 10 výkonech (33 %) došlo k nezávazným komplikacím a to elevaci jaterních testů 6x, subfebríliím 6x a bolestem v pravém podžebří 4x. U jednoho pacienta došlo k „down stagingu“ a následné resekci tumoru. Osm pacientů zemřelo na progresi onemocnění a šest pacientů žije s dobou sledování 8–42 měsíců. Průměrná doba přežití byla 21 měsíců. Jednoleté přežívání bylo 53 %, dvouleté a tříleté 40 % a 20 % (Graf 1). Výkon jsme opakovali 3x u jednoho pacienta, 2x u jiného a 1x u čtyřech pacientů. U šesti pacientů byla TACE provedena na čekací listině před transplantací jater. Z toho dva pacienti byli úspěšně transplantováni, čtyři na transplantaci čekají. V explantátu jater u obou transplantovaných pacientů se nezměnila velikost nádorového ložiska. Došlo ale k rozsáhlé nekróze nádoru, která tvořila 90 % respektive 75 % nádorové tkáně (Obr. 4, 5, 6).
1. Křivka přežívání pacientů po TACE v našem souboru. Průměrná doba přežití byla 21 měsíců. Hodnoceno metodou podle Kaplana-Meierové Graph 1. Patient survival curve following TACE in the study group. The mean survival period was 21 months. Assessed using the Kaplan-Meier method 
4. Kompletně nekrotický úsek tkáně nádoru (šipka). Nekróza je obklopená reaktivním lemem vazivové tkáně, vlevo nahoře je část cirhotického uzlu bez nádoru (100x, H&E) Fig. 4. Completely necrotized region of the tumor tissue (arrow). The necrosis is surrounded by a reactive rim of fibrous tissue, in the left upper corner, a cirrhotic, tumor-free bundle can be seen (100x, H&E) 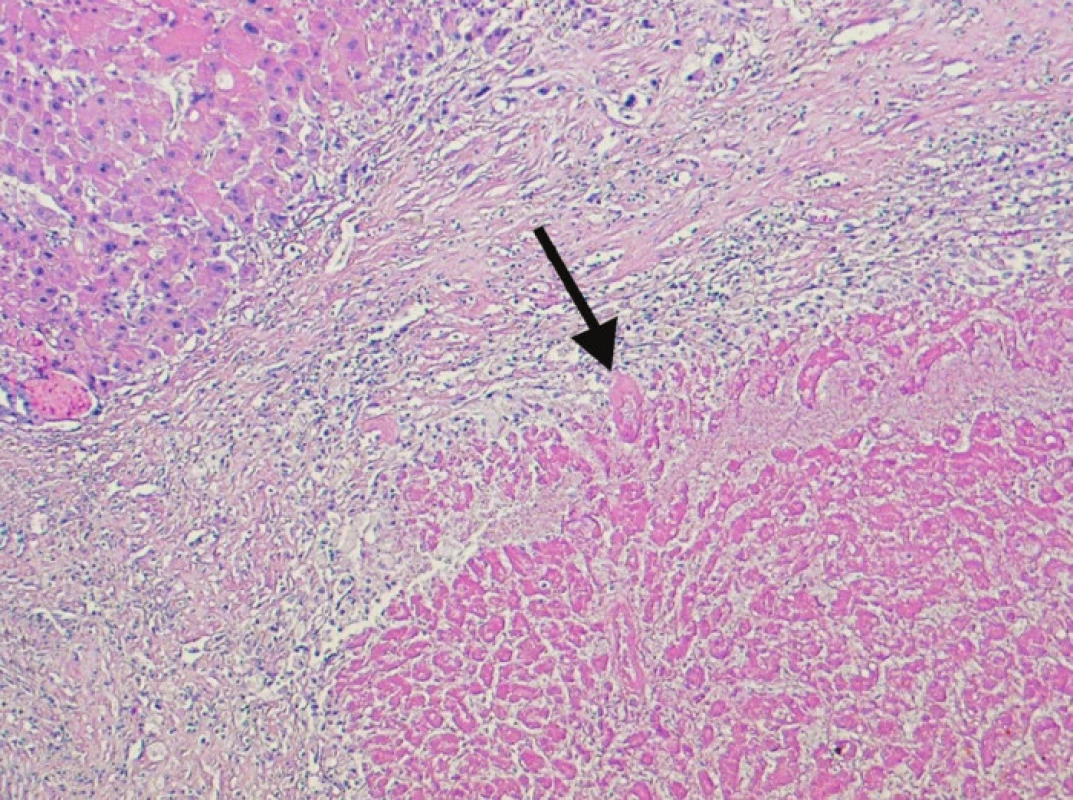
5. Detail rozhraní nekrotického nádoru a přilehlého vaziva. Tkáň na nekrózu reaguje obrovsko-buněčnou reakcí, která je součástí regresivně reparativních změn a zahrnuje resorpci nekrotických hmot s ohraničením ložiska (200x, H&E) Fig. 5. A detail view of the boundary between the necrotic tumor and the adjacent fibrous tissue. The necrosis produces a giant-cell reaction within the tissue, which is a part of the reparative changes and includes resorption of the necrotic tissue with the focus demarkation (200x, H&E) 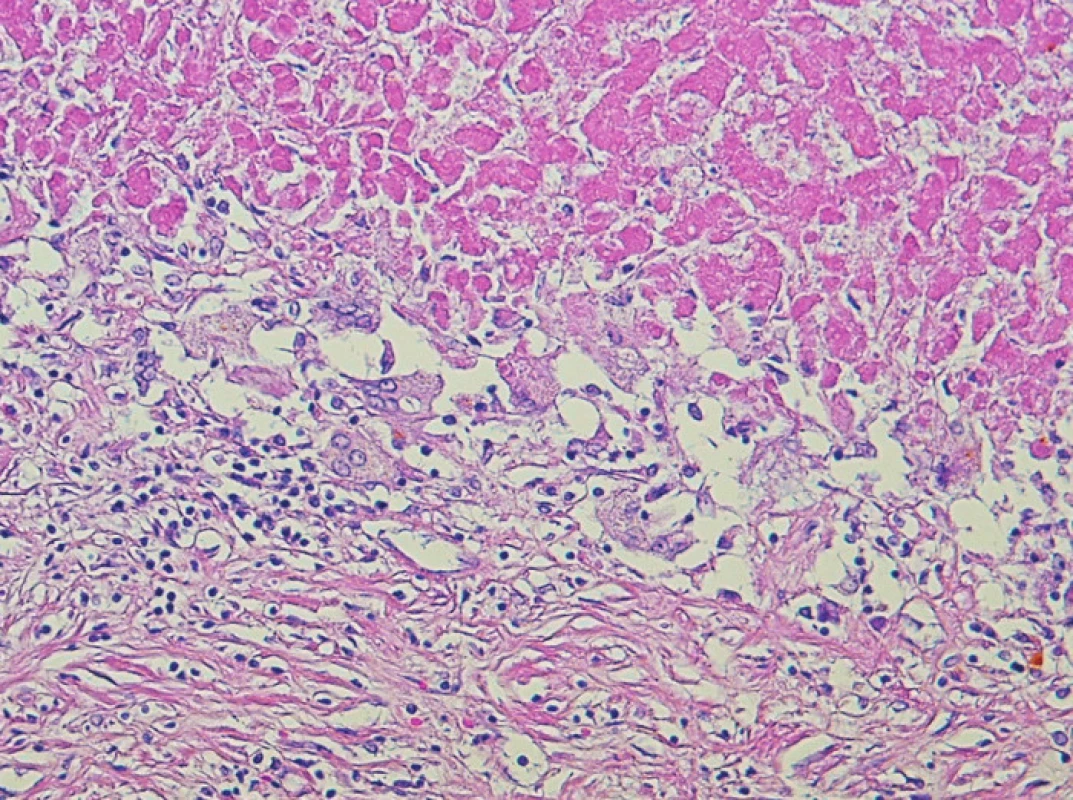
6. Nekrotický nádor – makroskopie Fig. 6. The necrotic tumor – macroscopy 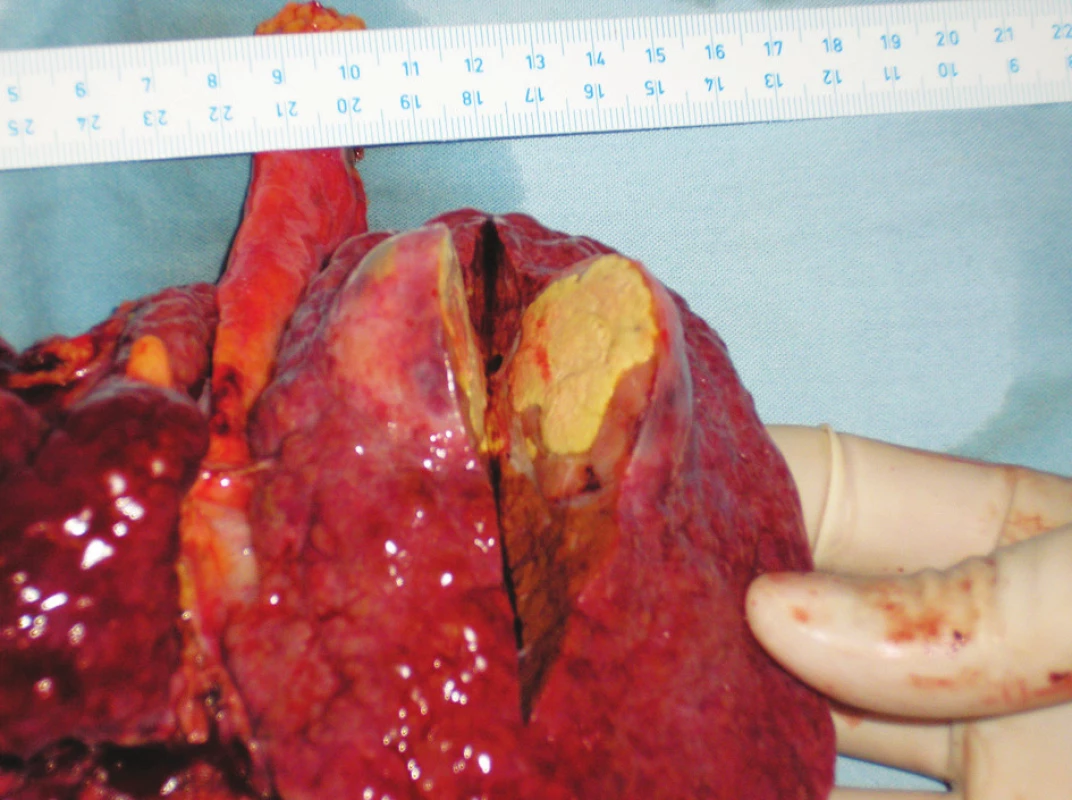
DISKUSE
První TACE byla provedena Doyonem a spolupracovníky v roce 1974 [14]. Princip metody vychází z toho, že HCC je až z 90 % živený tepennou krví z arteria hepatica [15, 16]. Lipiodol Ultra-Fluide je rentgenkontrastní iodizovaný olej který je dlouhodobě deponován v nádorové tkáni jater [17]. Při podání ve směsi s chemoterapeutikem může toto dlouhodobě lokálně působit. Byla prokázána až 40krát vyšší koncentrace chemoterapeutika v tumoru v porovnání s okolní jaterní tkání [18, 19]. Lipiodol postupně proniká až do presinusoidálních větviček v. portae a působí současnou blokádu portálního zásobení tumoru [20]. Následná embolizace nutritivní tepny želatinovou pěnou působí ischemii celého ložiska a dále potencuje terapeutický efekt [21–23].
Většina pacientů s HCC je diagnostikována v pokročilém stadiu onemocnění, které jim neumožňuje podstoupit kurativní léčbu – resekci nebo transplantaci. Pacienti nevhodní ke kurabilní terapii mají velmi špatnou prognózu. Perkutánní ablační metody jsou limitovány zejména rozsahem nádoru. Odpověď na systémovou chemoterapii je nízká (kolem 20 %) [24]. TACE je efektivní paliativní metoda léčby s prokázaným prodloužením přežití pacientů. Naše výsledky potvrzují nízké riziko komplikací a ve dvou případech histologicky verifikované nekrózy téměř celého nádoru. Přežívání pacientů závisí na mnoha faktorech: rozsah onemocnění, grading nádoru, přítomnost vaskulární invaze apod. V našem souboru převažují pacienti s pokročilejším stadiem onemocnění, což ovlivňuje celkové přežívání [9, 10, 25]. Při volbě léčebné strategie je nutná multioborová spolupráce chirurga, hepatologa, patologa, onkologa a intervenčního radiologa. U pacientů zvažovaných k transplantaci jater může TACE zmenšit nádorové ložisko. Indikace k embolizaci pacientů na čekací listině k transplantaci je v kompetenci transplantačních center.
ZÁVĚR
Transarteriální chemoembolizace je bezpečná metoda prodlužující přežití pacientů s jinak neléčitelným HCC. Pacienti jsou k léčbě indikováni na základě multioborové spolupráce (chirurg, hepatolog, onkolog a invazivní radiolog). Podmínkou úspěšné léčby HCC je její koncentrace na specializovaném pracovišti s dostupností všech diagnostických a terapeutických metod.
MUDr. Martin Varga
Ke Krči 1044/19
147 00 Praha 4
e-mail: mavg@medicon.cz
Sources
1. Parkin, D. M., Bray, F., Ferlay, J., Pisani, P. Estimating the world cancer burden: Globocan 2000. Int. J. Cancer, 2001; 94(2): 153–156.
2. Donato, F., Tagger, A., Chiesa, R., et al. Hepatitis B and C virus infection, alcohol drinking, and hepatocellular carcinoma: a case-control study in Italy. Brescia HCC Study. Hepatology, 1997; 26(3): 579–584.
3. Llovet, J. M., Burroughs, A., Bruix, J. Hepatocellular carcinoma. Lancet, 2003; 362(9399): 1907–1917.
4. Ryder, S. D. Guidelines for the diagnosis and treatment of hepatocellular carcinoma (HCC) in adults. Gut, 2003; 52 Suppl. 3: iiil–8.
5. Jaeck, D., Bachellier, P., Oussoultzoglou, E., Weber, J. C., Wolf, P. Surgical resection of hepatocellular carcinoma. Post-operative outcome and long-term results in Europe: an overview. Liver Transpl., 2004;10 (2 Suppl. l): S58–63.
6. Llovet, J. M., Bruix, J., Gores, G. J. Surgical resection versus transplantation for early hepatocellular carcinoma: clues for the best strategy. Hepatology, 2000; 31(4): 1019–1021.
7. Llovet, J. M., Ricci, S., Mazzaferro, V., et al. Sorafenib in advanced hepatocellular carcinoma. N. Engl. J. Med., 2008; 359(4): 378–390.
8. Okuda, K., Ohtsuki, T., Obata, H., et al. Natural history of hepatocellular carcinoma and prognosis in relation to treatment. Study of 850 patients. Cancer, 1985; 56(4): 918–928.
9. Takayasu, K., Arii, S., Ikai, I., et al. Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients. Gastroenterology, 2006; 131 (2): 461–469.
10. Lo, C. M., Ngan, H., Tso, W. K., et al. Randomized controlled trial of transarterial lipiodol chemoembolization for unresectable hepatocellular carcinoma. Hepatology, 2002; 35(5): 1164–1171.
11. Llovet, J. M., Real, M. I., Montana, X., et al. Arterial embolisation or chemoembolisation versus symptomatic treatment in patients with unresectable hepatocellular carcinoma: a randomised controlled trial. Lancet, 2002; 359(9319): 1734–1739.
12. Belghiti, J., Carr, B. I., Greig, P. D., Lencioni, R., Poon, R. T. Treatment before liver transplantation for HCC. Ann. Surg. Oncol., 2008; 15(4): 993–1000.
13. St Peter, S. D., Moss, A. A., Huettl, E. A., Leslie, K. O., Mulligan, D. C. Chemoembolization followed by orthotopic liver transplant for epithelioid hemangioendothelioma. Clin. Transplant., 2003; 17(6): 549–543.
14. Doyon, D., Mouzon, A., Jourde, A. M., Regensberg, C., Frileux, C. [Hepatic, arterial embolization in patients with malignant liver tumours (author_transl)]. Ann. Radiol. (Paris), 1974; 17(6): 593–603.
15. Ackerman, N. B. The blood supply of experimental liver metastases. IV. Changes in vascularity with increasing tumor growth. Surgery, 1974; 75(4): 589–596.
16. Kan, Z., Ivancev, K., Lunderquist, A., et al. In vivo microscopy of hepatic tumors in animal models: a dynamic investigation of blood supply to hepatic metastases. Radiology, 1993; 187(3): 621–626.
17. Bhattacharya, S., Novell, J. R., Winslet, M. C., Hobbs, K. E. Iodized oil in the treatment of hepatocellular carcinoma. Br. J. Surg., 1994; 81(11): 1563–1571.
18. Konno, T. Targeting cancer chemotherapeutic agents by use of lipiodol contrast medium. Cancer, 1990; 66(9): 1897–1903.
19. Nakamura, H., Hashimoto, T., Oi, H., Sawada, S. Transcatheter oily chemoembolization of hepatocellular carcinoma. Radiology, 1989; 170(3 Pt l): 783–786.
20. Gates, J., Hartnell, G. G., Stuart, K. E., Clouse, M. E. Chemoembolization of hepatic neoplasms: safety, complications, and whento worry. Radiographics, 1999; 19(2): 399–414.
21. Ikeda, M., Maeda, S., Shibata, J., et al. Transcatheter arterial chemotherapy with and without embolization in patients with hepatocellular carcinoma. Oncology, 2004; 66(1): 24–31.
22. Maeda, S., Fujiyama, S., Tanaka, M., Ashihara, H., Hirata, R., Tomita, K. Survival and local recurrence rates of hepatocellular carcinoma patients treated by transarterial chemolipiodolization with and without embolization. Hepatol. Res., 2002; 23(3): 202–210.
23. Suzuki, M., Suzuki, H., Yamamoto, T., et al. Indication of chemoembolization therapy without gelatin sponge for hepatocellular carcinoma. Semin. Oncol., 1997; 24(2 Suppl 6): S6-110–S6-115.
24. Nerenstone, S., Friedman, M. Medical treatment of hepatocellular carcinoma. Gastroenterol. Clin. North Am., 1987; 16(4): 603–612.
25. Bronowicki, J. P., Vetter, D., Dumas, F., et al. Transcatheter oily chemoembolization for hepatocellular carcinoma. A 4-year study of 127 French patients. Cancer, 1994; 74(1): 16–24.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 8-
All articles in this issue
- One-Year Survival Outcomes in Patients with Pancreatic Head and Portomesenteric Veins Resection
- An Optimum Miniinvasive Approach in Esophageal Replacement with Stomach
- GIST as a Cause of the Small Intestine Invagination
- Significance of the TPS Cytokeratin Marker in the Postoperative Follow Up of Colorectal Carcinoma Patients
- Transarterial Chemoembolization in Hepatocellular Carcinoma
- 120 Laparoscopic Adrenalectomies with a Harmonic Scalpel
- Crural Arteries PTA in Patients with Diabetes
- Posttraumatic Muscular Forearm Hernia
- Lesions in the Popliteal Fossa with Neurologic Symptomatology – Case Reports, Diagnostics and Treatment
- Treatment of the Elderly in the Regional Surgical Department
- Contribution of MRI to the Thoracolumbar Spine Injuries Diagnostics and Therapy
- Contribution of Abdominal Sonography in Acute Appendicitis Diagnostics – Our Experience
- PCCP versus Standard Proximal Femoral Nail in the Treatment of Pertrochanteric Femoral Fractures
- The Operation Risks and the Force of Preoperative Management
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- The Operation Risks and the Force of Preoperative Management
- Lesions in the Popliteal Fossa with Neurologic Symptomatology – Case Reports, Diagnostics and Treatment
- Transarterial Chemoembolization in Hepatocellular Carcinoma
- One-Year Survival Outcomes in Patients with Pancreatic Head and Portomesenteric Veins Resection
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

