-
Medical journals
- Career
Základné biologické úlohy galektínov v reparácii tkanív a raste nádorov
Authors: Peter Gál 1,2,3; Lenka Varinská 3; Vlasta Peržeľová 3,4; Ján Jakubčo 1; Martina Kostelníková 1; Ivan Kováč 5; Peter Spurný 1; Karel Smetana ml. 2
Authors‘ workplace: Východoslovenský ústav srdcových a cievnych chorôb, a. s., Košice, SR 1; Anatomický ústav 1. LF UK, Praha 2; Ústav farmakológie, Univerzita Pavla Jozefa Šafárika, Košice, SR 3; Ústav patologickej anatómie, Univerzita veterinárskeho lekárstva a farmácie, Košice, SR 4; II. chirurgická klinika, Univerzitná nemocnica Louisa Pasteura a UPJŠ, Košice, SR 5
Published in: Čas. Lék. čes. 2014; 153: 231-237
Category: Review Article
Overview
Galektíny patria medzi endogénne lektíny – bielkoviny špecificky rozpoznávajúce cukorné motívy. Galektíny hrajú významné úlohy v procesoch bunkovej proliferácie, diferenciácie, migrácie a tvorby medzibunkovej hmoty. Navyše sú schopné prenášať bunkové signály a podieľať sa na medzibunkových interakciách. Podobne bolo dokázané, že galektíny zohrávajú dôležitú úlohu pri tvorbe mikroprostredia nádoru a/alebo hojacej sa rany. Táto práca poskytuje prehľad experimentálnych a klinických štúdií zaoberajúcich sa biologickými úlohami galektínov v tkanivovej reparácii a jej paralele k raste nádoru.
Klíčová slova:
lektín – hojenie rán – proliferácia – diferenciácia – medzibunková hmotaÚvod
Z dôvodu stále stúpajúcich výskytov metabolických, kardiovaskulárnych a onkologických ochorení stúpa pravdepodobnosť výskytu zle sa hojacich rán. Už v roku 2003 sa len v Spojených štátoch amerických minulo vyše 9 miliárd dolárov na liečbu komplikácií spojených so zlým hojením (1). Medzi najvážnejšie komplikácie hojenia rán patrí stagnácia tvorby granulačného tkaniva, spomalená epitelizácia, dehiscencia a infekcia rany ako aj tvorba hypotrofických a keloidných jaziev. Za tieto problémy je často zodpovedná dysfunkcia kmeňových buniek a tkanivového mikroprostredia. Tieto biologické deje vedú k relatívne pomalému priebehu hojenia a k rozsiahlej tvorbe jaziev. Stimulácie hojenia rán je založená predovšetkým na protizápalovom efekte, zvýšení proliferácie buniek, stimulácii tvorby extracelulárnej matrice alebo na indukcii kontrakcie rany.
Na druhej strane hlavný dôvod limitovanej úspešnosti konzervatívnej liečby pokročilých nádorových ochorení je daný skutočnosťou, že klasická onkologická terapia je zameraná predovšetkým na elimináciu rýchlo sa deliacich buniek nádorového parenchýmu (2, 3). Touto cestou, ale nie sme schopní zásadným spôsobom narušiť fungovanie nádorovej kmeňovej bunky, ktorá je zodpovedná za tak dôležité komplikácie protinádorovej terapie, ako je minimálna reziduálna choroba a multi-lieková rezistencia (4). Istou možnosťou by bola terapeutická manipulácia nádorového mikroprostredia (predovšetkým strómy), na ktorom sú závislé kmeňové bunky. Kľúčovú úlohu pri vytváraní nádorovej strómy a granulačného tkaniva hrajú fibroblasty (5–8). Fibroblasty sú potentným zdrojom vybraných rastových faktorov (napr. IGF-2 (inzulínu podobný rastový faktor-2), BMP-4 (kostný morfogenetický proteín-4)), cytokínov (napr. IL-6 (interleukín-6)) a chemokínov (napr. CXCL-1, IL-8). Podobne nezameniteľný je ich význam pri produkcii štruktúrnych makromolekúl (kolagén, fibronektín, tenascín), ktoré tvoria extracelulárnu matricu. Pre kontrakciu rany je zásadná ich schopnosť diferenciácie na myofibroblasty, ktoré sú navyše schopné zásadným spôsobom ovplyvniť biologické vlastnosti nádorov (8). Okrem spomínaných regulačných molekúl existuje aj skupina glykoproteínov schopných zásadným spôsobom ovplyvniť biologické deje zapojené do hojenia rán a/alebo tvorby, rastu a metastázovania nádorov (tab. 1). Tieto molekuly sú endogénne lektíny s komplexným účinkom schopné špecificky rozpoznávať a viazať sacharidové štruktúry a prenášať rôzne signály (9). Nazývajú sa galektíny.
Galektíny
Prvý galektín bol objavený v roku 1975 Vivianom Teichbergom z extraktov elektrického úhora ako hemaglutinín s nízkou molekulovou hmotnosťou (14–16 kDa) viažuci beta-galaktozidy (10). Tento proteín bol nazvaný elektrolektín – dnes nazývaný galektín-1 (nová systematická nomenklatúra označuje galektíny arabskými číslicami podľa poradia objavenia). Neskôr boli objavené podobné lektíny v ďalších tkanivách rôznych živočíšnych druhov vrátane človeka. Do dnešného dňa bolo identifikovaných 15 galektínov.
Galektíny majú veľa znakov cytoplazmatických proteínov, sú syntetizované cytozolickými ribozómami, nemajú disulfidické mostíky, žiadne sacharidové reťazce, žiadnu signálnu sekvenciu a vo väčšine prípadov je ich N-koniec acetylovaný (11). Ich morfologická lokalizácia nie je obmedzená len na cytoplazmu, ale nachádzajú sa v závislosti na type galektínu aj v jadre a medzibunkových priestoroch (9). Základom ich štruktúry je prítomnosť tzv. sacharid-rozpoznávajúcej domény CRD (carbohydrate recognition domain) tvorenej približne 130 aminokyselinami. V závislosti od ich štruktúry a počtu CRD sú galektíny rozdelené do troch skupín (obr. 1) (12): 1. prototypové galektíny, obsahujúce buď jednu CRD (monomér) alebo dve identické CRD (homodimér) (galektíny-1, -2, -5, -7, -10, -11, -13, -14 a -15); 2. chiméra typ galektín, ktorý má len jedného člena, galektín-3, ktorý je zložený z nelektínovej domény napojenej na CRD; a 3. tzv. tandemové galektíny, pozostávajúce z 2 CRD navzájom spojených krátkym polypeptidovým reťazcom (galektíny-4, -6, -8, -9, a -12).
Funkčné interakcie galektínov s glykokonjugátmi ovplyvňujú adhéziu buniek a bunkovú signalizáciu (13). Interakcie galektínov s intracelulárnymi ligandmi ovplyvňujú množstvo signálnych ciest (13). Vďaka týmto funkčným interakciám sú galektíny zapojené do mnohých biologických dejov zasahujúcich do funkcie buniek ako napríklad: rast, diferenciácia, proliferácia, migrácia (14), zostrih mRNA (15), adhézia (16), chemotaxia (17), a apoptóza (18). Majú dôležitú úlohu v patologických procesoch autoimunitných ochorení, alergických reakcií, zápalov (19), onkologických ochorení (20), aterosklerózy a taktiež mnohých diabetických komplikácií (21).
Table 1. Prehľad jednotlivých galektínov a ich vplyv na procesy ovplyvňujúce hojenie rán 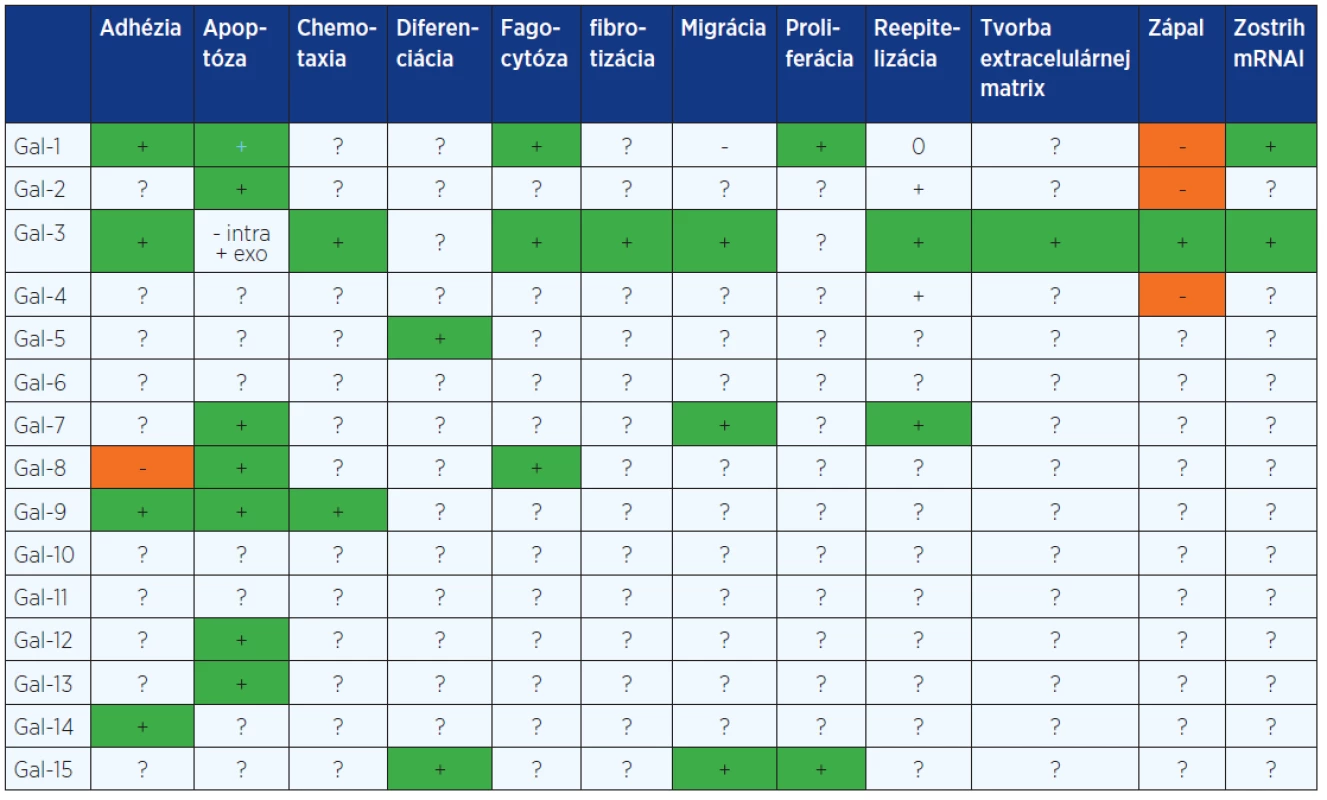
+ – stimuluje, - – inhibuje, 0 – neovplyvňuje, ? – neznáme, intra – intracelulárny, exo – exogénne pridaný Image 1. Schematické znázornenie štruktúry galektínov. Prototypové galektíny (1, 2, 5, 7, 10, 11, 13, 14 a 15), obsahujúce jednu (monomér) alebo dve identické CRD (homodimér). Chimerický galektín (3) je zložený z nelektínovej domény napojenej na CRD može byť vo forme monoméru, ale aj spájaný až do pentaméru. Tandemové galektíny (4, 6, 8, 9, a 12), pozostávajúce z 2 CRD navzájom spojených krátkym polypeptidovým reťazcom. 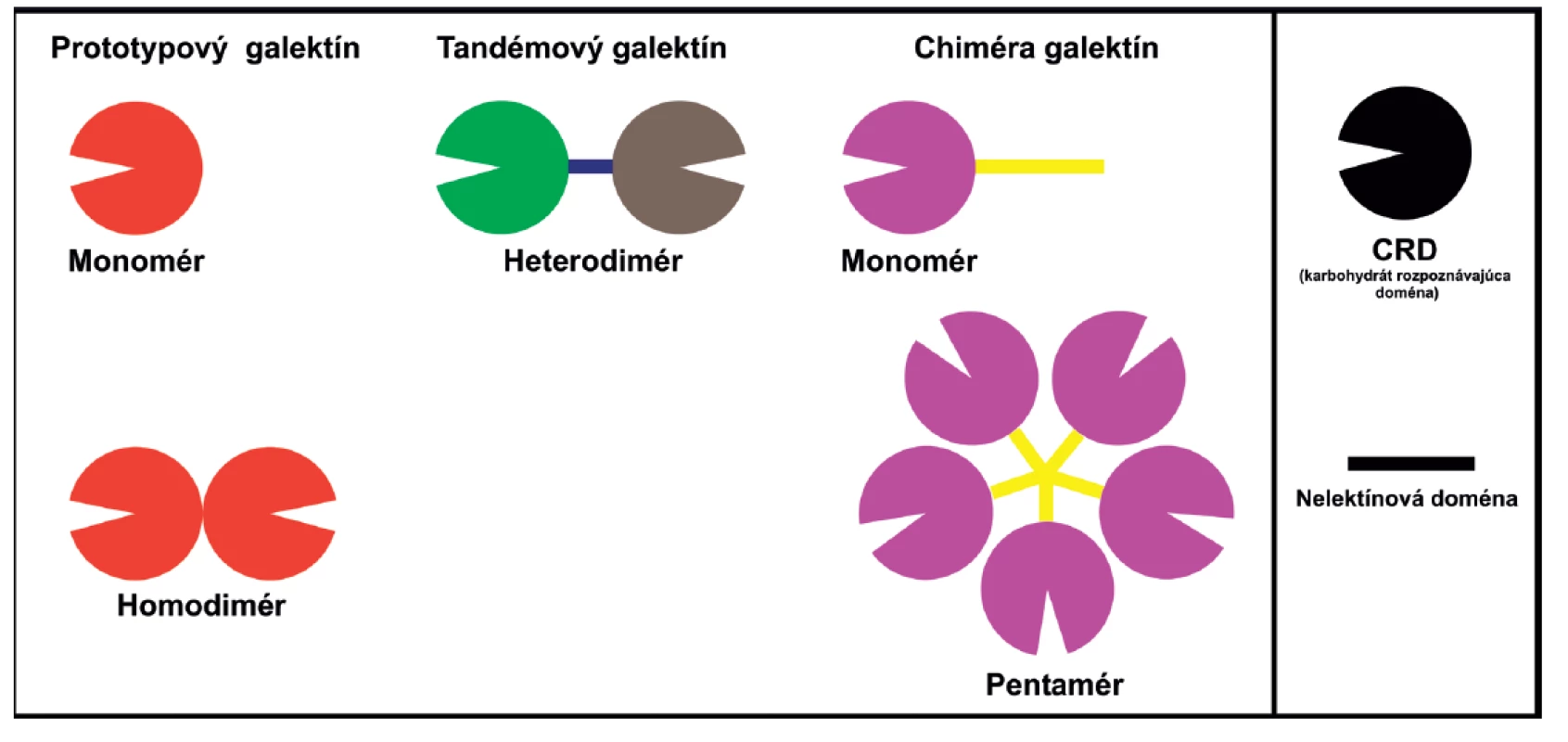
Image 2. Galektín-1 je výrazne exprimovaný v stróme bazaliómov (BCC) (A). Značený galektín-2 rozpoznáva väzbové miesta normálnych aj nádorových epitelových buniek (Gal-2-BS) (B). PML (promyelocytický leukemický proteín) telieska v jadrách stresovaných ľudských dermálnych fibroblastov (HDF) exprimujú galektín-2 (C). DNA je v každom obrázku ofarbená modro pomocou DAPI 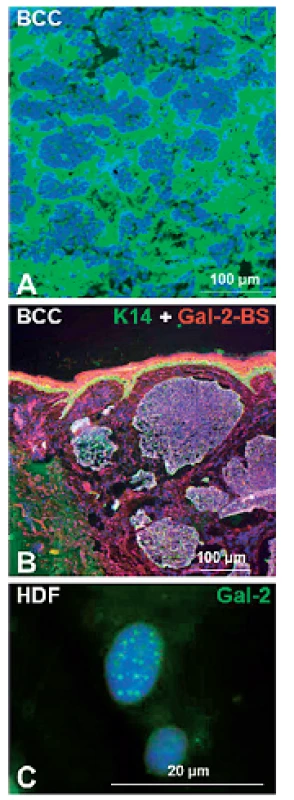
I. skupina galektínov
Galektín-1 je prítomný ako intracelulárne, tak aj extracelulárne (22) a zasahuje do mnohých fyziologických a patologických procesov. Ukázalo sa, že galektín-1 je vo zvýšenej miere prítomný v bunkách a medzibunkovej hmote strómy rôznych ľudských nádorov (obr. 2A) a v granulačnom tkanive hojacej sa rany (8, 23–26). Tento galektín rozpoznáva poly-N-acetyllaktosaminové epitopy nachádzajúce sa na množstve proteínov a niektorých lipidoch.
Galektín-1 je vo zvýšenej miere exprimovaný v zápalovej fáze hojenia rán (25, 26) a má protizápalový účinok, ktorý súvisí so supresiou prozápalových mediátorov IL-2, TNF-α (tumor nekrotizujúci faktor alfa), IFN-γ (interferón gama) (27), a indukciou protizápalových mediátorov IL-10, IL-5 a TGF-β (transformujúci rastový faktor-beta) (28). Preto sa viacero štúdií orientuje týmto smerom a snažia sa nájsť využitie galektínu-1 v liečbe chronických zápalových ochorení, ako je artritída (29), kolitída (30) a chronická pankreatitída (31).Na druhej strane sa taktiež ukázalo, že galektín-1 v nízkych koncentráciách významne podporuje rast buniek (32). Galektín-1 zvyšuje adhéziu normálnych a rakovinových buniek k medzibunkovej hmote (ECM – extracellular matrix) (20). Galektín-1 môže interagovať s integrínovými receptormi a indukovať anoikis (programovaná bunková smrť indukovaná stratou kontaktu bunky k ECM) (33, 34). Na druhej strane ECM bohatá na galektín-1 vytvára vhodné mikroprostredie pre výskyt a prežívanie slabo diferencovaných keratinocytov (7). Zaujímavé bolo zistenie, že galektín-1 existuje aj v oxidovanej forme, ktorá stratila lektínovú aktivitu.Táto oxidovaná forma však urýchľuje regeneráciu axónov po poranení periférnych nervov (35).
Bolo dokázané, že tento endogénny lektín hrá dôležitú úlohu v nádorovej angiogenéze a taktiež v samotnom raste a metastázovaní nádorov (36, 37). Presná biologická funkcia galektínu-1 pri tvorbe nádorového mikroprostredia a hojenia rán ale zostává stále predmetom ďalšieho výskumu. Avšak už dnes sú známe viaceré samostatné mechanizmy, ktorými galektín-1 stimuluje angiogenézu. Jedným z nich je interakcia s neurolipínom-1 na povrchu endotelových buniek, ktorý sa správa ako ko-receptor pre receptor cievneho endotelového rastového faktora (VEGFR – vascular endothelial growth factor receptor). Neurolipín zvyšuje fosforyláciu VEGF receptora, čo následne aktivuje mitogénom-aktivovanú proteín kinázu (MAPK) (38). Ďalším z mechanizmov je stimulácia proliferácie, adhézie a migrácie endotelových buniek ako dôsledok aktivácie Ras-Raf-Erk signálnej dráhy (24). Ukázalo sa, že exogénna aplikácia galektínu-1 stimuluje proliferáciu a migráciu endotelových buniek ako aj tvorbu ciev v in vitro (38–40) a in vivo (24) podmienkach.
Zvýšená expresia galektínu-1 v nádorových endotelových bunkách bola pozorovaná vo zvieracích ako aj ľudských nádoroch (41). Ukázalo sa, že výskyt galektín-1 pozitívnych endotelových buniek je 7% v nenádorových kapilárach, kým vo vzorkách získaných z primárneho karcinómu prostaty bol nárast až na 64 % (42). Navyše vyradenie génu pre galektín-1 v nádorových bunkách viedlo k zníženiu rastu nádoru negatívnym ovplyvnením procesu angiogenézy (43).
Zlá prognóza spojená s upreguláciou galektínu-1 je spojená aj s únikom nádorových buniek imunitnému dozoru a apoptózou T-lymfocytov (44). Navyše zvýšená expresia galektínu-1 koreluje s výskytom myofibroblastov v karcinómoch hlavy a krku, čím je známkou malígnej progresie a predstavuje negatívnu prognózu pre pacienta (8). Podobne je exogénne pridaný galektín-1 schopný indukovať diferenciáciu fibroblastov na myofibroblasty nezávisle od TGF-β (7). Galektín-1 môže tak byť cieľom, ktorý by mohol spojovať protinádorovú terapiu a liečbu rán (45)
Galektín-2 je dominantne exprimovaný v gastrointestinálnom trakte (46). Bolo dokazané, že signifikantne zlepšuje obnovenie črevného epitelu nezávisle od TGF-β, čo môže nájsť uplatnenie pri liečbe zápalových ochorení črevnej steny (IBD – inflammatory bowel disease) (47). V epidermis sú väzbové miesta pre galektin-2 prítomné v normálnom aj transformovanom epiteli (obr. 2B). U stresovaných buniek je galektín-2 lokalizovaný v PML (promyelocytický leukemický proteín) telieskach bunkových jadier (48) (obr. 2C).
Galektín-7 sa exprimuje vo viacvrstvových epiteloch: epidermis, cornea, ústna dutina, esofagus, anorektálny epitel (49). Je asociovaný s migráciou epitelových buniek, čím zohráva dôležitú úlohu v procese reepitelizácie kože (9) a rohovky (50, 51). Ukázalo sa, že tento lektín je exprimovaný aj v trachei a hrá úlohu pri dozrievaní folikulov v ováriu (52). Galektín-7 takisto pôsobí ako pro-apoptotický faktor prostredníctvom p53 (53). U nádorov vychádzajúcich z dlaždicových epitelov je expresia galektínu-7 významne znížená (54).
Galektíny-5, -10, -11, -13, -14 a -15. Ďalšie galektíny nehrajú podľa doposiaľ známych literárnych dát až tak významné úlohy v tkanivovej reparácii. Ukázalo sa, že galektín-5 je lokalizovaný v cytosóle a na povrchu retikulocytov a erytrocytov a podieľa sa na diferenciácii erytroblastov na zrelé erytrocyty (55). Galektín-10 sa exprimuje v eozinofilných granulocytoch, kde vytvára kryštalické formy známe ako Charcot-Leydenove kryštály. Na rozdiel od ostatných galektínov vykazuje omnoho vyššiu afinitu pre manózu ako pre β-galaktozidy (13). Galektín-11 sa exprimuje v gastrointestinálnom trakte (56). Z onkologického pohľadu je zaujímavý galektín-13, ktorý sa exprimuje v makrofágoch, NK - bunkách a v mnohých typoch nádorov (napr. karcinóm prsníka, adenokarcinóm prostaty, malígny melanóm atď.). Zvýšená expresia galektínu-13 vedie k indukcii apoptózy buniek prostredníctvom JNK/SAPK (C-junN-terminálna kináza/stresom aktivovaná proteínkináza) aktivácie (57). Na druhej strane k uvoľneniu galektínu-14 dochádza pri alergických zápaloch respiračného traktu a parazitárnych infekciách gastrointestinálneho traktu. Počas týchto zápalov ovplyvňuje adhéziu buniek a mení vlastnosti epitelu (58). Galektín-15 bol lokalizovaný v epitelových bunkách endometria a v zárodočných bunkách trofoektodermy. Extracelulárne reguluje migráciu buniek trofoblastu a ich adhéziu k epitelu endometria. Intracelulárne ovplyvňuje prežitie, rast a diferenciáciu buniek trofoblastu. Zároveň môže slúžiť ako marker funkcie endometria a plodnosti (59).
II. skupina galektínov
Galektín-3 je exprimovaný v aktivovaných makrofágoch, eozinofiloch, mastocytoch, fibroblastoch, epitelových bunkách gastrointestinálneho a respiračného traktu, obličkách a senzorických neurónoch. Ukázalo sa, že expresia galektínu-3 v ranách je v skorých štádiách nízka no v maturačnej fáze hojenia (tvorba jazvy) stúpa (26, 60). Aj napriek tomu je tento lektín schopný zrýchliť epitelizáciu rán (61). Podobne sa ukázalo, že galektín-3 stimuluje proliferáciu fibroblastov (62) a taktiež je modulátorom interakcií bunka-medzibunková hmota (63). Z tohto pohľadu bolo logické zistenie, že galektín-3 je významným induktorom tkanivovej fibrózy v rôznych tkanivách (30, 64–66). Výrazný vzostup koncentrácie galektínu-3 exprimovaného na povrchu, ale aj v cytoplazme alveolárneho epitelu bol pozorovaný pri rozvoji pľúcnej fibrózy (67). Navyše sa ukázalo, že galektín-3 aktivuje tvorbu myofibroblastov a fibrózu pečene a obličiek (64, 65).
Z pohľadu hojenia a tvorby nádorov je zaujímavý aj vplyv galektínov na zápal. Vo všeobecnosti pôsobí galektín-3 ako pro-zápalový faktor (13). Inhibuje uvoľňovanie protizápalového IL-5 najmä v eozinofiloch, no na druhej strane môže aktivovať mastocyty, neutrofily, monocyty a bazofily (68). U galektín-3 deficientných myší sa prejavili znížené funkcie mastocytov a redukcia akumulácie s astmou asociovaných leukocytov pri zápale dýchacích ciest (13). Navyše mali galektín-3 deficientné makrofágy omnoho nižšiu schopnosť chemotaxie a fagocytózy (17, 69). Galektín-3 zohráva kľúčovú úlohu v skorej fáze zápalu, prostredníctvom jeho väzby na integrínové receptory a patrí k dôležitým modulátorom funkcií neutrofilov. Interaguje s povrchovým receptorom neutrofilov CD66b, ktorý je zodpovedný za aktiváciu NADPH (nikotín amid adenín dinukleotid fosfát) oxidázy (70), čím indukuje respiračné vzplanutie neutrofilov (13). Zlepšuje adhéziu neutrofilov k laminínu (71), podporuje ich extrevazáciu do zápalového ložiska (72). Ukázalo sa, že tieto regulácie prebiehajú cez alternatívnu MAPK cestu (73).
Galektín-3 výrazne ovplyvňuje proces apoptózy buniek. Intracelulárne pôsobí ako antiapoptický faktor T-lymfocytov a nádorových buniek (74), avšak nízke dávky exogénne pridaného galektínu-3 indukujú proapoptický signál (75). Zvýšená expresia galektínu-3 bola pozorovaná pri mnohých typoch karcinómov. Galektín-3 zvyšuje invazivitu nádoru a podporuje tvorbu metastáz (63). Podobne ako galektín-1 aj galektín-3 je zapojený do procesu nádorovej angiogenézy. Je schopný stimulovať angiogenézu ovplyvnením funkcie VEGF a bazálneho fibroblastového rastového faktora (bFGF). K tomuto účinku dochádza po naviazaní sa galektínu-3 na αvβ3 integrín na povrchu endotelových buniek. Táto interakcia aktivuje FAK (fokálne adhézna kináza), čo následne vedie k VEGF - a bFGF-sprostredkovanej tvorbe ciev (76). Exogénne pridaný galektín-3 zvyšuje angiogénnu odpoveď in vitro a stimuluje vaskularizáciu in vivo (77).
Okrem zapojenia sa galektínu-3 do hojenia rán a nádorového rastu zohráva tento lektín úlohu aj v patogenéze srdcového zlyhania, kde je považovaný za nový potenciálny prognostický faktor. Vo viacerých klinických štúdiách bolo totiž preukázané, že pacienti so zvýšenou hladinou cirkulujúceho galektínu-3 majú horšiu prognózu (zvýšené riziko mortality) a riziko hospitalizácie v porovnaní s pacientmi s nízkymi alebo normálnymi hladinami (78, 79). Chimerický galektín spúšťa proliferáciu fibroblastov v myokarde pri srdcovom zlyhaní (80, 81).
III. tretia skupina galektínov
Galektín-4. Z tejto skupiny galektínov má z pohľadu hojenia rán pravdepodobne najväčší význam galektín-4, ktorý je podobne ako galektín-2 dominantne exprimovaný v gastrointestinálnom trakte (82). Ukázalo sa, že aj tento lektín dokáže signifikantne urýchliť črevnú reepitelizáciu nezávisle od TGF-β (47).
Galektín-6, -8, -9 a -12. Skupina týchto galektínov nemá významný dopad na biologické procesy zapojené do tkanivovej reparácie. Galektín-6 sa exprimuje v epitelových bunkách gastrointestinálneho traktu (GIT) (83). Galektín-8 je exprimovaný v pľúcach, pečeni, srdci, mozgu a obličkách. Špecificky interaguje s α3β1 a α6β1 integrínmi na bunkových povrchoch čím inhibuje adhéziu buniek v procesoch, ktoré vyžadujú interakciu proteín-sacharid. Navyše sa ukázalo, že galektín-8 indukuje proces apoptózy nezávisle od p53 (84) a podieľa sa na regulácii funkcie neutrofilov pri fagocytóze (85). Na druhej strane galektín-9 pôsobí ako chemotaktický faktor eozinofilov (86), čo naznačuje jeho potenciálnu úlohu v modulácii alergických a parazitárnych ochorení (87). Je exprimovaný v týmuse, pečeni, GIT, pľúcach a indukuje apoptózu aktivovaných T-lymfocytov a rakovinových buniek (88). Galektíny -8 a -9 sú okrem toho exprimované aj endotelovými bunkami. V porovnaní s galektínmi -1 a -3, ktoré sú intenzívne študované v súvislosti s nádorovou angiogenézou a ich zapojením do progresie rastu nádoru, je o galektínoch -8 a -9 dostupné len obmedzené množstvo informácií. Štúdie však naznačujú proangiogénny charakter predovšetkým galektínu-8 (89). Galektín-9 je v normálnych dlaždicových epiteloch exprimovaný v bazálnej vrstve, ktorá má proliferačnú aktivitu. Počas aktivácie epitelových buniek alebo v nádoroch sa tento galektín z epitelových buniek stráca (90). Toto pozorovanie naznačuje, možnú funkciu galektínu-9 v procese hojenia a kancerogenézy. Expresia galektínu-12 bola lokalizovaná v jadre a mitochondriách adipocytov, pričom indukuje ich apoptózu (91).
Záver
V tejto prehľadnej práci sme systematicky zosumarizovali regulačné úlohy galektínov na procesy zapojené do regenerácie a reparácie tkanív a poukázali sme na určitú podobu k tvorbe nádoru. Ukázalo sa, že expresia jednotlivých galektínov je často odlišná. Aj keď majú galektíny zjavnú sekvenčnú homológiu, každý proteín nasleduje svoj charakteristický vzor expresie a biologickej úlohy v priebehu hojenia. Zdá sa, že existuje určitá paralela medzi hojením rán a rastom nádorov (92, 93). Terapeutické riešenie oboch patologických stavov vyvoláva potrebu komplexného prístupu, z ktorého nie je možné vyňať väzivovú zložku vytvárajúcu vhodné mikroprostredie.
Zdá sa, že na modulácii mikroprostredia sa výraznou mierou podieľa galektín-1, ktorý je upregulovaný v skorej fáze reparácie, kde zásadným spôsobom ovplyvňuje zápal a diferenciáciu buniek. Podobne tomu je aj v niektorých typoch nádorov. Na druhej strane galektín-3 je upregulovaný v maturačnej fáze hojenia a pravdepodobne zohráva významnú úlohu v procese vyzrievania granulačného tkaniva a následnej tvorby jazvy. Tento lektín je v dnešnej dobe považovaný za marker fibrózy a srdcového zlyhania. Z publikovaných prác vyplýva, že v hojení rán môže mať určitý modulačný efekt ešte galektín 2, 4 a 7. Zásadná úloha ostatných galektínov v samotnom hojení tkanív ostáva zatiaľ otázna.
Je potrebné však povedať, že väčšina prác bola realizovaná na hlodavcoch. Korelácia animálnych štúdií k človeku by bola možná keby neexistovala žiadna medzidruhová variabilita. Keď boli porovnávané dáta zo štúdií na hlodavcoch k prasacej koži, zistilo sa, že sa môžu určité kvantitatívne aspekty predsa len líšiť (25, 26). Z toho vyplýva, že výsledky prezentované v animálnych štúdiách nemôžu byť priamo aplikovateľné aj pre ľudský organizmus. Vďaka dostupnosti tkanivových lektínov pre in vitro a in vivo experimenty môže byť ich úloha v procese hojenia rán aj naďalej skúmaná v ďalších klinických štúdiách.
ADRESA PRO KORESPONDENCI:
RNDr. Peter Gál, PhD.
Východoslovenský ústav srdcových a cievnych chorôb, a.s.
Úsek pre biomedicínsky výskum
Ondavská 8, 040 11 Košice, SR
e-mail:pgal@vusch.sk
Sources
1. Ashcroft GS, et al. Estrogen modulates cutaneous wound healing by downregulating macrophage migration inhibitory factor. J Clin Invest 2003; 111 : 1309–1318.
2. Korkaya H, et al. Breast cancer stem cells, cytokine networks, and the tumor microenvironment. J Clin Invest 2011; 121 : 3804–3809.
3. Scatena R, et al. Cancer stem cells: the development of new cancer therapeutics. Expert Opin Biol Ther 2011; 11 : 875–892.
4. Motlík J, et al. Porcine epidermal stem cells as a biomedical model for wound healing and normal/malignant epithelial cell propagation. Theriogenology 2007; 67 : 105–111.
5. Strnad H, et al. Head and neck squamous cancer stromal fibroblasts produce growth factors influencing phenotype of normal human keratinocytes. Histochem Cell Biol 2010; 133 : 201–211.
6. Plzák J, et al. Epithelial-stromal interaction in squamous cell epithelium-derived tumors: an important new player in the control of tumor biological properties. Anticancer Res 2010; 30 : 455–462.
7. Dvořánková B, et al. Human galectins induce conversion of dermal fibroblasts into myofibroblasts and production of extracellular matrix: potential application in tissue engineering and wound repair. Cells Tissues Organs 2011; 194 : 469–480.
8. Valach J, et al. Smooth muscle actin-expressing stromal fibroblasts in head and neck squamous cell carcinoma: increased expression of galectin-1 and induction of poor prognosis factors. Int J Cancer 2012; 131 : 2499–2508.
9. Gendronneau G, et al. Galectin-7 in the control of epidermal homeostasis after injury. Mol Biol Cell 2008; 19 : 5541–5549.
10. Teichberg A, et al. beta-D-galactoside binding protein from electric organ tissue of Electrophorus electricus. Proc Natl Acad Sci USA 1975 72 : 1383–1387.
11. Leffler H, et al. Introduction to galectins. Glycoconj J 2004; 19 : 433–440.
12. Hirabayashi J, et al. The family of metazoan metal-independent beta-galactoside-binding lectins: Structure, functions and molecular evolution. Glycobiology 1993; 3 : 297–304.
13. Cummings RD, et al. Galectins. Essentials of Glycobiology. 2nd edition. Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press; 2009. Chapter 33.
14. Hsu DK, et al. Regeneration of cellular homeostasis by galectins. Glycoconj J 2004; 19 : 507–515.
15. Liu FT, et al. Intracellular functions of galectins. Biochem Biophys Acta 2002; 1572 : 263–273.
16. Hughe RC, et al. Galectins as modulators of cell adhesion. Biochemie 2001; 83 : 667–676.
17. Sano H, et al. Human galectin-3 is a novel chemoattractant for monocytes and macrophages. J Immunol 2000; 165 : 2156–2164.
18. Hsu DK, et al. Galectins in apoptosis. Methods Enzymol 2006; 417 : 256–273.
19. Sato S, et al. Seeing strangers or annoucing „danger“: Galectin-3 in two models of innate imunity. Glycoconj J 2004; 19 : 583–591.
20. Van den Brule F, et al. Expression of galectins in cancer. Glycoconj J 2004; 19 : 537–542.
21. Yang RY, et al. Galectins: structure, function and therapeutic potential. Expert Rev Mol Med 2008; 10: e17.
22. Camby I, et al. Galectin-1: a small protein with major functions. Glycobiology 2006; 16 : 137–157.
23. Thijssen VL, et al. Galectins in the tumor endothelium: opportunities for combined cancer therapy. Blood 2007; 110 : 2819–2827.
24. Thijssen VL, et al. Tumor cells secrete galectin-1 to enhance endothelial cell activity. Cancer Res 2010 70 : 6216–6224.
25. Klíma J, et al. Differential regulation of galectin expression/ reactivity during wound healing in porcine skin and in cultures of epidermal cells with functional impact on migration. Physiol Res 2009; 58 : 873–884.
26. Gál P, et al. Open wound healing in vivo: monitoring binding and presence of adhesion/growth-regulatory galectins in rat skin during the course of complete re-epithelialization. Acta Histochem Cytochem 2011 44 : 191–199.
27. Rabinovich GA, et al. Specific inhibition of T cell adhesion to extracellular matrix a proinflammatory cytokine secretion by human recombinant galectin-1. Imunology 1999; 97 : 100–106.
28. Van der Leij J, et al. Dimeric galectin-1 induces IL-10 production in T-lymphocytes, an important tool in the regulation of the immune response. J Pathol 2004; 204 : 511–518.
29. Rabinovich GA, et al. Recombinant galectin-1 and its genetic delivery suppress collagen-induced via T cell apoptosis. J Exp Med 1999; 190 : 385–398.
30. Santucci L, et al. Galectin-1 suppresses experimental collitis in mice. Gastroenterology 2003; 124 : 1381–1394.
31. Wang L, et al. Galectin-1 and galectin-3 in chronic pancreatitis. Lab Invest 2000; 80 : 1233–1241.
32. Adams L, et al. Biphasic modulation of cell growth by recombinant human galectin-1. Biochim Biophys Acta 1996; 1312 : 137–144.
33. André S, et al. Tumor suppressor p16INK4a-modulator of glycomic profile and galectin-1 expression to increase susceptibility to carbohydrate-dependent induction of anoikis in pancreatic carcinoma cells. FEBS J 2007; 274 : 3233–3256.
34. Rabien A, et al. Tumor suppressor p16INK4a controls oncogenic K-Ras function in human pancreatic cancer cells. Cancer Sci 2012; 103 : 169–175.
35. Miura T, et al. Galectin-1beta, a natural monomeric form of galectin-1 lacking its six amino - terminal residues promotes axonal regeneration but not cell death. Cell Death Differ 2004; 11 : 1076–1083.
36. Saussez S, et al. Increased expression and altered intracellular distribution of adhesion/growth-regulatory lectins galectins-1 and -7 during tumour progression in hypopharyngeal and laryngeal squamous cell carcinomas. Histopathology 2008; 52 : 483–493.
37. Saussez S, et al. Adhesion/growth-regulatory tissue lectin galectin-1 in relation to angiogenesis/lymphocyte infiltration and prognostic relevance of stromal up-regulation in laryngeal carcinomas. Anticancer Res 2009; 29 : 59–65.
38. Hsieh SH, et al. Galectin-1, a novel ligand of neuropilin-1, activates VEGFR-2 signaling and modulates the migration of vascular endothelial cells. Oncogene. 2008; 27 : 3746–3753.
39. D’Haene N, et al. VEGFR1 and VEGFR2 involvement in extracellular galectin-1 - and galectin-3-induced angiogenesis. PLoS One 2013; 8: e67029.
40. Ito K, et al. Thiodigalactoside inhibits murine cancers by concurrently blocking effects of galectin-1 on immune dysregulation, angiogenesis and protection against oxidative stress. Angiogenesis 2011 14 : 293–307.
41. Thijssen VL, et al. The galectin profile of the endothelium: altered expression and localization in activated and tumor endothelial cells. Am J Pathol. 2008; 172 : 545–553.
42. Clausse N, et al. Galectin-1 expression in prostate tumor-associated capillary endothelial cells is increased by prostate carcinoma cells and modulates heterotypic cell-cell adhesion. Angiogenesis 1999; 3 : 317–325.
43. Laderach DJ et al. A unique galectin signature in human prostate cancer progression suggests galectin-1 as a key target for treatment of advanced disease. Cancer Res 2013; 73 : 86–96.
44. Zou W. Immunosuppressive networks in the tumour environment and their therapeutic relevance. Nat Rev Cancer 2005; 5 : 263–274.
45. Smetana K, et al. Phylogeny, regeneration, ageing and cancer: role of microenvironment and possibility of its therapeutic manipulation. Folia Biol (Praha) 2012; 59 : 207–216.
46. Paclik D, et al. Galectin-2 induces apoptosis of lamina propria T - lymphocytes and a meliorates acute and chronic experimental colitis in mice. J Mol Med (Berl) 2008; 86 : 1395–1406.
47. Paclik D, et al. Galectin-2 and -4, but not galectin-1, promote intestinal epithelial wound healing in vitro through a TGF-β-independent mechanism. Inflamm Bowel Dis 2008; 14 : 1366–1372.
48. Dvořánková B, et al. Human galectin-2: nuclear presence in vitro and its modulation by quiescence/stress factors. Histol Histopathol 2008; 23 : 167–168.
49. Magnaldo T, et al. Galectin-7, a marker of all types of stratified epithelia. Differentiation 1998; 63 : 159–168.
50. Saussez S, et al. Galectin-7. Cell Mol Life Sci 2006; 63 : 686–697.
51. Cao Z, et al. Galectin-7 as a potential mediator of corneal epitelial cell migration. Arch Ophthalmol 2003; 121 : 82–86.
52. Sato M, et al. Quantification of galectin-7 and its localization in adult mouse tissues. J Biochem 2002; 131 : 255–260.
53. Polyak K, et al. A Model for p53 – induced apoptosis. Nature 1997; 389 : 300–305.
54. Čada Z, et al. Galectin-7: will the lectin’s activity establish clinical correlations in head and neck squamous cell and basal cell carcinomas? Histol Histopathol 2009; 21 : 44–48.
55. Barrés C, et al. Galectin-5 is bound onto the surface of rat reticulocyte exosomes and modulates vesicle uptake by macrophages. Blood 2010; 115 : 696–705.
56. Rapoport EM, et al. Mammalian galectins: structure, carbohydrate specifity, and functions. Biochemistry 2008; 73 : 393–405.
57. Boronkai A, et al. Potentiation of paclitaxel - induced apoptosis by galectin-13 overexpression via activation of Ask-1-p38-MAP kinase and JNK/SAPK pathways and suppression of Akt and ERK ½ activation in U-937 human macrophage cells. J Cell Biology 2009; 89 : 753–763.
58. Young AR, et al. Functional charakterization of an eosinophil – specific galectin, ovine galectin-14. Glycoconj J 2009; 26 : 423–432.
59. Gray CA, et al. Discovery and charakterization of an epithelial specific galectin in the endometrium that forms crystals in the trophectoderm. Proc Natl Acad Sci USA 2004; 101 : 7982–7987.
60. Grendel T, et al. Early stages of trachea healing process: (immuno/lectin) histochemical monitoring of selected markers and adhesion/growth-regulatory endogenous lectins. Folia Biol (Praha) 2012; 58 : 135–143.
61. Cao Z, et al. Galectins-3 and -7, but not galectin-1, play a role in re-epitelialization of wounds. J Biol Chem 2002; 277 : 42299–42305.
62. Maeda N, et al. Stimulation of proliferation of rat hepatic stellare cells by galectin-1 and -3 through different intracellular signalling pathways. J Biol Chem 2003; 278 : 18938–18944.
63. Matarrese P, et al. Galectin-3 overexpression protects from apoptosis by improving cell adhesion properties. Int J Cancer 2000; 85 : 545–554.
64. Henderson NC, et al. Galectin-3 regulates myofibroblasts activation and hepatic fibrosis. Proc Natl Acad Sci USA 2006; 103 : 5060–5065.
65. Henderson NC, et al. Galectin-3 expression and secretion links macrophages to the promotion of renal fibrosis. Am J Pathol 2008; 172 : 288–298.
66. de Boer RA, et al. Galectin-3: a novel mediator of heart failure development and progression. Eur J Heart Fail 2009; 11 : 811–817.
67. Kasper M, et al. Immunohistochemical evidence for the occurence of similar epitelial phenotypes during lung development and radiation-induced fibrogenesis. Int J Radiat Biol 2000; 76 : 493–501.
68. Zuberi RI, et al. Activation of rat basophillic leukemia cells by epsilon BP, an IgE - binding endogenous lectin. Cell Immunol 1994; 156 : 1–12.
69. Sano H, et al. Critical role of galectin-3 in phagocytosis by macrophages. J Clin Invest 2003; 112 : 389–397.
70. Almkvist J, et al. Activation of the neutrophil nicotinamide adenine dinucleotide phosphate oxidaze by galectin-1. J Immunol 2002; 168 : 4034–4041.
71. Kuwabara I, et al. Galectin-3 promotes adhesion of human neutrophils to laminin. J Immunol 1996; 156 : 3939–3944.
72. Sato S, et al. Role of galectin-3 as an adhesion molecule for neutrophil extravasation during streptococal pneumonia. J Immunol 2002; 168 : 1813–1822.
73. Fernández GC, et al. Galectin-3 and soluble fibrinogen act in concert to modulate neutrophil activation and survival. Involvement of alternative MAPK-pathways. Glycobiology 2005; 15 : 519–527.
74. Yang RY, et al. Expression of galectin-3 modulates T-cells grouth and apoptosis. Proc Nath Acad Sci USA 1996; 93 : 6737–6742.
75. Fukumori T, et al. CD29 and CD7 mediate galectin-3-induced type II T-cell apoptosis. Cancer Res 2003; 63 : 8302–8311.
76. Markowska AI, et al. Galectin-3 is an important mediator of VEGF - and bFGF-mediated angiogenic response. J Exp Med 2010; 207 : 1981–1993.
77. Nangia-Makker P, et al. Galectin-3 induces endothelial cell morphogenesis and angiogenesis. Am J Pathol 2000; 156 : 899–909.
78. van der Velde AR, at al. Prognostic value of changes in galectin-3 levels over time in patients with heart failure: data from CORONA and COACH. Circ Heart Fail 2013; 6 : 219–226.
79. Motiwala SR, et al. Serial measurement of galectin-3 in patients with chronic heart failure: results from the ProBNP Outpatient Tailored Chronic Heart Failure Therapy (PROTECT) study. Eur J Heart Fail. 2013; 15 : 1157–1163.
80. Luecke N, et al. Secreted proteome of the murine multipotent hematopoietic progenitor cell line DKmix. Rapid Commun Mass Spectrom 2010; 24 : 561–570.
81. Hrynchysyn N, et al. Galectin-3: a new biomarker for the diagnosis, analysis and prognosis of acute and chronic heart failure. Arch Cardiovasc Dis 2013; 106 : 541–546.
82. Huflejt ME, et al. Galectin-4 in normal tissues and cancer. Glycoconj J 2003; 20 : 247–255.
83. Rapoport EM, et al. Mammalian galectins: structure, carbohydrate specificity, and functions. Biochemistry (Mosc) 2008; 73 : 393–405.
84. Hadari YR, et al. Galectin-8 binding to integrins inhibits cell adhesion and induces apoptosis. J Cell Sci 2000; 113 : 2385–2397.
85. Nishi N, et al. Galectin-8 modulates neutrophil function via interaction with integrin alphaM. Glycobiology 2003; 13 : 755–763.
86. Matsumoto R, et al. Biological activities of ecalectin: a novel eosinophil-activating factor. J Immunol 2002; 168 : 1961–1967.
87. Rabinovich GA, et al. Galectins as immunoregulators during infectious processes: from microbial invasion to the resolution of the disease. Parasite Immunology 2005; 27 : 103–114.
88. Kageshita T, et al. Possible role of galectin-9 in cell aggregation and apoptosis of human melanoma cell lines and its clinical significance. Int J Cancer 2002; 99 : 809–816.
89. Delgado VM, et al. Modulation of endothelial cell migration and angiogenesis: a novel function for the „tandem-repeat“ lectin galectin-8. FASEB J 2011; 25 : 242–254.
90. Fík Z, et al. Loss of adhesion/growth-regulatory galectin-9 from squamous cell epithelium in head and neck carcinomas. J Oral Pathol Med 2013; 42 : 166–173.
91. Hotta K, et al. Galectin-12, an adipose - expressed galectin - like molecule possessing apoptosis-inducing activity. J Biol Chem 2001; 276 : 34089–34097.
92. Dvorak HF, et al. Tumors: wounds that do not heal. Similarities between tumor stroma generation and wound healing. N Engl J Med 1986; 315 : 1650–1659.
93. Kolar M, et al. Upregulation of IL-6, IL-8 and CXCL-1 production in dermal fibroblasts by normal/malignant epithelial cells in vitro: Immunohistochemical and transcriptomic analyses. Biol Cell 2012; 104 : 738–751.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Perioperační chemoterapie u karcinomu žaludku – pohled chirurga
- Základné biologické úlohy galektínov v reparácii tkanív a raste nádorov
- Vápník, mléčné výrobky a redukce hmotnosti
- Mutagenní vliv vyššího věku otců u neurokardiofaciokutánního syndromu
- Centra pro závislé na tabáku v České republice v roce 2012: přehled, ekonomika
- Která etika pro lékařskou etiku? Pocta Hansu Jonasovi, 1903–1993
- Horizont 2020, rámcový program Evropské komise pro výzkuma inovace na roky 2014–2020
- ESHG Conference – Satellite meeting, MiCo
- DANIEL NATHANS
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Perioperační chemoterapie u karcinomu žaludku – pohled chirurga
- Mutagenní vliv vyššího věku otců u neurokardiofaciokutánního syndromu
- Vápník, mléčné výrobky a redukce hmotnosti
- Základné biologické úlohy galektínov v reparácii tkanív a raste nádorov
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

