-
Medical journals
- Career
Perioperační chemoterapie u karcinomu žaludku – pohled chirurga
: MUDr. David Hoskovec
: 1. chirurgická klinika 1. LF UK a VFN, Praha
: Čas. Lék. čes. 2014; 153: 227-230
: Review Article
Současné platné evropské doporučené postupy pro léčbu karcinomu žaludku zahrnují podání několika cyklů perioperační chemoterapie. Tato doporučení vychází z publikovaných výsledků randomizovaných studií, kde pacienti v tomto léčebném režimu měli lepší celkové přežití, případně i jiné sledované parametry (disease free interval, time to progression). V přehledu je podán rozbor chirurgické léčby pacientů v těchto studiích, ze kterého vyplývá, že u určitého procenta zařazených pacientů nebyl dodržen standardní rozsah chirurgického výkonu.
Klíčová slova:
karcinom žaludku – perioperační chemoterapie – operační léčba – D2 lymfadenektomie
Karcinom žaludku je čtvrté nejčastější maligní onemocnění ve světě. V České republice má sice jeho výskyt klesající tendenci, ale většina nemocných je diagnostikována s pokročilým, radikálně neřešitelným onemocněním. Proto také výsledky léčby nejsou povzbudivé (1, 2).
Jedinou terapií, která potenciálně vede k vyléčení nemocného, je radikální chirurgický výkon. Nepříznivé výsledky léčby mohou být zlepšeny, pokud se podaří onemocnění identifikovat v časnějším stadiu, nebo pokud budou nalezeny a zavedeny do praxe nové účinné adjuvantní a neoadjuvantní léčebné postupy (3).
V posledním desetiletí byl do řady doporučení, především evropských a severoamerických, včleněn koncept perioperační chemoterapie. Tento koncept vychází z několika publikovaných studií, ve kterých bylo zaznamenáno prodloužení přežití u pacientů, kterým byla podána perioperační chemoterapie (4, 5).
Guidelines z Japonska a dalších dálněvýchodních zemí jsou v rozporu s těmito doporučeními, protože primárně preferují chirurgický výkon, poté případně doplněný adjuvantní onkologickou léčbou (6).
Rozbor publikovaných výsledků studií
Doporučený rozsah resekce a lymfadenektomie u karcinomu žaludku je v současné době standardizován jak v Evropě (4), tak v dálněvýchodních zemích (6). Za adekvátní chirurgický výkon u tumorů T2–4 je považována subtotální resekce žaludku, případně gastrektomie (v anglickém originále subtotal and total gastrectomy) doplněná lymfadenektomií v rozsahu D2 u nádorů T2–4. U tumorů T1N0 japonské guidelines doporučují D1 + lymfadenektomii. Otázka případné splenektomie a resekce kaudy pankreatu není dosud uzavřena, v Evropě je doporučována při přímé invazi, japonští autoři čekají na výsledky studie JCOG 0110. (7)
Na tvorbu nových doporučení měli největší vliv studie MAGIC, ACCORD, EORTC 40954. Následně je podán přehled rozsahu chirurgického výkonu v těchto studiích.Magic
Do studie byli zařazeni pacienti s karcinomem žaludku, gastroezofageální (GE) junkce a dolní třetiny jícnu. Po zařazení byli randomizováni do dvou větví. Ve větvi s chemoterapií byl nemocný léčen epirubicinem (50 mg/m2 i.v. v den 1), cisplatinou (60 mg/m2 i.v. v den 1) a následnou 21 dní trvající kontinuální infuzí fluorouracilu (200 mg/m2/den). Tento cyklus byl aplikován 3krát před operací a 3krát po operaci. Bylo zařazeno 503 nemocných, 250 bylo indikováno k perioperační chemoterapii. Výsledky byly publikovány v roce 2006 (8).
Sedmdesát čtyři procent nemocných mělo karcinom žaludku, 14 % nádor dolní části jícnu a 12 % karcinom gastroezofageální junkce. V době publikace bylo 90 % nemocných sledováno do úmrtí, nebo déle než 2 roky. Skupina s perioperační chemoterapií měla lepší výsledky jak v čase do progrese onemocnění (p < 0,001) i v celkovém přežití
(p = 0,009) (graf 1). Typ operací a provedená lymfadenektomie je shrnuta v tabulce 1.Z tabulky jasně plyne, že u 18 % výkonů ve větvi s chemoterapií (a u 28 % ve větvi léčené chirurgicky), chirurg hodnotil rozsah resekce jako paliativní. Pokud se podíváme na rozsah výkonu, D2 lymfadenektomie byla provedena pouze u 42,5 % pacientů s chemoterapií a 40,4 % nemocných léčených chirurgicky. Pokud soubor zúžíme a nebudeme počítat pacienty s resekcí distálního jícnu, je doporučení o rozsahu lymfadenektomie dodrženo pouze u 57,7 % pacientů s chemoterapií a 51,6 % chirurgicky léčených nemocných. Ve větvi s chemoterapií pouze 41,6 % dokončilo celý plánovaný cyklus.
Accord
Do studie byli zařazeni nemocní s karcinomem distální 1/3 jícnu, GE junkce a žaludku. Randomizace byla do dvou větví – s perioperační chemoterapií a operací vs. resekční výkon bez chemoterapie. Perioperační léčba byla rozdělena na dva až tři cykly před a dva až tři cykly chemoterapie po operaci. Každý cyklus spočíval v podání fluorouracylu 800 mg/m2/den v kontinuální infuzi 1–5 den + jednohodinová infuze cisplatiny 100 mg/ m2 každý 28. den. Do studie bylo zařazeno 224 nemocných, z toho 113 ve skupině s chemoterapií a 111 v chirurgické skupině. Výsledky byly publikovány v roce 2011 (9).
Nejčastěji zastoupenou diagnózou byl karcinom GE junkce (64 %), následoval karcinom žaludku (25 %) a karcinom distálního jícnu (11 %). Skupina s chemoterapií měla lepší celkové přežití (p = 0,02) i disease free survival (p = 0,003) (graf 2). Rozsah provedených operačních výkonů je sumarizován v tabulce 2.
Rozsah lymfadenektomie není uveden, byla doporučena D2 lymfadenektomie, ale rozhodnutí záleželo na operujícím chirurgovi. Radikální chirurgický výkon byl proveden pouze u 74 % nemocných léčených chirurgicky a u 87 % ve větvi s chemoterapií. Obdobně jako ve studii MAGIC pouze 50 % nemocných absolvovalo kompletní pooperační chemoterapii.
Eortc 40954
Do studie byli zařazeni pacienti s lokálně pokročilým karcinomem žaludku (stadium III a IV), bez vzdálených metastáz, včetně karcinomů distálního jícnu Siewert I a II.
Ve větvi s chemoterapií proběhly dva 48denní cykly. V každém cyklu byla podána cisplatina v dávce 50 mg/m2 v jednohodinové infuzí (trvání 1 hod.) ve dnech 1, 15 a 29, následována d-L kyselinou listovou 500 mg/ m2 a fluorouracylem 2000 mg/ m2 1, 8., 15, 22, 29 a 36 den. Pooperační chemoterapie nebyla podávána (10). Karcinom horní třetiny žaludku a GE junkce mělo 52,8 % pacientů, 26,4 % karcinom střední 1/3 a 20,8 % dolní třetiny. Trial byl zastaven po zařazení 144 pacientů (72 v každé větvi). Při analýze se neprokázal benefit neoadjuvantní chemoterapie proti samotnému chirurgickému výkonu ani v celkovém přežití, ani v progression free intervalu (graf 3). Ve skupině s neoadjuvantní léčbou bylo více pooperačních komplikací, v chirurgické skupině vyšší počet uzlinových metastáz. Provedené operace jsou sumarizovány v tabulce 3.
1. Rozsah chirurgického výkonu ve studii MAGIC 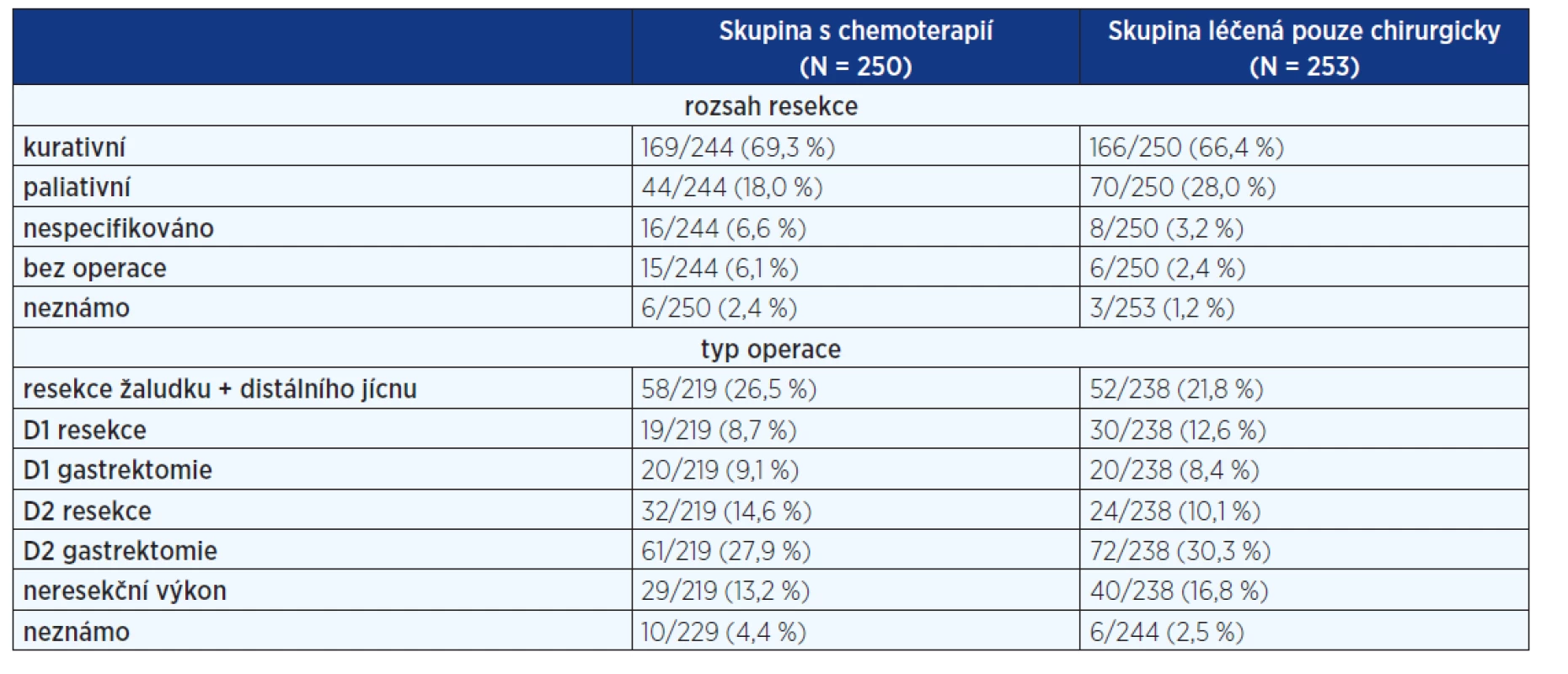
2. Rozsah operačního výkonu ve studii ACCORD 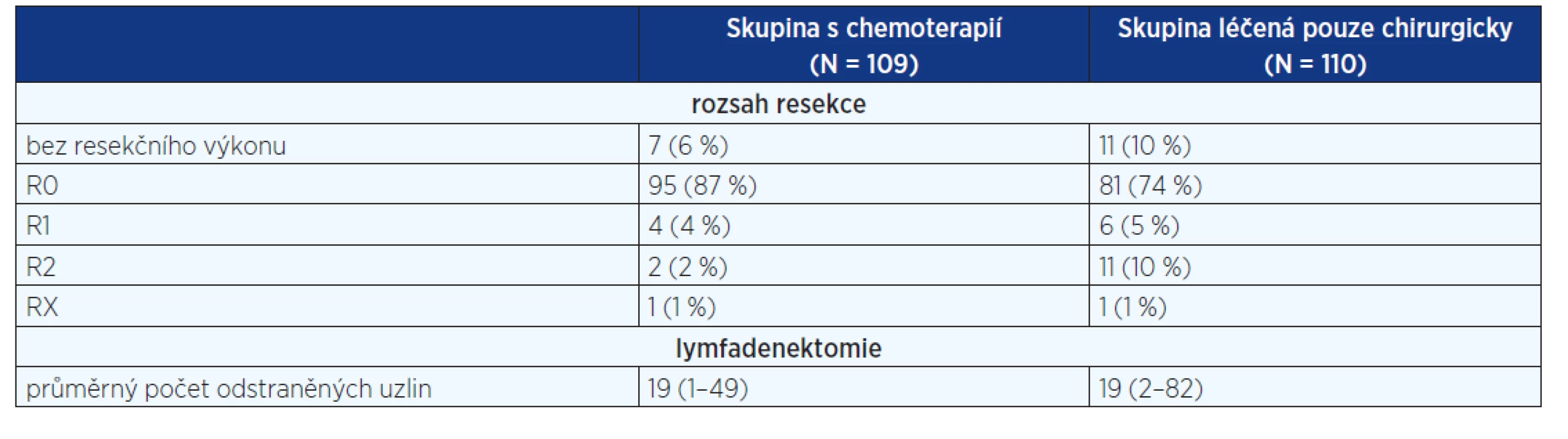
3. Rozsah operačního výkonu ve studii EORTC 40954 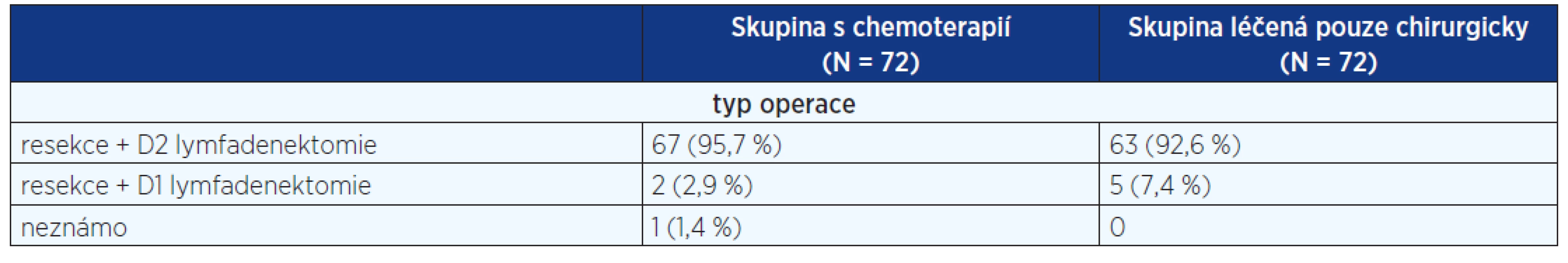
Diskuze
Největší počet pacientů s karcinomem žaludku je léčen v dálněvýchodních zemích, odkud (především z Japonska a Jižní Koreje) je také největší počet studií zaměřených na léčbu. Japonští chirurgové jsou také autoři konceptu rozšířené lymfadenektomie, který je po počátečním odmítání nyní všeobecně přijímán. K dočasnému odmítnutí D2 lymfadenektomie přispěly i dvě známé evropské studie porovnávající D1 a D2 lymfadenektomii (11, 12). Obě studie byly kritizovány za nedostatečné dodržení standardů operační léčby a malý počet pacientů operovaných v jednom centru. Přesto analýza provedená 15 let poté ukázala benefit D2 lymfadektomie (13).
Současná asijská doporučení preferují provedení chirurgického výkonu s D2 lymfadenektomií, případně doplněného pooperační chemoterapií. Tento koncept se opírá jak o celou řadu provedených studií srovnávajících rozsah lymfadenektomie (D1–4) proti sobě, tak o srovnání chirurgického výkonu samotného, případně doplněného pooperační onkologickou terapií (3). Podání pooperační chemoterapie podporují např. studie CLASSIC (1035 pacientů) (14) nebo ACTS-GC trial (1059 pacientů) (15). Standardem chirurgického výkonu byla D2 lymfafenektomie, u některých pacientů byla provedena D3 lymfadenektomie. Ve studii CLASSIC měl každý operující chirurg zkušenosti s minimálně 50 výkony pro karcinom žaludku za 1 rok. Ve studii CLASSIC bylo tříleté přežití 74 % ve větvi s následnou léčbou vs. 59 % ve větvi pouze s operací. Ve studii ACTS bylo tříleté přežití 80,1 % vs. 70,1 % (chemoterapie vs. operace). Po 5 letech přežívalo 70 % a 60 % nemocných. Eventuální přidání radioterapie (studie ARTIST), která randomizovala 458 pacientů, neprokázala statisticky signifikantní zlepšení přežití ve větvi s chemoradioterapií proti pouhé chemoterapii. Standardem chirurgické léčby byla opět D2 lymfadenektomie. Po 5 letech přežívalo 60–70 % pacientů (16).
Rozdílné výsledky spojené s pooperační chemoradioterapií byly dosaženy v USA, např. ve studii SWOG 9008/INT 0116. Ve větvi s chemoradioterapií bylo tříleté přežití 50% a v chirurgické větvi 41%. Při rozboru rozsahu chirurgické terapie se ukazuje, že 54 % nemocných mělo lymfadenektomii méně než D1 (!), D2 lymfadenektomie byla provedena pouze u 10 % nemocných (17, 18).
Při porovnání evropských studií proti asijským se jasně ukazuje, že přežití v evropských (a obdobně severoamerických) studiích nedosahuje stejných hodnot jako v dálněvýchodních souborech. Ani nejlepší výsledky publikované v Evropě nebo v USA se nepřibližují k přežití v japonských studiích. Z tohoto pohledu je na tom nejlépe studie EORTC 40954 (10), kde tříleté přežití bylo 50% a 62%. V této studii byla důsledně (alespoň dle publikovaných výsledků) dodržena standardní chirurgická léčba – D2 lymfadenektomie (graf 4).4. Srovnání přežití v japonských (tmavě šedá) a euro amerických (světle šedá) studiích 
Závěr
Publikované studie, které vedly ke změně doporučení a zařazení perioperační chemoterapie do léčebného algoritmu, trpí nedostatky v dodržování současných doporučení rozsahu chirurgické terapie, především co se týká rozsahu lymfadenektomie. V tomto světle se zdá, že perioperační (a zřejmě i pooperační adjuvantní terapie) se uplatní především v případech, kdy není dodržen současný doporučený standardní rozsah operace. K diskuzi se nabízí, zda je možné vůbec neadekvátní chirurgický výkon označit za radikální resekci. Na druhou stranu je nutné přiznat, že ani tam, kde je dodržen doporučený postup, nedosahují evropská centra obdobných výsledků jako v Asii. Je nutné si uvědomit, že v České republice určitě žádný chirurg neoperuje 50 případů karcinomu žaludku za 1 rok a v celé Evropě se bude jednat jen o několik jedinců (pokud se vůbec najdou). Takže do výsledků je nutné započítat i celkově menší zkušenost a rutinu.
Práce byla podpořena grantem Univerzity Karlovy PRVOUK 8.2.
ADRESA PRO KORESPONDENCI:
MUDr. David Hoskovec
1. chirurgická klinika 1. LF UK a VFN
U Nemocnice 2, 128 00 Praha 2
e-mail: david.hoskovec@vfn.cz
Sources
1. www.svod.cz
2. Tesař J, Krška Z, Zeman M. Karcinom žaludku a současnost. Rozhledy v chirurgii 2010; 89(3): 169–177.
3. De Manzoni G, Roviello F, Siquini W. Surgery in the multimodal management of gastrin cancer. Italy: Springer Verlag 2012.
4. Okines A, Verheij M, Allum W, Cunningham D, Cervantes A. Gastric cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Annals of Oncology 2010; 21(Suppl 5): v50–v54.
5. Kol. Gastric cancer, NCCN Clinical practice guidelines in oncology. Dostupné na: www.nccn.org
6. Japanese Gastric Cancer Association: Japanese gastric cancer treatment guidelines 2010 (ver. 3). Gastric Cancer 2011; 14 : 113–123.
7. Hoskovec D. Rozsah lymfadenektomie u karcinomu žaludku. Čas. Lék. čes. 2012; 151(4): 217–218.
8. Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer.
N Engl J Med 2006; 355 : 11–20.
9. Ychou M, Boige V, Pignon JP, et al. Perioperative Chemotherapy Compared With Surgery Alone for Resectable Gastroesophageal Adenocarcinoma: A FNCLCC and FFCD Multicenter Phase III Trial, Published Ahead of Print on March 28, 2011 as 10.1200/JCO.2010.33.0597.
10. Schuhmacher Ch, Gretschel S, Lordick F, et al. Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer Randomized Trial 40954, Published Ahead of Print on November 8, 2010 as 10.1200/JCO.2009.26.6114.
11. Hartgrink HH, van de Velde CJ, Putter H, et al. Extended lymph node dissection for gastric cancer: Who may benefit? Final results of the randomized Dutch Gastric Cancer Group Trial. J Clin Oncol 2004; 22 : 2069–2077.
12. Cuschieri A, Weeden S, Fielding J, et al. Patient survival after D1 and D2 resection for gastric cancer: Long-term results of the MRC randomized surgical trial. Surgical Co-operative Group. Br J Cancer 1999; 79 : 1522–1530.
13. Songun I, Putter H, Meershoek-Klein Kranenbarg E, et al. Surgical treatment of gastric cancer: 15-year follow-up results of the randomised nationwide Dutch D1D2 trial Lancet Oncol 2010; 11 : 439–449.
14. Yung-Jue Bang, Young-Woo Kim, Han-Kwang Yang et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC): a phase open-label, randomised controlled trial. Lancet 2012; 379 : 315–321.
15. Sakuramoto M, Sasako M, Yamaguchi T. Adjuvant chemotherapy for gastric cancer with s-1, an oral fluoropyrimidine N Engl J Med 2007; 357 : 1810–1820.
16. Lee J, Lim DH, Kim S, et al. Phase III trial comparing capecitabine plus cisplatin versus capecitabine plus cisplatin with concurrent capecitabine radiotherapy in completely resected gastric cancer with d2 lymph node dissection: the ARTIST trial. J Clin Oncol 2011; 30 : 268–273.
17. Macdonald JS, Smallex SR, Benedetti J, et al. Chemoradiotherapy after surgery compared with surgery alone for adenocarcinoma of the stomach or gastroesophageal junction. N Engl J Med 2001; 345 : 725–730.
18. Smalley SR, Benedetti JK, Haller DG, et al. Updated analysis of SWOG-Directed Intergroup Study 0116: a phase iii trial of adjuvant radiochemotherapy versus observation after curative gastric cancer resection. Published ahead of print on May 14, 2012 as 10.1200/JCO.2011.36.7136.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Perioperative chemotherapy in gastric cancer treatment – the surgeon’s view
- Basic biological roles of galectins in tissue repair and tumor growth
- Calcium, dairy products and weight reduction
- Mutagenic effect of advanced paternal age in neurocardiofaciocutaneous syndrome
- Centres for Tobacco-Dependent in the Czech Republic in 2012: overview and economy
- Which ethics for medical ethics? Homage to Hans Jonas, 1903–1993
- Horizon 2020, new EU Framework programme for research and innovation, 2014–2020
- ESHG Conference – Satellite meeting, MiCo
- DANIEL NATHANS
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Perioperative chemotherapy in gastric cancer treatment – the surgeon’s view
- Mutagenic effect of advanced paternal age in neurocardiofaciocutaneous syndrome
- Calcium, dairy products and weight reduction
- Basic biological roles of galectins in tissue repair and tumor growth
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career




