-
Medical journals
- Career
Co může internista udělat pro svého pacienta po ischemické cévní mozkové příhodě
Authors: Miroslav Škorňa
Authors‘ workplace: Neurologická klinika LF MU a FN Brno
Published in: Vnitř Lék 2021; 67(1): 7-14
Category: Main Topic
Overview
Cévní mozková příhoda (CMP) je častým onemocněním především starší populace. Jedná se o komplexní multioborovou problematiku a interní lékař představuje důležitý článek v péči o pacienty po CMP. Abychom předcházeli často invalidizující recidivě CMP, je zásadní včasné a správné zavedení účinné sekundární prevence. Článek podává základní informace o etiologii, možnostech došetření a sekundární prevenci ischemické CMP.
Klíčová slova:
cévní mozková příhoda – etiologie – sekundární prevence
Úvod
Ischemický iktus definujeme jako epizodu neurologické dysfunkce způsobenou fokálním mozkovým, míšním nebo retinálním infarktem. Infarkt centrální nervové soustavy (CNS) představuje nekrózu mozku, míchy nebo sítnice způsobenou ischemií, zjištěnou na základě patologického nálezu, nálezu na zobrazovacích vyšetřeních nebo jiných objektivních známek fokální mozkové, míšní nebo retinální ischemie, nebo na základě klinických příznaků fokální mozkové, míšní nebo retinální ischemie trvající ≥ 24 hodin (nebo do úmrtí); musí být vyloučena jiná etiologie (1).
Ischemická cévní mozková příhoda (iCMP) se projevuje náhle vzniklým ložiskovým neurologickým deficitem, který odpovídá teritoriu postižené mozkové tepny – nejčastěji jde o poruchu hybnosti a/nebo citlivosti poloviny obličeje, končetin nebo poloviny těla (zpravidla jednostranně), poruchu řeči (afázii nebo dysartrii) či dalších symbolických funkcí (např. apraxii), poruchu vizu (monokulární, heteronymní anopsii), ataxii, deviaci hlavy a očních bulbů, pohledovou parézu, diplopii či náhle vzniklou nevysvětlitelnou závrať. Bolest hlavy, zvracení v úvodu, porucha vědomí nebo epileptické paroxysmy bývají přítomny vzácněji (2).
V souvislosti s iCMP se v literatuře i klinické praxi často setkáváme s pojmy minor stroke a tranzitorní ischemická ataka. Minor stroke představuje obecně malý, drobný iktus a nemá jednotnou definici. Bývá tak označována iCMP s lehkým neurologickým deficitem, který je obvykle definován na základě NIHSS ≤ 3 (National Institutes of Health Stroke Scale; NIHSS = 0 znamená žádný neurologický deficit, vyšší skóre odpovídá těžšímu deficitu) (3). Tranzitorní ischemická ataka (TIA) patří do skupiny iCMP se všemi možnými konsekvencemi včetně požadavku na urgentní diagnostiku a léčbu. Označujeme tak přechodný ložiskový neurologický deficit předpokládaného cévního původu, který odezní většinou do 1 hodiny, maximálně pak do 24 hodin (4). V současnosti víme, že u 30–50 % pacientů, definovaných na základě časového kritéria trvání příznaků jako TIA, je nalezen na MR DWI (magnetická rezonance, difuzně vážená sekvence) mozkový infarkt (5). To jednak podtrhuje nároky na urgentní management přechodného ložiskového neurologického deficitu a jednak upřesňuje definování TIA. Kromě výše uvedeného časového hlediska by měl být splněn i požadavek na vyloučení akutního infarktu (4).
S incidencí 211 hospitalizovaných na 100 000 obyvatel v České republice (ČR) (6) je iCMP velmi častým onemocněním. CMP se významně podílejí na morbiditě a invalidizaci především starší populace a v ČR jsou druhou nejčastější příčinou kardiovaskulárních úmrtí (7). Pokud pacient prodělá TIA nebo neinvalidizující CMP, je nutná důsledná sekundární prevence, protože právě recidiva iCMP je často zodpovědná za trvalé invalidizující následky (8). Základním předpokladem pro správnou sekundární prevenci je znalost vlastní příčiny iCMP nebo alespoň vyšetření takových příčin, jejichž ovlivněním můžeme významně snížit riziko opakování iCMP. Pokud nebyla příčina iCMP zjištěna v průběhu hospitalizace, mělo by následovat zevrubné došetření etiologie ambulantním neurologem, optimálně pak cévním neurologem. Toto došetření často probíhá ve spolupráci s internistou/kardiologem a řada pacientů po prodělané iCMP je v dispenzární péči ambulantních internistů. Cílem této práce není podat vyčerpávající informace o iCMP, ale považuji za důležité, aby měl každý internista povědomí o nejdůležitějších příčinách iCMP, jejich došetření a možnostech sekundární prevence.
Etiologie iCMP a její došetření
Jak již bylo výše uvedeno, základním předpokladem pro účinnou sekundární prevenci je zjištění příčiny iCMP. Literatura popisuje velké množství jednotlivých příčin iCMP, proto je třídíme do několika skupin se společnými charakteristikami, včetně přístupu k sekundární prevenci. V klinické praxi je nejčastěji používanou klasifikací etiologická klasifikace TOAST (Trial of Org 10172 in Acute Stroke Treatment), resp. její novější verze SSS‑TOAST (Stop Stroke Study TOAST), která třídí pacienty podle etiologie do pěti kategorií – ateroskleróza velkých tepen, kardioembolizace, onemocnění malých tepen, jiná příčina a neurčená příčina (9, 10).
Pro jasnou aterosklerotickou etiologii iCMP je nutný průkaz okluze nebo alespoň 50% stenózy (event. stenózy pod 50 % s ulcerovaným plátem či trombem) velké mozkové tepny. Nezbytné je provedení zobrazovacího vyšetření extra - i intrakraniálních mozkových tepen alespoň jednou modalitou (DSA, CT angiografie, MR angiografie či ultrazvukové vyšetření).
Pro kardioembolickou etiologii svědčí přítomnost hlavního kardioembolizačního zdroje (Tab. 1). Dominantní postavení má mezi kardioembolickými ikty jednoznačně fibrilace síní. Fibrilace síní je jednak nejčastější jednotlivou příčinou iCMP (dle některých prací je souvislost iCMP s fibrilací síní odhadována až ve 39 % případů (11)) a jednak je zodpovědná za ikty s těžším neurologickým deficitem a vyšší mortalitou oproti iktům bez fibrilace síní (12). Základním diagnostickým algoritmem je 12svodové EKG, alespoň 24hodinová Holterovská EKG monitorace a transtorakální echokardiografie (TTE).
Table 1. Hlavní (vysoce rizikové) kardioembolizační zdroje 
Onemocnění malých tepen je přítomno, pokud prokážeme drobný subkortikální infarkt (tzv. lakunu, na DWI MR měří v největším rozměru max. 20 mm) v teritoriu penetrujících tepen (odstupují z proximálních větví Willisova okruhu, bazilární tepny nebo distálních částí vertebrálních tepen), difuzní postižení bílé hmoty (leukoaraiózu) či mikrokrvácení. Optimální zobrazovací modalitou je MR.
Kategorie „jiná příčina“ tvoří menšinu a představuje heterogenní skupinu vzácnějších onemocnění. Jedná se o tepenné disekce, trombofilie, vaskulitidy, nezánětlivé vaskulopatie (např. fibromuskulární dysplazie), migrenózní infarkt, hereditární mikroangiopatie (např. Fabryho choroba, CADASIL – Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarcts and Leukoencephalopathy), hyperviskózní syndrom, mozkové infarkty asociované s abúzem drog či iatrogenní příčiny (ikty po endovaskulárních výkonech a srdečních či cévních operacích). Z uvedeného vyplývá nutnost provedení pokročilého panelu vyšetření, který realizujeme především v případě anamnestického či klinického podezření a u pacientů mladších (cca do 55 let věku) s absencí „klasických“ cévních rizikových faktorů. Do pokročilého panelu vyšetření patří imunologický screening, vyšetření na získané či hereditární trombofilie, genetické a metabolické vyšetření, MR mozku s kontrastní látkou, celotělový PET, MR srdce, vyšetření likvoru či mozková biopsie.
Za pojmem „neurčená příčina“ se skrývají pacienti s kryptogenní CMP, nekompletně vyšetření a pacienti s více než jednou jasnou příčinou iktu.
Pro zájemce o podrobnější informace o etiologické klasifikaci SSS‑TOAST doporučuji článek doc. Tomka, kde je uveden i přehledně schematicky základní diagnostický algoritmus (10).
Kryptogenní ikty tvoří přibližně 1/3 všech iCMP a nejsou jednoznačně definovány (13, 14). Podíl kryptogenních iktů na celkové populaci pacientů s iCMP je ovlivněn řadou faktorů, významnou roli hraje především kvalita a rozsah došetření a věk. U pacientů mladších 50 let přesahuje podíl kryptogenních iktů 50 % (14).
Definovanou podskupinou kryptogenních iktů jsou tzv. ESUS (Embolic Strokes of Undetermined Source) ikty a s podílem 9–25 % na všechny iCMP tvoří významnou podskupinu iCMP (15, 16). Tento koncept vychází z předpokladu, že většina nelakunárních iktů je embolického původu. Jiné patofyziologické mechanismy vzniku nelakunárních iktů jsou možné (hemodynamické příčiny, vazospasmy či trombotické okluze vzniklé in‑situ), ale jsou považovány za mnohem méně časté než okluze (trombo)embolické. Pro zařazení iktu do kategorie ESUS je potřeba potvrdit na zobrazovacím vyšetření infarkt, který je nelakunární (lakuna = subkortikální infarkt ≤ 15 mm nebo ≤ 20 mm na MR DWI), vyloučit významnou stenózu (≥ 50 %) relevantní extra - i intrakraniální mozkové tepny, vyloučit hlavní kardioembolický zdroj (fibrilace/flutter síní, intrakardiální trombus, mechanická chlopenní náhrada, myxom nebo jiný tumor, mitrální stenóza, infarkt myokardu v posledních 4 týdnech, ejekční frakce levé komory < 30 %, vegetace na chlopních, infekční endokarditida) a jinou specifickou příčinu (vaskulitida, disekce, migréna/ vazospasmus, abúzus drog). Diagnostickým minimem je zobrazení mozku (CT, MR), mozkových tepen (CTA, MRA, UZ, DSA) a kardiologické vyšetření (TTE, EKG monitorace ≥ 24 hodin). Takhle definovaná podsku ‑ pina iktů je stále vysoce heterogenní a lze ji rozdělit do několika dalších hlavních podkategorií. Jedná se o ikty asociované s nízkorizikovým kardioembolizačním zdrojem, spojené s nádorovým onemocněním, arteriogenní (tepenné stenózy do 50 %, pláty aortálního oblouku) či paradoxní (zejména patentní foramen ovale – PFO) embolizace a způsobené latentní paroxysmální fibrilací síní, která představuje nejčastější příčinu ESUS iktů (více než 35 %) (14, 15, 17). Z uvedeného vyplývá, že u značné části pacientů bude diagnostické minimum nedostatečné a bude potřeba doplnit další vyšetření, zejména pak s ohledem na stavy, které vedou ke změně strategie v sekundární prevenci. Za nejdůležitější považuji dlouhodobou EKG monitoraci, jícnovou echokardiografii (TEE; detekce pravo‑levého zkratu) a onkologický screening, selektivně pak vyšetření z pokročilého panelu jak bylo uvedeno výše.
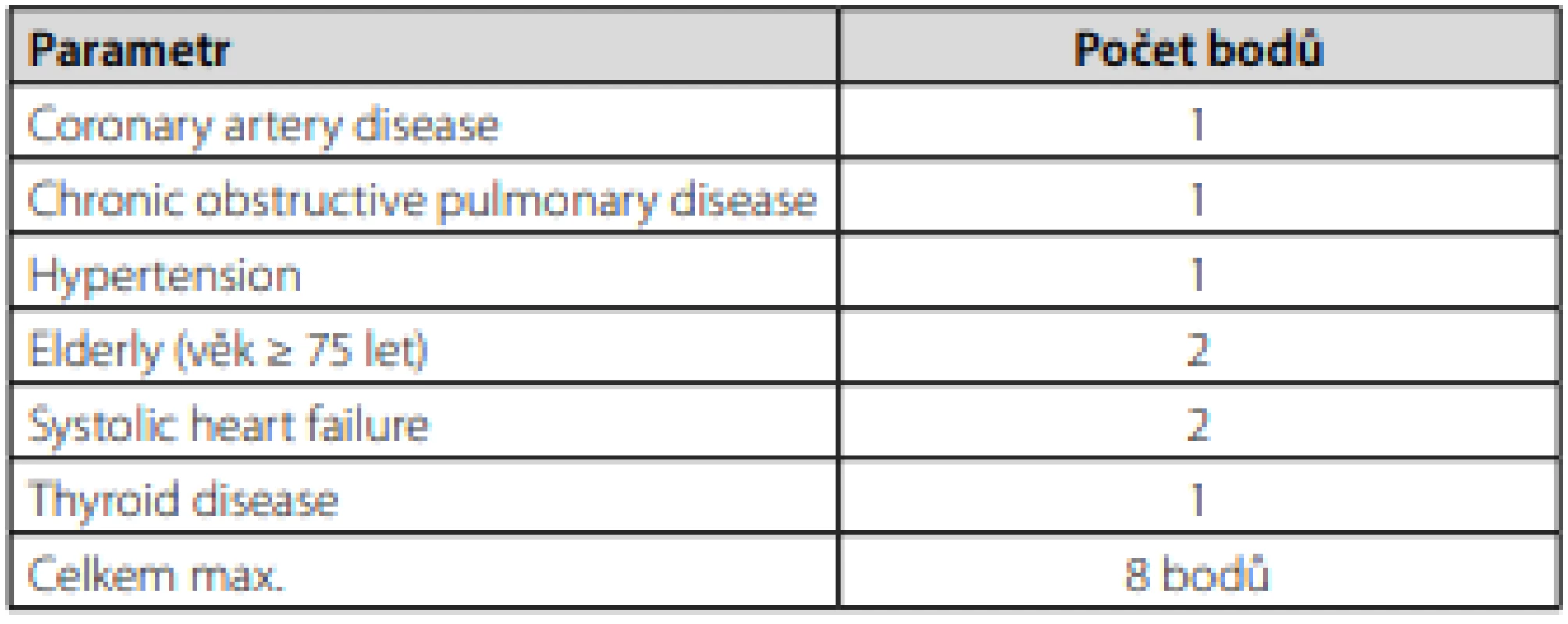
Dle doporučení Evropské kardiologické společnosti (ESC) pro fibrilaci síní z roku 2020 je u pacientů po iCMP indikována krátkodobá alespoň 24hodinová EKG monitorace, která by měla být následována kontinuální EKG monitorací alespoň 72 hodin. U selektované skupiny pacientů by měla být zvážena dlouhodobá EKG monitorace pomocí externích nebo implantabilních záznamníků (18). V ČR je velmi dobře dostupná 3týdenní EKG monitorace pomocí externích záznamníků. Superioritu dlouhodobé EKG monitorace oproti standardnímu 24hodinovému Holterovskému monitoringu dokumentovala řada studií a záchyt fibrilace síní při 30den ‑ ním monitoringu můžeme očekávat přibližně u 15 % pacientů po iCMP (19, 20). Obecně platí, že čím déle budeme pacienta monitorovat, tím je větší pravděpodobnost záchytu fibrilace síní. Ve studii CRYSTAL‑AF (implantabilní záznamník) došlo za 3 roky monitorace ke 30% záchytu fibrilace síní (21). Hlavní nevýhodou implantabilního záznamníku je jeho vysoká pořizovací cena a invazivita. Dlouhodobá EKG monitorace by měla být provedena u všech pacientů po kryptogenní iCMP, resp. ESUS, zejména pak u selektované skupiny, jak uvádí zmíněná doporučení pro fibrilaci síní (18) a Stanovisko Výboru Cerebrovaskulární sekce České neurologické společnosti ČLS JEP (22). Hlavními prediktory záchytu fibrilace síní po iCMP jsou vyšší věk (nad 60 let), kryptogenní iktus, především pak iktus embolického charakteru a recidivující embolické ikty v různých povodích hlavních mozkových tepen, elektrofyziologické (500–1000 supraventrikulárních extrasystol za 24 hodin), morfologicko‑funkční (zvětšení levé síně, abnormální morfologie ouška levé síně, snížená kontraktilita síní) a biochemické markery atriální kardiopatie (elevace NT‑proBNP, troponinu), a vyšší CHA2DS2VASc skóre (13, 14). Jednoduchou pomůckou k predikci záchytu fibrilace síní je Brown‑ESUS AF skóre, které pracuje s dvěma parametry – věkem a velikostí levé síně (Tab. 2) (23). U pacientů starších 74 let se středně těžkým až těžkým zvětšením levé síně byla pravděpodobnost záchytu fibrilace síní více než 50%. Další možností, kterou zmiňují i doporučení ECS pro fibrilaci síní, je skóre C2HEST (Tab. 3). Za vysoce rizikovou skupinu jsou považováni pacienti se skóre ≥ 4 a oproti nízce rizikové skupině (skóre 0–1) mají téměř pětinásobnou pravděpodobnost záchytu fibrilace síní (24).
Ze skupiny vzácných příčin CMP stojí za zmínku Fabryho choroba. Jedná se o progresivní metabolické dědičné onemocnění vázané na chromozom X, které je způsobeno mutací genu pro enzym α‑galak ‑ tosidázu A (GLA gen). Enzymový defekt vede k akumulaci glykolipidů a následně poškození řady orgánů. Jedním z prvních projevů může být kryptogenní CMP v mladém věku. Z dalších orgánů bývá postiženo srdce (karydiomyopatie, arytmie), ledviny, trávicí ústrojí, kůže (angiokeratomy), periferní nervový systém (neuropatická bolest, hypohidróza, zvýšená citlivost vůči chladu), oči (cornea verticillata) a uši (poruchy sluchu, závratě). Kromě postižení malých tepen, které je pro Fabryho chorobu typické, může dojít ke vzniku iCMP i jiným mechanismem (např. kardioembolizačně). U mladých pacientů (do 55 let) po kryptogenním iktu, především pak s pozitivní rodinnou anamnézou či známkách postižení dalších orgánů, by měl být proveden test na Fabryho chorobu vzhledem k možnosti účinné enzymové substituční terapie (25, 26).
Přehled sekundární prevence iCMP
Sekundární prevence iCMP by měla vycházet ze zjištěné etiologie a zahrnuje režimová opatření, farmakologické, chirurgické, endovaskulární a další specifické postupy.
Základním specifickým farmakologickým postupem je terapie antitrombotická – antiagregační, antikoagulační či kombinovaná.
U všech pacientů, kteří nevyžadují antikoagulační terapii, je indikována terapie antiagregační. Na základě doporučení a dostupnosti v ČR je indikována acetylsalicylová kyselina (ASA) v dávce 100 mg denně nebo klopidogrel 75 mg denně. Ostatní preparáty nejsou v ČR dostupné (dipyridamol) nebo nemají schválenou indikaci pro sekundární prevenci iCMP a lze je použít pouze ve výjimečných případech po schválení revizním lékařem (např. ticagrelor) (2, 27, 28).
Antikoagulační terapie je jednoznačně indikována u pacientů s fibrilací síní (i paroxysmální), intrakardiálním trombem, mechanickou chlopenní náhradou, středně těžkou až těžkou mitrální stenózou a prokázanou intrakraniální žilní trombózou (14, 27, 29, 30). U pacientů s mechanickou chlopní a mitrální stenózou lze použít pouze warfarin (29). Warfarin je preferován i u pacientů s intrakardiálním trombem. V případě fibrilace síní lze nasadit warfarin nebo NOAK (non‑vitamin K antagonist oral anticoagulants), nicméně léky ze skupiny NOAK by měly být jednoznačně preferovány pro lepší poměr účinnosti/bezpečnosti, jednodušší užívání a podstatně méně lékových a potravinových interakcí (18, 29). Jejich hlavním přínosem je téměř 50% redukce intrakraniálních krvácení (31). Neexistují tvrdá doporučení pro preferenci konkrétního preparátu v sekundární prevenci iCMP, nicméně pro různé klinické situace (např. vysoký věk, renální insuficience) může být výhodnější nasazení konkrétního NOAK (32, 33). Pro úhradu léků ze skupiny NOAK z veřejného zdravotního pojištění musely být do nedávné doby splněny specifické podmínky. Od 1. 11. 2020 je možno v první volbě předepisovat rivaroxaban a od 1. 1. 2021 se tato možnost rozšířila i na ostatní léky z této skupiny (apixaban, dabigatran a edoxaban). Od 1. 2. 2021 se bohužel podmínky pro preskripci NOAK (kromě rivaroxabanu) vrátily do původního stavu (s nutností splnit specifické podmínky). Doufejme, že bude možno v brzké době opět předepisovat všechny NOAK v první volbě a výběr optimálního léku bude jen na ošetřujícím lékaři. U pacientů s PFO je antikoagulační terapie indikována v případě současného průkazu hluboké žilní trombózy/plicní embolie. Dále lze zvažovat její nasazení u pacientů s prokázanou trombofilií a antifosfolipidovým syndromem, zejména v případě recidivující iCMP (27). V ostatních případech (těžká dilatační kardiomyopatie s EF LK ≤ 35 %, extrakraniální disekce arteria carotis interna nebo arteria vertebralis, významná ateroskleróza ascendentní aorty a aortálního oblouku) nebyl jasně prokázán benefit antikoagulační terapie oproti terapii antiagregační, proto by mělo být u těchto pacientů postupováno individuálně (14, 27, 28).
U části nemocných je indikována kombinovaná antitrombotická terapie (duální antiagregace nebo antikoagulace + antiagregace). Její podávání je vyhrazeno pro specifické situace a obvykle je časově omezeno na období s vysokým rizikem recidivy iCMP. Dlouhodobé užívání je spojeno s vysokým rizikem krvácivých komplikací.
Nasazení duální antiagregační terapie (DAPT) je indikováno časně po prodělané iCMP/TIA a její podávání by mělo být krátkodobé. Prospěšnost dlouhodobé a odložené DAPT nebyla prokázána. DAPT nasazujeme ve specifických situacích, jako je současný infarkt myokardu, implantace stentu a uzávěr PFO nebo ouška levé síně (2, 34, 35). Kombinace ASA a klopidogrelu je dále indikována na 3 měsíce u pacientů po prodělaném iktu nebo TIA (v posledních 30 dnech) způsobeném těžkou stenózou intrakraniální tepny (70–99 %) (36). Vyšší účinnost kombinace ASA a klopidogrelu byla oproti samostatné ASA prokázána u pacientů s rizikovou TIA a minor stroke (NIHSS ≤ 3). DAPT by měla být zahájena co nejdříve od příhody (do 24 hodin) a měla by být podávána po dobu 3 týdnů až maximálně 3 měsíců (37, 38). K podobným výsledkům dospěla i nedávno publikovaná studie THALES. Pacienti po nekardioembolickém iktu (NIHSS ≤ 5) nebo rizikové TIA, kterým byla nasazena kombinovaná léčba ASA + ticagrelor (do 24 hodin od příhody po dobu 30 dnů), měli nižší riziko recidivy CMP a úmrtí než pacienti, kteří užívali pouze ASA (39).
U stavů, kdy je indikována trvalá antikoagulační terapie (např. fibrilace síní), mohou vzniknout situace, kdy je nutné přidání antiagregační terapie na přechodnou dobu. Především jde o pacienty se současnou implantací stentu či akutním koronárním syndromem (28). Přidání antiagregační terapie k terapii antikoagulační je indikováno v případě selhání samotné antikoagulační terapie u pacientů po mechanické chlopenní náhradě. Duální antikoagulační + antiagregační terapie by měla být zvážena i v případě selhání antiagregační léčby u pacientů s biologickou chlopenní náhradou (27).
Duální terapie (kombinace ASA a malé, tzv. vaskulární, dávky rivaroxabanu) je relativně novým terapeutickým přístupem u pacientů se stabilním aterosklerotickým onemocněním. Studie COMPASS porovnávala samotnou ASA se samotným rivaroxabanem (2 × 5mg) a s kombinovanou léčbou ASA + rivaroxaban 2 × 2,5mg. Kombinovaná léčba dosáhla lepších výsledků než samotná ASA v primárním ukazateli (kompozit úmrtí z kardiovaskulárních příčin, CMP, infarkt myokardu). U pacientů užívajících kombinaci ASA + rivaroxabanu bylo oproti ASA zjištěno vyšší riziko závažného krvácení, nebyl ale rozdíl mezi výskytem intrakraniálního či fatálního krvácení. Čistý klinický přínos byl lepší u pacientů na kombinované léčbě než na samotné ASA (měli nižší riziko vzniku kompozitu úmrtí z kardiovaskulárních příčin, CMP, infarktu myokardu, fatálního krvácení nebo symptomatického krvácení do kritického orgánu) (40). Pacienti na kombinované léčbě měli oproti samotné ASA nižší riziku vzniku CMP/iCMP, což bylo konzistentní napříč podskupinami s největším benefitem u skupin nejrizikovějších (zejména u pacientů po prodělané iCMP) (41). Rivaroxaban 2 × 2,5 mg je hrazen v kombinaci s ASA u pacientů s ischemickou chorobou srdeční (ICHS – pacienti po infarktu myokardu nebo s vícečetným aterosklerotickým po ‑ stižením koronárních tepen) a současně onemocněním periferních tepen (včetně karotických) nebo ICHS a diabetem mellitem nebo ICHS a renální insuficiencí (CrCl < 60ml/min). Pokud pacient po iCMP splňuje tato kritéria, nemá vyšší riziko krvácení a neprodělal lakunární nebo krvácivou CMP, mělo by být v sekundární prevenci zváženo nasazení kombinované léčby ASA + rivaroxaban 2 × 2,5mg s odstupem alespoň 1 měsíce po iCMP.
Zvláštní problematiku v sekundární prevenci představují tzv. ESUS ikty. Dle současných doporučení je u nich i přes vysoké riziko recidivy iCMP indikována antiagregační terapie. Prospěšnost warfarinu oproti ASA nebyla u pacientů po nekardioembolizačním iktu prokázána (42). Předpokládaný embolizační mechanismus u ESUS iktů, vyšší účinnost warfarinu oproti ASA v určité podskupině kryptogenních iktů (43) a lepší bezpečnostní profil NOAK, vedly k úvahám, zda by právě NOAK nebyly účinnější než ASA v redukci rizika opakování CMP. Doposud byly ukončeny dvě studie, které porovnávaly účinnost rivaroxabanu (NAVIGATE ESUS) a dabigatranu (RE-SPECT ESUS) s ASA v sekundární prevenci po proběhlém embolizačním iktu z neznámého zdroje. Ve studii NAVIGATE ESUS nebyla prokázána vyšší účinnost rivaroxabanu proti ASA v redukci rizika recidivy iktu a systémové embolizace. Pacienti léčení rivaroxabanem měli současně vyšší riziko závažného krvácení (44). Ve studii RE-SPECT ESUS byl menší počet recidiv CMP v dabigatranové větvi, tento rozdíl však nebyl statisticky významný. Jistým přínosem je ale skutečnost, že nebyl zjištěn rozdíl ve výskytu závažných krvácení mezi pacienty léčenými dabigatranem a ASA (45). Zajímavé je, že u obou studií byla detekována podskupina, která profitovala z léčby NOAK. U dabigatranu to byli pacienti starší 75 let a u rivaroxabanu pacienti s průměrem levé síně více než 4,6 cm (45, 46). V současnosti stále probíhají další dvě podobně designované studie porovnávající účinnost apixabanu proti ASA. Jedná se o studie ARCADIA (primárním ukazatelem je recidiva CMP) a ATTICUS (primárním ukazatelem je alespoň 1 nová ischemická léze na MR ve 12 měsících) a hlavním rozdílem oproti předešlým studiím je větší selekce pacientů po prodělaném ESUS iktu – všichni pacienti musí mít alespoň jeden definovaný rizikový faktor (marker síňové kardiopatie) (47, 48). Z uvedeného vyplývá, že doposud nemáme tvrdá data, na jejichž základě bychom měli pacienty po proběhlém ESUS iktu, či jejich podskupiny, antikoagulovat. Toto by nám měly odhalit budoucí studie. Proto je důležité další došetření této skupiny pacientů, zejména pak s důrazem na detekci asymptomatické paroxysmální fibrilace síní.
Z nefarmakologických intervencí se v sekundární prevenci iCMP uplatňuje především karotická endarterektomie, implantace stentu do přívodných mozkových tepen, uzávěr PFO a ouška levé síně.
Karotická endarterektomie (CEA) je indikována u pacientů se symptomatickou (do 6 měsíců od CMP) 70–99 % stenózou vnitřní karotidy, u některých nemocných i v případě 50–69 % stenózy. Alternativou ke karotické endarterektomii je implantace stentu. Stenting upřednostňujeme u pacientů s kontraindikací CEA, lokalizací stenózy v chirurgicky nepřístupné oblasti, s restenózou po předchozí CEA a poradiační stenózou. Je nutno zdůraznit, že revaskularizace by měla být provedena do 2 týdnů po TIA a minor stroke a před i po operaci musí být ponechána antiagregační terapie. V případě implantace stentu je nutné nasazení duální antiagregační terapie (ASA + klopidogrel) před výkonem a v této léčbě má být pokračováno nejméně měsíc po stentingu (2, 27).
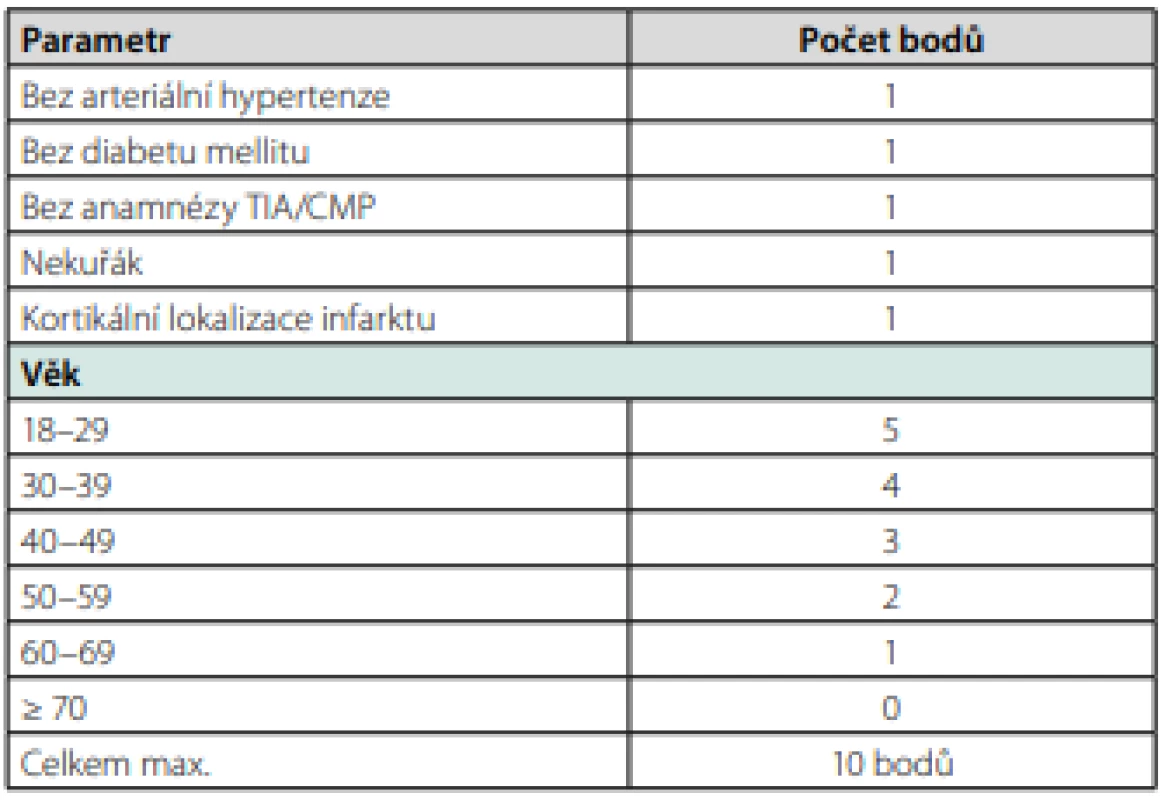
Incidence PFO je v obecné populaci vysoká a je udávána až ve 30 % (49). Usvědčit PFO za příčinu, resp. cestu pro paradoxní embolizaci bývá proto mnohdy obtížné. Studie CLOSE a Gore REDUCE (včetně prodlouženého sledování – data prezentována na ESO‑WSO 2020) prokázaly snížení rizika recidivy iktu u pacientů po kryptogenní CMP, kteří podstoupili uzávěr PFO a současně užívali antiagregační terapii, oproti pacientům, kteří byli léčeni pouze antiagregační terapií (35, 50). Stejně tak studie RESPECT extended prokázala lepší výsledky uzávěru PFO oproti antitrombotické terapii (antikoagulační či antiagregační) (51). Ke každému pacientovi bychom však měli přistupovat individuálně a i vzhledem k výše uvedeným studiím bychom měli uzávěr indikovat zejména v následujících případech: při průkazu zdroje paradoxní embolizace v žilním řečišti, dispozice k žilnímu trombembolismu, u pacientů mladších (cca do 60 let) s absencí klasických rizikových faktorů, po kryptogenním iktu embolického charakteru či při průkazu vícečetných (němých) ischemií v různých povodích, v případě současné přítomnosti aneurysmatu septa síní, u velkých zkratů (kvantifikace pomocí TEE či transkraniální sonografie po podání echokontrastní látky), prokázaném trombu v kanále PFO, v případě anamnesticky zjištěného Valsalvova manévru při vzniku CMP či hodnoty RoPE skóre nad 6 (Tab. 4) (52, 53). Alternativou k uzávěru PFO je antiagregační léčba v monoterapii. Vyšší účinnost antikoagulační te ‑ rapie oproti antiagregační terapii nebyla u pacientů s PFO bez současné hluboké žilní trombózy jednoznačně prokázána.
U pacientů s fibrilací síní, kteří mají závažnou kontraindikaci k antikoagulační terapii (např. prodělali lobární intracerebrální hematom), by měl být zvážen uzávěr ouška levé síně (LAAC) (18). Randomizované studie prokázaly noninferioritu LAAC oproti warfarinu (54) i NOAK (34). Pacienti po LAAC měli podobné riziko vzniku iktu a systémové embolizace jako pacienti užívající warfarin a měli nižší riziko hemoragických iktů. Efektivitu LAAC oproti NOAK (zejména apixabanu), které mají nižší riziko krvácení oproti warfarinu, posuzovala studie PRAGUE-17. Riziko vzniku primárního kompozitního ukazatele (iktus, TIA, systémová embolizace, kardiovaskulární úmrtí, klinicky relevantní krvácení, procedurální komplikace) bylo podobné v obou skupinách. U pacientů po LAAC byl trend k nižšímu riziku závažného neprocedurálního krvácení.
Závěr – „Co může internista udělat pro svého pacienta po iCMP?“
CMP představuje interdisciplinární problematiku. Na péči o pacienta s/po CMP se podílí řada subspecializací. Často jde o pacienty interně polymorbidní a mnohdy se stává, že pacient po propuštění z hospitalizace končí v dispenzární péči interní ambulance. Proto je důležité, aby byl internista obeznámen s hlavními příčinami CMP a základními principy sekundární prevence.
Všichni pacienti po iCMP by měli mít provedeno základní biochemické vyšetření včetně lipidového metabolismu a hormonů štítné žlázy, krevní obraz a základní koagulogram. Obligátní je zobrazovací vyšetření mozku a mozkových tepen, dále pak TTE (v případě její negativity či mladšího věku pak TEE) a alespoň 24hodinový Holterovský EKG monitoring. Důraz by měl být kladen na detekci fibrilace síní. Pacienti s kryptogenní CMP (především výše jmenované rizikové podskupiny) by měli podstoupit 3týdenní EKG monitoraci. Při každé ambulantní kontrole by mělo být provedeno 12svodové EKG či alespoň palpační vyšetření tepu.
Důležité je cílené ovlivňování cévních rizikových faktorů všemi možnými prostředky a správná indikace antitrombotická terapie, včetně terapie kombinované. Nutné je správné vedení antikoagulační terapie. U pacientů na warfarinu by měla být snaha udržovat čas v terapeutickém rozmezí nad 70 %. U pacientů s fibrilací je doporučeno upřednostňovat léky ze skupiny NOAK, v případě závažných nežádoucích účinků warfarinu či suboptimálním času v terapeutickém rozmezí by měl být pacient neprodleně převeden na NOAK.
V neposlední řadě je interní lékař specialistou, který provádí vyšetření před intervenčními zákroky a doporučuje perioperační management chronické medikace. Je nutno brát na zřetel, že před operací karotidy nikdy nevysazujeme antiagregační terapii. Management antitrombotické medikace před ostatními výkony závisí hlavně na charakteru zákroku a preferenci operatéra. Vysazení antitrombotické medikace u pacienta po iCMP vždy představuje zvýšené riziko recidivy příhody, a proto by měl být čas vysazení omezen na nezbytné minimum. V případě NOAK bychom se měli řídit doporučeními EHRA (European Heart Rhythm Association) z roku 2018 (29). U výkonů s minimálním rizikem krvácení (např. extrakce 1–3 zubů) je doporučeno terapii NOAK nepřerušovat resp. vynechat 1 dávku (v případě preparátů podávaných 2× denně). U výkonů s vysokým rizikem krvácení stačí většinou vynechat NOAK pouze 2 dny před výkonem (kromě pacientů s renální insuficiencí léčených dabigatranem).
Internista je důležitým prvkem a spolupracovníkem neurologa v péči o pacienty po iCMP a znalost problematiky CMP může zlepšit péči o pacienty po iCMP.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Miroslav Škorňa,
Neurologická klinika LF MU a FN Brno,
Jihlavská 20,
625 00 Brno
Cit. zkr: Vnitř Lék 2021; 67(1): 7–14
Článek přijat redakcí: 23. 11. 2020
Článek přijat po recenzích: 1. 2. 2021
Sources
1. Sacco RL, Kasner SE, Broderick JP, Caplan LR, Connors JJ, Culebras A et al. An updated definition of stroke for the 21st century: a statement for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2013; 44(7): 2064–2089.
2. Škoda O, Herzig R, Mikulík R, Neumann J, Václavík D, Bar M et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016. Cesk Slov Neurol N. 2016; 79/112(3): 351–363.
3. Škorňa M, Neumann J, Peška S, Mikulík R. Management tranzitorní ischemické ataky a minor stroke. Cesk Slov Neurol N. 2016; 79/112(2): 178–187.
4. Coupland AP, Thapar A, Qureshi MI, Jenkins H, Davies AH. The definition of stroke. JR Soc Med. 2017; 110(1): 9–12.
5. Easton JD, Saver JL, Albers GW, Alberts MJ, Chaturvedi S, Feldmann E et al. Defini ‑ tion and evaluation of transient ischemic attack: a scientific statement for healthca ‑ re professionals from the American Heart Association/American Stroke Association Stroke Council; Council on Cardiovascular Surgery and Anesthesia; Council on Cardiovascular Radiology and Intervention; Council on Cardiovascular Nursing; and the Interdisciplinary Council on Peripheral Vascular Disease. The American Academy of Neurology affirms the value of this statement as an educational tool for neurologists. Stroke. 2009; 40(6): 2276–2293.
6. Sedova P, Brown RD, Zvolsky M, Kadlecova P, Bryndziar T, Kubelka T et al. Incidence of Hospitalized Stroke in the Czech Republic: The National Registry of Hospitalized Patients. J Stroke Cerebrovasc, DiS. 2017; 26(5): 979–986.
7. Bruthans J. Epidemiologie a prognóza cévních mozkových příhod. 2009; 19(2).
8. Coutts SB, Modi J, Patel SK, Aram H, Demchuk AM, Goyal M et al. What causes disability after transient ischemic attack and minor stroke?: Results from the CT and MRI in the Triage of TIA and minor Cerebrovascular Events to Identify High Risk Patients (CATCH) Study. Stroke. 2012; 43(11): 3018–3022.
9. Ay H, Furie KL, Singhal A, Smith WS, Sorensen AG, Koroshetz WJ. An evidence‑based causative classification system for acute ischemic stroke. Ann Neurol. 2005; 58(5): 688–697.
10. Tomek A. Základní algoritmus vyšetření etiologie ischemické cévní mozkové příhody. Neurol praxi. 2019; 20(1): 12–16.
11. Sposato LA, Cipriano LE, Saposnik G, Ruíz Vargas E, Riccio PM, Hachinski V. Diagnosis of atrial fibrillation after stroke and transient ischaemic attack: a systematic review and meta‑analysis. Lancet Neurol. 2015; 14(4): 377–387.
12. Kimura K, Minematsu K, Yamaguchi T, (J‑MUSIC) JMSIC. Atrial fibrillation as a predictive factor for severe stroke and early death in 15,831 patients with acute ischaemic stroke. J Neurol Neurosurg Psychiatry. 2005; 76(5): 679–683.
13. Nouh A, Hussain M, Mehta T, Yaghi S. Embolic Strokes of Unknown Source and Cryp ‑ togenic Stroke: Implications in Clinical Practice. Front Neurol. 2016; 7 : 37.
14. Šaňák D, Hutyra M, Král M, Špaček M, Bártková A. Soumrak kryptogenní ischemické CMP – kardioembolizace je nejčastější příčina. Cesk Slov Neurol N. 2018; 81/114(3): 290–297.
15. Hart RG, Diener HC, Coutts SB, Easton JD, Granger CB, O‘Donnell MJ et al. Embolic strokes of undetermined source: the case for a new clinical construct. Lancet Neurol. 2014; 13(4): 429–438.
16. Hart RG, Catanese L, Perera KS, Ntaios G, Connolly SJ. Embolic Stroke of Undetermined Source: A Systematic Review and Clinical Update. Stroke. 2017; 48(4): 867-72.
17. Tomek A, Olšerová A. Embolický iktus z neurčeného zdroje. Neurol praxi. 2019; 20(1): 28–32.
18. Hindricks G, Potpara T, Dagres N, Arbelo E, Bax JJ, Blomström‑Lundqvist C et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio‑Thoracic Surgery (EACTS). Eur Heart J. 2020.
19. Gladstone DJ, Spring M, Dorian P, Panzov V, Thorpe KE, Hall J et al. Atrial fibrillation in patients with cryptogenic stroke. N Engl J Med. 2014; 370(26): 2467–2477.
20. Wachter R, Gröschel K, Gelbrich G, Hamann GF, Kermer P, Liman J et al. Holter‑electrocardiogram‑monitoring in patients with acute ischaemic stroke (Find‑AF. Lancet Neurol. 2017; 16(4): 282–290.
21. Brachmann J, Morillo CA, Sanna T, Di Lazzaro V, Diener HC, Bernstein RA, et al. Uncovering Atrial Fibrillation Beyond Short‑Term Monitoring in Cryptogenic Stroke Patients: Three‑Year Results From the Cryptogenic Stroke and Underlying Atrial Fibrillation Trial. Circ Arrhythm Electrophysiol. 2016; 9(1): e003333.
22. Šaňák D, Tomek A, Bar M, Herzig R, Mikulík R, Neumann J et al. Stanovisko Výboru Cerebrovaskulární sekce České neurologické společnosti ČLS JEP k dlouhodobému holte ‑ rovskému EKG monitoringu u pacientů s ischemickou cévní mozkovou příhodou. Cesk Slov Neurol N. 2018; 81/114(5): 607.
23. Ricci B, Chang AD, Hemendinger M, Dakay K, Cutting S, Burton T, et al. A Simple Score That Predicts Paroxysmal Atrial Fibrillation on Outpatient Cardiac Monitoring after Embolic Stroke of Unknown Source. J Stroke Cerebrovasc, DiS. 2018; 27(6): 1692–1696.
24. Li YG, Bisson A, Bodin A, Herbert J, Grammatico‑Guillon L, Joung B, et al. C 2 HEST Score and Prediction of Incident Atrial Fibrillation in Poststroke Patients: A French Nationwide Study. J Am Heart Assoc. 2019; 8(13): e012546.
25. Germain DP. Fabry disease. Orphanet J Rare, DiS. 2010; 5 : 30.
26. Namdar M. Electrocardiographic Changes and Arrhythmia in Fabry Disease. Front Cardiovasc Med. 2016; 3 : 7.
27. Kernan WN, Ovbiagele B, Black HR, Bravata DM, Chimowitz MI, Ezekowitz MD et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke. 2014; 45(7): 2160–2236.
28. Magerová H. Indikace antitrombotické terapie v sekundární prevenci ischemické CMP. Neurol praxi. 2019; 20(1): 17–20.
29. Steffel J, Verhamme P, Potpara TS, Albaladejo P, Antz M, Desteghe L et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non‑vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur Heart J. 2018; 39(16): 1330–1393.
30. Saposnik G, Barinagarrementeria F, Brown RD, Bushnell CD, Cucchiara B, Cushman M, et al. Diagnosis and management of cerebral venous thrombosis: a statement for he ‑ althcare professionals from the American Heart Association/American Stroke Association. Stroke. 2011; 42(4): 1158–1192.
31. Ntaios G, Papavasileiou V, Diener HC, Makaritsis K, Michel P. Nonvitamin‑K-antagonist oral anticoagulants versus warfarin in patients with atrial fibrillation and previous stroke or transient ischemic attack: An updated systematic review and meta‑analysis of randomized controlled trials. Int J Stroke. 2017; 12(6): 589–596.
32. Diener HC, Aisenberg J, Ansell J, Atar D, Breithardt G, Eikelboom J et al. Choosing a particular oral anticoagulant and dose for stroke prevention in individual patients with non‑valvular atrial fibrillation: part 1. Eur Heart J. 2017; 38(12): 852–859.
33. Diener HC, Aisenberg J, Ansell J, Atar D, Breithardt G, Eikelboom J, et al. Choosing a particular oral anticoagulant and dose for stroke prevention in individual patients with non‑valvular atrial fibrillation: part 2. Eur Heart J. 2017; 38(12): 860–868.
34. Osmancik P, Herman D, Neuzil P, Hala P, Taborsky M, Kala P, et al. Left Atrial Appendage Closure Versus Direct Oral Anticoagulants in High‑Risk Patients With Atrial Fibrillation. J Am Coll Cardiol. 2020; 75(25): 3122–3135.
35. Mas JL, Derumeaux G, Guillon B, Massardier E, Hosseini H, Mechtouff L, et al. Patent Foramen Ovale Closure or Anticoagulation vs. Antiplatelets after Stroke. N Engl J Med. 2017; 377(11): 1011–1021.
36. Derdeyn CP, Chimowitz MI, Lynn MJ, Fiorella D, Turan TN, Janis LS et al. Aggressive medical treatment with or without stenting in high‑risk patients with intracranial artery stenosis (SAMMPRIS): the final results of a randomised trial. Lancet. 2013.
37. Wang Y, Johnston SC. Clopidogrel with aspirin in minor stroke or transient ischemic attack. N Engl J Med. 2013; 369(14): 1376–1377.
38. Johnston SC, Easton JD, Farrant M, Barsan W, Conwit RA, Elm JJ et al. Clopidogrel and Aspirin in Acute Ischemic Stroke and High‑Risk TIA. N Engl J Med. 2018; 379(3): 215–225.
39. Johnston SC, Amarenco P, Denison H, Evans SR, Himmelmann A, James S et al. Ticagrelor and Aspirin or Aspirin Alone in Acute Ischemic Stroke or TIA. N Engl J Med. 2020; 383(3): 207–217.
40. Eikelboom JW, Connolly SJ, Bosch J, Dagenais GR, Hart RG, Shestakovska O et al. Rivaroxaban with or without Aspirin in Stable Cardiovascular Disease. New England Journal of Medicine. 2017; 377(14): 1319–1330.
41. Sharma M, Hart RG, Connolly SJ, Bosch J, Shestakovska O, Ng KKH et al. Stroke Outcomes in the COMPASS Trial. Circulation. 2019; 139(9): 1134–1145.
42. Mohr JP, Thompson JL, Lazar RM, Levin B, Sacco RL, Furie KL et al. A comparison of warfarin and aspirin for the prevention of recurrent ischemic stroke. N Engl J Med. 2001; 345(20): 1444–1451.
43. Longstreth WT, Jr., Kronmal RA, Thompson JL, Christenson RH, Levine SR, Gross R et al. Amino terminal pro‑B-type natriuretic peptide, secondary stroke prevention, and choice of antithrombotic therapy. Stroke. 2013; 44(3): 714–719.
44. Hart RG, Sharma M, Mundl H, Kasner SE, Bangdiwala SI, Berkowitz SD et al. Rivaroxaban for Stroke Prevention after Embolic Stroke of Undetermined Source. N Engl J Med. 2018; 378(23): 2191–201.
45. Diener HC, Sacco RL, Easton JD, Granger CB, Bernstein RA, Uchiyama S et al. Dabigatran for Prevention of Stroke after Embolic Stroke of Undetermined Source. N Engl J Med. 2019; 380(20): 1906–1917.
46. Healey JS, Gladstone DJ, Swaminathan B, Eckstein J, Mundl H, Epstein AE et al. Recu ‑ rrent Stroke With Rivaroxaban Compared With Aspirin According to Predictors of Atrial Fibrillation: Secondary Analysis of the NAVIGATE ESUS Randomized Clinical Trial. JAMA Neurol. 2019; 76(7): 764–773.
47. Kamel H, Longstreth WT, Jr., Tirschwell DL, Kronmal RA, Broderick JP, Palesch YY et al. The AtRial Cardiopathy and Antithrombotic Drugs In prevention After cryptogenic stroke randomized trial: Rationale and methods. Int J Stroke. 2019; 14(2): 207–214.
48. Geisler T, Poli S, Meisner C, Schreieck J, Zuern CS, Nägele T et al. Apixaban for treatment of embolic stroke of undetermined source (ATTICUS randomized trial): Rationale and study design. Int J Stroke. 2017; 12(9): 985–990.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue 1-
All articles in this issue
- Co může internista udělat pro svého pacienta po ischemické cévní mozkové příhodě
- Dlouhodobá EKG monitorace
- Patentní foramen ovale z pohledu intervenční kardiologie
- Následná péče po prodělaném covidu-19 a její úskalí
- Včasná a souběžná terapie dyslipidemie a hypertenze: kdy ji začít a jak udržet dlouhodobě dobrou adherenci pacientů?
- EMPEROR reduced – empagliflozin u nemocných se srdečním selháním se sníženou ejekční frakcí
- Kdy ukončit léčbu hepatitidy B?
- Fatálna koincidencia inaparentnej SARS‑CoV-2 infekcie a liekovej toxicity v teréne imunosupresie u 33-ročnej ženy
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
- Diagnostické hospitalizácie pred zaradením pacienta na čakaciu listinu pre transplantáciu obličky
- Komplexní interdisciplinární pohled na návrat ke sportu po prodělání infekce covid-19
- Úskalí řešení problémů polymedikace
- Taxánmi‑indukovaná polyneuropatia – aktuálne možnosti predikcie a manažmentu
- Horečka nejasného původu
- Nutriční podpora v časné fázi kritického stavu – zaostřeno na množství energie a bílkovin
- Kompetence pacienta a informovaný souhlas
- Internista a pacient po ischemické CMP
- Komentáře k analýze složení směsi flavonoidů v tabletách Diozen 500 mg metodou UHPLC
- Prof. MUDr. Jiří Vítovec, CSc., FESC, má jubileum
- Jubileum prof. MUDr. Vlastimila Ščudly, CSc.
- Je autoimunitní pankreatitida rizikovým faktorem adenokarcinomu pankreatu?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Horečka nejasného původu
- Dlouhodobá EKG monitorace
- Následná péče po prodělaném covidu-19 a její úskalí
- Překryvný syndrom SLE – ANCA asociovaná vaskulitida
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career