-
Medical journals
- Career
Hodnocení operačního rizika u pacientů s jaterní cirhózou
Authors: Eva Uchytilová; Eva Kieslichová
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní péče, Transplantcentrum IKEM Praha
Published in: Vnitř Lék 2020; 66(4): 253-257
Category:
Overview
Prevalence jaterní cirhózy v populaci narůstá. Narůstá tudíž i počet pacientů s cirhózou, kteří přicházejí do nemocnice k elektivnímu operačnímu zákroku. Tito pacienti mají vyšší riziko pooperačních komplikací i vyšší pooperační mortalitu. Stanovení perioperačního rizika pacientů s cirhózou je složitý a komplexní proces. Zahrnuje zhodnocení celkového stavu pacienta, včetně závažnosti přidružených onemocnění a stavu nutrice, stupně závažnosti samotného jaterního onemocnění, a časové naléhavosti operačního zákroku. Jednoznačná doporučení neexistují. Správné stanovení rizika chirurgického zákroku předoperačně se zvážením alternativních způsobů léčby je klíčové pro optimalizaci pooperačního průběhu u pacientů s jaterní cirhózou a snížení pravděpodobnosti vzniku pooperačních komplikací.
Klíčová slova:
Child‑Pugh skóre – jaterní cirhóza – MELD skóre – perioperační riziko
Úvod
Incidence chronického onemocnění jater (chronic liver disease – CLD) celosvětově narůstá a současně s ní roste i počet paci ‑ entů s CLD indikovaných k akutním nebo elektivním operačním výkonům. Prevalence cirhózy se celosvětově udává kolem 100 pacientů na 100 000 obyvatel. Mortalita pacientů s chronickým onemocněním jater se pohybuje kolem 2 milionů ročně, z toho 1 milion tvoří pacienti s jaterní cirhózou. Cirhóza tvoří v současné době 11. nejčastější příčinu smrti na světě (1, 2). V České republice trpí cirhózou jater 40 000–60 000 obyvatel a asi 2 000 z nich každý rok na toto onemocnění umírá (3, 4). Prevalence cirhózy mezi pacienty podstupujícími elektivní výkon je 0,8 %, tedy až 25 milionů cirhotiků podstoupí plánovaný chirurgický výkon každý rok (5). Tito pacienti mají o 47 % vyšší riziko pooperačních komplikací a 2,5× vyšší nemocniční mortalitu (6).
Hlavní příčinou těchto komplikací je chronická jaterní léze, jejímž důsledkem je alterace jaterních funkcí (syntetické, metabolické, detoxikační i sekreční), a porucha perfuze jater při cirhotické přestavbě parenchymu a snížené systémové vaskulární rezistenci. Hypoperfuze je dále potencována účinkem anestetik, peroperačními změnami distribuce tělních tekutin a srdečního výdeje zhoršující dodávku kyslíku do tkání, a koagulopatií, která zvyšuje riziko nejen krvácení, ale i trombóz (7).
Předoperační vyšetření
U pacientů kategorií ASA (American Society of Anesthesiologists) I a II (Tab. 1), kteří nepřichází k resekčnímu výkonu na játrech, není předoperační vyšetření jaterních funkcí rutinně požadováno. Je ale nezbytně nutné v případech, kdy vznikne z anamnézy nebo fyzikálního vyšetření jakékoliv podezření na jaterní lézi. Jestliže jsou jaterní enzymy (AST, ALT, ALP) elevovány nad trojnásobek horní hranice normy nebo je jakkoliv zvýšená hladina sérového bilirubinu, je doporučeno plánovaný zákrok odložit a pacienta dovyšetřit (8). V případě, že se jaterní onemocnění potvrdí, je potřeba objasnit jeho etiologii, zhodnotit stupeň pokročilosti, stupeň závažnosti jaterní dysfunkce a souvisejících komplikací (Tab. 2). Na druhé straně je nutné zvážit samotný operační zákrok, jeho indikaci, případné alternativní způsoby léčby, a především jeho časovou naléhavost (8).
Table 1. Klasifikace celkového fyzického stavu před anestezií dle ASA (American Society of Anesthesiologists) 
Míra pravděpodobnosti, že pacient v souvislosti s výkonem a anestezií zemře. Každé skupině ASA odpovídá predikovaná perioperační mortalita. Emergentní výkon představuje zvýšené perioperační riziko (věstník MZ ČR 1/2018) Mortalita dle klasifikace ASA: ASA I–0,06 %, II–0,47 %, III–4,39 %, IV–23,48 %, V–50,77 %. Table 2. Komplikace jaterní cirhózy 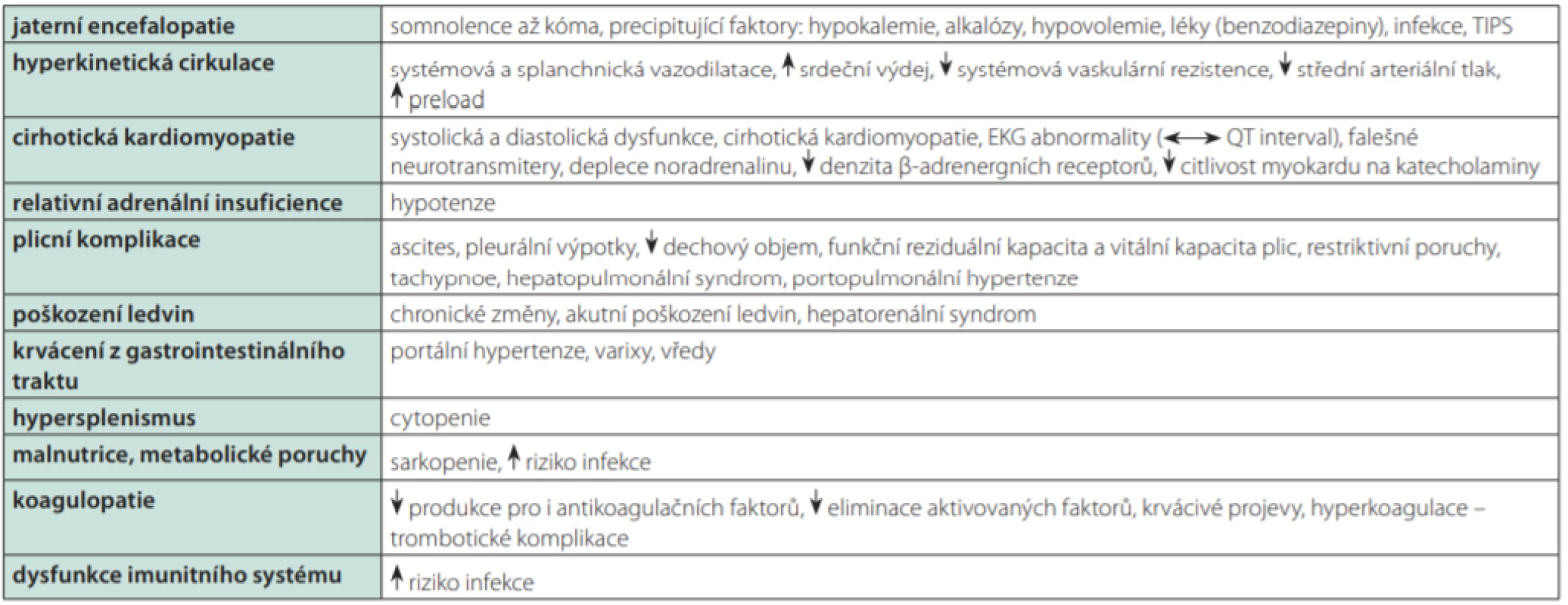
Zvýšená pooperační mortalita pacientů s cirhózou byla prokázána v mnoha studiích, např. v práci Lin et al. byla kromě vyšší 30denní mortality zjištěna i delší doba hospitalizace, častější příjem na jednotku intenzivní péče, nebo vyšší incidence infekčních a krvácivých pooperačních komplikací (9). Jiná práce zvýšenou mortalitu potvrdila, nikoliv však vyšší incidenci pooperačních komplikací. Zajímavým sekundárním zjištěním obou studií byla častější přítomnost závažných přidružených onemocnění u pacientů s cirhózou (10).
Operační riziko
Operační zákrok může být sám o sobě příčinou dekompenzace jaterního onemocnění, a to především u pacientů s nízkou hladinou sérového albuminu a komorbiditami (11). Mezi absolutní kontraindikace plánovaného výkonu patří akutní nebo fulminantní jaterní selhání, akutní virová nebo alkoholická hepatitida (8).
Otázka predikce perioperačního rizika pacienta s jaterní cirhózou je velmi komplexní a nejednoznačná. Lze využít existujících skórovacích systémů. Childovo‑Turcottovo‑Pughovo skóre (CTP) určuje stupeň pokročilosti cirhózy (Tab. 3a a 3b), původně bylo určeno k hodnocení rizika pacientů s cirhózou podstupujících portosystémový zkrat. Jeho korelace s pooperační mortalitou po elektivních i akutních operačních výkonech byla jednoznačně potvrzena, časová naléhavost operace byla identifikována jako jeden z hlavních faktorů mortality (8, 12, 13). V práci Telemové et al. bylo jako rizikový faktor pooperační mortality označeno podání krevní transfuze, nízká hladina albuminu, ASA skóre vyšší než III a časová naléhavost výkonu, přičemž nebyl zjištěn rozdíl v mortalitě mezi pacienty třídy CTP B a C (14). Avšak CTP má zásadní limity. Dvě veličiny z pěti, které jsou jeho součástí, podléhají do velké míry subjektivnímu hodnocení a zbývající tři, které jsou sice měřitelné objektivně laboratorními metodami, mají arbitrárně stanoveny horní hranice, tudíž CTP nemá kontinuální charakter.
Table 3. a. Semikvantitativní skóre podle Childa a Pugha 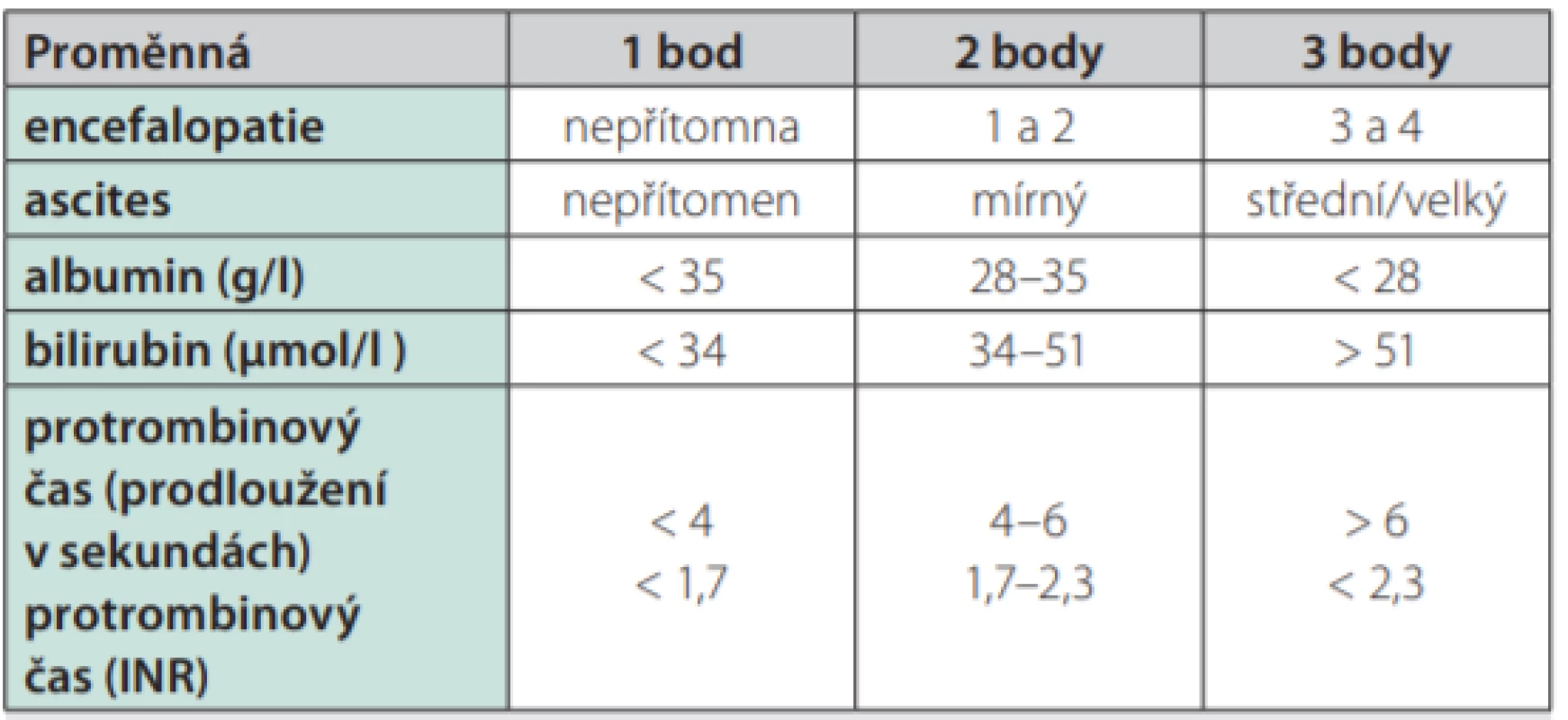
(pro primární biliární cholangitidu a primární sklerozující cholangitidu jsou upraveny hranice pro sérovou koncentraci bilirubinu) Třída A: 5–6 bodů, třída B: 7–9 bodů, třída C: 10–15 bodů Tab. 3b. Childovo-Pughovo skóre a predikce mortality 
MELD (model for end‑stage liver disease) skóre může mít ve srovnání s CTP jisté výhody (Tab. 4). Respektuje sérovou hladinu kreatininu a má kontinuální charakter. Předoperační MELD skóre dobře koreluje s pooperační morbiditou i mortalitou cirhotiků, jeho prediktivní hodnota je významně zesílena kombinací s předoperační sérovou hladinou albuminu (14).
Table 4. MELD skóre (Model for end-stage liver disease) 
log – přirozený logaritmus, MELDi - iniciální MELD skóre, Na - natremie Práce, které srovnávaly CTP a MELD jako prediktory pooperační mortality cirhotiků, jednoznačnou odpověď nepřinesly (8). Studie Farnsworthe et al. rozdíl mezi oběma skórovacími systémy neshledala, jen potvrdila, že akutní operační výkony souvisí s vyšší mortalitou (15). Jedna z největších a jistě pro praxi nejpřínosnějších studií, která se touto problematikou zabývala, prokázala silnou prediktivní hodnotu MELD a téměř lineární korelaci s 30denní i 90denní pooperační mortalitou. Navíc MELD skóre prokázalo prediktivní hodnotu mortality i v delším časovém horizontu od operace, a to v horizontu 1 roku i déle (16). U pacientů s ascitem nebo jaterní encefalopatií má ale MELD skóre omezenou výpovědní hodnotu, neboť tyto faktory nezohledňuje, navíc nezahrnuje počet trombocytů ani sérový albumin.
Existuje několik skórovacích systémů odvozených od MELD. Bylo spolehlivě prokázáno, že např. hyponatremie zásadně ovlivňuje přežití pacientů s jaterní cirhózou. Integrací parametrů MELD skóre s natremií pak vzniklo MELD‑Na (MELD sodium) a MESO index (MELD sodium index) skóre (17, 18). MELD skóre integrované s natremií a věkem pacienta (integrované MELD – iMELD) se ukázalo jako vhodný prediktor pooperační mortality cirhotiků po plánovaných operačních výkonech (19) (Tab. 4). Studie, která se zabývala srovnáním skórovacích systémů odvozených od CTP a MELD jako prediktorů mortality, došla k závěru, že CTP je nejlepším prediktorem celkové mortality, zatímco iMELD mortality pooperační (20). Jiná práce označila CTP jako vhodný prediktor 30denní pooperační morbidity, MELD skóre 90denní pooperační mortality a MELD‑Na roční pooperační mortality (21).
V roce 2017 vznikl nový model predikce pooperační mortality cirhotiků na základě výsledků velké studie japonských autorů na více než 2000 pacientů. Autoři identifikovali věk pacienta, třídu Child‑Pugh, přítomnost komorbidit a dobu trvání anestezie jako významné rizikové faktory pooperační mortality. Z těchto veličin byl vytvořen skórovací systém ADOPT‑LC (adequate operative treatment for liver cirrhosis), který spolehlivě koreluje s pooperační mortalitou pacientů s cirhózou a existuje už i jako aplikace pro operační systémy Android i Apple (22). Také autoři z Mayo clinic vytvořili moderní prediktor pooperační mortality pacientů s cirhózou, a to na základě práce Teh et al na 772 pacientech. Zahrnuje rovněž všechny významné faktory pooperační mortality, které autoři identifikovali (věk, kategorii ASA, sérový bilirubin, INR a etiologii jaterního onemocnění) a nazývá se modified MELD score for surgery (Tab. 5). Kalkulátor je volně dostupný k použití na webové stránce https://www.mayoclinic.org./medical‑professionals/ transplant‑medicine/calculators/post‑operative‑mortality‑risk‑in‑patients ‑ ‑with‑cirrhosis/itt-20434721. Modifikované MELD skóre slouží nejen jako prediktor 7denní, 30denní nebo 90denní, ale i roční a 5leté pooperační mortality pacientů s cirhózou (8, 16, 23).
Table 5. Modifikované MELD skóre k predikci perioperačního rizka (modified MELD score for surgery) 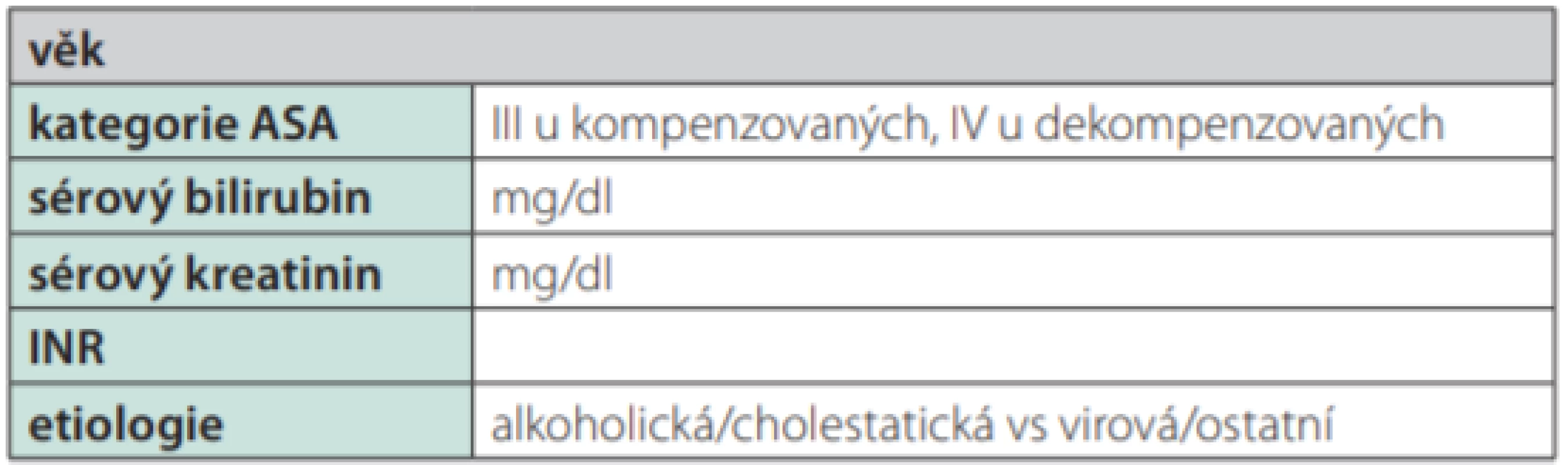
mortalita: 7denní, 30denní, 90denní, roční, pětiletá (%) Za účelem zjednodušení a alespoň částečné standardizace složitého postupu předoperačního hodnocení cirhotiků vytvořili autoři v Mount Sinai Medical Center protokol hodnocení operačního rizika pacientů s cirhózou (preoperative liver assessment checklist – POLA) (8), s cílem toto riziko minimalizovat a snížit významnou pooperační morbiditu a mortalitu těchto pacientů (schéma 1) Prvním bodem je zvážení časové naléhavosti výkonu. Jedná‑li se o zákrok urgentní, může být proveden bez dalších odkladů po získání informovaného souhlasu pacienta. Druhým bodem je charakteristika jaterního onemocnění, jeho etiologie a stupně pokročilosti. Akutní nebo fulminantní jaterní selhání, stejně tak jako akutní virová nebo alkoholická hepatitida představují absolutní kontraindikace elektivní operace. Třetím krokem je zhodnocení závažnosti přidružených onemocnění pacienta, především onemocnění kardiovaskulárních, renálních a diabetes mellitus. Mezi významné komorbidity související s horším pooperačním průběhem patří i malnutrice, optimalizace nutričního stavu je jednou z podmínek elektivního operačního výkonu. Čtvrtým bodem je vyšetření jater zobrazovacími metodami. Pátým bodem je pečlivé hodnocení anamnézy epizod dekompenzace jaterního onemocnění, které bývají předzvěstí dekompenzace v pooperačním období. Např. v případě recidivujících atak encefalopatie je nutné upravit dávkování anestetik a analgetik, v případě opakovaného krvácení do trávicího traktu je nezbytná kontrola výsledků posledního endoskopického vyšetření. Při recidivujícím ascitu je třeba včas nasadit diuretickou terapii. Za šesté je doporučeno pátrat po přítomnosti známek dekompenzace právě v předoperačním období. Je‑li přítomný ascites, je nutná diagnostická punkce k vyloučení spontánní bakteriální peritonitidy, v případě vyjádřeného mechanického syndromu punkce s evakuací. Jsou‑li známky aktivního krvácení do gastrointestinálního traktu, má přednost před operačním výkonem endoskopické ošetření, v případě encefalopatie je doporučeno zahájit léčbu laktulózou a rifaximinem. Sedmým bodem je laboratorní vyšetření jaterních funkcí a osmým zjištění stupně závažnosti jaterní dysfunkce pomocí skórovacích systémů. Devátým krokem je korekce koagulopatie a hemosubstituce. Substituce vitaminu K je samozřejmostí, substituce trombocytů není nutná při počtu nad 50 × 109 /l, nemá‑li pacient krvácivé projevy. Transfuzní práh pro substituci hemoglobinu je 70g/l, platí restriktivní přístup z důvodu možného nárůstu tlaku ve v. portae. Posledním, desátým krokem je pečlivá revize farmakoterapie. Neměly by být podávány léky s významnou nefrotoxicitou nebo hepatotoxicitou. U léků používaných v rámci anestezie (anestetika, analgetika, anxiolytika, neuroleptika) je nutné příslušným způsobem upravit dávkování, indikace podání benzodiazepinů jsou velmi omezené. Také podání farmak prodlužujících QTc interval je nutné pečlivě zvážit.
Schéma 1. Stanovení perioperačního rizika cirhotiků POLA – upraveno podle (8) 
Závěr
Jednoznačný doporučený postup hodnocení perioperačního rizika pacientů s jaterní cirhózou neexistuje. Klíčovou roli hraje indikace a časová naléhavost výkonu. Jedná‑li se o zákrok akutní nebo život zachraňující, je kromě zvážení alternativního způsobu léčby, včetně léčby paliativní, potřeba jen zajistit informovaný souhlas pacienta nebo jeho zákonného zástupce. Naopak, v případně výkonu elektivního, je nutné zhodnotit celkový stav pacienta, jeho věk, závažnost komorbidit a stav nutrice, a stanovit stupeň pokročilosti jaterního onemocnění. Jestliže dosahuje třídy CTP A a hodnoty MELD nižší než 12, elektivní výkon není důvod kontraindikovat. V případě CTP B a MELD skóre mezi 12–15 je potřeba postupovat přísně individuálně, pátrat po případné dekompenzaci jaterního onemocnění nebo některé z komorbidit a klinický stav pacienta před operací maximálně zkompenzovat. V případě malnutrice je nutná adekvátní nutriční příprava. Operační zákrok takového pacienta je doporučeno provést ve specializovaném centru, za rozšířené monitorace, se zajištěným lůžkem intenzívní péče. Překročí‑li MELD skóre hodnotu 15, má před plánovanou operací přednost zvážení zařazení pacienta na čekací listinu a provedení transplantace jater, nejsou‑li kontraindikace (7) (Schéma 2).
Schéma 2. Algoritmus stanovení operačního rizika pacientů s jaterním onemocněním – upraveno podle (8) 
Seznam zkratek
- ADOPT‑LC – adequate operative treatment for liver cirrhosis
- ALP – alkalická fosfatáza
- ALT – alaninaminotransferáza
- ASA – American Society of Anesthesiologists
- AST – aspartátaminotransferáza
- CLD – chronic liver disease
- CTP – Child‑Turcotte‑Pugh
- iMELD – intergrované MELD, MELD včetně s věku a natremie
- MELD – model for end‑stage liver disease
- MELD‑Na – MELD sodium – model for end‑stage liver disease včetně natremie
- MESO index – MELD sodium index – podíl MELD a natremie × 10
- POLA – preoperative liver assessment check list
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Eva Uchytilová, Ph.D.,
Klinika anesteziologie, resuscitace a intenzivní péče,
Transplantcentrum IKEM,
Vídeňská 1958/9,
140 21 Praha 4 – Krč
Cit. zkr: Vnitř Lék 2020; 66(4): 253–257
Článek přijat redakcí: 9. 12. 2019
Článek přijat k publikaci: 3. 2. 2020
Sources
1. Asrani SK, Devarbhavi H, Eaton J, et al. Burden of liver diseases in the world. J Hepatol 2019; 70 : 151–171.
2. Pimpin L, Cortez‑Pinto H, Negro F, et al. Burden of liver disease in Europe: Epidemiology and analysis of risk factors to identify prevention policies. J Hepatol 2018; 69 : 718–735.
3. Ehrman J, Aiglová K, Konečný M, et al. Aktuální možnosti léčby jaterní cirhózy v ambulanci internisty. Vnitř Lék 2016; 62 : 553–563.
4. Lata J, Vaňásek T, Stibůrek O. Jaterní cirhóza a její léčba. Vnitř Lék 2009; 55 : 774–778.
5. Blachier M, Leleu H, Peck‑Radosavljevic M, et al. The burden of liver disease in Europe: a review of available epidemiological data. J Hepatol 2013; 58 : 593–608.
6. International Surgical Outcomes Study group. Global patient outcomes after elective surgery: prospective cohort study in 27 low-, middle - and high‑income countries. Br J Anaesth 2016; 117 : 601–609.
7. Diaz KE, Schiano TD. Evaluation and Management of Cirrhotic Patients Undergoing Elective Surgery. Current Gastroenterology Reports 2019; 21 : 32.
8. Im GY, Lubezky N, Facciuto ME et al. Surgery in patients with portal hypertension: a preoperative checklist and strategies for attenuating risk. Clin Liver Dis 2014; 18 : 477–505.
9. Lin CS, Lin SY, Chang CC, et al. Postoperative adverse outcomes after non‑hepatic surgery in patients with liver cirrhosis. Br J Surg 2013; 100 : 1784–1790.
10. Deleuran T, Vilstrup H, Overgaard S, et al. Cirrhosis patients have increased risk of complications after hip or knee arthroplasty. Acta Orthop 2015; 86 : 108–113.
11. Nyberg EM, Batech M, Cheetham TC, et al. Postoperative Risk of Hepatic Decompensation after Orthopedic Surgery in Patients with Cirrhosis. J Clin Transl Hepatol 2016; 4 : 83–89.
12. Garrison RN, Cryer HM, Howard DA, et al. Clarification of risk factors for abdominal operations in patients with hepatic cirrhosis. Ann Surg 1984; 199 : 648–655.
13. Mansour A, Watson W, Shayani V, et al. Abdominal operations in patients with cirrho ‑ sis: still a major surgical challenge. Surgery 1997; 122 : 730–735.
14. Telem DA, Schiano T, Goldstone R, et al. Factors that predict outcome of abdominal operations in patients with advanced cirrhosis. Clin Gastroenterol Hepatol 2010; 8 : 451–457.
15. Farnsworth N, Fagan SP, Berger DH, et al. Child‑Turcotte‑Pugh versus MELD score as a predictor of outcome after elective and emergent surgery in cirrhotic patients. Am J Surg 2004; 188 : 580–583.
16. Teh SH, Nagorney DM, Stevens SR, et al. Risk factors for mortality after surgery in patients with cirrhosis. Gastroenterology 2007; 132 : 1261–1269.
17. Biggins SW, Kim WR, Terrault NA, et al. Evidence‑based incorporation of serum sodium concentration into MELD. Gastroenterology 2006; 130 : 1652–1660.
18. Ginès P, Guevara M Hyponatremia in cirrhosis: pathogenesis, clinical significance, and management. Hepatology 2008; 48 : 1002–1010.
19. Costa BP, Sousa FC, Serôdio M, et al. Value of MELD and MELD‑based indices in surgical risk evaluation of cirrhotic patients: retrospective analysis of 190 cases. World J Surg 2009; 33 : 1711–1719.
20. Kim DH, Kim SH, Kim KS, et al. Predictors of mortality in cirrhotic patients undergoing extrahepatic surgery: comparison of Child‑Turcotte‑Pugh and model for end‑stage liver disease‑based indices. ANZ J Surg 2014; 84 : 832–836.
21. Causey MW, Steele SR, Farris Z, et al. An assessment of different scoring systems in cirrhotic patients undergoing nontransplant surgery. Am J Surg 2012; 203 : 589–593.
22. Sato M, Tateishi R, Yasunaga H, et al. The ADOPT‑LC score: a novel predictive index of in‑hospital mortality of cirrhotic patients following surgical procedures, based on a national survey. Hepatol Res 2017; 47: E35–E43.
23. Henderson JM. What are the risks of general surgical abdominal operations in patients with cirrhosis? Clin Gastroenterol Hepatol 2010; 8 : 399–400.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 4-
All articles in this issue
- Súčasné možnosti liečby BCR‑ABL1 pozitívnej chronickej myelocytovej leukémie u dospelých pacientov
- Antikoagulační léčba tromboembolie u malignit – nové studie, nová doporučení
- Gastrointestinální a jaterní projevy nemocí přenášených klíšťaty
- Sekundárna prevencia po akútnom koronárnom syndróme
- Krvácení do GIT při portální hypertenzi
- Pacient po transplantaci ledviny v ambulanci internisty
- Plicní onemocnění a autoimunitní hemolytická anémie asociovaná s IgG4
- Problematika nezahájení dialýzy u geriatrických pacientů s pokročilým chronickým onemocněním ledvin
- Jaterní fibróza
- Jsou změny krevního obrazu použitelným ukazatelem velikosti dávky azathioprinu?
- Heparinem indukovaná trombocytopenie: kazuistika a přehled literatury
- Mikroskopická polyangiitída
- Srdcové zlyhávanie ako prejav akromegálie
- Dlouhodobé využití telemonitorovacího systému Diani v léčbě diabetes mellitus 1. typu
- Hyperurikemie z perspektivy nefrologického pacienta
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaterní fibróza
- Hodnocení operačního rizika u pacientů s jaterní cirhózou
- Mikroskopická polyangiitída
- Hyperurikemie z perspektivy nefrologického pacienta
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

