-
Medical journals
- Career
Mikroskopická polyangiitída
Authors: Daniel Tobiáš; Kristína Brázdilová; Zdenko Killinger; Juraj Payer
Authors‘ workplace: V. interná klinika LF UK a UN Bratislava, Nemocnica Ružinov, Slovenská republika
Published in: Vnitř Lék 2020; 66(4): 249-252
Category: Case Report
Overview
Mikroskopická polyangiitída (MPA) je zriedkavá, systémová, nekrotizujúca, ANCA (Anti‑Neutrophil Cytoplasmic Antibodies) asociovaná vaskulitída s postihnutím malých ciev, bez dôkazu nekrotizujúceho granulomatózneho zápalu. Stanovenie diagnózy mikroskopickej polyangiitídy je často náročné vzhľadom na jej prezentáciu súborom nešpecifických symptómov. Na našej klinike sme toto ochorenie diagnostikovali u 35-ročného pacienta, ktorý bol k nám prijatý pre migrujúce artritídy s febrilitami a papulóznym exantémom. Touto kazuistikou chceme poukázať na dôležitosť zváženia aj takých zriedkavých ochorení akým je, MPA v rámci diferenciálno‑diagnostického procesu najmä v prípade pacientov prezentujúcich sa nešpecifickými symptómami vzhľadom na vysokú mortalitu tohto ochorenia bez adekvátnej liečby.
Klíčová slova:
ANCA – cerebritída – glomerulonefritida – pankreatitida – polyangiitída – vaskulitida
Úvod
Mikroskopická polyangiitída je systémová, nekrotizujúca, ANCA (Anti‑Neutrophil Cytoplasmic Antibodies) asociovaná vaskulitída s postihnutím malých ciev, bez dôkazu nekrotizujúceho granulomatózneho zápalu (1). Toto ochorenie bolo podľa American College of Rheumatology pôvodne klasifikované za formu polyarteritis nodosa (2), no od roku 1992 je na základe International Chapel Hill Consensus Conference osobitnou formou vaskulitídy (3, 4). Ide sa o systémové ochorenie, pre ktoré je typické postihnutie cievnej steny autoimunitne podmieneným zápalom s následnými prejavmi vyplývajúcimi z jej poškodenia. Etiológia nie je presne známa, bola však pozorovaná asociácia mikroskopickej polyangiitídy (MPA) s niektorými liečivami ako propyltiouracil alebo s niektorými ochoreniami ako primárna biliárna cirhóza. Predpokladá sa, že za závažnosť a miesto cievneho postihnutia sú zodpovedné cytokínmi indukované zmeny v expresii a funkcii adhéznych molekúl spolu so zmenou aktivácie leukocytov a endotelových buniek (5, 6). Incidencia ochorenia sa udáva na 1–3 prípady na 100000. Klinický obraz tohto ochorenia je skutočne pestrý a najčastejšie zahŕňa nešpecifické príznaky – chudnutie, zvýšená telesná teplota až horúčky, bolesti svalov a kĺbov (ktoré súčasne patria aj postihnutiu muskuloskeletálneho systému), slabosť, únava. Ďalšie príznaky sa manifestujú podľa postihnutia jednotlivých orgánových systémov. Najčastejším a najtypickejším je postihnutie obličiek a pľúc v zmysle glomerulonefritídy, renálneho zlyhávania resp. alveolárneho krvácania, dyspnoe, kašla, hemoptýzy (23). Ďalším často postihnutým orgánom je koža, kde sa ochorenie môže manifestovať ako exantém, leukocytoklastická vaskulitída, purpura, livedo reticularis, ischémia akrálnych častí končatín, ulcerácie na koži, kožné nekrózy alebo gangréna. Medzi najčastejšie neurologické prejavy patrí mononeuritis multiplex, môžu sa však vyskytovať aj omnoho zriedkavejšie prejavy (22). Ku gastrointestinálnemu postihnutiu patria bolesti brucha, krvácanie do gastrointestinálneho traktu, pankreatitída. Postihnutie kardiovaskulárneho systému sa prejavuje bolesťami na hrudníku, známkami hypertenzie alebo srdcového zlyhávania, v zriedkavých prípadoch sa môže prejavovať aj ako infarkt myokardu. K menej častému postihnutiu patrí postihnutie očí s prejavmi episkleritídy alebo uveitídy. U mužov bola veľmi zriedkavo ako prejav tohto ochorenia popisovaná orchitída (7, 8, 13). Medzi klasifikačné kritériá tohto ochorenia patrí: rýchlo progredujúca glomeluronefritída (RPGN), alveolárne krvácanie, iné orgánové postihnutie (purpura, subkutánne krvácanie, gastrointestinálne krvácanie, mononeuritis multiplex), histologický nález: nekrotizujúca vaskulitída arteriol, kapilár a venúl, perivaskulárna infiltrácia zápalovými bunkami a laboratórny nález – pozitivita MPO (myoloperoxidáza) ANCA, zvýšené hladiny C‑reaktívneho proteínu (CRP), proteinúria, hematúria, zvýšené hladiny sérovej urey a kreatinínu (9). Charakteristikou, MPA je postihnutie malých ciev – arteriol, kapilár a venúl. Takéto postihnutie pri polyarteritis nodosa chýba, čo je jeden z hlavných rozdielov medzi týmito ochoreniami., MPA spolu s granulomatózou s polyangiitídou a eozinofilnou granulomatózou s polyangiitídou patria k ANCA asociovaným vaskulitídam s postihnutím malých ciev. Mikroskopická polyangiitída sa liší od granulomatózy s polyangitídou absenciou formácie granulómov a postihnutia hornej časti respiračného traktu. Na liečbu mikroskopickej polyangitídy sa používa imunosupresívna liečba. Výber konkrétneho liečiva závisí od rozsahu a závažnosti ochorenia. Používanými liečivami sú kortikoidy, cyklofosfamid, azatioprin, metotrexát, mykofenolát mofetil, inhibítory C5a receptora, biologická liečba rituximabom (10). Prognóza tak závažného ochorenia ako je, MPA je úzko spätá so závažnosťou orgá ‑ nového postihnutia. V prípade včasnej a správnej liečby však približne 90 % pacientov dosiahne zlepšenie stavu a približne 75 % dosiahne dokonca remisiu. 5-ročné prežívanie sa pohybuje na úrovni okolo 75 %. K relapsu dochádza približne v 30 % prípadov v priebehu 1–2 rokov. Bez adekvátnej liečby je pravdepodobnosť remisie signifikantne nižšia a riziko relapsov signifikantne vyššie (12).
Kazuistika
V tejto kazuistike prezentujeme prípad 35-ročného pacienta s anamnézou autoimunitnej hepatitídy v regresii, ktorý bol vyšetrovaný na centrálnom príjme našej nemocnice pre opuch a bolestivosť veľkých kĺbov s febrilitami s maximom 38,2 °C a kožným výsevom v oblasti pred ‑ kolení. Bol prijatý na V. internú kliniku LF UK a UN Bratislava. Vzhľadom na laboratórne parametre – obraz zápalového syndrómu bez klinických prejavov infekcie, proteinúriu a objektívny nález bola už pri príjme vyjadrená suspekcia na systémové zápalové ochorenie – vaskulitídu. Realizovala sa biopsia z pravého predkolenia, kde boli popísané črty perivaskulárnej lymfohistiocytárnej dermatitídy a fokálnej leukocytoklastickej vaskulitídy. V rámci prešetrenia orgánového postihnutia sa pacientovi realizoval Dopplerovské USG vyšetrenie dolných končatín s vylúčením hlbokej žilovej trombózy, echokardiografia bez nálezu perikardiálneho výpotku, RTG hrudníka a USG brucha bez znakov eventuálnej serozitídy (Obr. 1).
Image 1. RTG hrudníka bez znakov eventuálnej serozitídy 
High Resolution‑CT a spirometria boli tiež bez pozitívneho nálezu, na vyšetrenom očnom pozadí bol nález vaskulitídy sietnice oboch očí. Vzhľadom na uvedený nález sme začali pulznú liečbu glukokortikoidmi a lokálnu liečbu triamcinolom. Hospitalizácia bola komplikovaná bolesťami hlavy s nauzeou, a preto sme doplnili MRI mozgu a cervikálnej chrbtice, kde sa popísal obraz incipientného zápalového procesu cerebellárnych hemisfér s patologickými signálovými zmenami prevažne v oblasti kortiko‑medulárnej junkcie hemisfér kaudálne a edémom s protrúziou cerebellárnych tonzíl do foramen magnum a incipientným 3-komorovým hydrocefalom s naznačeným miernym transependymálnym prienikom likvoru (Obr. 2).
Image 2. MRI mozgu a cervikálnej chrbtice. Obraz incipientného zápalového procesu cerebellárnych hemisfér s patologickými signálovými zmenami prevažne v oblasti kortiko-medulárnej junkcie hemisfér kaudálne a edémom s protrúziou cerebellárnych tonzíl do foramen magnum a incipientným 3-komorovým hydrocefalom s naznačeným miernym transependymálnym prienikom likvoru 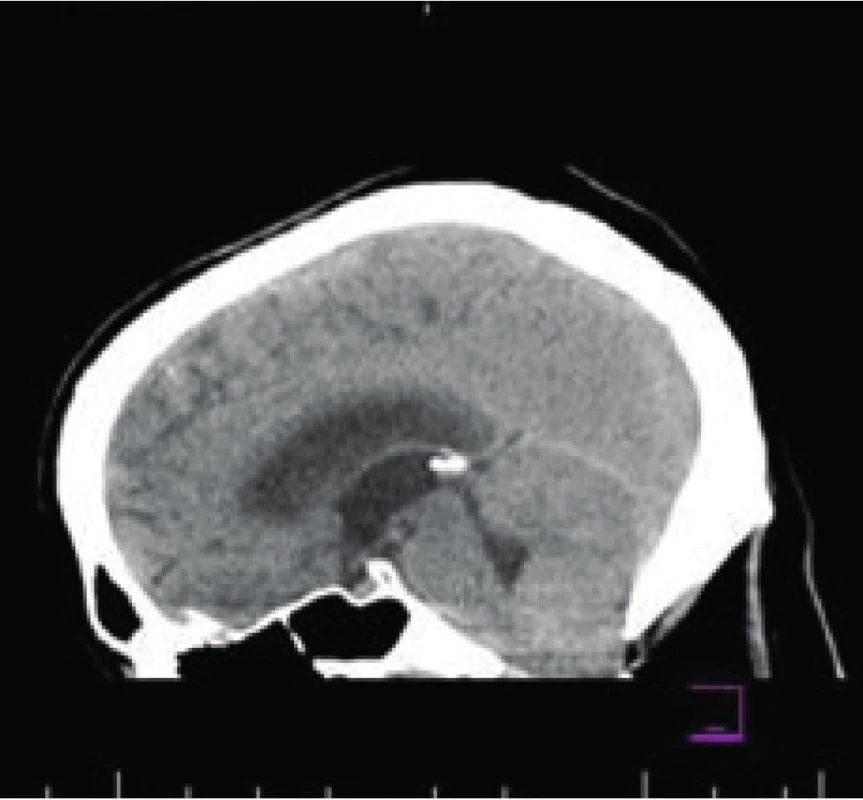
Po konzultácii s neurológom a neurochirurgom sme spočiatku postupovali konzervatívne, avšak pre ďalšie zhoršovanie stavu a nález edému mozgu na kontrolnom CT hlavy sme pacienta preložili Neurochirurgickú kliniku LF UK a UN Bratislava‑Kramáre, kde mu bola realizovaná externá drenáž. Konzultovaný infektológ v čase vzniku edému nevedel vylúčiť infekčnú príčinu a preto indikoval antivirotickú terapiu. Infekčná etiológia sa následne nepotvrdila. Stav bol záverovaný ako autoimunitná cerebritída s hydrocefalom, na základe čoho boli podané intravenózne imunoglobulíny v imunosupresívnej dávke. Kontrolné CT mozgu bolo už bez ložiskových zmien, preto neurológ odporučil ukončiť antiedémovú liečbu. Pacient bol následne preložený späť V. internú kliniku LF UK a UN Bratislava na dodiagnostikovanie suspektnej vaskulitídy. Tu sme realizovali doplňujúce laboratórne vyšetrenia – autoprotilátky, (ANCA boli opakovane negatívne), imunoglobulíny, sérologické vyšetrenie. Pokračovali sme v imunosupresii perorálnou liečbou glukokortikoidmi v dávke 20 mg prednizónu denne. Následne sa hospitalizácia komplikovala bolesťami brucha, v laboratórnom obraze s výraznou eleváciou zápalových parametrov (CRP 288 mg/l) a eleváciou sérovej amylázy a lipázy. Na CT brucha sa potvrdil obraz akútnej pankreatitídy - žiadna iná zjavná príčina bolestí brucha sa nenašla (Obr. 3).
Image 3. CT brucha s obrazom akútnej pankreatitídy 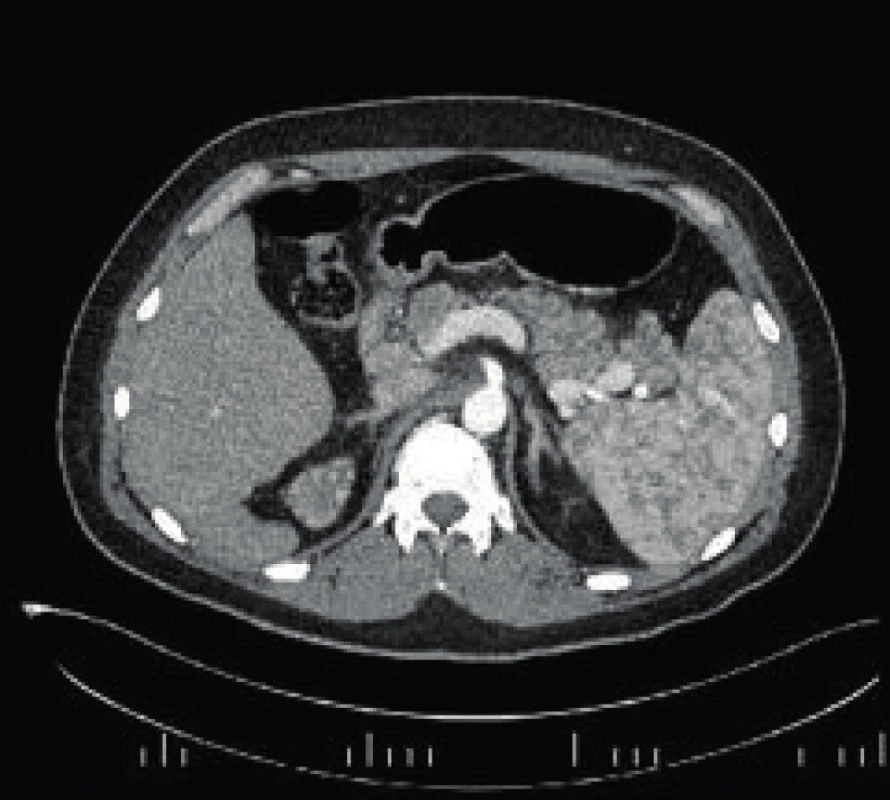
Po parenterálnej infúznej liečbe došlo k ústupu brušnej symptomatológie a laboratórnemu poklesu zápalovej aktivity. Napriek zlepšeniu zápalového syndrómu a abdominálnej symptomatológie sme však postupne evidovali rozvoj renálneho zlyhávania pri zachovanej diuréze – zhoršenie proteinúrie, výskyt hemoglobinúrie, stúpanie hodnôt kreatinínu (do 458 μmol/l) s poklesom glomerulárnej filtrácie (do 0,22 ml/s). Konzultovaný nefrológ stav záveroval ako rýchlo progredujúcu glomerulonefritídu v rámci základného ochorenia, potencovanú možnou kontrastom indukovanou nefropatiou. Vzhľadom na renálne zlyhávanie sme realizovali aj biopsiu obličky s nálezom ťažkého postihnutia obličiek v zmysle nekrotizujúcej glomerulonefritídy ako prejav predpokladanej mikroskopickej polyangiitídy. Na základe toho sme zintenzívnili imunosupresívnu liečbu a podali sme 1. pulz cyklofosfamidu v dávke 1000 mg a pokračovali v perorálnej liečbe glukokortikoidmi v dávke 100 mg denne (cyklofosfamid v najnižšej odporúčanej dávke pre intermitentné podávanie – 10 mg/kg a prednizón tiež v dávke pri spodnej hranici odporúčanej pre akútne stavy – 1 mg/kg, pacient vážil 100 kg). Po liečbe došlo pomerne rýchlo k zlepšovaniu klinického stavu a poklesu laboratórnych ukazovateľov renálneho zlyhávania. Po absolvovaní celkovo 6 pulzov cyklofosfamidu, každý s odstupom 4 týždňov, boli hodnoty kreatinínu 270 μmol/l a glomerulárnej filtrácie 24,6 ml/min, liečba cyklofosfamidom sa ukončila a pokračovalo sa v udržiavacej liečbe azatioprinom. Pacient je dispenzarizovaný na našej reumatologickej ambulancii, aktuálne užíva 100 mg azatioprinu (v udržiavacej dávke 1 mg/kg), 5 mg prednizónu denne a ako prevenciu glukokortikoidmi indukovanej osteoporózy vápnik v dennej dávke 1 000 mg a vitamín D v dávke 800 IU. U pacienta toho času pretrváva chronická renálna insuficiencia štádia G3b podľa KDIGO (Kidney Disease Improving Global Outcomes) hodnotami sérového kreatinínu 180–200 μmol/l. Pacient už nemal žiadne klinické prejavy ochorenia ani jeho komplikácií a došlo k rezolúcii oftalmologického, dermatologického aj neurologického nálezu ad intergrum. Ako komplikácia liečby sa u neho vyvinul ste ‑ roidný diabetes, ktorý vyžadoval spočiatku liečbu inzulínom, neskôr perorálnymi antidiabetikami, avšak po znížení dávok glukokortikoidov je aktuálne len na diéte. Pravidelne realizujeme všetky vyšetrenia v rámci prešetrenia event. orgánového postihnutia a progresie ochorenia (tj. RTG hrudníka, USG brucha, kompletné funkčné vyšetrenie pľúc, High Resolution‑CT, kvantitatívna proteinúria, echokardiografické vyšetrenie), ktoré sú dlhodobo negatívne a tiež denzitometrické vyšetrenie svedčí pre denzitu primeranú veku a je bez progresie.
Diskusia
Diagnostika, MPA je náročná a diagnóza sa často stanovuje per exclusionem, definitívne je možné ju stanoviť podľa nasledovných diagnostických kritérií:
Diagnostické kritériá
- symptómy: rýchlo progredujúca glomerulonefritída, alveolárne krvácanie, iné orgánové postihnutie (purpura, subkutánne krvácanie, gastrointestinálne krvácanie, mononeurits multiplex)
- histológický nález: nekrotizujúca vaskulitída arteriol, kapilár a venúl, perivaskulárna infiltrácia zápalovými bunkami
- laboratórny nález: pozitivita MPO‑ANCA, pozitivita CRP, proteinúria, hematúria, elevácia urey a sérového kreatinínu
Diagnóza
- definitívna, MPA: pozitivita 2 alebo viacerých symptómov a pozitívny histologický nález; alebo pozitivita 2 alebo viacerých symptómov (vrátane rýchlo progredujúcej glomerulonefritídy a alveolárneho krvácania) a pozitivita MPO‑ANCA
- pravdepodobná, MPA: pozitivita 3 symptómov; alebo pozitívny 1 symptóm a pozitivita MPO‑ANCA (9)
Diagnosticky sme vzhľadom na všetky doterajšie nálezy - vaskulitídu na sietnici, renálne poškodenie (RPGN), zmeny na koži, autoimunitná hepatitída, reakcia na liečbu - stav uzavreli ako mikroskopická polyangiitída. Rozvoj komplikácií v podobe akútnej pankreatitídy a cerebritídy sme po vylúčení, respektíve nepotvrdení inej etiológie hodnotili ako autoimunitnú etiológiu. V literatúre bolo už popisované postihnutie gastrointestinálneho traktu a nervového systému ako raritný prejav, MPA (1, 11). Nakoľko sa jedná o ANCA asociovanú vaskulitídu, je jej serologické stanovenie užitočným nástrojom pri diagnostike, MPA. ANCA pozitivitu nájdeme u 80 % pacientov s, MPA, typizovane MPO‑ANCA u 60 % pacientov a PR3 (proteináza 3) ANCA u 40 % pacientov. Negativita ANCA protilátok, s ktorou sme sa stretli, však ochorenie jednoznačne nevylučuje. Suponované bolo aj IgG4-RD (IgG4 related disease), avšak klinický obraz nebol typický, chýbalo predchorobie a rodinná záťaž, testované hladiny IgG4 boli v norme. V rámci diferenciálnej diagnostiky ANCA pozitívnych stavov treba myslieť predovšetkým na ostatné AAV (ANCA‑Associated Vasculitis) - okrem mikroskopickej polyangitídy do tejto skupiny patrí granulomatóza s polyangiitídou a eozinofilná granulomatóza s polyangiitídou. ANCA pozitivita sa však môže vyskytovať aj u iných autoimunitných ochorení akými sú systémový lupus erythematosus, reumatoidná artritída, Sjögrenov syndróm. Inou skupinou ochorení s možnou ANCA pozitivitou sú IBD (Inflammatory Bowel Disease) pričom pozitivita býva v tejto skupine ochorení častejšia pri ulceróznej kolitíde než pri Crohnovej chorobe. Treba však mať na pamäti, že v zriedkavých prípadoch dochádza pri stanovení ANCA aj k falošnej pozitivite, napr. pri Hodgkinovej chorobe, mnohopočetnom myelóme, HIV infekcii alebo tuberkulóze (14). Osobitnou skupinou ochorení v rámci diferenciálnej diagnostiky ANCA pozitivit, pri ktorej treba byť mimoriadne obozretný sú niektoré infekčné ochorenia, najmä tie s prejavmi podobnými AAV, nakoľko zlá diagnóza a podávanie imunosupresívnej liečby u infekčného stavu môže mať katastrofálne dôsledky. Najčastejšie takto uvádzaným ochorením je infekčná endokarditída, kde bola popisovaná aj možná indukcia produkcie ANCA prostredníctvom nešpecifickej aktivácie B‑lymfocytov alebo autoimunizácie po uvoľnení PR-3 z neutrofilov (15, 16). Ešte zriedkavejšie sú popisované vaskulitídy resp. vaskulopatie asociované s niektorými substanciami ako levamizol – antiparazitikum na liečbu askariázy a iných helmintóz, používa sa aj ako prímes v niektorých drogách, napr. v kokaíne (17). Pri voľbe terapie sme postupovali podľa EULAR (European League Against Rheumatism) odporúčaní. My sme zvolili liečbu cyklofosfamidom v kombinácii s prednizónom, ktoré je vhodné podávať v priebehu život ohrozujúceho priebehu (18). Po nastolení remisie sme prešli na kombináciu azatioprinu s prednizónom, s postupnou redukciou dávky prednizónu – túto kombináciu sme zvolili po starostlivom zvážení individuálneho benefitu a rizika – aj napriek riziku vzniku možnej akútnej pankreatitídy pri užívaní azatioprinu, toho času nebol vyšetrený deficit tiometylpurín transferázy (dodatočne sa tento deficit nepotvrdil). Táto kombinácia udržala pacienta v remisii do dnešného dňa. Mykofenolát mofetil sa v prípade život ohrozujúceho priebehu neodporúča podávať, okrem toho má časté komplikácie zo strany gastrointestinálneho traktu, poruchy funkcie obličiek (ktorú už mal pacient primárne) a hepatidítu (jednalo sa o pacienta s anamnézou autoimunitnej hepatitídy v regresii). Navyše podľa slovenských SPC (Summary Product Characteristics) sa toto liečivo vo všeobecnosti podáva iba rámci transplantácie obličiek, pri systémových ochoreniach ako systémový lupus erythematosus alebo lupusovej nefritíde a im podobným sa podáva výnimočne a ich podanie je viazané na indikáciu nefrológom. Metotrexát sa pri život ohrozujúcom priebehu taktiež neodporúča, takisto sme zohľadňovali vyššie spomenutú autoimunitnú hepatidídu v anamnéze. Biologická liečba – rituximab sa podáva až po zlyhaní štandardnej liečby, jej podávanie je navyše viazané na centrá biologickej liečby po schválení zdravotnou poisťovňou (20). Inhibítory C5a receptorov napriek sľubným výsledkom štúdií v Slovenskej republike nie sú k dispozícii, nemáme skúsenosti s ich používaním (19).Záver
Skutočnosť, že, MPA môže postihovať cievy ktoréhokoľvek orgánu v tele, môže sa prejavovať širokým spektrom nešpecifických symptómov a hodnoty ANCA protilátok môžu byť negatívne, výrazne sťažuje diagnostiku tohto ochorenia. V rámci diferenciálno‑diagnostického procesu je potrebné u pacientov s neobjasnenou príčinou teplôt a orgánovým postihnutím myslieť aj na také zriedkavé ochorenia akým je, MPA.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Daniel Tobiáš,
V. interná klinika LF UK a UN Bratislava,
Nemocnica Ružinov,
Ružinovská 6,
826 06 Bratislava,
Slovenská republika
Cit. zkr: Vnitř Lék 2020; 66(4): 249–252
Článek přijat redakcí: 3. 6. 2019
Článek přijat k publikaci: 17. 9. 2019
Sources
1. Chung SA, Seo P Microscopic polyangiitis. Rheum Dis Clin North Am 2010; 36 : 545–558.
2. Fries JF, Hunder GG, Bloch DA et al. The American College of Rheumatology 1990 criteria for the classification of vasculitis. Summary. Arthritis Rheum 1990; 33 : 1135–1136.
3. Jennette JC, Falk RJ, Andrassy K et al. Nomenclature of systemic vasculitides. Proposal of an international consensus conference. Arthritis Rheum. 1994; 37 : 187–192.
4. Lightfoot RW, Michel BA, Bloch DA et al. The American College of Rheumatology 1990 criteria for the classification of polyarteritis nodosa. Arthritis Rheum 1990; 33 : 1088–1093.
5. Amezcua‑Guerra LM, Prieto P, Bojalil R et al. Microscopic polyangiitis associated with primary biliary cirrhosis: a causal or casual association? J Rheumatol 2006; 33 : 2351–2353.
6. Seligman VA, Bolton PB, Sanchez HC et al. Propylthiouracil‑induced microscopic polyangiitis. J Clin Rheumatol 2001; 7 : 170–174.
7. Altaie R, Ditizio F, Fahy GT Microscopic polyangitis presenting with sub‑acute reversible optic neuropathy. Eye (Lond.) 2005; 19 : 363–365.
8. Nagai Y, Hasegawa M, Igarashi N et al. Cutaneous manifestations and histological features of microscopic polyangiitis. Eur J Dermatol 2008; 19 : 57–60.
9. Ozaki S ANCA‑associated vasculitis: diagnostic and therapuetic strategy. Allergo Int 2007; 56 : 87–96.
10. Specks U, Merkel PA, Seo P et al. Efficacy of remission‑induction regimens for ANCA‑associated vasculitis. N Engl J Med 2013; 369 : 417–427.
11. Haraguchi K, Gunji K, Ito Y et al. Extensive pancreatic necrosis in microscopic polyangiitis. Clin Exp Nephrol 2005; 9 : 326–331.
12. Oh YJ, Ahn SS, Park ES et al. Chest and renal involvements, Birmingham vascular activity score more than 13.5 and five factor score more than 1 at diagnosis are significant predictors of relapse of microscopic polyangiitis. Clin Exp Rheumatol 2017; 19 : 47–54.
13. Agard C, Mouthon L, Mahr A et al. Microscopic Polyangiitis and Polyarteritis Nodosa: How and When Do They Start? Arthritis & Rheumatism 2003; 15 : 709–715.
14. Avery TY, Bons J, van Paassen P et al. Diagnostic ANCA algorithms in daily clinical practice: evidence, experience, and effectiveness. Lupus 2016; 31 : 917–924.
15. Veerappan I, Prabitha EN, Abraham A et al. Double ANCA‑positive vasculitis in a patient with infective endocarditis. Indian J Nephrol 2012; 22 : 469–472.
16. Langlois V, Marie I Antineutrophil cytoplasmic antibodies associated with infective endocarditis: Literature review. Rev Med Interne 2017; 38 : 450-457.
17. Tran H, Tan D, Marnejon TP et al. Cutaneous vasculopathy associated with levamisole‑adulterated cocaine. Clinical Medicine & Research 2013; 11 : 26. 30.
18. Yates M, Watts RA, Bajema IM et al. EULAR/ERA‑EDTA recommendations for the management of ANCA‑associated vasculitis. Ann Rheum Dis 2016; 75 : 1583–1594.
19. Tesar V, Hruskova Z Avacopan in the treatment of ANCA‑associated vasculitis. Expert Opin Investig Drugs 2018; 27 : 491–496.
20. Taha R, El‑Haddad H, Allmualim A et al. Systematic review of the role of rituximab in treatment of antineutrophil cytoplasmic autoantibody‑associated vasculitis, hepatitis C virus‑related cryoglobulinemic vasculitis, Henoch‑Schönlein purpura, ankylosing spondylitis, and Raynaud’s phenomenon. Open Access Rheumatol 2017; 9 : 201–214.
21. Jones RB, Hiemstra TF, Ballarin J et al. Mycophenolate mofetil versus cyclophospha ‑ mide for remission induction in ANCA‑associated vasculitis: a randomised, non‑inferiority trial. Ann Rheum Dis 2019; 78 : 399–405.
22. Cibičková Ľ, Soukup T, Tomš J et al. Centrální pravostranná hemiparéza jako dominující projev systémové vaskulitidy. Vnitř Lék 2010; 56 : 1194–1197.
23. Bradna P, Maňák J, Soukup T Difuzní alveolární hemoragie – akutní, život ohrožující stav v revmatologii. Vnitř Lék 2018; 64.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 4-
All articles in this issue
- Contemporary treatment methods of adult patients with BCR/ABL1 positive chronic myeloid leukemia
- Anticoagulation therapy in cancer associated thromboembolism – new studies, new guidelines
- Gastrointestinal and hepatic symptoms of tickborne diseases
- Secondary prevention after acute coronary syndrome
- Bleeding in portal hypertension
- Patient after kidney transplantation in outpatient internal clinic
- Lung diseases and autoimmune hemolytic anemia associted with IgG4 disease
- Witholding dialysis in elderly patients with chronic kidney disease
- Liver fibrosis
- Are changes in the blood count clinically useful marker of azathioprine dose?
- Heparin-induced thrombocytopenia: a case report and literature overview
- Microscopic polyangiitis
- Heart failure as a manifestation of acromegaly
- Long term use of the telemonitoring system Diani in the therapy of a patient with type 1 diabetes
- Hyperuricemia in renal disease patients
- Evaluation of surgical risk in patients with liver cirrhosis
- 20 let klinických zkušeností s léčbou chronické myeloidní leukemie inhibitory tyrosinové kinázy
- Léčba pacientů s chronickou myeloidní leukemií – nečekaný anebo očekávaný průnik onkologie a vnitřního lékařství?
- Stanovisko Angiologickej sekcie Slovenskej lekárskej komory (AS SLK) k užívaniu antagonistov renín-angiotenzínaldosterónového systému
- K životnímu jubileu prof. MUDr. Jindřicha Špinara, CSc., FESC
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Liver fibrosis
- Evaluation of surgical risk in patients with liver cirrhosis
- Microscopic polyangiitis
- Hyperuricemia in renal disease patients
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

