-
Medical journals
- Career
Vrozený deficit C2 složky komplementu – variabilní klinická manifestace (kazuistiky a přehled problematiky)
Authors: Pavlína Králíčková 1; Ctirad Andrýs 1; Tomáš Freiberger 2,3; Jan Krejsek 1
Authors‘ workplace: Ústav klinické imunologie a alergologie LF UK a FN Hradec Králové 1; Centrum kardiovaskulární a transplantační chirurgie Brno 2; Ústav klinické imunologie a alergologie LF MU a FN u sv. Anny Brno 3
Published in: Vnitř Lék 2020; 66(2): 87-91
Category: Case Report
Overview
Deficit C2 složky komplementu patří mezi nejčetnější deficity komplementového systému. Klinicky se může manifestovat infekcemi způsobenými nejčastěji opouzdřenými bakteriemi (Streptococcus pneumoniae a Neisseria meningitidis) ve formě meningitid, gonitid, pneumonií či septikemie. U části nemocných dochází k rozvoji autoimunitních komplikací, především systémového lupus erythematodes. Kauzální léčba není dostupná. Z preventivních opatření je doporučována vakcinace, popř. dlouhodobé profylaktické podávání antibiotik. Článek prezentuje 2 nemocné ze 2 nepříbuzných rodin. První nemocný trpěl v dětství otitidami, později prodělal osteomyelitidu, meningitidu se ztrátou sluchu a pneumonii. Nemocný ze druhé rodiny prodělal jednu nekomplikovanou meningitidu v předškolním věku. V dospělosti se léčil pro zvýšenou frekvenci infekcí horních cest dýchacích. Jeho sestra byla zcela asymptomatická. U všech tří byla diagnostikována delece 28 bp (c.841-849+19del28) v genu pro C2 složku komplementu v homozygotní podobě. Naše práce se snaží poukázat na variabilitu klinické manifestace u homozygotních nositelů mutace od zcela asymptomatických jedinců až po komplikované stavy provázené závažnými infekčními komplikacemi a častou diagnostikou až v dospělém věku.
Klíčová slova:
C2 – imunodeficience – komplementový systém – meningitida – pneumokokové infekce – vakcinace
Úvod
Komplementový systém (KS) představuje nespecifickou humorální složku imunitního systému. K jeho hlavním funkcím patří identifikace a likvidace patogenů a odstraňování vlastních napadených nebo alterovaných buněk. Některé složky fungují jako opsonizační a chemotaktické působky. Účastní se i při procesu likvidace apoptotických tělísek, úzce spolupracuje s mechanismy adaptivní imunity, s T-lymfocyty i B-lymfocyty (1).
Je tvořen souborem více než 40 výkonných a regulačních glykoproteinů, které se nacházejí v krevním séru nebo na povrchu buněk. V krevním séru se vyskytuje 9 složek (C1-C9), několik jeho faktorů (B, D, P) a regulátorů aktivity (H, I, DAF – decay accelerating factor, MCP – membrane cofactor of proteolysis). Složky C za normálních okolností cirkulují v krvi v neaktivní formě. Po setkání s aktivátorem následuje přeměna první neaktivní složky C na aktivní proteolytický enzym, který rozštěpí molekulu další složky na 2 fragmenty, z nichž jeden je proteolytickým enzymem štěpící následující složku opět na 2 fragmenty a druhý má jinou biologickou aktivitu (opsonizace – C3b, C4b, chemotaxe – C3a, C5a, tvorba anafylatoxinů – C3a, C4a, C5a). Tímto kaskádovým způsobem se postupně rozštěpí prvních 5 složek komplementu. Vzniklý fragment C5b se naváže na povrch buňky, která se nachází v jeho blízkosti. Po navázání složek C6-C8 a několika složek C9 (bez dalšího štěpení) vznikne MAC komplex (membrane attack complex), jehož jednotlivé molekuly se kruhovitě zabudují do cytoplazmatické membrány terčové buňky tak, že mezi nimi vznikne otvor, kterou do buňky proudí voda působící její osmotickou lýzu (1, 2). Aktivace KS probíhá třemi základními cestami: alternativní, klasickou a lektinovou (Obr. 1).
Image 1. Schematické znázornění komplementové kaskády a hlavních aktivátorů klasické, lektinové a alternativní cesty 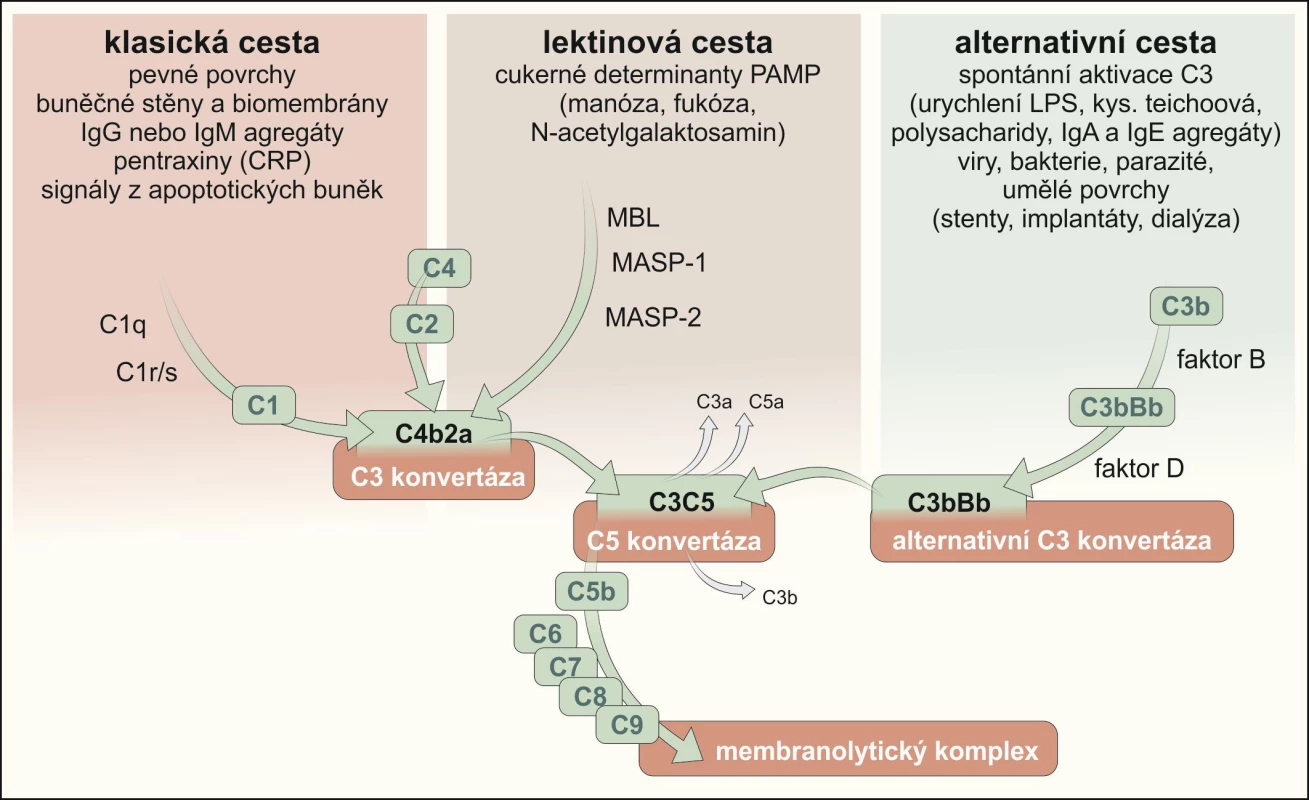
Deficity komplementu obecně
Deficity komplementu představují podíl přibližně 5% ze všech hlášených primárních imunodeficiencí (3). V obecné populaci je předpokládána prevalence 0,03%. Výjimku tvoří deficit manosa-binding lektinu (MBL), kde je odhadován výskyt v homozygotní formě přibližně v 5% (4). Dědičnost je v naprosté většině případů autozomálně recesivní (kromě deficitu properdinu X-vázaného, a faktoru B, C1-inhibitoru a MPC/CD46 autozomálně dominantního). Heterozygotní přenašeči recesivních chorob bývají klinicky zcela zdrávi. Typickými projevy nemocných s deficitem komplementu obecně jsou meningokokové meningitidy ve věku nad 5 let. Nejčastějšími původci dalších infekčních komplikací (pneumonie, septikemie, artritida, osteitida, otitis media) jsou Neisseria meningitidis, Streptococcus pneumoniae, Haemophilus influenzae či Neisseria gonorrhoeae (5–8).
Jako neinfekční projevy jsou popsány autoimunitní onemocnění, nejčastěji: systémový lupus erythematodes – SLE, včetně kožní formy, revmatoidní artritida, dermatomyozitida, vaskulitida (5, 9–11). Až 95% nemocných s deficitem C1q složky rozvíjí v průběhu života SLE (12). Typické, zejména pro deficit alternativní dráhy, je postižení ledvin (membranoproliferativní glomerulonefritida, nemoc denzních depozit, C3 glomerulonefritida) (5, 13).
Specifickou skupinu tvoří nemocní s recidivujícím hemolyticko-uremickým syndromem (HUS). HUS je onemocnění charakterizované mikroangiopatickou hemolytickou anémií, trombocytopenií a renálním selháváním. Ke klinické manifestaci dochází obvykle již v kojeneckém věku. Po vyloučení mutace ADAMTS13 (kódující metaloproteázu štěpící von Willebrandův faktor) je doporučeno vyšetření deficitu komplementu (především faktorů I, H, B, trombomodulinu, C3). Většina mutací je heterozygotních a rodinný výskyt je hlášen až u 20% pacientů (14).
Deficit C1 inhibitoru (množství, porušená funkce) je příčinou hereditárního angioedému. Patofyziologicky je indukován bradykininem. Je charakterizován tvorbou nebolestivých, nesvědivých otoků podkoží a sliznic. Otoky se rozvíjejí během několika hodin, přetrvají obvykle déle než 12 hod, často 2–3 dny a poté spontánně vymizí. Nejčastěji postihují podkoží v oblasti obličeje, končetin a genitálu. Jsou bělavého charakteru a nesvědí. Postižení gastrointestinálního traktu vede k vyčerpávajícím, krutým, křečovitým bolestem, které bývají provázeny zvracením a vodnatými průjmy. Otok laryngu, uvuly, měkkého patra či jazyka mohou končit bez adekvátní pomoci úmrtím(15).
Laboratorní diagnostika komplementového systému
Jako screeningové vyšetření funkční aktivity slouží hemolytické testy pro klasickou dráhu (CH50, CH100) a/nebo alternativní dráhu (AH50, AH100). V současné době je stále více využívána alternativa ve formě imunoenzymatického průkazu aktivace všech 3 drah pomocí specifické protilátky namířené proti komplexu C5b-9. Při zjištění snížené funkce některé dráhy lze přikročit ke stanovení sérové koncentrace jednotlivých klíčových složek (nejčastěji C2, C3, C4, C5 a MBL). K definitivní diagnóze vrozeného deficitu je nutno přistoupit ke genetickému vyšetření.
Zvláštní postavení má vyšetření sérové koncentrace a funkce C1-inhibitoru (podezření na hereditární angioedém), průkaz membránových proteinů vázaných GPI kotvou průtokovou cytometrií: CD59 – protektin, CD55 – DAF (v diagnostice paroxyzmální noční hemoglobinurie), průkaz autoprotilátek proti C3 složce, tzv. nefritickému faktoru (membranoproliferativní glomerulonefritida), autoprotilátek proti C1q podjednotce (SLE, získaný bradykininem indukovaný angioedém) (1).
Kazuistika 1
49letý muž byl doporučen na naši kliniku plicním lékařem pro perzistující kašel k vyloučení alergického podílu na obtížích nemocného.
Rodinná anamnéza byla zcela bez pozoruhodností. Nemocný trpěl v předškolním věku četnými otitidami, pro které byla provedena v 5 letech adenotomie s následným ústupem obtíží. Ve 12 a 15 letech prodělal úraz kotníku a následně kolenního kloubu. Obě události byly komplikovány rozvojem osteomyelitidy. Cílená antibiotická léčba vedla ke zhojení bez trvalých následků. Ve 22 letech, v době konání základní vojenské služby, prodělal meningitidu komplikovanou vznikem hluchoty levého ucha s občasnými poruchami rovnováhy. Bližší informace o kauzálním infekčním agens nebyly dostupné. V mladší dospělosti udával četnější výskyt zánětů průdušek a ve 33 letech prodělal pneumonii, opět bez nálezu příčinného patogenu.
Vyšetření alergologem a klinickým imunologem vyhledal pro perzistující suchý kašel bez dušnosti či pískotů. Udal řadu let trvající mírnou rinitidu celoročního charakteru se zhoršováním v jarních měsících. Z dalších anamnestických dat vyplynulo, že ve 34 letech prodělal biliární pankreatitidu. V době vyšetření byl léčen pro diabetes mellitus 2. typu a vertebrogenní algický syndrom.
Alergologické vyšetření vyloučilo astma bronchiale. V kožních prick testech reagoval pozitivně na břízovité (indurace 10 mm) a Dermatophagoides farinae (6mm). Indikovaná impedance jícnu odhalila extraezofageální reflux.
Laboratorní vyšetření zjistilo ve 2 nezávislých měřeních významně sníženou aktivitu komplementu klasickou – 5% (referenční rozmezí 40–150%) a lektinovou cestou – 5% (10–150%). Sérová koncentrace C4 složky komplementu byla v normě, koncentrace složky C2 byla detekována při dolní hranici normy 0,010g/l (0,010–0,30). Doporučené genetické vyšetření prokázalo homozygotní mutaci genu pro C2 složku komplementu, deleci 28 bp na rozhraní 6. exonu a 6. intronu (NM_000063, c. 841-849+19del28), která vede k poruše sestřihu pre-mRNA, vynechání exonu 6 z výsledného transkriptu a poruše syntézy C2, a která byla popsána jako příčina deficience C2 složky komplementu 1. typu (16).
V oblasti humorální imunity nebyl zjištěn deficit. Sérové koncentrace celkového IgG, podtříd IgG, celkového IgA a IgM a dále i koncentrace specifických protilátek proti tetanickému toxoidu i kapsulárnímu pneumokokovému antigenu nevybočovaly z referenčních rozmezí.
Stav byl uzavřen jako vrozený deficit C2 složky komplementu, perzistující alergická rinitida s vazbou na roztoče a jarní stromy. Jako kofaktor kašle byla podezřívána refluxní choroba jícnu, což následně potvrdila provedená impedance jícnu.
Byla zahájena léčba antihistaminiky, nosními steroidy, blokátory protonové pumpy, včetně režimových opatření. Pro zjištěný deficit komplementu bylo nemocnému doporučeno podstoupit preventivní vakcinaci konjugovanými vakcínami proti pneumokokům a meningokokům. Dlouhodobou antibiotickou profylaxi odmítl pro nízkou nemocnost v posledních letech.
Kazuistika 2
35letý muž byl doporučen k imunologickému vyšetření pro recidivující infekce horních cest dýchacích provázené zvýšenou únavou a bolestmi dolních končetin. Oba jeho rodiče ani sestra neprodělali žádnou závažnou infekci, matka byla sledována po operaci pro meningeom. Nemocný udal, že v předškolním věku prodělal jednu ataku nekomplikované meningitidy, bližší okolnosti mu však nebyly známy. Na zvýšenou nemocnost si začal stěžovat až ve 23 letech po nástupu do zaměstnání (dělník a později řidič v autobusové dopravě). Vstupní vyšetření ve spádové alergologické ambulanci neprokázalo v té době senzibilizaci na inhalační alergeny. Laboratorní vyšetření zjistilo lehce sníženou sérovou koncentraci IgG 5,01g/l (referenční rozmezí 7,3–19,5). Sérové koncentrace IgA a IgM byly v rámci referenčního rozmezí, nebyl zjištěn deficit podtříd IgG. Ve 30 letech provedené nové alergologické vyšetření prokázalo pozitivitu kožních testů s vazbou na roztoče, podpořenou lehce zvýšenou hodnotou specifického IgE proti Dermatophagoides farinae 0,64 U/ml (norma do 0,35) a Dermatophagoides pteronyssinus 1,52U/ml (norma do 0,35). Léčba byla rozšířena o celoroční užívání antihistaminik.
Následné vyšetření imunologem na našem pracovišti potvrdilo známé snížení hodnoty IgG 5,6 g/l (7,3–19,5) se současnou hraniční koncentrací podtříd IgG1 3,0 g/l (3,1–8,8) a IgG4 pod detekovatelnou dolní hranicí 0,07 g/l, hodnoty specifických protilátek proti polysacharidovému pneumokokovému antigenu a tetanickému toxoidu nevybočovaly z referenčního rozmezí, zatímco hodnota specifických protilátek proti Haemophilus influenzae 0,08mg/l (norma 0,2–23,4) byla snížená. Doplněné vyšetření komplementového systému prokázalo snížení aktivace klasické cesty 7% (norma 40–150) a lektinové cesty 8% (10–150), při zachované aktivitě cesty alternativní. Na základě tohoto vyšetření bylo vysloveno podezření na možný deficit C2 složky komplementu, které bylo následně potvrzeno nejen sérologicky (hladina C2 0,006 g/l, norma 0,01–0,03), ale i geneticky. U pacienta byla diagnostikována homozygotní mutace C2, delece 28 bp (c. 841-849+19del28).
V současné době se nemocný cítí dobře, frekvence infekcí horních cest dýchacích samovolně poklesla na míru přijatelnou nemocným. Pacientovi bylo doporučeno z preventivních důvodů absolvovat očkování proti Streptococcus pneumonie a Neisseria meningitidis. Nejprve byl vakcinován (částečně z diagnostických důvodů) polysacharidovou vakcínou PNEUMO 23, Sanofi Pasteur, Lyon, Francie a následně i konjugovanou vakcínou Prevenar 13, Pfitzer Limited, Kent, Velká Británie. Po 4 týdnech po vakcinaci nebyl ani v jednom případě zaznamenán další vzestup sérových koncentrací specifických protilátek. S ohledem na nízkou nemocnost v této době nebyla po dohodě dlouhodobá antibiotická léčba realizována. Antihistaminika užívá jen sporadicky, nebyl indikován k substituční léčbě imunoglobuliny.
Genetické vyšetření dalších členů rodiny prokázalo tutéž mutaci v homozygotní formě u sestry a v heterozygotní formě u matky. Otec nemocného se k vyšetření nedostavil. I přesto, že je pacientova sestra zcela klinicky asymptomatická, doporučili jsme jí podstoupit preventivní vakcinaci.
Deficit C2 složky komplementu
Deficit C2 složky komplementu je pokládán za nejčetnější deficit KS v bělošské populaci. Mezi všemi nemocnými s deficitem KS zaujímá přibližně 1/3, s odhadovanou prevalencí homozygotních mutací 1 : 10 000 (8). V České republice (ČR) bylo v genetické laboratoři Centra pro kardiovaskulární a transplantační chirurgii v Brně k 1. 4. 2018 diagnostikováno celkem 17 pacientů ze 14 rodin s homozygotní mutací.
Strukturální gen pro C2 je umístěn v oblasti MHC III. třídy společně s geny pro C4 a faktor B na 6. chromozómu (9). Principiálně jsou odlišovány 2 typy: typ 1 způsobený poruchou syntézy a typ 2 spojený s poruchou sekrece (17).
Funkce C2 složky v komplementové kaskádě spočívá v poskytování katalytické subjednotky C3 konvertázy C4b2a. C4b2a může vznikat pomocí aktivace klasické cesty (C1q, r, s, C4, C2) či lektinové cesty (MBL či fikoliny v komplexu s MASP-1 váží relevantní cukerné molekuly a aktivují MASP-2, který štěpí C2 a C4 za vzniku C3-konvertázy). Naopak cesta alternativní je intaktní (1).
Nositelé homozygotní mutace mohou být zcela klinicky asymptomatičtí (7). Naopak klinický význam mutace mohou zvyšovat další přidružené humorální deficity, především snížené sérové koncentrace IgG2, IgG4 a IgA (18, 19).
Spektrum možných patogenů a typy onemocnění popisuje švédská studie čítající 40 osob z 33 rodin. U 23/40 (57,5%) udává anamnézu invazivní infekce (zejména septikemie, meningitidy s dominujícím patogenem Streptococcus pneumonie), u 12/40 (30%) opakovaně. 19/40 (47,5%) prodělalo minimálně jednu pneumonii a opakující se pneumonie byly hlášeny u 10/40 (25%). Opakující se infekce se vyskytovaly zejména v dětském věku (7). Převahu pneumokokových infekcí nad meningokokovými 75% vs 13% potvrzuje i další evropská studie z roku 2015 (22 nemocných), demograficky zahrnující nemocné z Velké Británie, ČR, Německa, Maďarska, Španělska, Turecka a Srbska (8). Kromě meningitid, pneumonií a septikemií byly popsány i artritidy, osteitidy a otitidy (7, 18, 20–22).
Přibližně 10–30% nositelů rozvine v průběhu života autoimunitní komplikace, především SLE, či jeho izolované kožní formy, event. revmatoidní artritidu, dermatomyozitidu, Henoch-Schoenleinovu purpuru, membranoproliferativní glomerulonefritidu či vaskulitidu (9–11). Predominantně bývají postiženy ženy, stejně jako u nemocných se SLE bez přítomného deficitu KS. Tíže orgánových komplikací u C2 deficitu se významně neliší od běžné SLE populace (10). Lintner et al udává častější propuknutí onemocnění v dětském věku, avšak s mírnějším průběhem, klinicky dominující fotosenzitivitou, pozitivní rodinnou anamnézou. Anti DNA protilátky bývají negativní, naopak typický je zrnitý typ imunofluorescence ANA (těsnější vazba k anti Ro/SSA). Nefropatii pozoroval méně často (23).
Příčinná léčba poruch komplementového systému není zatím dostupná. Nejsou k dispozici jednotná léčebná doporučení. Léčba autoimunitních komplikací se neliší od nemocných bez komplementového deficitu. V léčbě deficitu C1 inhibitoru se uplatňuje substituce přirozeným či rekombinantním C1 inhibitorem anebo blokáda bradykininových receptorů (icatibant) (15).
V léčbě HUS způsobeného komplementovým deficitem je indikován eculizumab (monoklonální IgG2 protilátka vázající se na C5 složku komplementu inhibující tak aktivaci terminální části komplementu) (14).
Z preventivních antiinfekčních opatření je doporučována vakcinace a dlouhodobá antibiotická profylaxe. Obecně je doporučována vakcinace proti meningokokům a pneumokokům, s výhodou je užití polysacharidového antigenu konjugovaného na proteinový nosič, i když u řady nemocných je i odpověď na polysacharidový antigen v dostatečné míře zachována (24).
Evropská studie porovnávající přístup k antibiotické profylaxi na Britských ostrovech a na kontinentu (profylaxe hojně užívaná zejména ve Velké Británii) a shrnující dostupná retrospektivní data stran preventivních vakcinací nevedla k uspokojivým závěrům v tomto směru. Ve sledované skupině nemocných nebyly oba tyto léčebné postupy provázeny signifikantním poklesem infekčních příhod, byť se zdálo, že po stanovení diagnózy frekvence infekcí poklesla (8). Výsledky mohly být ovlivněny řadou faktorů.
Z dlouhodobého hlediska problematiku hodnocení efektivity vakcinace znesnadňuje nemožnost optimálně měřit vakcinační odpověď se stanovením míry protektivity. Dostupnost vakcín s vazbou na proteinový nosič je otázkou až posledních let. Dlouho nebyla dostupná vakcinace proti Neisseria meningitidis typu B. Navíc nelze vyloučit možnost infekce i méně častými sérotypy. K ozřejmění je vhodné provést prospektivní studie.
Poslanecká sněmovna ČR schválila dne 30. 6. 2017 novelu zákona č. 48/1997 Sb., o veřejném zdravotním pojištění, kde v části věnované hrazeným službám (§ 30), dochází ke změnám a k rozšíření úhrady vybraných očkování ze zdravotního pojištění. Nově se zavádí úhrada očkování u vybraných, chronicky nemocných, rizikových skupin pacientů bez ohledu na věk. Jedná se o úhradu očkování proti invazivním meningokokovým onemocněním, pneumokokovým onemocněním, onemocněním vyvolaným Haemophilus influenzae typu b a proti chřipce u pacientů s porušenou nebo zaniklou funkcí sleziny, pacientů po autologní nebo allogenní transplantaci kmenových hemopoetických buněk, pacientů se závažným primárním nebo sekundárním imunodeficitem nebo pacientů po prodělané invazivní meningokokové nebo invazivní pneumokokové infekci (25).
očkování proti invazivním meningokokovým onemocněním jsou Evropskou lékovou agenturou (EMA) registrovány a jsou v ČR k dispozici dvě konjugované tetravalentní vakcíny obsahující antigeny 4 séroskupin meningokoka A, C, W, Y (Men A, C, W, Y vakcína) a 2 rekombinantní vakcíny obsahující antigeny meningokoka séroskupiny B (MenB4C a MenB-FHbp vakcína). U Men A, C, W, Y vakcíny byla prokázána ochrana nejen proti invazivnímu meningokokovému onemocnění způsobenému těmito 4 séroskupinami, ale i proti nosičství meningokoků těchto séroskupin. K zabezpečení co nejširšího séroskupinového pokrytí se doporučuje v ČR očkování s využitím jak Men A, C, W, Y, tak Men B vakcín. Aplikace obou vakcín je doporučena v odstupu minimálně 14 dnů, v případě potřeby lze aplikovat současně, avšak do odlišných míst. Při simultánní aplikaci je možné očekávat vyšší reaktogenitu vakcín. K udržení dlouhodobé imunity je v některých případech doporučeno přeočkování (26).
Závěr
Klinické projevy homozygotního deficitu C2 složky komplementu mohou být vysoce variabilní od zcela asymptomatických jedinců až po komplikované stavy provázené závažnými infekčními komplikacemi. Diagnostika až v dospělém věku není nijak výjimečná. Kauzální léčba neexistuje. Obecně je doporučováno preventivní očkování v součinnosti s vakcinačními centry. V indikovaných případech pak využít dlouhodobou antibiotickou profylaxi. Rutinní by mělo být aktivní vyhledávání autoimunitních komplikací.
KORESPONDENČNÍ ADRESA AUTORA:
doc. MUDr. Pavlína Králíčková, Ph.D.,
Ústav klinické imunologie a alergologie LF UK a FN
Sokolská tř. 581,
500 05 Hradec Králové
Cit. zkr: Vnitř Lék 2020; 66(E-2): e48–e52
Článek přijat redakcí: 20. 7. 2018
Článek přijat k publikaci: 6. 12. 2018
Sources
1. Krejsek J, Andrýs C. Komplementový systém. In: Krejsek J, Andrýs C. Krčmová I Imunologie člověka. 1. Vydání. Hradec Králové, nakladatelství Garamond s.r.o., 2016, 78–86.
2. Ferenčík M, Rovenský J, Shoenfeld Y et al. Komplementový systém. In: Imunitní system - informace pro každého. 1. Vydání. Praha: Grada Publishing 2015 : 48–51.
3. Modell V, Gee B, Lewis DB, et al. Global study of primary immunodeficiency diseases (PI) – diagnosis, treatment, and economic impact: an updated report from the Jeffrey Modell Foundation. Immunol Res 2011; 51 : 61–70.
4. Babovic-Vuksanovic D, Snow K, Ten RM. Mannose-binding lectin (MBL) deficiency. Variant alleles in a midwestern population of the United States. Ann Allergy Asthma Immunol Off Publ Am Coll Allergy Asthma Immunol 1999; 82 : 134–138.
5. Grumach AS, Kirschfink M. Are complement deficiencies really rare? Overview on prevalence, clinical importance and modern diagnostic approach. Mol Immunol 2014; 61 : 110–117.
6. Šrotová A, Litzman J, Rumlarová Š, et al. Recurrent meningitis and inherited complement deficiency. Epidemiol Mikrobiol Imunol 2016; 65 : 238–242.
7. Jönsson G, Truedsson L, Sturfelt G, et al. Hereditary C2 deficiency in Sweden: frequent occurrence of invasive infection, atherosclerosis, and rheumatic disease. Medicine (Baltimore) 2005; 84 : 23–34.
8. Turley AJ, Gathmann B, Bangs C, et al. Spectrum and management of complement immunodeficiencies (excluding hereditary angioedema) across Europe. J Clin Immunol 2015; 35 : 199–205.
9. Pickering MC, Botto M, Taylor PR, et al. Systemic lupus erythematosus, complement deficiency, and apoptosis. Adv Immunol 2000; 76 : 227–324.
10. Agnello V Association of systemic lupus erythematosus and SLE-like syndromes with hereditary and acquired complement deficiency states. Arthritis Rheum 1978; 21: (Suppl. 5): 146–152.
11. Jönsson G, Truedsson L, Sturfelt G, et al. Hereditary C2 deficiency in Sweden: frequent occurrence of invasive infection, atherosclerosis, and rheumatic disease. Medicine (Baltimore) 2005; 84 : 23–34.
12. Stegert M, Bock M, Trendelenburg M. Clinical presentation of human C1q deficiency: How much of a lupus? Mol Immunol 2015; 67 : 3–11.
13. Zhao W, Ding Y, Lu J, et al. Genetic analysis of complement pathway in C3 glomerulopathy. Nephrol Dial Transplant 2018 (doi: 10.1093/ndt/gfy033, ahead of print).
14. Kaplan BS, Ruebner RL, Spinale JM, et al. Current treatment of atypical hemolytic uremic syndrome. Intractable Rare Dis Res 2014; 3 : 34–45.
15. Mauer M, Magert M, Ansotegui J, et al. The international WAO/EAACI guideline for the management of hereditary angioedema. The 2017 revision and update. Allergy 2018; doi10.1111/all.13384.
16. Johnson CA, Densen P, Hurfold jr. RK et al. Type I human complement C2 deficiency. A 28-base pair gene deletion causes skipping of exon 6 during RNA splicing. J Biol Chem 1992; 267 : 9347-9353.
17. Yu CY. Molecular genetics of the human MHC complement gene cluster. Exp Clin Immunogenet 1998; 15 : 213–230.
18. Litzman J, Freiberger T, Bartonková D, et al. Early manifestation and recognition of C2 complement deficiency in the form of pyogenic infection in infancy. J Paediatr Child Health 2003; 39 : 274–277.
19. Alper CA, Xu J, Cosmopoulos K, et al. Immunoglobulin deficiencies and susceptibility to infection among homozygotes and heterozygotes for C2 deficiency. J Clin Immunol 2003; 23 : 297–305.
20. Gaschignard J, Levy C, Chrabieh M. Invasive pneumococcal disease in children can reveal a primary immunodeficiency. Clin Infect Dis Off Publ Infect Dis Soc Am 2014; 59 : 244–251.
21. Attwood JT, Williams Y, Feighery C. Impaired IgG responses in a child with homozygous C2 deficiency and recurrent pneumococcal septicaemia. Acta Paediatr Oslo Nor 2001; 90 : 99–101.
22. Hussain A, Prasad KSRK, Bhattacharyya D, et al. C2 deficiency primary meningococcal arthritis of the elbow by Neisseria meningitidis serogroup Y in a 12-year old girl. Infection 2007; 35 : 287–288.
23. Lintner KE, Wu YL, Yang Y, et al. Components of the Complement Classical Activation Pathway in Human Systemic Autoimmune Diseases. Front Immunol 2016; 7 : 36.
24. Brodszki N, Skattum L, Bai X, et al. Immune responses following meningococcal serogroups A, C, Y and W polysaccharide vaccination in C2-deficient persons: evidence for increased levels of serum bactericidal antibodies. Vaccine 2015; 33 : 1839–1845.
25. http://www.vakcinace.eu/aktuality/archiv-aktualit
26. http://www.vakcinace.eu/doporuceni-a-stanoviska (Doporučení České vakcinologické společnosti ČLS JEP pro očkování proti invazivním meningokokovým onemocněním.)
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 2-
All articles in this issue
- Inkretinová léčba diabetu a kardiovaskulární komplikace
- SGLT-2 inhibitory a jejich postavení v současné medicíně
- Obezita a kardiovaskulární onemocnění
- Diabetická noha
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
- Stárnutí cév a vaskulární paměť
- Klinické aspekty depozice tuku v epikardu
- Adipocytokíny a tyreopatie
- Thymom – možnosti diagnostiky
- Aktuality v léčbě a prevenci klostridiové kolitidy
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Celiakie dospělých
- Cushingov syndróm a akromegália na podklade pikoadenómu hypofýzy
- Vrozený deficit C2 složky komplementu – variabilní klinická manifestace (kazuistiky a přehled problematiky)
- Diferenciální diagnostika hypoglykemie
- Co přináší internistům nové doporučení ESC – diabetes?
- Diabetes a kardiovaskulární onemocnění
- Epidemiologie infekcí vyvolaných Clostridium difficile (CDI) v České republice
- Extraintestinální projevy celiakie
- RECENZE KNIHY ÚVOD DO VNITŘNÍHO LÉKAŘSTVÍ – doc. MUDr. Jitka Mlíková Seidlerová, Ph.D., a kol.
- Pioglitazon
- Relation between testosterone levels and body composition, physical functioning and selected biochemical parameters in adult males
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika hypoglykemie
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Thymom – možnosti diagnostiky
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

