-
Medical journals
- Career
Diferenciální diagnostika hypoglykemie
Authors: Jan Schovánek 1; Ubica Cibičková 1; Filip Čtvrtlík 2; Zdeněk Fryšák 1; David Karásek 1
Authors‘ workplace: III. interní klinika – nefrologická, revmatologická a endokrinologická, Fakultní nemocnice Olomouc, a Lékařská fakulta Univerzity Palackého v Olomouci 1; Radiologická klinika, Fakultní nemocnice Olomouc a Lékařská fakulta Univerzity Palackého v Olomouci 2
Published in: Vnitř Lék 2020; 66(2): 129-133
Category: Differential Diagnosis Column or What You Can Be Asked at a Postgraduate Certification Exam
Overview
Přehledná práce zpracovává z diferenciálně diagnostického pohledu problematiku hypoglykemie. V úvodu vyzdvihuje nutnost dodržení Whippleových kritérií pro potvrzení diagnózy hypoglykemie. Stručně shrnuje klinické projevy hypoglykemie, připomíná patofyziologické, časové a klinické rozdělení hypoglykemických příhod. Pro klinické použití je i dle doporučených postupů vhodné rozdělení pacientů na diabetiky a nediabetiky. V přehledných grafech a tabulkách je dokumentováno rozdělení hypoglykemických příhod, jejich klinická manifestace a diferenciální diagnostika.
Klíčová slova:
hypoglykemie – nádorová hypoglykemie – Whippleova triáda
Úvod
Hypoglykemie je definována jako patologický důsledek poklesu glykemie provázený klinickými a humorálními projevy. Laboratorně je za hypoglykemii považovaná hodnota nižší než normální pro danou laboratoř (arbitrárně je obvykle udávaná hodnota 3,5 mmol/l v žilní krvi/plazmě). Z klinického pohledu tuto situaci vystihuje Whippleho trias – snížená koncentrace glukózy v krvi, klinická symptomatologie jako důsledek hypoglykemie a následné vymizení potíží po podání glukózy, resp. po úpravě glykemie (1).
Klinické projevy hypoglykemie
Symptomy hypoglykemie můžeme rozdělit na neuroglykopenické – vznikající jako důsledek nedostatku glukózy v mozkových buňkách, a autonomní (neurogenní) – subjektivní projevy vnímání změn v autonomním (sympato‑adrenálním) nervovém systému (Tab. 1.) (2). U pacientů se však popsané symptomy překrývají, např. u pacientů s inzulinomem mělo autonomní příznaky hypoglykemie 77 % pacientů a neuroglykopenické 96 % (3).
Table 1. Klinické příznaky hypoglykemie. Upraveno dle (11) 
Lidský organismus se fyziologicky brání rozvoji hypoglykemie zástavou vyplavovaní inzulinu a uvolněním kontraregulačních hormonů (4). Subjektivní vnímání hypoglykemie je tedy ovlivněno i vnímáním kontraregulačních změn. Autonomní (neurogenní) příznaky se obvykle rozvíjejí dříve než příznaky neuroglykopenické (Tab. 2.). Dalším ovlivňujícím faktorem vnímání hypoglykemie je i rychlost jejího rozvoje.
Table 2. Pokles glykemie a aktivace kontraregulačních hormonů. Upraveno dle (6, 11) 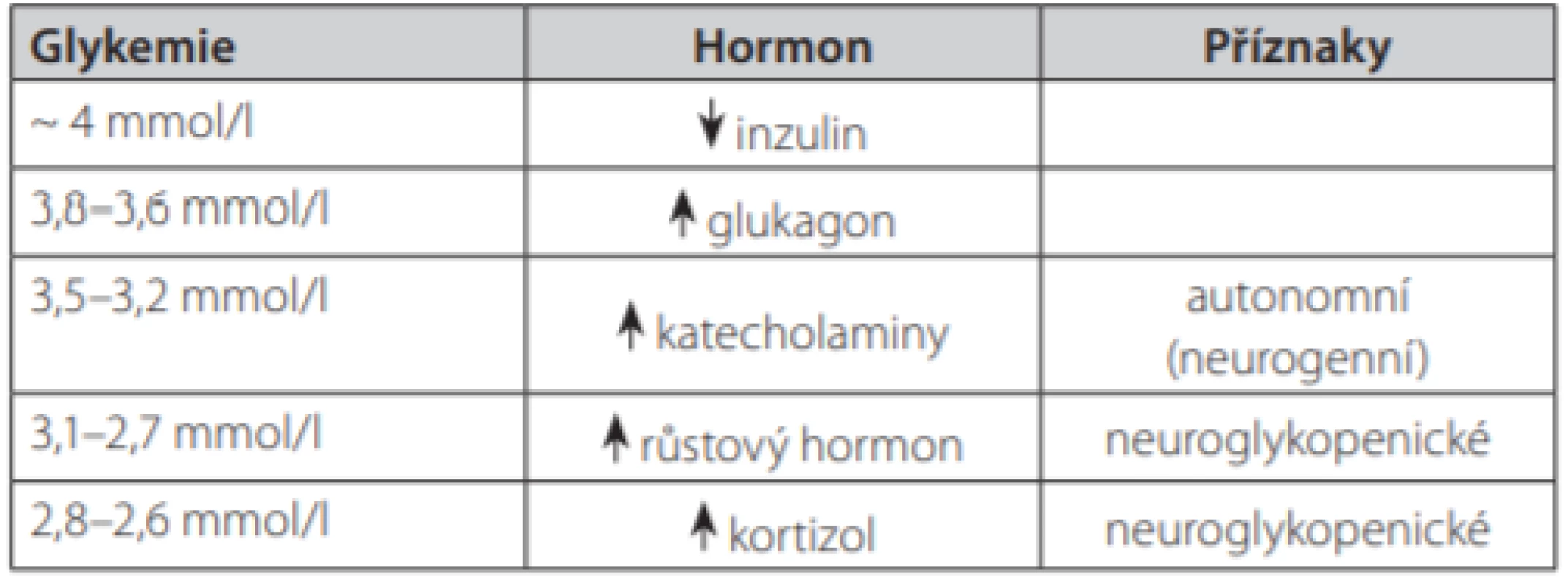
V každodenní praxi se často můžeme setkat s pacienty, kteří mají vyjádřeny autonomní a někdy i neuroglykopenické symptomy ustupující po jídle, u kterých ale nelze doložit pokles plazmatické hladiny krevního cukru. Tyto pacienty tedy nelze považovat za pacienty trpící skutečnou hypoglykemií, protože nesplňují všechna Whippleova kritéria (1). Nízké hodnoty glykemie, zjištěné při měření kapilární krve osobními glukometry nebo pomocí senzoru pro kontinuální monitoring (měřicí glykemii v intersticiální tekutině), mohou vznést podezření na stavy spojené s hypoglykemií, avšak pro potvrzení diagnózy je nutný odběr žilní krve. Při záchytu nízké hodnoty glykemie u asymptomatického pacienta je žádoucí odběr opakovat, zajistit okamžité zpracování v laboratoři a při potvrzení hypoglykemie dále postupovat dle doporučeného schématu (Schéma 1.).
Schéma 1. Diferenciálně diagnostické schéma přístupu k pacientovi s hypoglykemií. Upraveno dle (11, 18, 19) 
Zkratky: PAD – perorální antidiabetika, I – inzulin, C-P – C-peptid, DS – drug screen - vyšetření hladin léků, IGF *- inzulinu podobné růstové faktory (zahrnuje – pro-IGF-II, volné IGF-II, poměr IGF-II/IGF-I), IAS – Inzulinový autoimunitní syndrom – „Hiratova nemoc”, TAS – nádorový autoimunitní syndrom, A – protilátky proti inzulinu (přítomnost protilátek proti inzulinu [IAS, Hiratova nemoc] nebo protilátek proti inzulinovému receptoru [typ B inzulinové rezistence]). – zvýšení, – snížení, + přítomny, - nepřítomny, N – v normě Dělení hypoglykemických příhod
Patofyziologicky můžeme hypoglykemické stavy rozdělit na stavy se zvýšenou utilizací glukózy (často inzulinem mediovanou) a na stavy se sníženou tvorbou glukózy. Upravené rozdělení dle prof. Škrhy je uvedeno v tabulce 3. Další časté dělení hypoglykemických příhod je dle vztahu k příjmu jídla, tedy na hypoglykemii lačnou a postprandiální (Tab. 4.). Toto rozdělení nemusí být vždy zcela spolehlivé, protože oba typy hypoglykemií se mohou vyskytovat v rámci jediné diagnózy. Např. review sledující 237 pacientů s inzulinomem zaznamenalo lačnou hypoglykemii u 73 % pacientů, postprandiální u 6 % a kombinaci obou typů vykazovalo 21 % pacientů (3).
Table 3. Patofyziologické rozdělení hypoglykemických příhod. Upraveno dle (11) 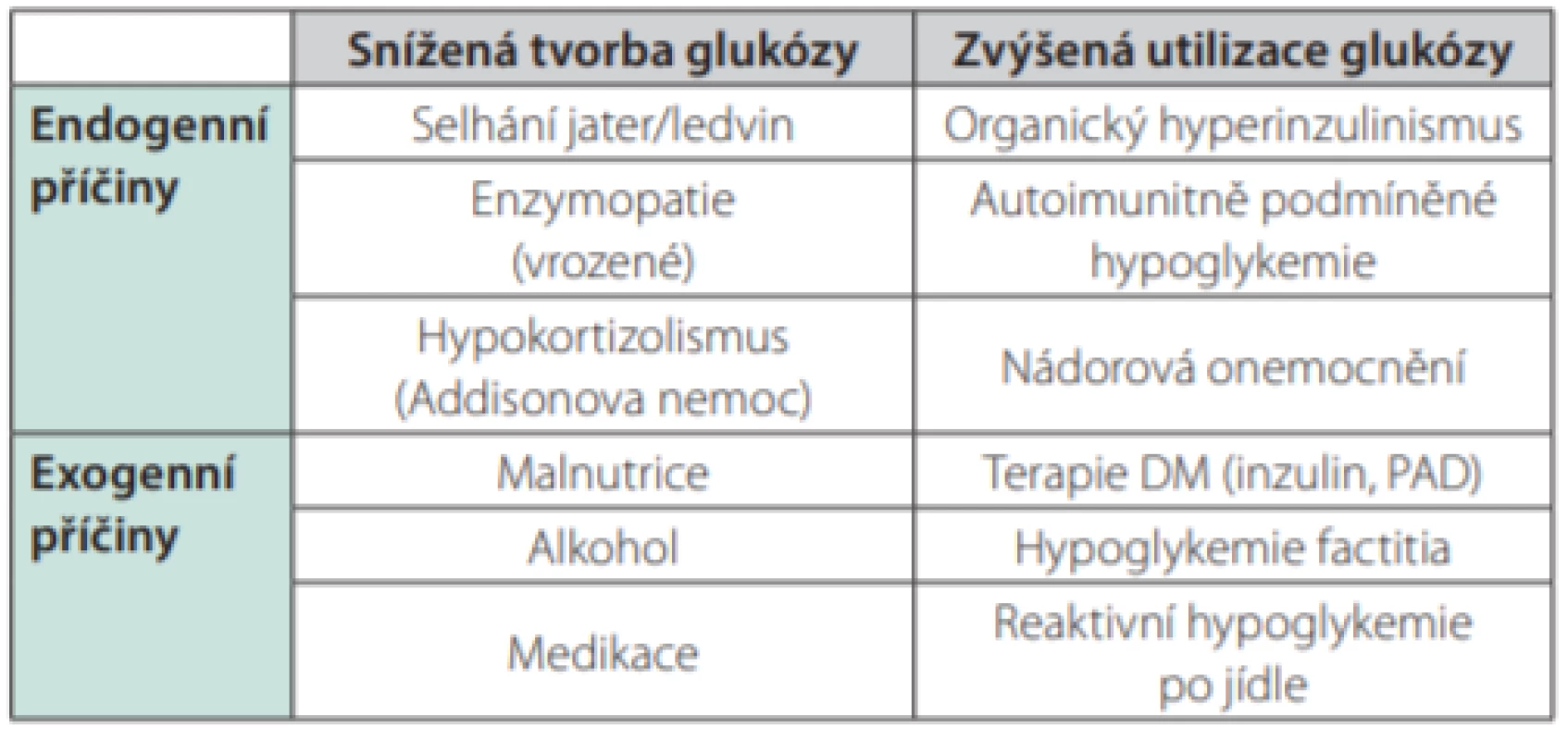
Table 4. Časové rozdělení hypoglykemie 
Americká endokrinologická společnost ve svém doporučeném postupu rozděluje hypoglykemické příhody na příhody u pacientů zdravých („seemingly well“) a příhody u pacientů nemocných/léčených („ill/medicated“), což lze také chápat jako potíže ambulantních anebo hospitalizovaných pacientů (4). V klinické praxi musíme zejména u hospitalizovaných pacientů vyloučit záměnu vzorku či medikace.
Prakticky nejpoužívanější je rozdělení na hypoglykemické příhody u diabetiků a nediabetiků. Diferenciální diagnostika u nemocných léčených inzulinem nebo hypoglykemizujícími léky není zpravidla náročná. U dosud dobře kompenzovaných diabetiků s nově vzniklými hypoglykemiemi bychom však neměli zapomínat na možnost lékové interakce, snížení funkce ledvin, zvýšeného příjmu alkoholu, vzniku inzulinomu nebo jiné endokrinopatie navozující hypoglykemii (např. hypokortizolemii).
Jedná‑li se naopak o nemocného, který nepřichází do styku s jednoznačně hypoglykemizujícími léky, může být diferenciálně diagnostický proces záludný a náročný, proto je součástí tohoto textu navržené diferenciálně diagnostické schéma (Schéma 1.).
Vyšetření pacienta s hypoglykemií
V osobní anamnéze zvažujeme věk primomanifestace poruchy k vyloučení vrozených poruch metabolismu (např. kongenitální hyperinzulinismus), dále bychom měli posoudit, zda se jedná o dosud zdravého pacienta, anebo pacienta s chronickou chorobou, zejména DM (diabetes mellitus). Cíleně se ptáme na četnost hypoglykemických příhod, jejich výskyt během dne a vztah ke konzumaci jídla (nalačno či postprandiálně). V případě výskytu hypoglykemie s projevy neuroglykopenie v ranních hodinách u dosud zdravého a lačného pacienta je zvažován organický hyperinzulinismus. U postprandiálních hypoglykemií musíme zhodnotit složení jídla (zejména obsah jednoduchých „rychlých“ cukrů) a event. i příjem alkoholu. Důležitý je podrobný rozbor farmakologické anamnézy. Léky spojené s možným rozvojem hypoglykemie jsou uvedeny v tabulce 5. (4).
Table 5. Hypoglykemizující medikace s uvedením kvality důkazu. Upraveno dle (4). Tabulka neuvádí léčiva nedostupná v ČR. 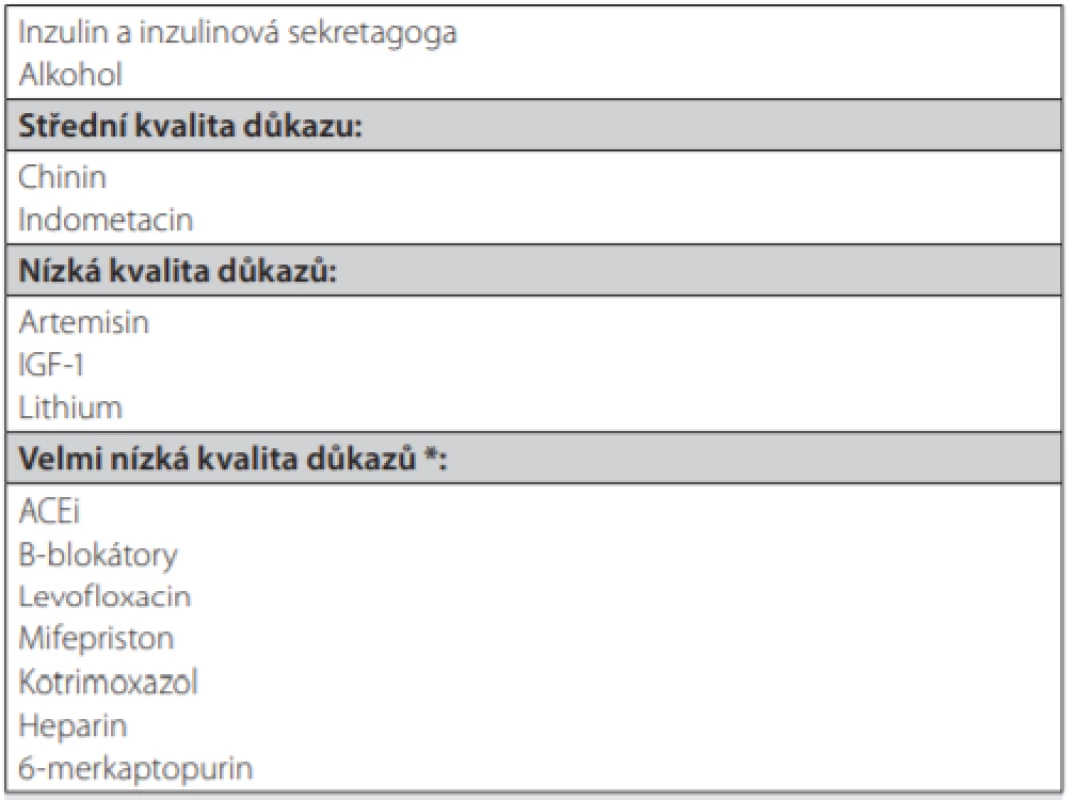
*léky s více než 25 případy prokázaných hypoglykemií Při fyzikálním vyšetření pátráme zejména po změnách v objektivním nálezu, typických pro onemocnění jater či ledvin, chronický alkoholismu, Addisonově chorobě nebo onemocnění štítné žlázy.
Dle podezření na konkrétní etiologii hypoglykemie volíme laboratorní vyšetření, funkční testy a event. zobrazovací vyšetření. U zdravých pacientů („seemingly well“) je pro komplexní diferenciální diagnostiku dle uvedeného schématu vhodné stanovení glykemie, inzulinu, C‑peptidu, proinzulinu, beta‑hydroxybutyrátu (ketolátek) a sérových hladin perorálních antidiabetik (toxikologie). Těmito odběry by měla být odlišena endogenní a exogenní hyperinzulinemie od ostatních příčin hypoglykemie. Dále lze diferenciálně diagnosticky stanovit protilátky proti inzulinu a inzulinovému receptoru k vyloučení autoimunitní etiologie hypoglykemie.
Hypoglykemie u diabetiků
V naprosté většině případů vzniká hypoglykemie právě v důsledku absolutního či relativního nadbytku inzulinu při terapii inzulinem nebo perorálními antidiabetiky (deriváty sulfonylurey, glinidy). Rizikové pro vznik hypoglykemie i u dosud dobře kompenzovaného diabetika jsou situace spojené s vynecháním/opožděním pravidelné stravy, požitím menší porce potravy, poklesem glomerulární filtrace (dehydratace) nebo abnormální fyzickou námahou. Některé lékové interakce, zejména derivátů sulfonylurey (SU) s např. ACE inhibitorem, mohou prohlubovat hypoglykemický efekt derivátů SU.
U diabetiků je hypoglykemie závažným nežádoucím účinkem léčby, a proto pro její hodnocení, zejména v souvislosti s klinickými studiemi nových léčiv, vznikly zvláštní definice a rozdělení (využívané zejména regulačními autoritami) (5, 6). Jejich podrobný výčet je nad rámec této publikace, uvádíme pouze přehlednou tabulku (Tab. 6.).
Table 6. Rozdělení hypoglykemií u diabetiků dle Americké diabetologické společnosti (20) 
Hypoglykemie u nediabetiků
Hypoglykemie u nediabetiků je vzácný symptom s širokou paletou příčin. V retrospektivní studii, hodnotící 37898 pacientů bez DM neakutně přijatých do nemocnice, byla incidence hypoglykemie (glykemie pod 3mmol/l) 36 : 10000 (7). Klinické projevy hypoglykemie se neliší u diabetiků a nediabetiků, nicméně nediabetici obvykle příznaky hypoglykemie neznají, a proto nejsou schopni tyto stavy, které se mohou opakovat, přesně popsat. Často musíme pro odběr správné anamnézy využít informace od rodinných příslušníků. Hypoglykemie u nediabetiků bývají spíše méně závažné a jen vzácně způsobují trvalé neurologické postižení (8).
Léky
Medikace je nejčastější příčinou hypoglykemie a nebývá snadné diabetikovi prokázat zneužití inzulinu či PAD (perorální antidiebetikum) k navození hypoglykemie, ať už z psychologicko‑psychiatrických, nebo zištných důvodů (tzn. hypoglycemia facticia). Obvykle se jedná o zdravotnické pracovníky, kteří mají přístup k medikaci a chápou princip jejího použití (zneužití). K průkazu nám může pomoci toxikologické stanovení léků (případně jejich metabolitů) v krvi/moči, určení poměru hladiny sérového inzulinu k C‑peptidu (typicky vysoká hladina inzulinu a nízký C‑peptid) (4).
Z léků, které mají uvedeny hypoglykemii jako nežádoucí účinek v SPC, jsou nejčastěji zmiňovány chinolony, chinin, beta‑blokátory a ACEi (4). Chinin a artemisin jsou léčiva používaná k léčbě malárie, kde hypoglykemie vzniká pravděpodobně v důsledku kombinací těchto léků a zvýšené spotřeby glukózy Plasmodiem. Již výše byla uvedena interakce mezi deriváty SU a ACEi, možnost rozvoje hypoglykemie pouze při medikaci ACEi je sporná. Léčba beta‑blokátory je v popředí zájmu zejména u pacientů s DM, kde se můžou podílet na vzniku hypo i hyperglykemie. Hypoglykemické příhody byly popsány zejména u neselektivních beta‑blokátorů, použití selektivních beta‑blokátorů vedlo ke snížení incidence hypoglykemie u pacientů léčených inzulinem. Při medikaci beta‑blokátorů je dále uváděno prodloužení doby nutné k restituci normoglykemie po proběhlé hypoglykemické příhodě (9).
Vzhledem k obecně stárnoucí populaci musíme vzít v úvahu také již často premorbidně sníženou funkci jater a ledvin, dehydrataci a další chronické nemoci, které zvyšují pravděpodobnost vzniku nežádoucích účinků léků.
Alkohol
V podmínkách akutního přijmu/LSPP jsou časté hypoglykemie v důsledku většího alkoholového excesu často kombinovaného se sníženým příjmem potravy. Hypoglykemie je v tomto konkrétním případě důsledkem inhibice jaterní glukoneogeneze. Vyšší příjem alkoholu je pro léčené diabetiky rizikovým, protože snižuje jejich schopnost vnímat hypoglykemii a adekvátně na ni reagovat.
Kritické stavy
Pro vznik hypoglykemie v život ohrožujících stavech jsou nezávislými rizikovými faktory sepse, DM a nutnost mechanické ventilace, a to zejména u pacientů s preexistujícím chronickým renálním, jaterním nebo srdečním selháním (10). Hypoglykemie vzniká jako důsledek deplece zásob glykogenu a inhibice glukoneogeneze zánětlivými cytokiny.
Porucha výživy
Hypoglykemie může být přítomna i u pacientů s nedostatečnou glukoneogenezí, jak pro reálný nedostatek živin, tak u pacientů odmítajících stravu.
Reaktivní hypoglykemie po jídle
S touto formou hypoglykemie se můžeme setkat u pacientů po operacích žaludku, jedná se o formu dumping syndromu a správnou diagnózu je esenciální správný odběr anamnézy. Jako „nepravou“ postprandiální hypoglykemii či pseudohypoglykemii označujeme klinicky relativně častý stav, který však nenaplňuje klasické podmínky Whippleho trias (11). Obvykle po izolovaném požití velmi sladké potraviny (čokoláda) dojde k vyplavení inzulinu a i malý pokles glykemie vede k opravdu zřetelným adrenergním příznakům (tachykardie, pocení, slabost až pocit na omdlení), avšak hladina glykemglykemie zůstává v normě. Těmto stavům se dá obvykle předcházet změnou jídelníčku.
Deficit kortizolu – Addisonova nemoc
Vyhodnocení hladiny kortizolu u pacienta s prokázanou hypoglykemií je esenciální, protože nediagnostikovaný hypokortizolismus může pacienta potenciálně ohrozit na životě. U již diagnostikovaných Addisoniků může být Addisonská krize doprovázena hypoglykemií, a proto je nutné nejen navýšit substituční dávku hydrocortisonu, ale také zajistit pacienta proti hrozící hypoglykemii (12).
Nádorová hypoglykemie
Hypoglykemie vznikající čistě na podkladě nádorového onemocnění je vzácná, častěji se může jednat o akumulaci rizikových faktorů u polymorbidního nemocného. I zde je pro její správnou léčbu nezbytná správná diagnóza. Patofyziologicky může být nádorová hypoglykemie zprostředkována několika mechanismy: může mít podobu inzulárního či neinzulárního tumoru, vznikat v důsledku autoimunitní nadprodukce protilátek (nejčastěji proti inzulinovému receptoru), výrazné metabolické aktivity tumoru nebo nádorové destrukce jater či nadledvin (Tab. 7.) (13).
Table 7. Patofyziologické rozdělení příčin nádorové hypoglykemie. Upraveno dle (18) 
V případě inzulárního tumoru (inzulinomu, nebo jeho nenádorové varianty nesidioblastózy) je hypoglykemie způsobena nadprodukcí inzulinu (14). V diagnostice používáme test lačněním (hladový test), ve kterém sledujeme v pravidelných intervalech hladiny – glykemie, inzulinu, C‑peptidu a kortizolu. Průkaz inzulinomu spočívá v doložení hypoglykemie s vysokou hladinou C‑peptidu (inzulinu). Dalším krokem je morfologický průkaz inzulinomu. Lze začít CT nebo MR pankreatu, v poslední době často volíme spíše endosonografii pankreatu s možností biopsie případného tumoru. Pro odhalení nesidioblastózy – hypertrofie/hyperplazie pankreatických beta buněk, je k dispozici selektivní angiografie se stimulací sekrece inzulinu podáním kalcia. Výkon se provádí jen vzácně, a to z důvodů jeho extrémní náročnosti na logistiku a techniku provedení.
V některých případech nádorové hypoglykemie není etiologickým původcem inzulin, ale jeho strukturálně podobný polypeptid – Somatomedin A, známý také jako insulin‑like growth factor II (IGF‑II) (13). Předpokládaným mechanismem působení je zejména inhibice glykogenolýzy a glukoneogeneze. Hypoglykemie vzniklá u neinzulárního tumoru se nazývá Doege‑Potteruv syndrom s incidencí přibližně jednoho případu na milion obyvatel. Tento typ hypoglykemie byl popsán u mezenchymálních tumorů, fibromů, karcinoidu, myelomu, lymfomu, hepatocelulárního a kolorektálního karcinomu (15).
Feochromocytom – nádor dřeně nadledviny – ovlivňuje komplexně glukózovou homeostázu. Katecholaminy, zejména noradrenalin, stimulují α2 adreno‑receptory, čímž inhibují sekreci inzulinu a zvyšují inzulinovou rezistenci, může tedy docházet k hyperglykemii (16). Na druhou stranu byly popsány i případy zvýšeného uvolňování inzulinu stimulací β2 adreno‑receptorů (17).
Nádorovou hypoglykemglykemii zprvu léčíme podáním glukózy, mine‑li se léčba účinkem (vzhledem k jinému mechanismu vzniku), zahraniční literatura doporučuje v ČR nedostupný glukagon i.v. (18). V našich podmínkách by bylo možné zvolit kombinaci glukokortikoidů s růstovým hormonem.
Závěr
Hypoglykemický stav je běžná klinická situace, vyžadující správnou diagnostickou rozvahu a následnou promptní léčbu. Opomenutí či nedostatečné došetření příčiny hypoglykemie může vést k její recidivě se závažnými zdravotními důsledky.
Podpořeno: Granty MZ ČR 17-31847 A a MZČR – RVO (FNOL, 00098892)
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Jan Schovánek Ph.D.,
III. interní klinika – nefrologická, revmatologická a endokrinologická,
Fakultní nemocnice Olomouc a Lékařská fakulta Univerzity Palackého v Olomouci,
I. P. Pavlova 6,
779 00 Olomouc
Cit. zkr: Vnitř Lék 2020; 66(2): 129–133
Článek přijat redakcí: 17. 12. 2019
Článek přijat k publikaci: 5. 3. 2020
Sources
1. Surgery ISo. Journal International de Chirurgie1938.
2. Cryer PE. Hypoglycemia, functional brain failure, and brain death. The Journal of clinical investigation. 2007;117(4):868-70. Epub 2007/04/04.
3. Placzkowski KA, Vella A, Thompson GB, Grant CS, Reading CC, Charboneau JW, et al. Secular trends in the presentation and management of functioning insulinoma at the Mayo Clinic, 1987–2007. The Journal of clinical endocrinology and metabolism. 2009; 94(4): 1069–1073. Epub 2009/01/15.
4. Cryer PE, Axelrod L, Grossman AB, Heller SR, Montori VM, Seaquist ER, et al. Evaluation and management of adult hypoglycemic disorders: an Endocrine Society Clinical Prac ‑ tice Guideline. The Journal of clinical endocrinology and metabolism. 2009; 94(3): 709 – 728. Epub 2008/12/18.
5. Seaquist ER, Anderson J, Childs B, Cryer P, Dagogo‑Jack S, Fish L, et al. Hypoglycemia and diabetes: a report of a workgroup of the American Diabetes Association and the Endocrine Society. The Journal of clinical endocrinology and metabolism. 2013; 98(5): 1845 – 1859. Epub 2013/04/17.
6. Glucose Concentrations of Less Than 3.0 mmol/L (54 mg/dL) Should Be Reported in Clinical Trials: A Joint Position Statement of the American Diabetes Association and the European Association for the Study of Diabetes. Diabetes care. 2017; 40(1): 155–157. Epub 2016/11/23.
7. Nirantharakumar K, Marshall T, Hodson J, Narendran P, Deeks J, Coleman JJ, et al. Hypoglycemia in non‑diabetic in‑patients: clinical or criminal? PloS one. 2012; 7(7): e40384. Epub 2012/07/07.
8. Service FJ, Cryer PE, Vella A. Hypoglycemia in adults without diabetes mellitus: Clinical manifestations, diagnosis, and causes. UpToDate, Waltham, MA. (Accessed on June 13, 2019): UpToDate; 2019.
9. Dungan K, Merrill J, Long C, Binkley P. Effect of beta blocker use and type on hypoglycemia risk among hospitalized insulin requiring patients. Cardiovascular diabetology. 2019; 18(1): 163. Epub 2019/11/30.
10. Krinsley JS, Grover A. Severe hypoglycemia in critically ill patients: risk factors and out‑comes. Critical care medicine. 2007; 35(10): 2262–2267. Epub 2007/08/25.
11. Skrha J. Hypoglykemie : od patofyziologie ke klinické praxi. Praha: Maxdorf; 2013.
12. Bornstein SR, Allolio B, Arlt W, Barthel A, Don‑Wauchope A, Hammer GD, et al. Diagnosis and Treatment of Primary Adrenal Insufficiency: An Endocrine Society Clinical Practice Guideline. The Journal of clinical endocrinology and metabolism. 2016; 101(2): 364 – 389. Epub 2016/01/14.
13. Schovanek J, Cibickova L, Ctvrtlik F, Tudos Z, Karasek D, Iacobone M, et al. Hypoglycemia as a Symptom of Neoplastic Disease, with a focus on Insulin‑like Growth Factors Producing Tumors. Journal of Cancer. 2019; 10(26): 6475–6480. Epub 2019/11/30.
14. Service FJ, Vella A. Insulinoma. In: Post T, editor. UpToDate. UpToDate, Waltham, MA. (Accessed on July 19, 2018)2018.
15. de Groot JW, Rikhof B, van Doorn J, Bilo HJ, Alleman MA, Honkoop AH, et al. Non‑islet cell tumour‑induced hypoglycaemia: a review of the literature including two new cases. Endocrine‑related cancer. 2007; 14(4): 979–993. Epub 2007/11/30.
16. Wiesner TD, Bluher M, Windgassen M, Paschke R. Improvement of insulin sensitivity after adrenalectomy in patients with pheochromocytoma. The Journal of clinical endocrinology and metabolism. 2003; 88(8): 3632–3636. Epub 2003/08/14.
17. Cerasi E, Effendic S, Luft R. Role of adrenergic receptors in glucose‑induced insulin secretion in man. Lancet. 1969; 2(7615): 301–302. Epub 1969/08/09.
18. Iglesias P, Diez JJ. Management of endocrine disease: a clinical update on tumor‑induced hypoglycemia. European journal of endocrinology. 2014; 170(4): R147–157. Epub 2014/01/25.
19. Service FJ, Vella A, Hirsch IB, Mulder JE. Nonislet cell tumor hypoglycemia. UpToDate, Waltham, MA. (Accessed on June 13, 2019): UpToDate; 2018.
20. Seaquist ER, Anderson J, Childs B, Cryer P, Dagogo‑Jack S, Fish L, et al. Hypoglycemia and diabetes: a report of a workgroup of the American Diabetes Association and the Endocrine Society. Diabetes care. 2013; 36(5): 1384–1395. Epub 2013/04/17.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 2-
All articles in this issue
- Incretin-based treatment of diabetes and cardiovascular complications
- The position of SGLT2 inhibitors in current medicine
- Obesity and cardiovascular disease
- Diabetic foot
- Diosmin/hesperidin: a cooperating tandem, or is diosmin crucial and hesperidin an inactive ingredient only?
- Blood vessel ageing and vascular memory
- Clinical aspects of epicardial fat deposition
- Adipocytokines and thyreopathies
- Thymoma – diagnostics options
- Clostridium difficile Infection: an update on treatment and prevention
- Hypoxemia/hypoxia and new concepts of oxygen therapy in intensive care
- Celiac disease in adults
- Cushing’s syndrome and acromegaly based on picoadenoma of the pituitary gland
- Inherited C2-complement deficiency: variable clinical manifestation (case reports and review)
- Differential diagnosis of hypoglycemia
- What is new for internists in ESC guidelines on diabetes?
- Diabetes a kardiovaskulární onemocnění
- Epidemiologie infekcí vyvolaných Clostridium difficile (CDI) v České republice
- Extraintestinální projevy celiakie
- RECENZE KNIHY ÚVOD DO VNITŘNÍHO LÉKAŘSTVÍ – doc. MUDr. Jitka Mlíková Seidlerová, Ph.D., a kol.
- Pioglitazone
- Relation between testosterone levels and body composition, physical functioning and selected biochemical parameters in adult males
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Differential diagnosis of hypoglycemia
- Hypoxemia/hypoxia and new concepts of oxygen therapy in intensive care
- Thymoma – diagnostics options
- Diosmin/hesperidin: a cooperating tandem, or is diosmin crucial and hesperidin an inactive ingredient only?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

