-
Medical journals
- Career
Celiakie dospělých
Authors: Zuzana Vacková
Authors‘ workplace: II. interní klinika Fakultní nemocnice Plzeň
Published in: Vnitř Lék 2020; 66(2): 116-120
Category: Case Report
Overview
Celiakie je celoživotní, autoimunitní onemocnění, vyskytující se u geneticky predisponovaných osob při konzumaci lepku. Její prevalence se pohybuje kolem 1 % populace a zastoupení žen je 2–3× častější. Celiakie je jednou z nejčastějších příčin malabsorpce, její projevy však mohou být značně rozmanité – od zcela asymptomatických po plně rozvinutý malabsorpční syndrom. Častým nálezem u dospělých jsou zejména extraintestinální projevy. Zlatým standardem diagnostiky je sérologický průkaz specifických protilátek (proti tkáňové tranglutamináze ve třídě IgA) v kombinaci s charakteristickým histologickým nálezem z biopsie duodena. Kauzální léčbou je celoživotní bezlepková dieta. Při jejím striktním dodržování snížíme riziko závažných komplikací (např. T‑lymfom tenkého střeva).
V následujícím sdělení předkládáme kazuistiku 58leté pacientky, u které byla stanovena diagnóza celiakie v tomto věku na základě dominantně neklasických příznaků – konkrétně mnohočetných patologických fraktur při metabolické kostní chorobě z malabsorpce kalcia a vitaminu D s následnou sekundární hyperparathyreózou.
Klíčová slova:
bezlepková dieta – celiakie – Gluten – malabsorpce
Úvod
Celiakie (glutensenzitivní enteropatie) je celoživotní systémové onemocnění, způsobené autoimunitní reakcí u geneticky predisponovaných osob při konzumaci lepku. V současné době se manifestuje celiakie u 1 % populace na světě, zastoupení žen je 2–3× častější. Incidence v Evropě je udávána od 0,1 do 3,7/1000 živě narozených za rok a pro dospělou populaci 1,3–3,9/100000 za rok (1). Celiakie se může vyskytnout v jakémkoli věku, v časném dětství i u starších osob. Některé práce uvádějí, že počátek onemocnění má dva vrcholy výskytu – v prvních dvou letech života a následně ve druhé až třetí dekádě života (2). V patogenezi onemocnění se uplatňuje genetická predispozice s autozomálně dominantní dědičností a inkompletní penetrancí. S celiakií jsou asociovány ty geny lokalizované na 6. chromozomu, které kódují antigeny histokompatibility II. třídy – konkrétně HLA‑DQ2 a HLA‑DQ8 (3). Geny HLA‑DQ2 a HLA‑DQ8 se vyskytují u 99 % celiaků a bílkovinným produktem těchto genů jsou povrchové glykoproteiny, které jsou lokalizovány na enterocytech a buňkách imunitního systému sliznice tenkého střeva a fungují jako vysoce aktivní receptory antigenních peptidů, vzniklých štěpením lepku digestivními proteázami (4). Enzym tkáňová transglutamináza se vyskytuje ve všech buňkách, jak intracelulárně (intracytoplazmaticky), tak extracelulárně, a má pleiotropní funkce (mimo jiné je jeho úlohou deamidace glutenových peptidů) v buňkách střevní sliznice. Gliadin (bílkovinná frakce lepku) je prezentován ve spojení s příslušnými HLA antigeny II. třídy na povrchu antigen prezentujících buněk pomocným T lymfocytům. Stimulované lymfocyty poté spouštějí kaskádu zánětlivé reakce, uvolňují prozánětlivé cytokiny a aktivují další T lymfocyty, B lymfocyty a NK buňky. Tímto dochází k nekontrolovanému zánětu, na jehož konci stojí infiltrace střevní sliznice mononukleárními buňkami, hyperplazie krypt a atrofie klků (5, 6).
Podle míry klinických projevů klasifikujeme celiakii do čtyř forem – symptomatickou (klasickou a neklasickou), subklinickou (asymptomatickou), potencionální a refrakterní (5). Klasická forma zahrnuje symptomy malabsorpce (steatoreu, průjmy, nechutenství, úbytek na váze), histologický nález atrofie klků a vymizení slizničních lézí a symptomů onemocnění po vynechání potravin s obsahem lepku. Typickým nálezem je také vždy pozitivita protilátek proti tkáňové transglutamináze.
Neklasická forma se projevuje především mimostřevními potížemi – např. metabolickou kostní chorobou, hypochromní anémií (hlavním místem vstřebávání železa je orální jejunum), Duhringovou herpetiformní dermatitidou, infertilitou, depresemi, únavou (1). U těchto pacientů bývá nalézána atrofie klků v biopsii z duodena a opět vždy pozitivní protilátky proti tkáňové transglutamináze (5).
Celiakie se ve své subklinické formě může projevit velmi mírnými a nespecifickými příznaky, jako je hraniční deficience železa, nevysvětlitelná elevace sérových aminotransferáz nebo únava. Opět nalézáme pozitivní protilátky proti tkáňové transglutamináze a atrofii duodenálních klků v histologickém obraze (5).
Potencionální celiakie se vyznačuje buď pozitivními protilátkami s normálním histologickým nálezem z duodena, anebo intraepiteliální lymfocytózou v histologickém obraze s absencí autoprotilátek (5).
Refrakterní celiakie zahrnuje situace, kdy příznaky celiakie přetrvávají i po zavedení bezlepkové diety více než jeden rok. Příčinou bývá ve většině případů konzumace stopového množství lepku. Nejsou výjimkou ani případy, kdy malabsorbční syndrom přetrvává navzdory přísné bezlepkové dietě (příčinou pak mohou být jiné malabsorpční syndromy či maligní onemocnění) (1, 5).
Četnost výskytu klinických příznaků zobrazuje Graf 1.
Graph 1. Prevalence klinických příznaků celiakie u dospělých. Upraveno podle (2) 
Diagnóza celiakie dospělých se opírá o přítomnost klinických příznaků (a jejich odpovědi na bezlepkovou dietu), stanovení hladin protilátek a výsledky biopsie z aborálního duodena. U pacientů s nízkou pravděpodobností celiakie (s němou rodinnou anamnézou stran celiakie, bez příznaků malapsorpce) stanovujeme hladinu příslušných protilátek – nejčastěji protilátky proti tkáňové transglutamináze ve třídě IgA (Anti‑tTG IgA) a celkové IgA v séru (v případě prokázaného IgA deficitu pak stanovujeme protilátky proti tkáňové transglutamináze ve třídě IgG). Alternativou je stanovení hladin protilátek proti endomysiu (Anti‑EMA IgA). Negativita protilátek představuje vysokou negativní prediktivní hodnotu (pacienti již nepotřebují enterobiopsii), pacienti s pozitivitou protilátek by měli podstoupit ezofagogastroduodenoskopii s biopsií z aborálního duodena.
U pacientů s vysokou pravděpodobností celiakie (nemocní s příznaky malabsorpce či nemocní s gastrointestinálními nebo extrain ‑ testinálními příznaky) by měly být stanoveny protilátky proti tkáňové transglutamináze ve třídě IgA (spolu s hladinou celkového IgA v séru). U pacientů s deficitem IgA stanovujeme Anti‑tTG IgG a protilátky proti deamidovaným gliadinovým peptidům – DGP‑IgG (7).
Před stanovením protilátek či před provedením biopsie z tenkého střeva je nezbytné, aby byl pacient dostatečně zatížen lepkem ve stravě a nedodržoval bezlepkovou dietu!
Enterobiopsie z duodena může poskytnout rozličný histologický obraz (hodnocen podle tzv. Marshovy klasifikace, za histologický nález slučitelný s celiakií je považováno stadium Marsh 2 a více). Hlavním nálezem bývá atrofie klků, hyperplazie krypt a zvýšený počet intraepiteliálních lymfocytů (8).
V případě nejistých diagnóz (při diskrepanci mezi výsledkem stanovených protilátek a histologií) se jako pomocná metoda užívá genetické vyšetření – určení HLA‑DQ2/ DQ8. Pozitivita genetického vyšetření je však velmi nespecifická a pro diagnózu celiakie nemá velký význam. Ve skutečnosti znamená přítomnost HLA‑DQ2/ DQ8 (s ohledem na častý výskyt i u zdravé populace) jen přítomnost zvýšeného genetického rizika. Jedině negativita genetického vyšetření poskytuje 99% pravděpodobnost, že se o celiakii nejedná (9).
Celiakie je často asociována s Duhringovou herpetiformní dermatitidou, Downovým syndromem a selektivním IgA deficitem. Dále ji často vídáme v souvislosti s autoimunitními chorobami – diabetem mellitem 1. typu, autoimunitní thyreopatií, Addisonovou chorobou, primární biliární cholangoitidou, primární sklerozující cholangitidou, autoimunitní hepatitidou, Sjögrenovým syndromem, systémovým lupusem, sarkoidózou, glutenovou ataxií a řadou dalších (4). Cílený screening celiakie se provádí u přesně definovaných cílových skupin, u nichž lze předpokládat vyšší výskyt jedinců s nepoznanou celiakií. V České republice je screening celiakie dán Metodickým pokynem Ministerstva zdravotnictví ČR z roku 2011 (Tab. 1.). Vyšetření dle Metodického pokynu je dvoustupňové a spočívá ve stanovení protilátek proti tkáňové transglutamináze ve třídě IgA a celkového IgA v séru (při jeho deficitu, pak následuje stanovení protilátek proti tkáňové transglutamináze ve třídě IgG), a v případě pozitivity protilátek pak v provedení enterobiopsie z aborálního duodena (10).
Table 1. Metodický pokyn Ministerstva zdravotnictví ČR z roku 2011 pro screening celiakie. Upraveno podle (10) 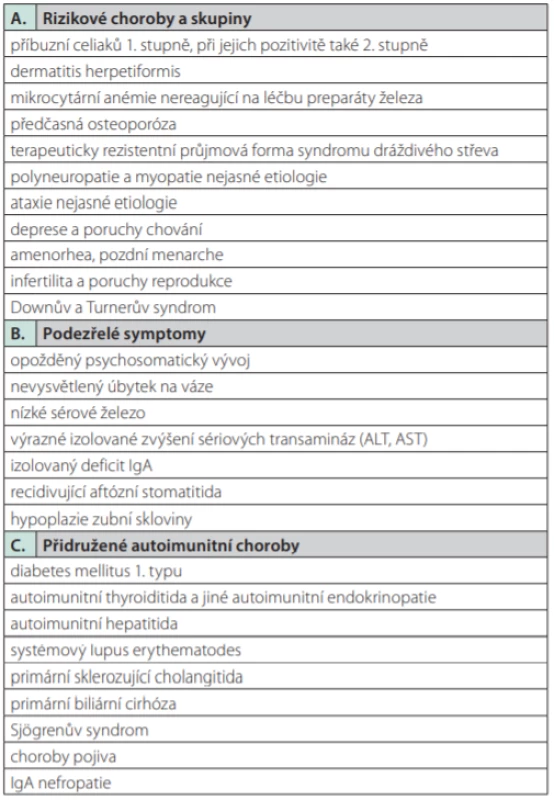
U celiaků bylo zaznamenáno vyšší celkové riziko vzniku malignity než u běžné populace. Zejména byl pozorován vyšší výskyt tumorů gastrointestinálního traktu – tumorů orofaryngeální oblasti (především dlaždicobuněčného karcinomu jícnu), adenokarcinomu tenkého střeva, kolorektálního a hepatocelulárního karcinomu. Vyšší incidence byla též zaznamenána u nehodginských B‑lymfomů. Přibližně polovinu všech malignit celiaků představuje prognosticky závažný T‑lymfom tenkého střeva (lymfom z intraepiteliálních T‑lymfocytů). Celková incidence lymfomů je odhadována na 8–10 % (1, 11).
Jedinou kauzální léčbou celiakie je striktní bezlepková dieta. Obecnou zásadou bezlepkové diety je vyřazení potravin z jídelníčku s obsahem pšenice, žita a ječmenu. Naopak bezpečnou náhradou je sója, rýže, kukuřice, pohanka či brambory. Oves není zcela vyloučen, ale smí jej konzumovat jedině celiaci v klinické a sérologické remisi onemocnění (12). Limit obsahu lepku pro potraviny, označené jako bezlepkové, je v ČR 20mg/kg. To znamená, že potraviny se stopovým množstvím lepku (definovaným množstvím lepku do 50mg/kg) mohou více než dvojnásobně překračovat limit pro bezlepkovou potravinu (13)!
Kontrola celiaka se zpravidla provádí po 6 měsících. Měl by být zkontrolován krevní obraz, kyselina listová, vitamin B 12, parametry metabolismu železa, jaterní testy a hladina protilátek – nejčastěji protilátek proti tkáňové transglutamináze ve třídě IgA. Normalizace hladiny protilátek je obyčejně dosaženo po třech až dvanácti měsících bezlepkové diety (14). Striktní adherence k bezlepkové dietě vede k částečné či kompletní reparaci duodenální sliznice s vymizením příznaků malabsorpce. Reparace duodenální sliznice však trvá u dospělých delší dobu než u dětí, a bývá častěji inkompletní.
Kazuistika
58letá pacientka (169 cm, 69 kg) byla přivezena záchrannou službou na chirurgickou ambulanci po pádu na pravé rameno. Anamnesticky byla nemocná po hysterektomii (bez adnexektomie) pro uterus myomatosus ve 39 letech a před třemi lety prodělala frakturu obratle C7, jiné nemoci neměla. Chronicky neužívala žádnou medikaci. Na chirurgii udávala bolesti pravé klíční kosti a kostrče, současně si stěžovala na váhový úbytek 20 kg za posledních šest měsíců s občasnou průjmovitou stolicí. Objektivně byla nemocná astenického habitu, s četnými krustou krytými exkoriacemi po celém těle, jinak s normálním fyzikálním nálezem. Provedeným RTG vyšetřením byla zjištěna fraktura laterální třetiny pravé klavikuly, ostatní bolestivá místa byla bez zřetelné fraktury na RTG. Dále následovalo nativní CT pánve s nálezem vícečetných fraktur dolního i horního raménka kosti stydké bilaterálně (fraktury nebyly zcela čerstvé, částečně již byly přihojené), s prolomením horních krycích ploch obratlových těl LS páteře se Schmorlovými uzly, dolní část sakra byla oproti horní části do pravého úhlu (nejspíše jako stará poúrazová změna), byla patrná výrazná difuzní osteoporóza. S tímto nálezem byla nemocná přijata na chirurgická lůžka k analgetické terapii. Dalším následujícím vyšetřením bylo CT hrudníku a břicha, které ozřejmilo ještě starší fraktury šestého až osmého žebra vlevo paravertebrálně, druhého až pátého žebra vpravo v zadní axilární čáře a starší frakturu křídla levé lopatky. Dalším nálezem na CT byl zvýrazněný reliéf ilea s nápadnými řasami, ostatní orgány dutiny břišní i hrudní byly bez patologického nálezu. K dovyšetření byla nemocná následně přeložena na interní lůžko.
Laboratorně byla pozoruhodná mikrocytární anémie (Hb 83 g/l, MCV 74 fl), sideropenie (železo 4,6 μmol/l), hodnota feritinu (15 μg/l) na dolní hranici normy, nízká saturace transferinu (na 6 %), neměřitelně nízká hladina kyseliny listové, výrazná elevace alkalické fosfatázy (ALP 17 μkat/l), hypokalcemie (Ca 1,9 mmol/l), mírná hypofosfatemie (P 0,65 mmol/l) a hypoalbuminemie (albumin 31 g/l) s normální hodnotou renálních parametrů (urea 3,4 mmol/l, kreatinin 39 μmol/l). Z endokrinologických parametrů byl výrazně elevován parathormon (PTHi 598 ng/l), z osteologických parametrů byl elevován C terminální telopeptid (CTx 3 μg/l), osteokalcin (OSTEO 118 μg/l), prokolagen N terminálního propeptidu (568 ug/l) a výrazně snížený 25-hydroxy vitamin D (25 OH Vit D 15 nmol/l). Stran funkce štítné žlázy byla nemocná v euthyreóze. K diagnostice zásadním způsobem přispěla hodnota protilátek proti tkáňové transglutamináze ve třídě IgA, která byla nad horní hranicí měřitelnosti (Anti‑tTG IgA více než 128 kIU/l), celková hodnota IgA v séru byla normální (1,5 g/l).
V průběhu hospitalizace byla podávána perorálně kyselina listová a železo (v dávce 320 mg denně), dále jednorázově intravenózně a následně perorálně kalciferol a do normalizace kalcia byla podávána 2× denně jeho substituce v podobě intravenózního 10% Calcium gluconicum.
Pacientka v dalším průběhu hospitalizace podstoupila gastroskopické vyšetření s nálezem několika drobných polypů žaludku do 3 mm, bulbus duodena byl s normálním nálezem, postbulbárně do DIII byla v celém průběhu atrofická sliznice (odtud byla odebrána biopsie). Histologický nález odpovídal klinicky vysoce suspektní celiakii – prokázal totální atrofii klků, hyperplazii krypt, chronickou zánětlivou celulizaci a intraepiteliální lymfocytózu (Obr. 1., 2.). Dle modifikované Marshovy klasifikace (pro hodnocení histologického nálezu celiakie) odpovídala sliznice duodena typu 3c.
Image 1. Histologický obraz duodena pacientky. Barveno hematoxylinem a eozinem, zvětšeno 200×. Zobrazena sliznice duodena s úplnou atrofií klků, hyperplazií krypt a chronickou zánětlivou celulizací lamina propria mucosae. Obrázek poskytnut MUDr. M. Daumovou, Ph.D. (Šiklův ústav patologie, Fakultní nemocnice Plzeň) 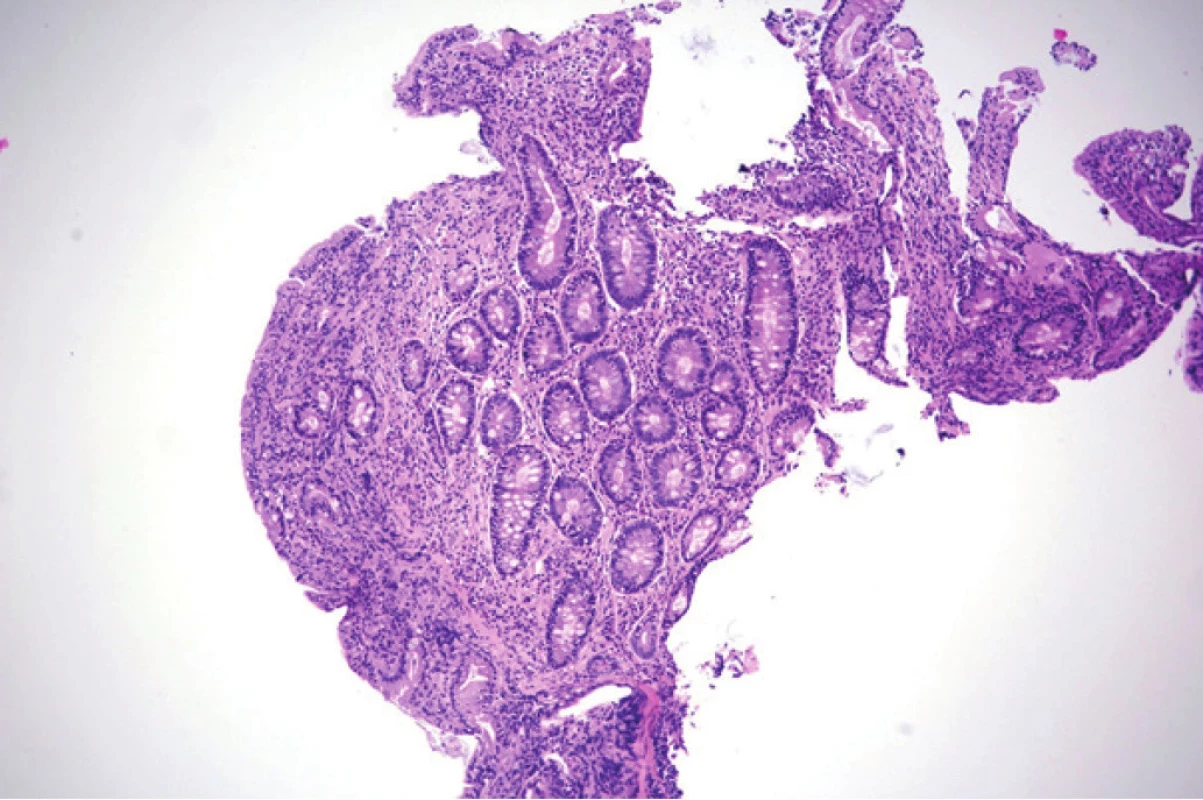
Image 2. Histologický obraz duodena pacientky. Barveno hematoxylinem a eozinem, zvětšeno 400×. Zobrazena intraepiteliální lymfocytóza (tj. více než 30 intraepiteliálních lymfocytů/100 enterocytů). Obrázek poskytnut MUDr. M. Daumovou, Ph.D. (Šiklův ústav patologie, Fakultní nemocnice Plzeň) 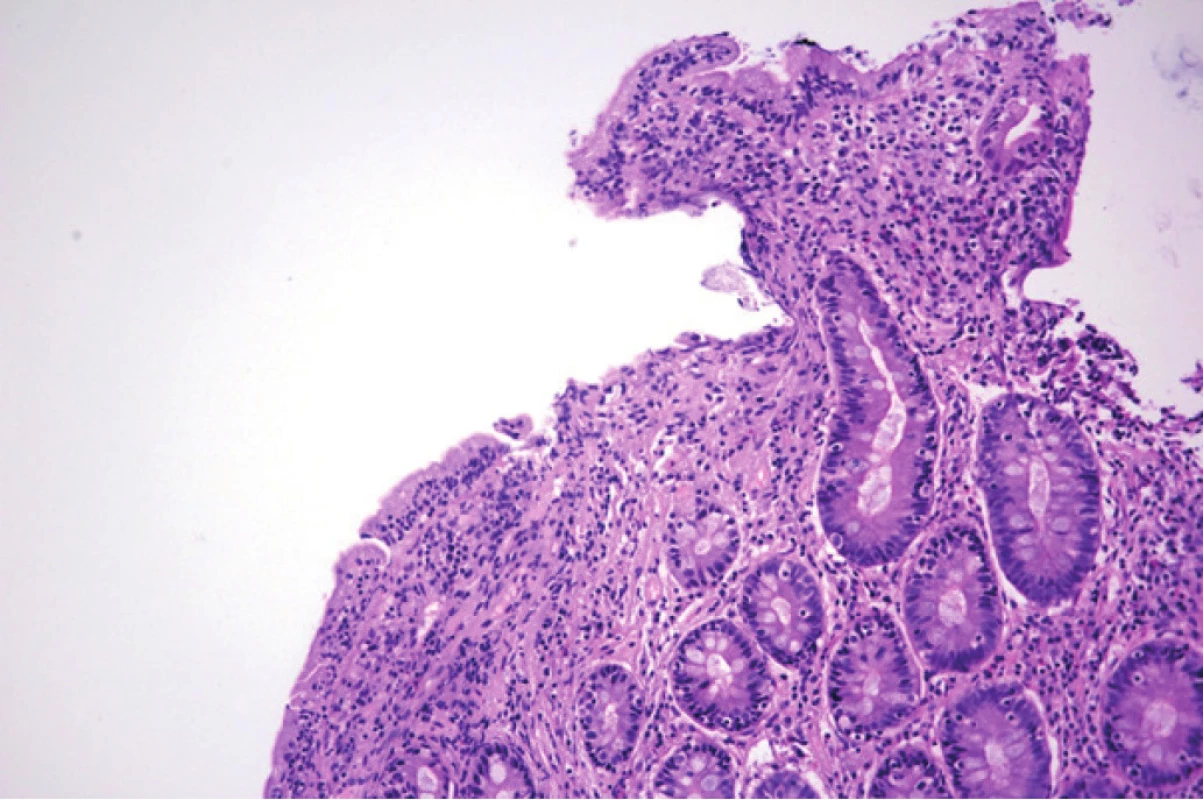
Po provedené biopsii jsme zahájili bezlepkovou dietu a pacientka začala pozvolna rehabilitovat.
Udávaný úbytek na váze byl s největší pravděpodobností následkem průjmů, které však samotnou nemocnou nebyly líčeny nijak výrazně a byly pouze občasné.
Nemocnou jsme následně s diagnózou prvozáchytu celiakie, sekundární metabolické kostní choroby s mnohočetnými frakturami, sekundární hyperparathyreózy a nutriční anémie z nedostatku železa a kyseliny listové přeložili na rehabilitační oddělení.
Diferenciálně diagnosticky bylo ještě vzhledem k extrémní elevaci PTHi uvažováno endokrinologem i o koexistující primární hyperparathyreóze, která se však vzhledem k postupné normalizaci hodnot PTHi při substituci kalcia nejevila pravděpodobná.
Metabolická kostní choroba (osteologem na základě kostní denzitometrie vyhodnocená jako těžká sekundární osteoporóza s možným podílem osteomalacie) byla po zahájení dietních opatření a substituci vápníku a vitaminu D zlepšena pozvolným nárůstem denzity kostního minerálu (BMD = bone mineral density) a osteologem nebyla shledána nutnost k podání osteoanabolické terapie.
Korekce laboratorních abnormalit se dostavovala s různým časovým odstupem. Do půl roku od zahájení bezlepkové diety a substituce příslušných nutrientů se upravila anémie, hypokalcemie, sideropenie a karence kyseliny listové. Po roce se normalizovala hladina parathormonu a teprve po 2 letech hodnota alkalické fosfatázy z mnohočetných patologických fraktur. Protilátky proti tkáňové transglutamináze ve tříde IgA zůstávají i po 2 letech od zahájení diety mírně nadhraniční (Anti‑tTG IgA 24 kIU/l).
Závěr
Případ této pacientky ukazuje na možnou souvislost dominantně extraintestinálních příznaků (sideropenická anémie, hyperparathyreóza, metabolická kostní choroba, patologické fraktury) s dosud nediagnostikovanou celiakií. S celiakií může být následkem malabsorpce spjata řada zdánlivě nesouvisejících chorob. U této nemocné se v důsledku malabsorpce železa v orálních částech jejuna objevila sideropenická anémie. Z důvodu malabsorpce kalcia a vitaminu D se aktivovala příštítná tělíska a došlo k rozvoji sekundární hyperparathyreózy. Na základě hyperparathyreózy pak vystupňovaná osteoresorpce přispěla k rozvoji metabolické kostní choroby a ke vzniku četných patologických fraktur, které zapříčinily elevaci alkalické fosfatázy. Intermitentně se dostavující průjmy byla zcela minoritní potíží. Ačkoli se nemocná neprezentovala přednostně typickým malabsorpčním syndromem, tak právě malabsorpce byla příčinou projevů nemocné.
Obecně lze říci, že v dospělosti ubývá gastrointestiálních symptomů celiakie a převažují projevy extraintestinální. Vzhledem k tomu, že extraintestinální (atypické) projevy jsou u celiakie časté, a navíc na tuto diagnózu není často ve středním věku pomýšleno, zůstává celiakie často nediagnostikována. Odhaduje se, že nediagnostikována zůstává většina případů. Proto je nutné opustit zažité dogma, že je celiakie pouze onemocněním dětského věku a v dospělosti se již nevyskytuje. Vzhledem k jednoduché diagnostice, kauzální léčbě a možným závažným pozdním komplikacím neléčené celiakie je zapotřebí na tuto často opomíjenou diagnózu myslet a zahrnout ji do diferenciální diagnostiky. Pro širokou škálu svých projevů se s celiakií mohou setkat lékaři všech odborností.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Zuzana Vacková,
II. interní klinika Fakultní nemocnice Plzeň,
Tř. E. Beneše 13,
305 89 Plzeň
Cit. zkr: Vnitř Lék 2020; 66(2): 116–120
Článek přijat redakcí: 4. 12. 2019
Článek přijat k publikaci: 12. 1. 2020
Sources
1. Frühauf P, Bronský J, Dědek P, et al. Celiakie – doporučený postup pro diagnostiku a terapii u dětí a dospívajících. Čes‑slov Pediat 2016; 71 (3): 175–183.
2. Caio G, Volta U, Sapone A, et al. Celiac disease: a comprehensive current review. BMC Med17, 142 (2019). Dostupné z DOI: .
3. Češka R. Interna. Praha: Triton, 2010. ISBN 978-80-7387-423-0.
4. Frič P, Keil R. Celiakie pro praxi. Med Praxi 2011; 8(9): 354–359.
5. Schuppan D, Walburga D. Pathogenesis, epidemiology, and clinical manifestations of celiac disease in adults. UpToDate [cit. 2019–11–18].
6. Falt P, Fojtík P, Šmajstrla V. Celiakie – současný pohled na etiopatogenezi, diagnostiku a terapii. Kardiol Rev Int Med 2014, 16(3): 219–223.
7. Kelly C. Diagnosis of celiac disease in adults. UpToDate [cit. 2019–11–18].
8. Husová L., Hermanová M. Hepatopatie, celiakie a lymfocytární kolitida. Čes a Slov Gastroent a Hepatol 2007; 61(6): 309–313.
9. Hoffmanová I, Sánchez D, Tlaskalová Hogenová H. Diagnostická úskalí celiakie. Vnitř Lék 2019; 65(1): 24–29.
10. Věstník Ministerstva zdravotnictví České republiky. Ročník 2011, částka 3. Strana 51–54. Vydáno 28. února 2011.
11. Frič P, Keil R. Celiakie pro praxi. Med Praxi 2011; 8(9): 354–359.
12. Hoffmanová I, Sánchez D, Szczepanková A, Tlaskalová Hogenová H. The Pros and Cons of Using Oat in a Gluten‑Free Diet for Celiac Patients. Nutrients. 2019, 11, 2345.
13. Postupy a stanoviska Státní zemědělské a potravinářské inspekce. Označování potravin z hlediska obsahu lepku. Zveřejněno 6. 4. 2016.
14. Ciclitira P. Management of celiac disease in adults. UpToDate [cit. 2019–11–18].
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2020 Issue 2-
All articles in this issue
- Inkretinová léčba diabetu a kardiovaskulární komplikace
- SGLT-2 inhibitory a jejich postavení v současné medicíně
- Obezita a kardiovaskulární onemocnění
- Diabetická noha
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
- Stárnutí cév a vaskulární paměť
- Klinické aspekty depozice tuku v epikardu
- Adipocytokíny a tyreopatie
- Thymom – možnosti diagnostiky
- Aktuality v léčbě a prevenci klostridiové kolitidy
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Celiakie dospělých
- Cushingov syndróm a akromegália na podklade pikoadenómu hypofýzy
- Vrozený deficit C2 složky komplementu – variabilní klinická manifestace (kazuistiky a přehled problematiky)
- Diferenciální diagnostika hypoglykemie
- Co přináší internistům nové doporučení ESC – diabetes?
- Diabetes a kardiovaskulární onemocnění
- Epidemiologie infekcí vyvolaných Clostridium difficile (CDI) v České republice
- Extraintestinální projevy celiakie
- RECENZE KNIHY ÚVOD DO VNITŘNÍHO LÉKAŘSTVÍ – doc. MUDr. Jitka Mlíková Seidlerová, Ph.D., a kol.
- Pioglitazon
- Relation between testosterone levels and body composition, physical functioning and selected biochemical parameters in adult males
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diferenciální diagnostika hypoglykemie
- Hypoxemie/hypoxie a nové koncepty oxygenoterapie v intenzivní péči
- Thymom – možnosti diagnostiky
- Diosmin/hesperidin – spolupracující tandem nebo je diosmin klíčový a hesperidin jen neúčinnou příměsí?
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

