-
Medical journals
- Career
Sekundární imunodeficience jako následek chronických onemocnění
Authors: Zita Chovancová
Authors‘ workplace: Ústav klinické imunologie a alergologie LF MU a FN u sv. Anny v Brně
Published in: Vnitř Lék 2019; 65(2): 117-124
Category:
Overview
Sekundární imunodeficience (SID), tedy získané poruchy funkce imunitního systému, představují heterogenní skupinu onemocnění s rozmanitou etiologií. Většinou se jedná o kombinovanou poruchu humorálních i buněčných složek vrozeného i adaptivního imunitního systému. Jsou doménou především dospělého věku. Mezi nejdůležitější příčiny rozvoje SID patří diabetes mellitus, porucha funkce jater a ledvin, protein-energetická malnutrice, porucha slezinných funkcí a změny imunitního systému ve stáří. Nejčastěji se manifestuje zvýšenou frekvencí infekcí nebo přítomností neobvyklých komplikací běžných infekcí a občas také rozvojem oportunních infekcí. Základní diagnostika se opírá o vyšetření krevního obrazu a diferenciálního rozpočtu leukocytů, biochemické vyšetření včetně stanovení koncentrace celkových bílkovin a albuminu a biochemické vyšetření moči k vyloučení ztrát bílkovin. Při podezření na rozvoj klinicky významné SID je indikováno vyšetření imunologické. Terapie SID se opírá zejména o léčbu nebo dobrou kompenzaci základního onemocnění. U pacientů s klinickými příznaky SID je možné terapeuticky zasáhnout pomocí profylaktické antibiotické léčby, vakcinace, substituční imunoglobulinové léčby, případně nasazení látek podporujících funkci imunitního systému.
Klíčová slova:
hyposplenizmus – imunosenescence – porucha funkce jater – porucha funkce ledvin – sekundární imunodeficience
Úvod
Sekundární imunodeficience (SID) představuje stav získané poruchy funkce imunitního systému, který nevzniká na dědičném podkladě, jako je to v případě primárních imunodeficiencí (PID). Tyto získané poruchy funkce imunitního systému se rozvíjejí v důsledku celkové změny organizmu působením vnějších i vnitřních vlivů, v důsledku základního onemocnění nebo jeho léčby. Představují značně heterogenní skupinu onemocnění s rozmanitou etiologií. Na rozdíl od PID se vyskytují poměrně často, a to zejména v dospělé populaci, přičemž většinou mívají méně závažný průběh s výjimkou SID v důsledku infekce HIV a léčby některých maligních onemocnění. SID sice můžeme dělit dle porušené složky imunitního systému podobně jako PID na protilátkové, buněčné, kombinované, fagocytární nebo komplementové, nicméně většinou jsou porušeny humorální i buněčné složky imunitního systému současně. Stavů, které mohou vést k sekundárnímu porušení funkce imunitního systému, je celá řada (tab. 1). V tomto sdělení se však zaměříme na nejdůležitější chronická onemocnění a stavy, které mohou být příčinou rozvoje SID, na což je třeba v rámci péče o tyto pacienty pomýšlet.
Table 1. Přehled nejčastějších příčin sekundárních imunodeficiencí 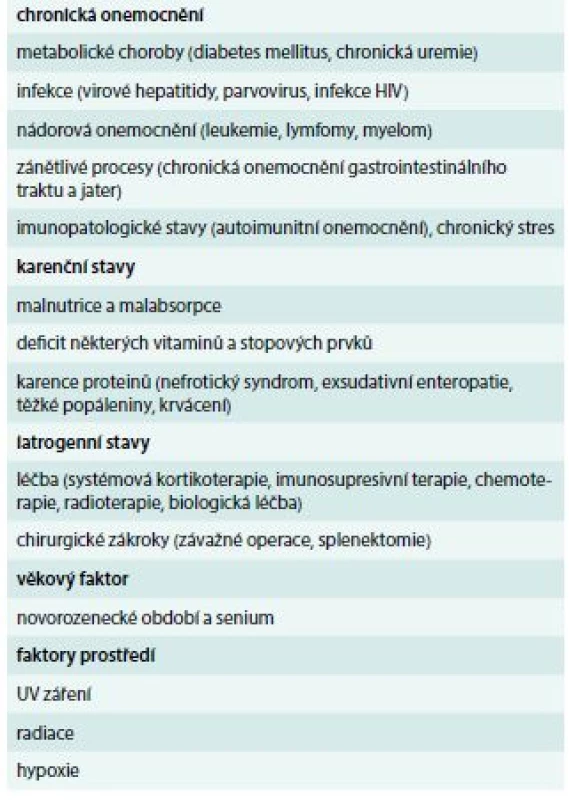
SID při metabolických onemocněních
Diabetes mellitus
Pacienti s diabetes mellitus (DM) trpí na zvýšenou frekvenci infekcí, přičemž některé z nich mají oproti běžné populaci také horší průběh [1]. Podílet se na tom může řada faktorů (porucha imunitního systému, zvýšená adherence mikroorganizmů k buňkám u pacientů s DM, přítomnost mikroangiopatie a makroangiopatie, neuropatie či iatrogenní příčiny). Hyperglykemické prostředí u těchto pacientů podporuje zvýšenou virulenci některých patogenů, zejména Candida albicans. Na svém povrchu totiž exprimuje povrchový protein, který vykazuje značnou podobnost s receptorem pro komplementovým faktor C3b (CR3). Tento receptor se váže na opsonizační C3b složku komplementu, a soutěží tak s vazbou receptorů fagocytujících buněk, což vede k útlumu komplementem mediované fagocytózy [2]. Glykosurie podporuje růst bakterií kmene Escherichia coli, což se podílí na zvýšení počtu infekcí močových cest pacientů s DM [3].
U pacientů s DM byly popsány některé změny parametrů imunitního systému, které se však pravděpodobně nepodílejí významně na jejich zvýšené nemocnosti. Pacienti s DM mají vrozeně sníženou koncentraci C4 složky komplementu [4]. Byly u nich popsány též zvýšené klidové koncentrace TNFα, IL6 a IL8 [1].
Polymorfonukleární leukocyty vykazují u některých pacientů sníženou fagocytární kapacitu v porovnání s buňkami zdravých kontrol, která pozitivně koreluje s kompenzací diabetu [1]. U některých pacientů s DM bylo nalezeno snížení koncentrace zinku v séru, jiné klinické studie však podobné nálezy nepotvrdily [1]. Zdá se tedy, že u pacientů s DM hrají významnější roli, spíše než dílčí poruchy vrozené nebo získané imunitní odpovědi, faktory zvyšující virulenci organizmu vycházející ze základního onemocnění.
Porucha funkce ledvin
Progresivní ztráta renálních funkcí je spojena s poškozením buněčné složky imunitního systému, která se někdy označuje jako s uremií asociovaná imunodeficience. Pacienti s konečným stadiem chronických renálních onemocnění (End-Stage Renal Disease – ESRD) mají sníženou odpovídavost na očkování a jsou zvýšeně náchylní k infekcím a k rozvoji nádorového bujení, a to zejména v případě malignit asociovaných s viry [5]. U pacientů s ESRD se vyskytuje „celkově prozánětlivé prostředí“, které může ovlivňovat funkci imunitního systému mechanizmem předčasného stárnutí imunitního systému [6]. Při zvyšující se uremií vzrůstá v periferní krvi i počet neutrofilů, které jsou bazálně aktivovány, nicméně mají snížené fagocytární funkce a zabíjecí schopnosti. Pacienti s ESDR mají také vyšší počty cirkulujících prozánětlivých monocytů, které bývají dávány do souvislosti s rozvojem aterosklerózy a vaskulární kalcifikace. Porušená funkce makrofágů se může podílet na snížené schopnosti odstraňování bakterií [7]. Absolutní počty NK-buněk jsou u těchto pacientů snížené a jejich počet koreluje se závažností poruchy glomerulární filtrace. Také velikost a funkce dendritických buněk je negativně ovlivněna uremií, nicméně přesný mechanizmus jejího působení není znám [8]. Pacienti s ESDR mají snížený počet T-lymfocytů a B-lymfocytů, a to zejména jejich naivních forem. Tyto buňky vykazují známky aktivace, ale zároveň taky sníženou proliferaci po stimulaci polyklonálními mitogeny [6]. Celkově vzato se zdá být pravděpodobné, že SID je u těchto pacientů způsobena zejména poruchou funkce dendritických buněk a T-lymfocytů.
Porucha funkce jater
Játra jsou většinou považována za významný orgán z hlediska metabolických, nutričních a detoxifikačních aktivit organizmu, nicméně je dobré si uvědomit, že hrají velmi důležitou roli také ve vrozené a adaptivní imunitní odpovědi. Z procesů řadících se do vrozené imunitní odpovědi se jedná zejména o tvorbu proteinů akutní fáze (mimo jiné např. C-reaktivního proteinu, manózu vázajícího lektinu a dále C3, C4 a C9 složek komplementu), fagocytózu jaterními makrofágy (tzv. Kupfferovými buňkami), nespecifickou pinocytózu nepotřebných molekul a zabíjení buněk přirozenými zabíječi – NK-buňkami (Natural Killers cells/buňky). V rámci adaptivních mechanizmů dochází v játrech k odstraňování aktivovaných T-lymfocytů, indukci tolerance na potravou přijaté antigeny či autoantigeny, k extratymové proliferaci T-lymfocytů a v neposlední řadě k odstraňování celé řady signalizačních a efektorových molekul [9]. Játra se tedy podílejí na rozvoji systémové odpovědi na lokálně probíhající zánětlivé procesy odstraňováním nepotřebných částic a solubilních molekul z cirkulace a zabíjením nádorových buněk. Jsou také hlavním místem extratymového vývoje T-lymfocytů, což je důležité zejména proto, že tymus, ve kterém tyto procesy probíhají po narození a v dětství, během života involvuje [10].
Poruchy jaterní struktury nebo funkce mohou mít tedy za následek významnou sekundární poruchu funkce imunitního systému. V důsledku různých chronických onemocnění jater totiž dochází k postupnému zániku hepatocytů a jejich náhradě vazivovou tkání, což vede k rozvoji jaterní cirhózy. Ta je bez závislosti na etiologické příčině jejího rozvoje komplikována dysfunkcí imunitního systému asociovanou s cirhózou, která se projevuje zvýšenou náchylností k infekcím. Ta vzniká jednak porušenou funkcí jater poškozením jaterního retikuloendotelového systému (snížení odstraňování antigenů z krve) a dále porušenou tvorbou proteinů v játrech (faktorů komplementu, solubilních receptorů rozpoznávajících vzory a proteinů akutní fáze), čímž dochází k snížení opsonizace bakterií a porušení mechanizmů vrozené imunitní odpovědi [11]. V rámci systémových změn při jaterní cirhóze dochází k poškození cirkulujících buněk imunitního systému (neutrofilů, monocytů, NK-buněk, T-lymfocytů a B-lymfocytů), ale také střevních buněk imunitního systému (zánět střeva, poškození střevních bariér) [11]. Pacienti s alkoholickou cirhózou jater mají zvýšené koncentrace sérových IgG a IgA imunoglobulinů v důsledku zvýšené tvorby B-buněčných diferenciačních faktorů pro IgG a IgA, ale nikoli IgM imunoglobuliny [12]. Postupný rozvoj cirhózy vede k poruše funkcí jater a stimulaci imunitního systému díky signálům přes tzv. s patogenem nebo nebezpečím asociované molekulární vzory (Pathogen-Associated Molecular Patterns – PAMPs a Damage/Danger-Associated Molecular Patterns – DAMPs). To vede k poruše regulační a efektorové funkce imunitního systému. Ve fázi kompenzované cirhózy bez translokace bakterií z gastrointestinálního traktu (GIT) dochází při nekróze hepatocytů k aktivaci signálů DAMPs a následně k rozvoji sterilního systémového zánětu. Při dekompenzaci cirhózy se dostávají do jater bakteriální produkty ze střeva (endotoxiny), které dále aktivují imunitní systém (zvyšuje se sérová koncentrace proinflamatorních cytokinů a povrchová exprese aktivačních markerů na imunitních buňkách). V tomto okamžiku převažuje prozánětlivý stav v důsledku opakované signalizace pomocí PAMPs a snížení tvorby protizánětlivých cytokinů a negativních zpětnovazebných mechanizmů (např. tvorba IL10). Ve stadiu dekompenzované cirhózy se objevuje zhoršující se imunodeficience v důsledku ztráty kontrolní funkce imunitního systému a poruchy jeho funkce. V terminálním stadiu je imunitní systém vyčerpán. A i když pokračuje neustálý antigenní tlak přes PAMPs-molekuly, převládá již imunodeficitní stav v důsledku postižení vrozené i adaptivní imunitní odpovědi [11].
SID v důsledku ztráty proteinů
Protože imunoglobuliny jsou biochemicky glykoproteiny, tak také stavy charakterizované zvýšenou ztrátou proteinů mohou vést k projevům sekundární protilátkové imunodeficience. Patří mezi ně poruchy ledvin nebo GIT doprovázené ztrátou proteinů, těžké popáleniny či významná ztráta krve.
Průnik bílkovin do moči je dán velikostí jejich molekuly. Bílkoviny s molekulovou hmotností větší než albumin (69 kD), pronikají do moči velmi omezeně, přičemž se snižující se molekulovou hmotností a efektivním průměrem molekuly se filtrace těchto částic významně zvyšuje. V glomerulech volně filtrované nízkomolekulární proteiny jsou účinně resorbovány a následně katabolizovány v proximálním tubulu, proto jsou jejich koncentrace v moči minimální. Mezi proteiny ztrácené tzv. fyziologickou proteinurii patří i IgG a sekreční IgA (do 10–15 mg/24 hod) a volné lehké řetězce imunoglobulinů (do 10–15 mg/24 hod). Přítomnost vyšší koncentrace IgG v moči svědčí pro glomerulární neselektivní proteinurii. Je ukazatelem těžšího glomerulárního poškození, zánětlivé syntézy v intersticiu ledviny nebo postrenální proteinurie [13].
Enteropatie se ztrátou proteinů (Protein-Losing Enteropathy – PLE) patří mezi vzácná onemocnění charakterizována ztrátou sérových proteinů a jejich únikem do gastrointestinálního traktu, což vede k rozvoji hypoproteinemie [14]. Příčiny rozvoje PLE jsou velmi rozmanité (tab. 2). Výrazné ztráty proteinů epitelem zažívacího traktu jsou způsobeny buď únikem proteinů přes poškozenou sliznici, nebo obstrukcí lymfatických cest, což vede k přímému prosakování na proteiny bohaté lymfy. Ztrátou jsou postiženy zejména proteiny, pro které je charakteristické pomalejší obnovování a delší poločas rozpadu. Bylo prokázáno, že pacienti s PLE mají velmi nízké sérové koncentrace celkových sérových bílkovin, albuminu a celkových IgG imunoglobulinů, nicméně navzdory hypoproteinemii mají zachovalé koncentrace proteinu vázajícího retinol a prealbuminu, které mají kratší poločas rozpadu [15].
Table 2. Přehled nejčastějších příčin enteropatie se ztrátou proteinů (PLE). Upraveno podle [14] ![Přehled nejčastějších příčin enteropatie se ztrátou proteinů (PLE). Upraveno podle [14]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/95509f046e0d3d76f4667f97b1051bfd.jpeg)
NSA – nesteroidní antiflogistika SID u pacientů bez sleziny
Slezina představuje důležitý imunoaktivní orgán, který se podílí pomocí slezinných makrofágů na odstraňování nepotřebných buněk nebo bakteriálních nebo parazitárních antigenů nacházejících se přímo v krevním řečišti. Zatímco játra se podílejí zejména na odstraňování dobře opsonizovaných bakterií, slezina vychytává méně opsonizované bakterie, mezi které patří zejména obalené mikroorganizmy. Slezina je také hlavním místem tvorby imunoglobulinů ve třídě IgM, na které se podílí zejména B-lymfocyty marginální zóny. Koncentrace IgM imunoglobulinů po splenektomii se snižuje [16]. Slezina je také hlavním místem tvorby tuftsinu a properdinu, což jsou dva důležité opsoniny. Tuftsin je tetrapeptid vznikající ve slezině enzymatickým odštěpením z Fc domény těžkého řetězce IgG, a významně stimuluje fagocytární a baktericidní aktivitu neutrofilních granulocytů a makrofágů [17]. K funkčnímu hyposplenizmu může vést celá řada onemocnění a jiných patologických stavů (tab. 3). Pacienti s vrozenou nebo získanou poruchou funkce sleziny jsou náchylní k infekcím způsobeným obalenými a některými dalšími patogeny, jako je Streptococcus pneumoniae, Haemophilus influenzae typu b, meningokok, salmonela a další enterobakterie nebo také virus chřipky. Infekce opouzdřenými patogeny mohou u těchto pacientů vést k progresivní septikemii s mortalitou, která se při sepsi pohybuje mezi 50–70 % [18]. Tento stav je označován jako OPSI syndrom (Overwhelming PostSplenectomy Infection/postsplenektomický septický syndrom) a byl poprvé popsán počátkem 50. let minulého století [19]. Celoživotní riziko rozvoje tohoto syndromu se odhaduje na 5 %, přičemž z toho 30 % infekcí se projeví v 1. roce po splenektomii a 50 % během prvních 2 let po splenektomii [20]. Proto je v rámci preventivních opatření vhodné tyto pacienty naočkovat vakcínou proti pneumokokům, hemofilům, meningokokům a viru chřipky [21]. Pokud se u těchto pacientů objeví horečka, je vhodné nasadit bezodkladně antibiotika, z nichž jsou doporučována amoxicilin/klavulanát (1 g každých 6–8 hod), cefuroxim/axetil (500 mg každých 6–8 hod) nebo moxifloxacin (400 mg každých 24 hod) [21,22]. Jistou formou ochrany těchto pacientů by mohlo být též vytvoření národního registru, protože se ukázalo, že u takto dlouhodobě systematicky sledovaných pacientů dochází k signifikantnímu snížení rizika rozvoje infekcí opouzdřenými bakteriemi vzhledem k lepší preventivní i jiné péči o ně [23].
Table 3. Nejčastější stavy vedoucí k hyposplenizmu nebo slezinné atrofii. Upraveno podle [44,45] ![Nejčastější stavy vedoucí k hyposplenizmu
nebo slezinné atrofii. Upraveno podle [44,45]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ea6931a9abb183a3dd4f519b9be78345.jpeg)
AIDS – syndrom získané imunodeficience APECED – autoimunitní polyendokrinní syndrom/Autoimmune Polyendocrinopathy Candidiasis Ectodermal Dystrophy HIV – infekce virem lidské imunodeficience/ Human Immunodeficiency Virus SID u malnutrice
Malnutrice neboli podvýživa je definována jako porucha výživy způsobená neadekvátním nebo nedostatečných příjmem základních energetických substrátů vzhledem k potřebě organizmu. Protein-energetický typ malnutrice je způsoben vyváženým nedostatkem potravy a jsou při něm zachovány normální hladiny plazmatických proteinů. Oproti tomu proteinový typ malnutrice je charakterizovaný nedostatečným přísunem bílkovin ve stravě, což se projevuje poklesem plazmatických hladin albuminu a transferinu, poklesem absolutního počtu lymfocytů a poruchou buněčné imunity [24]. Neadekvátní výživa tedy ovlivňuje negativně funkci imunitního systému, a to obecně nejvíce v dětském věku a ve stáří. Protože podvýživa v dětském věku je především doménou rozvojových zemí, v našich podmínkách je nejdůležitější myslet na podvýživu u starších osob.
Dle rozsáhlé retrospektivní studie zabývající se stavem imunitního systému u dětí bylo prokázáno, že se změny imunitního systému v důsledku malnutrice týkají vrozené (porušená funkce epiteliálních bariér kůže a gastrointestinálního traktu, snížená granulocytární mikrobicidní aktivita, menší počet cirkulujících dendritických buněk, snížený počet komplementových proteinů při zachovalém počtu leukocytů a proteinů akutní fáze) i získané imunitní odpovědi (snížení koncentrace solubilního IgA v slinách a slzách, atrofie lymfoidních orgánů, snížení odpovědi opožděné přecitlivělosti, menší počet cirkulujících B-lymfocytů, převaha Th2 asociovaných cytokinů a snížení lymfocytární odpovědi na fytohemaglutinin při zachovalém počtu lymfocytů a cirkulujících imunoglobulinů v periferní krvi) [25].
Prevalence proteinového typu malnutrice se zvyšuje s věkem a činí 5–30 % u starších osob žijících doma, 16–70 % žijících v nějakém sociálním zařízení a 20–60 % u hospitalizovaných pacientů [24]. Podvýživa zvyšuje morbiditu a mortalitu pacientů a zhoršuje průběh jejich chronických onemocnění. Porucha funkce imunitního systému je silně závislá na tíži protein-energetické malnutrice a koreluje též s frekvencí infekcí a mortalitou [26]. Je nutné si uvědomit, že k poruše imunitního systému ve vyšším věku dochází i v důsledků vlastního stárnutím organizmu (viz dále). Proto je třeba odlišit změny, které souvisejí s imunosenescencí, a nelze jim tedy účinně předcházet, od změn, které souvisejí s nedostatkem nutričních faktorů. Na poruše funkce imunitního systému ve stáří se totiž podílí deficit některých makronutričních (zejména proteinů) a mikronutričních faktorů (zejména vitaminu B6, zinku, kyseliny listové nebo vitaminu E) a jejich suplementace ve stravě může pomoci zlepšit funkci imunitního systému [26]. Ukázalo se, že pokud byli pacienti ve věku nad 65 let, normální výživové parametry (tedy koncentraci sérového albuminu > 39 g/l, normální koncentraci zinku, selenu, kyseliny listové a vitaminů C, E, B6 a B12 a navíc hladiny CRP < 30 mg/l), byla proliferace lymfocytů a produkce IL2 srovnatelná s mladými dospělými lidmi ve věku 20–30 let [27]. Úspěšnost úpravy nutričního stavu těchto pacientů závisí na míře stresu, kterému jsou pacienti vystaveni, ať už je jeho příčina jakákoli. Stresový stav vede k aktivaci monocyto-makrofágového systému s produkcí prozánětlivých cytokinů (IL1, IL6, TNF a dalších), které se mimo jiné podílí na dalším spotřebovávání nutričních rezerv, což je ve starším věku dále prohlubuje malnutrici pacientů [26].
SID v seniu
Stárnutí je ireverzibilní proces, který se společně se všemi orgány lidského těla týká také imunitního systému. Imunosenescence je zodpovědná za postupné s věkem se prohlubující snížení funkce imunitního systému, která se projevuje zhoršenou obranyschopností proti patogenům z vnějšího prostředí, sníženou odpovídavostí na očkování a zvýšenou incidencí autoimunitních fenoménů a nádorových onemocnění [28]. Stárnutí imunitního systému se týká mechanizmů vrozené i získané imunity (tab. 4).
Table 4. Změny imunitního systému ve stáří. Upraveno podle [35] ![Změny imunitního systému ve stáří.
Upraveno podle [35]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/763726d49bd35a7336c8437d6bb8a07b.jpeg)
Infekční onemocnění představují jen malou část komplexního problému stáří a stárnutí, nicméně patří mezi významné příčiny úmrtí těchto pacientů. Nejzávažnějšími z nich jsou pneumonie, sepse, infekční komplikace diabetes mellitus nebo tuberkulóza. Charakteristika infekčních onemocnění ve stáří se odlišuje v několika směrech. Infekce jsou ve stáří způsobeny oproti mladšímu věku jinými etiologickými agens, často se jedná o nozokomiální původce, projevují se atypickým klinickým obrazem nebo se častěji vyskytují postinfekční komplikace. Klinická i laboratorní manifestace infekcí nemusí být ve vyšším věku výrazná. Často chybí typické klinické (horečka) nebo laboratorní (leukocytóza, posun doleva v diferenciálním rozpočtu leukocytů nebo elevace C-reaktivního proteinu) známky svědčící pro závažnou bakteriální infekci [29]. Častým příznakem infekčních onemocnění ve stáří je naopak manifestace v jiném než postiženém orgánu. Např. u geriatrických pacientů s neuropsychickou symptomatologií (dezorientace, agresivita) je nutno pátrat po přítomnosti infekčního onemocnění. Někdy na něj upozorní jen nespecifické příznaky, jako je nechutenství, únava, pády nebo pobolívání těla [30].
Mechanizmy vrozené imunity (makrofágy a polymorfonukleární leukocyty) se nezdají být věkem významně ovlivněny [26]. Počet neutrofilů a makrofágů se nemění, počty NK-buněk bývají dokonce vyšší, nicméně funkce těchto buněk (chemotaxe, fagocytóza, cytotoxicita, tvorba cytokinů a chemokinů, proliferace a exprese receptorů) se s věkem snižuje [31]. Zvýšená náchylnost k infekcím ve vyšším věku může být dána sníženou tvorbou IFNγ [32]. Produkce prozánětlivých cytokinů je ve vyšším věku zachována (IL1) nebo i zvýšena (TNFα, IL6) [33]. Homeostáza organizmu je ve stáří vychýlena směrem k prozánětlivému fenotypu. Protože je T-lymfocytární odpověď na signály pocházející z buněk a molekul vrozeného imunitního systému snížena, musí makrofágy k docílení jejich aktivace produkovat více cytokinů, a to vede k navození proinflamatorního prostředí [26]. Během senescence také dochází ke snížení počtu pomocných i cytotoxických T-lymfocytů a vychýlení rovnováhy mezi Th1 a Th2 lymfocyty ve směru Th2 buněk. Pacienti vyššího věku na rozdíl od mladých a dospělých tvoří méně naivních T-lymfocytů a B-lymfocytů a mají více jejich paměťových forem [34]. Změny v počtu lymfocytárních subpopulací nastávají jednak v důsledku involuce tymu, při níž probíhá tymová výchova, a vzestupu proliferace naivních T-lymfocytů do stadia paměťových buněk v periferii, ale také v důsledku útlumu kostní dřeně, která tvoří méně B-buněčných prekurzorů [35–37]. Převaha Th2 lymfocytů ve stáří může vysvětlit, proč nedochází za normálních okolností k poklesu koncentrace imunoglobulinů, i když jejich afinita během života klesá a vzrůstá tvorba autoprotilátek [38]. To může být dáno také tím, že postupně během života dochází ke snižování počtu CD5- B-lymfocytům, které tvoří protilátky proti cizorodým antigenům, ve prospěch CD5+ B-lymfocytů, které jsou častěji asociovány s produkcí autoprotilátek [39].
Popsané změny však mají na funkci T-lymfocytů zřejmě jen malý vliv [26]. Jejich proliferace je srovnatelná s lidmi v produktivním věku, jen její vrchol nastupuje o něco později (3.–4. den vs 2.–3. den) [40]. Pokles T-buněčných funkcí se objevuje až u velmi starých přiměřeně věku zdravých lidí (> 90 let). Na zvýšené náchylnosti pacientů k infekcím ve vyšším věku by se mohl podílet zejména pokles počtu cytotoxických T-lymfocytů, protože právě tyto buňky jsou hlavní efektorové buňky podílející se přímo na likvidaci infikovaných buněk lidského těla. Pokles T-buněčných efektorových funkcí se významně podílí na zhoršené odpovídavosti na patogeny, očkování a vyšší náchylnosti k rozvoji nádorových onemocnění [41].
Během posledních několika desetiletí bylo zkoumáno propojení mezi T-buněčnými a metabolickými signalizačními drahami [42] a má se za to, že imunosenescence by mohla být způsobena změnami nebo poruchami v tomto propojení [43]. Zajímavým pohledem, který propojuje problematiku výživy, věku a imunitního systému, je názor vycházející z nedávných výzkumů, že stárnutí významně ovlivňuje dopad výživy na funkci imunitního systému [43].
Diagnostika sekundárních imunodeficiencí
V rámci základního vyšetření pacientů s podezřením na sekundární postižení funkce imunitního systému před odesláním k vyšetření specialistovi by mělo být provedeno vyšetření krevního obrazu a diferenciálního rozpočtu leukocytů, základní biochemické vyšetření včetně stanovení koncentrace celkových bílkovin a albuminu, ale také biochemické vyšetření moče k vyloučení ztrát bílkovin močí. V případě nálezu neutropenie v diferenciálním rozpočtu leukocytů je vhodné pacienta odeslat na vyšetření hematologické. Pokud je podezření na rozvoj klinicky významné sekundární imunodeficience, pak je indikováno vyšetření imunologické. Klinicky se SID projevují recidivujícími infekcemi (zejména pacienti, kteří prodělali sinusitidu, otitidu, pneumonii nebo meningitidu), které nereagují adekvátně na běžně užívanou terapii. Diagnostika SID je u specialisty kromě anamnézy založena na laboratorních vyšetřeních, ve kterých se zjišťuje koncentrace humorálních složek imunitního systému a počet imunokompetentních buněk.
Léčba sekundárních imunodeficiencí
Terapie SID se opírá zejména o léčbu nebo dobrou kompenzaci základního onemocnění. U pacientů s klinickými příznaky sekundární imunodeficience je možno nasadit profylaktickou antibiotickou léčbu. Obecně není doporučováno aplikování živých vakcíny a při používání polysacharidových vakcín je vhodné volit vakcíny konjugované. U některých pacientů se závažným poklesem koncentrace celkových IgG imunoglobulinů a klinickými příznaky imunodeficience je vhodná substituční imunoglobulinová léčba. Efekt užívání bakteriálních imunomodulátorů je sporný, nicméně každopádně by tyto preparáty neměly být podávány v případě, že k rozvoji sekundární imunodeficience vedlo autoimunitní onemocnění nebo pacient nějakým autoimunitním onemocněním trpí.
Závěr
Sekundární imunodeficience různé závažnosti jsou doménou především dospělého věku. Postihují zejména starší pacienty s různými základními interními diagnózami, jejichž průběh mohou negativně ovlivnit. Tíže sekundárního porušení funkce imunitního systému závisí především na kompenzaci základního onemocnění. Pokud se u pacientů vyskytují klinické příznaky typické pro poruchu funkce imunitního systému, je vhodné je léčit a sledovat cestou klinického imunologa.
MUDr. Zita Chovancová, Ph.D.
Ústav klinické imunologie a alergologie LF MU a FN u sv. Anny v Brně
Doručeno do redakce 16. 8. 2018
Přijato po recenzi 26. 11. 2018
Sources
-
Geerlings SE, Hoepelman AI. Immune dysfunction in patients with diabetes mellitus (DM). FEMS Immunol Med Microbiol 1999; 26(3–4): 259–265. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1574–695X.1999.tb01397.x>.
-
Hostetter MK. Handicaps to host defense. Effects of hyperglycemia on C3 and Candida albicans. Diabetes 1990; 39(3): 271–275.
-
Geerlings SE, Brouwer EC, Gaastra W et al. Effect of glucose and pH on uropathogenic and non-uropathogenic Escherichia coli: studies with urine from diabetic and non-diabetic individuals. J Med Microbiol 1999; 48(6): 535–539. Dostupné z DOI: <http://dx.doi.org/10.1099/00222615–48–6–535>.
-
Uko G, Christiansen FT, Dawkins RL et al. Low serum C4 concentrations in insulin dependent diabetes mellitus. Br Med J (Clin Res Ed) 1983; 286(6379): 1748–1749.
-
Maisonneuve P, Agodoa L, Gellert R et al. Cancer in patients on dialysis for end-stage renal disease: an international collaborative study. Lancet 1999; 354(9173): 93–99.
-
Betjes MG, Langerak AW, van der Spek A et al. Premature aging of circulating T cells in patients with end-stage renal disease. Kidney Int 2011; 80(2): 208–217. Dostupné z DOI: <http://dx.doi.org/10.1038/ki.2011.110>.
-
Girndt M, Ulrich C, Kaul H et al. Uremia-associated immune defect: the IL-10-CRP axis. Kidney Int Suppl 2003; (84): S76-S79. Dostupné z DOI: <http://dx.doi.org/10.1046/j.1523–1755.63.s84.14.x>.
-
Kim JU, Kim M, Kim S et al. Dendritic Cell Dysfunction in Patients with End-stage Renal Disease. Immune Netw 2017; 17(3): 152–162. Dostupné z DOI: <http://dx.doi.org/10.4110/in.2017.17.3.152>.
-
Racanelli V, Rehermann B. The liver as an immunological organ. Hepatology 2006; 43(2 Suppl 1): S54-S62. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.21060>.
-
Robinson MW, Harmon C, O‘Farrelly C. Liver immunology and its role in inflammation and homeostasis. Cell Mol Immunol 2016; 13(3): 267–276. Dostupné z DOI: <http://dx.doi.org/10.1038/cmi.2016.3>.
-
Albillos A, Lario M, Álvarez-Mon M. Cirrhosis-associated immune dysfunction: distinctive features and clinical relevance. J Hepatol 2014; 61(6): 1385–1396. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2014.08.010>.
-
Girón JA, Alvarez-Mon M, Menéndez-Caro JL et al. Increased spontaneous and lymphokine-conditioned IgA and IgG synthesis by B cells from alcoholic cirrhotic patients. Hepatology 1992; 16(3): 664–670.
-
Snyder S, John JS. Workup for proteinuria. Prim Care 2014; 41(4): 719–735. Dostupné z DOI: <http://dx.doi.org/10.1016/j.pop.2014.08.010>.
-
Umar SB, DiBaise JK. Protein-losing enteropathy: case illustrations and clinical review. Am J Gastroenterol 2010; 105(1): 43–49, quiz 50. Dostupné z DOI: <http://dx.doi.org/10.1038/ajg.2009.561>.
-
Takeda H, Ishihama K, Fukui T et al. Significance of rapid turnover proteins in protein-losing gastroenteropathy. Hepatogastroenterology 2003; 50(54): 1963–1965.
-
William BM, Corazza GR. Hyposplenism: a comprehensive review. Part I: basic concepts and causes. Hematology 2007; 12(1): 1–13.
-
Siebert A, Gensicka-Kowalewska M, Cholewinski G et al. Tuftsin – Properties and Analogs. Curr Med Chem 2017; 24(34): 3711–3727. Dostupné z DOI: <http://dx.doi.org/10.2174/0929867324666170725140826>.
-
Chinen J, Shearer WT. Secondary immunodeficiencies, including HIV infection. J Allergy Clin Immunol 2010; 125(2 Suppl 2): S195-S203. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaci.2009.08.040>.
-
King H, Shumacker HB. Splenic studies. I. Susceptibility to infection after splenectomy performed in infancy. Ann Surg 1952; 136(2): 239–242.
-
Price VE, Dutta S, Blanchette VS et al. The prevention and treatment of bacterial infections in children with asplenia or hyposplenia: practice considerations at the Hospital for Sick Children, Toronto. Pediatr Blood Cancer 2006; 46(5): 597–603. Dostupné z DOI: <http://dx.doi.org/10.1002/pbc.20477>.
-
Rubin LG, Levin MJ, Ljungman P et al. 2013 IDSA clinical practice guideline for vaccination of the immunocompromised host. Clin Infect Dis 2014; 58(3): 309–318. Dostupné z DOI: <http://dx.doi.org/10.1093/cid/cit816>. Erratum in Clin Infect Dis 2014; 59(1): 144.
-
Kim HS, Kriegel G, Aronson MD. Improving the preventive care of asplenic patients. Am J Med 2012; 125(5): 454–456. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2011.11.009>.
-
Arnott A, Jones P, Franklin LJ et al. A registry for patients with asplenia/hyposplenism reduces the risk of infections with encapsulated organisms. Clin Infect Dis 2018; 67(4): 557–561. Dostupné z DOI: <http://dx.doi.org/10.1093/cid/ciy141>.
-
Guyonnet S, Rolland Y. Screening for Malnutrition in Older People. Clin Geriatr Med 2015; 31(3): 429–437. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cger.2015.04.009>.
-
Rytter MJ, Kolte L, Briend A et al. The immune system in children with malnutrition – a systematic review. PLoS One 2014; 9(8): e105017. Dostupné z DOI: <http://dx.doi.org/10.1371/journal.pone.0105017>.
-
Lesourd B. Nutritional factors and immunological ageing. Proc Nutr Soc 2006; 65(3): 319–325.
-
Ahluwalia N, Mastro AM, Ball R et al. Cytokine production by stimulated mononuclear cells did not change with aging in apparently healthy, well-nourished women. Mech Ageing Dev 2001; 122(12): 1269–1279.
-
Dewan SK, Zheng SB, Xia SJ et al. Senescent remodeling of the immune system and its contribution to the predisposition of the elderly to infections. Chin Med J (Engl) 2012; 125(18): 3325–3331.
-
Wasserman M, Levinstein M, Keller E et al. Utility of fever, white blood cells, and differential count in predicting bacterial infections in the elderly. J Am Geriatr Soc 1989; 37(6): 537–543.
-
Norman DC. Clinical Features of Infection in Older Adults. Clin Geriatr Med 2016; 32(3): 433–441. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cger.2016.02.005>.
-
Gomez CR, Nomellini V, Faunce DE et al. Innate immunity and aging. Exp Gerontol 2008; 43(8): 718–728. Dostupné z DOI: <http://dx.doi.org/10.1016/j.exger.2008.05.016>.
-
Rink L, Cakman I, Kirchner H. Altered cytokine production in the elderly. Mech Ageing Dev 1998; 102(2–3): 199–209.
-
Goronzy JJ, Li G, Yu M et al. Signaling pathways in aged T cells – a reflection of T cell differentiation, cell senescence and host environment. Semin Immunol 2012; 24(5): 365–372. Dostupné z DOI: <http://dx.doi.org/10.1016/j.smim.2012.04.003>.
-
Saule P, Trauet J, Dutriez V et al. Accumulation of memory T cells from childhood to old age: central and effector memory cells in CD4(+) versus effector memory and terminally differentiated memory cells in CD8(+) compartment. Mech Ageing Dev 2006; 127(3): 274–281. Dostupné z DOI: <http://dx.doi.org/10.1016/j.mad.2005.11.001>.
-
Maijó M, Clements SJ, Ivory K et al. Nutrition, diet and immunosenescence. Mech Ageing Dev 2014; 136–137 : 116–128. Dostupné z DOI: <http://dx.doi.org/10.1016/j.mad.2013.12.003>.
-
Dunn-Walters DK. The ageing human B cell repertoire: a failure of selection? Clin Exp Immunol 2016; 183(1): 50–56. Dostupné z DOI: <http://dx.doi.org/10.1111/cei.12700>.
-
Nikolich-Zugich J. Ageing and life-long maintenance of T-cell subsets in the face of latent persistent infections. Nat Rev Immunol 2008; 8(7): 512–522. Dostupné z DOI: <http://dx.doi.org/10.1038/nri2318>.
-
Arreaza EE, Gibbons JJ, Siskind GW et al. Lower antibody response to tetanus toxoid associated with higher auto-anti-idiotypic antibody in old compared with young humans. Clin Exp Immunol 1993; 92(1): 169–173.
-
Weksler ME. Immune senescence: deficiency or dysregulation. Nutr Rev 1995; 53(4 Pt 2): S3-S7.
-
Mazari L, Lesourd BM. Nutritional influences on immune response in healthy aged persons. Mech Ageing Dev 1998; 104(1): 25–40.
-
Hakim FT, Gress RE. Immunosenescence: deficits in adaptive immunity in the elderly. Tissue Antigens 2007; 70(3): 179–189. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1399–0039.2007.00891.x>.
-
Pollizzi KN, Powell JD. Integrating canonical and metabolic signalling programmes in the regulation of T cell responses. Nat Rev Immunol 2014; 14(7): 435–446. Dostupné z DOI: <http://dx.doi.org/10.1038/nri3701>.
-
Yaqoob P. Ageing alters the impact of nutrition on immune function. Proc Nutr Soc 2017; 76(3): 347–351. Dostupné z DOI: <http://dx.doi.org/10.1017/S0029665116000781>.
-
Di Sabatino A, Carsetti R, Corazza GR. Post-splenectomy and hyposplenic states. Lancet 2011; 378(9785): 86–97. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(10)61493–6>.
-
Brigden ML. Detection, education and management of the asplenic or hyposplenic patient. Am Fam Physician 2001; 63(3): 499–506, 508.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2019 Issue 2-
All articles in this issue
- Zánět obranný a poškozující: základní charakteristiky
- Cytokiny rodiny IL1 u chronických zánětlivých procesů
- Heterogenita lymfocytov ako ústredných operačných jednotiek imunitného systému
- Mikrobiota, imunita a imunologicky mediované choroby
- Primární imunodeficience u dospělých
- Sekundární imunodeficience jako následek chronických onemocnění
- Léčba humorálních imunodeficiencí
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Co dnes znamená alergologie pro internu a naopak
- Anafylaktické příznaky a anafylaktický šok
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Anafylaktické příznaky a anafylaktický šok
- Nežádoucí účinky imunoglobulinové léčby
- Současné trendy v imunosupresivní léčbě
- Primární imunodeficience u dospělých
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

