-
Medical journals
- Career
PET-CT dokumentovaná remise multicentrické formy Castlemanovy choroby po léčbě rituximabem
Popis případu a přehled literatury
Authors: Zdeněk Adam 1; Petr Szturz 1; Renata Koukalová 2; Zdeněk Řehák 2; Luděk Pour 1; Marta Krejčí 1; Lenka Šmardová 1; Michal Eid 1; Pavlína Volfová 1; Zdeňka Čermáková 3; Leoš Křen 4; Filip Sokol 4; Ivo Hanke 5; Eva Michalková 1; Zdeněk Král 1; Jiří Mayer 1
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; Oddělení nukleární medicíny, centrum PET, RECAMO, Masarykova onkologického ústavu Brno, primář MUDr. Zdeněk Řehák, Ph. D. 2; Oddělení klinické biochemie FN Brnoa Katedra laboratorních metod LF MU Brno, přednosta doc. MUDr. Milan Dastych, CSc., MBA 3; Ústav patologie LF MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Leoš Křen, Ph. D. 4; Chirurgická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Zdeněk Kala, CSc. 5
Published in: Vnitř Lék 2015; 61(3): 251-258
Category: Case Report
Overview
Popisujeme případ multicentrické formy Castlemanovy choroby, s generalizovanou lymfadenopatií a splenomegalií, provázenou typickými B symptomy – úbytek hmotnosti 15 kg, horečky neinfekčního původu, noční pocení, symptomy anémie. Histologické vyšetření uzlin s nejvyšší akumulací fluorodeoxyglukózy, odebrané torakoskopicky z mediastina, prokázalo plazmocelulární typ Castlemanovy choroby. Vyšetření HIV a lidského herpesviru 8 (HHV-8) bylo negativní. Stanovení diagnózy nemoci předcházely 3 recidivy herpes zosteru, což svědčilo o alteraci imunity. Léčba byla zahájena kombinací talidomidu, dexametazonu a cyklofosfamidu. Po 2 měsících léčby nebyla zřetelná léčebná odpověď a pacient tuto léčbu špatně toleroval. Proto byl tento způsob léčby ukončen. Pro léčbu 2. linie byla zvolena léčba R-CHOP (Mabthera – rituximab, cyklofosfamid, adriamycin, vinkristin a prednison. V průběhu 2 cyklů této léčby se zmenšila lymfadenopatie a splenomegalie, ale léčbu provázely závažné infekční komplikace. Proto dále pokračovala pouze monoterapie přípravkem Mabthera v dávce 375 mg/m2 v 28denních intervalech. Tato léčba se ukázala jako účinná a dobře tolerovaná. Při kontrolním PET-CT vyšetření vymizela lymfadenopatie a splenomegalie a normalizovala se akumulace fluorodeoxyglukózy. Mabthera v monoterapii se v tomto případě ukázala jako účinný a velmi dobře tolerovaný lék. Pro multicentrickou formu Castlemanovy nemoci existuje v současnosti více účinných léčebných alternativ: léčba rituximabem v monoterapii či v kombinaci, léčba imunomodulačními léky (talidomid nebo lenalidomid), léčba protilátkami proti interleukinu 6 (siltuximab) nebo proti jeho receptoru (tocilizumab). V případně neúčinnosti jedné léčebné alternativy je nutné otestovat další alternativu. V tomto případně nebyla úspěšná léčba založená na talidomidu, zatímco léčba založená na přípravku Mabthera dosáhla vymizení projevů nemoci.
Klíčová slova:
Castlemanova choroba – Mabthera – rituximab – siltuximab – talidomidÚvod
U Castlemanovy choroby je dobře známý její morfologický obraz a klinický průběh. Příčiny vzniku této choroby neboli její etiopatogeneze, jsou zatím z větší části neznámé. Učebnice patologie popisují 2 základní formy Castlemanovy choroby (zvané též angiofolikulární hyperplazie lymfatických uzlin): hyalině vaskulární typ a plazmocelulární typ. Klinikové ze svého úhlu pohledu rozeznávají 2 prognosticky a léčebně zcela odlišné formy: unicentrickou a multicentrickou formu Castlemanovy nemoci [1].
Unicentrická forma je obvykle tvořena lokalizovaným zvětšením lymfatických uzlin, je obvykle asymptomatická, nebo symptomy jsou jen mírné a dominantně je za ně odpovědný tlak zvětšených uzlin na okolní orgány a tkáně. Chirurgická léčba zpravidla vše vyřeší.
Naproti tomu pacienti s multicentrickou formou Castlemanovy choroby mají multifokální zvětšení lymfatických uzlin a občas také splenomegalii a hepatomegalii. Nemoc způsobuje pravidelně B symptomy, jak je známe u pacientů s lymfomy: noční pocení, neinfekční subfebrilie až febrilie, úbytek hmotnosti. K častým příznakům patří také patologická únava (fatigue) a také příznaky závažné anémie. U osob s Castlemanovou chorobou mohou být projevy narušené imunity, např. vaskulitida [2].
K pravidelným laboratorním znakům multicentrické formy Castlemanovy nemoci patří anémie, zvýšená hodnota markerů zánětu (sedimentace, CRP), často zvýšená koncentrace celkové bílkoviny v séru způsobená vysokou koncentrací polyklonálních imunoglobulinů.
Cílem léčby (zjednodušeně řečeno) může být buď redukce počtu polyklonálních lymfocytů a plazmocytů, které tvoří lymfadenopatii u této choroby, anebo redukce patologicky zvýšené nadprodukce prozánětlivých cytokinů, hlavně interleukinu 6 a někdy i interleukinu 1. K dosažení redukce patologické lymfadenopatie lze použít monoklonální protilátku antiCD20, rituximab v monoterapii, případně v kombinaci s cytostatiky a kortikoidy. K dosažení snížení hladin prozánětlivých cytokinů lze použít imunomodulační léky (talidomid nebo lenalidomid) a nověji protilátky proti interleukinu 6 nebo jeho receptoru [2].
Cílem této práce je poukázat na fakt, že Castlemanova choroba nereagující na jednu léčebnou alternativu může pozitivně reagovat na jinou léčbu, neboli že u pacientů s multicentrickou formou Castlemanovy chorobu je třeba otestovat všechny léčebné alternativy. Již dříve jsme popsali nemocného, jehož nemoc nereagovala na léčbu rituximabem a zareagovala až na léčbu talidomidem a lenalidomidem [3,4]. Zde popisujeme nemocného, jehož choroba neustupovala po léčbě talidomidem a ustoupila až při léčbě rituximabem.
Popis případu
Muž, narozený roku 1941, byl v roce 2010 úspěšně operován pro nádor tlustého střeva (resekce a vytvoření anastomózy) s následnou adjuvantní chemoterapií a dle kontrol je bez známek diseminace této nemoci. V roce 2012 podstoupil totální prostatektomii pro lokalizovaný karcinom. Po operaci dostal transfuze krve a výsledkem bylo svědění kůže celého těla, dle pozdějšího histologického hodnocení tato reakce odpovídala potransfuzní reakci. V průběhu roku 2012 měl 2krát recidivy herpes zoster, což je další signál svědčící o alteraci T buněčné imunity.
Na naše pracoviště byl odeslán v květnu roku 2013 k diferenciální diagnóze zvýšené koncentrace imunoglobulinů a kolísavých teplot nejasné, neinfekční etiologie. Teploty přesahovaly 38 °C a někdy dosahovaly až ke 39 °C. Provázelo je výrazné noční pocení, tak intenzivní, že občas musel i měnit pyžamo. Jeho hmotnost za poslední rok poklesla ze 105 kg na 90 kg. Měl zřetelnou splenomegalii (asi 6 cm přes oblouk žeberní) a krční a axilární lymfadenopatii (1,5–3,0 cm). V červenci roku 2013 vznikla další, již třetí recidiva pásového oparu.
V laboratorních výsledcích byly tyto zásadní odchylky od normy: anémie s koncentrací hemoglobinu 106 g/l (norma je 135–176 g/l), zvýšená koncentrace celkové bílkoviny na 108 g/l (norma 64–83 g/l) a zvýšená koncentrace imunoglobulinu typu IgG 60,5 g/l (norma 7–16 g/l), ostatní typy imunoglobulinů byly v normě. Elektroforéza prokázala polyklonální zmnožení imunoglobulinů, monoklonální imunoglobulin nebyl prokázán. Volné lehké řetězce imunoglobulinů byly výrazně zvýšené, κ 511,79 mg/l a λ 148,69 mg/l, jejich poměr byl 3,44 (norma 0,26–1,65), takže výrazné zvýšení koncentrací obou typů volných lehkých řetězců při normální hodnotě kreatininu, ale jejich poměr byl jen nepatrně vychýlen od normy, což odpovídá polyklonálnímu zmnožení imunoglobulinů. Hodnoty CRP byly jen nepatrně nad normou.
První PET-CT vyšetření v červnu roku 2013 prokázalo generalizovanou lymfadenopatii s hraniční až lehce zvýšenou akumulací fluorodeoxyglukózy (FDG). Vyšší akumulace FDG byla jen v uzlinách mediastina a v plicních hilech (SUVmax 5,95), hraniční akumulace FDG pak v krčních a v tříselných uzlinách. Dále byla popsána hepatosplenomegalie s vyšší akumulací FDG ve slezině. Sonograficky však byl na periferních uzlinách popsán obraz reaktivní lymfadenopatie. Histologické hodnocení kostní dřeně bylo bez jednoznačné patologie. Multiparametrické flow-cytometrické vyšetření prokázalo v kostní dřeni 0,27 % plazmatických buněk polyklonálního charakteru, dále zvýšené množství B-lymfocytů včetně mladších forem a snížené zastoupení T-lymfocytů. Kostní dřeň byla vyšetřena i cytogeneticky, v populaci plazmocytů byla ve 23 % případů prokázána delece 13q14 (Rb1).
Histologické vyšetření periferní uzliny nepřineslo jasnou diagnózu, a proto v srpnu roku 2013 byly z torakoskopického zákroku odebrány uzliny k histologickému vyšetření. Cíleně byly odebrány ty uzliny, které nejvíce akumulovaly FDG. Histologické vyšetření uzlin z mediastina popsalo zachovalou strukturu lymfatické uzliny, v jejím parakortexu byla přítomna nápadná infiltrace hojnými polyklonálními plazmatickými buňkami CD 138+ κ+ λ+, místy byly zastiženy hyalinizované cévy. Patolog histologický obraz zhodnotil jako plazmocelulární typ Castlemanovy choroby.
Vyšetření na HIV bylo negativní. Vyšetření lidského herpesviru 8 (HHV-8) bylo také negativní.
Detekce HHV-8 je prováděna metodou polymerázové řetězové reakce (PCR) pomocí komerční soupravy CMV HHV6,7,8 R-gene firmy Argene (Francie) na pracovišti Centra molekulární biologie a genové terapie Interní hematologické a onkologické kliniky LF MU a FN Brno (kontakt: Mgr. Pavlína Volfová, PhD. , pvolfova@fnbrno. cz, Sekce oportunních infekcí, Dětská nemocnice, Černopolní 9, Brno 625 00). Výchozím biologickým materiálem pro toto vyšetření je 2,5–5 ml nesrážlivé periferní krve odebrané do zkumavky s EDTA. Transport vzorku do laboratoře je možný při pokojové teplotě, stabilita vzorku je 1–2 dny při 4 °C. Vyšetření HHV-8 není rutinně prováděno ve všech laboratořích, ale u pacientů se systémovými příznaky Castlemanovy choroby může mít přítomnost viru vliv na podanou léčbu.
Léčbu jsme chtěli zahájit režimem s talidomidem. 10. září 2013 jsme začali podávat cyklofosfamid 800 mg i. v. 1krát za 14 dní a dexametazon 20 mg vždy 4 dny po sobě 1krát za 14 dní. Od 2. měsíce léčby (cyklu), po schválení revizním lékařem, byl přidán k této léčbě MYRIN – thalidomid v dávce 100 mg denně. Léčbu cyklofosfamidem, talidomidem a dexametazonem toleroval pacient špatně, zhoršila se slabost, dušnost, objevily se otoky dolních končetin. Plicní embolie nebyla potvrzena. Při vyhodnocení léčebného efektu počátkem listopadu roku 2013 nebyla zřetelná žádoucí léčebná odpověď, a tak jsme tuto léčbu vyhodnotili jako málo účinnou a špatně tolerovanou a ukončili ji.
V rámci 2. linie léčby dostal pacient 12. listopadu 2013 kombinaci monoklonální protilátky antiCD20 (Mabthera) a chemoterapii CHOP (cyklofosfamid, adriamycin, vinkristin a prednison). Druhá aplikace té samé léčby následovala 16. prosince 2013. Léčba však byla komplikována dlouhodobější neutropenií, která se rozvinula i přes profylaktické podávání leukocytárních růstových faktorů a byla komplikována recidivující plicní infekcí. Proto v rámci další léčby pokračovala od 3. cyklu pouze monoterapie monoklonální protilátkou antiCD20 (Mabthera) ve standardní dávce 375mg/m2, což u pacienta činilo 800 mg, aplikovaná 1krát měsíčně, poslední v srpnu roku 2014.
Vyhodnocení léčby jsme provedli v červenci roku 2014. PET-CT vyšetření popsalo výraznou regresi dříve popsaných ložisek v mediastinu a v plicním parenchymu, nebyla popsána patologická akumulace v lymfatických uzlinách a výrazně se zmenšila slezina (obr. 1–4). Podobně se upravovaly i laboratorní markery nemoci, jak dokumentuje tab. 1. Léčba přípravkem Mabthera v monoterapii se v tomto případě ukázala jako účinná a dobře tolerovaná, a proto byla Mabthera podána celkem 8krát, podobně jako je tomu v léčebných protokolech u lymfomů. Hodnoty celkové bílkoviny a imunoglobulinu IgG se v průběhu léčby dostaly do fyziologického rozmezí, ne však koncentrace hemoglobinu. Vyšetření parametrů krvetvorby po ukončení léčby přípravkem Mabthera ukázalo snížení ferritinu i železa a následující kolonoskopické vyšetření prokázalo polypy – jejichž řešení pokračuje v lednu roku 2015.
Table 1. Nálezy charakterizující aktivitu choroby a jejich vývoj v průběhu léčby 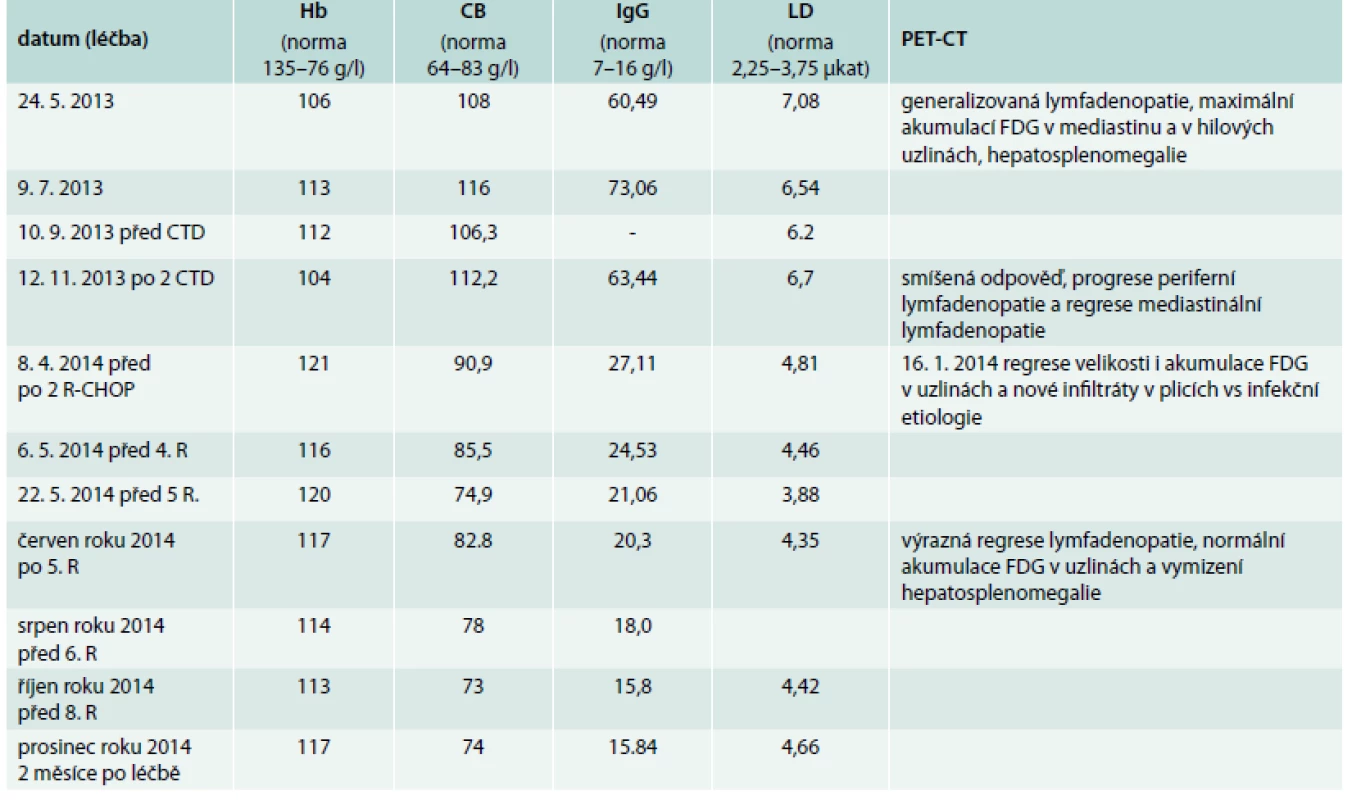
R – aplikace rituximabu v monoterapii Hb – hemoglobin CB – koncentrace celkové bílkoviny IgG – koncentrace imunoglobulinu typu IgG. Obr. 1 a 2. PET/CT studie z června roku 2013 a listopadu roku 2013 
Nahoře sumované obrazy (tzv. MIP), dole fúzované PET/CT axiální řezy mediastinem při aortálním oblouku. Patologickým obrazem je zvýšená akumulace FDG ve zvětšených mediastinálních uzlinách na iniciální studii, které v listopadu roku 2013 regredují (červené šipky). Abnormním nálezem na obou vyšetřeních je zvýšená akumulace FDG ve slezině (přesahující akumulaci jaterní). V listopadu roku 2013 se objevuje akumulace FDG v uzlinách pravé axily (zelené šipky) a na krku vlevo (černá šipka). Obr. 3 a 4. PET/CT studie z ledna roku 2014 a července roku 2014 
Nahoře sumované obrazy (tzv. MIP) a dole fúzované axiální řezy v mediastinu a plicích. Akumulace FDG v reziduích mediastinálních uzlin je již nízká (červené šipky). V lednu roku 2014 se však objevují zánětlivé infiltráty v plicích a plicních hilech (modré šipky), které v červenci roku 2014 regredují. Akumulace FDG ve slezině se již v lednu roku 2014 normalizovala (je již nižší než v játrech). Diskuse
Castlemanova choroba své jméno nese po Benjaminu Castlemanovi, autorovi prvního popisu lokalizované angiofolikulární hyperplazie z roku 1954 [5]. Mnohočetné postižení uzlin angiofolikulární hyperplazií bylo popsáno až v roce 1978 [6].
Multicentrická forma Castlemanovy nemoci je vzácná jednotka, s níž se setkávají hematologové, onkologové, revmatologové a virologové. Jak jsme uvedli v úvodu, její definice je založena na typickém morfologickém obrazu. Specifické histopatologické znaky či biomarkery pro tuto chorobu nejsou známy. Multicentrická forma Castlemanova choroby se dělí dle výsledků virologických vyšetření na:
- Castlemanovu chorobu s průkazem viru HIV
- Castlemanovu chorobu s průkazem lidského herpesviru 8 (HHV-8) metodou PCR v periferní krvi a anebo s pozitivitou latentního HHV-8 nukleárního antigenu v lymfatické tkáni
- idiopatickou multicentrickou Castlemanovu chorobu – případy, kdy není prokázán ani HIV ani HHV-8 infekce; tato forma je nejčastější
Přítomnost viru HIV byla prokázána jen u menšiny (u 15 %), přítomnost viru HHV-8 byla prokázána jen u 17 % [1].
Castlemanova choroba patří mezi velmi vzácné choroby. Epidemiologická data máme jen z odhadů provedených v USA, kde incidenci odhadli na 0,15 případů/1 milión obyvatel, a prevalenci na 2,4/1 milión obyvatel [1].
Morfologové v roce 2014 stále rozlišují jen 2 základní typy a další 2 typy jako odvozené varianty. V souboru asi 198 HIV negativních případů multicentrické formy Castlemanovy nemoci byly stanoveny tyto histologické typy:
- hyalině-vaskulární typ 17–49 %
- plazmocelulární typ 46–77 %
- smíšený typ, nesoucí znaky jak hyalinně vaskulárního a plazmocelulárního typu, 4–20 %
- plazmablastický typ, který se ale vyskytuje jedině při HHV-8 infekci [1,7]
Patofyziologie nemoci
Laboratorní analýzy genů pro imunoglobuliny a T buněčný receptor prokázaly, že lymfocytární proliferace je v případě idiopatické Castlemanovy nemoci polyklonální a že je důsledkem zvýšených koncentrací cytokinů. Průkaz klonálních buněk by měl vždy vzbudit podezření na existující klonální lymfoproliferaci či transformaci v ni. Nicméně i v této oblasti se ještě můžeme dočkat překvapení, protože výjimečně se objevila práce popisují klonalitu buněk u Castlemanovy nemoci. Chybí nám však definice vyvolávajícího činitele, nevíme ani, zda vyvolávajících činitelů nemůže být více. Víme jen, že míra agresivity průběhu koreluje s koncentrací interleukinu 6, který je považován za klíčový pro rozvoj symptomů a morfologie této nemoci. Narušení signální kaskády interleukinu 6 protilátkami proti interleukinu 6 nebo protilátkami proti receptoru pro interleukinu 6 vede k ústupům příznaku nemoci i velikosti lymfadenopatie [1,7].
Interleukin 6 je multifunkční cytokin, který indukuje plazmocytózu v kostní dřeni, hypergamaglobulinemii, zvýšenou tvorbu vaskulárního endoteliálního růstového faktoru (VEGF), trombocytózu, tvorbu proteinů akutního zánětu v játrech (tedy i CRP), aktivaci makrofágů a T buněk. Interleukin 6 je zodpovědný i za autoimunitní projevy, které Castlemanovu nemoc občas provázejí. V případně pacientů s POEMS syndromem (Polyneuropathy, Organomegaly, Endokrinopathy, Monoclonal gammopathy, Skin changes) se předpokládá zvýšení VEGF nezávislé na Il6 [1,7].
Určitou roli v patofyziologie hraje také interleukin 1, neboť byl popsán pacient nereagující na léčbu protilátkami proti interleukinu 6, který zareagoval na protilátky proti interleukinu 1 [8].
Morfologický obraz a problémy v morfologické diferenciální diagnostice
Histologický obraz plazmocelulární varianty Castlemanovy choroby je charakterizován výraznou interfolikulární plazmocytózou v lymfatické uzlině. Plazmocyty jsou polyklonální. Celková architektonika lymfatické uzliny je zachovaná. Interfolikulárně bývají zmnožené cévy. Lymfatické folikuly obsahují hyperplastická zárodečná centra. Malá část zárodečných center často vykazuje regresivní změny a může připomínat folikuly u hyalinně vaskulární varianty s koncentricky uspořádanými lymfocyty v plášťové zóně.
Bioptická diagnostika Castlemanovy choroby je obtížná. Zejména u plazmocelulární varianty jsou morfologické znaky značně nespecifické. Existuje celá řada nádorových, autoimunitních a infekčních onemocnění, která mohou imitovat obraz Castlemanovy choroby. Na druhou stranu jsou málokdy všechny morfologické znaky plně vyjádřené a odlišení od reaktivně změněné lymfatické uzliny může být problematické. Pokud je bioptický nález nejednoznačný a podezření na multicentrickou formu Castlemanovy choroby trvá, může být třeba exstirpovat a histologicky vyšetřit další lymfatickou uzlinu.
Průběh idiopatické multicentrické formy Castlemanovy nemoci
Idiopatická multicetrická forma Castlemanovy nemoci se typicky objevuje ve 4. a v 5. dekádě života, častěji u mužů než u žen. Z popisu případů je však zřetelné, že u většiny nemocných má choroba dlouholetý průběh, pacienty sice rychle nezabíjí, ale výrazně zhoršuje kvalitu jejich života. Projevy případné vaskulitidy mohou trvale invalidizovat (cévní mozkové příhody) a komplikují další léčbu i ošetřování. Vzhledem k narušení imunity se zvyšuje u těchto nemocných výskyt dalších maligních chorob ve srovnání s průměrnou populací [1,2,7,8].
Nemoc má na jedné straně spektra klinických obrazů příznivé průběhy se spontánními ústupy a recidivami s mírnou lymfadenopatií a B symptomy, na straně druhé spektra nepříznivě probíhající případy se závažnými B symptomy (neinfekční horečky, úbytek hmotnosti, noční pocení), dále může být přítomna obtěžující hepatosplenomegalie, retence tekutin (vedoucí až k anasarce, pleurálním výpotkům a ascitu) až k orgánovému selhání a smrti. K projevům patří symptomatická a klinicky závažná anémie a také tvorba kožních hemangiomů. V podstatně se popisují následné 4 formy klinických průběhů [9]:
- opakované relapsy a remise
- stabilní perzistující choroba
- progredující fatální choroba
- transformace v maligní lymfom
Poměrně často se objevují popisy komplikujících cévních mozkových příhod, které pravděpodobně souvisejí s vaskulitidou. Typické klinické a laboratorní nálezy pro multicentrickou formu Castlemanovy nemoci uvádí tab. 2.
Table 2. Typické klinické a laboratorní nálezy pro multicentrickou formu Castlemanovy nemoci 
Histologicky i klinicky se může překrývat průběh multicentrické formy Castlemanovy nemoci s osteosklerotickým myelomem a s POEMS syndromem, jak vyplývá z citované literatury. Souvislosti Castlemanovy choroby s POEMS syndromem čekají na objasnění. Proto je u každého pacienta s multicentrickou formou Castlemanovy choroby je vhodné pátrat po rysech POEMS syndromu a naopak [10–17].
U pacientů s multicentrickou formou Castlemanovy nemoci byly popsány i koincidence i s dalšími chorobami, které uvádí tab. 3.
Table 3. Popsané koincidence Castlemanovy choroby s dalšími nemocemi. Upraveno podle [7] ![Popsané koincidence Castlemanovy choroby s dalšími nemocemi. Upraveno podle [7]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/e4fe241037f916230a32aff695e751d3.png)
Léčba
Klasická chemoterapie
V letech před příchodem biologických léků do klinické praxe (antiCD20 protilátky a thalidomidu a lenalidomidu) byly testovány klasické chemoterapeutické kombinace používané pro léčbu maligních lymfomů. Léčba založená na kombinaci cytostatik v některých případech vedla k vymizení symptomů nemoci, ale jak plyne z naší zkušenosti, v případě alterované imunity provázející Castlemanovu nemoc a dlouhodobější neutropenie může být klasická chemoterapie provázena život ohrožujícími infekcemi. Přehled všech publikovaných zkušeností s klasickou chemoterapií lze nalézt v citované literatuře [18–20].
AntiCD20 protilátka (rituximab)
Mabthera (rituximab) je monoklonální protilátka proti povrchovému antigenu CD20, který je lokalizovaný na fyziologických i transformovaných B-lymfocytech. Po navázání dochází k destrukci těchto lymfocytů. A protože polyklonální B-lymfocyty tvoří převážnou část uzlin postižených Castlemanovou chorobou, je racionální použít cílené destrukce těchto buněk pomocí rituximabu. Mabthera je u této choroby účinná i v monoterapii, jak vyplývá z četných citovaných popisů případů, ale je možné také účinek přípravku Mabthera potencovat kombinací s dalšími léky, které se používají při léčbě maligních lymfomů, tedy s glukokortikoidy, a dále s alkylačními či tetracyklinovými cytostatiky. Tato léčba má potenciál navodit léta trvající kompletní remisi [21–31]. Gerald v roce 2007 popsal 92 % léčebných odezev při monoterapii přípravkrm Mabthera, přičemž léčebné odezvy měly dlouhodobý charakter, 79 % pacientů bylo po 2 letech sledování stále v remisi [32]. Léčba přípravkem Mabthera snižuje dle některých pozorování riziko pozdější transformace v maligní lymfom [33].
V literatuře lze najít několik prací, které popisují synergický účinek podání přípravku Mabthera a talidomidu. Talidomid, imunomodulační, antiinflamatorní a antiangiogenní lék má silnou aktivitu proti této nemoci i v monoterapii. Proto je doporučována kombinovaná léčba rituximabem a talidomidem [34,35].
IMIDs – imunomodulační léky
Talidomid byl jako první zařazen do skupiny IMIDs – immunomodulatory drugs. V lidském organizmu má velmi pestré účinky. Mimo jiné potlačuje tvorbu některých cytokinů, mezi nimi interleukinu 6 a VEGF. A právě tato jeho vlastnost – potlačovat tvorbu prozánětlivých cytokinů – jej činní účinným proti Castlemanově nemoci, jak dokládají četné popisy případů [39–47].
Bortezomib
Úspěchy bortezomibu u mnohočetného myelomu vedly k testování bortezomibu u plazmocelulární varianty Castlemanovy nemoci. A dle tří publikací, které popisují tuto léčbu, bylo podání bortezomibu spojeno s dosažením kompletní remise. Bortezomib je tedy po rituximabu dalším novým účinným lékem pro tyto nemocné [36–38].
Protilátka proti interleukinu 6 a jeho receptoru
V literatuře lze nalézt popisy případů s multicentrickou formou Castlemanovy nemoci úspěšně léčených protilátkou proti receptoru interleukinu 6 zvanou tocilizumab. Byla prokázána úspěšnost této léčby. Tato látka je používána hlavně v Asii a Japonsku, jak plyne z citované literatury [48–53].
V Evropské unii je od května roku 2014 registrována pro léčbu multicentrické formy Castlemanovy choroby protilátka proti interleukinu 6 zvaná siltuximab (SYLVANT). Podmínkou je nepřítomnost infekce HIV a nepřítomnosti infekce lidským herpesvirem 8 (HHV-8). Siltuximab tvoří stabilní komplexy s bioaktivními formami interleukinu 6 a brání jeho vazbě na rozpustné i membránové vazebné receptory. Siltuximab se podává v doporučené dávce 11 mg/kg formou intravenózní infuze 1krát za 3 týdny až do případného selhání léčby. Ošetřující lékař si musí být vědom, že přípravek siltuximab může maskovat známky akutního zánětu, včetně potlačení horečky a reaktantů akutní fáze, a naopak může vést ke zvýšení hodnoty triglyceridů a cholesterolu v séru. Proto se požaduje, aby pacienti měli vždy před podáním siltuximabu alespoň počet neutrofilů vyšší než 1,0 × 109/l a počet trombocytů vyšší než 50 × 109/1 a při závažné infekci by se léčba siltuximabem měla vždy přerušit [54–57].
Závěry pro praxi
- Nejasná lymfadenopatie a teploty trvající déle než 3 týdny mohou mít příčinu mimo jiné v Castlemanově nemoci.
- Polyklonální zvýšení imunoglobulinů a volných lehkých řetězců κ a λ a zvýšená koncentrace celkové bílkoviny, stejně jako zvýšené CRP bez příznaků infekce anebo anémie odpovídající anémii chronických chorob může mít příčinu v Castlemanově nemoci.
- PET-CT zobrazení je užitečné pro zjištění rozsahu nemoci i pro hodnocení léčebného efektu.
- Histologickou verifikaci nemoci je vhodné provádět z uzlin nejvíce akumulujících FDG, nediagnostický výsledek vyšetření periferní uzliny bez výrazné akumulace FDG tuto nemoc nevylučuje [58].
- Multicentrická forma Castlemanovy choroby může být spojena s defektem imunitní odezvy, a proto klasická chemoterapie a léčba vysokými dávkami glukokortikoidů může přivodit závažné nežádoucí komplikace (běžné i oportunní infekce).
- Základními léky pro multicentrickou formu Castlemanovy choroby jsou: Mabthera, léky ze skupiny IMIDs (talidomid, lenalidomid) a monoklonální protilátka proti interleukinu 6 (siltuximab) a proti receptoru pro interleukin 6 (tocilizumab).
- V případě, že nemoc nereaguje na zvolenou léčbou první linie, je třeba otestovat další ze jmenovaných léků, protože nemoc nereagující na jeden typ léčby může kompletně ustoupit po jiné léčbě, jak dokumentuje tento popis případu.
Děkujeme kolektivu pracovníků OKRZP Ústředí VZP ČR a MUDr. Haně Burkoňové, revizní lékařce RP VZP ČR Brno, kteří posuzovali celou problematiku, za povolení úhrady léčby velmi vzácné Castlemanovy choroby, pro kterou neexistují oficiální léčebná doporučení.
Text byl vytvořen v souvislosti s následujícími aktivitami: MZ ČR – RVO (FNBr, 65269705) a 23/14/NAP a NT13190–3/2012, NT14310–3/2013, NT12215–4/2011 NT 12215–4/2011, NT12215, MZ ČR – RVO (FNBr, 65269705) a dále OP VaVpl – RECAMO, CZ. 1. 05/2. 1. 00/03. 0101, MZ ČR – RVO (MOÚ 00209805), MUNI/A/0830/2013, NT12130 a NT 14575.
prof. MUDr. Zdeněk Adam CSc.
z.adam@fnbrno.cz
Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice
www.fnbrno.cz
Doručeno ro redakce 26. 9. 2014
Přijato po recenzi 12. 1. 2015
Sources
1. Robinson D Jr, Reynolds M, Casper C et al. Clinical epidemiology and treatment patterns of patients with multicentric Castleman disease: results from two US treatment centres. Br J Haematol 2014; 165(1): 39–48.
2. Szturz P, Moulis M, Adam Z et al. Castlemanova choroba. Klin Onkol 2011; 24(6): 424–434.
3. Szturz P, Adam Z, Chovancová J et al. Lenalidomide: a new treatment option for Castleman disease. Leuk Lymphoma 2012; 53(10): 2089–2091.
4. Adam Z, Pour L, Krejčí M et al. Účinnost lenalidomidu u vzácných krevních chorob: u histiocytózy z Langerhansových buněk, multicentrické Castlemanovy choroby, POEMS syndromu, Erdheimovy Chesterovy choroby a angiomatózy. Popis případů a přehled literatury. Vnitř Lék 2012; 58(11): 856–866.
5. Castleman B, Towe VW. Case report of the Massachusetts General Hospital weekly clinicopathological exercises, fouded by Richard C Cabot. N Engl J Med 1954; 251(10): 396–400.
6. Gaba AR, Stein RS, Sweet DJ et al. Multicentric giant node hyperplasia. Am J Clin Pathol 1978; 69(1): 86–90.
7. Fajgenbaum DC, van Rhee F, Nabel CS. HHV-8 negative idiopathic multicentric Castleman disease: novel insight into biology pathogenesis and therapy. Blood 2014; 123(19): 2924–2933.
8. El-Osta J, Janku F. Successful treatment of Castleman disease with interleukin-1 receptor antagonist (Anakinra). Mol Cancer Ther 2010; 9(6): 1485–1488.
9. Cronin DM, Warnke RA. Castleman disease: an update on classification and the spectrum of associated lesions. Adv Anat Pathol 2009; 16(4): 236–246.
10. Dispenzieri A. POEMS syndrome: 2011 update on diagnosis, risk-stratification, and management. Am J Hematol 2011; 86(7): 591–601.
11. Ruwan KP, Parakramawansha C, Wijeweera I et al. A case of POEMS syndrome with mixed hyaline vascular and plasma cell type Castleman’s disease. Ceylon Med J 2009; 54(2): 68–69.
12. Misri R, Kharkar V, Dandale A et al. Multiple capillary hemangiomas: a distinctive lesion of multicentric Castleman’s disease and POEMS syndrome. Indian J Dermatol Venereol Leprol 2008; 74(4): 364–366.
13. Dispenzieri A. Castleman disease. Cancer Treat Res 2008; 142 : 293–330.
14. Garcia T, Dafer R, Hocker S et al. Recurrent strokes in two patients with POEMS syndrome and Castleman’s disease. J Stroke Cerebrovasc Dis 2007; 16(6): 278–284.
15. Owens CL, Weir EG, Ali SZ. Cytopathologic findings in “POEMS” syndrome associated with Castleman disease. Diagn Cytopathol 2007; 35(8): 512–515.
16. Eisenbarth SC, Colegio OR, Iyer A et al. Images in neuro-oncology: a case of POEMS (Polyneuropathy, Organomegaly, Endocrinopathy, Monoclonal protein and Skin changes) in a patient with multicentric Castleman’s disease. J Neurooncol 2007; 81(2): 163–165.
17. Huang J, Wang L, Zhou W et al. Hyaline vascular Castleman disease associated with POEMS syndrome and cerebral infarction. Ann Hematol 2007; 86(1): 59–61.
18. Chronowski GM, Ha CS, Wilder RB et al. Treatment of unicentric and multicentric Castleman disease and the role of radiotherapy. Cancer 2001; 92(3): 670–676.
19. Wolf M, Van Offel JF, Van de Velde A et al. Multicentric plasma cell variant Castleman’s disease presenting with cutaneous vasculitis and pulmonary parenchymal involvement in a patient with ankylosing spondylitis: case report and review of the literature. Acta Clin Belg 2011; 66(4): 305–310.
20. Dham A, Peterson BA. Castleman disease. Curr Opin Hematol 2007; 14(4): 354–359.
21. Peker D, Martinez AE, Schwartz MA et al. Complete remission in 4 patients with human herpesvirus 8-associated multicentric Castleman disease using rituximab and liposomal doxorubicin, a novel chemotherapy combination. Clin Adv Hematol Oncol 2012; 10(3): 204–206.
22. Hoffmann C, Schmid H, Müller M et al. Improved outcome with rituximab in patients with HIV-associated multicentric Castleman disease. Blood 2011; 118(13): 3499–3503.
23. Fragasso A, Mannarella C, Ciancio A et al. Complete remission and virologic response to combined chemoimmunotherapy (R-CVP) followed by rituximab maintenance in HIV-negative, HHV-8 positive patient with multicentric Castleman disease. Leuk Lymphoma 2008; 49(11): 2224–2226.
24. Casquero A, Barroso A, Fernández Guerrero ML et al. Use of rituximab as a salvage therapy for HIV-associated multicentric Castleman disease. Ann Hematol 2006; 85(3): 185–187.
25. Ide M, Kawachi Y, Izumi Y et al. Long-term remission in HIV-negative patients with multicentric Castleman’s disease using rituximab. Eur J Haematol 2006; 76(2): 119–123.
26. Powles T, Stebbing J, Montoto S et al. Rituximab as retreatment for rituximab pretreated HIV-associated multicentric Castleman disease. Blood 2007; 110(12): 4132–4133.
27. Bestawros A, Michel R, Séguin C et al. Multicentric Castleman’s disease treated with combination chemotherapy and rituximab in four HIV-positive men: a case series. Am J Hematol 2008; 83(6): 508–511.
28. Buchler T, Dubash S, Lee V et al, Rituximab failure in fulminant multicentric HIV/human herpesvirus 8-associated Castleman’s disease with multiorgan failure: report of two cases. AIDS 2008; 22(13): 1685–1687.
29. Bower M, Veraitch O, Szydlo R et al. Cytokine changes during rituximab therapy in HIV-associated multicentric Castleman disease. Blood 2009; 113(19): 4521–4524.
30. Mian H, Leber B. Mixed variant multicentric Castleman disease treated with rituximab: case report. J Pediatr Hematol Oncol 2010; 32(8): 622.
31. Lee JP, Kim DK, Oh DY et al. Successfully treated multicentric Castleman’s disease with renal thrombotic microangiopathy using rituximab and corticosteroid. Clin Nephrol 2011; 75(2): 165–170.
32. Gérard L, Bérezné A, Galicier L et al . Prospective study of rituximab in chemotherapy-dependent human immunodeficiency virus associated multicentric Castleman’s disease: ANRS 117 CastlemaB Trial. J Clin Oncol 2007; 25(22): 3350–3356.
33. Gérard L, Michot JM, Burcheri S et al. Rituximab decreases the risk of lymphoma in patients with HIV-associated multicentric Castleman disease. Blood 2012; 119(19): 2228–2233.
34. Ramasamy K, Gandhi S, Flowers MT et al. Rituximab and thalidomide combination therapy for Castleman Disease. Br J Haematol 2012; 158(3): 421–423.
35. Stary G, Kohrgruber N, Herneth AM et al. Complete regression of HIV-associated multicentric Castleman disease treated with rituximab and thalidomide. AIDS 2008; 22(10): 1232–1234.
36. Wang X, Ye S, Xiong C et al. Successful treatment with bortezomib and thalidomide for POEMS syndrome associated with multicentric mixed-type Castleman’s disease. Jpn J Clin Oncol 2011; 41(10): 1221–1224.
37. Hess G, Wagner V, Kreft A et al. Effects of bortezomib on pro-inflammatory cytokine levels and transfusion dependency in a patient with multicentric Castleman disease. Br J Haematol 2006; 134(5): 544–545.
38. Sobas MA, Alonso Vence N, Diaz Arias J et al. Efficacy of bortezomib in refractory form of multicentric Castleman disease associated to POEMS syndrome (MCD-POEMS variant). Ann Hematol 2010; 89(2): 217–219.
39. Fishman SJ, Feins NR, D’Amato RJ et al. Long-term remission of Crohn’s disease treated with thalidomide: a seminal case report. Angiogenesis 1999; 3(3): 201–204.
40. Lee FC, Merchant SH. Alleviation of systemic manifestations of multicentric Castleman’s disease by thalidomide. Am J Hematol 2003; 73(1): 48–53.
41. Starkey CR, Joste NE, Lee FC. Near-total resolution of multicentric Castleman disease by prolonged treatment with thalidomide. Am J Hematol 2006; 81(4): 303–304.
42. Kim SY, Lee SA, Ryoo HM et al. Thalidomide for POEMS syndrome. Ann Hematol 2006; 85(8): 545–546.
43. Wang X, Ye S, Xiong C et al. Successful treatment with bortezomib and thalidomide for POEMS syndrome associated with multicentric mixed-type Castleman’s disease. Jpn J Clin Oncol 2011; 41(10): 1221–1224.
44. Menegato MA, Canelles MF, Tonutti E et al. Remission of nephrotic syndrome after thalidomide therapy in a patient with Castleman’s disease. Clin Nephrol 2004; 61(5): 352–356.
45. Miltenyi Z, Toth J, Gonda A et al. Successful immunomodulatory therapy in castleman disease with paraneoplastic pemphigus vulgaris. Pathol Oncol Res 2009; 15(3): 375–381.
46. Zhao X, Shi R, Jin X et al. Diffuse hyperpigmented plaques as cutaneous manifestation of multicentric Castleman disease and treatment with thalidomide: report of three cases. J Am Acad Dermatol 2011; 65(2): 430–432.
47. Jung CP, Emmerich B, Goebel FD et al. Successful treatment of a patient with HIV-associated multicentric Castleman disease (MCD) with thalidomide. Am J Hematol 2004; 75(3): 176–177.
48. Galeotti C, Boucheron A, Guillaume S et al. Sustained remission of multicentric Castleman disease in children treated with tocilizumab, an anti-interleukin-6 receptor antibody. Mol Cancer Ther 2012; 11(8): 1623–1626.
49. Yuzuriha A, Saitoh T, Koiso H et al. Successful treatment of autoimmune hemolytic anemia associated with multicentric Castleman disease by anti-interleukin-6 receptor antibody (tocilizumab) therapy. Acta Haematol 2011; 126(3): 147–150.
50. Higuchi T, Nakanishi T, Takada K et al. A case of multicentric Castleman’s disease having lung lesion successfully treated with humanized anti-interleukin-6 receptor antibody, tocilizumab. J Korean Med Sci 2010; 25(9): 1364–1367.
51. Arita Y, Sakata Y, Sudo T et al. The efficacy of tocilizumab in a patient with pulmonary arterial hypertension associated with Castleman’s disease. Heart Vessels 2010; 25(5): 444–447.
52. Song SN, Tomosugi N, Kawabata H et al. Down-regulation of hepcidin resulting from long-term treatment with an anti-IL-6 receptor antibody (tocilizumab) improves anemia of inflammation in multicentric Castleman disease. Blood 2010; 116(18): 3627–3634.
53. Nishimoto N, Terao K, Mima T et al. Mechanisms and pathologic significances in increase in serum interleukin-6 (IL-6) and soluble IL-6 receptor after administration of an anti-IL-6 receptor antibody, tocilizumab, in patients with rheumatoid arthritis and Castleman disease. Blood 2008; 112(10): 3959–3964.
54. Williams SC. First IL-6-blocking drug nears approval for rare blood disorder. Nat Med 2013; 19(10): 1193.
55. Liu YC, Stone K, van Rhee F. Siltuximab for Multicentric Castleman disease. Expert Rev Hematol 2014; 7(5): 545–557.
56. van Rhee F, Fayad L, Voorhees P et al. Siltuximab, a novel anti-interleukin-6 monoclonal antibody, for Castleman’s disease. J Clin Oncol 2010; 28(23): 3701–3702.
57. Kurzrock R, Voorhees PM, Casper C et al. A phase I, open-label study of siltuximab, an anti-IL-6 monoclonal antibody, in patients with B-cell non-Hodgkin lymphoma, multiple myeloma, or Castleman disease. Clin Cancer Res 2013; 19(13): 3659–3670.
58. Szturz P, Adam Z, Řehák Z et al. Castlemanova choroba: retrospektivní studie léčebných výsledků u 10 pacientů z jednoho centra. Klin Onkol 2013; 26(2): 124–134.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 3-
All articles in this issue
- Neceliakální glutenová senzitivita – editorial
- Neceliakální glutenová senzitivita – editorial
- Naše zkušenosti s hormonální léčbou transsexuálních pacientů
- Má tělesná výška vliv na závažnost chronického žilního onemocnění na dolních končetinách?
- Zkušenosti s léčbou biosimilárními léky
- Najnovšie aspekty diagnostiky a terapie hyponatriémie
- Neceliakální glutenová senzitivita
- Chronická tromboembolická plicní hypertenze
- Nové doporučené postupy ESC pro diagnostiku a léčbu akutní plicní embolie
-
Syndróm vénovej panvovej kongescie – diagnóza a manažment
Odporúčanie Angiologickej sekcie Slovenskej lekárskej komory (2015) -
PET-CT dokumentovaná remise multicentrické formy Castlemanovy choroby po léčbě rituximabem
Popis případu a přehled literatury - Hypersenzitivní reakce po podání heparinu s aktivací heparinem indukované trombocytopenie po zahájení intermitentní hemodialýzy
- Vybrané právní aspekty povinné mlčenlivosti
-
Lehké hypoglykemie jsou v České republice u pacientů s diabetem 2. typu léčených inzulinovými analogy běžné a jejich výskyt pacienty znepokojuje
Výsledky průzkumu GAPP2TM (Global Attitudes of Patient and Physicians) - Hormonální léčba transsexuálních pacientů – editorial
- Nejnovější aspekty diagnostiky a terapie hyponatremie – editorial
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Naše zkušenosti s hormonální léčbou transsexuálních pacientů
-
Syndróm vénovej panvovej kongescie – diagnóza a manažment
Odporúčanie Angiologickej sekcie Slovenskej lekárskej komory (2015) - Neceliakální glutenová senzitivita
- Najnovšie aspekty diagnostiky a terapie hyponatriémie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



