-
Medical journals
- Career
Najnovšie aspekty diagnostiky a terapie hyponatriémie
: Igor Šturdík; Monika Adamcová; Juraj Payer
: V. interná klinika LF UK a UN Bratislava, Slovenská republika, prednosta prof. MUDr. Juraj Payer, PhD., FRCP
: Vnitř Lék 2015; 61(3): 209-2018
: Review
Hyponatriémia patrí medzi najčastejšie elektrolytové dysbalancie v bežnej klinickej praxi, ktorá je asociovaná so zvýšenou morbiditou a mortalitou pacientov. V súčasnosti je podrobnejšie prebádaná patofyziológia vzniku hyponatriémie pri jednotlivých vyvolávajúcich príčinách, medzi ktorými hlavnú úlohu zohráva antidiuretický hormón a osmoregulačné mechanizmy. Článok oboznamuje pre klinickú prax s relatívne novým delením hyponatriémie na základe závažnosti klinických príznakov a efektívnej osmolality séra, ponúka zjednodušené postupy pri diagnostike a liečbe hyponatriémie, ktoré sú založené na aktuálnych odporúčaniach svetových odborných spoločností a na podklade medicíny dôkazov.
Kľúčové slová:
diagnostika – hyponatriémia – liečba – patofyziológiaÚvod
Sodík je základným iónom v ľudskom organizme, tvorí viac ako 90 % katiónov v extracelulárnej tekutine u dospelého človeka a s príslušnými aniónmi udržiava osmotický tlak, podmieňuje objem extracelulárnej tekutiny a podieľa sa na udržiavaní homeostázy vnútorného prostredia. Hyponatriémia je definovaná ako zmena množstva sodíka v extracelulárnej tekutine a zmena veľkosti extracelulárnej tekutiny v neprospech sodíka. Z laboratórneho hľadiska je hodnotená ako pokles koncentrácie sodíka v plazme pod 135 mmol/l. Hyponatriémia patrí medzi najčastejšie elektrolytové abnormality v bežnej klinickej praxi, jej prevalencia u hospitalizovaných pacientov je 15–20 % [1–3]. Hoci u väčšiny pacientov ide o ľahký pokles sodíka, hyponatriémia má v klinickej praxi svoj význam. Zo štúdií je zrejmé, že hyponatriémickí pacienti s rôznymi pridruženými ochoreniami majú vyššiu mortalitu a morbiditu [4–8], u pacientov s koncentráciou sodíka < 120 mmol/l stúpa pravdepodobnosť úmrtia až na 50 % [9,10]. V našej nedávno publikovanej práci sme kontrolovanou retrospektívnou štúdiou z prostredia bežného interného oddelenia potvrdili, že v porovnaní s pacientmi bez hyponatriémie stúpa úmrtnosť hyponatriémických pacientov až 3-násobne, a preto možno hyponatriémiu považovať za nezávislý prognostický faktor nemocničnej mortality [2]. Problematika hyponatriémie je aktuálna, čo dosvedčuje fakt, že v priebehu roku 2014 vyšli odporúčania európskych [11] aj amerických endokrinologických spoločností [4] ohľadom diagnostiky a liečby hyponatriémie, pričom sa tieto odporúčania odlišujú v niektorých postupoch. V našom článku vychádzame z európskych odporúčaní.
Patofyziológia a klinické príznaky hyponatriémie
Hyponatriémia je primárne poruchou vodného hospodárstva s relatívnym nadbytkom telesnej vody oproti obsahu telesného sodíka a draslíka a je zvyčajne asociovaná s poruchou vylučovania antidiuretického hormónu – vazopresínu. Zmeny sérovej koncentrácie nátria a s ním spojených aniónov spôsobujú zmeny sérovej osmolality. V rámci patofyziológie hyponatriémie je dôležité odlišovať pojem celkovej sérovej osmolality od efektívnej osmolality – tonicity séra. Celková osmolalita je koncentrácia všetkých častíc v danom množstve vody (mmol/kg), bez ohľadu na to, či častice môžu alebo nemôžu prechádzať cez biologické membrány. Tonicita séra je počet častíc, ktoré sa podieľajú na presune vody medzi extracelulárnym a intracelulárnym priestorom, u membrán oddeľujúcich extracelulárny a intracelulárny priestor funkčne vyjadruje ich relatívnu priepustnosť pre častice [12]. Iba osmoticky efektívne častice vytvárajú osmoticky aktívny gradient cez bunkové membrány a spôsobujú pohyb vody medzi intracelulárnym a extracelulárnym priestorom. Vo väčšine prípadov hyponatriémia vzniká v dôsledku hypotonicity séra, čo spôsobuje príznaky opuchu buniek, hoci vzácne sa môže hyponatriémia vyskytovať aj pri izotonickom alebo hypertonickom sére, ak sérum obsahuje veľa prídavných osmoticky aktívnych častíc, ako je glukóza či manitol. Pri hyponatriémii sa stretávame aj so stavmi, pri ktorých je objem extracelulárnej tekutiny znížený, normálny alebo zvýšený. Hoci klinické zhodnotenie objemu vody u pacienta je v praxi často obtiažne, ukázalo sa, že koncept objemového statusu je užitočný, pretože pomáha pochopiť diagnostiku a následnú liečbu hypoosmolárnej hyponatriémie.
Regulácia príjmu vody a homeostáza
Sérová koncentrácia sodíka je daná relatívnym množstvom extracelulárnej vody k sodíku, môže byť regulovaná príjmom a výdajom vody. Hlavnými mechanizmami regulácie vodného metabolizmu sú smäd a vylučovanie vazopresínu, slúžia na minimalizáciu osmoticky indukovanej disrupcie buniek. Osmoreceptory, neuróny lokalizované v prednom hypotalame, detekujú zmeny v rozpínaní buniek v dôsledku zmien systémovej efektívnej osmolality. Zníženie rozpínania buniek spustí signalizáciu osmoreceptívnych neurónov, čo vedie k vzniku smädu a vyplavovaniu vazopresínu z podmozgovej žľazy. Vazopresín zvyšuje reabsorpciu vody z primárneho moču v distálnych tubuloch nefrónov a moč sa stáva viac koncentrovaný. Aby u človeka nepretrvával neustále smäd, prah na vyplavovanie vazopresínu je nižší ako prah na spustenie smädu [12]. Za bežných okolností vyplavovanie vazopresínu zo zadnej časti hypofýzy závisí na efektívnej osmolalite séra. Informáciu o osmolalite séra prenášajú centrálne a periférne osmoreceptory, ktoré exprimujú na povrchu svojich buniek iónové transmembránové kanály nazvané tranzientný receptorový napäťový vanilloid 1 a 4 (TRPV1 a TRPV4) [13,14]. Katiónové kanály TRPV1 a TRPV4 premieňajú osmoticky navodené zmeny v bunkovom objeme na funkčne relevantné zmeny v membránovom potenciáli. Osmoticky aktivovaný kanál TRPV1 sa tvorí v magnocelulárnych bunkách a v cirkumventrikulárnych štruktúrach mozgu, ktoré produkujú aj vazopresín [15,16]. TRPV4 bol nedávno identifikovaný v torakálnych gangliách zadných miechových povrazcov [14]. Cirkulujúci objem snímajú na rozpínanie buniek citlivé receptory v ľavej predsieni, karotickom sinuse a aortálnom oblúku. Pri vzostupe cirkulujúceho objemu aferentné nervové impulzy inhibujú sekréciu vazopresínu [12], naopak pri poklese objemu sa spomalí výtoková rýchlosť v oblasti receptorov a stúpa vazopresínová sekrécia [17]. Zníženie tlaku krvi už iba o 5 % mení sérovú koncentráciu vazopresínu, pričom vazopresín v krvi stúpa, tak ako tlak krvi postupne klesá, a predpokladá sa závislosť exponenciálneho tvaru medzi sérovou koncentráciou vazopresínu a percentuálnym poklesom stredného tepnového tlaku krvi. Pretože osmoregulácia a baroregulácia sekrécie vazopresínu sú navzájom závislé mechanizmy, je exkrécia vody obličkami udržiavaná na nižšej hodnote sérovej osmolality, ktorá predstavuje osmolalitu ako pri mierne zníženom cirkulačnom objeme [18]. Ako sa cirkulačná hypovolémia zhoršuje, sérová koncentrácia vazopresínu dramaticky stúpa a baroregulácia preváži nad osmoregulačným systémom. Osmosenzitívne neuróny sú lokalizované v mozgu v subfornickej štruktúre a v organum vasculosum lamina terminalis. Tieto neuróny ležia navonok od mozgovo-krvnej bariéry, a preto integrujú informácie o osmolalite s endokrinnými signálmi vďaka hormónom ako angiotenzín II a atriálny nátriuretický peptid. Angiotenzín II priamo vplýva na osmoregulačné neuróny, zosilňuje pomerný vzťah medzi osmolalitou, receptorovým a akčným potencionálom neurónov supraoptického jadra, hovoríme o osmosenzorickej transdukcii [19]. Zadná časť hypofýzy je jediným orgánom, kde dochádza k regulovanému uvoľňovaniu vazopresínu. Za patologických okolností môžu bunky hypofýzy aj iné bunky syntetizovať a uvoľňovať vazopresín nezávisle od sérovej koncentrácie alebo cirkulujúceho objemu. Tento stav po prvýkrát Schwartz a Bartter nazvali ako syndróm neadekvátnej sekrécie antidiuretického hormónu (SIADH) [20]. Dnes už vieme, že genetické a farmakologické vplyvy môžu tiež zvýšiť permeabilitu vody v zberných kanálikoch obličiek za absencie vazopresínu, preto sa v súčasnosti preferuje termín syndróm neadekvátnej antidiurézy (SIAD). Aby sa mohla reabsorbovať voda v zberných kanálikoch obličiek a koncentrovať moč, musia sa stať zberné kanáliky permeabilné pre vodu. Bazolaterálna membrána buniek je vždy permeabilná pre vodu prostredníctvom vodných kanálov akvaporínu 3 a 4. Vazopresín reguluje permeabilitu cez apikálnu membránu inzerciou akvaporínu 2. Vďaka priestorovej konfigurácii Henleho slučiek prechádzajú solúty z kôry obličky do drene a následná vysoká osmolalita drene obličiek zabezpečuje hnaciu silu potrebnú pre reabsorpciu vody zo zberných kanálikov [11]. Vzhľadom na reabsorpciu sodíka a urey z lúmenu, osmolalita špičky drene môže dosiahnuť v prípade deplécie vody až 1 200 mosm/l. Dreňovú osmolalitu určuje maximálna osmolalita moču a je ovplyvnená vazopresínom.
Pseudohyponatriémia
Pseudohyponatriémia je laboratórny artefakt, ktorý vzniká pri abnormálne vysokej koncentrácii lipidov alebo proteínov v krvi, čo interferuje s presným meraním sodíka. S pseudohyponatriémiou sme sa často stretávali v minulosti pri meraniach sodíka pomocou plameňovej fotometrie, v súčasnosti sa koncentrácia sodíka meria podstatne senzitívnejšie ión selektívnymi elektródami. Pseudohyponatriémia sa však stále vyskytuje aj v dnešnej dobe [21]. Dôvodom je, že pri laboratórnom vyšetrení sú všetky vzorky žilovej krvi nariedené a pri počítaní koncentrácie sodíka sa vyžaduje konštantná distribúcia medzi vodou a pevnou fázou séra. Sérová osmolalita sa meria v nerozriedenej vzorke, a preto výsledok bude v medziach normy aj v prípade pseudohyponatriémie [21]. Ak meranie sérovej osmolality nie je k dispozícii, priama potenciometria s použitím analyzátora krvných plynov odhalí skutočnú koncentráciu sodíka, pretože toto vyšetrenie tiež prebieha v nerozriedenej vzorke krvi.
Syndróm „reset osmostat“
Príčinou chronickej hyponatriémie v niektorých podmienkach je zmena nastavovacieho bodu a sklonu osmoregulačnej krivky v mechanizme regulácie osmolality, pričom reakcia osmoreceptorov na vylučovanie vazopresínu ostáva nedotknutá [12]. S týmto javom sa stretávame napr. v tehotenstve, počas ktorého je sérová koncentrácia sodíka znížená len o 4–5 mmol/l.
Izotonická hyponatriémia
U väčšiny pacientov sa stretávame s hypotonickou hyponatriémiou, čiže sú znížené sérová koncentrácia sodíka ako aj efektívna osmolalita. Niekedy sérum obsahuje ďalšie častice, ktoré zvyšujú efektívnu osmolalitu a znižujú sérovú koncentráciu sodíka pritiahnutím vody z intracelulárneho priestoru. Príkladom sú glukóza (hyperglykémia pri nekontrolovanom diabetes mellitus) [22], manitol a glycín (absorpcia zavlažovacích tekutín počas urologických a gynekologických operácií) [23,24]. Výsledkom je, že „translokačná“ hyponatriémia sa často mylne považuje za pseudohyponatriémiu, hoci pri pseudohyponatriémii je sérová osmolalita v norme a nevyskytujú sa žiadne presuny vody.
Hypertonická hyponatriémia
V prípadoch hyponatriémie indukovanej hyperglykémiou je hyponatriémia spôsobená dilúciou v dôsledku hyperosmolality. Je dôležité odlišovať meranú osmolalitu séra od efektívnej osmolality [25]. Ako sa voda vracia do intracelulárneho priestoru počas liečby hyperglykémie, mala by sa sérová koncentrácia sodíka zvyšovať, čo vedie ku konštantnej efektívnej osmolalite. Ak tomu tak nie je, môže vzniknúť edém mozgu v dôsledku príliš rýchleho zníženia efektívnej osmolality [26].
Hypotonická hyponatriémia so zníženým objemom extracelulárnej tekutiny
Pri hypotonickej hyponatriémii je znížený extracelulárny objem tekutín s alebo bez deficitu sodíka, čím sa môže výrazne zvýšiť sekrécia vazopresínu. To vedie k zadržiavaniu vody napriek hypotonicite séra. Z hľadiska osmoregulácie je toto uvoľnenie vazopresínu síce nevhodné, ale je dôležité na zachovanie intravaskulárneho objemu.
Extrarenálne straty sodíka
K stratám sodíka gastrointestinálnym traktom dochádza pri hnačkách a zvracaní. Pri početných hnačkách obličky zadržiavajú sodík v snahe zachovať potrebnú hladinu sodíka, preto koncentrácia sodíka v moči je nízka. V prípade zvracania metabolická alkalóza spôsobí straty sodíka obličkami, pretože sodík sprevádza bikarbonát odchádzajúci močom napriek aktivovanému renín-angiotenzínovému systému. Transdermálne straty sodíka pozorujeme pri porušenej kožnej bariére pri rozsiahlych popáleninách a pri cystickej fibróze, kedy dochádza k poruchám reabsorpcie sodíka v potných žľazách.
Renálne straty sodíka
Diuretiká, najmä tiazidové, vedú k strate sodíka, ku zníženiu objemu extracelulárnej tekutiny a následne sa uvoľňuje vazopresín. Predpokladá sa, že tiazidy dokážu priamo indukovať uvoľnenie vazopresínu alebo zvyšujú vnímavosť zberných kanálikov na cirkulujúci vazopresín. Tento efekt diuretík sa prejaví len u časti pacientov [27]. Slučkové diuretiká hyponatriémiu spôsobujú iba výnimočne, pretože redukujú osmolalitu v dreni obličiek a znižujú ich schopnosť koncentrovať moč [28]. Pri primárnom hypoaldosteronizme sa hypovolemická hyponatriémia vyskytne ako prvý a často jediný príznak ochorenia. Syndróm cerebrálnej straty soli (CSWS – cerebral salt-wasting syndrome) pri subarachnoidálnom krvácaní, traumách hlavy, nádoroch centrálnej nervovej sústavy (CNS), neurochirurgických zákrokoch vzniká v dôsledku zvýšených hladín nátriuretického peptidu. Diagnostika CSWS je obťažná, preto je v klinickej praxi naddiagnostikovaným ochorením, často sa zamieňa za syndróm inadekvátnej diurézy a sekundárnu adrenálnu insuficienciu [29]. Nefropatie asociované so stratou soli ako tubulopatie po chemoterapii, analgetické nefropatie či cystické ochorenie obličiek sú stavy, pri ktorých oblička stratila schopnosť reabsorbovať primerané množstvo sodíka [30]. Straty do tretieho priestoru môžu výrazne znížiť cirkulujúci objem únikom tekutiny z ciev s následnou aktiváciou baroreceptorov a uvoľnením vazopresínu, čo môže mať za následok zníženie sérovej hladiny sodíka. Patria sem ileózne stavy, pankreatitídy, sepsa alebo traumy, pričom podávanie hypotonických tekutín hyponatriémiu len prehĺbi.
Hypotonická hyponatriémia s normálnym objemom extracelulárnej tekutiny
Euvolemická hyponatriémia je zapríčinená absolútnym zvýšením telesnej vody z nadmerného príjmu tekutín a zároveň je prítomná porucha exkrécie čistej vody, a to buď z dôvodu neprimeranej sekrécie vazopresínu alebo z nedostatočného príjmu solútov. Pri SIAD je vylučovanie vazopresínu nezávislé od tonicity séra a celkového objemu tekutín, pričom sa vazopresín uvoľňuje z hypofýzy či z ektopického ložiska. Eventuálne SIAD vzniká zo zvýšenej aktivity vazopresínu v zberných kanálikoch alebo pri mutácii napäťového receptora 2 [31]. SIAD ostáva exklúznou diagnózou a stále sú platné diagnostické kritériá navrhnuté Bartterom a Schwartzom [20] (tab. 1). Celková anestézia, nauzea, bolesť, stres a rozličné medikamenty sú u hospitalizovaných pacientov nešpecifické, ale potentné stimuly pre sekréciu vazopresínu, ktoré sú častými príčinami SIAD. Najčastejšími príčinami SIAD sú malobunkové karcinómy pľúc, karcinómy tráviaceho traktu, zápaly pľúc, ochorenia CNS a lieky ako selektívne inhibítory spätného vychytávania serotonínu, antiepileptiká, chemoterapeutiká, analógy vazopresínu [32]. Nedávno boli zistené aj genetické poruchy spôsobujúce SIAD [33]. Pri sekundárnej adrenálnej insuficiencii nie je zníženie aldosterónu tak výrazné ako pri primárnej forme, a preto nie sú dôvodom hyponatriémie straty sodíka obličkami, ale hypokorticizmus pri nedostatočnej sekrécii adrenokortikotropného hormónu. Za normálnych okolností kortizol potláča tvorbu vazopresínu v hypotalame. Trvale nízke hodnoty kortizolu nedokážu adekvátne potlačiť tvorbu vazopresínu a k hyponatriémii dochádza podobne ako pri SIAD [34]. Hypotyreóza je iba zriedkavo príčinou klinicky závažnej hyponatriémie, hoci je zahrnutá vo všetkých diagnostických postupoch. Zistilo sa, že zníženie sérovej koncentrácie sodíka o 0,14 mmol/l je sprevádzané vzostupom tyreostimulačného hormónu o 10 mU/l [35]. Hyponatriémia sa môže vyskytnúť pri myxedéme ako následok zníženého srdcového výdaja a glomerulárnej filtrácie. Príčinou euvolemickej hyponatriémie je aj nadmerný príjem bezsolútovej vody. Aktivita vazopresínu chýba, osmolalita moču je veľmi nízka, zvyčajne pod 100 mmol/kg. Pri primárnej polydypsii, často v rámci základného psychiatrického ochorenia, príjme pacient viac vody ako môžu obličky vylúčiť. Na hyponatriémii sa v tomto prípade najviac podieľa príjem nadmerného množstva vody, ale môžu sa pridružiť aj straty solútov obličkami alebo získané zhoršenie exkrécie čistej vody [36]. Množstvo vody, ktorú môžu obličky denne odstrániť, závisí od vylučovania solútov, a tým aj od ich príjmu. Ak je príjem solútov relatívne nízky vzhľadom k prijatej vode, môže dochádzať k hyponatriémii z nadmerného príjmu vody, ktorú pozorujeme napr. u pacientov s anorexiou, s takzvanou „čaj a toast“ hyponatriémiou a pivnou potomániou (hyponatriémia pri notorickom pití piva).
1. Diagnostické kritéria syndrómu neadekvátnej antidiurézy. Upravené podľa [20] ![Diagnostické kritéria syndrómu neadekvátnej antidiurézy. Upravené podľa [20]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/f72902ace71b660b1a49d0a3c8d2e257.png)
Hypotonická hyponatriémia so zvýšeným objemom extracelulárnej tekutiny
Renálne zlyhávanie
Pri poklese glomerulárnej filtrácie sa znižuje schopnosť obličiek vylučovať čistú vodu a v pokročilom štádiu obličkového ochorenia sa už osmolalita moču približuje osmolalite séra. Na vylučovaní čistej vody sa nepodieľa vazopresín, ale závisí od počtu vylúčených solútov. Pri nedodržaní reštrikcie tekutín dôjde ľahko k rozvoju hyponatriémie.
Srdcové zlyhávanie
Približne 20–30 % pacientov s chronickým srdcovým zlyhávaním triedy NYHA III-IV má hyponatriémiu, čo je spojené so závažnejším zlyhávaním srdca. U takýchto pacientov stúpa mortalita, pričom ostáva neobjasnené, či hyponatriémia odráža závažnosť ochorenia, alebo je jeho následkom [37]. Hoci retencia sodíka obličkami vedie k zvýšeniu objemu extracelulárnej tekutiny, efektívny objem cirkulujúcej krvi je znížený v dôsledku nedostatočného srdcového výdaja, a to vyvolá vylučovanie vazopresínu hypofýzou cez baroreceptory mediovanú humorálnu aktivitu. Súčasne sa aktivuje systém renín-angiotenzín a zvýšené vylučovanie vazopresínu spôsobí retenciu sodíka obličkami a zvýši osmolalitu moču. Ku vzniku hyponatriémie u pacientov so srdcovým zlyhaním môže prispieť aj užívanie diuretík.
Pečeňové zlyhanie
Systémová vazodilatácia a arteriovenózne skraty pri cirhóze pečene znižujú cirkulujúci objem a uvoľnením vazopresínu dochádza k retencii vody, pričom ku vzniku hyponatriémie prispieva aj užívanie diuretík [38].
Nefrotický syndróm
Pri nefrotickom syndróme znížený onkotický tlak môže vyvolať pokles objemu cirkulujúcej krvi a následná sekrécia vazopresínu sa podieľa na vzniku hyponatriémie. Sklon ku zadržiavaniu vody je spojený s retenciou sodíka, čo vyžaduje často intenzívnejšiu diuretickú liečbu.
Diagnostický algoritmus hyponatriémie
Na začiatku celého diagnostického procesu je nutné zaklasifikovať hyponatriémiu. Hyponatriémiu delíme z viacerých hľadísk. Podľa biochemickej závažnosti na ľahkú (130–135 mmol/l), stredne ťažkú (125–130 mmol/l) a ťažkú (pod 125 mmol/l). Podľa doby trvania na akútnu (dokumentovaná existencia < 48 hod) a chronickú (dokumentovaná existencia > 48 hod). Ak z časového hľadiska nemožno hyponatriémiu určiť jednoznačne, považujeme ju za chronickú dovtedy, kým nepreukážeme opak (tab. 2). Príznaky hyponatriémie sa líšia od ľahkých (apatia, porucha pozornosti), cez stredne závažné (bolesť hlavy, zmätenosť, dezorientácia, nauzea, kognitívny deficit, instabilita, pády) až po ťažké (vracanie, kŕče, kardiorespiračné poruchy, porucha vedomia až smrť) (tab. 3). Podľa klinických príznakov delíme hyponatriémiu na stredne závažne symptomatickú a závažne symptomatickú, čo znamená akýkoľvek biochemický stupeň hyponatriémie v prítomnosti stredne závažných alebo závažných symptómov hyponatriémie [11]. Závažnosť príznakov hyponatriémie závisí aj od rýchlosti jej vzniku. Pacienti s chronickou hyponatriémiou sú dobre adaptovaní na nižšie hodnoty sodíka, mávajú zvyčajne ľahké prejavy. U pacientov s akútnou formou hyponatriémie sa môžu prejaviť aj ťažšie príznaky pri hodnotách sodíka v rozmedzí ľahkého až stredne ťažkého stupňa. Závažné príznaky akútnej hyponatriémie sú vyvolané opuchom mozgu a zvýšeným intrakraniálnym tlakom. Pri chronickej hyponatriémii sa mozgové bunky prispôsobia zníženému množstvu sodíka a uvoľnia z intracelulárnych priestorov do svojho okolia osmoticky aktívne častice (sodík, draslík, chloridy a organické látky), ktoré redukujú opuch mozgu. Tento proces trvá zvyčajne 24–48 hod. Pri neopatrne rýchlej korekcii natriémie sa voda z mozgovej bunky presunie do extracelulárneho priestoru, dochádza k prudkému zmenšeniu mozgových buniek a k osmotickej demyelinizácii, predilekčne v ponse a predĺženej mieche (pontínna a extrapontínna myelinolýza). Najviac sú ohrození pacienti v septickom stave, s abúzom alkoholu, s malnutríciou a onkologickí pacienti [39]. Od pojmu asymptomatická hyponatriémia sa v súčasnosti upúšťa, pretože v striktnom zmysle slova hyponatriémia nie je nikdy bez príznakov. Veľmi limitované a subklinické znaky ako napr. mierne poruchy sústredenia sú pozorované pri ľahkých hyponatriémiách [40]. Mnoho tradičných diagnostických algoritmov hyponatriémie ako aj americké odporúčania začínajú zhodnotením objemového statusu pacienta lekárom na základe anamnézy, klinického vyšetrenia a laboratórnych ukazovateľov. Následne sa zatriedi hyponatriémia na hypovolemickú, euvolemickú alebo hypervolemickú [4]. Často však nie je jasné, či objemový status znamená objem extracelulárnej tekutiny, cirkulujúci efektívny objem alebo celkové množstvo telesnej vody. Navyše senzitivita a špecificita klinického zhodnotenia objemového statusu sú nízke, čo potencionálne vedie k nesprávnej diagnostike príčin hyponatriémie [41]. Dôležité je uvedomiť si, že diagnostika hyponatriémie je zložitá, žiadna klasifikácia nie je stopercentne spoľahlivá a príčiny hyponatriémie môžu byť aj kombinované. Podľa európskych odporúčaní je nutné potvrdiť hypotonickú a vylúčiť non-hypotonickú hyponatriémiu. Tonicitu séra možno vypočítať pomocou rovnice:
efektívna osmolalita (mmol/kg H2O) = 2 × [sérová koncentrácia Na (mmol/l) + sérová koncentrácia K (mmol/l)] + sérová koncentrácia glukózy (mmol/l)
Ak je prítomná hyperglykémia, treba korigovať hodnotu natriémie vzhľadom na hyperglykémiu podľa vzorca [22]:
nameraná sérová koncentrácia sodíka v mmol/l + 2,4 × (sérová koncentrácia glukózy v mmol/l – 5,5)/5,5 mmol/l
2. Lieky a stavy spojené s akútnou hyponatriémiou. Upravené podľa [11] ![Lieky a stavy spojené s akútnou hyponatriémiou. Upravené podľa [11]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/67a19dcdf1e1dd08a62ed1e0920667b5.png)
3. Klasifikácia príznakov hyponatriémie. Upravené podľa [11] ![Klasifikácia príznakov hyponatriémie. Upravené podľa [11]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c4c567b54c815a9a6a509327d21a8b6c.png)
Po potvrdení hypotonickej hyponatriémie sa hodnotí osmolalita moču. Vzorka moču by mala byť odobratá súčasne so vzorkou krvi, pričom osmolalita moču aj koncentrácia sodíka v moči sa vyšetrujú z tej istej vzorky moču. Ak je osmolalita moču ≤ 100 mmol/kg, odporúča sa akceptovať za príčinu hyponatriémie relatívny nadbytok prijatej vody, ak je osmolalita moču > 100 mmol/kg, musí sa zhodnotiť koncentrácia sodíka v moči. Ak je koncentrácia sodíka v moči ≤ 30 mmol/l, za príčinu hyponatriémie sa predpokladá nízky efektívny artériový objem. Ak je koncentrácia sodíka v moči > 30 mmol/l, zhodnotí sa množstvo extracelulárnej tekutiny, vylúčia sa iné príčiny hypotonickej hyponatriémie pred vyslovením diagnózy SIAD, pričom možno použiť klasické diagnostické kritéria SIAD (tab. 1) a uvážia sa známe príčiny SIAD. V rámci potvrdenia diagnózy SIAD sa už neodporúča merať koncentráciu vazopresínu. Pri diagnostike netreba opomínať primárnu alebo sekundárnu adrenálnu insuficienciu. Primárna adrenálna insuficiencia sa často prezentuje hyperkaliémiou a ortostatickou hypotenziou, ale tiež sa môže vyskytovať bez znakov redukovanej extracelulárnej tekutiny a môže tak pripomínať SIAD. U pacientov užívajúcich diuretiká je nutné opatrne hodnotiť koncentráciu sodíka v moči > 30 mmol/l [42]. U týchto pacientov na odlíšenie redukovaného efektívneho cirkulujúceho objemu od SIAD sa za lepší parameter považuje frakčná exkrécia kyseliny močovej < 12 % ako močová koncentrácia sodíka [43]. CSWS je raritným ochorením u pacientov s intrakraniálnym poškodením, pri ktorom sa v dôsledku veľkej natriurézy redukuje objem extracelulárnej tekutiny, preto patognomické pre CSWS sú veľmi vysoká koncentrácia sodíka v moči, vysoká sérová koncentrácia urey, ortostatická hypotenzia a nízky centrálny venózny tlak (tab. 5).
4. Diagnostické rozdiely medzi SIADH a CSWS. Upravené podľa [29] ![Diagnostické rozdiely medzi SIADH a CSWS. Upravené podľa [29]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/74e4713d3dbe323ac9d4ba1d961e0a9a.png)
5. Rozdiely medzi americkými a európskymi algoritmami v diagnostike a v liečbe hyponatriémie 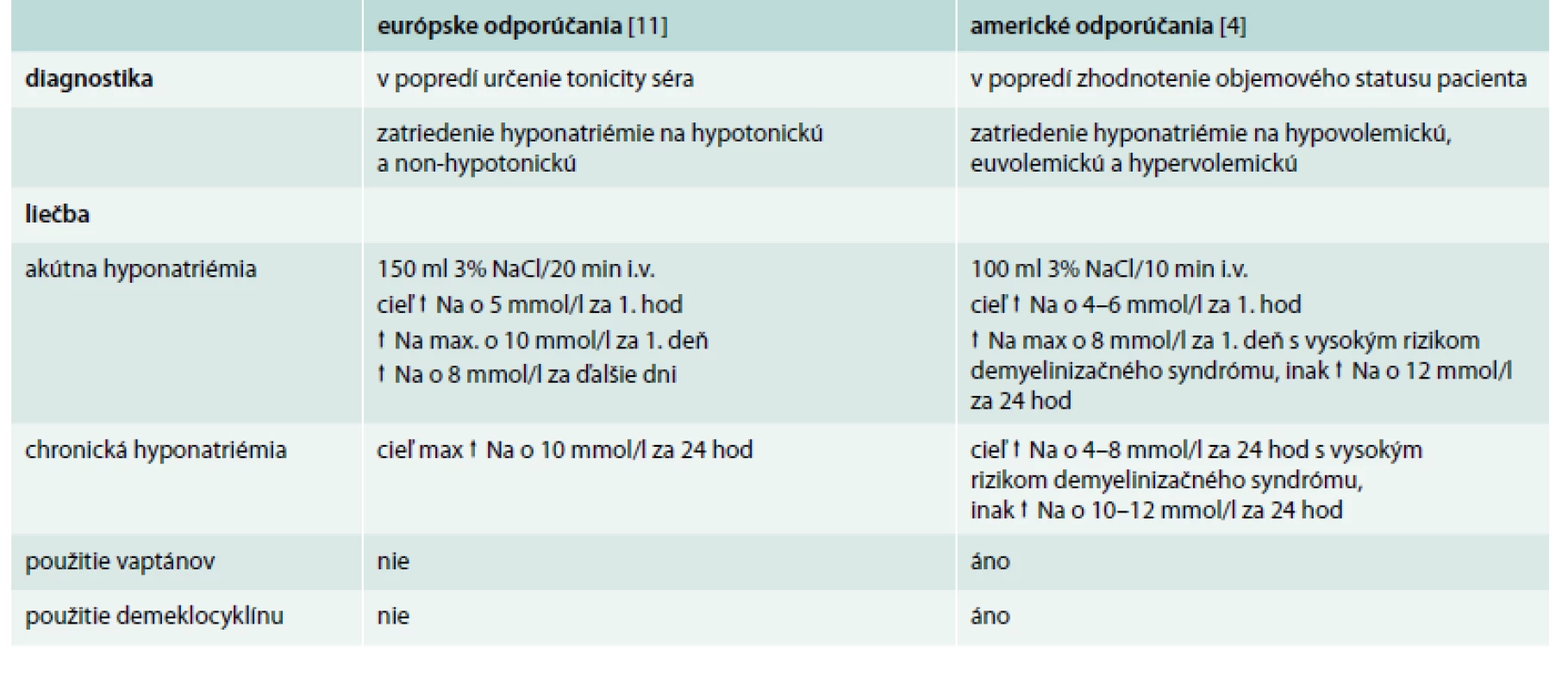
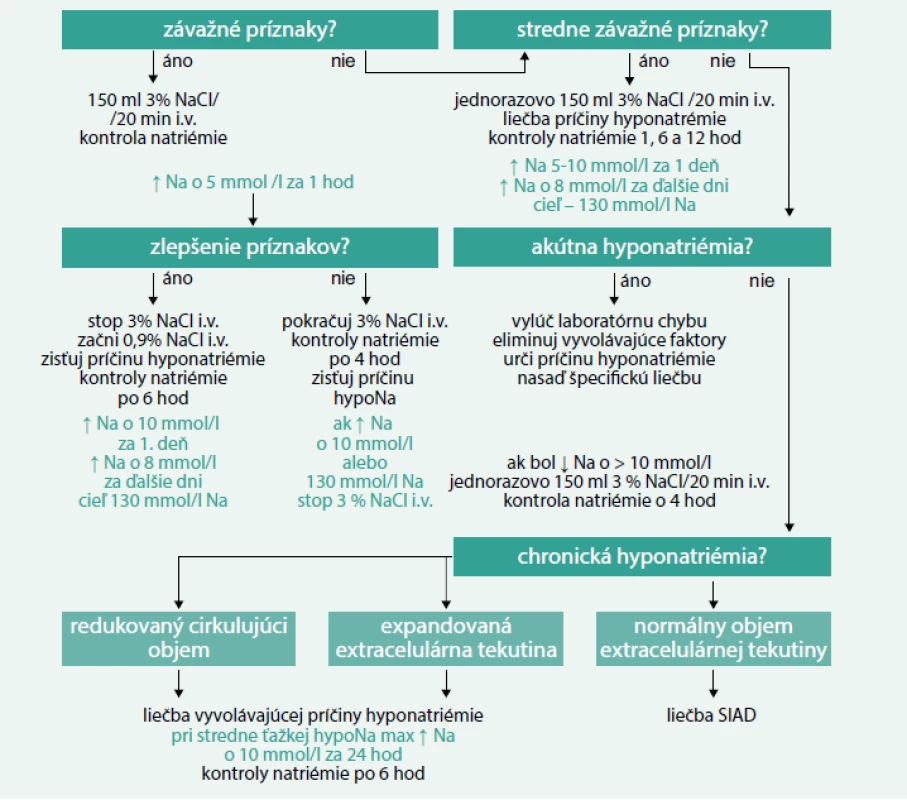
Terapeutický algoritmus hyponatriémie
Pri zostavovaní najnovších odporúčaní ohľadom liečby hyponatriémie európski klinickí a vedeckí pracovníci vychádzali z úvahy, že pri výskyte hyponatriémie so závažnými alebo so stredne závažnými klinickými príznakmi preváži riziko opuchu mozgu nad rizikom osmotickej demyelinizácie [11]. Tieto skutočnosti odôvodňujú urgentné podanie liečby bez ohľadu na biochemickú závažnosť a dobu trvania hyponatriémie. Kruciálne pre správnu interpretáciu liečebného algoritmu je správne zatriediť hyponatriémiu podľa závažnosti príznakov, a preto musí byť isté, že príznaky sú naozaj spôsobené hyponatriémiou.
3% roztok NaCl používaný v liečbe hyponatriémie nie je v našich podmienkach komerčne vyrábaný, preto je nutné si ho v bežnej klinickej praxi pripraviť z dostupných foriem roztokov NaCl: 320 ml 3% roztoku NaCl získame pridaním 70 ml 10% NaCl do 250 ml 0,9% NaCl.
Liečba hyponatriémie so závažnými príznakmi
Liečebný manažment počas 1. hodiny začína bez ohľadu na dobu trvania hyponatriémie podaním 150 ml 3% hypertonického soľného roztoku intravenózne v priebehu 20 min s následnou kontrolou sérovej hladiny sodíka. Tieto dva kroky, podanie roztoku a kontrola natriémie, sa opakujú dovtedy, kým sa nedosiahne vzostup sérovej koncentrácie sodíka o 5 mmol/l počas 1. hodiny. Liečba pacientov so závažnými príznakmi hyponatriémie musí prebiehať za súčasného monitorovania klinického stavu a kontroly biochemických ukazovateľov. Ak po navýšení natriémie o 5 mmol/l dôjde ku zlepšeniu klinického stavu a zmierneniu príznakov, preruší sa podávanie hypertonického roztoku a pokračuje sa vo vnútrožilovom podávaní 0,9% roztoku NaCl až do zistenia príčiny hyponatriémie s cieľom stabilizovať hladinu sodíka. V priebehu prvých 24 hod sa odporúča vzostup sodíka o 10 mmol/l, počas ďalších 24 hod o 8 mmol/l za deň až do dosiahnutia hladiny sodíka 130 mmol/l. Kontroly sodíka sú potrebné každých 6 hod, po stabilizácii hladín stačia denne laboratórne kontroly. Ak nedôjde ku zlepšeniu príznakov po navýšení natriémie o 5 mmol/l za 1. hodinu, pokračuje sa v podávaní 3% hypertonického soľného roztoku. Kontrola hladiny sérového sodíka počas podávania 3% roztoku je nutná každé 4 hod. Zároveň je potrebné pátrať po ďalších možných príčinách stavu. Infúziu prerušíme pri zlepšení príznakov, zvýšení hladiny celkového sodíka o 10 mmol/l alebo ak koncentrácia sodíka dosiahne 130 mmol/l.
Liečba hyponatriémie so stredne závažnými príznakmi
Nutné je rýchle diagnostické zhodnotenie príčin hyponatriémie, odstrániť možné vyvolávajúce faktory a začať špecifickú liečbu. Liečba sa začína jednorazovým podaním 150 ml 3% hypertonického soľného roztoku vnútrožilovo v priebehu 20 min, následne je snaha ďalšou liečbou zvýšiť hladinu sodíka o 5 mmol/l za prvých 24 hod, maximálne však do 10 mmol/l. Počas ďalších 24 hod sa pokračuje v liečbe s cieľom zvýšiť natriémiu o 8 mmol/l až do dosiahnutia sérovej koncentrácie sodíka 130 mmol/l. Laboratórne kontroly sa realizujú po 1, 6 a 12 hod. Ak sa pri zvyšovaní hladín sodíka nezlepšuje klinický stav pacienta, musia sa prehodnotiť iné príčiny klinických ťažkostí pacienta.
Liečba akútnej hyponatriémie bez závažných a stredne závažných príznakov
Ak sa vylúči možná laboratórna chyba, eliminujú sa vyvolávajúce faktory, neodkladne sa diagnosticky zhodnotí príčina hyponatriémie a nasadí sa špecifická liečba. Ak je pokles sodíka viac ako 10 mmol/l, liečba sa začne jednorazovo podaním infúzie 3% hypertonického soľného roztoku v priebehu 20 min s kontrolu sérovej hladiny sodíka o 4 hod.
Liečba chronickej hyponatriémie bez závažných a stredne závažných príznakov
Hneď na začiatku sa vylúčia faktory prispievajúce ku vzniku hyponatriémie a začne sa špecifická liečba. Pri hyponatriémii ľahkého stupňa je cieľom liečby hlavne korekcia natriémie. Pri stredne ťažkej a ťažkej hyponatriémii nesmie byť korekcia o viac ako 10 mmol/l za deň s biochemickou kontrolou hladín sodíka každých 6 hod. V prípade nelepšenia stavu je nutné prehodnotiť diagnostický postup a konzultovať so špecialistami. Pri zvýšenom objeme extracelulárnej tekutiny je nutná reštrikcia tekutín, aby sa zabránilo ďalšiemu preťažovaniu tekutinou, a liečba základného ochorenia. Antagonisty V2-receptorov vazopresínu (vaptány) sa v liečbe hyponatriémie podľa európskych expertov neodporúčajú. U pacientov liečených vaptánmi bol zaznamenaný zvýšený počet úmrtí v porovnaní s pacientmi liečených placebom [44,45]. Vaptány sa spájajú s vysokým rizikom rapídnej korekcie hyponatriémie a s následným rizikom neurologických komplikácií. Tiež existujú obavy z toxicity vaptánov, napr. z hepatotoxicity tolvaptánu podľa vyhlásení amerického úradu Food and Drug Administration z roku 2013. Rovnako sa pri akejkoľvek závažnosti hyponatriémie neodporúča použiť lítium ani tetracyklínový derivát demeklocyklín, pretože boli hlásené viaceré nežiaduce účinky [46,47]. Pri liečbe pacientov so SIAD so stredne ťažkou až ťažkou hyponatriémiou sa pristupuje najskôr ku reštrikcii tekutín. Rovnaký efekt sa dosiahne zvýšením perorálneho príjmu solútov: 0,25–0,50 g urey na kg telesnej hmotnosti (1 vrecúško urey zarobené lekárnikom obsahuje 10 g urey + 2 g NaHCO3 + 1,5 g kyseliny citrónovej + 200 mg sacharózy v 50–100 ml vody) alebo kombinácia nízkych dávok slučkových diuretík a kuchynskej soli. Ani u SIAD sa podávanie vaptánov, demeclocyklínu a lítia neodporúča. V prípade nízkeho extracelulárneho objemu je dôležitá náhrada tekutín vo forme intravenózneho podania 0,9% fyziologického roztoku alebo iného vhodného kryštaloidu v dávke 0,5–1,0 ml na kg telesnej hmotnosti za hod. Zabráni sa tak zároveň hroziacemu poklesu hladiny sodíka v plazme. V prípade rýchlej korekcie sodíka o viac ako 10 mmol/l za prvých 24 hod a viac ako 8 mmol/l za ďalšie dni sa odporúča prerušiť podávanú terapiu a zvážiť podanie bezsolútovej vody, napr. roztokov glukózy, event. sa odporúča intravenózne podanie dezmopresínu. Pri tejto korekcii je nutné prísne sledovať bilanciu tekutín (obr. 2). Americké odporúčania ohľadom liečby hyponatriémie tiež vychádzajú zo závažnosti symptómov hyponatriémie a jej dĺžky trvania. Od európskych algoritmov sa odlišujú prevažne v malých detailoch (tab. 5), hlavným rozdielom je, že sa v nich stále odporúča používanie vaptánov a demeklocyklínu pri chronickej hyponatriémii.
1. Diagnostický algoritmus. Upravené podľa [11] ![Diagnostický algoritmus. Upravené podľa [11]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/340bc833dedf44251cca8b077d238fb0.png)
Záver
Hyponatriémia je v klinickej praxi častým fenoménom, ktorý zvyšuje morbiditu a mortalitu pacientov nezávisle od pridružených komorbidít. Novými a stále prebiehajúcimi bádaniami sa dopĺňajú informácie o zložitom patofyziologickom mechanizme vzniku hyponatriémie. Posledné európske odporúčania z roku 2014 ohľadom diagnostiky a liečby hyponatriémie sú dostatočne vyčerpávajúce a sú užitočným nástrojom pre lekárov v klinickej praxi. Odstránenie všeobecne používaného pojmu asymptomatická hyponatriémia sa zdá byť dobrým krokom v problematike hyponatriémie. Odporúčania proti užívaniu vazopresínových antagonistov v liečbe chronickej hyponatriémie sú adekvátne z viacerých už spomínaných príčin, v neposlednom rade je to nedostatok komparatívnych štúdií vaptány versus štandardná liečba a vysoká ekonomická záťaž týchto medikamentov. V algoritmoch je odporúčané okamžite podať hypertonický roztok sodíka u pacientov so závažnými a stredne závažnými príznakmi, čo je dosť praktické v porovnaní so zložitým prepočítavaním vzorcov, ako bolo odporúčané v minulosti. Problematické sa v odporúčaniach javí používanie 0,9% roztoku NaCl tzv. fyziologického roztoku, ktorý má nefyziologickú vysokú koncentráciu sodíka a chloridov. Jeho používanie je spojené s rizikom prestrelenia korekcie nátriémie, pričom to platí najmä pre stavy spojené s deficitom extracelulárnej tekutiny, kedy potlačenie vazopresínu vedie ku zvýšenej exkrécii bezsolútovej vody obličkami s rizikom prudkého vzostupu natriémie. Vhodnejšie a stále viac akceptované riešenie je používanie balancovaných kryštaloidov s fyziologickou koncentráciou sodíka, hoci definitívne vedecké dôkazy nám nateraz chýbajú. Nevýhodou týchto európskych algoritmov je, že nie všetky odporúčania majú najvyšší stupeň medicíny dôkazov, čo zdôrazňuje potrebu ďalšieho výskumu, najmä vo forme prospektívnych kontrolovaných štúdií.
MUDr. Igor Šturdík
igor.sturdik@gmail.com
V. interná klinika LF UK a UN, Bratislava, Slovenská republika
www.fmed.uniba.sk
Doručeno do redakce 30. 11. 2014
Přijato po recenzi 15. 1. 2015
Sources
1. Whelan B, Bennett K, O’Riordan D et al. Serum sodium as a risk factor for in-hospital mortality in acute unselected general medical patients. QJM 2009; 102(3): 175–182.
2. Sturdik I, Adamcova M, Kollerova J et al. Hyponatraemia is an independent predictor of in-hospital mortality. Eur J Intern Med 2014; 25(4): 379–382.
3. Rudnay M, Lazurova I. Prevalence of hyponatremia in patients on department of internal medicine. Vnitř Lék 2013; 59(19): 876–879.
4. Verbalis JG, Goldsmith SR, Greenberg A et al. Diagnosis, Evaluation, and Treatment of Hyponatremia: Expert Panel Recommendations. Am J Med 2013; 126(10 Suppl 1): S1-S42.
5. Serste T, Gustot T, Rautou PE et al. Severe hyponatremia is a better predictor of mortality than MELDNa in patients with cirrhosis and refractory ascites. J Hepatol 2012; 57(2): 274–280.
6. Wald R, Jaber BL, Price LL et al. Impact of hospital-associated hyponatremia on selected outcomes. Arch Intern Med 2010; 170(3): 294–302.
7. Cardenas A, Gines P. Management of patients with cirrhosis awaiting liver transplantation. Gut 2011; 60(3): 412–421.
8. Chawla A, Sterns RH, Nigwekar SU et al. Mortality and serum sodium: do patients die from or with hyponatremia? Clin J Am Soc Nephrol 2011; 6(5): 960–965.
9. Baran D, Hutchinson TA. The outcome of hyponatremia in a general hospital population. Clin Nephrol 1984; 22(2): 72–76.
10. Saeed BO, Beaumont D, Handley GH et al. Severe hyponatraemia: investigation and management in a district general hospital. J Clin Pathol 2002; 55(12): 893–896.
11. Spasovski G, Vanholder R, Allolio B et al. Clinical practice guideline on diagnosis and treatment of hyponatraemia. Eur J Endocrinol 2014; 170(3): G1-G47.
12. Verbalis JG. Disorders of body water homeostasis. Best Pract Res Clin Endocrinol Metab 2003; 17(4): 471–503.
13. Bourque CW. Central mechanisms of osmosensation and systemic osmoregulation. Nat Rev Neurosci 2008; 9(7): 519–531.
14. Lechner SG, Markworth S, Poole K et al. The molecular and cellular identity of peripheral osmoreceptors. Neuron 2011; 69(2): 332–344.
15. Sharif Naeini R, Witty MF, Seguela P et al. An N-terminal variant of Trpv1 channel is required for osmosensory transduction. Nat Neurosci 2006; 9(1): 93–98.
16. Ciura S, Bourque CW. Transient receptor potential vanilloid 1 is required for intrinsic osmoreception in organum vasculosum lamina terminalis neurons and for normal thirst responses to systemic hyperosmolality. J Neurosci 2006; 26(35): 9069–9075.
17. Norsk P. Influence of low - and high-pressure baroreflexes on vasopressin release in humans. Acta Endocrinol (Copenh) 1989; 121(Suppl 1): 3–27.
18. Robertson GL. Thirst and vasopressin function in normal and disordered states of water balance. J Lab Clin Med 1983; 101(3): 351–371.
19. Zhang Z, Bourque CW. Amplification of transducer gain by angiotensin II-mediated enhancement of cortical actin density in osmosensory neurons. J Neurosci; 28(38): 9536–9544.
20. Schwartz WB, Bennett W, Curelop S et al. A syndrome of renal sodium loss and hyponatremia probably resulting from inappropriate secretion of antidiuretic hormone. Am J Med 1957; 23(4): 529–542.
21. Turchin A, Seifter JL, Seely EW. Clinical problem-solving. Mind the gap. N Engl J Med 2003; 349(15): 1465–1469.
22. Hillier TA, Abbott RD, Barrett EJ. Hyponatremia: evaluating the correction factor for hyperglycemia. Am J Med 1999; 106(4): 399–403.
23. Desmond J. Serum osmolality and plasma electrolytes in patients who develop dilutional hyponatremia during transurethral resection. Can J Surg 1970; 13(2): 116–121.
24. Aviram A, Pfau A, Czaczkes JW et al. Hyperosmolality with hyponatremia, caused by inappropriate administration of mannitol. Am J Med 1967; 42(4): 648–650.
25. Carlotti AP, Bohn D, Mallie JP et al. Tonicity balance, and not electrolyte-free water calculations, more accurately guides therapy for acute changes in natremia. Intensive Care Med 2001; 27(5): 921–924.
26. Hoorn EJ, Carlotti AP, Costa LA et al. Preventing a drop in effective plasma osmolality to minimize the likelihood of cerebral edema during treatment of children with diabetic ketoacidosis. J Pediatr 2007; 150(5): 467–473.
27. Friedman E, Shadel M, Halkin H et al. Thiazide-induced hyponatremia. Reproducibility by single dose rechallenge and an analysis of pathogenesis. Ann Intern Med 1989; 110(1): 24–30.
28. Sonnenblick M, Friedlander Y, Rosin AJ. Diuretic-induced severe hyponatremia. Review and analysis of 129 reported patients. Chest 1993; 103(2): 601–606.
29. Sherlock M, O’Sullivan E, Agha A et al. Incidence and pathophysiology of severe hyponatraemia in neurosurgical patients. Postgrad Med J 2009; 85(1002): 171–175.
30. Hamdi T, Latta S, Jallad B et al. Cisplatin-induced renal salt wasting syndrome. South Med J 2010; 103(8): 793–799.
31. Verbalis JG. Whole-body volume regulation and escape from antidiuresis. Am J Med 2006; 119(7 Suppl 1): S21-S29.
32. Dedinska I, Manka V, Sagova I et al. Hyponatremia – carbamazepine medication complications. Vnitř Lék 2012; 58(1): 72–75.
33. Tian W, Fu Y, Garcia-Elias A et al. A loss-of-function nonsynonymous polymorphism in the osmoregulatory TRPV4 gene is associated with human hyponatremia. Proc Natl Acad Sci USA 2009; 106(33): 14034–14039.
34. Faustini-Fustini M, Anagni M. Beyond semantics: defining hyponatremia in secondary adrenal insufficiency. J Endocrinol Invest 2006; 29(3): 267–269.
35. Warner MH, Holding S, Kilpatrick ES. The effect of newly diagnosed hypothyroidism on serum sodium concentrations: a retrospective study. Clin Endocrinol (Oxf) 2006; 64(5): 598–599.
36. Musch W, Xhaet O, Decaux G. Solute loss plays a major role in polydipsia-related hyponatraemia of both water drinkers and beer drinkers. QJM 2003; 96(6): 421–426.
37. Goldberg A, Hammerman H, Petcherski S et al. Hyponatremia and long-term mortality in survivors of acute ST-elevation myocardial infarction. Arch Intern Med 2006; 166(7): 781–786.
38. Goland S, Naugolny V, Korbut Z et al. Appropriateness and complications of the use of spironolactone in patients treated in a heart failure clinic. Eur J Intern Med 2011; 22(4): 424–427.
39. Jiskra J. Hyponatremie: diagnostický postup a nové léčebné možnosti. Hyponatremia: diagnostic process and new therapeutic approaches. Interní Med 2012; 14(8 a 9): 312–317.
40. Renneboog B, Musch W, Vandemergel X et al. Mild chronic hyponatremia is associated with falls, unsteadiness, and attention deficits. Am J Med 2006; 119(1): 71. e1-e8.
41. Hoorn EJ, Halperin ML, Zietse R. Diagnostic approach to a patient with hyponatraemia: traditional versus physiology-based options. QJM; 2005; 98(7): 529–540.
42. Schrier RW. Pathogenesis of sodium and water retention in high-output and low-output cardiac failure, nephrotic syndrome, cirrhosis, and pregnancy (1). N Engl J Med 1988; 319(16): 1065–1072.
43. Fenske W, Stork S, Koschker AC et al. Value of fractional uric acid excretion in differential diagnosis of hyponatremic patients on diuretics. J Clin Endocrinol Metab 2008; 93(8): 2991–2997.
44. Rozen-Zvi B, Yahav D, Gheorghiade M et al. Vasopressin receptor antagonists for the treatment of hyponatremia: systematic review and meta-analysis. Am J Kidney Dis 2010; 56(2): 325–337.
45. Jaber BL, Almarzouqi L, Borgi L et al. Short-term efficacy and safety of vasopressin receptor antagonists for treatment of hyponatremia. Am J Med 2011; 124(10): 977. e1-e9. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2011.04.028>.
46. De Troyer A. Demeclocycline. Treatment for syndrome of inappropriate antidiuretic hormone secretion. JAMA 1977; 237(25): 2723–2726.
47. Carrilho F, Bosch J, Arroyo V et al. Renal failure associated with demeclocycline in cirrhosis. Ann Intern Med 1977; 87(2): 195–197.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 3-
All articles in this issue
- Non-celiac gluten sensitivity
- Non-celiac gluten sensitivity
- Our experience with hormonal therapy in transsexual patients
- Does body height affect the severity of chronic venous disease in lower extremities?
- Experiences with biosimilar drugs in therapy
- The most recent aspects of diagnosis and therapy of hyponatraemia
- Non-celiac gluten sensitivity
- Chronic thromboembolic pulmonary hypertension
- New ESC guidelines on the diagnosis and management of acute pulmonary embolism
-
Pelvic venous congestion syndrome – diagnosis and management.
Guidelines of the Angiology Section of Slovak Medical Chamber (2015) -
PET-CT dokumentovaná remise multicentrické formy Castlemanovy choroby po léčbě rituximabem
Popis případu a přehled literatury - Hypersensitive reaction after application of heparin with activation heparin induced trombocytopenia in initiation of intermittent haemodialysis
- Selected legal aspects of compulsory confidentiality
- Mild hypoglycaemia is common in type 2 diabetic patients treated with insulin analogues in the Czech Republic and the patients are concerned about it: results of a GAPP2TM survey (Global Attitudes of Physicians and Patient)
- Hormonal therapy in transsexual patients – editorial
- The most recent aspects of diagnosis and therapy of hyponatraemia – editorial
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Our experience with hormonal therapy in transsexual patients
-
Pelvic venous congestion syndrome – diagnosis and management.
Guidelines of the Angiology Section of Slovak Medical Chamber (2015) - Non-celiac gluten sensitivity
- The most recent aspects of diagnosis and therapy of hyponatraemia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career