-
Medical journals
- Career
Praktické otázky léčby novými antitrombotiky
Authors: Jan Vojáček
Authors‘ workplace: I. interní kardioangiologická klinika LF UK a FN Hradec Králové, přednosta prof. MUDr. Pavel Červinka, Ph. D.
Published in: Vnitř Lék 2014; 60(4): 389-395
Category: 60th Birthday - prof. MUDr. Petr Widimský, DrSc., FESC, FACC
Overview
Nová perorální antitrombotika prokázala v poslední době výrazně lepší prevenci trombotických komplikací u nemocných v řadě klinických situací, jako je fibrilace síní, tromboembolická nemoc nebo akutní koronární syndromy. Na trh byla uvedena jak nová perorální antikoagulancia (NPA) – dabigatran, rivaroxaban a apixaban, tak nové účinné protidestičkové léky – tikagrelor a prasugrel. Jejich uvedení bylo podpořeno pozitivními výsledky pilotních studií: RE-LY, ROCKET AF, ARISTOTLE, PLATO a TIMI 38 TRITON a později i rychle získávanými klinickými zkušenostmi. NPA ve svých studiích potvrdily noninferioritu ve výskytu mozkové cévní příhody nebo systémové embolizace, apixaban a dabigatran 150 mg 2krát denně prokázaly superioritu. Rovněž všechny 3 molekuly byly noninferiorní ve výskytu závažného krvácení, přičemž apixaban a dabigatran 110 mg 2krát denně byl superiorní. Proto jsou NPA odbornými doporučeními upřednostňována před warfarinem pro většinu pacientů. Z dosavadních protidestičkových léků je klopidogrel z genetických důvodů při polymorfizmech P450 (polymorfizmus CYP2C19 a CYP3A4 alel – *1 normálně funkční izoformy a *2 a *3 nefunkční alely) a v důsledku následného selhání metabolické přeměny na účinnou látku laboratorně či klinicky neúčinný v závislosti na populaci až u 20–35 % nemocných. Nové protidestičkové léky mají rychlejší a konzistentnější nástup účinku oproti klopidogrelu a vzhledem k svému metabolizmu je menší množství nemocných, kteří jsou rezistentní na tuto skupinu léků. Prasugrel je kontraindikován u nemocných po cévní mozkové příhodě nebo TIA, nemocných nad 75 let a u nemocných s tělesnou hmotností nižší než 60 kg a má data ukazující výhodnost jeho podávání především u nemocných se STEMI nebo u diabetiků. Tikagrelor snižuje mortalitu nemocných s akutním koronárním syndromem bez rozdílů v závažném krvácení mezi skupinou léčenou tikagrelorem a klopidogrelem, s vyšším výskytem velkého krvácení bez vztahu k aortokoronárnímu bypassu při podávání tikagreloru, včetně vyššího výskytu fatálního intrakraniálního krvácení a menší výskyt fatálních krvácení jiných typů. U nemocných s chronickým onemocněním ledvin a s kreatininovou clearance 30–60 ml/min tikagrelor významně snižuje primární end-point oproti klopidogrelu. U nemocných s chronickým onemocněním ledvin tikagrelor snižuje i celkovou mortalitu. Nová antitrombotika přinesla velký pokrok nejen ve snížení výskytu trombotických a krvácivých komplikací, ale i zjednodušení rozhodovacích algoritmů. Hledání optimální léčby trombózy však bude nepochybně ještě dlouho vyžadovat intenzivní základní i klinický výzkum.
Klíčová slova:
nová perorální antikoagulancia – prasugrel – tikagrelorÚvod
Nová perorální antitrombotika prokázala v poslední době výrazně lepší prevenci trombotických komplikací u nemocných v řadě klinických situací jako je fibrilace síní, tromboembolická nemoc nebo akutní koronární syndromy.
Na trh byla uvedena jak nová perorální antikoagulancia (NPA) – dabigatran, rivaroxaban a apixaban, tak nové účinné protidestičkové léky – tikagrelor a prasugrel. Jejich uvedení bylo podpořeno pozitivními výsledky pilotních studií: RE-LY [1,2], ROCKET AF [3], ARISTOTLE [4], PLATO [5] a TIMI 38 TRITON [6] a později i rychle získávanými klinickými zkušenostmi.
Nová perorální antikoagulancia
U nemocných s fibrilací síní je celkový klinický benefit antikoagulační léčby patrný prakticky u všech rizikových skupin podle CHA2-DS2-VASc skóre s výjimkou skóre 0 [7]. Pokud použijeme CHA2-DS2-VASc skóre, procento nemocných s fibrilací síní, kteří by měli být léčeni perorální antikoagulací, dosahuje 94 % [7]. Přesto je warfarinem léčeno jen asi polovina indikovaných nemocných a z toho jen 50–70 % kontrolních hodnot INR je v terapeutickém rozmezí. Novější údaje již potvrzují, že adherence k NPA (v tomto případě k dabigatranu) je u chronické léčby nemocných s fibrilací síní významně vyšší [7].
Klinické studie s NPA byly předurčeny tak, aby potvrdily alespoň srovnatelnou účinnost a bezpečnost ve srovnání s warfarinem v prevenci mozkové cévní příhody nebo systémové embolizace u pacientů s nevalvulární fibrilací síní. Všechny molekuly ve svých studiích potvrdily noninferioritu ve výskytu mozkové cévní příhody nebo systémové embolizace, apixaban a dabigatran 150 mg 2krát denně prokázaly superioritu. Dabigatran v této dávce byl jako jediný účinnější v prevenci ischemických mozkových cévních příhod. Rovněž všechny 3 molekuly byly noninferiorní ve výskytu závažného krvácení, přičemž apixaban a dabigatran 110 mg 2krát denně byl superiorní. Proto jsou NPA odbornými doporučeními upřednostňována před warfarinem pro většinu pacientů.
Dabigatran
Dabigatran je přímý inhibitor trombinu. Z dabigatran etexilátu je vstřebáváno asi 7 % podané látky, poté je esterázami rychle konvertován na účinnou látku dabigatran. Vylučován je z 80 % ledvinami, není metabolizován cytochromem P450 [8]. Vzhledem k farmakokinetice nedochází k významným lékovým interakcím s inhibitory nebo induktory cytochromu P450, ale jsou popsány lékové interakce na podkladě velmi vzácně se vyskytující inhibice nebo indukce P-glykoproteinu [9]. Léčba inhibitory P-glykoproteinu vede k riziku předávkování dabigatranu. Současná léčba ketokonazolem, itrakonazolem, cyklosporinem a takrolimem je proto kontraindikována, při souběžné léčbě amiodaronem nebo verapamilem je doporučena redukce dávky dabigatranu [10].
Komu nemá být podáván dabigatran
Jsou to osoby s glomerulární filtrací pod 30 ml/min, nemocní, kteří jsou léčeni látkami výrazně zvyšujícími krevní hladinu dabigatranu (výše uvedené inhibitory P-glykoproteinu), zůstávající indikace pro použití warfarinu jsou především nemocní po náhradě chlopně mechanickou protézou.
Dávkování dabigatranu
Výběr dávky dabigatranu je následující: pro většinu nemocných 2krát 150 mg denně, 2krát denně 110 mg při věku nad 75 (80) let, při současném podávání léků s možnou interakcí (verapamil), a při středně snížené glomerulární filtraci (30–49 ml/min). Rovněž u nemocných s gastritidou, ezofagitidou nebo s gastroezofageálním refluxem lze zvážit podání dabigatranu 2krát denně 110 mg.
Léčba dabigatranem – postup a péče o pacienty
Doporučený praktický postup při zahájení léčby a péči o nemocné léčené dabigatranem: stanovení renálních funkcí, změření plazmatické hladiny kreatininu, výpočet glomerulární filtrace vzorcem podle Cocrofta-Gaulta (http://nephron.org/cgi-bin/CGSI.cgi) a stanovení biologického poločasu dabigatranu (tab. 1 a tab. 2). Klinické rozhodování o postupu léčby se řídí těmito úvahami.
Table 1. Vztah biologického poločasu dabigatranu k funkci ledvin 
Table 2. Doporučovaný interval mezi ukončením podávání dabigatranu a elektivním invazivním výkonem 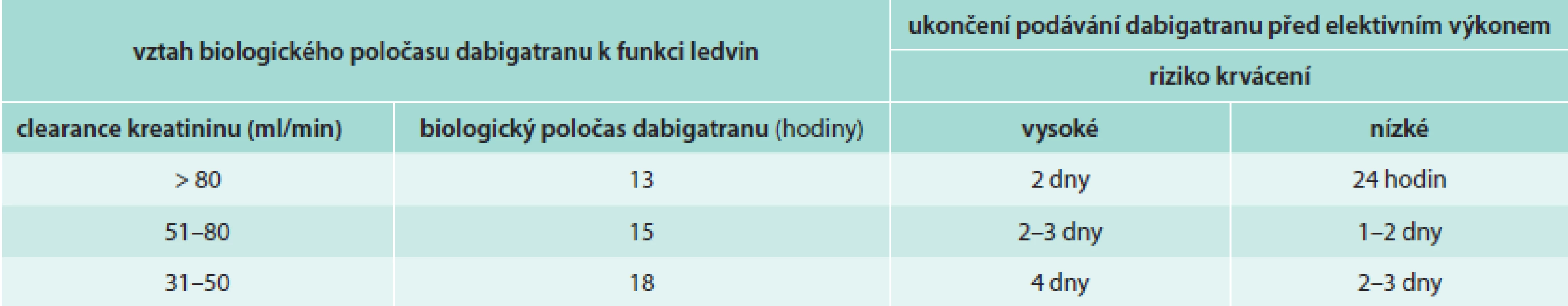
Rivaroxaban
Rivaroxaban je přímý inhibitor aktivovaného faktoru X. Až 95 % vstřebané látky je vázáno na plazmatické bílkoviny. Vylučován je z jedné třetiny renální cestou, zbytek je metabolizován v játrech cestou cytochromů P450, CYP3A4 a CYP2J2, ale i jinými mechanizmy.
Komu nemá být podáván rivaroxaban
Vzhledem ke kombinovanému renálnímu vylučování a jaterní biotransformaci je riziko závažných lékových interakcí vedoucích k předávkování rivaroxabanu omezeno na léky inhibující současně CYP3A4 a P-glykoprotein [9]. Neměl by být podáván současně rivaroxaban a azolová antimykotika (ketokonazol, vorikonazol, itrakonazol) nebo inhibitory proteáz HIV (ritonavir). Při užívání induktorů CYP3A4 (rifampicin, fenytoin, karbamazepin, barbituráty) dochází ke snižování hladiny a tedy i účinnosti rivaroxabanu i apixabanu [10].
Dávkování rivaroxabanu
Rivaroxaban 20 mg 1krát denně je pro většinu nemocných, 15 mg 1krát denně při středně snížené glomerulární filtraci (30–49 ml/min). Apixaban 5 mg 2krát denně pro většinu, 2,5 mg 2krát denně při splnění dvou ze3 kritérií – věk > 80 let, tělesná hmotnost < 60 kg, hladina kreatinin > 133 µmol/l.
Kontraindikací léčby rivaroxabanem je jaterní onemocnění s koagulopatií včetně cirhotických pacientů s klasifikací Child-Pugh B a C.
Léčba rivaroxabanem – postup a péče o pacienty
Při převodu z warfarinu na rivaroxaban jsou hodnoty INR falešně zvýšeny (test INR není pro měření antikoagulační aktivity rivaroxabanu vhodný a nemá být používán).
Naopak během přechodu z rivaroxabanu na warfarin je riziko nízké antikoagulační aktivity. U pacientů, kteří jsou převáděni z rivaroxabanu na warfarin, by měly být oba léky podávány současně, dokud není dosaženo hladiny INR ≥ 2,0. Po dobu prvních 2 dnů fáze převodu by mělo být použito standardní úvodní dávkování warfarinu s následným dávkováním podle INR. Během doby, během níž pacienti užívají oba léky, by neměla být odebírána krev na INR dříve než 24 hod po předchozí dávce rivaroxabanu, je tedy nutno krev odebrat bezprostředně před další dávkou rivaroxabanu.
U pacientů, převáděných z heparinu na rivaroxaban, by měla být léčba rivaroxabanem zahájena do 2 hod před dalším plánovaným podáním nízkomolekulárního heparinu nebo v době vysazení kontinuálně podávaného intravenózního nefrakciovaného heparinu.
Naopak při převodu z rivaroxabanu na nízkomolekulární heparin je první dávka parenterálního antikoagulancia podána v době, kdy by měla být užita další dávka rivaroxabanu.
Vhodné a nevhodné koagulační testy pro NPA jsou uvedeny v tab. 3.
Table 3. Vhodné a nevhodné koagulační testy pro NPA 
*měření hladin léků hmotnostní spektrometrií Nové protidestičkové léky
K pokroku došlo i v léčbě nemocných s akutním koronárním syndromem. U dosavadní rutinně používané duální antiagregační léčby kyselinou acetylsalicylovou a klopidogrelem, jejíž účinnost byla prokázána nejprve ve studii CURE a PCI CURE a potvrzena dalšími, je velkým problémem variabilita léčebného účinku klopidogrelu [11]. Klopidogrel je po absorpci z gastrointestinálního traktu metabolizován zejména v játrech cytochromovým systémem P450 na účinný metabolit. Z genetických důvodů při polymorfizmech P450 (polymorfizmus CYP2C19 a CYP3A4 alel – *1 normálně funkční izoformy a *2 a *3 nefunkční alely) a v důsledku následného selhání metabolické přeměny na účinnou látku může být léčba laboratorně nebo klinicky neúčinná v závislosti na populaci až u 20–35 % nemocných.
Z nových protidestičkových léků je tikagrelor přímo účinkující nethienopyridinový reverzibilní inhibitor destičkového receptoru P2Y12. Patrně má i další účinky zprostředkované přes metabolizmus adenozinu.
Prasugrel je thienopyridin s ireverzibilní blokádou výše uvedeného receptoru.
Oba léky mají rychle nastupující a prediktabilní laboratorní i klinický účinek u naprosté většiny nemocných.
Tikagrelor
Účinnost
Účinnost tikagreloru u nemocných s akutním koronárním syndromem byla prokázána ve studii PLATO [5]. Ve 12měsíčním sledování byl u nemocných s akutním koronárním syndromem dosažen primární end-point sestávající z úmrtí z kardiovaskulárních příčin, infarktu myokardu nebo cévní mozkové příhody u 9,8 % nemocných léčených tikagrelorem a u 11,7 % nemocných léčených klopidogrelem (p < 0,001). V tikagrelorové skupině byl i významně nižší výskyt samotného infarktu myokardu (5,8 % u tikagreloru oproti 6,9 % u klopidogrelu, p = 0,005), úmrtí z cévních příčin (4,0 % vs 5,1 %, p = 0,001), ale ne samotná cévní mozková příhoda (1,5 % vs 1,3 %, p = 0,22). Mortalita z jakékoliv příčiny byla nižší u nemocných léčených tikagrelorem – 4,5 % oproti 5,9 % při léčbě klopidogrelem (p < 0,001). Nebyly rozdíly v závažném krvácení mezi skupinou léčenou tikagrelorem a klopidogrelem (11,6 % a 11,2 %, p = 0,43), nicméně podávání tikagreloru mělo vyšší výskyt velkého krvácení bez vztahu k aortokoronárnímu bypassu (4,5 % vs 3,8 %, p = 0,03), včetně vyššího výskytu fatálního intrakraniálního krvácení a menší výskyt fatálních krvácení jiných typů [5].
Důležité informace přinášejí i následné subanalýzy studie PLATO [12–14].
Tak u nemocných s chronickým onemocněním ledvin a s kreatininovou clearance < 60 ml/min (n = 3 237), byl ve větvi s tikagrelorem významně snížen primární end-point na 17,3 % oproti 22,0 % v klopidogrelové větvi (HR 0,77; 95% CI 0,65–0,90) s absolutním snížením rizika větším než u nemocných s normální funkcí ledvin (n =11 965): 7,9 % vs 8,9 % (HR 0,90; 95% CI 0,79–1,02). U nemocných s chronickým onemocněním ledvin tikagrelor snížil i celkovou mortalitu (10,0 % vs 14,0 %; HR 0,72; 95% CI 0,58–0,89). Výskyt velkého krvácení, fatálního krvácení stejně jako krvácení bez vztahu k aortokoronárnímu bypassu se mezi oběma skupinami významně nelišily.
Nemocní v tikagrelorové i v klopidogrelové větvi měli obdobný výskyt velkého krvácení podle kritérií PLATO (11,6 % vs 11,2 %; p = 0,43), podle kritérií TIMI (7,9 % vs 7,7 %, p = 0,56) i podle kritérií GUSTO (2,9 % vs 3,1 %, p = 0,22). Výskyt krvácení ve vztahu k intervenčním výkonům nebyl rovněž statisticky rozdílný v obou větvích. Velká krvácení bez vztahu k aortokoronárnímu bypassu (4,5 % vs 3,8 %, p = 0,02) a velká krvácení bez vztahu k intervenčnímu výkonu (3,1 % vs 2,3 %, p = 0,05) byly častější u nemocných léčených tikagrelorem, primárně po 30 dnech léčby. Výskyt fatálního krvácení a počet transfuzí se nelišily mezi oběma větvemi. Nebyly významné interakce pro velké krvácení nebo kombinaci malého a velkého krvácení mezi tikagrelorovou a klopidogrelovou větví a věkem ≥ 75, váhou pod 60 kg, chronickým renálním onemocněním, clearancí kreatininu < 60 ml/min, dávkou kyseliny acetylsalicylové, předrandomizačním podáním klopidogrelu či nasycovací dávkou klopidogrelu.
Výsledky u nemocných na tikagreloru, indikovaných ke kardiochirurgické léčbě ve studii PLATO naznačují, že postačuje jeho vysazení 2–3 dny před operací oproti 5–7 dnům u klopidogrelu a prasugrelu.
Prasugrel
Účinnost
Účinnost prasugrelu byla prokázána ve studii TIMI 38 TRITON [6]. Primární end-point se vyskytl u 12,1 % nemocných na klopidogrelu a 9,9 % na prasugrelu (HR prasugrel vs klopidogrel: 0,81; 95% CI 0,73–0,90; p < 0,001). Pokles v prasugrelové skupině byl i u výskytu infarktu myokardu (9,7 % u klopidogrelu vs 7,4 % pro prasugrel; p < 0,001), urgentní TVR (3,7 % vs 2,5 %; p < 0,001) a trombózy stentu (2,4 % vs 1,1 %; p < 0,001). Velké krvácení bylo u 2,4 % nemocných na prasugrelu a 1,8 % na klopidogrelu (HR 1,32; 95% CI 1,03–1,68; p = 0,03). Vyšší výskyt byl v prasugrelové skupině i u život ohrožujících krvácení (1,4 % vs 0,9 %; p = 0,01) a fatálních krvácení (0,4 % vs 0,1 %; p = 0,002). Při hodnocení celkového klinického benefitu byla tedy studie v podstatě negativní. Pokud se však z analýzy zpětně, post hoc explorativně vyloučily 3 nejrizikovější podskupiny s nejmenším profitem z prasugrelu a nejvyšším výskytem krvácivých komplikací, a to nemocní po CMP nebo TIA, nemocní nad 75 let věku a nemocní s tělesnou hmotností nižší než 60 kg, ve zbytku souboru byla účinnost prasugrelu vysoká (HR 0,74; 95% CI, 0,66–0,84; p < 0,001) bez rozdílu v krvácivých komplikacích ve srovnání s klopidogrelem (HR 1,24; 95% CI 0,91–1,69; p = 0,17), a s významným celkovým klinickým benefitem. Primární end-point (úmrtí z kardiovaskulárních příčin, nefatální infarkt myokardu nebo nefatální cévní mozková příhoda) se po této úpravě vyskytl v 8,3 % u prasugrelu a v 11,0 % u klopidogrelu (HR 0,74, CI 0,66–0,84, p < 0,001). Hlavní bezpečnostní end-point (velké krvácení bez vztahu k aortokoronárnímu bypassu) bylo v 2,0 % u prasugrelu a v 1,5 % u klopidogrelu (HR 1,24, CI 0,91–1,69, p = 0,17) a celkový klinický benefit se projevil i ve složeném end-pointu (úmrtí z jakýchkoliv příčin, nefatální infarkt myokardu, nefatální cévní mozková příhoda nebo nefatální velké krvácení bez vztahu k aortokoronárnímu bypassu) a ten byl zaznamenán v 10,2 % u prasugrelu a v 12,5 % u klopidogrelu (HR 0,80, CI 0,71–0,89, p < 0,001).
U nemocných se STEMI byl ve studii TRITON-TIMI 38 [15] po 30 dnech dosažen primární end-point v 6,5 % nemocných ve větvi s prasugrelem oproti 9,5 % při klopidogrelu (HR 0,68, 95% CI 0,54–0,87; p = 0,0017). Tento efekt trval do 15 měsíců (10,0 % vs 12,4 %; HR 0,79, CI 0,65–0,97, p = 0,0221). Prasugrel po dobu 30 dnů i 15 měsíců významně snížil i výskyt trombózy stentu. TIMI život ohrožující krvácení a TIMI velké i malé krvácení byly stejné u prasugrelu i klopidogrelu a pouze TIMI velké krvácení po aortokoronárním bypassu bylo významně vyšší po prasugrelu (p = 0,0033). Rovněž u diabetiků byla ve studii TIMI 38-TRITON tendence k většímu poklesu ischemických příhod bez vzestupu TIMI velkého krvácení a tedy celkově vyšší výsledný benefit ve větvi s prasugrelem než s klopidogrelem. Tato data ukázala důležitost intenzivní protidestičkové léčby u diabetiků [16].
Nové protidestičkové léky – shrnutí
Nové protidestičkové léky mají rychlejší a konzistentnější nástup účinku oproti klopidogrelu a vzhledem k svému metabolizmu je menší množství nemocných, kteří jsou rezistentní na tuto skupinu léků. Prasugrel je kontraindikován u nemocných po cévní mozkové příhodě nebo TIA, nemocných ve věku > 75 let a u nemocných s tělesnou hmotností < 60 kg a má data ukazující výhodnost jeho podávání především u nemocných se STEMI, či u diabetiků. Tikagrelor snižuje mortalitu nemocných s akutním koronárním syndromem bez rozdílů v závažném krvácení mezi skupinou léčenou tikagrelorem a klopidogrelem, s vyšším výskytem velkého krvácení bez vztahu k aortokoronárnímu bypassu při podávání tikagreloru, včetně vyššího výskytu fatálního intrakraniálního krvácení a menší výskyt fatálních krvácení jiných typů. U nemocných s chronickým onemocněním ledvin a s kreatininovou clearance 30–60 ml/min tikagrelor významně snižuje primární end-point oproti klopidogrelu. U nemocných s chronickým onemocněním ledvin tikagrelor snižuje i celkovou mortalitu.
Antikoagulační léčba u nemocných s akutním koronárním syndromem
Antitrombotická léčba nemocných s akutním koronárním syndromem – a to jak STEMI, tak i NSTEMI – není doposud spolehlivě vyřešena. I při použití v současné době optimální léčby zůstávají stále trombotické, ale především krvácivé komplikace poměrně časté. Využití NPA v léčbě nemocných s akutním koronárním syndromem je proto již určitou dobu ve středu pozornosti. I přes příznivý výsledek studie ATLAS ACS 2-TIMI 51 [17] však nové paradigma antitrombotické léčby nemocných po akutním koronárním syndromu ve smyslu změny duální antiagregace na trojitou antitrombotickou léčbu zdaleka není všeobecně přijímáno a řada otázek zůstává.
Studie ATLAS ACS 2-TIMI 51 prokázala, že inhibitor faktoru Xa – rivaroxaban – snížil výskyt kardiovaskulárních příhod u nemocných s akutním koronárním syndromem. V této studii byl podáván rivaroxaban 2krát denně v dávce 2,5 mg nebo 5 mg nebo bylo ke standardní léčbě přidáváno placebo (randomizace 1 : 1 : 1) včetně nízkých dávek kyseliny acetylsalicylové a thienopyridinů klopidogrelu nebo tiklopidinu. Randomizace byla stratifikována podle plánovaného nasazení thienopyridinu. Ve 2letém sledování byl primární end-point sestávající z kardiovaskulárního úmrtí, infarktu myokardu a cévní mozkové příhody dosažen celkem u 8,9 % při rivaroxabanu oproti 10,7 % při placebu (p = 0,008) a u pacientů se STEMI 8,4 % vs 10,6 % (p = 0,019). Výsledky byly obecně konzistentní přes všechny testované podskupiny vyjma nemocných po mozkových cévních příhodách či po tranzientní ischemické atace. Primární bezpečnostní end-point, tj. krvácení bez vztahu k aortokoronární revaskularizaci – byl významně častější u nemocných na rivaroxabanu (2,1 %) oproti placebu (0,6 %, p < 0,001). Intrakraniální krvácení bylo rovněž vyšší při podání rivaroxabanu (0,6 % vs 0,2 %, p < 0,0009). Všeobecně bylo krvácení častější po 6 měsících podávání, u osob s nízkou tělesnou hmotností a u starších nemocných [17]. Rivaroxaban 2,5 mg 2krát denně snížil četnost úmrtí z kardiovaskulárních příčin (2,5 % vs 4,2 %, p = 0,006) a úmrtí z jakýchkoliv jiných příčin (3,0 % vs 4,7 %, p = 0,008); lepší přežívání však nebylo patrné při dávce 5 mg 2krát denně.
Metaanalýzu, do které zavzali celkem 7 studií u nemocných s akutním koronárním syndromem, provedených od začátku roku 2000 do konce roku 2011, v nichž byly vedle duální antiagregace podávány ještě inhibitory trombinu nebo faktoru Xa nové generace, provedli Komoczi et al [18]. Do uvedené metaanalýzy bylo zařazeno celkem 31 286 nemocných a autoři prokázali dramaticky významně vyšší riziko krvácivých komplikací (HR 3,03, p < 0,001). Byl zjištěn lehký statisticky významný pokles výskytu trombózy stentu a ischemických příhod, ale bez ovlivnění mortality (HR 0,98, p = 0,57). Limitací uvedené metaanalýzy je nepochybně ta skutečnost, že sem byly zařazeny studie s různými antikoagulancii a o různě dlouhé době trvání, včetně studií předčasně ukončených, navíc s různou dávkou zkoumaných léků. Nicméně je nepochybné, že postavení antikoagulancií přidaných u akutních koronárních syndromů k duální antiagregační léčbě bude vyžadovat dalšího ověření velkými přesně cílenými randomizovanými studiemi.
Otázka trojité antitrombotické léčby (Triple Therapy)
Otázka trojité antitrombotické léčby (Triple Therapy) vznikla historicky na základě studií z 1. poloviny 90. let minulého století, které prokázaly neúčinnost antikoagulační léčby warfarinem v zabránění trombózy koronárního stentu a nízkou účinnost protidestičkové léčby v zabránění embolizace u fibrilace síní ve srovnání s antikoagulací. Proto bylo považováno za nezbytné u nemocných s fibrilací síní a po implantaci stentu po určitou dobu podávat jak duální antiagregaci, tak antikoagulační léčbu. Pro účinnost tohoto postupu v době moderních antitrombotik však chybějí robustnější data a vše se spíše soustřeďuje na posouzení výskytu závažných komplikací, především krvácení.
Téměř 10 % nemocných s akutním koronárním syndromem má rovněž fibrilaci síní [7]. Proto otázka trojité antitrombotické léčby, tj. kombinace duální antiagregace s antikoagulanciem, vzbuzuje i v poslední době značnou pozornost výzkumníků. Teoreticky vychází z výrazného zlepšení prognózy po podání antikoagulační léčby nemocným s fibrilací síní a duální antiagregace nemocným s akutním koronárním syndromem a po implantaci stentu, a naopak z neúčinnosti antiagregační léčby při fibrilaci síní a antikoagulace po implantaci koronárního stentu a otazné účinnosti u akutního koronárního syndromu. Zatím však nebyla náležitým způsobem v dostatečně dimenzované studii tato otázka testována a nebyla tudíž ani prokázána účinnost trojité antitrombotické léčby a pozornost je tudíž věnována snazší otázce bezpečnosti, především z hlediska krvácivých komplikací.
Prakticky je k dnešnímu dni jedinou randomizovanou, i když svým rozsahem spíše malou studií, která se soustředila na problém trojité antitrombotické léčby, studie WOEST [19]. Přestože proti této studii je vznášena celá řada námitek, její výsledky potvrzují riziko zvýšeného výskytu krvácivých komplikací při současném podání duální antiagregace společně s antikoagulační léčbou byť jen na krátkou dobu. Ve studii WOEST byl její primární end-point – všechna krvácení – dán především malými krváceními, ne všichni zařazení nemocní (pouze 69 %) měli fibrilaci síní – byla převaha femorálního přístupu nad radiálním a zařazeni byli jak akutní, tak chroničtí nemocní. Trvání trojité antitrombotické léčby 12 měsíců bylo delší, než je běžné v klinice a požadováno v současných doporučeních. Použití inhibitorů protonové pumpy bylo řídké a chybí i údaj o tom, zda mortalita v této malé studii byla ovlivněna přerušením antitrombotické léčby při vzniku krvácení.
Další údaje pocházejí z dánského národního registru, do hodnocení byli vybráni nemocní s fibrilací síní a infarktem myokardu nebo s koronárním stentingem v letech 2000–2009 (11 480 osob, průměrný věk 75,6 let [SD ± 10,3], mužů 60,9 %). Fatální nebo nefatální krvácení bylo vyhodnoceno ve vztahu ke stupni antitrombotické léčby: trojitá antitrombotická léčba (triple therapy – TT) s antagonistou vitaminu K (VKA) + aspirin + klopidogrel, proti VKA + aspirin nebo thienopyridin (VKA + AP), a konečně proti duální protidestičkové léčbě aspirin + klopidogrel (D). Během 1 roku bylo zaznamenáno 728 krvácivých příhod (6,3 %); 79 bylo fatálních (0,7 %). Během 30 dní bylo zaznamenáno 22,6, 20,3 a 14,3 krvácivých příhod na 100 osob za rok sledování pro TT, VKA + AP a D. Jak časně do 90 dní, tak opožděně (90–360 dní) riziko krvácení stouplo významně u TT oproti VKA + AP i D (HR 1,47 a 1,36). Nebyl významný rozdíl v tromboembolickém riziku pro TT vs VKA + AP (HR 1,15). Autoři uzavírají, že vysoké riziko krvácení je přítomno již velmi časně, že neexistuje bezpečné okno pro trojitou antitrombotickou léčbu, a tato by tudíž měla být indikována až po důkladném zvážení rizika krvácivých komplikací [20].
Krvácení je často multifaktoriální a důležitou roli hraje především poškození renálních funkcí. Zásadně důležité pro léčbu je proto i opakované hodnocení renálních funkcí, kdy i mírné poškození je spojeno s vyšším rizikem krvácení [21]. Rovněž HAS-BLED skóre významně předpovídá riziko krvácení u nemocných na trojité antitrombotické léčbě [22].
Důležitá je i skutečnost, že tito nemocní jsou často starší, polymorbidní s vysokým rizikem výskytu komplikací. Pokud se týká trojité antitrombotické léčby ve spojení s novými perorálními antikoagulancii u pacientů s fibrilací síní, tak jediná studie, v níž nebylo kontraindikováno podávání klopidogrelu, byla RE-LY [23,24]. Duální antiagregace společně s antikoagulační léčbou je spojena s vyšším rizikem než samotná antikoagulační či antiagregační léčba. Data pro podání NPA a duální antiagregace jsou omezená, a proto je nutno přistupovat ke každému pacientovi individuálně a délku trojkombinační léčby pečlivě zvažovat při zhodnocení rizika jednak mozkové příhody, koronární příhody a rizika krvácení.
Závěr
Trombóza představuje obrovský problém nejen současné kardiologie [25], ale doslova celé medicíny. S možnostmi trombotických komplikací se setkáváme napříč většinou oborů, stejně jako s nutností klinického rozhodování o nemocných léčených moderními účinnými antitrombotiky. Důsledky trombózy jsou dalekosáhlé v tom, že je odpovědna za většinu úmrtí v moderním světě. Přes velké pokroky v léčbě trombózy se nadále setkáváme s jejím selháním ve smyslu jak nezanedbatelného výskytu trombotických příhod, tak i nežádoucích účinků léčby – stále je nepřijatelně vysoký výskyt především krvácivých komplikací této léčby. Nová antitrombotika, se kterými se rychle seznamujeme v posledních letech, přinesly velký pokrok nejen ve snížení výskytu trombotických a krvácivých komplikací, ale i zjednodušení rozhodovacích algoritmů. Hledání optimální léčby trombózy však bude nepochybně ještě dlouho vyžadovat intenzivní základní i klinický výzkum.
prof. MUDr. Jan Vojáček, DrSc., FESC, FACC
jan.vojacek@fnhk.cz
I. interní kardioangiologická klinika LF UK a FN, Hradec Králové
www.fnhk.cz
Doručeno do redakce: 21. 2. 2014
Sources
1. Connolly SJ, Ezekowitz MD, Yusuf S et al for RE-LY Steering Committee and Investigators. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009; 361(12): 1139–1151.
2. Connolly SJ , Ezekowitz MD, Yusuf S et al for the Randomized Evaluation of Long-Term Anticoagulation Therapy Investigators. Newly Identified Events in the RE-LY Trial. (letter to the editor). N Engl J Med 2010; 363(19): 1875–1876.
3. Patel MR, Mahaffey KW, Garg J et al for the ROCKET AF Investigators. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011; 365(10): 883–891.
4. Granger CB, Alexander JH, McMurray JJV et al for the ARISTOTLE Committees and Investigators. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011; 365(11): 981–992.
5. Wallentin L, Becker RC, Budaj A et al for the PLATO Investigators. Ticagrelor versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2009; 361(11): 1045–1057.
6. Wiviott SD, Braunwald E, McCabe CH et al. for the TRITON–TIMI 38 Investigators. Prasugrel versus Clopidogrel in Patients with Acute Coronary Syndromes. N Engl J Med 2007; 357(20): 2001–2015.
7. Marín F, Huber K, Lip GYH. Antithrombotic therapy in atrial fibrillation and stent implantation: treatment or threats by the use of triple or dual antithrombotic therapy. Thromb Haemost 2013; 110(4): 623–625.
8. Stangier J, Rathgen K, Stähle H et al. The pharmacokinetics, pharmacodynamics and tolerability of dabigatran etexilate, a new oral direct thrombin inhibitor, in healthy male subjects. Br J Clin Pharmacol 2007; 64(3): 292–303.
9. Walenga JM, Adiguzel C. Drug and dietary interactions of the new and emerging oral anticoagulants. Int J Clin Pract 2010; 64(7): 956–967.
10. Kessler P. Porovnání warfarinu a nových antitrombotik z hlediska lékových interakcí. Klin Farmakol Farm 2012; 26(2): 74–78.
11. Franchini M. New antiplatelet agents: why they are needed. Eur J Intern Med 2009; 20(8): 733–738.
12. Held C, Åsenblad N, Bassand JP et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes undergoing coronary artery bypass surgery results from the PLATO (Platelet Inhibition and Patient Outcomes) Trial. J Am Coll Cardiol 2011; 57(6): 672–684.
13. Becker RC, Bassand JP , Budaj A et al for the PLATO Investigators. Bleeding complications with the P2Y12 receptor antagonists clopidogrel and ticagrelor in the PLATelet inhibition and patient Outcomes (PLATO) trial. Eur Heart J 2011; 32(23): 2933–2944.
14. James S, Budaj A, Aylward P et al (the PLATO Investigators). Ticagrelor versus clopidogrel in acute coronary syndromes in relation to renal function: results from the Platelet Inhibition and Patient Outcomes (PLATO) trial. Circulation 2010; 122(11): 1056–1067.
15. Montalescot G, Wiviott SD, Braunwald E et al. for TRITON-TIMI 38 Investigators. Prasugrel compared with clopidogrel in patients undergoing percutaneous coronary intervention for ST-elevation myocardial infarction (TRITON-TIMI 38): double-blind, randomised controlled trial. Lancet 2009; 373(9665): 723–731.
16. Wiviott SD, Braunwald E, Angiolillo DJ et al for TRITON-TIMI 38 Investigators. Greater clinical benefit of more intensive oral antiplatelet therapy with prasugrel in patients with diabetes mellitus in the trial to assess improvement in therapeutic outcomes by optimizing platelet inhibition with prasugrel-Thrombolysis in Myocardial Infarction 38. Circulation 2008; 118(16): 1626–1636.
17. Mega JL, Braunwald E, Wiviott SD et al for the ATLAS ACS 2-TIMI 51 Investigators. Rivaroxaban in patients with a recent acute coronary syndrome. N Engl J Med 2012; 366(1): 9–19.
18. Komocsi A, Vorobcsuk A, Kehl D et al. Use of new generation oral anticoagulant agents in patients receiving anticoagulant therapy after an acute coronary syndrome: systematic review and meta-analysis of randomized controlled trials. Arch Intern Med 2012; 172(20): 1537–1545.
19. Dewilde WJ, Oirbans T, Verheught FW et al. Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and undergoing percutaneous coronary intervention: an open label, randomized, controlled trial. Lancet 2013; 381(9872): 1107–1115.
20. Lamberts M, Olesen JB, Ruwald MH et al. Bleeding after initiation of multiple antithrombotic drugs, including triple therapy, in atrial fibrillation patients following myocardial infarction and coronary intervention: a nationwide cohort study. Circulation 2012; 126(10): 1185–1193.
21. Manzano-Fernández S, Cambronero F, Caro-Martínez C et al. Mild kidney disease as a risk factor for major bleeding in patients with atrial fibrillation undergoing percutaneous coronary stenting. Thromb Haemost 2012; 107(1): 51–58.
22. Smith JG, Wieloch M, Koul S et al. Triple antithrombotic therapy following an acute coronary syndrome: prevalence, outcomes and prognostic utility of the HAS-BLED score. EuroIntervention 2012; 8(6): 672–678.
23. Čihák R, Haman L, Heinc P. Souhrn Aktualizace doporučených postupů ESC pro léčbu fibrilace síní z roku 2012. Připraven Českou kardiologickou společnosti. Cor et Vasa 2012; 54: e341-e351.
24. Camm AJ, Lip GY, De Caterina R et al. ESC Committee for Practice Guidelines (CPG). 2012 focused update of the ESC Guidelines for the management of atrial fibrillation: an update of the 2010 ESC Guidelines for the management of atrial fibrillation. Developed with the special contribution of the European Heart Rhythm Association. Eur Heart J 2012; 33(21): 2719–2747. Erratum in: Eur Heart J 2013; 34(10): 790. Eur Heart J 2013; 34(36): 2850–2851.
25. Widimský P. Thrombosis – the central problem in clinical cardiology. Cor Vasa 2013; 55(2): e85.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 4-
All articles in this issue
- Prof. MUDr. Petr Widimský, DrSc., FESC, FACC šedesátiletý
- Vývoj klinického zájmu o plicní hypertenzi v České republice
- 30 let programu transplantace srdce v Institutu klinické a experimentální medicíny v Praze
- Medikamentózní léčba plicní arteriální hypertenze v roce 2014
- Neobvyklá intervence na nativní tepně u pacienta po aortokoronárním bypassu
- Optická koherentní tomografie, oddálená implantace stentu a přímá perkutánní koronární intervence u nemocných s infarktem myokardu a elevací ST segmentu
- Pečeň pri srdcovom zlyhávaní
- Mitrální stenóza
- Léčba srdečního selhání u diabetiků
- Vliv zkušenosti na výsledky katetrové implantace aortální chlopně v léčbě významné aortální stenózy
- Plně vstřebatelný lékový koronární stent: kde jsme v roce 2014?
- Význam stanovení galektinu 3 jako ukazatele myokardiální fibrózy v klinické kardiologii
- Místo chirurgické revaskularizace v léčbě akutního infarktu myokardu
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Predklinické kardiovaskulárne ochorenia a tuhosť aorty
- Acute heart failure and cardiogenic shock – trends at the beginning of 21st century
- Může léčba hypertenze ovlivnit výskyt demence?
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Srovnání amerických a evropských (českých) doporučení pro diagnostiku a léčbu chronického srdečního selhání
- Význam vulnerabilních aterosklerotických plátů a možnosti jejich detekce pomocí intravaskulární spektroskopie
- Katetrizační renální denervace v léčbě rezistentní hypertenze: realita nebo fikce?
- Praktické otázky léčby novými antitrombotiky
- Kombinační léčba hypertenze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pečeň pri srdcovom zlyhávaní
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Mitrální stenóza
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

