-
Medical journals
- Career
Význam vulnerabilních aterosklerotických plátů a možnosti jejich detekce pomocí intravaskulární spektroskopie
Authors: Cyril Štěchovský; Martin Horváth; Petr Hájek; Josef Veselka
Authors‘ workplace: Kardiologická klinika 2. LF UK a FN Motol Praha, přednosta prof. MUDr. Josef Veselka, CSc., FESC, FSCAI, FICA
Published in: Vnitř Lék 2014; 60(4): 375-379
Category: 60th Birthday - prof. MUDr. Petr Widimský, DrSc., FESC, FACC
Overview
Termín vulnerabilní plát je používán k popisu aterosklerotické léze s vysokým rizikem vzniku trombózy a akutní klinické manifestace v podobě infarktu myokardu či cévní mozkové příhody. Vulnerabilní pláty jsou histopatologicky a patofyziologicky poměrně dobře definovanou entitou. Jejich detekce in vivo doposud narážela na nedostatek metod schopných kvantifikovat určitou charakteristiku vulnerabilního plátu, která by predikovala riziko jeho klinické manifestace a která by byla validována ve velkých klinických studiích. Intravaskulární spektroskopie, která byla cíleně vyvinuta k detekci velikosti lipidového jádra aterosklerotického plátu, se zdá být nadějnou metodou k identifikaci in vivo a k rizikové stratifikaci vulnerabilních plátů. Tento článek shrnuje současné poznatky z klinických studií na téma near-infrared spectroscopy (NIRS).
Klíčová slova:
ateroskleróza – lipidové jádro – NIRS (near-infrared spectroscopy) – vulnerabilní plátÚvod
Onemocnění způsobená aterosklerózou jsou nejčastější příčinou úmrtí v České republice. Ateroskleróza je multifaktoriální proces, na kterém se podílí nejen krevní cholesterol, ale celá řada mediátorů a buněk. Aterosklerotické pláty se liší obsahem lipidů, velikostí lipidového jádra, tloušťkou fibrózního krytu, obsahem solí kalcia a počtem a aktivitou zánětlivých buněk. Za akutní klinickou manifestaci aterosklerózy je obvykle zodpovědná ruptura plátu s nasedající trombózou, která způsobí infarkt myokardu či náhlou smrt v případě koronárního postižení a cévní mozkovou příhodu v případě onemocnění karotických tepen. Pláty zodpovědné za klinické příhody se označují jako nestabilní, vulnerabilní či rizikové, k jejich základním charakteristikám patří velké nekrotické jádro s vysokým obsahem lipidů a tenký fibrózní kryt. Schopnost identifikace nestabilního plátu před jeho klinickou manifestací je již dlouhou dobu jedním z hlavních cílů kardiologie.
Význam detekce vulnerabilního plátu
Observační histopatologické studie objasnily základní histologické znaky aterosklerotických plátů vyskytujících se u pacientů zemřelých na infarkt myokardu (IM) či náhlou koronární smrt. U většiny těchto pacientů jsou nalézány ruptury a eroze plátů s velkým nekrotickým lipidovým jádrem, tenkým fibrózním krytem (thin-cap fibroatheroma – TCFA), hemoragiemi, neovaskularizací a vysokým obsahem zánětlivých buněk, na které nasedá trombus. Tyto studie také prokázaly, že výše popsané vulnerabilní pláty se vyskytují jen asi ve 4 % délky koronárních tepen, což naznačuje, že riziko vzniku trombózy je fokální a že tato místa s rizikovými pláty jsou potenciálně přístupná lokální léčbě [1]. Navzdory konsensu o klinickém významu přítomnosti těchto plátů, testování hypotézy vulnerabilního plátu v klinických studiích brzdí nedostatek spolehlivých zobrazovacích metod schopných zmíněné charakteristiky detekovat. Užití angiografických kritérií stenózy podhodnocuje rozsah aterosklerotického postižení zejména v časných fázích onemocnění, kdy se díky pozitivní cévní remodelaci může lumen tepny jevit jako normální navzdory přítomnosti významného aterosklerotického plátu ve stěně cévy (obr. 1). Angiografické hodnocení závažnosti stenózy také nezřídka nekoreluje s funkčním významem zúžení pro vznik zátěžové ischemie. Angiografie neposkytuje přesnou informaci o morfologii aterosklerotického plátu a nepodává žádnou informaci o složení plátu a jeho biologické aktivitě. Intravaskulární ultrazvuk (IVUS) dokáže zobrazit průřez stěnou cévy, velikost plátu, kalcifikace a tromby. Studie s IVUS ukázaly, že v lézích u pacientů s akutním koronárním syndromem (AKS) se často nalézají pláty zaujímající velkou část tepny, obsahující kalcifikace a hypoechogenní projasnění [2]. Nevýhodou IVUS je malé axiální rozlišení (100–200 µm), které neumožňuje zobrazit endotel a fibrózní čepičku plátu a nízká tkáňová specificita bez možnosti přímé detekce lipidového jádra. Optická koherenční tomografie (OCT) poskytuje vysoké axiální rozlišení (12–18 µm), díky kterému je schopna detekovat pláty s tenkým fibrózním krytem, ruptury a eroze, které se nalézají u pacientů s AKS. Pomocí OCT je dokonce možné sledovat endotelizaci stentu. Nevýhodou OCT je malý průnik do tkáně (1–2 mm), což obvykle nedovoluje zobrazit rozměry tepny a velikost celého plátu. Metoda také není schopna přímo detekovat lipidové jádro plátu [3]. Nejsilnější důkazy o existenci fokálních vulnerabilních lézí, které lze detekovat in vivo před tím, než způsobí klinickou příhodu, zatím pocházejí ze studie PROSPECT. Ve studii PROSPECT [4] byly 697 pacientům s AKS provedeny koronarografie a IVUS ve všech koronárních povodích. Bylo zjištěno, že přítomnost další koronární stenózy (mimo culprit lézi) s minimální plochou lumen ≤ 4 mm2, plátem zaujímajícím ≥ 70 % plochy cévy (plaque burden) či klasifikovaným jako TCFA pomocí radiofrekvenční virtuální histologie (VH-IVUS) představuje rizikový faktor úmrtí z kardiálních příčin, IM či rehospitalizace pro akutní koronární syndrom během 3leté doby sledování. Většina příhod byla způsobena lézemi, které byly na vstupní koronarografii nevýznamné. Přítomnost všech 3 výše zmíněných charakteristik představovala 18% riziko vzniku klinické příhody z dané léze, naopak pláty nesplňující žádnou z charakteristik představovaly jen 0,3% riziko. Pokud připustíme, že léze zodpovědné za klinické příhody mají obzvlášť vysoký obsah lipidů, tenký fibrózní kryt a vysokou aktivitu zánětlivých buněk, pak metody schopné detekovat tyto charakteristiky budou mít vyšší senzitivitu a specificitu pro predikci koronárních příhod než doposud užívaná vyšetření.
Image 1. Cévní remodelace 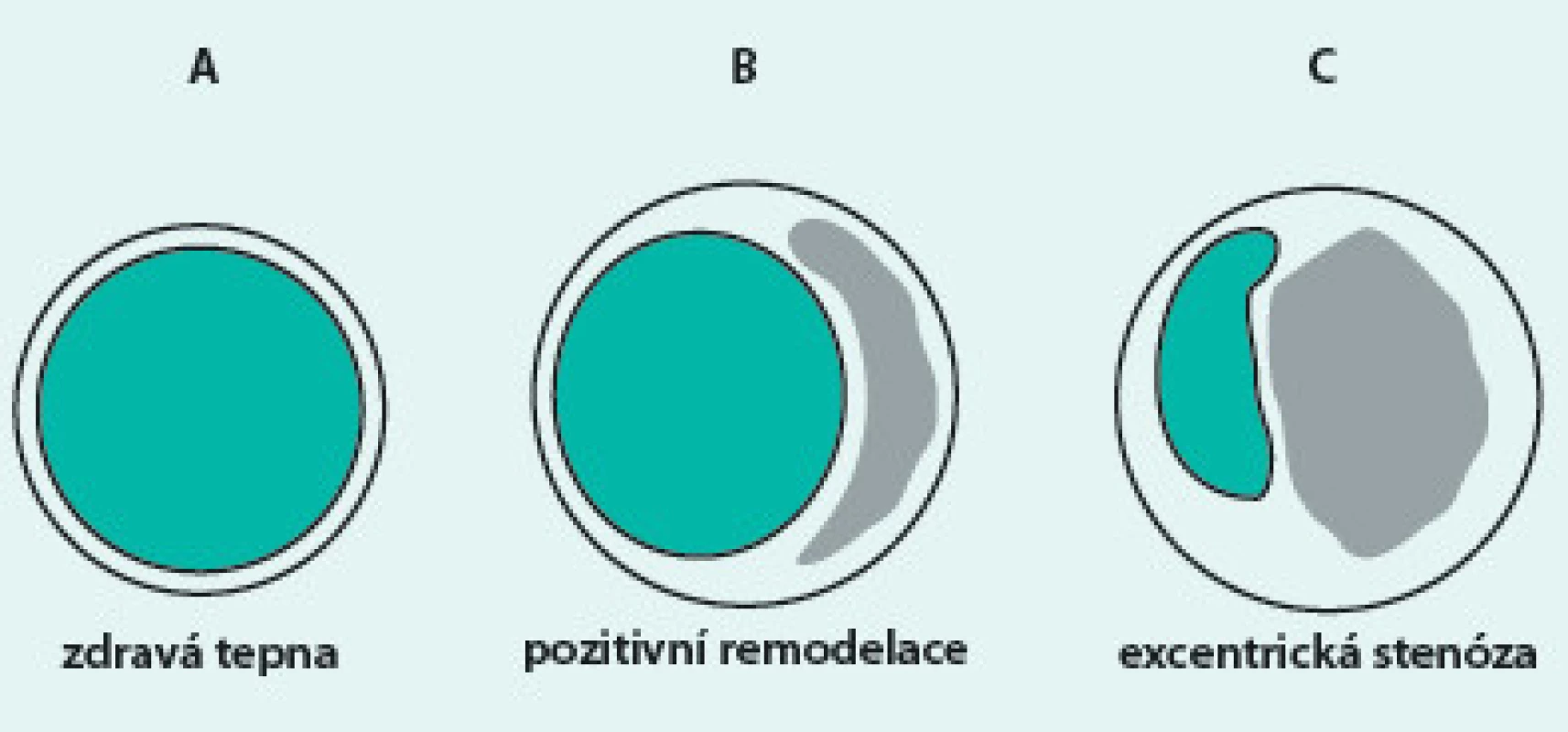
A – zdravá tepna B – tepna obsahující aterosklerotický plát C – stenotická tepna s objemným plátem; plocha lumen A a B je stejná. Co je NIRS?
Near infrared spectroscopy (NIRS) je invazivní vyšetřovací metoda k in vivo identifikaci a kvantifikaci lipidového jádra aterosklerotického plátu. Hlavní výhodou NIRS je schopnost detekce aterosklerotických plátů obsahujících lipidové jádro (lipid core plaque – LCP). Definice LCP (viz dále) se snaží co nejvíce přiblížit patologickému popisu vulnerabilního plátu a akcentuje přítomnost ateromových hmot (amorfní směsi cholesterolu, dalších lipidů, zánětlivých a nekrotických buněk) pod fibrózním krytem plátu. NIRS nezobrazuje lumen cévy, velikost plátu ani tloušťku fibrózního krytu, kombinace s IVUS však poskytuje simultánní a vzájemně se doplňující informaci o chemickém složení a struktuře plátu. NIRS-IVUS tak nabízí potenciál k identifikaci vulnerabilního plátu.
Princip NIRS
Spektroskopie je metoda používaná již desetiletí v analytické chemii pro identifikaci organických molekul ve směsích. Využívá rozptylu, absorpce a odrazu elektromagnetického záření o různých vlnových délkách, přičemž vlnové délky odražených paprsků jsou specifické pro dané molekuly ve směsi. Při použití vhodné vlnové délky emitovaného záření 800–2 500 nm, tedy v pásmu tzv. blízkého infračervenému záření (near-infrared – NIR), a algoritmu detekce odraženého záření vlnových délek specifických pro cholesterol a jeho estery, lze tyto detekovat v aterosklerotickém plátu. Pro detekci lipidového jádra aterosklerotického plátu in vivo byl vyvinut NIRS katétr, který obsahuje optické vlákno a NIR spektrometr emitující NIR záření do stěny cévy a detekující odražené paprsky. Průnik NIR paprsků přes sloupec krve je dostatečný k odlišení signálu z cévní stěny a k odlišení plátů bohatých na lipidové jádro od ostatních. Vyšetření probíhá po zavedení 3,2 F NIRS katétru po standardním vodiči na distální konec úseku tepny a jeho pomalém vysouvání konstantní rychlostí 0,5 mm/s, přičemž sonda emitující NIR záření rotuje rychlostí 4 otáčky za sekundu. Systém provede přibližně 80 měření na 1 mm tepny. Výsledkem vyšetření tepny NIRS katétrem je chemogram: na ose x je délka vyšetřené tepny a na ose y obvod tepny ve stupních. Chemogram je dvourozměrná mapa, která představuje pohled do vnitřku podélně rozříznuté tepny (obr. 2). Detekce lipidů má pravděpodobnostní charakter, každému měření je přiřazen 1 pixel na chemogramu dle intenzity signálu lipidů, na obrazovce je tato hodnota kódována barvou od červené (nízká intenzita lipidového signálu) po žlutou (vysoká intenzita lipidového signálu). Souhrn výsledků pro každé 2 mm chemogramu analyzovaného úseku tepny se nazývá block chemogram. Číselná hodnota každého úseku představuje 90. percentil hodnot všech pixelů v odpovídajícím 2milimetrovém úseku chemogramu. Block chemogram je zobrazen ve stejné barevné škále jako chemogram a s pomocí 4 barev znázorňuje pravděpodobnost přítomnosti LCP ve 2milimetrovém segmentu (červená: p < 0,57, tmavě oranžová: 0,57 ≤ p ≤ 0,84, světle oranžová: 0,84 ≤ p ≤ 0,98, žlutá: p > 0,98) Jeden obdélníček block chemogramu mající žlutou barvu si lze zjednodušeně představit jako 2milimetrový úsek tepny obsahující s vysokou pravděpodobností LCP (obr. 3). Podíl pixelů, kterým byla na chemogramu přiřazena žlutá barva, k celkovému počtu pixelů chemogramu násobený tisícem se nazývá lipid core burden index (LCBI), je to tedy bezrozměrné číslo od 0 do 1 000. Čtyřmilimetrový úsek tepny s nejvyšším LCBI je označen maxLCBI4mm. LCBI a maxLCBI4mm kvantifikují přítomnost LCP ve vyšetřovaném úseku tepny. Lze říci, že při LCBI 0 neobsahuje vyšetřený úsek tepny žádné LCP, neznamená to však, že nemůže být ateroskleroticky postižen a mít těsnou stenózu. NIRS neposkytuje žádné strukturální (anatomické) informace o lumen a stěně cévy. Tuto limitaci lze odstranit použitím katétru, který kombinuje jak NIRS, tak intravaskulární ultrazvukovou sondu (IVUS) (obr. 4). Během jediného vyšetření tak lze získat informace o morfologii a přítomnosti lipidů v plátu a identifikovat tak LCP.
Image 2. Chemogram 
na ose x zachycena délka tepny, na ose y úhel rotace sondy (žlutá – pozitivní signál LCP, červená – v cévní stěně se nenachází plát bohatý na lipidy, černá – výpadek signálu) Image 3. Chemogram tepny se dvěma LCP 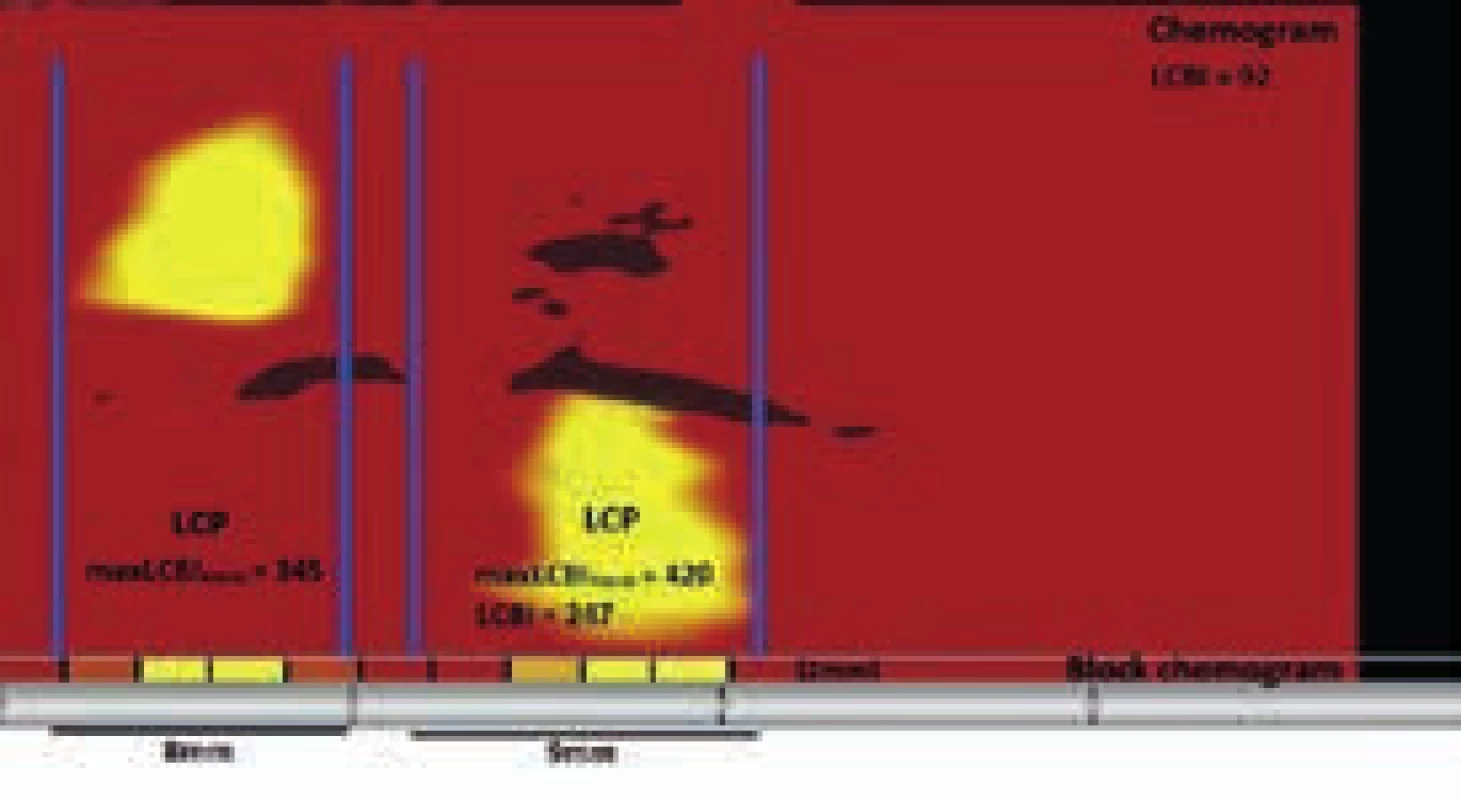
(části block chemogramu mající minimálně jeden 2mm úsek žlutou barvou). Celková zátěž tepny přítomností LCP a jejich velikostí je LCBI (lipid core burden index). LCBI lze určit i pro menší úseky tepny, např. obsahující jednotlivý LCP nebo úsek určený k překrytí stentem. Image 4. Příčný řez koronární tepnou obsahující LCP zobrazený NIRS-IVUS katétrem (TVC-Imaging System, Infraredx, Burlington, USA). 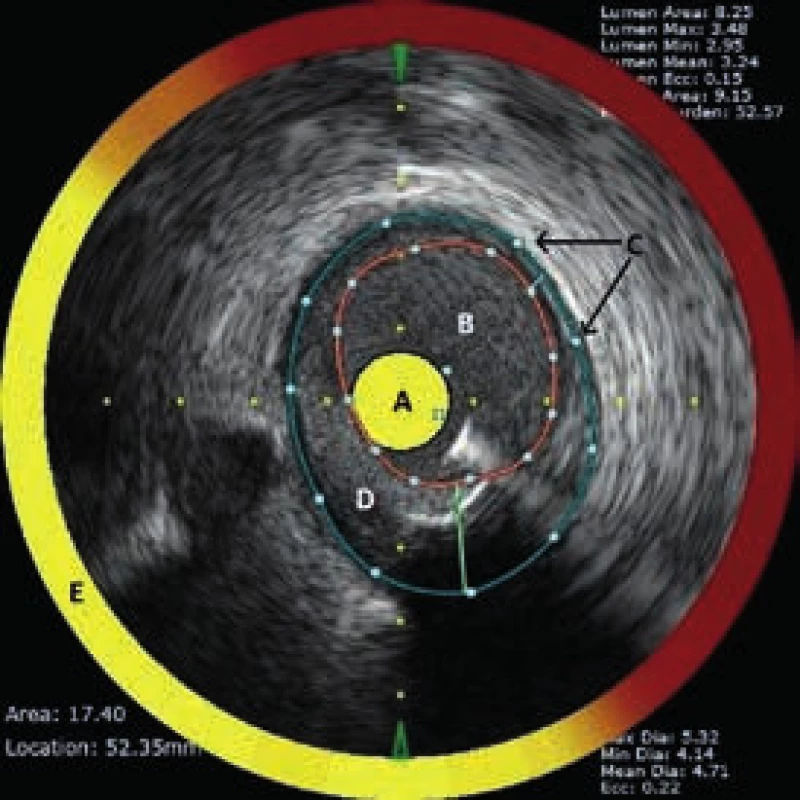
A – katétr (barevná škála odpovídající block chemogramu) B – plocha lumen C – rozměr tepny D – aterosklerotický plát E – chemogram Schopnost NIRS detekovat LCP in vivo
Přítomnost LCP byla arbitrárně definována jako minimálně jeden 2milimetrový úsek block chemogramu, který má žlutou barvu. Schopnost NIRS spolehlivě a reproducibilně detekovat LCP byla nejprve validována vyšetřováním koronárních tepen získaných post mortem ve srovnání s histologickým zlatým standardem (fibroaterom v cirkulárním rozsahu > 60 °, tloušťka na příčném histologickém řezu > 200 µm, s fibrózní čepičkou o průměrné síle < 450 µm). Ve studii byla zjištěna AUC (area under the receiver – operating characteristic curve) pro detekci LCP 0,80 (95% CI; 0,70–0,93). Hlavním zdrojem chyb při detekci LCP byla falešná pozitivita fibroateromů s tloušťkou krytu ≥ 450 µm a plátů ≤ 200 µm na příčném řezu. Následně bylo provedeno klinické ověření principů NIRS, které prokázalo, že signály NIRS získané katetrizací pacientů jsou spektrálně podobné signálům z patologických preparátů. Bylo tedy prokázáno, že lze LCP detekovat in vivo [5].
Význam identifikace LCP v koronárních tepnách
Invazivní vyšetření NIRS-IVUS katétrem je schopno detekovat léze s plaque burden > 70 %, o kterých je již známo, že jsou rizikovým faktorem koronárních příhod, a simultánně identifikovat LCP. Od NIRS se očekává zvýšení diagnostické přesnosti detekce vulnerabilních aterosklerotických plátů, určení lézí s velkým rizikem periprocedurálního IM při perkutánní koronární intervenci (PCI), u kterých by případně mělo smysl rutinně užívat distální protekční systémy, a určení optimální délky stentu k pokrytí obou konců léze osahující LCP. V současnosti již existuje řada důkazů z observačních klinických studií, které podporují význam NIRS detekce LCP v koronárních tepnách. Madder et al prokázali, že culprit léze pacientů s AKS jsou častěji tvořeny LCP než pacientů se stabilní ICHS (84 % vs 53 %). Pacienti s AKS mají také častěji přítomny další LCP v intervenované tepně [6]. Další studie u pacientů s akutním IM s ST elevacemi prokázala, že maxLCBI4mm > 400 je charakteristické pro culprit léze a je 6krát vyšší než u non-culprit lézí [7]. Během PCI dojde k roztlačení plátu do stran a do délky, část obsahu plátu, která je tvořena měkkými (lipidovými) hmotami, však embolizuje a způsobí různou míru obstrukce mikrocirkulace. Tento jev je příčinou části periprocedurálních elevací kardiomarkerů a pravděpodobně zodpovídá za zpomalení či úplnou zástavu průtoku krve intervenovanou tepnou (no-flow fenomén), což je komplikace, ke které dojde u malé části pacientů po PCI. Lze předpokládat, že léze způsobující výše zmíněné komplikace obsahují velké lipidové jádro a budou tedy detekovány NIRS jako LCP. Bylo prokázáno, že při PCI dojde k poklesu LCBI intervenované tepny [8]. U pacientů podstupujících PCI je přítomnost velkého LCP (maxLCBI4mm nad 500) v místě uložení stentu rizikovým faktorem periprocedurální elevace biomarkerů nekrózy myokardu [9]. Dixon et al zjistili, že 16 % lézí indikovaných k PCI má LCP za angiograficky patrnými konci léze, určení délky stentu dle angiografie vyústí u této léze k jejímu inkompletnímu překrytí: jeden či oba konce stentu budou v LCP. Tím dojde k ruptuře LCP, která nebude kompletně překryta stentem, což by mohlo představovat rizikový faktor trombózy stentu [10].
Perspektivy NIRS a léčba vulnerabilního plátu
Je pravděpodobné, že vulnerabilní aterosklerotické pláty bylo doposud těžší identifikovat než léčit. V současnosti již existují klinicky prověřené postupy zaměřené na jejich léčbu ve specifických situacích, které snižují mortalitu pacientů a pro které máme řadu důkazů z randomizovaných klinických studií – PCI u pacientů s AKS, farmakoterapie statiny po IM. PCI u pacientů s akutním koronárním syndromem představuje vlastně cílenou léčbu klinicky manifestního vulnerabilního plátu. Terapie statiny u pacientů po IM má mimo jiné za cíl stabilizovat vulnerabilní pláty. Ve studii YELLOW bylo prokázáno, že intenzivní léčba rosuvastatinem (40 mg/den) u pacientů s chorobou více tepen vede již během 7 týdnů k signifikantně větší redukci maxLCBI4mm v angiograficky významných lézích než léčba standardní dávkou statinu [11]. Teprve velké prospektivní studie s dobou sledování několik let nám ukážou, s jakou mírou senzitivity a specificity NIRS identifikuje LCP zodpovědné za budoucí koronární příhody a zda ovlivnění těchto lézí např. pomocí intenzivní farmakoterapie či cíleného překrytí léze biodegradabilním stentem (biodegradable vascular scaffold – BVS), vedoucí ke snížení počtu LCP a celkového LCBI, způsobí i redukci incidence IM a mortality. Bude třeba také stanovit, pro jaké pacienty by byla tato cílená léčba přínosná a ekonomicky efektivní. V současnosti probíhá nábor pacientů do studie PROSPECT II, ve které bude 900 pacientům s AKS proveden NIRS-IVUS. Bude testována schopnost NIRS identifikovat vulnerabilní léze vedoucí k recidivě IM a jiným klinicky závažným příhodám. Současně bude probíhat podstudie PROSPECT ABSORB, ve které bude 300 pacientů randomizováno na preventivní PCI s uložením BVS do lézí identifikovaných studií PROSPECT za rizikové vs optimální terapie dle platných doporučených postupů. Jedná se o první randomizovanou studii testující možnost předejít vzniku IM koronární intervencí v místě bez angiograficky významné stenózy. Další studie LRP plánuje u 9 000 pacientů s klinicky indikovanou koronarografií provést NIRS-IVUS a sledovat 2letou mortalitu a výskyt klinických příhod v závislosti na iniciálním LCBI a počtu LCP [12]. V případě, že v těchto studiích bude nalezena NIRS-IVUS charakteristika léze, která s velkou diagnostickou přesností dokáže predikovat vznik AKS, a v případě pozitivních výsledků intervenčních studií zaměřených na tyto léze bychom se mohli dočkat změny doporučených postupů pro léčbu AKS a stabilní ICHS. Závěry prvních velkých studií budou k dispozici nejdříve za 3 roky. Je však otázkou, zda dvouleté až tříleté sledování pacientů v těchto studiích je dostatečně dlouhé, aby nám přineslo silné důkazy o prospěšnosti intervenční léčby založené na NIRS detekci vulnerabilního plátu.
Závěr
Slibné výsledky doposud publikovaných menších studií s NIRS vedly k zahájení velkých observačních studií na pacientech s AKS či podstupujících PCI. Tyto studie hodnotí schopnost NIRS (v kombinaci s IVUS) identifikovat vulnerabilní léze zodpovědné za IM, úmrtí či nutnost revaskularizace během sledování. Nejočekávanější výsledky přinesou plánované nebo již probíhající randomizované studie porovnávající efekt „preventivní“ PCI vysoce rizikových lézí s implantací nejnovějších typů stentů (BVS) ve srovnání s terapií dle současných doporučených postupů a randomizované studie hodnotící použití distálních protekčních systémů v prevenci periprocedurálního IM při PCI lézí s velkým LCBI. Pozitivní výsledky těchto studií by potvrdily klinický význam NIRS a vedly by pravděpodobně k jejímu začlenění do portfolia intervenčních kardiologických pracovišť. Při indikaci k revaskularizaci myokardu zůstane i do budoucna rozhodujícím faktorem anatomická identifikace stenóz a detekce zátěžové ischemie. NIRS posouvá diagnostiku koronární nemoci od popisu stenóz a určení jejich hemodynamického významu k identifikaci vulnerabilních plátů, nové rizikové stratifikaci pacientů podle přítomnosti a velikosti LCP v koronárních tepnách a novým indikacím koronárních intervencí založených na identifikaci LCP. To vše za předpokladu, že probíhající observační a na ně navazující randomizované studie přinesou pozitivní výsledky. Pokud se tak nestane, neznamená to, že naše představy o patofyziologii vulnerabilního plátu a vzniku infarktu myokardu jsou chybné, ale spíše, že současné diagnostické a terapeutické možnosti jsou stále příliš nedokonalé. K přesnějšímu hodnocení vulnerability plátu bude nejspíše potřeba kombinace metod detekujících jeho různé charakteristiky (velikost plátu, tloušťka fibrózního krytu, velikost lipidového jádra, aktivita zánětlivých buněk atd). Nové invazivní vyšetřovací metody zaměřené na detekci vulnerabilních plátů najdou klinické uplatnění nejprve v sekundární prevenci u pacientů po IM či podstupujících PCI. U těchto pacientů mohou být invazivní intrakoronární vyšetření prováděna bez významného zvýšení rizika a s navýšením nákladů jen o cenu vlastního diagnostického katétru. Nicméně invazivní vyšetření a na ně navazující terapie by mohly být použity i v rámci primární prevence u vybraných pacientů. Takováto strategie by musela zahrnovat stupňovitý proces komplexního zhodnocení kardiovaskulárního rizika od klasických rizikových faktorů, přes nové biomarkery a neinvazivní zobrazovací metody po invazivní vyšetření pro nejvíce rizikové pacienty [13] a navazující sled intervencí s prokázanou účinností pro specifické rizikové skupiny. Aby neinvazivní zobrazovací metody byly využitelné k identifikaci osob s velmi vysokým rizikem IM a úmrtí z kardiovaskulárních příčin, musely by mít pozitivní prediktivní hodnotu několikanásobně vyšší než současně používané systémy založené na demografických a klinických údajích [14]. Aby bylo odůvodnitelné invazivní vyšetření k identifikaci vulnerabilních lézí u vysoce rizikových pacientů, musely by existovat léčebné postupy nad rámec dnes používané farmakoterapie a nefarmakologických postupů, které by dále snižovaly kardiovaskulární riziko.
MUDr. Cyril Štěchovský
stechovsky@gmail.com
Kardiologická klinika 2. LF UK a FN Motol, Praha
www.fnmotol.cz
Doručeno do redakce: 4. 2. 2014
Sources
1. Waksman R, Serruys PW. Handbook of the Vulnerable Plaque. Martin Dunitz: New York 2004. ISBN 9781841843230.
2. McDaniel MC, Eshtehardi P, Sawaya FJ et al. Contemporary clinical applications of coronary intravascular ultrasound. J Am Coll Cardiol Intv 2011; 4(11): 1155–1167.
3. Bezerra HG, Costa MA, Guagliumi G et al. Intracoronary optical coherence tomography: a comprehensive review clinical and research applications. J Am Coll Cardiol Intv 2009; 2(11): 1035–1046.
4. Stone GW, Maehara A, Lansky AJ et al. A prospective natural-history study of coronary atherosclerosis. N Engl J Med 2011; 364(3): 226–235.
5. Waxman S, Dixon SR, L'Allier P et al. In Vivo Validation of a Catheter-Based Near-Infrared Spectroscopy System for Detection of Lipid Core Coronary Plaques: Initial Results of the SPECTACL Study. JACC Cardiovasc Imaging 2009; 2(7):858–868.
6. Madder RD, Steinberg DH, Anderson RD. Multimodality Direct Coronary Imaging with Combined Near-Infrared Spectroscopy and Intravascular Ultrasound: Initial US Experience. Catheter Cardiovasc Interv 2013; 81(3): 551–557.
7. Madder RD, Goldstein JA, Madden SP et al. Detection by Near-infrared Spectroscopy of Large Lipid Core Plaques at Culprit Sites in Patients with Acute ST-Segment Elevation Myocardial Infarction. J Am Coll Cardiol Intv 2013; 6(8): 838–846.
8. Garcia BA, Wood F, Cipher D et al. Reproducibility of near-infrared spectroscopy for the detection of lipid core coronary plaques and observed changes after coronary stent implantation. Catheter Cardiovasc Interv 2010; 76(3): 359–365.
9. Goldstein JA, Maini B, Dixon SR et al. Detection of Lipid-core Plaques by Intra-coronary Near-infrared Spectroscopy Identifies High Risk of Peri-Procedural Myocardial Infarction. Circ Cardiovasc Interv 2011; 4(5): 429–437.
10. Dixon SR, Grines CL, Munir A et al. Analysis of Target Lesion Length Before Coronary Artery Stenting Using Angiography and Near-Infrared Spectroscopy Versus Angiography Alone. Am J Cardiol 2012; 109(1): 60–66.
11. Kini AS, Baber U, Kovacic JC et al. Changes in Plaque Lipid Content After Short-Term Intensive Versus Standard Statin Therapy: The YELLOW Trial (Reduction in Yellow Plaque by Aggressive Lipid-Lowering Therapy). J Am Coll Cardiol 2013; 62(1): 21–29.
12. Madder RD, Stone GW, Erlinge D et al. The Search for Vulnerable Plaque – The Pace Quickens. J Invasive Cardiol 2013; 25(Suppl A): 29–33.
13. Braunwald E. Epilogue: What do clinicians expect from imagers? J Am Coll Cardiol 2006; 47(Suppl 8): C101-C103.
14. Fleg JL, Stone GW, Fayad ZA et al. Detection of high-risk atherosclerotic plaque: report of the NHLBI Working Group on current status and future directions. JACC Cardiovasc Imaging. 2012; 5(9): 941–955.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 4-
All articles in this issue
- Prof. MUDr. Petr Widimský, DrSc., FESC, FACC šedesátiletý
- Vývoj klinického zájmu o plicní hypertenzi v České republice
- 30 let programu transplantace srdce v Institutu klinické a experimentální medicíny v Praze
- Medikamentózní léčba plicní arteriální hypertenze v roce 2014
- Neobvyklá intervence na nativní tepně u pacienta po aortokoronárním bypassu
- Optická koherentní tomografie, oddálená implantace stentu a přímá perkutánní koronární intervence u nemocných s infarktem myokardu a elevací ST segmentu
- Pečeň pri srdcovom zlyhávaní
- Mitrální stenóza
- Léčba srdečního selhání u diabetiků
- Vliv zkušenosti na výsledky katetrové implantace aortální chlopně v léčbě významné aortální stenózy
- Plně vstřebatelný lékový koronární stent: kde jsme v roce 2014?
- Význam stanovení galektinu 3 jako ukazatele myokardiální fibrózy v klinické kardiologii
- Místo chirurgické revaskularizace v léčbě akutního infarktu myokardu
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Predklinické kardiovaskulárne ochorenia a tuhosť aorty
- Acute heart failure and cardiogenic shock – trends at the beginning of 21st century
- Může léčba hypertenze ovlivnit výskyt demence?
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Srovnání amerických a evropských (českých) doporučení pro diagnostiku a léčbu chronického srdečního selhání
- Význam vulnerabilních aterosklerotických plátů a možnosti jejich detekce pomocí intravaskulární spektroskopie
- Katetrizační renální denervace v léčbě rezistentní hypertenze: realita nebo fikce?
- Praktické otázky léčby novými antitrombotiky
- Kombinační léčba hypertenze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pečeň pri srdcovom zlyhávaní
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Mitrální stenóza
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

