-
Medical journals
- Career
30 let programu transplantace srdce v Institutu klinické a experimentální medicíny v Praze
Authors: Lenka Hošková 1; Ivan Málek 1; prof. MUDr. Vojtěch Melenovský, CSc. 1; Marianna Podzimková 1; Markéta Hegarová 1; Zora Dorazilová 1; Josef Kautzner 1; Ivan Netuka 2; Jan Pirk 2
Authors‘ workplace: Klinika kardiologie Institutu klinické a experimentální medicíny Praha, přednosta prof. MUDr. Josef Kautzner, CSc. 1; Klinika kardiovaskulární chirurgie Institutu klinické a experimentální medicíny Praha, přednosta prof. MUDr. Jan Pirk, DrSc. 2
Published in: Vnitř Lék 2014; 60(4): 275-281
Category: 60th Birthday - prof. MUDr. Petr Widimský, DrSc., FESC, FACC
Overview
Transplantace srdce se stala v posledních desetiletích zavedenou metodou léčby pokročilého srdečního selhání. Právě v lednu roku 2014 uplynulo 30 let od zahájení klinického programu transplantace srdce v Institutu klinické a experimentální medicíny. Do konce roku 2013 bylo provedeno 936 transplantací srdce. Od svých počátků zaznamenal transplantační program značný vývoj, uvolnila se indikační kritéria, prohloubily se znalosti celé problematiky, jsou k dispozici a stále se hledají nová imunosupresiva. Prodloužila se doba přežívání a zlepšila se kvalita života pacientů. Přesto však zůstává péče o transplantované nemocné často komplikovaným úkolem pro tým zdravotníků s řadou specifických problémů k řešení.
Klíčová slova:
dárci srdce – imunosuprese – indikační kritéria – rejekce štěpu – transplantace srdce – výběr pacientůÚvod
V lednu roku 2014 uplynulo 30 let od zahájení klinického programu transplantace srdce (TxS) v Institutu klinické a experimentální medicíny Praha (IKEM), což představuje dobrou příležitost k ohlédnutí zpět a shrnutí vývoje v této oblasti. Do konce roku 2013 bylo v České republice provedeno 1 394 TxS. Dosud nejdéle žijící pacient po TxS v ČR, transplantovaný jako 3. v pořadí v roce 1984, se letos se dožije 30 let od výkonu [1,2]. V České republice se TxS provádí ve 2 centrech – v IKEM v Praze a Centru kardiovaskulární a transplantační chirurgie (CKTCH) v Brně (graf 1), IKEM se na celkovém počtu TxS v ČR podílí více než 67 %. V množství transplantací na 1 milion obyvatel se Česká republika řadí na velmi dobré 3. místo v Evropě (6,9 výkonů na milion obyvatel v roce 2012). V současné době je ve světě přibližně 400 center provádějících TxS [3] a jednoroční přežívání dosahuje více než 80 % pacientů. Dle údajů mezinárodního registru je medián dlouhodobého přežívání 11 let [3]. Šedesátidevítiprocentní pravděpodobnost 5letého přežití u pacientů transplantovaných v IKEM (graf 2) se tedy zcela shoduje s celosvětovým průměrem.
Graph 1. Roční celkové počty transplantací srdce provedených v Institutu klinické a experimentální medicíny v Praze (tmavá barva) a v Centru kardiovaskulární a transplantační chirurgie v Brně (světlá barva) 
Graph 2. Křivka dlouhodobého přežívání po transplantaci srdce v IKEM u všech pacientů transplantovaných v IKEM od začátku programu v lednu roku 1984 do ledna roku 2014 (n = 939 transplantovaných). Kumulativní přežívání značeno plnou čarovu, přerušované křivky označují směrodatnou odchylku. 
Velký rozvoj programu TxS v IKEM přinesla 90. léta minulého století, zejména v důsledku zvýšení počtu dárců orgánů [4]. Do roku 1993 byly všechny odběry srdce od zemřelých dárců prováděny pouze na domácím pracovišti a všichni dárci byli transportováni, často i ze vzdálenosti 400 km, v současné době je většina odběrů vzdálených. K relativně vysokému počtu dárců orgánů v České republice významnou mírou přispívá princip předpokládaného souhlasu s posmrtným darováním orgánů s tím, že existuje tzv. negativní registr – registr osob nesouhlasících s odběrem orgánů a tkání po smrti. Zákon současně ukládá ošetřujícímu lékaři, který se stará o potencionálního dárce orgánů, povinnost informovat o předpokládaném odběru orgánů pozůstalé. Pokud rodina s odběrem nesouhlasí, v běžné praxi se jejich přání respektuje a odběr orgánů není proveden.
Dárci srdce
Česká republika se potýká v posledních 10 letech s relativním nedostatkem dárců orgánů, počet dárců ročně se pohybuje okolo 17–20 na 1 milion obyvatel (v roce 2012 to bylo 20,4/1 milion obyvatel). Podobně jako v jiných zemích se významně zvýšil i věk dárců, konkrétně v roce 1993 byl medián věku dárců necelých 30 let a v roce 2011 to bylo 54 let. Medián věku dárců srdcí, která byla v IKEM transplantována, byl 25 let v roce 1995 a v roce 2013 to bylo 42 let. Od roku 2000 do roku 2011 bylo transplantováno celkem 77 srdcí od dárců starších 60 let.
Indikace k transplantaci srdce
K TxS jsou indikováni pacienti s terminálním srdečním selháním, u kterých byly vyčerpány všechny ostatní možnosti léčby [5–7]. Podmínkou je absence závažných přidružených onemocnění, předpoklad dobré spolupráce a dobré sociální zázemí. Některé okolnosti představují absolutní kontraindikaci TxS (tab. 1). Kandidát TxS je klinicky vyšetřen za hospitalizace v IKEM, indikace je stanovena na indikačním semináři, na němž jsou přítomni kardiologové a kardiochirurgové. Pacienti jsou zařazeni na čekací listinu v urychleném nebo standardním pořadí v jednotlivých kategoriích dle krevních skupin a tělesné váhy (I-IV). Kritériem pro urgentní zařazení je nutnost hospitalizace a parenterální léčby srdečního selhání, dále přítomnost těžké plicní hypertenze (PH), implantovaná mechanická srdeční podpora, kombinovaná transplantace či retransplantace. Zvláštní pozornost je věnována přítomnosti PH. Pravostranná katetrizace Swan-Ganzovým termodilučním katétrem je obligátní součástí vyšetření před TxS. U pacientů na čekací listině je toto vyšetření opakováno v 3–12měsíčních intervalech. Je-li přítomna zvýšená plicní vaskulární rezistence (nález transpulmonálního gradientu TPG > 15 mm Hg nebo plicní arteriolární rezistence (PAR ≥ 3 Woodovy jednotky v euvolemickém stavu), provádíme testování reverzibility pomocí prostaglandinu E1. Nález fixované významné PH (TPG > 20 mm Hg nebo PAR > 4 W.j.) představuje momentální kontraindikaci k TxS. V takovém případě zahajujeme léčbu sildenafilem [8,9], případně indikujeme pacienta k zavedení levostranné mechanické podpory. Při dlouhodobém snížení tlaku v levé síni pomocí mechanické podpory dochází obvykle k poklesu PH a k ústupu zvýšené plicní arteriální resistence. TxS je poté možno provést bez zvýšeného rizika selhání pravé komory srdeční [10].
Table 1. Kontraindikace transplantace srdce 
U méně symptomatických pacientů je nutno provést prognostickou stratifikaci. Je provedeno komplexní posouzení stavu a vývoje onemocnění, z vyšetřovacích metod nám nejvíc pomáhá spiroergometrie a sledování dynamiky BNP. Nepříznivou známkou je zjištění vrcholové spotřeby kyslíku (VO2max ≤ 10 ml/kg/min, nebo < 50 % predikované hodnoty VO2max a nebo známky hyperventilace). Špatnou prognózu signalizuje i chybění poklesu BNP při léčbě dekompenzace srdečního selhání. V našem centru máme možnost využít všechny možnosti farmakologické i nefarmakologické léčby (chirurgická revaskularizace, implantace přístroje pro srdeční resynchronizační terapii, obvykle ICD s možností biventrikulární stimulace, mechanická podpora). Využití těchto postupů umožnilo snížit úmrtnost pacientů na čekací listině TxS, která se nyní pohybuje kolem 10–15 % za rok. Základní diagnóza příjemce, která vedla k terminálnímu srdečnímu selhání, byla v našem souboru nejčastěji dilatační kardiomyopatie (49 %), na druhém místě je ischemická choroba srdeční (40 %), graf 3.
Graph 3. Základní příčiny srdečního selhání u pacientů, kterří podstoupili translantaci srdce v IKEM v letech 1984–2013 
Výběr pacientů
Většina pacientů, zvláště ve vyšších věkových skupinách, má řadu přidružených chorob nebo jsou jiné okolnosti, které je nutno považovat za relativní kontraindikace k TxS (tab. 1). Nemocné nad 65 let věku indikujeme výjimečně. Zvláště v případech, u nichž je příčinou srdečního selhání ischemická dysfunkce levé komory, jsou často přítomny projevy celkové aterosklerózy a další komponenty metabolického syndromu, které indikaci mohou komplikovat. Diabetes mellitus není v našem centru překážkou TxS pouze v případě, že není přítomno postižení ledvin nebo nejsou přítomny projevy makroangiopatie či mikroangiopatie. Častým přidruženým onemocněním je obstrukční bronchopulmonální choroba, v těchto případech je zvláště důležité posoudit, jakým podílem se porucha uplatňuje na obtížích pacienta. Problematická je též indikace u nemocných, kteří prodělali v posledních letech maligní onemocnění. U nich navrhujeme spíše zavedení mechanické podpory s vědomím, že nutná imunosuprese po TxS výrazně zvyšuje riziko relapsu onemocnění. Součástí vyšetření před TxS je detekce protilátek proti lymfocytům (PRA). Přítomnost PRA > 10 % je vždy indikací k provedení prospektivního cross-match testu při TxS, velmi vysoké titry se snažíme ovlivnit desentizací [11]. S touto metodou máme zatím omezené zkušenosti, využíváme imunoadsorpci a intravenózní imunoglobulin. Vyšetření PRA u pacientů na čekací listině provádíme v 1–12měsíčních intervalech.
Imunosuprese
Základní imunosupresivní schéma tvoří takrolimus nebo cyklosporin v kombinaci s mykofenolátem a kortikoidy (tab. 2). V průběhu posledních let došlo ke změně imunosupresivních schémat. Cyklosporin, který byl ještě v roce 2003 podáván všem de-novo pacientům po TxS, byl postupně nahrazen takrolimem [3]. Naši pacienti po TxS v současnosti užívají v 69 % takrolimus, v 25 % cyklosporin A, v 67 % mykofenolát, v 73 % prednison a v 6 % inhibitor proliferace signálu (mTOR).
Table 2. Přehled základní imunosupresivní terapie používané po transplantaci srdce 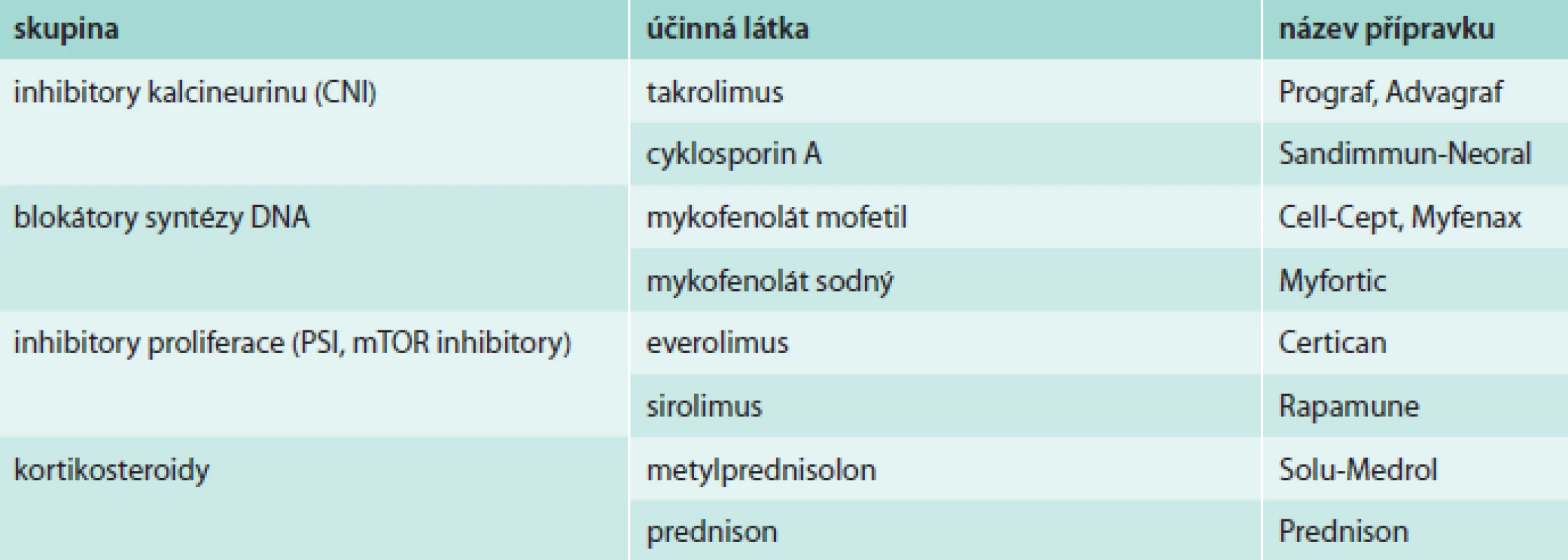
V 1. roce po TxS je nejčastější kombinací takrolimus s mykofenolátem a prednisonem. Volba imunosupresivní kombinace vychází z obvyklých doporučených schémat, ale vždy tak, aby byla pro daného pacienta optimálně „upravená na míru“. S postupujícím časem od TxS je možné imunosupresivní schéma upravit nebo snižovat dávky. U nerizikových nemocných (bez epizod akutní rejekce) lze později vysadit kortikoidy, zvláště při výrazné obezitě, obtížně korigovatelné cukrovce nebo těžké osteoporóze. Takrolimus má některé výhodnější vlastnosti než cyklosporin, účinnější antirejekční působení, výhodou při jeho podávání je dále menší výskyt hypertenze a poruch lipidového metabolizmu, méně častý rozvoj renální dysfunkce, hirsutizmu a gingivální hyperplazie. Mezi novější imunosupresiva patří skupina inhibitorů proliferace signálu (PSIs/mTOR inhibitorů), jako jsou sirolimus a everolimus. Nejčastější indikací konverze z kalcineurinových inhibitorů na sirolimus je rozvoj renální dysfunkce [12], rozvoj některých typů nádorů a ve zvláštních případech také nutnost posílení imunosuprese. Výsledky některých klinických studií ukazují na snížení progrese koronární nemoci po podávání PSIs/mTOR inhibitorů [13]. Není vhodné převádět pacienty již v pokročilém stupni renální dysfunkce a nemocné s proteinurií > 1,0 g/24 hod. Nejčastějšími nežádoucími účinky PSIs/mTOR inhibitorů jsou hyperlipidemie, komplikace hojení ran (dehiscence a infekce sterna), perikardiální nebo pleurální výpotek, otoky končetin, proteinurie, akné a pneumonitida.
Rejekce štěpu
Diagnóza a léčba rejekce
Základem diagnostiky rejekce štěpu v prvých 12 měsících po TxS je endomyokardiální biopsie [14]. Během 1. měsíce jsou provedeny 3 biopsie, během 1. roku celkem 8 protokolárních biopsií. Diagnózu a stupeň rejekce stanovujeme podle modifikované Banffské klasifikace, v posledních letech je nedílnou součástí imunohistologické vyšetření se stanovením fragmentů proteinů komplementu v cévách štěpu (C3,4d). Přítomnost těchto fragmentů je známkou humorální rejekce, která je zprostředkována protilátkami. V průběhu vývoje imunosupresivní léčby jsme v souladu s ostatními centry zaznamenali významný pokles výskytu buněčné rejekce. V léčbě buněčné rejekce je prvou volbou podání metylprednisolonu (3 g ve třech následujících dnech), který je účinný v naprosté většině případů. Humorální rejekce je vzácnější, ale klinicky závažnější forma, často provázená vznikem dysfunkce štěpu. Léčba humorální rejekce je komplexní, využíváme imunoadsorpci, intravenózní imunoglobuliny a monoklonální protilátky anti-CD20 (rituximab). Při závažném průběhu máme prvé zkušenosti s bortezomibem.
Infekce
Infekce jsou závažným problémem po TxS. Nejvyšší riziko infekcí je v prvních 6 měsících, v pozdějším období pak při intenzivnější imunosupresi. V 1. roce po operaci se infekce objeví u 40–70 % nemocných, infekce jsou příčinou až 1/3 úmrtí po TxS. Polovinu všech infekčních komplikací představují infekce bakteriální. Virové infekce tvoří 40 % všech infekčních komplikací, nejčastěji jsou způsobené herpetickými viry, mezi nimiž hlavní místo zaujímá Cytomegalovirus. Reaktivaci viru detekujeme sérologickým vyšetřením či molekulárně-genetickým vyšetřením (PCR), nejčastěji k ní dochází během 2. měsíce po transplantaci. Klinický průběh je rozmanitý, od zcela asymptomatické formy přes obraz běžné virózy až po výrazné orgánové postižení. Lékem volby je ganciklovir, respektive valganciklovir. V současné době profylakticky podáváme valganciklovir rizikovým pacientům během prvních 100 dnů po transplantaci a tato léčba vedla k významnému snížení výskytu cytomegalových infekcí. V období od 2. do 6. měsíce po TxS je nejvyšší riziko oportunních infekcí a dalších méně častých infekcí, jako je aspergilóza, toxoplasmóza, nokardióza či pneumocystóza. V případě toxoplazmózy a pneumocystózy je účinná chemoprevence podáváním Biseptolu, který pacienti užívají 3–6 měsíců po TxS v dávce 480 mg denně. Léčba infekce by měla být zahájena včas, spíše širokospektrými antibiotiky podávanými v dostatečných dávkách a dostatečně dlouho. V těžších případech je nutné redukovat po nezbytně dlouhou dobu dávky imunosupresiv.
Renální dysfunkce
Na renální dysfunkci se podílí toxicita kalcineurinových inhibitorů (takrolimu a cyklosporinu), která při dlouhodobé léčbě vede u řady nemocných k progresivní a ireverzibilní nefropatii. Příčina této komplikace je multifaktoriální, podílí se na ní hypertenze, porucha metabolizmu lipidů, diabetes mellitus, věk či obezita. Dalšími nepříznivými vlivy jsou nízký srdeční výdej před operací, dlouhodobé podávání vyšších dávek diuretik a vankomycinu, pooperační hypertenze a vyšší hodnoty sérového kreatininu před operací. Předchozí anamnéza ICHS také významně přispívá k rozvoji renální dysfunkce po TxS. Zjistili jsme, že nemocní, u nichž byl kreatinin ≥ 150 µmol/l na konci 5. roku, měli renální funkci signifikantně horší již v 1. měsíci (p < 0,01) a v 1. roce po TxS (p < 0,001) [15]. Více než 50 % pacientů léčených kalcineurinovými inhibitory má již 2 roky po TxS renální dysfunkci a 5–10 % nemocných dospěje do stadia nezvratného selhání ledvin. Výsledky některých klinických studií ukazují na zlepšení renálních funkcí po konverzi z kalcineurinového inhibitoru na PSIs/mTOR inhibitory [16]. Při pokročilém selhání ledvin indikujeme transplantaci ledviny. V našem souboru byla oddálená transplantace ledviny provedena u 25 nemocných s dobrým klinickým efektem.
Hypertenze
Hypertenze se po TxS vyskytuje u 80–90 % nemocných, významný vliv má především podávání cyklosporinu A (CsA) a kortikoidů. Krevní tlak u nemocných po TxS má odlišný průběh, nedochází k obvyklému poklesu tlaku v nočních hodinách, ale naopak k jeho vzestupu. Hlavní příčinou je porucha regulace oběhu v důsledku autonomní denervace srdce. Dostatečné kontroly hypertenze u většiny nemocných dosáhneme až kombinovanou léčbou. Za 6 měsíců po TxS je u 2/3 nemocných k léčbě hypertenze podávána alespoň dvojkombinace léků. Lékem volby jsou ACE inhibitory, případně blokátory receptorů AT1 a blokátory vápníkového kanálu. Kličková diuretika jsou užívána zvláště v časném období po Tx při objemovém přetížení. Snažíme se vyhnout kalium šetřícím diuretikům, především amiloridu a spironolaktonu, která v kombinaci s takrolimem mohou způsobit hyperkalemii. Alespoň jeden z antihypertenzních léků by měl být podáván ve večerních hodinách.
Hyperlipidemie
Porucha lipidového metabolizmu je častým problémem po TxS a patří mezi rizikové faktory rozvoje koronární nemoci štěpu. Příčina je multifaktoriální, kromě věku, obezity, diabetu a renální dysfunkce přispívá k jejímu rozvoji podávání imunosupresiv, především CsA a kortikosteroidů. CsA snižuje syntézu žlučových kyselin z cholesterolu, zvyšuje produkci lipoproteinů LDL a potencuje oxidaci LDL částic. Tím dochází k vzestupu celkového a LDL-cholesterolu v séru asi o 20–30 %. Kortikosteroidy zvyšují syntézu volných mastných kyselin, podporují vznik inzulinové rezistence a rozvoj hypertriglyceridemie, podporují syntézu VLDL a snížení hladiny HDL-cholesterolu. Studie Kobashigawy et al s pravastatinem jako první prokázala snížený výskyt hemodynamicky významných akutních rejekcí (3 % vs 14 %) a zlepšení jednoročního přežívání (94 % vs 78 %) [17]. Léčbu statiny zahajujeme již v časném pooperačním období. Při výběru vhodného statinu sledujeme kromě účinnosti na lipidové spektrum i možné lékové interakce se zavedenou imunosupresivní léčbou (nejčastěji riziko myopatie). Nejbezpečnějším statinem kromě pravastatinu je hydrofilní fluvastatin. Prokázali jsme, že kombinace atorvastatinu a takrolimu je účinná a bezpečná z hlediska rabdomyolýzy [18]. Cílových hodnot celkového cholesterolu a triglyceridů však dosáhneme jen u 60–70 % nemocných, proto v určitých případech využíváme kombinační léčbu fluvastatinem nebo atorvastatinem s ezetimibem.
Koronární nemoc štěpu
Kombinace akcelerované aterosklerózy a chronické vaskulární rejekce (koronární nemoc štěpu) představuje častou komplikaci dlouhodobého průběhu po TxS s výskytem u více než 1/2 nemocných po 10 letech. Po 3. roce představuje spolu s malignitami nejčastější příčinu úmrtí pacientů. Jedním z rizikových faktorů rozvoje koronární nemoci štěpu je z dárce přenesená ateroskleróza věnčitých tepen. Výskyt a klinický význam této časně diagnostikované (tedy z dárce přenesené) aterosklerózy jsme studovali v souboru 162 konsekutivních pacientů. Věnčité tepny byly vyšetřeny metodou intrakoronárního ultrazvuku ve 4. týdnu po TxS. Patologické změny byly přítomny téměř u poloviny (45 %) nemocných v úzké korelaci s věkem dárce [19]. Následné 7leté sledování ukázalo vysoký výskyt závažné kardiální události (50 % oproti 10 % s normálním časným nálezem). V současné době intrakoronární ultrazvuk nevyužíváme, standardně provádíme selektivní koronarografii ve 4. týdnu a následně v ročních intervalech. Vývoj onemocnění se snažíme ovlivnit podáváním statinů, součástí pravidelné medikace u nás je atorvastatin, který lze podávat s takrolimem bez většího rizika rabdomyolýzy. Proliferativní složku ovlivňujeme mTOR inhibitorem (everolimus), v těchto případech však musíme počítat s vyšším rizikem nežádoucích účinků.
Malignity
Nádorová onemocnění se u pacientů po TxS vyskytují mnohem častěji než v běžné populaci a rychleji progredují. U pacientů přežívajících více než 5 let jsou nádory (solidních orgánů i hematologické) příčinou úmrtí ve 23 % případů a jejich výskyt kolísá mezi 3,5 a 16 %. Dlouhodobá imunosupresivní léčba a opakované infekce oslabují schopnost imunitního systému ničit potencionální nádorové buňky. Také genetické faktory hrají důležitou úlohu. Nutnost podávání vyšších dávek imunosupresiv po TxS ve srovnání s pacienty po transplantaci ledviny vysvětluje častější výskyt tumorů po TxS, především non-Hodgkinova lymfomu. Významný rizikový faktor představuje kouření, zvláště u nádorů plic a zažívacího traktu. Kožní tumory úzce souvisejí s expozicí slunečnímu záření. Ze souboru 886 nemocných sledovaných na našem pracovišti jsme zjistili nádor u 170 pacientů, tj. u 19,2 %.
Nejčastěji se vyskytují kožní nádory (44 %), přičemž převažují nemelanomové nádory kůže. Nejpočetněji je zastoupen spinocelulární karcinom, následovaný bazocelulárním karcinomem. Antiproliferační efekt PSI/mTOR inhibitorů (sirolimus, everolimus) přináší novou možnost, jak snížit výskyt malignit po transplantaci solidních orgánů [20]. Z výsledku několika multicentrických studií vyplývá signifikantně nižší výskyt tumorů u pacientů po transplantaci ledviny, kterým byl podáván sirolimus místo kalcineurinových inhibitorů [21]. Odpověď, zda jsou mTOR inhibitory stejně účinné také v prevenci a léčbě nádorů po TxS, přinesou výsledky dalších studií. Časná diagnóza a vhodná léčba nádoru je jediným předpokladem další relativně příznivé prognózy. Pravidelné kontroly a spolupráce se spádovými lékaři mají zásadní význam pro prevenci a časný záchyt nádorového onemocnění (tab. 3)
Table 3. Opatření k primární prevenci malignity u pacientů po transplantaci srdce 
Závěr
TxS přináší zlepšení kvality života nemocných. Rozvoj nových imunosupresiv umožnil delší přežívání pacientů po TxS, přesto dlouhodobá péče o tyto nemocné přináší určité specifické problémy. Nejčastějšími komplikacemi po TxS jsou arteriální hypertenze, porucha funkce ledvin a porucha metabolizmu lipidů. Standardní součástí medikace jsou antihypertenziva (preferenčně inhibitory ACE) a statiny. Péče o pacienty po TxS vyžaduje komplexní přístup, který spočívá v těsné spolupráci kardiocentra se spádovými kardiology a internisty, ale i s dalšími odborníky.
MUDr. Lenka Hošková
leho@medicon.cz
Klinika kardiologie IKEM, Praha
www.ikem.cz
Doručeno do redakce: 10. 2. 2014
Sources
1. Kočandrle V, Fabián J, Firt P. Transplantace srdce. Čas Lék Čes 1984; 123(43): 1297–1302.
2. Pirk J, Málek I et al. Transplantace srdce. Karolinum: Praha 2008. ISBN-13 : 978–80–246–1606–3.
3. Lund LH, Edwards LB, Kucheryavaya AY et al. The Registry of International Society for Heart and Lung Transplantation: thirtieth official adult heart transplant report - 2013; focus theme: age. J Heart Lung Transplant 2013; 32(10): 951–964.
4. Pokorná E. Zemřelí dárci orgánů, právní normy diagnostiky smrti mozku. Přehled dárců a transplantací jater v České republice. Vnitř Lék 2013; 59(8): 678–681.
5. Málek I. Indikace k transplantaci srdce. Cor Vasa 2008; 50(3): 129–132.
6. Špinar J, Vítovec J, Hradec J et al. Doporučený postup České kardiologické společnosti pro diagnostiku a léčbu chronického srdečního selhání, 2011. Cor Vasa 2012; 54(3–4): 161–182.
7. Špinarová L. Transplantace srdce – minulost, současnost a výhled do budoucna. Vnitř Lék 2010; 56(8): 884–888.
8. Reichenbach A, Al-Hiti H, Malek I et al. The effects of phosphodiesterase 5 inhibition on hemodynamics, functional status and survival in advanced heart failure and pulmonary hypertension: a case-control study. Int J Cardiol 2013; 168(1): 60–65.
9. Melenovsky V, Al-Hiti H, Kazdova L et al. Transpulmonary B-type natriuretic peptide uptake and cyclic guanosine monophosphate release in heart failure and pulmonary hypertension: the effects of sildenafil. J Am Coll Cardiol 2009; 54(7): 595–600.
10. Kettner J, Dorazilová Z, Netuka I et al. Is severe pulmonary hypertension a contraindication for orthotopic heart transplantation? Not any more. Physiol Res 2011; 60(5): 769–775.
11. Hošková L, Pagáčová L, Slavčev A et al. Heart transplantation in a highly sensitised patient. Kardiol Pol 2011; 69(1): 51–53.
12. Hunt J, Lerman M, Magee MJ et al. Improvement of renal dysfunction by conversion from calcineurin inhibitors to sirolimus after heart transplantation. J Heart Lung Transplant 2005; 24(11): 1863–1867.
13. Raichlin E, Bae JH, Khalpey Z et al. Conversion to sirolimus as primary immunosuppression attenuates the progression of allograft vasculopathy after cardiac transplantation. Circulation 2007; 116(23): 2726–2733.
14. Janek B. Role endomyokardiální biopsie v současnosti – editorial. Interv Akut Kardiol 2013; 12(3): 112–114.
15. Hošková L, Viklický O, Málek I et al. Ischaemic heart disease is a risk factor for renal failure after heart transplantation. Int J Cardiol 2008; 123(3): 358–360.
16. Hunt J, Lerman M, Magee MJ et al. Improvement of renal dysfunction by conversion from calcineurin inhibitors to sirolimus after heart transplantation. J Heart Lung Transplant 2005; 24(11): 1863–1867.
17. Kobashigawa JA, Katznelson S, Laks H et al. Effect of pravastatin on outcomes after cardiac transplantation. N Engl J Med 1995; 333(10): 621–627.
18. Skalická B, Kubánek M, Málek I et al. Conversion to tacrolimus and atorvastatin in cyclosporine-treated heart transplant recipients with dyslipidemia refractory to fluvastatin. J Heart Lung Transplant 2009; 28(6): 598–604.
19. Kocík M, Málek I, Janek B. Risk factors for the development of coronary artery disease of a grafted heart as detected very early after orthotopic heart transplantation. Transpl Int 2007; 20(8): 666–674.
20. Kauffman HM, Cherikh WS et al. Maitenance immunosuppression with target of target-of-rapamycin inhibitors is associated with reduced incidence of de-novo malignancies. Transplantation 2005; 80(7): 883–889.
21. Alberú J, Pascoe MD, Campistol JM et al. Lower malignancy rates in renal allograft recipients converted to sirolimus-based, calcineurin inhibitor-free immunotherapy: 24-month results from the CONVERT trial. Transplantation 2011; 92(3): 303–310.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2014 Issue 4-
All articles in this issue
- Prof. MUDr. Petr Widimský, DrSc., FESC, FACC šedesátiletý
- Vývoj klinického zájmu o plicní hypertenzi v České republice
- 30 let programu transplantace srdce v Institutu klinické a experimentální medicíny v Praze
- Medikamentózní léčba plicní arteriální hypertenze v roce 2014
- Neobvyklá intervence na nativní tepně u pacienta po aortokoronárním bypassu
- Optická koherentní tomografie, oddálená implantace stentu a přímá perkutánní koronární intervence u nemocných s infarktem myokardu a elevací ST segmentu
- Pečeň pri srdcovom zlyhávaní
- Mitrální stenóza
- Léčba srdečního selhání u diabetiků
- Vliv zkušenosti na výsledky katetrové implantace aortální chlopně v léčbě významné aortální stenózy
- Plně vstřebatelný lékový koronární stent: kde jsme v roce 2014?
- Význam stanovení galektinu 3 jako ukazatele myokardiální fibrózy v klinické kardiologii
- Místo chirurgické revaskularizace v léčbě akutního infarktu myokardu
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Predklinické kardiovaskulárne ochorenia a tuhosť aorty
- Acute heart failure and cardiogenic shock – trends at the beginning of 21st century
- Může léčba hypertenze ovlivnit výskyt demence?
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Srovnání amerických a evropských (českých) doporučení pro diagnostiku a léčbu chronického srdečního selhání
- Význam vulnerabilních aterosklerotických plátů a možnosti jejich detekce pomocí intravaskulární spektroskopie
- Katetrizační renální denervace v léčbě rezistentní hypertenze: realita nebo fikce?
- Praktické otázky léčby novými antitrombotiky
- Kombinační léčba hypertenze
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pečeň pri srdcovom zlyhávaní
- Pravá komora pri ťažkej pľúcnej hypertenzii pri vrodených chybách srdca – odlišná a špecifická
- Operace Ebsteinovy anomálie v dospělém věku – naše zkušenosti
- Mitrální stenóza
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

