-
Medical journals
- Career
Transplantace krvetvorných buněk a její role v léčbě chorob krvetvorby během posledních 25 let
Authors: A. Vítek; M. Lukášová; V. Chudomel†; A. Májský†; J. Souček; P. Kobylka; P. Kořínková; M. Loudová; M. Dobrovolná; E. Matějková; M. Písačka; Z. Sieglová; M. Vraná; J. Hrabánek; J. Sajdová; D. Šponerová; M. Marková; V. Válková; Z. Gašová; P. Cetkovský
Authors‘ workplace: Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Marek Trněný, CSc.
Published in: Vnitř Lék 2012; 58(Suppl 2): 46-55
Category:
Overview
Transplantace krvetvorných buněk je život zachraňující výkon u celé řady hematologických nemocí. Rozvoj transplantací se datuje od začátku 70. let minulého století, po objevení HLA systému. V ÚHKT byl transplantační program zahájen v roce 1986 a do konce roku 2011 zde bylo provedeno 918 transplantací krvetvorných buněk pro různá hematologická onemocnění. Dlouhodobé přežití všech pacientů po transplantaci se pohybuje kolem 50 %, a to v rozmezí 20–90 % v závislosti na typu a pokročilosti onemocnění, na typu dárce a na věku pacienta.
Klíčová slova:
transplantace krvetvorných buněk – historie transplantace – transplantace u akutní myeloidní leukemie – transplantace u chronické myeloidní leukemie – transplantace pro myelodysplastický syndrom – transplantace u akutní lymfatické leukemie – transplantace u non-Hodgkinských lymfomů – transplantace pro myelofibrózu s myeloidní metaplazií – transplantace pro chronickou lymfatickou leukemii – transplantace pro těžkou aplastickou anémiiTransplantací kostní dřeně rozumíme výkon spočívající v infuzi koncentrátu progenitorových buněk krvetvorby (krvetvorných buněk), tzv. štěpu, příjemci (pacientovi), podstoupivšímu před převodem předtransplantační přípravný režim, tzv. conditioning. Původním a po dlouhou dobu jediným zdrojem progenitorových buněk pro transplantaci byla kostní dřeň, a proto se výkon nazývá transplantace kostní dřeně (BMT). V současné době se dává přednost názvu transplantace krvetvorných buněk (HCT), neboť jako zdroj těchto buněk se kromě kostní dřeně využívá i periferní krev (PBPC) nebo krev pupečníková. Podle původu progenitorových buněk krvetvorby rozeznáváme transplantace autologní (autoHCT), kdy dárcem buněk je pacient sám sobě, a transplantace alogenní (alloHCT), kdy dárcem je nějaká osoba akceptovatelně shodná s příjemcem v HLA systému. Krvetvorné buňky po přihojení kompletně obnoví krvetvorbu a imunitní systém, a to dárcovského typu.
Transplantací krvetvorných buněk je možné docílit několika efektů:
- Obnovit krvetvorbu poškozenou po vysokodávkovaných (myeloablativních) režimech. Toho se využívá v léčbě nádorů rezistentních na standardní léčbu, ale citlivých na vysokodávkovanou léčbu.
- Dodat chybějící nebo nahradit defektní krvetvorné progenitorové buňky či buňky z nich vznikající, jak tomu je u těžké aplastické anémie, Fanconiho anémie, srpkovité anémie, talasemie, PNH, osteopetrózy aj.
- Zlepšit či alespoň stabilizovat některé vrozené poruchy metabolizmu transcelulárním přenosem enzymů z transplantovaných do postižených buněk (některé mukopolysacharidózy či sfingolipidózy).
- Nahradit nemocný imunitní systém zdravým u některých vrozených poruch imunity (SCID, WAS a další) a u některých těžce probíhajících autoimunitních nemocí (roztroušená skleróza, sklerodermie, progresivní polyartritida a další).
- Navodit tzv. GVL efekt (graft versus leukemia – reakce štěpu proti leukemii/nádoru), a tím vyléčit nádory na GVL citlivé. Je vyvoláván alogenními T-lymfocyty, které jsou schopny rozpoznat některé druhy nádorů a eliminovat je svými imunologickými mechanizmy.
V současné době se standardně indikují k transplantaci pacienti s následujícími chorobami: akutní myeloidní leukemie, akutní lymfatická leukemie, non-Hodgkinské lymfomy, maligní lymfogranulom, myelodysplastický syndrom, myelofibróza, chronická lymfatická leukemie, chronická myeloidní leukemie, těžká aplastická anémie, myelom, vrozené poruchy krvetvorby, metabolizmu a imunity. Pro některé pacienty s těmito diagnózami je provedení transplantace jedinou šancí na vyléčení. Vzhledem k rizikům spojeným s transplantacemi se k nim však indikují pouze ti nemocní, kteří nemají šanci na vyléčení či na významné prodloužení života jiným, méně rizikovým léčebným postupem.
Historie transplantace kostní dřeně
Použití jaderných zbraní v roce 1945 a setkání se s nemocí z ozáření vyvolaly zájem o vliv radioaktivního záření na živé organizmy a hledání způsobů léčení nemoci z ozáření.
Při experimentech na zvířecím modelu bylo již v roce 1956 zjištěno Barnesem a Loutitem [1], že transplantace krvetvorných buněk má antileukemický efekt. Současně byl pozorován a popsán potransplantační syndrom, který je nyní znám pod pojmem reakce štěpu proti hostiteli (graft versus host disease – GVHD). V roce 1957 (E. D. Thomas) [2] byly publikovány výsledky syngenních transplantací u 2 pacientů s ALL prokazující, že infuze kostní dřeně vede k obnově krvetvorby u pacientů léčených vysokou dávkou ozáření a cytostatik. V roce 1958 Mathe použil u 5 ozářených jaderných fyziků při havárii reaktoru v Jugoslávii alogenní kostní dřeň a pozoroval a popsal u nich přechodné přihojení štěpu. Stejný autor popsal v roce 1965 dlouhodobé přihojení, chimerizmus, toleranci a antileukemický efekt alogenní transplantace u jednoho transplantovaného pacienta, který posléze zemřel na infekční komplikace při chronické GVHD.
V roce 1970 M. Bortin sumarizoval výsledky 203 alogenních transplantací provedených v letech 1958–1968. Z nich dlouhodobě přežívali pouze 3 pacienti, ostatní zemřeli v důsledku nepřihojení štěpu, reakce štěpu proti hostiteli a relapsu. Ke zlepšení výsledků transplantací došlo až po objevení HLA systému začátkem 60. let 20. století a po zjištění jeho role v transplantační imunologii (J. Dausset, J. J. van Rood) [4]. To umožnilo začít vyhledávat HLA shodné dárce mezi sourozenci, což vedlo ke snížení počtu rejekcí i GVHD. Zavedení metotrexatu (MTX) [3] do prevence GVHD vedlo ke snížení rizika vzniku GVHD a ke zlepšení výsledků transplantací. V roce 1968 (E. D. Thomas) popsal první transplantaci od HLA shodného sourozence jiného než jednovaječné dvojče. Další pokrok byl umožněn objevením cyklosporinu (CSA) na začátku 70. let minulého století a jeho zavedením do profylaxe GVHD. Kombinace CSA a MTX je dodnes nejčastěji používaným režimem pro prevenci GVHD. Založení prvního registru nepříbuzných dárců v roce 1973 ve Velké Británii umožnilo získávat dárce pro pacienty bez HLA shodných pokrevních dárců. Byl následován vznikem dalších registrů v ostatních zemích, takže v současné době je na celém světě registrováno asi 18 milionů nepříbuzných dárců spolu s 500 000 štěpů pupečníkové krve. To umožňuje vyhledat HLA plně shodného dárce pro asi 70 % pacientů a až pro 90 % pacientů při akceptování dárce s jednou neshodou.
V České republice bylo již v roce 1959 popsáno použití autologní dřeně k zajištění chemoterapie (Kašpar – TRN Jičín) [5]. V roce 1960 byl proveden převod alogenní dřeně u pacienta s AL (Arient – ÚVN Praha) [5]. V roce 1963 Wiedermann et al uskutečnili převod alogenní kostní dřeně u pacienta s aplastickou anémií. V roce 1963 Nouza et al převedli alogenní kostní dřeně u 3 pacientů (ÚHKT Praha) [5]. V roce 1976 Bláha a Chudomel uskutečnili převod štěpu od HLA ne plně shodného sourozence (HK, ÚHKT). V roce 1983 Chudomel a Hrodek popsali výsledky převodů fetálních jater (ÚHKT, II. dětská klinika FN Motol Praha) [5].
V roce 1986 byla v pražském Ústavu hematologie a krevní transfuze (ÚHKT) provedena první transplantace kostní dřeně (Chudomel, Lukášová) od HLA shodného sourozence, kterou byl zahájen program transplantací kostní dřeně, či lépe řečeno krvetvorných buněk, na území naší republiky. Další rok byly v ÚHKT uskutečněny 2 transplantace a mladá žena, která byla v tomto roce transplantována pro diagnózu akutní myeloidní leukemie, žije dodnes, a je tak nejdéle žijící pacientkou transplantovanou v tehdejší ČSSR.
Zasloužil se o to zejména prim. MUDr. V. Chudomel, CSc., který ve spolupráci s MUDr. M. Lukášovou tento program s velkým osobním nasazením postupně uvedl v život. Tím otevřel cestu i ostatním centrům v České republice, takže se alogenní transplantační programy postupně rozvinuly ve FN Motol Praha, FN v Plzni, FN v Brně, FN v Olomouci a ve FN v Hradci Králové. Kromě toho vzniklo několik center zaměřených pouze na transplantace autologní, a to zejména v Praze (VFN Praha, FN Královské Vinohrady Praha, FN Krč Praha).
Prvních několik let bylo v ÚHKT děláno méně než 10 transplantací za rok, takže během prvních 8 let bylo realizováno celkem asi 60 transplantací, což je přibližně počet, který je v současné době dělán za 1 rok.
Zatímco v počátku byly transplantace rezervovány pro mladé pacienty a věkový průměr pacientů transplantovaných během prvních 8 let byl 29 let s rozptylem 16–45 let, pohyboval se střední věk pacientů transplantovaných v posledních 2 letech kolem 49 let s rozptylem 19–66 let. 50 % z nich bylo starších 50 let a 15 % bylo ve věku nad 60 let. To bylo umožněno zejména zavedením nemyeloablativních přípravných režimů v roce 1999 do naší klinické praxe. Během let se měnily transplantační postupy v souladu se světovými trendy. V roce 1990 byla v ÚHKT udělána 1. autologní transplantace, což bylo umožněno zavedením kryokonzervačních technik s možností uchovávat dlouhodobě kostní dřeň v tekutém dusíku. V roce 1993 zde byly pro transplantaci poprvé použity krvetvorné buňky získané z periferní krve namísto z kostní dřeně. Tato technika postupně převládla nad transplantacemi kostní dřeně, takže v současnosti prakticky všechny autologní a větší část alogenních transplantací jsou dělány tímto způsobem. V roce 1991 byla v ÚHKT udělána první transplantace od nepříbuzného dárce a tyto transplantace postupně převýšily transplantace od pokrevně příbuzných dárců, takže v současnosti tvoří nadpoloviční většinu alogenních transplantací na našem pracovišti. To bylo umožněno mimo jiné i tím, že zdravotní pojišťovny začaly hradit náklady spojené s vyhledáním a s odběrem štěpů od nepříbuzných dárců v zahraničí. Rovněž vznik českých registrů dárců kostní dřeně přispěl k rozvoji těchto transplantací, díky čemuž v posledních letech asi 25 % štěpů pro nepříbuzné transplantace získáváme od dárců českých.
Celkem bylo v ÚHKT do konce roku 2011 uděláno 918 transplantací. Z toho 818 alogenních (473 od nepříbuzných dárců, 345 od pokrevních příbuzných) a 100 autologních pro následující diagnózy: akutní myeloidní leukemie (AML) 266, chronická myeloidní leukemie (CML) 159, myelodysplastický syndrom (MDS) 151, akutní lymfatická leukemie (ALL) 100, non-Hodgkinský lymfom (NHL) 71, chronická lymfatická leukemie (CLL) 46, myelofibróza s myeloidní metaplazií (MMM) 58, mnohočetný myelom (MM) 34, maligní lymfogranulom (HD) 16, těžká aplastická anémie (SAA) 12. Koncem roku 2011 byla provedena analýza výsledků transplantací provedených v letech 1986–2010. V tomto období bylo uděláno 851 transplantací. Z toho 751 alogenních (421 od nepříbuzných dárců, 330 od pokrevních příbuzných) a 100 autologních pro následující diagnózy: akutní myeloidní leukemie (AML) 243, chronická myeloidní leukemie (CML) 158, myelodysplastický syndrom (MDS) 143, akutní lymfatická leukemie (ALL) 95, non-Hodgkinský lymfom (NHL) 63, chronická lymfatická leukemie (CLL) 39, myelofibróza s myeloidní metaplazií (MMM) 50, myelom (MM) 32, maligní lymfogranulom (HD) 15, těžká aplastická anémie (SAA) 11 a některé další diagnózy (obr. 1–3).
Image 1. Počty transplantací v jednotlivých letech (1986–2010). Celkem 851 transplantací (sourozenecké 330, nepříbuzné 421, autologní 100). 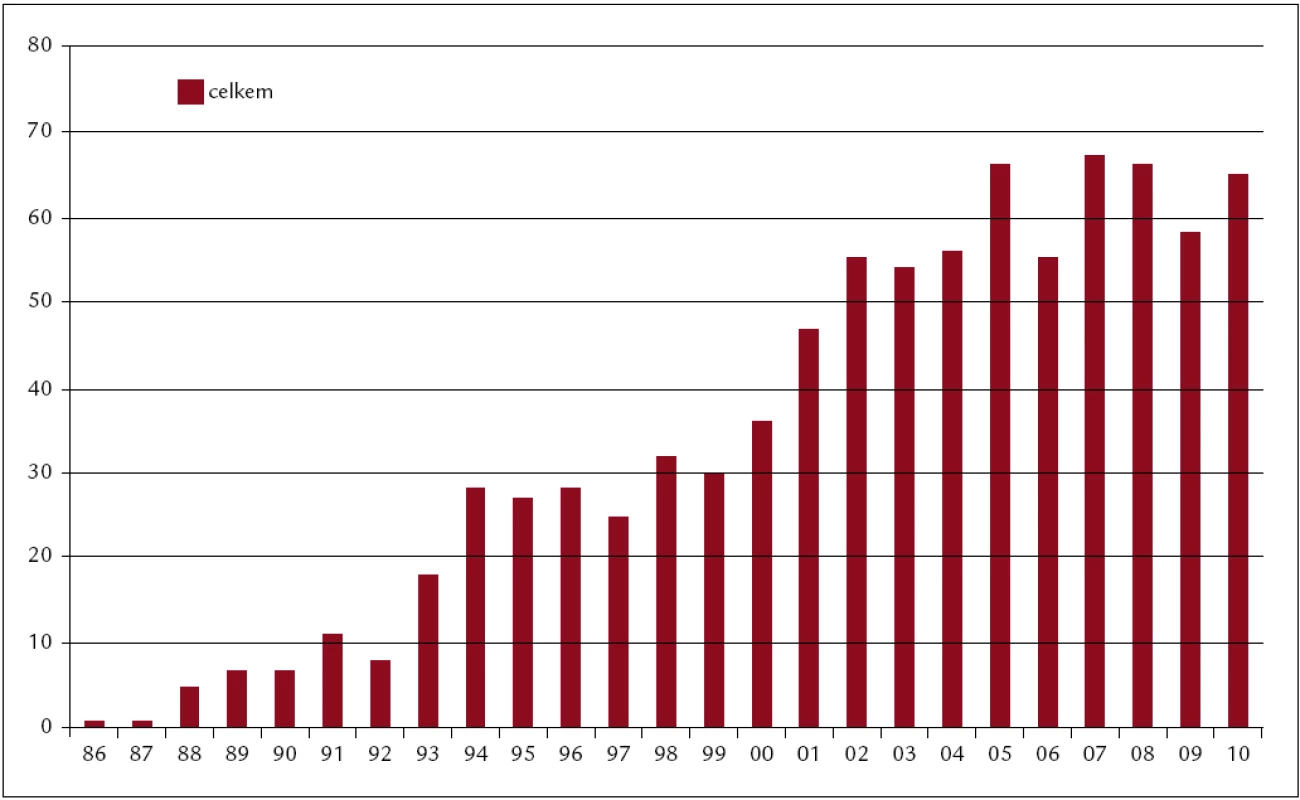
Image 2. Celkové počty transplantací pro jednotlivé diagnózy (1986–2010). 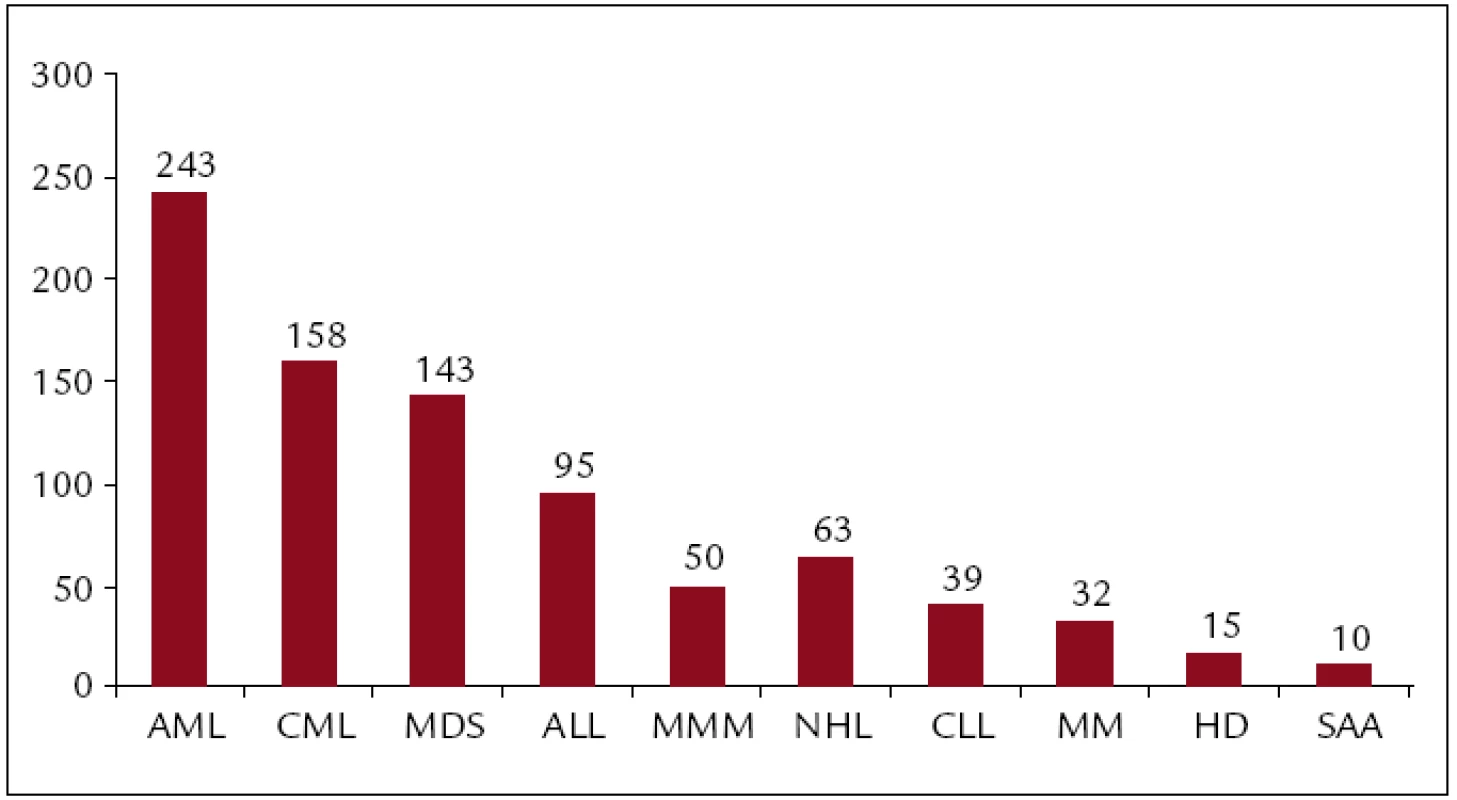
Image 3. Počty transplantací v jednotlivých letech (1986–2010) dle typu dárce (sib – sourozenec, UD – nepříbuzný, auto – autologní). 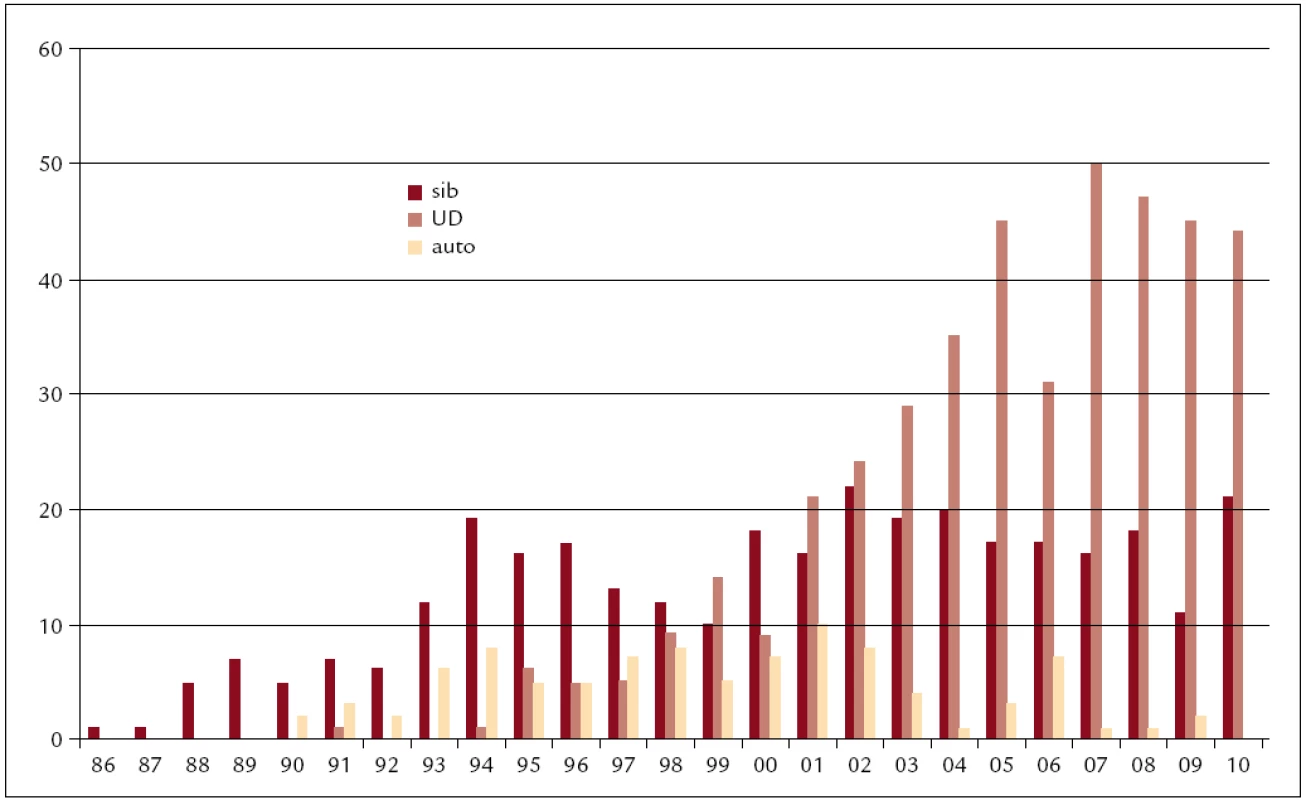
Charakteristika pacientů a výsledky transplantací u jednotlivých diagnóz jsou uvedeny v následujícím přehledu. Data od všech alogenně transplantovaných pacientů byla zahrnuta do statistické analýzy pravděpodobnosti přežití. Pro jednotlivé podskupiny diagnóz byla vytvořena křivka pravděpodobnosti přežití (Kaplan-Meier). Pacienti byli kromě diagnózy rozděleni do podskupin podle typu dárce a podle stupně HLA shody. Charakteristika jednotlivých skupin a jejich křivky přežití jsou následující:
Alogenní transplantace u akutní myeloidní leukemie
Akutní myeloidní leukemie je onemocnění vyléčitelné u asi 30–50 % pacientů samotnou chemoterapií. Vyléčitelnost je dána podtypem AML, když rozeznáváme podtypy s nízkým, středním a vysokým rizikem relapsu [6].
Mezi AML s nízkým rizikem relapsu řadíme AML s přítomností některých prognosticky dobrých cytogenetických nálezů. Tyto podtypy AML jsou poměrně dobře vyléčitelné chemoterapií, šance na navození kompletní remise (CR) je 84 % a riziko relapsu po navození 1. CR se pohybuje kolem 35 %. Nemocní s AML s dobrou prognózou neprofitují z alloHCT v 1. kompletní remisi. Indikace se objevuje až po relapsu, nejlépe po navození 2. CR, kdy lze indikovat i autologní transplantaci štěpem bez přítomnosti reziduální nemoci.
Do středněrizikového podtypu řadíme AML s těmito cytogenetickými změnami: přídatný chromozom 8 (+8), ztráta chromozomu Y (–Y), přídatný chromozom 6 (+6), ztráta krátkých ramen chromozomu 12 (del.12p) či AML s normálním karyotypem. Pacienti z této skupiny mají šanci na docílení CR 76 % s asi 50% rizikem relapsu. Má-li pacient se středněrizikovou AML sourozence shodného v HLA systému, doporučuje se provedení transplantace v 1. CR (s výjimkou pacientů s normální cytogenetikou a kombinací mutací NPM1+/FLT3-ITD - či CEBPA+, kteří se řadí do skupiny nízkorizikové). Z výsledků transplantací vyplývá, že u nemocných se středněrizikovou AML je možné též indikovat transplantaci od plně shodného nepříbuzného dárce v 1. CR, chybou však není ani oddálení takové transplantace do doby po relapsu.
Mezi vysocerizikové řadíme AML s některými prognosticky špatnými cytogenetickými změnami. Chemoterapií lze u těchto AML navodit remisi u asi 55 % pacientů. Riziko relapsu je kolem 80 % a šance na navození 2. remise je nízká. Pro tyto pacienty znamená transplantace od příbuzného i nepříbuzného dárce v 1. CR šanci na snížení rizika relapsu s podobným přežitím po obou typech HCT.
Další velmi rizikovou podskupinou pacientů z hlediska relapsu jsou nemocní, kteří neodpoví remisí na 1. indukční léčbu. Specifickou indikací jsou transplantace u pacientů s AML rezistentními na indukci a u chemorezistentního relapsu onemocnění, u nichž je popisováno vyléčení po transplantaci u 7–20 % pa-cientů.
V ÚHKT bylo v období let 1986–2010 transplantováno 192 pacientů s AML, 115 žen a 77 mužů. U 70 pacientů byl použit štěp od HLA shodného sourozence, u 8 od jiného pokrevního příbuzného a 114 jich bylo transplantováno štěpem od dárce nepříbuzného. Kostní dřeň byla transplantována u 60 a PBPC u 132 pacientů. Myeloablativní přípravný režim byl použit u 158 pacientů, 34 pacientů podstoupilo nemyeloablativní výkon. Pro 127 pacientů se podařilo vyhledat dárce se shodou 8/8 HR, pro 42 se shodou 7/8, pro 19 se shodou 6/8, pro 3 se shodou 5/8 a jeden byl transplantován od dárce se shodou 4/8. U všech pacientů transplantovaných od nepříbuzných dárců či od příbuzných HLA neshodných dárců byl v přípravném režimu použit antitymocytární globulin ke snížení rizika nepřihojení štěpu a ke snížení rizika vzniku akutní a chronické GVHD.
Transplantace od HLA shodných sourozenců (sibling HCT)
Celkem 70 pacientů (41 žen a 29 mužů). Medián věku 44 let (17–64). Kostní dřeň u 20 pacientů, PBPC u 50 pacientů. Myeloablativní conditioning u 57 pacientů a nemyeloablativní u 13 pacientů.
Transplantace od HLA shodných nepříbuzných dárců (MUD)
Celkem 50 pacientů (23 žen a 27 mužů). Medián věku 50 let (22–63). Kostní dřeň u 21 pacientů, PBPC u 29 pacientů. Myeloablativní conditioning u 38 pacientů a nemyeloablativní u 12 pacientů (obr. 4).
Image 4. Pravděpodobnost přežití u pacientů s AML po transplantaci od HLA plně shodného dárce. 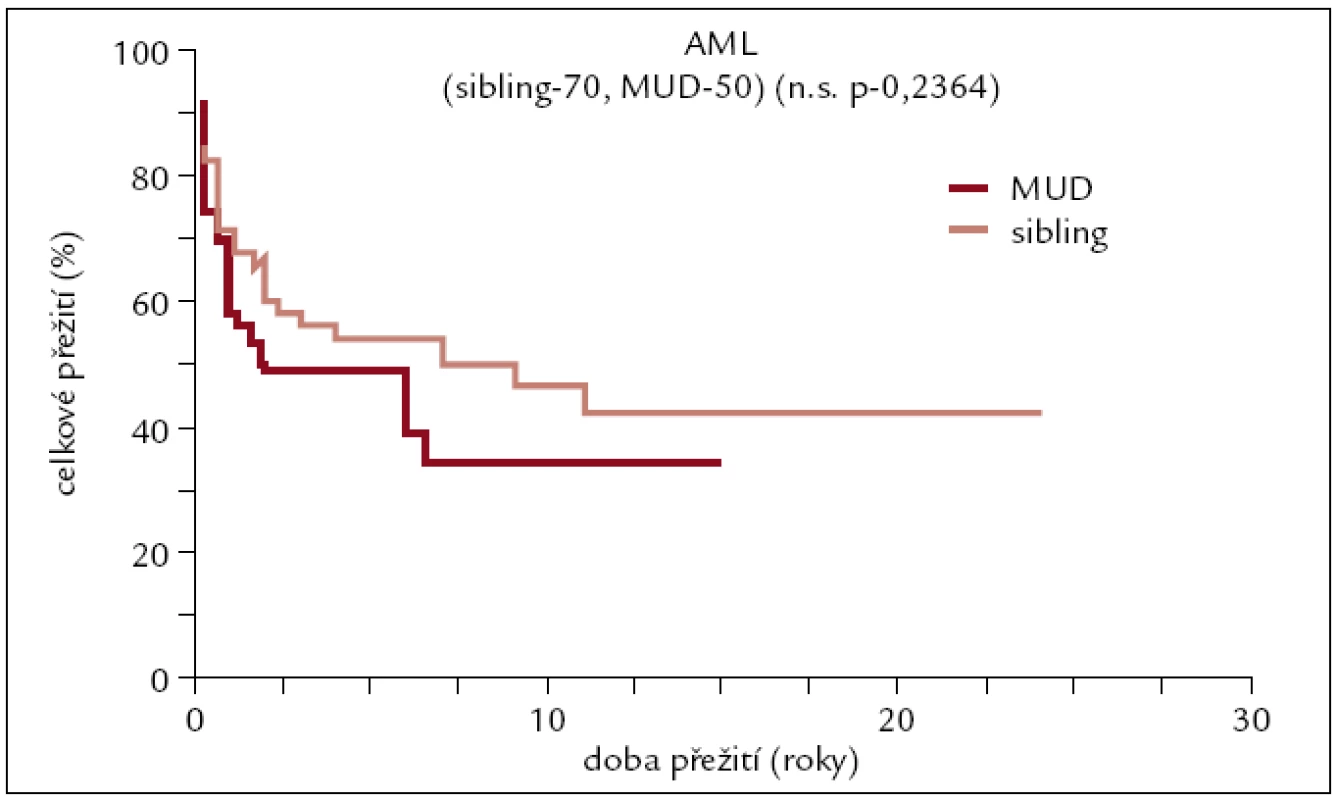
Transplantace od HLA neshodných nepříbuzných dárců (MMUD)
Celkem 64 pacientů (38 žen a 26 mužů). Medián věku 46 let (21–63). Kostní dřeň u 16 pacientů, PBPC u 48 pacientů. 37 pacientů – štěp se shodou 7/8, 18 pacientů se shodou 6/8, 3 pacienti se shodou 5/8. 6 pacientů dárce se shodou 9/10. Myeloablativní conditioning použit u 56 pacientů a nemyeloablativní u 8 pacientů (obr. 5).
Image 5. Pravděpodobnost přežití pacientů s AML po alogenní transplantaci od nepříbuzného dárce v závislosti na HLA shodě. 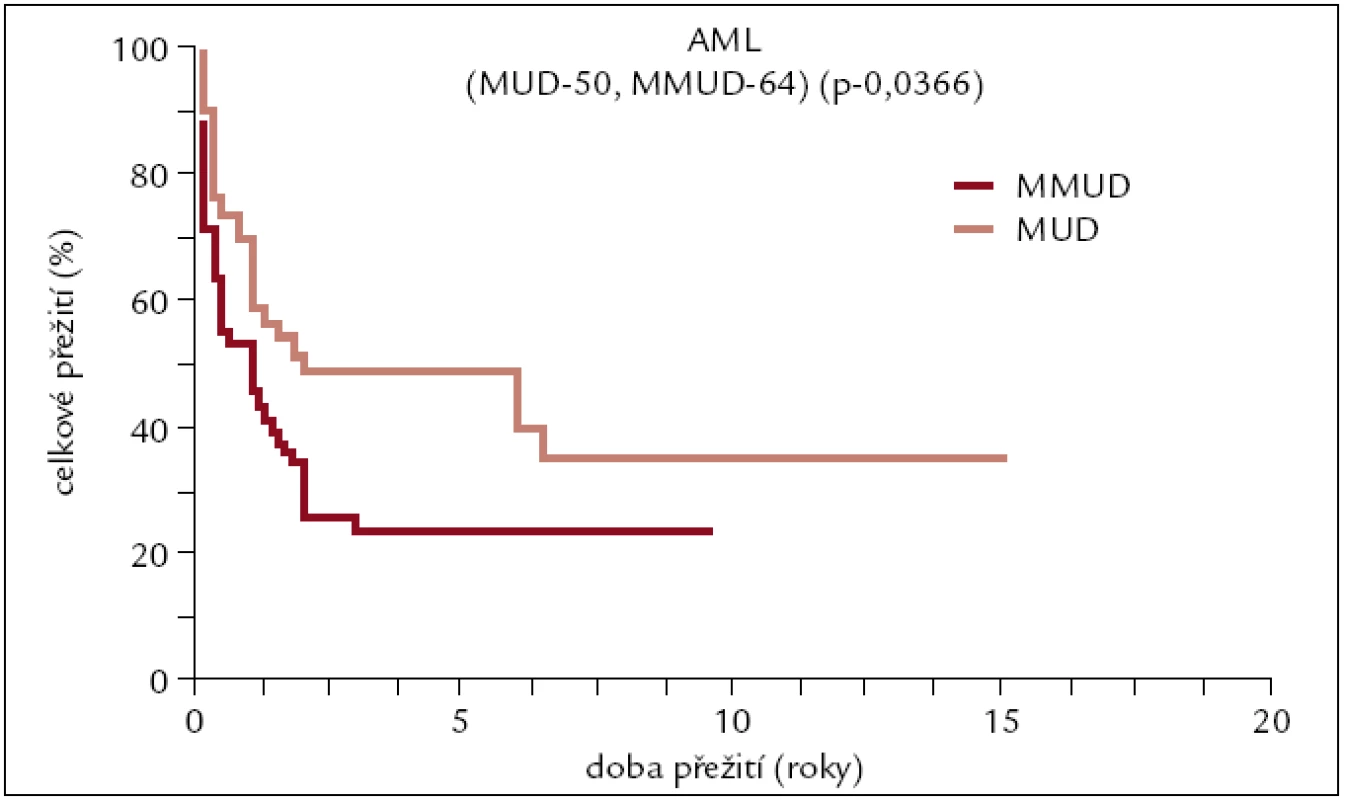
Souhrn
Výsledky transplantací od HLA shodných sourozenců a plně shodných nepříbuzných dárců u pacientů s AML se od sebe statisticky významně neliší. Pětileté přežití se pohybuje kolem 50 %, více než 10 let přežívá asi 40 % pacientů. Pacienti po transplantaci od HLA neshodného nepříbuzného dárce mají horší přežití pohybující se v dlouhodobém horizontu kolem 20 %. Tento výsledek je ovlivněn do určité míry tím, že k HLA neshodné transplantaci jsou častěji indikováni pacienti s prognosticky horšími typy AML.
Alogenní transplantace u chronické myeloidní leukemie
U tohoto onemocnění byla do objevení tyrozinkinázových inhibitorů (TKI) léčebným postupem první volby alogenní transplantace; po zavedení TKI do léčby po roce 2000 se transplantace stala léčebným postupem druhé a další volby. Většina našich pacientů byla transplantována v letech 1994–2006, v posledních několika letech jsou pacienti s CML transplantováni spíše výjimečně. K transplantaci se indikují při rezistenci či při ztrátě odpovědi, a to i na další řady TKI, při progresi do vyššího stadia při léčbě a při nesnášenlivosti těchto léků. V současnosti se neliší výsledky transplantací od HLA shodných sourozenců a od nepříbuzných dárců.
Na našem pracovišti bylo do konce roku 2010 pro CML transplantováno 148 pacientů (89 mužů a 59 žen). 105 pacientů bylo transplantováno v 1. chronické fázi (CP) onemocnění, 43 pacientů v pokročilejším stadiu. Medián věku v době transplantace byl 35 let (16–62). Sedmdesát transplantací bylo od HLA shodného sourozence, 78 od dárce nepříbuzného. 48 pa-cientů mělo dárce se shodou 8/8, 21 se shodou 7/8, 8 pacientů se shodou 6/8 a jeden se shodou 5/8. Kostní dřeň – 96 pacientů, PBPC – 52 pacientů. Myeloablativní conditioning – 140 pacientů, nemyeloablativní – 8 pacientů. U všech pacientů transplantovaných od nepříbuzných dárců či od příbuzných HLA neshodných dárců byl v přípravném režimu použit antitymocytární globulin (obr. 6, 7).
Image 6. Pravděpodobnost přežití u pacientů s CML po alogenní transplantaci v závislosti na pokročilosti onemocnění. 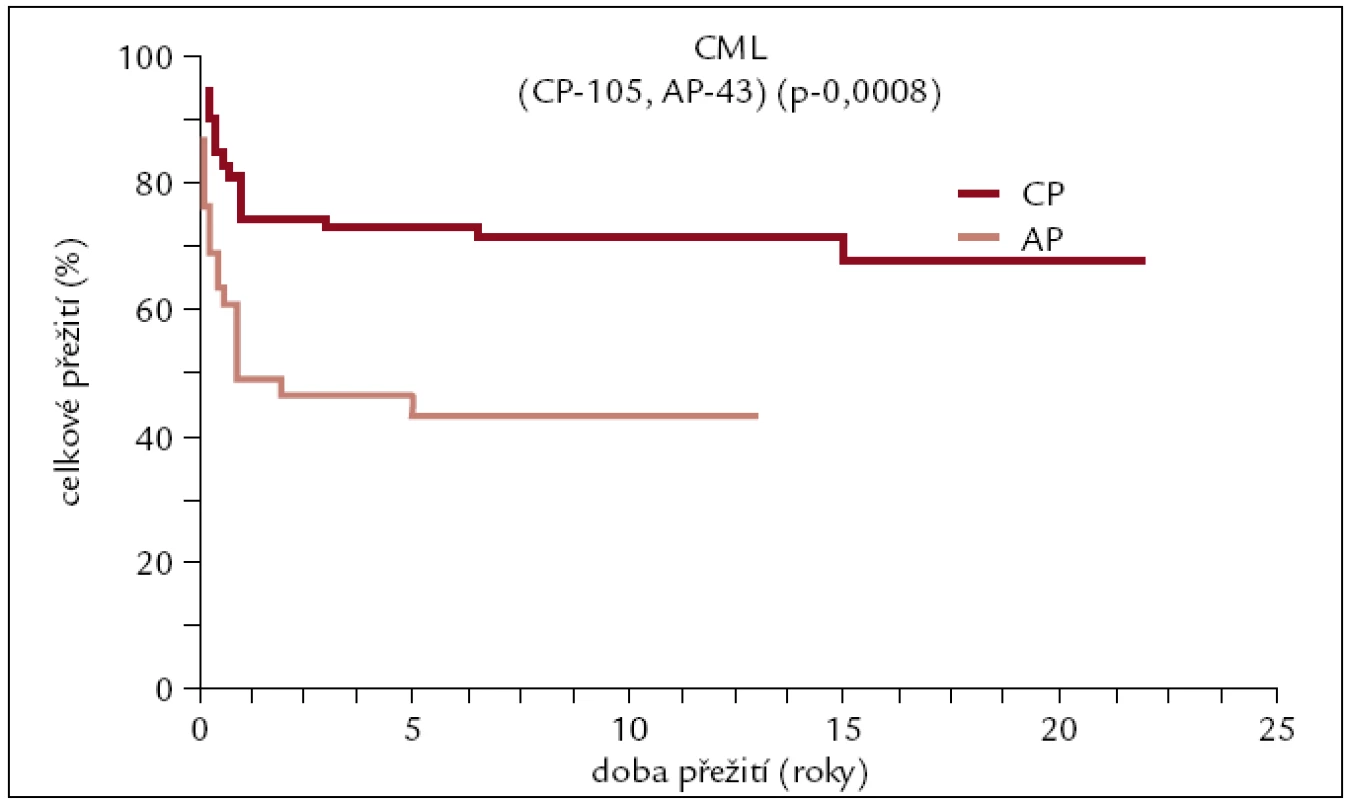
Image 7. Pravděpodobnost přežití u pacientů s CML po transplantaci v 1. chronické fázi v závislosti na období, kdy byla transplantace provedena. 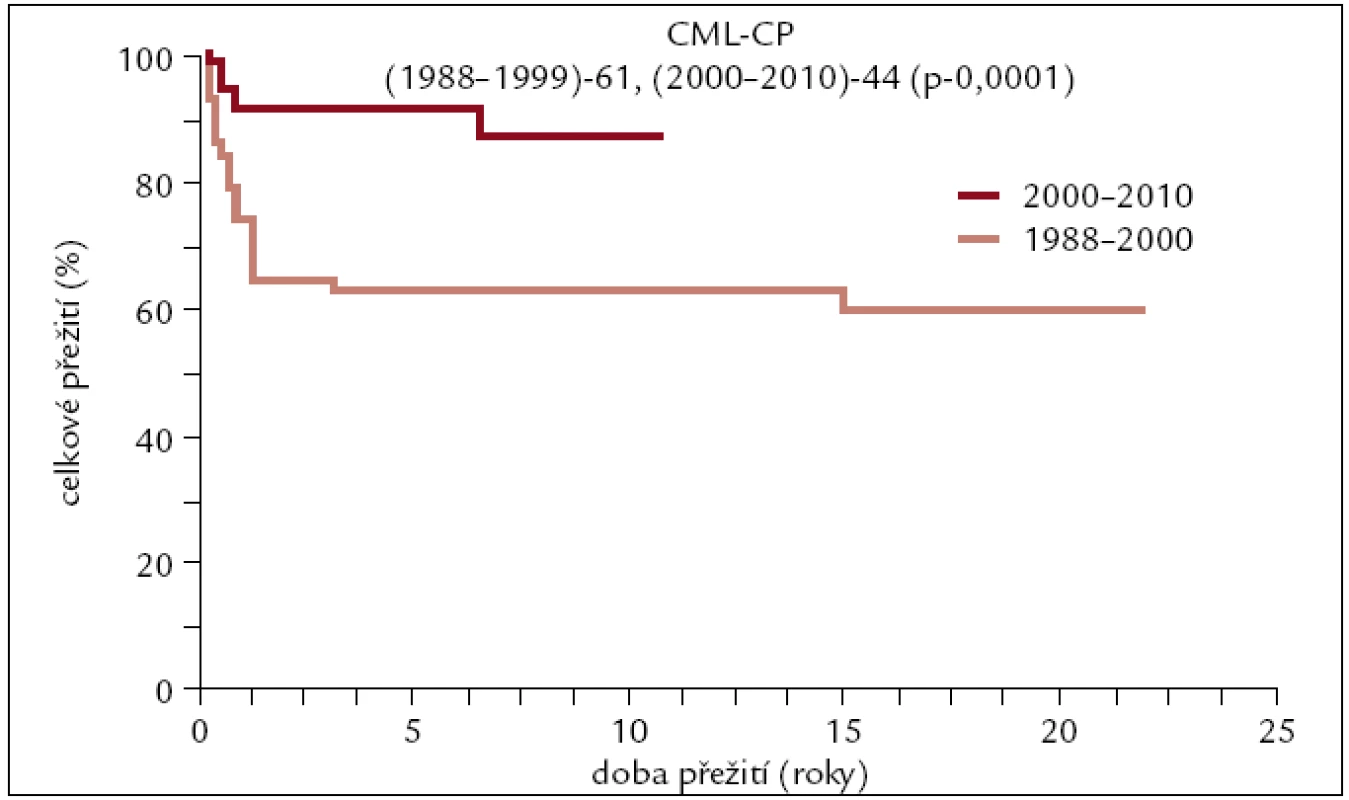
Souhrn
Výsledky transplantací u pacientů transplantovaných v 1. CP od HLA shodného sourozence či nepříbuzného dárce se od sebe neliší, a proto byly zahrnuty do jedné křivky. Dlouhodobé přežití se pohybuje kolem 70 %. U pacientů transplantovaných po roce 2000 je pravděpodobnost 10letého přežití 85–90 %, zatímco u pacientů transplantovaných dříve se přežití pohybuje kolem 60 %. Rozdíly v přežití těchto 2 skupin pacientů jsou statisticky významné. Statisticky významně horší přežití je patrno též u pacientů transplantovaných pro pokročilejší stadium CML v porovnání s 1. CP.
Alogenní transplantace pro myelodysplastický syndrom
Alogenní transplantace pro myelodysplastický syndrom (MDS) [7] patří mezi nemoci, které se dají vyléčit pouze alogenní transplantací. Protože však pacienti s méně pokročilým stadiem MDS mají medián přežití 5,7 roku, indikují se pacienti s RA k alloHCT až od intermediárního rizikového stupně II dle IPSS (těžká cytopenie a nepříznivé změny karyotypu), u nichž se medián přežití pohybuje kolem 1,2 roku.
U nemocných s RAEB či sekundární AML je alloHCT standardní léčebnou metodou 1. volby, přičemž nejlepších potransplantačních výsledků je dosahováno u pacientů, u nichž je předchozí chemoterapií dosaženo redukce blastů pod 10 %.
V ÚHKT bylo do konce roku 2010 transplantováno pro toto onemocnění 106 pacientů (45 žen a 61 mužů). 36 z nich pro refrakterní anémii (RA), 70 pacientů pro pokročilejší stadium typu RAEB či sekundární AML. Medián věku v době transplantace byl 44 let (14–64). Dárcem byl HLA shodný sourozenec u 43 pacientů, jiný pokrevní příbuzný u 6 pacientů a dárce nepříbuzný u 57 pacientů. Dřeň byla transplantována u 47 pacientů, PBPC u 59 pacientů. 85 výkonů bylo uděláno myeloablativně, 21 nemyeloablativně. 76 transplantací bylo uděláno od HLA shodného dárce, 24 HCT od dárců se shodou 7/8, 4 transplantace od dárců se shodu 6/8 a 2 se shodou 4/8.
U všech pacientů transplantovaných od nepříbuzných dárců či od příbuzných HLA neshodných dárců byl v přípravném režimu použit antitymocytární globulin (obr. 8).
Image 8. Pravděpodobnost přežití pacientů s MDS po alogenní transplantaci v závislosti na pokročilosti onemocnění. 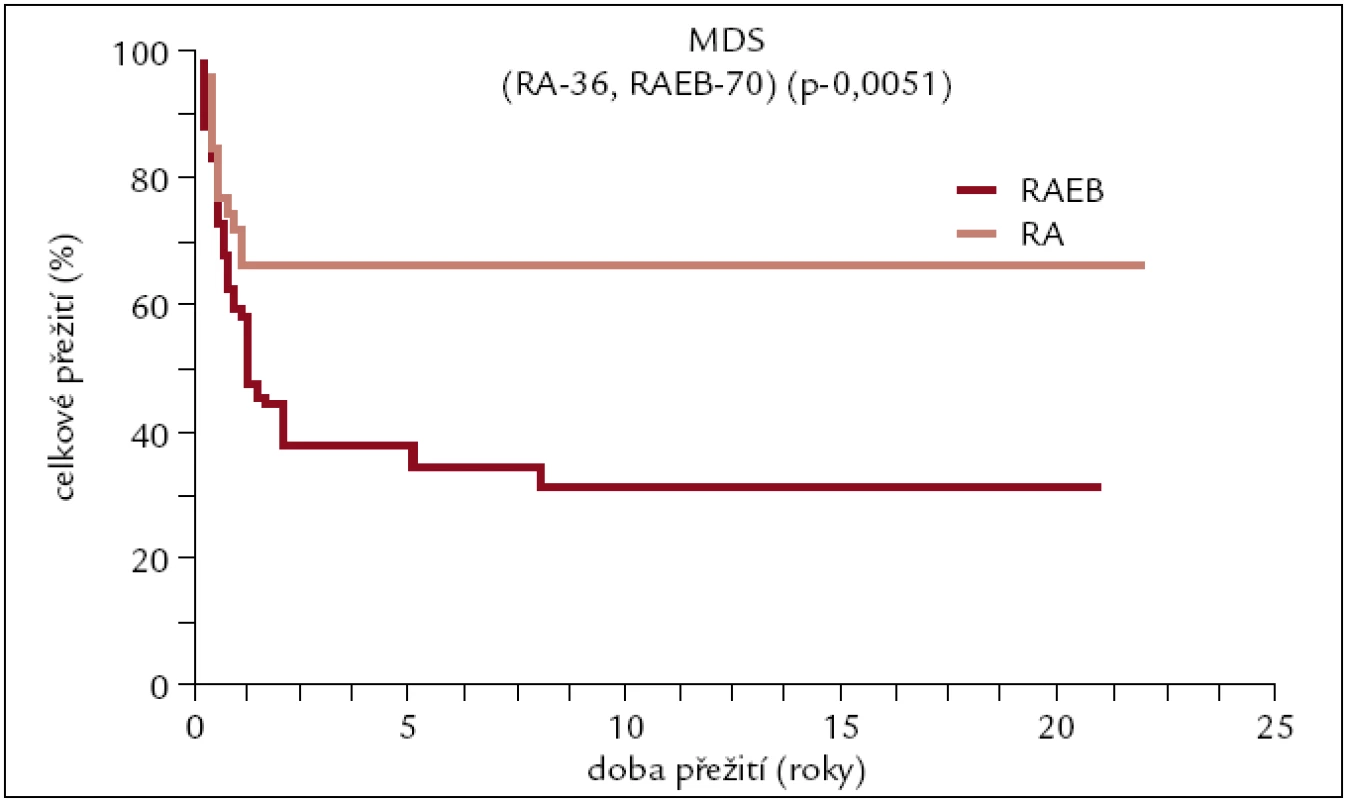
Souhrn
U pacientů s MDS se pravděpodobnost 10letého přežití v naší sestavě pohybuje kolem 70 % u pacientů transplantovaných pro méně pokročilé stadium onemocnění typu RA a kolem 30 % u pacientů s pokročilým stadiem nemoci typu RAEB a sekundární AML.
Alogenní transplantace u akutní lymfatické leukemie
Akutní lymfatická leukemie u dospělých pacientů patří mezi choroby vyléčitelné u asi 30–40 % pacientů samotnou chemoterapií. Vyléčitelnost, podobně jako u AML, je ovlivněna podtypem onemocnění. ALL se dá rozdělit do skupiny s nízkým, středním a vysokým rizikem relapsu [6]. Mezi rizikové faktory patří zejména věk nad 35 let, leukocytóza nad 30 × 109/l u B ALL a nad 100 × 109/l u T ALL, rizikový fenotyp, nepříznivá cytogenetika (t.9,22, t.4,11, t.8,14, t.1,19 a další), pozdní docílení kompletní remise a perzistence minimální reziduální nemoci po docílení remise. Kandidáty pro provedení alogenní transplantace od HLA shodného sourozence v 1. CR jsou téměř všichni dospělí pacienti, zatímco transplantace od nepříbuzného dárce v 1. CR je dle současných doporučení rezervována spíše pro pacienty ze skupiny s vyšším rizikem relapsu, a to zejména nejsme-li schopni vyhledat HLA plně shodného nepříbuzného dárce. Naopak u pacientů po relapsu, nejlépe v 2. CR, je provedení alogenní transplantace, a to i od nepříbuzného dárce, spojeno s nejlepším přežitím ve srovnání s chemoterapií či autologní transplantací.
V ÚHKT bylo do konce roku 2010 transplantováno 83 pacientů (45 mužů a 38 žen) pro akutní lymfatickou leukemii. Medián věku v době transplantace byl 32 let (17–64). 24 z nich bylo transplantováno štěpem od HLA shodného sourozence, 2 od jiného pokrevního příbuzného a 57 od dárce nepříbuzného. 77 výkonů bylo uděláno po myeloablativním a 6 po nemyeloablativním conditioningu. U 33 pacientů byla použita kostní dřeň a u 50 pacientů PBPC. 55 výkonů bylo od dárce se shodou 8/8, 16 od dárce se shodou 7/8, 11 se shodou 6/8 a 1 se shodou 5/8.
U všech pacientů transplantovaných od nepříbuzných dárců či od příbuzných HLA neshodných dárců byl v přípravném režimu použit antitymocytární globulin (obr. 9).
Image 9. Pravděpodobnost přežití pacientů s ALL po alogenní transplantaci. 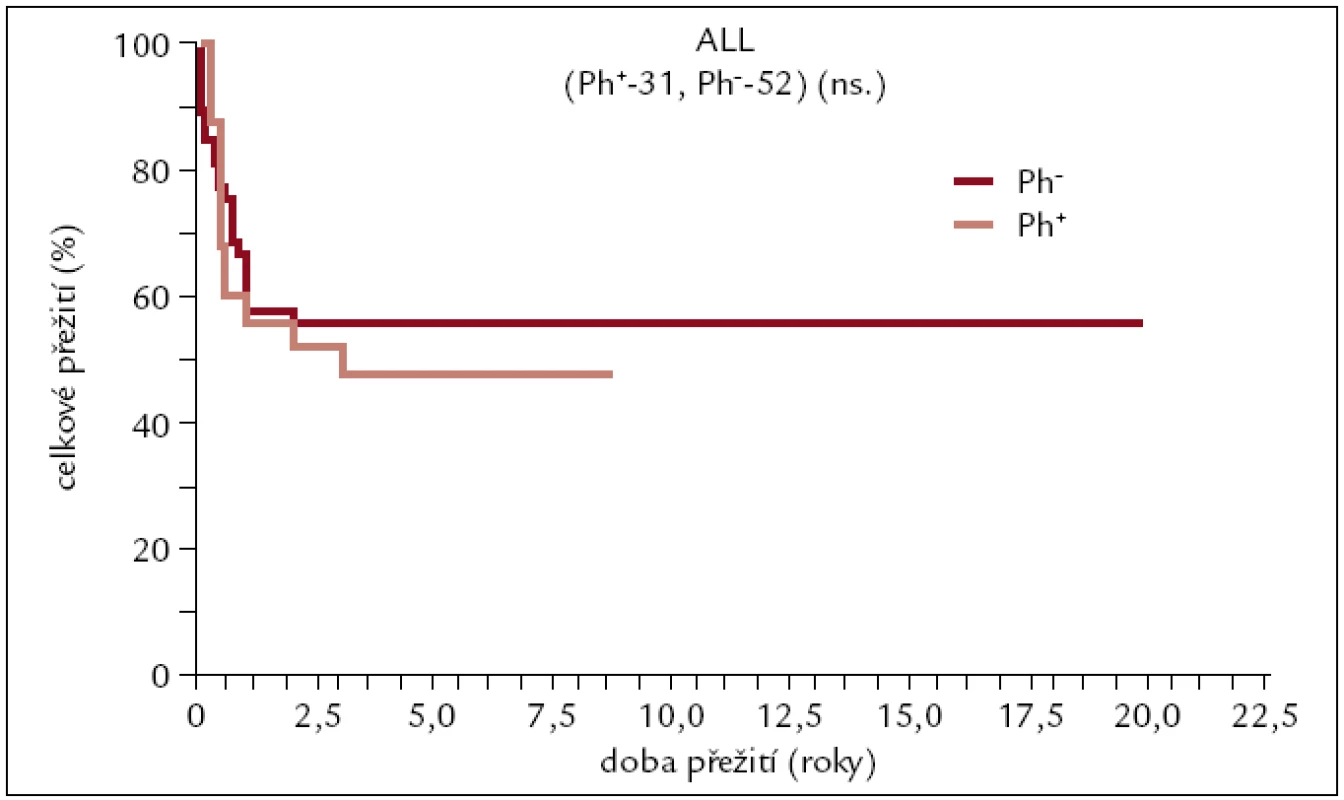
Souhrn
Z výsledků je patrné, že pacienti po transplantaci pro ALL žijí dlouhodobě s asi 50% pravděpodobností, nezávisle na přítomnosti, či absenci Ph chromozomu.
Alogenní transplantace u non-Hodgkinských lymfomů
Přestože je alogenní transplantace u folikulárních lymfomů (FCL) jediným postupem s kurativním potenciálem, zůstává tento výkon rezervován pro pacienty s agresivně probíhajícím onemocněním nereagujícím na nejlepší známou chemo/imunoterapii. Folikulární lymfom je dobře citlivý na GVL efekt alogenní transplantace, což umožňuje používat s úspěchem nemyeloablativní postupy. U pacientů s jinými podtypy NHL je upfront indikována léčba chemoterapií, event. v kombinaci s autologní transplantací. K alogenním výkonům jsou indikováni pacienti s agresivně probíhajícím onemocněním a/nebo relabující po autologních transplantacích [9].
V ÚHKT bylo do konce roku 2010 transplantováno 47 pacientů (29 mužů a 18 žen) pro NHL. Patnáct z nich pro folikulární, 32 po jiný podtyp NHL (DLBCL, MCL, T-NHL a další). Medián věku v době transplantace byl 47 let (21–62). Dárcem byl HLA shodný sourozenec u 17 a dárce nepříbuzný u 30 pacientů. Dřeň byla použita u 10 a PBPC u 37 pacientů. Myeloablativní conditioning podstoupilo 23 a nemyeloablativní 24 pacientů.
U všech pacientů transplantovaných od nepříbuzných dárců či od příbuzných HLA neshodných dárců byl v přípravném režimu použit antitymocytární globulin (obr. 10).
Image 10. Pravděpodobnost přežití pacientů s NHL po alogenní transplantaci. 
Souhrn
U nemocných transplantovaných pro folikulární NHL je patrna tendence k lepšímu přežití po transplantaci ve srovnání s ostatními podtypy NHL. Pětileté přežití pacientů s FCL se pohybuje kolem 80 %, zatímco u ostatních je to asi 40 %. Rozdíl však není z důvodu malého počtu pacientů statisticky významný.
Alogenní transplantace pro myelofibrózu s myeloidní metaplazií
Alogenní transplantace představuje u tohoto onemocnění jediný známý postup s kurativním potenciálem [10]. K transplantaci se indikují pacienti s pokročilejším stavem onemocnění, ať již dle Lille skóre či IPSS. Anémie s hemoglobinem pod 100 g/l, leukocytóza nad 25–30 × 109/l, počet blastických elementů v periferní krvi nad 1 % či počet blastů + promyelocytů + myelocytů nad 10 %, přítomnost B symptomů a věk nad 65 let jsou rizikové faktory, pomocí nichž lze stratifikovat pacienty do skupiny s mediánem přežití 93–135 měsíců při absenci všech rizikových faktorů, nebo naopak do skupiny s mediánem přežití 13–27 měsíců u pacientů s vyjádřenými 2 a více rizikovými faktory. Nezpochybnitelnou indikací pro provedení transplantace je rozvoj anémie s hodnotami Hb pod 100 g/l.
V ÚHKT bylo do konce roku 2010 transplantováno 42 pacientů (21 mužů a 21 žen) pro myelofibrózu. Medián věku v době transplantace byl 52 let (37–64). 40 pacientům byla transplantována PBPC, 2 pacienti dostali kostní dřeň. Dvanáct transplantací byly od HLA shodného sourozence, 30 od dárce nepříbuzného. 28 od dárce se shodou 8/8, 10 od dárce se shodou 7/8 a 4 od dárce se shodou 6/8. U 28 pacientů byl použit myeloablativní a u 14 nemyeloablativní conditioning. U všech pacientů transplantovaných od nepříbuzných dárců či od příbuzných HLA neshodných dárců byl v přípravném režimu použit antitymocytární globulin (obr. 11).
Image 11. Pravděpodobnost přežití pacientů s myelofibrózou po alogenní transplantaci. 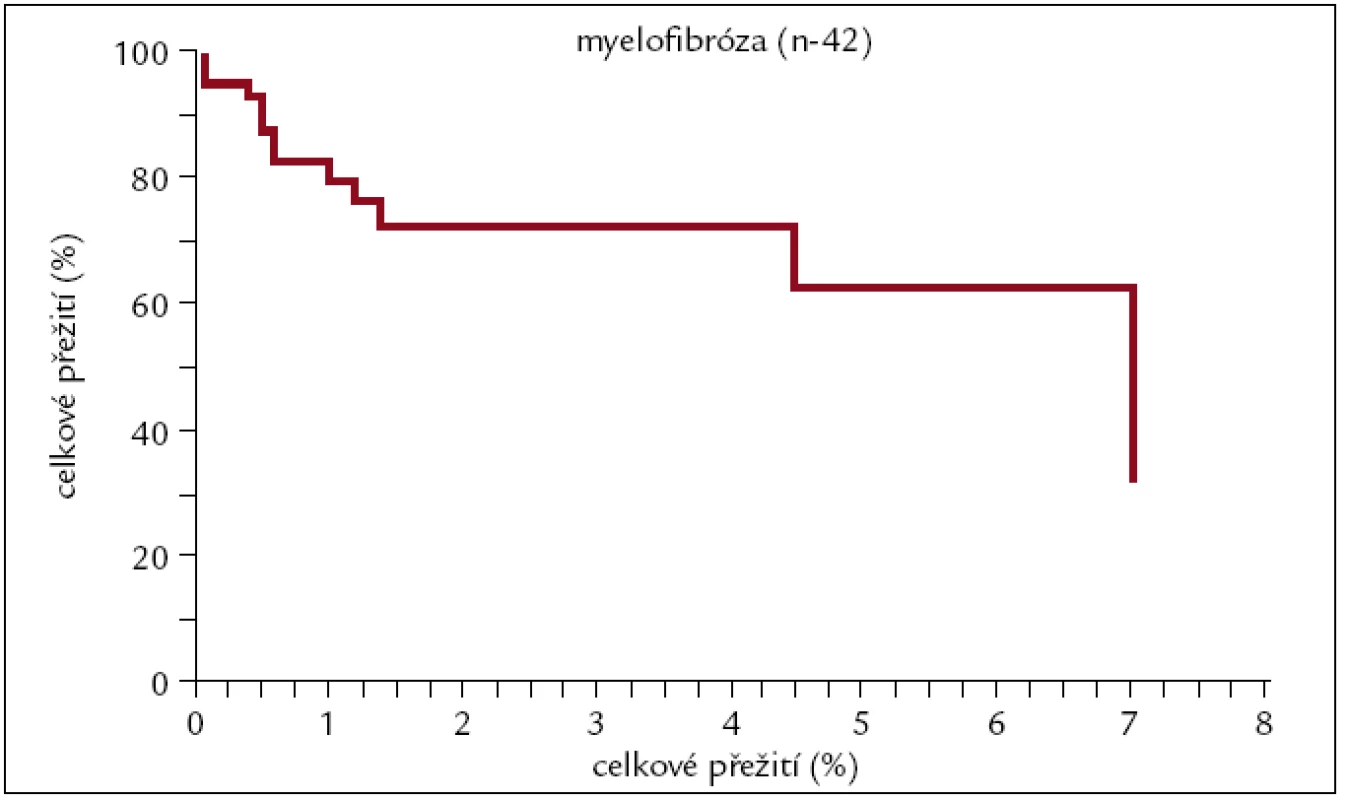
Souhrn
Pravděpodobnost 3letého přežití u pacientů s myelofibrózou po alogenní HCT je v naší sestavě 70 %. K dlouhodobějším výsledkům se zatím nemůžeme vyjádřit, protože nejdelší doba sledování je necelých 7 let.
Transplantace pro chronickou lymfatickou leukemii
Alogenní transplantace je u chronické lymfatické leukemie jediným známým postupem s kurativním potenciálem [11]. Alogenní transplantace přichází v úvahu jako léčebná možnost u mladších, již dříve léčených nemocných s nepříznivou prognózou definovanou agresivním klinickým průběhem nemoci a/nebo přítomností nepříznivého cytogenetického nálezu (17p-), u nemocných refrakterních na léčbu fludarabinem nebo relabujících po této léčbě do 12 měsíců od jejího ukončení a u pacientů relabujících do 24 měsíců po provedení autoHCT.
V ÚHKT bylo transplantováno do konce roku 2010 pro toho onemocnění 34 pacientů (30 mužů a 4 ženy). Medián věku byl 54 let (39–64). HLA shodný sourozenec byl dárcem u 11 a dárce nepříbuzný u 23 pacientů. U 7 pacientů byla transplantována kostní dřeň a u 27 pacientů PBPC. Myeloablativní conditioning byl použit u 16 a nemyeloablativní u 18 pacientů. U všech pacientů transplantovaných od nepříbuzných dárců či od příbuzných HLA neshodných dárců byl v přípravném režimu použit antitymocytární globulin (obr. 12).
Image 12. Pravděpodobnost přežití pacientů s CLL po alogenní transplantaci. 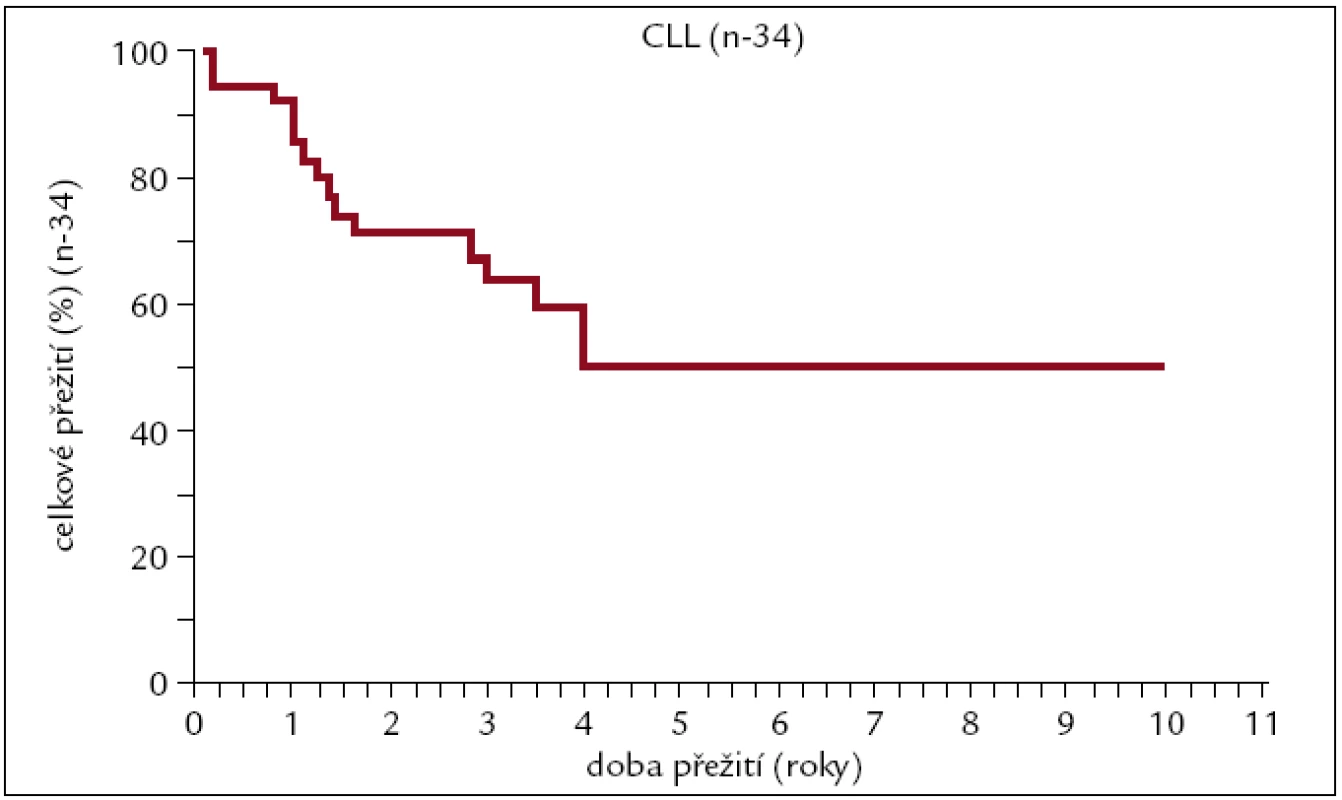
Souhrn
Pravděpodobnost 10letého přežití u pacientů s CLL po alogenní transplantaci je v naší sestavě vysocerizikových pacientů asi 50 %, když plateau na křivce pozorujeme od 4. roku po transplantaci. Relapsy jsou častým důvodem neúspěchu transplantace spolu s GVHD a infekčními komplikacemi.
Transplantace pro těžkou aplastickou anémii
U nemocných s těžkou aplastickou anémií (SAA) [12] do věku 45–55 let je indikována transplantace od HLA shodného sourozence upfront. Transplantace by u nich měla být udělána co nejdříve. Proto u každého takového pacienta je třeba hned po stanovení diagnózy vyšetřit HLA u sourozenců. Pacienti starší či bez HLA shodného sourozence zahájí léčbu imunosupresí. U mladších pacientů do věku 55–60 let se současně zahájí search nepříbuzného dárce a v případě neodpovědi na léčbu imunosupresivy (hodnotit za 4 měsíce) se indikuje transplantace od nepříbuzného dárce. U pacientů starších, kteří mají HLA shodného sourozence, se při selhání imunosuprese indikuje transplantace do věku 60–65 let.
V ÚHKT bylo do konce roku 2010 transplantováno 10 pacientů (5 žen a 5 mužů) pro SAA. Medián věku byl 22 let (16–37). Dárcem byl HLA shodný sourozenec u 8 a nepříbuzný dárce u 2 pacientů. Čtyři pacienti dostali kostní dřeň, 6 pacientů PBPC. Devět pacientů mělo štěp od dárce se shodou 8/8, jeden se shodou 6/8. U všech pacientů byl v přípravném režimu použit antitymocytární globulin (obr. 13).
Image 13. Pravděpodobnost přežití pacientů s SAA po alogenní transplantaci. 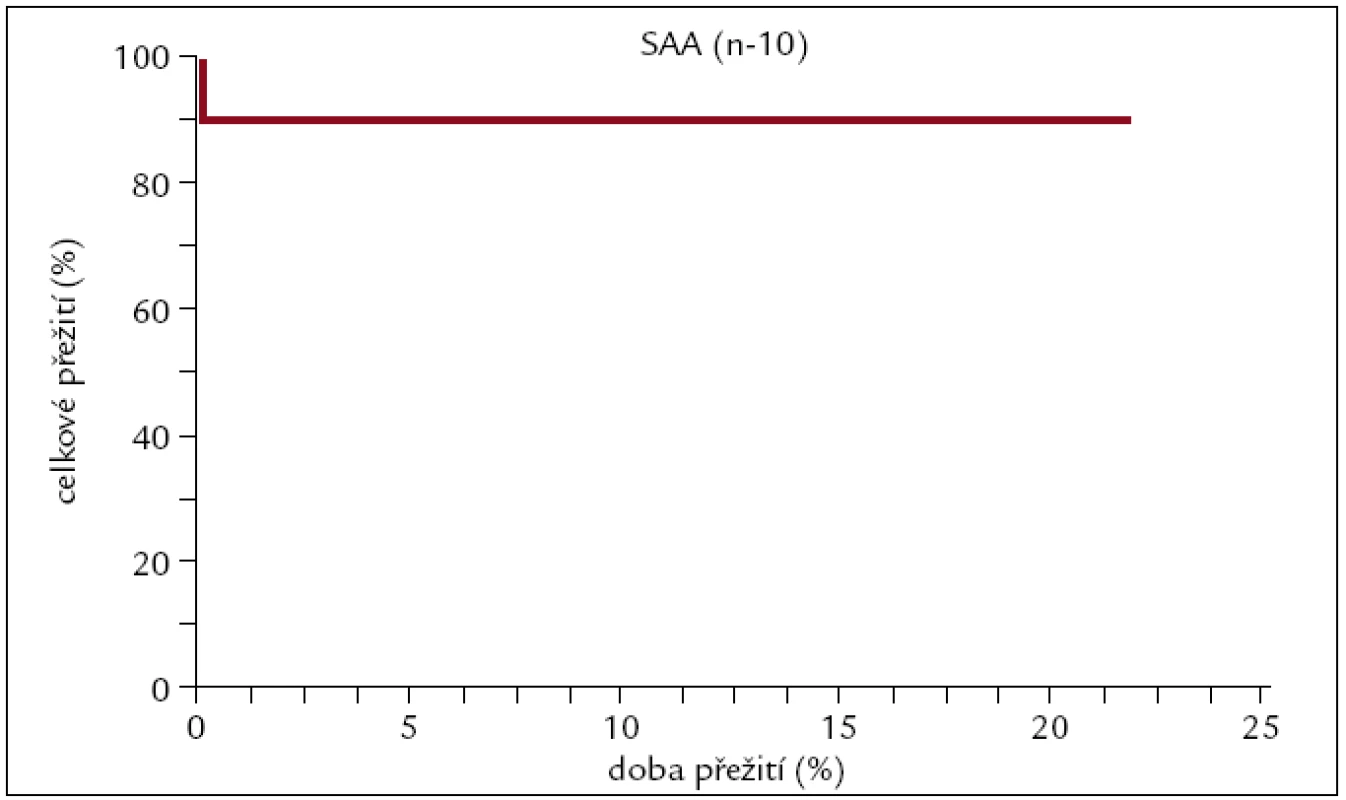
Souhrn
Z našich 10 hodnocených pacientů s SAA jich dlouhodobě žije 9 při nejdelší době sledování 20 let. Je zřejmé, že alogenní transplantace je velmi efektivní léčebný postup u pacientů s touto diagnózou.
Závěr
Transplantace krvetvorných buněk je život zachraňující výkon u řady nemocí, které jsou nevyléčitelné žádným jiným v současné době známým postupem.
Je to zároveň výkon zatížený rizikem vzniku řady těžkých i život ohrožujících komplikací. Proto je třeba jej indikovat uvážlivě tak, aby profit byl vyšší než možná rizika z něj vyplývající. Pacienty je k transplantaci třeba indikovat včas, dříve než onemocnění či klinický stav pacienta pokročí do stadia vylučujícího dobrý efekt transplantace.
MUDr. Antonín Vítek
www.uhkt.cz
e-mail: vitek@uhkt.cz
Doručeno do redakce: 12. 5. 2012
Sources
1. Barnes DW, Corp MJ, Loutit JF et al. Treatment of murine leukemia with X-rays and homologous bone marrow: preliminary communication. Br Med J 1956; 2 : 626–627.
2. Thomas ED, Lochte HL Jr, Lu WC et al. Intravenous infusion of bone marrow in patients receiving radiation and chemotherapy. N Engl J Med 1957; 257 : 491–496.
3. Thomas ED, Collins JA, Herman EC Jr et al. Marrow transplants in lethally irradiated dogs given methotrexate. Blood 1962; 19 : 217–228.
4. van Rood JJ. The detection of transplantation antigens in leukocytes. Semin Hematol 1968; 5 : 187–214.
5. Vaňásek J, Starý J, Kavan P et al. Transplantace kostní dřeně. Praha: Galén 1996.
6. Apelbaum FR. Hematopoietic cell transplantation of adult acute myeloid leukemia. In: Thomas’ Hematopoietic Cell Transplantation. 4th ed. Oxford: Blackwell Publishing 2009 : 761–774.
7. Kröger N. HSCT for myelodysplastic syndromes. In: The EBMT Handbook. Haematopoietic stem cell transplantation. 5th ed. Genoa: Forum Service Editore 2012 : 343–357.
8. Forman SJ. Hematopoietic cell transplantation for acute lymphoblastic leukemia in adults. In: Thomas’ Hematopoietic Cell Transplantation. 4th ed. Oxford: Blackwell Publishing 2009 : 791–805.
9. Schouten HS, Sureda A. HSCT for non--Hodgkin’s lymphoma. In: The EBMT Handbook. Haematopoietic stem cell transplantation. 5th ed. Genoa: Forum Service Editore 2012 : 415–429.
10. Pavlu J, Apperley J. Chronic myeloid leukaemia and the myeloproliferative disorders. In: The EBMT Handbook. Haematopoietic stem cell transplantation. 5th ed. Genoa: Forum Service Editore 2012 : 365–375.
11. Dreger P, Schetelig J. Chronic lymphocytic leukaemia. In: The EBMT Handbook. Haematopoietic stem cell transplantation. 5th ed. Genoa: Forum Service Editore 2012 : 377–384.
12. The complete treatment algorithm for SAA. Available from: http://www.ebmt.org.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue Suppl 2-
All articles in this issue
- Myelodysplastický syndrom. Pokroky v diagnostice a léčbě během 30 let trvání registru nemocných s myelodysplastickým syndromem v ÚHKT
- Akutní myeloidní leukemie – historický vývoj a současnost léčby ve světě a v ÚHKT
- Akutní lymfoblastová leukemie: historie a současnost
- Chronická myeloidní leukemie – zásadní změna prognózy nemocných po zavedení léčby inhibitory tyrozinových kináz
- Molekulární genetika v diagnostice a léčbě chronické myeloidní leukemie
- Transplantace krvetvorných buněk a její role v léčbě chorob krvetvorby během posledních 25 let
- Prevence a léčba infekčních komplikací v hematoonkologii
- Naléhavé stavy v hematologii
- Péče o pacienty s hemofilií a jejich rodiny v ÚHKT
- Sledování vrozených a získaných, strukturních a funkčních změn fibrinogenu
- Využití „label-free“ proteinových čipů pro proteomiku onkohematologických onemocnění
- Hemaferéza – vysoce účinná technika v terapii nemocných
- Imunohematologie – historie, současný stav poznání a role ÚHKT
- Metabolizmus železa a jeho regulace
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Imunohematologie – historie, současný stav poznání a role ÚHKT
- Naléhavé stavy v hematologii
- Metabolizmus železa a jeho regulace
- Hemaferéza – vysoce účinná technika v terapii nemocných
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

