-
Medical journals
- Career
Metabolizmus železa a jeho regulace
: D. Vyoral 1,2; J. Petrák 1,2
: Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Marek Trněný, CSc. 1; Ústav patologické fyziologie 1. lékařské fakulty UK Praha, přednosta prof. MUDr. Emanuel Nečas, DrSc. 2
: Vnitř Lék 2012; 58(Suppl 2): 115-126
:
Železo je nezastupitelný biogenní prvek, jako katalytická součást mnoha metaloproteinů se uplatňuje téměř ve všech biochemických drahách, je však také schopno iniciovat tvorbu škodlivých volných radikálů. Tento přehledový článek shrnuje nové poznatky o mechanizmech, regulacích a poruchách absorpce a transportu železa.
Klíčová slova:
železo – metabolizmus železaÚvod
Železo (Fe) je 4. nejhojnější prvek v zemské kůře a vzhledem k složení zemského jádra (odhaduje se 80 % Fe) je pravděpodobně i nejhojnějším prvkem na Zemi [1]. Podle některých vědců sehrál tento prvek klíčovou úlohu při syntéze prvotních prebiotických polymerů. Podle těchto představ došlo ke vzniku biochemických reakcí na povrchu krystalů pyritu FeS2 dávno před vznikem proteinů a nukleových kyselin [2]. Pozůstatkem těchto reakčních center by mohly být takzvané Fe/S proteiny. Tyto bílkoviny obsahují ve své molekule prostetickou skupinu složenou z atomů železa a síry – tzv. Fe/S klastr (iron-sulfur cluster).
V současnosti známe několik stovek lidských bílkovin vážících železo a spektrum reakcí, v nichž hraje železo svou nezastupitelnou roli, zahrnuje zřejmě všechny biochemické dráhy.
Železo se v biologických systémech vyskytuje především ve 2 oxidačních stavech – jako iont železitý (Fe3+) a železnatý (Fe2+). Za fyziologických podmínek podléhá dvojmocné železo rychlé oxidaci a trojmocné železo vytváří nerozpustné, biologicky nedostupné polynukleární hydroxidy. Mezi faktory ovlivňující rozpustnost a redoxní rovnováhu železa ve vodném roztoku patří především pH, saturace kyslíkem, iontové složení roztoku a přítomnost ligandů s potenciálem vytvářet komplexy s dvojmocným či trojmocným železem. Rovnovážná koncentrace volných železitých iontů (Fe3+) je za fyziologických podmínek (vlivem tvorby a polymerace jeho hydroxidů) extrémně nízká (10–18 mol/l), což znamená, že buňka či organizmus musí udržovat železo v rozpustné podobě vytvářením komplexů se specifickými nízkomolekulárními či vysokomolekulárními ligandy. K tomu, aby byl jediný iont železa přenesen z potravy do transferinu v krevním oběhu, je nutná komplikovaná souhra mnoha různých bílkovin ve střevní buňce. Podobně je vícekrokový proces zahrnující interakci mnoha bílkovin nezbytný k zabudování jednoho iontu železa z transferinu do hemoglobinu či jiného proteinu obsahujícího železo. K získání železa z okolí potřebují prokaryotní mikroorganizmy souhru překvapivě velkého množství genů, které často pro organizmy napadené těmito mikroby představují faktory patogenity. Je známo několik set druhů specifických sideroforů, molekul s obrovskou afinitou pro železo, prostřednictvím kterých jednotlivé druhy bakterií mezi sebou soutěží a bojují o dostupnost životně důležitého prvku. Siderofory jsou schopny „uloupit“ železo pro invadující mikroby z tkání a tělesných tekutin hostitele.
V tkáních vyšších organizmů pak fungují přenašečové molekuly (transferin) železa s neméně vysokými afinitami pro tento prvek, které mají za úkol takovým loupežím zabránit [3]. Nikoli náhodou je význam železa pro vztahy mezi mikroorganizmy a mezi mikroby a mnohobuněčnými organizmy přirovnáván k významu ropy v ekonomice globálního světa.
Chemické reakce, v nichž hraje železo svou nezastupitelnou roli, najdeme ve všech biochemických drahách. Nejdůležitější vlastností železa jako biokatalyzátoru je jeho existence ve 2 stabilních oxidačních stavech a schopnost fungovat jako donor nebo akceptor elektronu, tedy jako redoxní činidlo.
Železo se účastní přenosu kyslíku (hemoglobin, myoglobin), je aktivní součástí bílkovin elektrontransportního řetězce (Fe/S bílkoviny a cytochromy), účastní se procesů oxidativní fosforylace (mitochondriální akonitáza, sukcinát dehydrogenáza), syntézy DNA (ribonukleotid reduktáza), katalýzy biologických oxidací (oxidáza), ale také rozkladu kyslíkových derivátů (superoxid dismutáza) a podílí se i na mnoha dalších biochemických pochodech.
Tytéž fyzikálně-chemické vlastnosti železa, které jsou pro organizmus velice výhodné a nezbytné, mohou způsobovat jeho poškození. Redoxní reakce železa jsou totiž zdrojem vysoce reaktivních volných radikálů. Klasickým příkladem je Fentonova reakce, při které vzniká vysoce reaktivní hydroxylový radikál:
H2O2 + Fe2+ + H+ → H2O + Fe3+ + HO•
Hydroxylový radikál může způsobovat peroxidaci lipidů s následným poškozením buněčných membrán a rovněž poškození DNA a bílkovin. Peroxidace lipidů volnými radikály je považována za hlavní příčinu poškození organizmu při přetížení železem [4,5].
Bílkoviny obsahující železo můžeme z hlediska uspořádání funkční skupiny rozdělit do 3 typů – hemoproteiny, Fe/S proteiny a metaloproteiny s jinou vazbou Fe než v hemu či Fe/S skupině. Za zvláštní skupinu lze považovat membránové transportéry a oxidázy//reduktázy specifické pro membránový přenos železa, které vážou tento kov jen přechodně.
Hemoproteiny
Hemoglobin je nejhojněji se vyskytující železo vážící protein v lidském těle. Jeho nejvyšší koncentrace samozřejmě nalezneme v erytrocytech. Zralá červená krvinka totiž obsahuje přibližně 640 milionů molekul hemoglobinu. Lidský hemoglobin je složen vždy ze 4 polypeptidických globinových řetězců, přičemž na každý z řetězců je navázána prostetická hemová skupina.
Syntéza hemu probíhá zčásti v mitochondriích a zčásti v cytoplazmě. Jedná se o sérii reakcí, která začíná kondenzací glycinu se sukcinyl-CoA a končí vestavěním železa do molekuly protoporfyrinu IX [6]. Vestavění hemu do hemoglobinu je komplexní proces, na kterém se, jak ukázala studie naší skupiny, podílí řada proteinových komponent dohlížejících na správné sestavení tetrametru, zajišťujících přenos hemu z mitochondrií a zamezujících oxidaci hemového železa [7].
Kromě hemoglobinu, myoglobinu, cytoglobinů a neuroglobinů (což jsou nedávno objevené cytosolické hemoproteiny pravděpodobně chránící před oxidativním poškozením) jsou hemoproteiny zastoupeny v mnoha dalších metabolických drahách. Mezi hemoproteiny patří např. cytochromy elektrontransportního řetězce v mitochondriích, cytochromy CYP (zajišťující metabolizmus xenobiotik, steroidů, arachidonové kyseliny, tromboxanů, retinové kyseliny, vitaminu D), některé transkripční faktory, aktivátory proteosyntézy, guanylát cyklázy a NO syntázy a také hemoproteiny ovlivňující cirkadiánní rytmy.
Fe/S bílkoviny (iron-sulfur proteins)
Další velmi významnou skupinou bílkovin obsahujících železo jsou Fe/S proteiny. Tyto obsahují ve své molekule prostetickou skupinu složenou ze železa a síry – tzv. Fe/S klastr (iron-sulfur cluster). Fe/S bílkoviny hrají roli v mnoha metabolických drahách, např. v Krebsově cyklu (mitochondriální akonitáza, sukcinát dehydrogenáza), při opravách DNA (některé endonukleázy, helikázy) a v elektrontransportním řetězci (NADH-CoQ reduktáza). Mitochondriální ferochelatáza syntetizující hem vestavbou železa do protoporfyrinu IX je rovněž enzymem s Fe/S klastrem. Fe/S bílkoviny jsou, podobně jako hem, syntetizovány zčásti v mitochondriích a zčásti v cytoplazmě (obr. 1) a na syntéze jejich Fe/S klastrů a jejich vestavování do vazebných míst cílových bílkovin se podílí složitý komplex mnoha proteinů, jejichž genetické defekty způsobují myopatie a sideroblastické anémie [8].
1. Endocytóza transferinu a nitrobuněčný transport železa. Diferický transferin je po navázání na transferinový receptor (TfR) endocytován ve vezikulu obaleném klatrinem. V endozomu se po okyselení vakuolární ATPázou ionty železa z transferinu uvolní, jsou redukovány reduktázou (Steap 3) a transportovány kanálem pro Fe2+ (DMT1). Pohyb endozomů podél cytoskeletálních vláken myosinu řídí proteiny Sec15 a MRCKα (není zakresleno). Další osud železa není jasný, pravděpodobně vstupuje do mitochondrií přes transportér mitoferin (Mfrn) za účasti dalších dosud neidentifikovaných proteinů přímým kontaktem endozomu s mitochondrií. Předpokládá se také přenos do cytozolických metaloproteinů (např. feritin) jejich přímým kontaktem s cytozolickou stranou membrány endozomu [49]. Podle jiných představ se železo v cytozolu naváže na nízkomolekulární ligand (např. ATP, citrát, NADPH) a stane se součástí tzv. labilní hotovosti železa (LIP). Do mitochondrií vstupuje železo pravděpodobně kanálem pro Fe2+ (mitoferin 1 a 2 (Mfrn 1/2)) a je využito ferochelatázou (FC) (ta je pravděpodobně součástí translokačního proteinového superkomplexu v místě kontaktu mitochondrií s endozomy). Železo v mitochondriích také může být využito multiproteinovými komplexem ISC (iron-sulphur cluster assembly complex) pro syntézu mitochondriálních Fe/S proteinů. Fe/S proteiny jsou sestavovány také v cytozolu (CIA – cytoplasmic iron-sulfur assembly), kam mohou být Fe/S skupiny dopraveny z mitochondrií (ABCB7 transportér) a v buněčném jádře. Detaily transportu hemu z mitochondrií nejsou dosud objasněny. Obrázek převzat se svolením [1]. ![Endocytóza transferinu a nitrobuněčný transport železa.
Diferický transferin je po navázání na transferinový receptor (TfR) endocytován ve vezikulu obaleném klatrinem. V endozomu se po okyselení vakuolární ATPázou ionty železa z transferinu uvolní, jsou redukovány reduktázou (Steap 3) a transportovány kanálem pro Fe2+ (DMT1). Pohyb endozomů podél cytoskeletálních vláken myosinu řídí proteiny Sec15 a MRCKα (není zakresleno). Další osud železa není jasný, pravděpodobně vstupuje do mitochondrií přes transportér mitoferin (Mfrn) za účasti dalších dosud neidentifikovaných proteinů přímým kontaktem endozomu s mitochondrií. Předpokládá se také přenos do cytozolických metaloproteinů (např. feritin) jejich přímým kontaktem s cytozolickou stranou membrány endozomu [49]. Podle jiných představ se železo v cytozolu naváže na nízkomolekulární ligand (např. ATP, citrát, NADPH) a stane se součástí tzv. labilní hotovosti železa (LIP).
Do mitochondrií vstupuje železo pravděpodobně kanálem pro Fe2+ (mitoferin 1 a 2 (Mfrn 1/2)) a je využito ferochelatázou (FC) (ta je pravděpodobně součástí translokačního proteinového superkomplexu v místě kontaktu mitochondrií s endozomy). Železo v mitochondriích také může být využito multiproteinovými komplexem ISC (iron-sulphur cluster assembly complex) pro syntézu mitochondriálních Fe/S proteinů. Fe/S proteiny jsou sestavovány také v cytozolu (CIA – cytoplasmic iron-sulfur assembly), kam mohou být Fe/S skupiny dopraveny z mitochondrií (ABCB7 transportér) a v buněčném jádře.
Detaily transportu hemu z mitochondrií nejsou dosud objasněny. Obrázek převzat se svolením [1].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/3a7b29cac3f61df0ad436c8f5df1cb46.jpg)
Ostatní bílkoviny vážící železo
Do této heterogenní skupiny můžeme zařadit důležité enzymy, jako jsou např. serin/threonin fosfatázy, tartarát rezistentní kyselá fosfatáza, ribonukleotid reduktáza, některé hydrogenázy, lipooxygenáza, fenylalanin, tryptofan a tyrozin hydroxylázy, enzymy metabolizmu katecholaminů, dopaminu a serotoninu, prolyl-lysyl hydroxylázy a mnohé další. V těchto bílkovinách je železo vázáno jiným způsobem, zpravidla v jednodušších klastrech než ve výše uvedených skupinách. K této skupině bílkovin patří i multimerní komplex zvaný feritin.
Feritin byl purifikován a krystalizován českým fyziologem Vilémem Laufbergerem již v roce 1932. Jeho funkcí je pravděpodobně uchovávat potenciálně škodlivé železo v bezpečné formě. Zda feritin funguje jako přímá buněčná zásoba železa pro metabolické děje, nebo lze-li ho přirovnat spíše ke skládce vyhořelého jaderného paliva, je předmětem stálých sporů a nejasností.
Molekula savčího feritinu se skládá z 24 podjednotek. Protein vytváří jakousi skořápku či lasturu, která je schopna pojmout do své dutiny o průměru 80 nm více než 4 000 atomů trojmocného železa, které je vázáno ve směsi amorfní formy hydroxidu železitého (rzi) a magnetické krystalické formy magnetitu.
Železo ve feritinu je dáváno do příčinné souvislosti se vznikem neurodegenerativních chorob včetně Parkinsonovy nemoci a prionových onemocnění [9]. Prionový protein se v buňkách mozku účastní transportu železa do feritinu, jak jsme prokázali jako členové mezinárodního výzkumného týmu [10].
Jádro feritinu může mít kromě zásobní nebo „úložné“ role také jiné, dosud však neobjasněné funkce. Domény krystalického magnenitu by mohly sloužit jako nosič magnetické buněčné paměti [11,12]. Feritin je nanostruktura s vlastnostmi qubitu (základní jednotka kvantového počítače [13,14]) a tento protein možná najde využití v budoucích počítačích, které by byly založeny na fenoménech kvantové mechaniky a které by svými možnostmi daleko předčily počítače dneška. O feritinu v neuronech je známo, že má vazebná místa na mikrotubulech [15] a objevily se hypotézy, které popisují lidské vědomí jako kvantově mechanický proces probíhající v qubitech tubulinu a feritinu mozkových buněk [16]. Že by ve feritinu a tubulinu sídlila lidská duše?
Feritiny obratlovců jsou zpravidla složeny ze dvou (H a L; H – heavy, L – light) typů vysoce homologních podjednotek. V závislosti na počtu a uspořádání jednotlivých podjednotek vzniká velké množství izomerů, izoferitinů lišících se např. izoelektrickým bodem. Jaký mají tyto izoferitiny (specifické pro jednotlivé tkáně i typy nádorů) biologický význam, nebylo dosud objasněno. Kromě strukturní úlohy vykazují feritiny také funkci feroxidázovou, která je nezbytná pro tvorbu „bezpečné“, tedy trojmocné formy železa [17,18]. Ionty železa vstupují do feritinu kanály s feroxidázovou aktivitou, o mechanizmu uvolnění železa z feritinové schránky je toho známo překvapivě málo. Předpokládá se, že k uvolnění feritinového železa je nutná kompletní proteolytická degradace proteinového obalu v lyzozomech spojená se silným okyselením.
Feritin přítomný v krevní plazmě železo neobsahuje a není jasné, jakou má funkci a zda se do krve dostane aktivní sekrecí nebo pochází z rozpadlých buněk. Jeho hladiny v plazmě dobře korelují se zásobami železa v organizmu s výjimkou akutních nebo chronických zánětlivých onemocnění, kdy zvýšení feritinu přetížení železem neindikuje. Feritin je obsažen také v buněčném jádře, kde může zabraňovat tvorbě volných radikálů, fungovat při regulaci transkripce a sloužit jako zdroj železa pro ribonukleotid reduktázu a další metaloproteiny [20]. Asi 30 % buněčného feritinu je pevně vázáno na nitrobuněčné membrány, ale význam této asociace není dosud objasněn.
Za podmínek přetížení železem lze v hepatocytech objevit tzv. siderozomy – nepravidelné, někdy membránou obalené elektrodenzní shluky bohaté na železo, které vykazují reaktivitu s protilátkami proti feritinu. Podobné částice lze nalézt také v cytoplazmě makrofágů i bez přetížení železem. Tato pravděpodobně degradační podoba feritinu bývá označována jako hemosiderin. Tento fenomén je však charakterizován spíše morfologicky než biochemicky. Železo v hemosiderinu má zřejmě podobu agregátů polymerních hydroxidů železa.
Byl popsán také specifický mitochondriální feritin [19], o jehož funkcích je toho zatím známo velice málo. Ví se, že je kódován jinými geny než cytosolický feritin a že se hromadí v mitochondriích nemocných se sideroblastickými anémiemi.
Proteiny, které se účastní vstřebávání a transportu železa
Transferin je sérový monomerní glykoprotein o molekulové hmotnosti 80 kDa, který váže s velmi vysokou afinitou (Kd = 10–23 M) dva atomy trojmocného železa. Úlohou transferinu je distribuce železa mezi krví a ostatními tkáněmi exprimujícími transferinový receptor. Vazba atomů železa na transferin je závislá na pH a tato závislost je součástí mechanizmu fyziologického uvolňování železa z transferinu [21]. Transferin je součástí širší skupiny příbuzných, železo vážících bílkovin, do které dále patří ovotransferin, laktoferin a melanotransferin. Ovotransferin z vaječného bílku a laktoferin z mléka a jiných sekretů mají nejspíše funkce bakteriostatické. Membránově vázaný homolog melanotransferin (p97) se zřejmě může podílet na transportu železa do buňky, jeho fyziologická funkce však zůstává neznámá. Množství železa navázaného na transferin v extracelulární tekutině je registrováno senzorem na plazmatické membráně hepatocytů. Jde o multiproteinový komplex, u kterého byly dosud popsány bílkoviny označené jako transferinový receptor 1 a 2 (TfR1 a TfR2) a protein zvaný HFE.
Transferinový receptor
Transferinový receptor (TfR1) je transmembránový homodimerický glykoprotein o molekulové hmotnosti 180 kDa. Obě podjednotky jsou spojeny disulfidickým můstkem a každá váže jednu molekulu transferinu. Transferin nesoucí železo se na svůj receptor váže s vysokou afinitou. Podstatnou vlastností transferinového receptoru je jeho odlišná afinita pro diferický transferin, monoferický transferin a apotransferin. Disociační konstanta transferinového receptoru se udává pro diferický transferin v rozmezí Kd = 5–20 × 10–9 M, zatímco pro transferin monoferický a apotransferin je afinita receptoru 30krát, resp. 500krát nižší [22].
Po navázání transferinu nesoucího 2 atomy železa je celý komplex transferin-transferinový receptor endocytován, železo zůstává uvnitř buňky a transferin i jeho receptor jsou recyklovány z buňky ven, resp. na její povrch. V krevní plazmě lze detekovat volný transferinový receptor, který se uvolňuje především z retikulocytů přítomných v kostní dřeni a krvi exocytózou a procesem zvaným „membrane shedding“.
Byl objeven homolog transferinového receptoru označený jako TfR2 [23], který na povrchu hepatocytů slouží v komplexu s TfR1 a proteinem HFE jako senzor množství extracelulárního (na transferin navázaného) železa a podílí se na regulaci tvorby hormonu hepcidinu v hepatocytech (viz níže). Mutace v genu kódujícím TfR2 [24] byly objeveny u pacientů s hemochromatózou typu III (tab. 1).
1. Typy dědičné hemochromatózy. 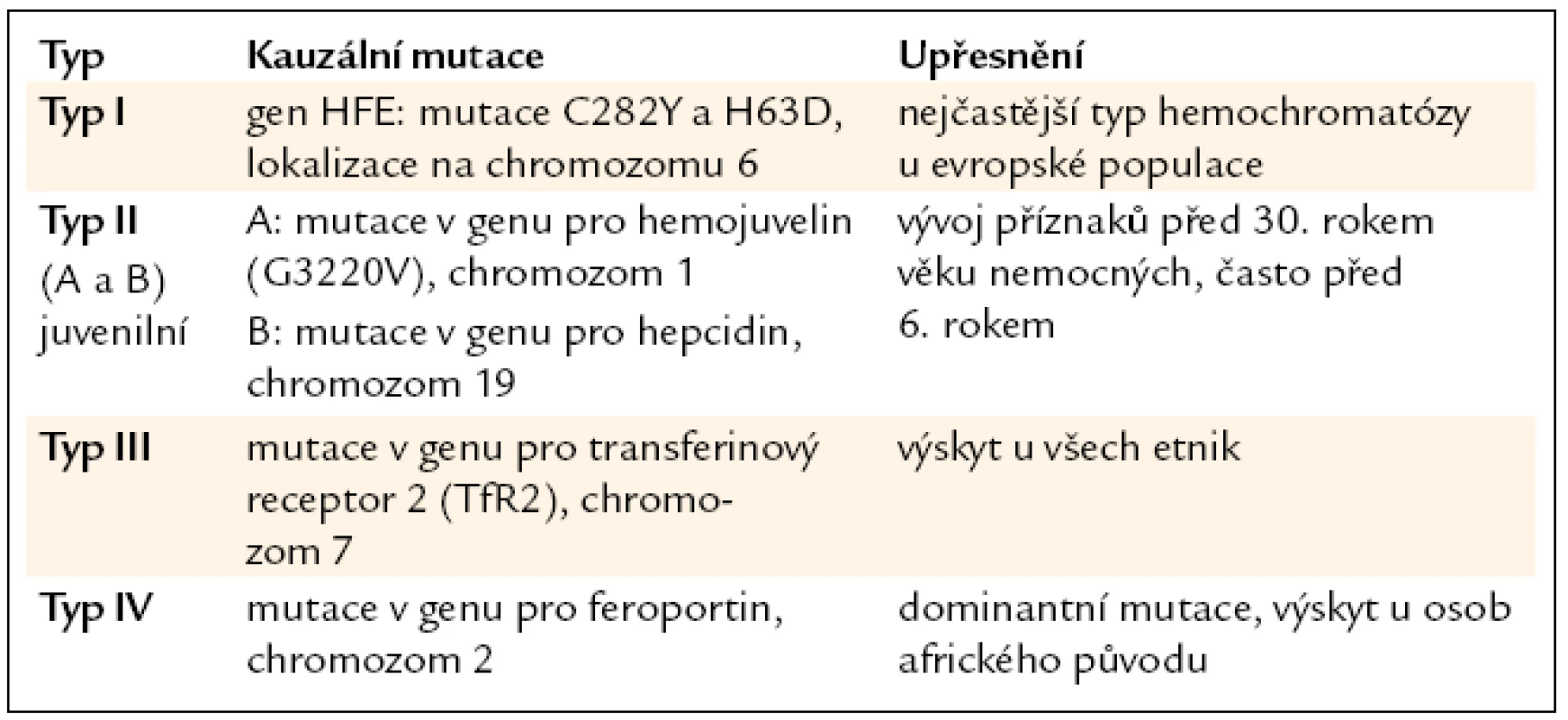
Protein HFE
Gen pro tento protein byl pozičně klonován v roce 1996 a byla identifikována jeho mutace u pacientů s primárním přetížením železem – dědičnou hemochromatózou [25]. Protein kódovaný genem HFE patří do rodiny bílkovin hlavního histokompatibilního komplexu I. třídy, a je tudíž asociován s α2-mikroglobulinem. U nemocných s hemochromatózou typu I je přítomna mutace, která toto spojení znemožňuje, a zabraňuje tak expresi tohoto komplexu na povrchu buněk [26]. Protein HFE sám železo neváže, ale bylo zjištěno, že je v plazmatické membráně hepatocytů asociován s transferinovými receptory TfR1 a TfR2 a účastní se monitorování množství železa v plazmě.
Transportér DMT1 (divalent metal transporter) je membránový přenašeč železnatých, zinečnatých a dalších divalentních kationtů, který transportuje netransferinové železo do enterocytů, ale podílí se zřejmě i na přechodu železa z endozomu do nitra jiných buněk [27–29]. Mutace genu pro tento transportér vedou k anémii z nedostatku železa [30–32].
Ceruloplazmin a hephaestin
Ceruloplazmin je monomerní sérová oxidáza známá spíše svou rolí v metabolizmu mědi [33]. Je však známo, že in vitro je tento protein schopen katalyzovat oxidaci nejen mědi, ale také dvojmocného železa [34]. Autozomálně recesivní aceruloplazminemie je onemocnění, u něhož je jedním z projevů ukládání železa v některých tkáních. Ačkoli bylo navrženo několik modelů účasti ceruloplazminu v metabolizmu železa, jeho skutečná úloha zůstává stále nejasná.
Byl také nalezen membránový homolog ceruloplazminu nazvaný hephaestin. Hephaestin je feroxidáza podílející se na exportu železa z enterocytů [35] zprostředkovaném proteinem feroportinem [36,37]. Hephaestin je mutován u sla-myši (sex-linked anemia), která trpí anémií zaviněnou defektem přenosu železa z enterocytů do cirkulace.
Feroportin
Feroportin je membránový transportér zodpovědný za export železa z některých specializovaných buněk, např. střevních enterocytů, makrofágů a hepatocytů [36,37]. Feroportin slouží zároveň jako receptor pro hormon hepcidin, po navázání hepcidinu na feroportin je celý komplex endocytován a degradován v lyzozomech. Tím dojde k zastavení výdeje železa ze zásob v hepatocytech a makrofázích a k zamezení střevní absorpce železa (obr. 4). Mutace genu kódujícího tento protein způsobují autozomálně dominantní formu hemochromatózy typu IV (tab. 1) [38].
Frataxin
Na obratu mitochondriálního železa se podílí frataxin, protein mutovaný u pacientů s Friedrichsovou ataxií. Tato bílkovina se účastní syntézy Fe/S proteinů v mitochondriích. Při mutacích v genu pro frataxin dochází k hromadění železa v mitochondriích a poškození buněk, především neuronů a kardiomyocytů [39]. Jak jsme prokázali v naší studii, defekty syntézy Fe/S klastrů vedou k porušení energetického metabolizmu v citlivých buňkách [40].
Proteiny regulující endocytózu transferinu
Pohyb endozomů obsahujících transferin/TfR je řízen řadou proteinů. Klíčovým proteinem je Sec15, jehož mutovaný gen byl pozičně klonován u anemických kmenů myší [41] a jehož úlohou je regulovat buněčný transport endozomů závislý na aktinu a myozinu.
Další bílkovinou, která se nepřímo podílí na transportu železa, je proteinová kináza MRCKα. Tato kináza je v endozomech přítomna v komplexu s transferinovým receptorem, kde reguluje příjem buněčného železa [42]. Jak jsme prokázali, exprese kinázy MRCKα ovlivňuje příjem železa buňkou a je na úrovni translace řízena množstvím buněčného železa přes tzv. „iron responsive elements“ (viz dále, [43]).
Nitrobuněčný metabolizmus železa
Do buněk lidského těla, s několika málo výjimkami, vstupuje železo navázané na transferin endocytózou zprostředkovanou transferinovým receptorem (viz obr. 1, příjem netransferinového železa je stručně zmíněn v odstavci „Netransferinové železo“). Endocytóza probíhá ve vezikulu obaleném klatrinem (clathrin coated pit). Mechanizmus, kterým se železo dostává z endozomu do cílových bílkovin, není dosud dobře popsán a je pravděpodobné, že seznam proteinů, které se na tomto procesu podílejí, zdaleka není kompletní.
Nejprve dojde ke snížení pH vnitřního prostředí endocytovaného vezikulu činností H+ATPázy. Vazba železa na transferin se v kyselém (pH = 5,5) prostředí endozomu destabilizuje a rozpustnost železa se zvýší. Víme, že transferin zůstává navázán na svůj receptor a uvolňuje se až při exocytóze [45]. Uvolněný iont nebo komplex železa tedy musí nějak překonat membránu vezikulu. Pravděpodobným transmembránovým přenašečem je DMT1 [29]. Ten ovšem transportuje pouze dvojmocné kationty, přičemž transferinové železo je trojmocné a přenosu tedy zřejmě předchází redukce železa reduktázou Steap3 [46].
Transferin zbavený železa (apotransferin) s transferinovým receptorem zůstávají v endozomu a jsou recyklovány na povrch buňky. Apotransferin tak odchází z buňky ven a transferinový receptor se opět stává součástí plazmatické membrány, a je tak připraven k novému endocytickému cyklu (obr. 1). Co se ovšem děje s iontem či komplexem železa po opuštění endozomu?
Buněčná hotovost železa aneb co je a co není LIP
Dle mnohých autorů vstupuje železo po opuštění endozomu (nebo po přímém vstupu zprostředkovaném transportérem DMT1 v případě střevní absorpce) do hypotetické, tzv. „nízkomolekulární hotovosti chelatovatelného železa“ označované zkratkou LIP (labile iron pool, free-iron pool nebo transit iron pool). Tento intermediát představovaný nestabilními komplexy železa s nějakým nízkomolekulárním ligandem (např. citrát, ATP) by měl teoreticky sloužit jako meziprodukt či zásobárna železa pro vestavbu do bílkovin. Nízkomolekulární, a tudíž cytoplazmou snadno difundující komplex železa by tak byl vhodným zdrojem železa pro následné procesy, především pro syntézu hemu v mitochondriích, vestavění železa do dalších metaloproteinů nebo pro jeho depozici do feritinu.
Na druhou stranu by takový intermediát mohl spouštět železem katalyzovanou tvorbu reaktivních volných radikálů, a představoval by tak pověstnou hořící svíčku na sudu se střelným prachem.
Přes zjevnou vnitřní logiku a půvab této hypotézy však k jejímu přijetí dosud chybí pádné experimentální důkazy. Naše podrobné kinetické studie využívající značení buněk radiotransferinem 59Fe a využívající nativní, nedenaturující separační techniky svědčí proti existenci takové nízkomolekulární hotovosti železa a navrhují alternativní model přímého vestavování železa endozomálním multiproteinovým komplexem do cílových bílkovin [47–50]. Podobný mechanizmus byl popsán pro aktivaci metaloproteinů obsahujících měď a zinek, kde je příslušný kov transportován a vestavěn do cílových míst pomocí specializovaných bílkovin – chaperonů [51]. Další studie v laboratoři prof. Přemysla Poňky pak prokázaly unikátní mechanizmus transportu železa do mitochondrií erytroidních buněk přímým kontaktem endozomů s mitochondriemi, kdy dojde k vytvoření přechodného „superkomplexu“ mnoha bílkovin předávajících si postupně iont železa z endozomu až k ferochelatáze uvnitř mitochondrií [52].
Regulace vstupu železa do buňky a jeho ukládání
Nedostatek železa může pro buňku znamenat smrt, jeho nadbytek a jím zprostředkované oxidativní poškození rovněž. Tyto okolnosti podmínily vznik účinného systému regulace vstupu železa a jeho následného bezpečného ukládání [53,54]. Celý regulační mechanizmus je popsán na posttranskripční úrovni. Podílejí se na něm specifické úseky mRNA klíčových proteinů transportu a zpracování železa a dvě RNA-vazebné bílkoviny s afinitou k těmto úsekům (obr. 2).
2. Úloha IRP1 v regulaci translace mRNA pro feritin a stability mRNA pro transferinový receptor. Za nedostatku železa se IRP1 váže na vlásenkovitou oblast označovanou jako IRE (iron responsive element) v 5’ nepřekládané oblasti (UTR) mRNA pro feritin nebo na pět kopií IRE elementu v 3’ nepřekládané oblasti mRNA pro transferinový receptor. 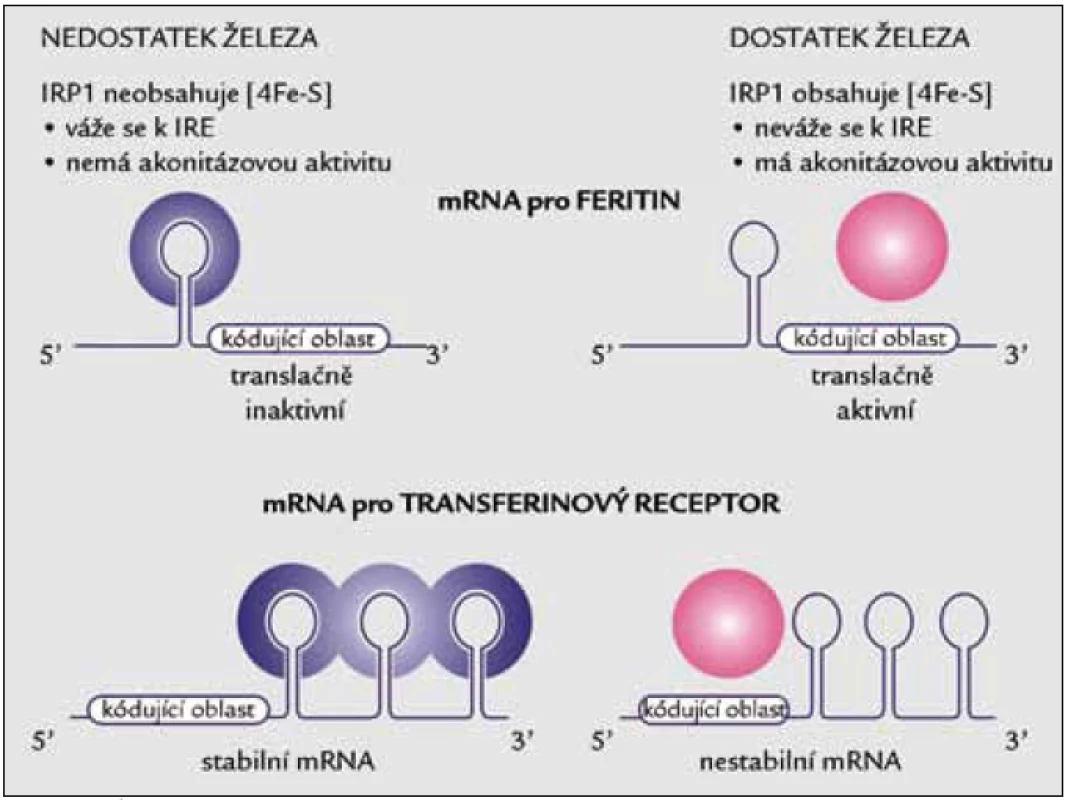
Základem celého systému je monitoring dostupného buněčného železa na základě sestavování a rozpadu Fe/S klastru cytoplazmatické akonitázy označované jako IRP1 (iron regulatory protein 1). Je-li v okolí dostupné dostatečné množství železa, je krychlový Fe/S klastr (typu 4Fe4S) proteinu IRP1 sestaven a bílkovina vykazuje akonitázovou aktivitu (konvertuje citrát přes cis-akonitát na izocitrát). Je-li ovšem železa nedostatek, kompletní Fe/S klastr nevznikne nebo je rozložen a IRP1 získává schopnost vázat se na určitou sekvenci RNA. Za nedostatku železa se tedy IRP1 specificky váže na sekvenčně specifickou vlásenkovitou oblast označovanou jako IRE (iron responsive element) v 5’ nepřekládané oblasti (UTR) mRNA pro feritin nebo na 5 kopií IRE elementu v 3’ nepřekládané oblasti mRNA pro transferinový receptor. Následkem vazby IRP na 5’ UTR v mRNA pro feritin je zabráněno připojení malé ribozomální podjednotky, a dochází tak k supresi translace tohoto proteinu. Vazba IRP na 3’ UTR mRNA transferinového receptoru vede ke zvýšení její stability, a tudíž k syntéze většího množství transferinového receptoru na úrovni bílkoviny.
Trpí-li buňka nedostatkem železa, zvyšuje expresi transferinového receptoru a snižuje množství feritinu. V případě přetížení se chová přesně obráceně – omezí vstup železa nižším počtem receptorů pro transferin a potenciálně nebezpečné železo uloží do většího množství molekul feritinu. Posttranskripční regulaci hladinami železa prostřednictvím bílkovin IRP vysvětluje obr. 2.
Stejným mechanizmem je regulována úroveň exprese erytroidně specifické δ-aminolevulinát syntázy (e-ALAS), esenciálního enzymu v dráze syntézy hemu. Její IRE jsou lokalizovány podobně jako u feritinu v 5’ UTR, a je tedy nedostatkem železa suprimována. Rovněž mRNA pro jednu z forem proteinu DMT1 nese ve své 3’ UTR IRE sekvenci a mRNA pro exportér železa – feroportin – má IRE element v 5’ nepřekládané oblasti, podobně jako kináza MRCKα [43].
Kromě IRP1 se v savčích buňkách vyskytuje vysoce homologní protein IRP2 [53,54], který má stejnou RNA vazebnou aktivitu, ta však na rozdíl od IRP1 není regulována na úrovni sestavování Fe/S klastru proteolýzou IRP2 indukovanou zvýšenými hladinami železa.
Absorpce a recyklace železa
Celkové množství železa v těle zdravého člověka se pohybuje v rozmezí 3,5–4,5 g. Obrat železa v organizmu je znázorněn na obr. 3.
3. Příjem, ztráty distribuce a recyklace železa v lidském těle. Denní ztráty 1–2 mg železa jsou vyrovnávány střevní absorpcí. Celkový denní tělový obrat železa je asi 20 mg, denně je recyklováno asi 0,8 % cirkulujících erytrocytů. Přestárlý erytrocyt je pohlcen makrofágem, jeho železo je uvolněno do cirkulace. Přerušovaná čára naznačuje neefektivní erytropoézu – situaci, kdy většina erytrocytů není uvolněna do cirkulace a podléhá v kostní dřeni apoptóze. 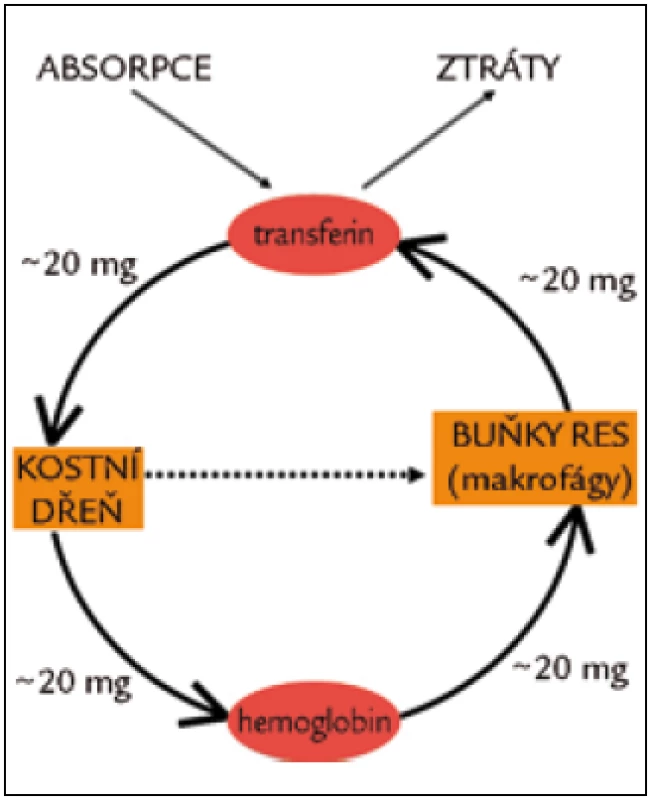
Vstřebávání železa představuje protiváhu jeho denním ztrátám způsobeným odlupováním epitelů a krvácením (Jinými způsoby organizmus železo nemůže vyloučit). Denně člověk ztratí a znovu z potravy vstřebá asi 1 mg železa. Jeho hlavním zdrojem jsou bílkoviny vážící železo – hemové i nehemové proteiny. Hemové železo je absorbováno z potravy účinněji než nehemové, až 2/3 železa v lidském těle pocházejí z absorpce hemového železa, přestože hem představuje pouze 1/3 železa v běžné stravě [56].
V trávenině v kyselém prostředí žaludku dojde ke zvýšení rozpustnosti železa, k narušení stability vazeb mezi nehemovým železem a jeho ligandy a ke změně jeho distribuce vzhledem k ligandům. K další změně rozpustnosti a distribuce železa dojde po neutralizaci tráveniny sekretem pankreatu v duodenu a navázáním na muciny na povrchu kartáčového lemu enterocytů. Co je tedy ve skutečnosti ligandem/ligandy nehemového železa v okamžiku před jeho vstupem do enterocytu, nevíme.
Železo je absorbováno v duodenu a proximální části tenkého střeva. Nehemové železo vstupuje do enterocytů přenašečem DMT1 [27], transportu však předchází redukce na dvojmocný kationt zprostředkovaná dosud neznámou reduktázou.
Mechanizmus vstřebávání hemového železa je jiný než u železa nehemového, ale není dosud uspokojivě popsán. Hemové železo vstupuje do enterocytů jako intaktní hem či hemin. Předpokládá se však přítomnost hemového receptoru nebo transportéru na povrchu enterocytů [55]. Takový protein však dosud nebyl nalezen. Uvnitř buňky je hem rozštěpen hemoxygenázou a železo je dále zpracováváno stejně jako železo nehemové [55,56].
Jakým mechanizmem se železo, ať již původně hemové, či nehemové, dostává dále do krevního oběhu, není dosud přesně známo, ale na jeho exportu z buňky se zřejmě podílejí nedávno popsané bílkoviny feroportin a hephaestin. Nakonec se však železo objeví v cirkulaci navázané na transferin a připravené k distribuci do tkání, např. do kostní dřeně.
Železo přicházející z enterocytů však představuje pouze několik procent denního obratu sérového transferinového železa. Většinu železa totiž transferin získává „z recyklace“ od makrofágů retikuloendoteliálního systému, kde jsou degradovány na konci svého života erytrocyty a další buňky, a rovněž z hepatocytů (obr. 3, 4).
4. Vliv hepcidinu na export železa z hepatocytů, enterocytů a makrofágů. A. Železo přítomné v trávenině je přeneseno do enterocytů transportérem pro Fe<sup>2+</sup> (DMT1). Z enterocytů je železo exportováno feroportinem, poté se naváže na apotransferin v extracelulární tekutině. V makrofázích a hepatocytech je železo uvolněno z feritinu a exportováno feroportinem ven z buněk, kde je opět navázáno na apotransferin. B. Hepcidin se váže na feroportin na buněčném povrchu. Tato vazba spustí internalizaci komplexu hepcidin-feroportin a následnou degradaci komplexu hepcidin-feroportin v lysozomech. Tímto je zablokován export železa z enterocytů (absorpce z potravy), hepatocytů a makrofágů (uvolnění železa z feritinových zásob). Železo navázané na transferin v krevní plazmě je rychle odčerpáno syntézou hemu v kostní dřeni, a tak dojde rychle k poklesu saturace plazmatického transferinu. 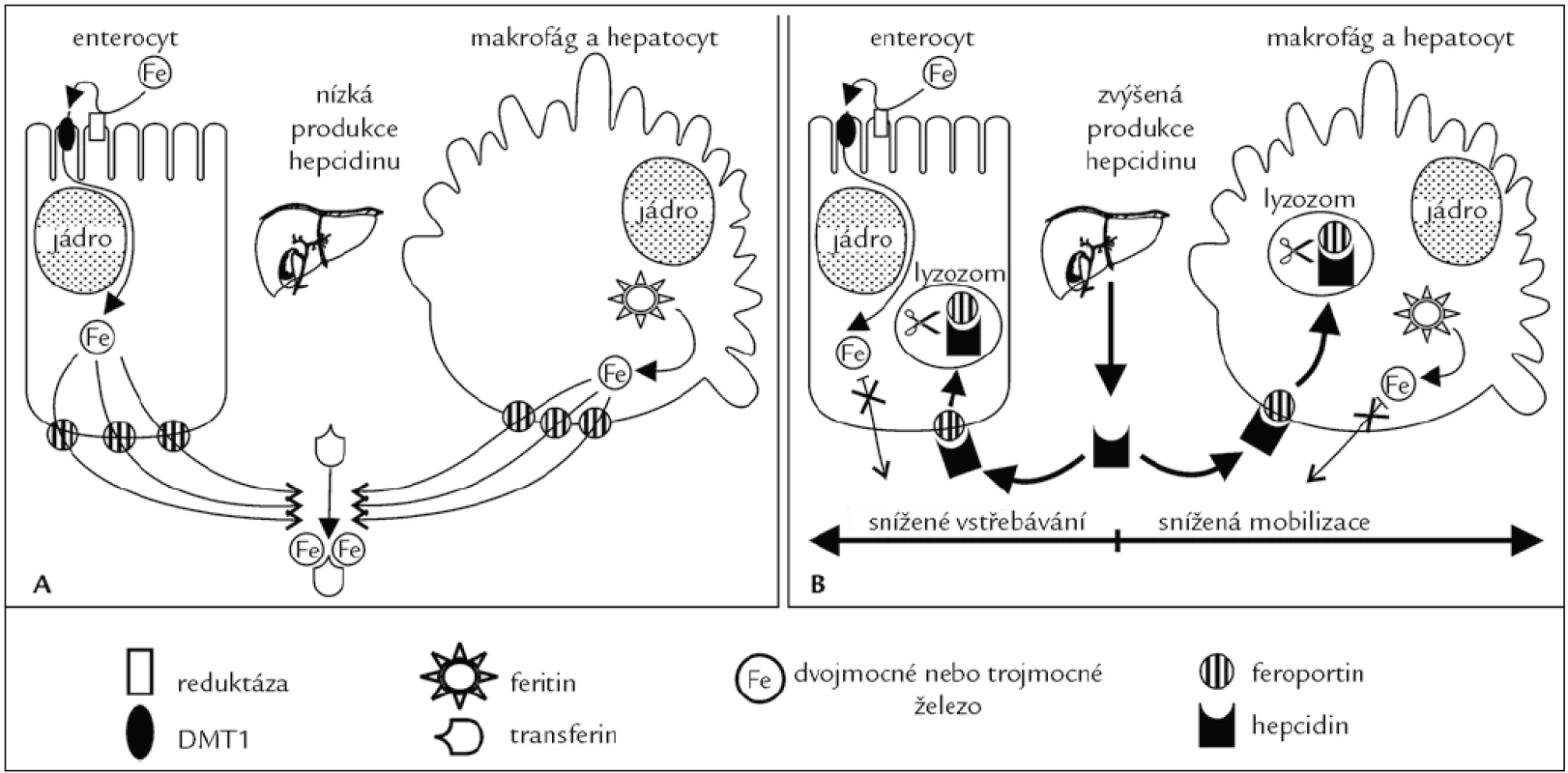
Netransferinové železo
Za fyziologických podmínek je veškeré sérové železo vázáno na transferin, který je saturován zhruba z 30 %. Při přetížení organizmu železem však může být saturace transferinu absolutní a v séru se může objevit tzv. netransferinové železo (NTBI – non-transferrin bound iron) v koncentracích až 5–15 µM [58]. Přítomnost tohoto fenoménu byla poprvé demonstrována u pacientů s přetížením organizmu železem vzniklým v důsledku četných transfuzí [59]. Některé odborné práce udávají přítomnost NTBI i při neúplné saturaci transferinu [60]. Za potenciální nosič tohoto netransferinového sérového železa byl označen citrát [61]. Vzhledem k relativně nízké koncentraci citrátu v séru oproti jiným molekulám schopným komplexovat železo (především aminokyselinám) však toto tvrzení vyžaduje další experimentální důkazy.
O mechanizmu vstupu netransferinového železa do buňky je doposud známo jen velmi málo. Mnoho typů buněk je schopno přijímat železo z nízkomolekulárních komplexů [např. citrát-Fe, askorbát-Fe, citrát železito-amonný, NTA-Fe (kyselina nitriltrioctová)] in vitro [62]. Experimenty s těmito nízkomolekulárními komplexy naznačují existenci specifického saturovatelného příjmu netransferinového železa [63–65].
Část železa vázaného na nízkomolekulární ligandy může být rovněž přijímána nespecificky, např. ve fluidní fázi endocytózy nebo pinocytózou. Význam příjmu železa z netransferinových donorů in vivo však zůstává značně spekulativní.
U člověka a ostatních obratlovců je celkové množství železa řízeno peptidovým hormonem hepcidinem (hepar × cidin = antimikrobiální molekula produkovaná v játrech). Jak tomu bývá u opravdových objevů, byla cesta k nalezení úlohy hepcidinu spletitá. Hepcidin byl původně objeven [66,67] při studiu defenzinů, peptidů přirozené imunity. S těmito molekulami má hepcidin některé společné chemické vlastnosti a antimikrobiální aktivitu. Při bližším zkoumání bylo však zjištěno, že po vyřazení genu pro hepcidin zvířata trpěla přetížením organizmu železem – hemochromatózou [68]. Tento nález naznačoval, že hepcidin hraje důležitou roli v regulaci homeostázy železa. Koncepce byla potvrzena v jiném experimentu, kde nadprodukce hepcidinu vyvolala u transgenních myší těžké anémie [69]. Nedlouho potom popsali Roetto et al inaktivující mutace v lidském genu pro hepcidin ve 2 rodinách, jejichž členové trpěli vzácnou formou tzv. juvenilní hemochromatózy [70].
Hepcidin je syntetizován především v játrech. Úroveň exprese je řízena jako odpověď na celkové množství železa v organizmu, hypoxii, anémii a zánět. Z jaterních buněk je tato molekula uvolněna jako peptid o 84 aminokyselinách, který je později štěpen na peptidy o 25, 22 a 20 aminokyselinách označovaných společným názvem hepcidin. Funkční význam variant hepcidinu není znám. Hepcidin se váže na povrchu cílových buněk (enterocyty, hepatocyty a makrofágy) na receptor, kterým je exportér železa – feroportin (obr. 4). Po navázání je komplex hepcidin-feroportin endocytován a degradován v lyzozomech. Protože feroportin slouží jako transmembránový kanál pro dvojmocné železo, omezí se tímto mechanizmem vstřebávání železa (enterocyty) a jeho přesuny ze zásobáren (hepatocyty, makrofágy) do krevní plazmy a poklesne saturace plazmatického transferinu (obr. 4). Je-li železa nedostatek, produkce hepcidinu se naopak sníží. Hepcidin tedy funguje jako negativní regulátor vstřebávání a recyklace železa.
Hepcidin se podílí na patogenezi anémie chronických onemocnění. Při těchto stavech vedou zvýšené hladiny hepcidinu k přesunu cirkulujícího železa do hepatocytů a makrofágů. Tento mechanizmus se považuje za faktor přirozené imunity, kterým se omezí dostupnost železa v extracelulární tekutině pro invadující mikroorganizmy. Pokles koncentrace plazmatického železa pak vede k omezení syntézy hemu v erytroblastech a k anémii.
V posledních 10 letech byly odhaleny základní regulační mechanizmy ovlivňující expresi hepcidinu (obr. 5). V genech některých bílkovin, které se na těchto regulačních mechanizmech u člověka podílejí, byly nalezeny mutace vedoucí k dědičnému přetížení železem – hemochromatóze. Proteiny, jejichž geny jsou při hemochromatóze mutovány (tab. 1), jsou buď součástí signální dráhy, která ovlivňuje expresi hepcidinu (např. protein hemojuvelin), nebo součástí senzoru pro extracelulární železo (transferinový receptor 2), nebo slouží jako receptor pro hepcidin (feroportin). Mutován může být i gen pro samotný hepcidin.
5. Regulace exprese hepcidinu. Syntéza hepcidinu je ovlivňována množstvím železa v hepatocytech, hypoxií, úrovní erytropoezy a zánětovými signály. Zásoby buněčného železa ovlivňují dosud neznámým mechanizmem syntézu a uvolnění mediátorů exprese hepcidinu – bone morphogenic proteins (BMPs), zejména BMP6 a sestavení membránového komplexu, který obsahuje receptory BMPR I a II se serintreonin kinázovou aktivitou. Vazba BMP6 na tyto receptory aktivuje signální kaskádu, která zahrnuje fosforylaci cytozolické druhých poslů – proteinů SMAD1, SMAD5 a SMAD8 a jejich translokaci do buněčného jádra, kde aktivují transkripce genu pro hepcidin. Dalšími bílkovinami, které se uplatňují v regulaci syntézy hepcicinu, jsou neogenin a hemojuvelin. Neogenin se váže na hemojuvelin, stabilizuje jej a pomáhá v jeho odštěpení od membrány. Odštěpení hemojuvelinu je zprostředkováno proteázou TMPRSS6 a regulováno železem. Solubilní hemojuvelin (sHJV) pak soutěží s BMP6 o vazbu na signální komplex receptorových kináz (BMPR I a II), a snižuje tak produkci hepcidinu. Hemojuvelin je tak negativním regulátorem hepcidinu, podobně jako SMAD7 a proteáza TMPRSS6. Signály pro syntézu hepcidinu poskytuje také množství transferinového železa v krevní plazmě. Senzorem je komplex transferinových receptorů TfR1, TfR2 s proteinem HFE na membráně hepatocytu, které v závislosti na množství extracelulárního železa předávají do buněčného jádra signál k syntéze hepcidinu. Expresi hepcidinu dále ovlivňují mediátory zánětu, zejména interleukin 6 (IL-6), který stimuluje syntézu hepcicinu prostřednictvím signálního proteinu STAT3. Syntéza hepcidinu je dále stimulována, pokud je metabolizmus hepatocytu patologicky vystupňován. K tomu dochází např. při všech typech zánětů jater, cirhóze a alkoholizmu, tento stav je označován jako stres endoplazmatického retikula. Za těchto okolností se z endoplazmatického retikula hepatocytů uvolní signální bílkovina c-AMP responsive element binding protein H (CREBH), který v jádře aktivuje transkripci hepcidinového genu. Mezi inhibiční signály pro syntézu hepcidinu patří senzor buněčného kyslíku – hypoxia inducible factor (HIF), erytropoietin (Epo) a dále signály, vypovídající o úrovni erytropoézy. Povaha těchto signálů není v současnosti přesně známa, ale předpokládá se, že plazmatické hladiny 2 proteinů – growth differentiation factor 15 (GDF15) a twisted gastrulation protein homolog 1 (TWSG1) – jsou nějakým způsobem spjaty s úrovní erytropoézy v kostní dřeni. Obrázek převzat se svolením [90]. ![Regulace exprese hepcidinu.
Syntéza hepcidinu je ovlivňována množstvím železa v hepatocytech, hypoxií, úrovní erytropoezy a zánětovými signály. Zásoby buněčného železa ovlivňují dosud neznámým mechanizmem syntézu a uvolnění mediátorů exprese hepcidinu – bone morphogenic proteins (BMPs), zejména BMP6 a sestavení membránového komplexu, který obsahuje receptory BMPR I a II se serintreonin kinázovou aktivitou.
Vazba BMP6 na tyto receptory aktivuje signální kaskádu, která zahrnuje fosforylaci cytozolické druhých poslů – proteinů SMAD1, SMAD5 a SMAD8 a jejich translokaci do buněčného jádra, kde aktivují transkripce genu pro hepcidin.
Dalšími bílkovinami, které se uplatňují v regulaci syntézy hepcicinu, jsou neogenin a hemojuvelin. Neogenin se váže na hemojuvelin, stabilizuje jej a pomáhá v jeho odštěpení od membrány. Odštěpení hemojuvelinu je zprostředkováno proteázou TMPRSS6 a regulováno železem. Solubilní hemojuvelin (sHJV) pak soutěží s BMP6 o vazbu na signální komplex receptorových kináz (BMPR I a II), a snižuje tak produkci hepcidinu. Hemojuvelin je tak negativním regulátorem hepcidinu, podobně jako SMAD7 a proteáza TMPRSS6.
Signály pro syntézu hepcidinu poskytuje také množství transferinového železa v krevní plazmě. Senzorem je komplex transferinových receptorů TfR1, TfR2 s proteinem HFE na membráně hepatocytu, které v závislosti na množství extracelulárního železa předávají do buněčného jádra signál k syntéze hepcidinu. Expresi hepcidinu dále ovlivňují mediátory zánětu, zejména interleukin 6 (IL-6), který stimuluje syntézu hepcicinu prostřednictvím signálního proteinu STAT3.
Syntéza hepcidinu je dále stimulována, pokud je metabolizmus hepatocytu patologicky vystupňován. K tomu dochází např. při všech typech zánětů jater, cirhóze a alkoholizmu, tento stav je označován jako stres endoplazmatického retikula. Za těchto okolností se z endoplazmatického retikula hepatocytů uvolní signální bílkovina c-AMP responsive element binding protein H (CREBH), který v jádře aktivuje transkripci hepcidinového genu. Mezi inhibiční signály pro syntézu hepcidinu patří senzor buněčného kyslíku – hypoxia inducible factor (HIF), erytropoietin (Epo) a dále signály, vypovídající o úrovni erytropoézy. Povaha těchto signálů není v současnosti přesně známa, ale předpokládá se, že plazmatické hladiny 2 proteinů – growth differentiation factor 15 (GDF15) a twisted gastrulation protein homolog 1 (TWSG1) – jsou nějakým způsobem spjaty s úrovní erytropoézy v kostní dřeni. Obrázek převzat se svolením [90].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/a174cd0c05aa6dbfd6d0cc1c16177873.jpg)
Kromě jater je hepcidin syntetizován řadou dalších tkání. V žaludku ovlivňuje jeho parakrinní produkce sekreci gastrinu a kyseliny chlorovodíkové, což má vliv na uvolňování železa z metaloproteinů v potravě. Lokální syntéza hepcidinu je v žaludku stimulována např. při infekci Helicobacter pylori, což je považováno za obranný mechanizmus [71]. Hepcidin je dále lokálně produkován buňkami výstelky žlučových cest, kde působí antimikrobiálně [72], β buňkami Langerhansových ostrůvků v pankreatu [73] a řadou dalších tkání včetně srdce a mozku. Význam autokrinní a parakrinní produkce hepcidinu v různých tkáních, včetně možného ovlivnění metabolizmu železa u buněk nádorů, není prozkoumán. Kromě bezprostředního vlivu na metabolizmus železa je hepcidin dáván do souvislosti s patofyziologií řady chorob, např. aterosklerózy a infarktu myokardu [74,75], zánětů jater a cirhózy [76], malárie [3] a septického šoku [77]. Hepcidin je rovněž považován za biomarker chronické obstrukční bronchopulmonární choroby [78] a některých typů nádorů.
Hepcidin reguluje metabolizmus železa, který díky tomu, že je železo nezbytné pro velké množství metabolických pochodů, zase ovlivňuje fyziologické procesy i patofyziologii mnoha chorobných stavů. Předpokládá se proto (a patentové spisy přetékají obsáhlými seznamy chorob, viz např. patent WO 2009/139822 A1), že měření hladin hepcidinu a podávání samotného hepcidinu či jeho agonistů a antagonistů bude mít v budoucnu značný diagnostický i terapeutický význam [79,80]. Nejblíže praktickému využití je ovlivňování dráhy hepcidinu zřejmě u některých typů anémií, kde by mohlo pomoci v léčbě anémie z nedostatku železa, anémie u myelodysplastického syndromu (nízké hladiny hepcidinu) a anémií u chronických onemocnění (vysoké hladiny hepcidinu) [81]. Teoreticky by totiž bylo možné provádět substituční terapii syntetickým hepcidinem nebo stimulovat jeho expresi (u myelodysplastického syndromu a anémií s potransfuzním přetížením železem) nebo naopak snižovat množství či aktivitu hepcidinu, např. podáváním monoklonální antihepcidinové protilátky nebo látek tlumících produkci hepcidinu [82,83] u anémií u chronických chorob a anémií u renálních onemocnění.
Přestože je k měření koncentrací hepcidinu v tělních tekutinách k dispozici několik komerčních kitů, chybí dosud referenční hodnoty a naměřené koncentrace se u jednotlivých metod výrazně liší [84]. Zdá se, že referenční metodou bude měření pomocí hmotnostní spektrometrie [84], neboť většina imunologických metod není schopna spolehlivě měřit vázaný hepcidin, který je v krvi, jak jsme ukázali v naší práci, přítomen v komplexu s α2-makroglobulinem [85]. Význam této interakce (kromě ovlivnění stability hepcidinu v krvi a prevence glomerulární filtrace) pravděpodobně spočívá v rozdílných interakcích volného a vázaného hepcidinu s cílovými receptory.
Zajímavý je vztah hepcidinu a metabolizmu železa k biologii nádorových buněk. Již dlouhou dobu je známo, že nádorové buňky mají oproti normálním tkáním podstatně vyšší požadavky na příjem železa [86]. Povaha tohoto jevu ani charakter sloučenin, ve kterých je železo v nádorových buňkách vázáno, nejsou přesně známy. Má se ale za to, že čím je obsah železa v buňkách větší, tím více vzniká železem katalyzovaných volných radikálů, které atakují všechny buněčné molekulární komponenty, zvyšují četnost mutací a zvětšují maligní potenciál buněk. Nedávno dostala tato pozorování nový impulz, když se zjistilo, že u karcinomů prsu existuje silná korelace mezi invazivitou, šířením metastáz, prognózou pacientek a expresí feroportinu a hepcidinu buňkami tumoru [87,88]. Agresivní a metastazující nádory mají nižší hladinu feroportinu a vyšší hladinu hepcidinu než nádory nemetastazující a s dobrou prognózou. Tyto výsledky tedy podporují představu, že hepcidinem indukované degradace exportéru buněčného železa – feroportinu – vedou k „uzamčení“ železa v buňkách, k vystupňované produkci volných radikálů a hromadění genetických defektů. Skutečnosti, že nádorové buňky hromadí železo, by bylo možné využít pro novou třídu cytostatik – specifických chelátorů železa – které by vyvazovaly tento kov jen v nádorových buňkách nebo indukovaly cytotoxické volné radikály [89].
Přestože od objevu hepcidinu v roce 2002 bylo nashromážděno mnoho nových informací o působení a patofyziologických souvislostech tohoto hormonu, zůstává stále mnoho nejasného. Je feroportin jediným receptorem pro hepcidin? Vyvolává hepcidin změny genové exprese podobně jako většina jiných hormonů? Jaký je význam lokální produkce hepcidinu mimo jaterní tkáň? Jaký význam má autokrinní a parakrinní sekrece hepcidinu? Jaký je vztah hepcidinu, feroportinu a železa k biologii nádorových buněk?
Výzkum hepcidinu a jeho vlivu na metabolizmus železa přinese v budoucnu jistě nejedno překvapení.
Nezbytnost železa pro život všech organizmů, jeho účast v neobyčejném množství biochemických drah a na druhé straně jeho schopnost poškozovat buňku volnými radikály a podílet se na patogenezi mnoha závažných onemocnění, to vše dohromady činí z tohoto kovu objekt prvořadé fyziologické důležitosti hodný intenzivního vědeckého zájmu.
Poděkování
Autoři děkují prof. MUDr. Přemyslu Poňkovi a MUDr. Antonínu Hradílkovi za uvedení do popisované problematiky a poskytnutí mnohaleté výzkumné inspirace. Dále autoři děkují prof. MUDr. Alexi Sheftelovi, prof. MUDr. Přemyslu Poňkovi a prof. MUDr. Antonellu Pietrangellovi za souhlas s uveřejněním obrázků.
Tento článek byl uveřejněn s podporou Ústavního záměru ÚHKT, grantu GAČR 305/09/1390, programu PRVOUK P24/LF1/3 (1.LF UK, MOLMED) a grantu ERDF OPPK CZ.2.16/3.1.00/24001.
doc. MUDr. Daniel Vyoral, CSc.
www.uhkt.cz
e-mail: vyoral@uhkt.cz
Doručeno do redakce: 15. 5. 2012
Sources
1. Sheftel AD, Mason AB, Ponka P. The long history of iron in the Universe and in health and disease. Biochim Biophys Acta 2012; 1820 : 161–187.
2. Wächtershäuser G. On the chemistry and evolution of the pioneer organism. Chem Biodivers 2007; 4 : 584–602.
3. Prentice AM. Hepcidin and iron-mediated resistance to malaria. EMBO Mol Med 2011; 3 : 620–622.
4. McCord JM. Iron, free radicals, and oxidative injury. Semin Hematol 1998; 35 : 5–12.
5. Britton RS, Ramm GA, Olynyk J et al. Pathophysiology of iron toxicity. Adv Exp Med Biol 1994; 356 : 239–253.
6. Ponka P. Tissue-specific regulation of iron metabolism and heme synthesis: distinct control mechanisms in erythroid cells. Blood 1997; 89 : 1–25.
7. Babusiak M, Man P, Sutak R et al. Identification of heme binding protein complexes in murine erythroleukemic cells: study by a novel two-dimensional native separation – liquid chromatography and electrophoresis. Proteomics 2005; 5 : 340–350.
8. Rouault TA. Biogenesis of iron-sulfur clusters in mammalian cells: new insights and relevance to human disease. Dis Model Mech 2012; 5 : 155–164.
9. Friedman A, Arosio P, Finazzi D et al. Ferritin as an important player in neurodegeneration. Parkinsonism Relat Disord 2011; 17 : 423–430.
10. Singh A, Mohan ML, Isaac AO et al. Prion protein modulates cellular iron uptake: a novel function with implications for prion disease pathogenesis. PLoS One 2009; 4: e4468.
11. Størmer FC, Wielgolaski FE. Are magnetite and ferritin involved in plant memory? Rev Environ Sci Biotechnolo 2010; 9 : 105–107.
12. Størmer FC, Mysterud I, Slaqsvold T et al. Evolution and possible storage of information in a magnetite system of significance for brain development. Med Hypotheses 2011; 76 : 901–904.
13. Tejada JA. Does macroscopic quantum coherence occur in ferritin? Science 1996; 272 : 424–426.
14. Choi SH, Kim JW, Chu SH et al. Ferritin--Templated Quantum-Dots for Quantum Logic Gates. 12th SPIE International Symposium on Smart Structures and Smart Materials San Diego. California 2005 : 3.6–3.10.
15. Hasan MR, Koikawa S, Kotani S et al. Ferritin forms dynamic oligomers to associate with microtubules in vivo: implication for the role of microtubules in iron metabolism. Exp Cell Res 2006; 312 : 1950–1960.
16. Hagan S, Hameroff SR, Tuszyński JA. Quantum computation in brain microtubules: decoherence and biological feasibility. Phys Rev E Stat Nonlin Soft Matter Phys 2002; 65 : 061901.
17. Harrison PM, Arosio P. The ferritins: molecular properties, iron storage function and cellular regulation. Biochim Biophys Acta 1996; 1275 : 161–203.
18. Chasteen ND. Ferritin. Uptake, storage, and release of iron. Metal Ions Biol Syst 1998; 35 : 479–514.
19. Levi S, Corsi B, Bosisio M et al. A human mitochondrial ferritin encoded by an intronless gene. J Biol Chem 2001; 276 : 24437–24440.
20. Alkhateeb AA, Connor JR. Nuclear ferritin: a new role for ferritin in cell biology. Biochim Biophys Acta 2010; 1800 : 793–797.
21. Richardson DR, Ponka P et al. The molecular mechanisms of the metabolism and transport of iron in normal and neoplastic cells. Biochim Biophys Acta 1997; 1331 : 1–40.
22. Young SP, Bomford A, Williams R et al. The effect of the iron saturation of transferrin on its binding and uptake by rabbit reticulocytes. Biochem J 1984; 219 : 505–510.
23. Kawabata H, Yang R, Hirama T et al. Molecular cloning of transferrin receptor 2. A new member of the transferrin receptor-like family. J Biol Chem 1999; 274 : 20826–20832.
24. Camaschella C, Roetto A, Calì A et al. The gene TFR2 is mutated in a new type of haemochromatosis mapping to 7q22. Nat Genet 2000; 25 : 14–15.
25. Feder JN, Gnirke A, Thomas W et al. A novel MHC class I-like gene is mutated in patients with hereditary haemochromatosis. Nat Genet 1996; 13 : 399–408.
26. Feder JN, Tsuchihashi Z, Irrinki A et al. The hemochromatosis founder mutation in HLA-H disrupts beta2-microglobulin interaction and cell surface expression. J Biol Chem 1997; 272 : 14025–14028.
27. Gunshin H, Mackenzie B, Berger UV et al. Cloning and characterization of a mammalian proton-coupled metal-ion transporter. Nature 1997; 388 : 482–488.
28. Cannone-Hergaux F, Gruenheid S, Ponka P et al. Cellular and subcellular localization of the Nramp2 iron transporter in the intestinal brush border and regulation by dietary iron. Blood 1999; 12 : 4406–4417.
29. Gruenheid S, Canonne-Hergaux F, Gauthier S et al. The iron transport protein NRAMP2 is an integral membrane glycoprotein that colocalizes with transferrin in recycling endosomes. J Exp Med 1999; 189 : 831–841.
30. Fleming MD, Romano MA, Su MA et al. Nramp2 is mutated in the anemic Belgrade (b) rat: evidence of a role for Nramp2 in endosomal iron transport. Proc Natl Acad Sci USA 1998; 95 : 1148–1153.
31. Fleming MD, Trenor CC 3rd, Su MA et al. Microcytic anaemia mice have a mutation in Nramp2, a candidate iron transporter gene. Nat Genet 1997; 16 : 383–386.
32. Mims MP, Guan Y, Pospisilova D et al. Identification of a human mutation of DMT1 in a patient with microcytic anemia and iron overload. Blood 2005; 105 : 1337–1342.
33. Mukhopadhyay CK, Attieh ZK, Fox PL et al. Role of ceruloplasmin in cellular iron uptake. Science 1998; 279 : 714–717.
34. Harris ZL, Durley AP, Man TK et al. Targeted gene disruption reveals an essential role for ceruloplasmin in cellular iron efflux. Proc Natl Acad Sci USA 1999; 96 : 10812–10817.
35. Vulpe CD, Kuo YM, Murphy TL et al. Hephaestin, a ceruloplasmin homologue implicated in intestinal iron transport, is defective in the sla mouse. Nat Genet 1999; 21 : 195–199.
36. Donovan A, Brownlie A, Zhou Y et al. Positional cloning of zebrafish ferroportin1 identifies a conserved vertebrate iron exporter. Nature 2000; 403 : 776–781.
37. McKie AT, Marciani P, Rolfs A et al. A novel duodenal iron-regulated transporter, IREG1, implicated in the basolateral transfer of iron to the circulation. Mol Cell 2000; 5 : 299–309.
38. Njajou OT, Vaessen N, Joosse M et al. A mutation in SLC11A3 is associated with autosomal dominant hemochromatosis. Nat Genet 2001; 28 : 213–214.
39. Patel PI, Isaya G. Friedreich ataxia: from GAA triplet-repeat expansion to frataxin deficiency. Am J Hum Genet 2001; 69 : 15–24.
40. Sutak R, Xu X, Whitnall M et al. Proteomic analysis of hearts from frataxin knockout mice: marked rearrangement of energy metabolism, a response to cellular stress and altered expression of proteins involved in cell structure, motility and metabolism. Proteomics 2008; 8 : 1731–1741.
41. Lim JE, Jin O, Bennett C et al. A mutation in Sec15l1 causes anemia in hemoglobin deficit (hbd) mice. Nat Genet 2005; 37 : 1270–1273.
42. Cmejla R, Ptackova P, Petrak J et al. Human MRCKalpha is regulated by cellular iron levels and interferes with transferrin iron uptake. Biochem Biophys Res Commun 2010; 395 : 163–167.
43. Cmejla R, Petrak J, Cmejlova J. A novel iron responsive element in the 3‘UTR of human MRCKalpha. Biochem Biophys Res Commun 2006; 341 : 158–166.
44. Heikkila T, Wheatley E, Crighton D et al. Co-crystal structures of inhibitors with MRCKβ, a key regulator of tumor cell invasion. PLoS One 2011; 6: e24825.
45. Aisen P. Transferrin, the transferrin receptor, and the uptake of iron by cells. Metal Ions Biol Syst 1998; 35 : 585–631.
46. Knutson MD. Steap proteins: implications for iron and copper metabolism. Nutr Rev 2007; 65 : 335–340.
47. Vyoral D, Hradilek A, Neuwirt J. Transferrin and iron distribution in subcellular fractions of K562 cells in the early stages of transferrin endocytosis. Biochim Biophys Acta 1992; 137 : 148–154.
48. Richardson DR, Ponka P, Vyoral D. Distribution of iron in reticulocytes after inhibition of heme synthesis with succinylacetone: examination of the intermediates involved in iron metabolism. Blood 1996; 87 : 3477–3488.
49. Vyoral D, Petrák J. Iron transport in K562 cells: a kinetic study using native gel electrophoresis and 59Fe autoradiography. Biochim Biophys Acta 1998; 1403 : 179–188.
50. Petrák JV, Vyoral D. Detection of iron-containing proteins contributing to the cellular labile iron pool by the native electrophoresis metal blotting technique. J Inorg Biochem 2001; 86 : 669–675.
51. O’Halloran TV, Culotta VC. Metallochaperones, an intracellular shuttle service for metal ions. J Biol Chem 2000; 275 : 25057–25060.
52. Sheftel AD, Zhang AS, Brown C et al. Direct interorganellar transfer of iron from endosome to mitochondrion. Blood 2007; 110 : 125–132.
53. Theil CE. The iron responsive element (IRE) family of mRNA regulators. Regulation of iron transport and uptake compared in animals, plants, and microorganisms. Met Ions Biol Syst 1998; 35 : 403–434.
54. Ponka P, Beaumont C, Richardson DR. Function and regulation of transferrin and ferritin. Semin Hematol 1998; 35 : 35–54.
55. Uzel C, Conrad ME. Absorption of heme iron. Semin Hematol 1998; 35 : 27–34.
56. Worthington MT, Cohn SM, Miller SK et al. Characterization of a human plasma membrane heme transporter in intestinal and hepatocyte cell lines. Am J Physiol Gastrointest Liver Physiol 2001; 280: G1172–G1177.
57. Fleming RE, Sly WS. Hepcidin: a putative iron-regulatory hormone relevant to hereditary hemochromatosis and the anemia of chronic disease. Proc Natl Acad Sci USA 2001; 98 : 8160–8162.
58. Hershko C, Peto TE. Non-transferrin plasma iron. Br J Haematol 1987; 66 : 149–151.
59. Hershko C, Graham G, Bates GW et al. Non--specific serum iron in thalassaemia: an abnormal serum iron fraction of potential toxicity. Br J Haematol 1978; 40 : 255–263.
60. Bradley SJ, Gosriwitana I, Srichairatanakool S et al. Non-transferrin-bound iron induced by myeloablative chemotherapy. Br J Haematol 1997; 99 : 337–343.
61. Grootveld M, Bell JD, Halliwell B et al. Non--transferrin-bound iron in plasma or serum from patients with idiopathic hemochromatosis. Characterization by high performance liquid chromatography and nuclear magnetic resonance spectroscopy. J Biol Chem 1989; 264 : 4417–4422.
62. Richardson D, Baker E. The uptake of inorganic iron complexes by human melanoma cells. Biochim Biophys Acta 1991; 1093 : 20–28.
63. Kaplan J, Jordan I, Sturrock A et al. Regulation of the transferrin-independent iron transport system in cultured cells. J Biol Chem 1991; 266 : 2997–3004.
64. Sturrock A, Alexander J, Lamb J et al. Characterization of a transferrin-independent uptake system for iron in HeLa cells. J Biol Chem 1990; 265 : 3139–3145.
65. Basset P, Quesneau Y, Zwiller J. Iron-induced L1210 cell growth: evidence of a transferrin-independent iron transport. Cancer Res 1986; 46 : 1644–1647.
66. Krause A, Neitz S, Mägert HJ et al. LEAP-1, a novel highly disulfide-bonded human peptide, exhibits antimicrobial activity. FEBS Lett 2000; 480 : 147–150.
67. Park CH, Valore EV, Waring AJ et al. Hepcidin, a urinary antimicrobial peptide synthesized in the liver. J Biol Chem 2001; 276 : 7806–7810.
68. Nicolas G, Bennoun M, Devaux I et al. Lack of hepcidin gene expression and severe tissue iron overload in upstream stimulatory factor 2 (USF2) knockout mice. Proc Natl Acad Sci USA 2001; 98 : 8780–8785.
69. Nicolas G, Bennoun M, Porteu A et al. Severe iron deficiency anemia in transgenic mice expressing liver hepcidin. Proc Natl Acad Sci USA 2002; 99 : 4596–4601.
70. Roetto A, Papanikolaou G, Politou M et al. Mutant antimicrobial peptide hepcidin is associated with severe juvenile hemochromatosis. Nat Genet 2003; 33 : 21–22.
71. Schwarz P, Kübler JA, Strnad P et al. Hepcidin is localised in gastric parietal cells, regulates acid secretion and is induced by Helicobacter pylori infection. Gut 2012; 61 : 193–201.
72. Strnad P, Schwarz P, Rasenack MC et al. Hepcidin is an antibacterial, stress-inducible peptide of the biliary system. PLoS One 2011; 6: e16454.
73. Kulaksiz H, Fein E, Redecker P et al. Pancreatic beta-cells express hepcidin, an iron-uptake regulatory peptide. J Endocrinol 2008; 197 : 241–249.
74. Li JJ, Meng X, Si HP et al. Hepcidin destabilizes atherosclerotic plaque via overactivating macrophages after erythrophagocytosis. Arterioscler Thromb Vasc Biol 2012; 32 : 1158–1166.
75. Simonis G, Mueller K, Schwarz P et al. The iron-regulatory peptide hepcidin is upregulated in the ischemic and in the remote myocardium after myocardial infarction. Peptides 2010; 31 : 1786–1790.
76. Oliveira SJ, de Sousa M, Pinto JP. ER Stress and Iron Homeostasis: A New Frontier for the UPR. Biochem Res Int 2011 : 896474.
77. De Domenico I, Zhang TY, Koening CL et al. Hepcidin mediates transcriptional changes that modulate acute cytokine-induced inflammatory responses in mice. J Clin Invest 2010; 120 : 2395–2405.
78. Duru S, Bilgin E, Ardiç S. Hepcidin: A useful marker in chronic obstructive pulmonary disease. Ann Thorac Med 2012; 7 : 31–35.
79. Patent WO2009139822.
80. Kroot JJ, Tjalsma H, Fleming RE et al. Hepcidin in human iron disorders: diagnostic implications. Clin Chem 2011; 57 : 1650–1669.
81. Goodnough LT, Nemeth E, Ganz T. Detection, evaluation, and management of iron--restricted erythropoiesis. Blood 2010; 116 : 4754–4761.
82. Sasu BJ, Cooke KS, Arvedson TL et al. Antihepcidin antibody treatment modulates iron metabolism and is effective in a mouse model of inflammation-induced anemia. Blood 2010; 115 : 3616–3624.
83. Bartnikas TB, Fleming MD. A tincture of hepcidin cures all: the potential for hepcidin therapeutics. J Clin Invest 2010; 120 : 4187–4190.
84. Li H, Rose MJ, Tran L et al. Development of a method for the sensitive and quantitative determination of hepcidin in human serum using LC-MS/MS. J Pharmacol Toxicol Methods 2009; 59 : 171–180.
85. Peslova G, Petrak J, Kuzelova K et al. Hepcidin the hormone of iron metabolism is bound to alpha-2-macroglobulin in blood. Blood 2009; 113 : 6225–6236.
86. Richardson DR, Kalinowski DS, Lau S et al. Cancer cell iron metabolism and the development of potent iron chelators as anti-tumour agents. Biochim Biophys Acta 2009; 1790 : 702–717.
87. Torti SV, Torti FM. Ironing out cancer. Cancer Res 2011; 71 : 1511–1514.
88. Pinnix ZK, Miller LD, Wang W et al. Ferroportin and iron regulation in breast cancer progression and prognosis. Sci Transl Med 2010; 2 : 43–56.
89. Merlot AM, Kalinowski DS, Richardson DR. Novel Chelators for Cancer Treatment: Where are we Now? Antioxid Redox Signal 2012. Epub ahead of print.
90. Pietrangelo A. Hepcidin in human iron disorders: therapeutic implications. J Hepatol 2011; 54 : 173–181.
Labels
Diabetology Endocrinology Gynaecology and obstetrics Internal medicine Neurology General practitioner for adults
Article was published inInternal Medicine

2012 Issue Suppl 2-
All articles in this issue
- Myelodysplastic syndromes. Progress in diagnosis and treatment within 30 years of myelodysplastic syndromes registry in Institute of Hematology in Prague
- Acute myeloid leukaemia – the post and present of the treatment in the world and the Institute of Heamatology and Blood Transfusion in Prague
- Acute lymphoblastic leukemia: past and present
- Chronic myeloid leukaemia – a crucial change to the patient prognosis after an introduction of tyrosine kinase inhibitors
- Molecular genetics in the chronic myeloid leukemia diagnostics and therapy
- Transplantation of haematopoietic cells and its role in the treatment of haematopoiesis during the last 25 years
- Prevention and treatment of infectious complications in haematooncology
- Emergency situations in hematology
- Care for patients with haemophilia and their families at The Institute of Haematology and Blood Transfusion in Prague
- Studies of structural and functional changes of fibrinogen
- Use of label-free protein chips for proteomics of oncohematological diseases
- Hemapheresis – the efficient therapeutic technique in clinical practice
- Immunohaematology – the history, current knowledge and the role of The Institute of Haematology and Blood Transfusion in Prague
- Iron metabolism and its regulations
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Immunohaematology – the history, current knowledge and the role of The Institute of Haematology and Blood Transfusion in Prague
- Emergency situations in hematology
- Iron metabolism and its regulations
- Hemapheresis – the efficient therapeutic technique in clinical practice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

