-
Medical journals
- Career
Imunohematologie – historie, současný stav poznání a role ÚHKT
: M. Písačka; P. Kořínková; E. Matějková; H. T. Bolcková
: Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Marek Trněný, CSc.
: Vnitř Lék 2012; 58(Suppl 2): 103-114
:
Imunohematologie se zabývá studiem a diagnostikou interakcí imunitního systému a krve, především detekcí antigenů krevních buněk a protilátek proti nim. Objevení principů imunohematologie na začátku 20. století prolomilo imunitní bariéru pro krevní transfuzi a umožnilo rozvoj celého transfuzního lékařství a všech oborů s transfuzí souvisejících. Rutinní využití imunohematologických vyšetření spočívá v oblasti zajištění kompatibilních převodů transfuzních přípravků a v diagnostice, monitoringu a léčbě alo - a autoimunitních cytopenií. V současné době je známo více než 300 antigenů erytrocytů (32 systémů krevních skupin, několik kolekcí a 2 série antigenů), dále desítky antigenů trombocytů a leukocytů a rozsáhlý HLA systém, kde se imunohematologie prolíná s transplantační imunologií. V této přehledné práci je uvedena historie poznání v imunohematologii a informace o používaných diagnostických metodách. K rozvoji československé a poté české imunohematologie významně přispělo oddělení imunohematologie ÚHKT a při něm působící Referenční laboratoř pro imunohematologii. Toto pracoviště má nyní nezastupitelnou úlohu v poskytování superkonziliárních laboratorních vyšetření a konzultací, v zavádění nových metod, v externí kontrole v imunohematologii a v mezinárodní imunohematologické spolupráci a některé publikované výsledky přispěly k rozvoji obecného imunohematologického poznání.
Klíčová slova:
imunohematologie – antigeny krevních buněk – krevní skupiny: systémy, kolekce, série – protilátky – kompatibilní transfuze – Referenční laboratoř pro imunohematologii v ÚHKTÚvod
Imunohematologie je medicínský obor, jehož náplní je, jak je zřejmé z názvu, studium vztahu imunitního systému a krve. Jde o obor poměrně mladý, jeho základy byly položeny teprve na začátku minulého století, nicméně velice významný – bez využití imunohematologických poznatků by nebyl možný rozvoj transfuzní medicíny jako takové a následně všech oborů, ve kterých hraje krevní substituce důležitou roli (léčba cytopenií nejrůznějšího původu – od traumatologických krevních ztrát přes vrozené či získané poruchy krvetvorby po složité chirurgické zákroky a transplantace).
Krev každého jedince je unikátní, kromě jednovaječných dvojčat je totiž téměř nemožné najít jinou osobu „stejné krve“, tedy takovou, kde by nebyl žádný rozdíl v antigenních profilech jednotlivých krevních buněk a složek plazmy. Rozdílnosti antigenů jsou rozeznatelné imunitním systémem, který reaguje na nález cizorodého antigenu ve vlastním prostředí snahou o jeho odstranění, provázenou tvorbou protilátek. A právě tato část interakce imunitního systému – vztahy antigenů a protilátek – je předmětem imunohematologického zkoumání a praktické využití poznatků umožňuje zajištění optimální hemoterapie (prevenci hemolytických transfuzních reakcí – HTR). Kromě toho jsou imunohematologická vyšetření důležitá pro diagnostiku v oblasti alo - a autoimunitních cytopenií [fetální/neonatální cytopenie při fetomaternální inkompatibilitě, např. hemolytické onemocnění novorozence – HON] a autoimunitních stavů (autoimunitní hemolytická anémie – AIHA).
Historie oboru (od ABC 1902 po ABC 2012)
Na počátku imunohematologických dějin stál popis jevu, že sérum některých osob aglutinuje (shlukuje) červené krvinky jiných osob [1]. Následně byl poprvé použit termín krevní skupina – tedy rozdělení osob do skupin podle toho, jak navzájem reagovaly jejich krvinky a séra. Původní skupiny byly 3 (protože Landsteiner měl v době publikace zmiňované práce k dispozici vzorky krve vlastní a několika spolupracovníků z laboratoře, v tomto malém souboru se nevyskytla nejméně častá skupina, dnešní AB) a dostaly první pracovní označení A, B a C (ze skupiny C se stala dnešní skupina O, v ISBT nomenklatuře a ve většině zemí se užívá písmeno „O“, nikoli naše číslice „0“). Byl tedy popsán první systém krevních skupin a první 3 fenotypy – jeden měl antigen A, druhý antigen B a třetí neměl ani A ani B.
V roce 2012 známe na membráně erytrocytů již 329 antigenů řazených do 33 systémů krevních skupin, dále do 6 kolekcí a do 2 sérií (17 antigenů s nízkou frekvencí výskytu a 6 s vysokou frekvencí výskytu). Shodou okolností jsou na konci aktuální řady poznání systémy ISBT 032 a 033, Langereis a Junior, jejichž „rodný list“ – tedy původní publikace – začínají také ABC… Jde o antigeny na bílkovinách rodiny ABC (ATP-binding cassette transporter) – ABCB6 – Lan [2] a ABCG2 – Junior [3].
Antigen (Ag) je struktura membrány krevní buňky definovaná lidskou aloprotilátkou – tedy protilátkou produkovanou imunizovanou osobou, které daný znak na membráně chybí. Biochemicky jde o membránové proteiny či glykoproteiny [rozdíly ve škále zahrnující případy od změny jediné aminokyseliny v řetězci (většina Ag) až po přítomnost/chybění celé bílkoviny (RhD)] anebo o cukry – terminální či subterminální monosacharidy glykosylačních řetězců membránových glykoproteinů a glykolipidů.
Imunohematologie erytrocytů
Systémy krevních skupin [14,15]
Systém je charakterizován jako soubor fenotypů definovaných lidskými protilátkami a vyznačujících se společnými vlastnostmi, jakými jsou:
- známá biochemická podstata,
- definovaná chromozomální loka-lizace,
- identifikovaný a sekvenovaný gen.
V systému může být jen jeden antigen (např. P, H), ale i desítky antigenů (Rh, MNS).
Kolekcí označujeme soubor fenotypů se sérologickou, biochemickou, event. genetickou definicí, ale zatím nesplňující všechna kritéria systému.
Do sérií pak zařazujeme antigeny zatím neodpovídající definovaným systémům a kolekcím [ISBT série 700: LFA (antigeny s nízkou frekvencí výskytu) – incidence méně než 1 % v populaci; ISBT série 901: HFA (antigeny s vysokou frekvencí výskytu) – incidence vyšší než 90 % v populaci].
ABO systém (ISBT 001)
Z transfuzního hlediska jde o nejvýznamnější systém a základní „překážku“ transfuze před objevením krevních skupin, protože oproti ostatním systémům je charakterizován jedinečnou vlastností – existencí přirozených protilátek (vytvořených po narození na základě imunizačního působení antigenů zevního prostředí) proti tomu antigenu, který není na krvinkách dané osoby. Tyto protilátky, na rozdíl od jiných, mnohem vzácnějších přirozených protilátek, mají často hemolytický potenciál (cestou aktivace komplementové kaskády) a inkompatibilní transfuze mohou působit akutní hemolytické reakce se závažným klinickým průběhem, mnohdy i fatálním.
V roce 1900 Landsteiner popsal fakt, že sérum zdravých lidí shlukuje erytrocyty některých jiných osob [1]. V roce 1901 na základě výše zmíněného popsal 3 krevní skupiny A, B a C (později pojmenovanou O) [4]. Skupinu AB popsali v roce 1902 von Decastello a Sturli [5].
Podle definice antigenu jako struktury definované lidskou protilátkou rozeznáváme v systému 4 základní antigeny: A, B, AB a A1.
Pro snadnější pochopení genetických vztahů jsou však v základním modelu uváděny 2 antigeny (A a B) a 4 fenotypy (tab. 1).
1. Genetické vztahy – v základním modelu jsou uváděny 2 antigeny (A a B) a 4 fenotypy. 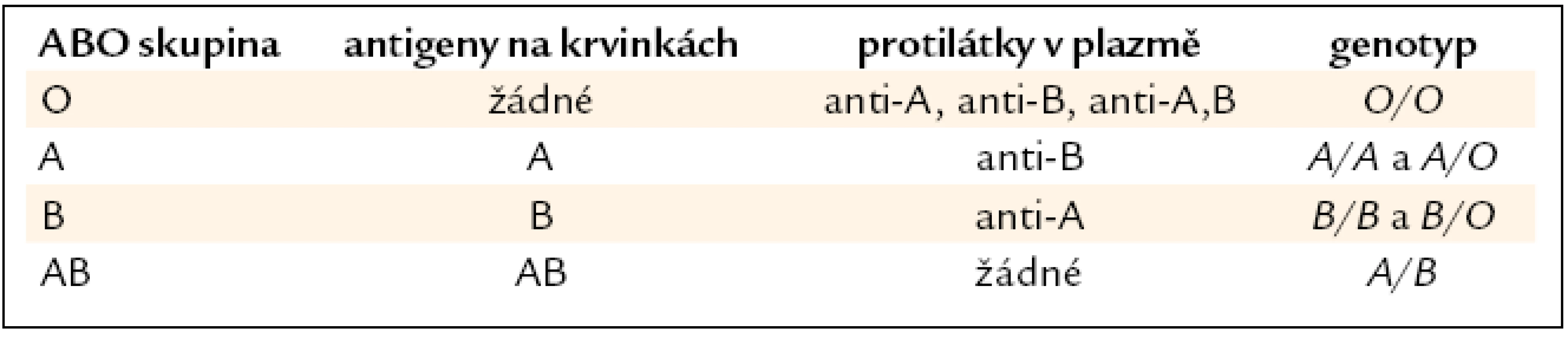
Antigeny jsou terminální oligosacharidy široké palety glykosylačních řetězců glykoproteinů a glykolipidů přítomných na membráně erytrocytů, ale i jiných krevních buněk, na většině epitelových a endotelových buněk, v plazmě, tělních tekutinách a sekretech. Jsou nepřímými produkty 3 základních alel ABO genu (existujících ale již v desítkách subtypů), kodominantních A a B a recesivní O. Tyto alely kódují glykosyltransferázy zodpovědné za syntézu antigenů A a B a za absenci této glykosylace u fenotypu O (obě alely kódují nefunkční transferázy). Konečné formy antigenů tohoto systému jsou také ovlivňovány produkty genů kódujících fukosyltransferázy podílející se na výstavbě prekurzorového H řetězce: H (FUT1), Secretor (FUT2) a Lewis (FUT3).
Prekurzorový H řetězec zůstává nepokrytý u skupiny O. Je označován jako H antigen [historický název, který nahradil původní O-substanci (O pochází z německého „ohne A und B“), vzniklý z „heterogenní“, tj. prokazovaný u více skupin: O, A2, B aj.; v CD nomenklatuře jde o CD173]. Imunodominantním monosacharidem navázaným na H-prekurzor u skupiny A je N-acetyl-D-galaktozamin, u skupiny B D-galaktóza.
MNS systém (ISBT 002)
První zmínka je z roku 1927 od Karla Landsteinera [6]. První protilátky definující antigeny M a N byly sice popsány u králíků imunizovaných lidskými erytrocyty, záhy však byly prokázány i lidské aloprotilátky. K označení byla použita tehdy v sérologii neobsazená písmena. Postupně se z tohoto systému stal 2. nejvíce polymorfní systém. Je to dáno tím, že molekulárním podkladem je cluster 3 těsně vázaných genů: GYPA, GYPB a GYPE, třetí z nich má však nestabilní transkripty, a tak se uplatňují pouze produkty prvních dvou – glykoforiny A a B (GPA a GPB). Kromě základních antigenů M, N, S, s a v černošské populaci ještě významného antigenu U nejrůznějšími genovými přestavbami vznikly ještě další 4 desítky antigenů (celkem t.č. v systému 46 antigenů). Klinicky nejde o příliš „nebezpečný“ systém, hemolytický potenciál mají aloprotilátky anti-S, anti-s, anti-U a vzácně i jiné, pokud jsou třídy IgG a reagují při 37 °C v antiglobulinovém testu.
P1Pk systém (ISBT 003)
První zmínku o tomto systému lze najít ve zmíněné práci Karla Landsteinera [6], k označení bylo použito další písmeno v pořadí. Klinicky jde opět o „benigní“ systém, s protilátkami spíše třídy IgM a reagujícími za nižších teplot a nespojovanými s HON ani HTR (jen raritně mírné pozdní potransfuzní reakce).
Do tohoto systému jsou tč. řazeny 3 antigeny – P1, Pk a P1PK4; příbuzné jsou antigeny P (ISBT systém 028 – GLOB), Forssman (ISBT systém 31 – FORS) a LKE a PX2 (ISBT kolekce 209 – Glob). Klinicky významná je protilátka s kombinovanou specifitou anti-PP1Pk.
Rh systém (ISBT 004)
Jde o nejpolymorfnější systém s největší aloimunogenicitou – s častou tvorbou IgG protilátek působících těžké HON (hlavně anti-D, anti-c) a mírné až těžké HTR pozdního typu. Molekulárním podkladem erytroidně specifického systému jsou 2 blízké geny, jejichž produktem jsou 2 proteiny účastnící se výstavby Rh komplexů erytrocytové membrány. Funkcí je transmembránový transport, pravděpodobně podíl na přenosu O2/CO2 (dříve uváděný transport NH4+ se uplatňuje spíše u nižších živočichů).
První informace související s Rh systémem se objevila v odborné literatuře v roce 1939 [7]. Byla to kazuistika potransfuzní reakce po transfuzi krve manžela ženě, která předtím porodila mrtvý plod a v jejímž séru byla následně zjištěna protilátka reagující s krvinkami přibližně 85 % AB0 kompatibilních jedinců. Bylo potvrzeno, že jak potransfuzní reakce, tak i úmrtí plodu souvisí s nalezenou protilátkou reagující s dosud neznámým krvinkovým antigenem. O rok později bylo poprvé použito označení Rh odvozené na základě protilátky získané imunizací králíků a morčat krvinkami opice Macacus rhesus [8]. Byla vyslovena hypotéza, že na krvinkách makaků se nachází antigen (Rhesus faktor) a imunizovaná zvířata vytvořila protilátku anti-Rh (anti-Rhesus). Zpočátku panoval názor, že obě výše uvedené protilátky mají stejnou specifitu a v následujících letech bylo v souvislosti s ní popsáno mnoho dalších případů potransfuzních reakcí a hemolytického onemocnění novorozence. Přestože se později ukázalo, že lidská a zvířecí protilátka mají odlišné specifity, zůstalo pro lidskou protilátku zachováno vžité (ale v podstatě nesprávné) označení anti-Rh, zatímco pro zvířecí protilátku bylo zvoleno označení anti-LW. Jedinci, jejichž krvinky reagovaly pozitivně s anti-Rh protilátkou, byli označováni Rh-pozitivní (Rh+), ostatní jako Rh-negativní (Rh–).
Tento zpočátku zdánlivě jednoduchý systém (Rh+/Rh–) se postupem vývoje imunohematologického poznání stal nejpolymorfnějším systémem lidských krevních skupin. V současné době rozeznáváme na základě reakcí polyklonálních protilátek 53 antigenů Rh systému, přičemž původní Rhesus faktor a anti-Rh odpovídají antigenu D a protilátce anti-D. Dále se rutinně vyšetřují alelické páry C/c a E/e a antigen Cw (z důvodu relativně častého výskytu protilátek těchto specifit), s ostatními antigeny/protilátkami se setkáváme vzácně.
Lutheran systém (ISBT 005)
Specifita anti-Lua byla popsána v roce 1945 [9], anti-Lub o 10 let později. V současné době známých 19 antigenů tohoto systému je lokalizovaných na 2 glykoproteinech CD239 majících imunoglobulinovou strukturu a patřících mezi receptory a adhezivní molekuly (ligandy pro laminin).
Klinický význam není příliš velký, protilátky v tomto systému sice mohou působit potransfuzní reakce, ale většinou pozdní a mírné a kvůli slabé expresi na fetálních krvinkách nejsou spojovány s případy HON.
Kell systém (ISBT 006) a Kx systém (ISBT 019)
Tyto dva systémy spolu úzce souvisejí, Kell antigeny, popsané prvně v roce 1946 [10], jsou neseny glykoproteinem CD239 (membránovou metaloendopeptidázou), který je disulfidickou vazbou spojen s Kx proteinem (membránový kotransportér neurotransmiterů a Na a Cl iontů). Alterace jednoho z proteinů ovlivňuje expresi druhého (fenotypy K0 a McLeod). Kell je první ze systémů objevených pomocí antiglobulinového testu, dosud bylo definováno již 33 antigenů. Jde o klinicky významný systém s potenciálem výskytu těžkých HTR i HON (zde navíc spolu s hemolýzou přispívá k anemizaci plodu i supresivní efekt protilátek na erytropoézu).
Lewis systém (ISBT 007)
Antigeny tohoto systému (popsán v roce 1946 [11]) jsou na membránu erytrocytu adsorbovány z plazmy, tedy na rozdíl od jiných se nemění po transplantaci krvetvorných buněk.
Dva hlavní antigeny tohoto systému, Lea (LE1) a Leb (LE2), mají trochu matoucí označení, nejsou totiž alelické jako podobně značené páry jiných systémů. Biosyntéza těchto antigenů totiž závisí na dalších spolupracujících systémech – produktem Lewis genu (Le, FUT3) je totiž fukosyltransferáza měnící řetězec H-prekurzoru typu 1 (za vzniku Lea) a/nebo H řetězec typu 1 (za vzniku Leb), konečný Lewis fenotyp spoluzávisí na účinnosti Se genu (FUT2).
Duffy systém (ISBT 008)
Systém byl definován v roce 1950 [12]. Glykoprotein Duffy (také DARC) nesoucí základní pár alelických antigenů Fya (FY1, Gly42) a Fyb (FY2, Asp42) má v kavkazské populaci frekvenci výskytu 65 %, resp. 80 %. Slabá forma Fyb je označována jako Fyx. HFA FY3 je definován protilátkou produkovanou osobami Fy(a-b-), LFA FY4 je susp. jeho antitetickou alelou. HFA FY5 chybí u osob Fy(a-b-) a Rhnull a FY6 je podobný FY3, ale definován mírně odlišnou monoklonální protilátkou.
Antigeny tohoto systému jsou neseny glykoproteinem s funkcí receptoru chemokinů, který je také receptorem usnadňujícím celulární invazi některými typy plasmodií (původci malárie). Tento fakt má za následek velké rozdíly ve frekvencích jednotlivých fenotypů – zatímco v bělošské populaci má 99,99 % osob Duffy antigeny, většina černochů, zejména v subsaharské oblasti, je Fy(a-b-). (Fy null fenotyp je způsoben homozygocií pro nulovou alelu – mutaci v GATA-1 vazné oblasti promotoru Duffy genu, která zabraňuje erytroidní expresi.)
Protilátky v tomto systému jsou imunního původu s potenciálem působit HTR a HON.
Kidd systém (ISBT 009)
Systém (první publikace v roce 1951 [13]) na glykoproteinu (transportér urey) tvoří alelický pár Jka (JK1, Asp280) a Jkb (JK2, Asn280) s frekvencí 76 %, resp. 72 % v kavkazské populaci. Raritní nulový fenotyp [Jk(a-b-)] je výsledkem homozygocie nefunkčního JK genu, relativně často se vyskytuje v Polynézii (0,5 %). Osoby s nulovým fenotypem mohou vytvářet anti-Jk3.
Protilátky v tomto systému patří k velmi nebezpečným – jednak pro obtížnou detekovatelnost (po imunizaci transfuzí či těhotenstvím poměrně rychle síla nálezu zeslabuje, někdy reagují jen homozygotní krvinky) a jednak pro velkou hemolytickou účinnost (IgG často bývají ve směsi s IgM, které aktivují komplement, byly popsány jak těžké akutní – i fatální – hemolýzy, tak i HTR pozdního typu s těžkým průběhem). Na rozdíl od HTR jsou naštěstí tyto protilátky v případech fetomaternální inkompatibility jen velmi vzácně příčinou těžších fetálních hemolýz.
Diego systém (ISBT 010)
22 antigenů tohoto systému je neseno bílkovinou pásu 3 (anion-exchanger, AE1), nejčastějším proteinem membrány erytrocytu, nejznámější jsou alelické páry Dia/Dib a Wra/Wrb. Některé protilátky proti antigenům tohoto systému mají potenciál působit HTR i HON [14,15].
Yt systém (ISBT 011)
Antigeny tohoto systému jsou neseny membránovou acetylcholinesterázou. Protilátky jsou většinou IgG, nejsou však zprávy o HON a u HTR jsou popisovány těžké (vzácně) i benigní (většinou) případy [14,15].
Xg systém (ISBT 012)
Antigeny systému jsou kódovány XG genem na X-chromozomu. Frekvence Xga u žen je 89 %, u mužů 66 %. Protilátky nejsou klinicky významné [14,15].
Scianna systém (ISBT 013)
Systém je tvořen alelickým párem SC1/SC2, jedním HFA (SC3) a 4 LFA (Rd, STAR, SCER a SCAN). Protilátky jsou asi benigní (nejsou zprávy o HTR a těžších HON) [14,15].
Dombrock systém (ISBT 014)
V současné době je známo 8 antigenů nesených GPI-zakotveným glykoproteinem patřícím do skupiny ADP-ribosyltransferáz, patří sem alelický pár Doa/Dob a další HFA. Protilátky v tomto systému jsou významné (zprávy o akutních i pozdních HTR, naopak nebyly dosud popsány případy HON) [14,15].
Colton systém (ISBT 015)
Antigeny jsou nesené aquaporinem-1, jde o alelický pár Coa/Cob a HFA CO3. Protilátky jsou IgG s potenciálem HTR i HON [14,15].
Landsteiner-Wiener systém (ISBT 016)
LW glykoprotein je adhezivní molekula příbuzná imunoglobulinům (ICAM-4). Systém je tvořen alelickým párem LWa (HFA) a LWb (LFA, s výrazně častějším výskytem v Pobaltí než v ostatních populacích). LWab je definován protilátkou nereagující pouze s raritním nulovým LW(a-b-) fenotypem a s Rhnull. Protilátky jsou považovány za benigní, nejsou zprávy o závažných HTR a/nebo HON [14,15].
Chido/Rodgers systém (ISBT 017)
Nejde o vlastní krvinkový systém, ale podobně jako u Lewis o struktury adsorbované na erytrocyty z plazmy. Jde o C4 komponentu komplementu, přičemž rozdíly mezi jednotlivými antigeny tohoto systému jsou dány aminokyselinovými substitucemi. Sérologickou charakteristikou protilátek v tomto systému je jejich inhibovatelnost plazmou. Protilátky jsou většinou IgG, avšak z hlediska HTR a HON benigní. U anti-CH1 byly popsány anafylaktické reakce po transfuzích plazmy a trombocytů [14,15].
H systém (ISBT 018)
Je popsán u systému ABO.
Kx systém (ISBT 019)
Je popsán u systému Kell.
Gerbich systém (ISBT 020)
Antigeny tohoto systému (3 HFA a 5 LFA) jsou lokalizovány na membránových sialoglykoproteinech GPC a GPD, což jsou produkty jediného genu GYPC (GPD je zkrácenou verzí GPC, vznik těchto 2 forem je dán iniciací mRNA translace na dvou místech). Anti-Gerbich protilátky zatím nebyly popsány jako příčina HON, pokud jde o HTR, jsou v literatuře protichůdné zprávy (jednou ikterus jako známka pozdní HTR, v druhém případě podání 16 inkompatibilních TU bez známek hemolýzy) [14,15].
Cromer systém (ISBT 021)
Nosičem 18 antigenů tohoto systému je glykoprotein s funkcí regulace komplementu (DAF, CD55). DAF má GPI kotvu a chybí u osob s PNH. Protilátky jsou většinou IgG, s ojedinělými zprávami o HTR, nikoli však o HON [14,15].
Knops systém (ISBT 022)
9 antigenů tohoto systému je neseno glykoproteinem CR-1 (CD35) s funkcí regulace komplementu. Protilátky jsou považovány za klinicky benigní [14,15].
Indian systém (ISBT 023)
Systém představuje alelický pár Ina (LFA s výskytem jen v indické a arabské populaci) a Inb a 2 další HFA (s lokalizací na CD44). Protilátky jsou považovány za klinicky benigní.
Blízce asociovaný je HFA AnWj (901009), kde však mají protilátky potenciál těžkých HTR [14,15].
Ok systém (ISBT 024)
Systém o jediném antigenu – HFA Oka – je nesen glykoproteinem CD147 z příbuzenstva imunoglobulinů. Protilátka má potenciál působit HTR (podle studie přežívání značených erytrocytů) [14,15].
Raph systém (ISBT 025)
První systém předpovězený monoklonálními protilátkami před nálezem aloimunizace. Zatím je málo informací o molekule nesoucí tento antigen i o významu protilátek [14,15].
John Milton Hagen systém (ISBT 026)
Systém o jediném HFA antigenu neseném CDw108 (semaphorin). Zatím málo informací o podkladu (získaný?/vrozený?) a o charakteru popisovaných variant. Protilátka má suspektní vliv na zkrácené přežívání inkompatibilních erytrocytů [14,15].
I systém (ISBT 027)
Jediný antigen (I) tohoto systému je nalézán uvnitř rozvětvených komplexních oligosacharidových řetězců zakončených ABH a Lewis antigeny. Produktem genu GCNT2 je transferáza katalyzující větvení přímých N-acetylaktosaminových řetězců. Je-li nefunkční, řetězce zůstávají lineární (i antigen – ten však, protože je kódován jiným genem, je zařazen do kolekce 207). Novorozenecké erytrocyty jsou i+ I–, protože větvící transferáza dosahuje účinnosti až během prvních postnatálních měsíců. Vzácně může být nefunkčnost větvící transferázy trvalá (homozygocie neaktivních mutací) – tím vzniká tzv. fenotyp i u dospělých, provázený obvykle tvorbou alo-anti-I. Získaná zvýšená exprese i antigenu může provázet dyserytropoetické stavy (talasemie, srpkovitá anémie, HEMPAS, syndrom Diamond-Blackfan, myelodysplazie, PNH a AML), pravděpodobně pro stresovou hematopoézu (při zvýšených nárocích na produkci krvinky zkráceně vyzrávají) [14,15].
Globo systém (ISBT 028)
Popsán u příbuzného systému P1Pk (ISBT 003).
Gill systém (ISBT 029)
Systém o jednom HFA antigenu (Gill, GIL1), lokalizován na aquaglycerolporinu (glykoprotein transportující vodu, ureu a glycerol). Protilátka IgG třídy byla asociována s HTR a laboratorním HON (jen pozitivní PAT, bez klinických příznaků) [14,15].
RHAG systém (ISBT 030)
Tento systém je tvořen čtyřmi antigeny – Duclos, Ola, DSLK a RHAG4. O klinickém významu protilátek je málo informací [14,15].
FORS systém (ISBT 031)
Systém definován v roce 2011 [16], obsahuje HFA Forssman (popsán u biochemicky příbuzného systému P1Pk).
JR (ABCG2) systém (ISBT 032)
Nově (v roce 2012) definovaný systém o jednom HFA antigenu Jra neseném proteinem ABCG2 (ze skupiny ATP-binding cassette transportérů). Jra je v praxi transfuzní služby v ČR nejčastěji řešeným HFA problémem [detekce protilátky anti-Jra a fenotypu Jr(a-) u osob romského etnika]. Protilátky mají klinický potenciál (spíše HON, ale i HTR) [3].
LAN (ABCB6) systém (ISBT 033)
Nově (v roce 2012) definovaný systém o jednom HFA antigenu Lan neseném proteinem ABCB6 (další protein ze skupiny ATP-binding cassette transportérů). Tento antigen představuje transfuzní riziko, protože existují záznamy o těžkých potransfuzních reakcích a spíše mírných případech HON [2].
Kolekce krevních skupin [14,15]
Cost kolekce (ISBT 205)
Alelické antigeny Csa/ Csb mající vztah k systému Knops (ISBT 022) [chybí u Kn(a-b-), McC(a-), Sl(a-) a Yk(a-)], nejsou však neseny CR1 glykoproteinem. Protilátky nejsou považovány za klinicky významné.
Ii kolekce (ISBT 207)
Jediný antigen kolekce – i – uveden u příbuzného systému I.
Er kolekce (ISBT 208)
Dva alelické antigeny Era (HFA) a Erb (LFA). Protilátky třídy IgG, málo informací o závažnosti (jen laboratorní HON – pozitivita PAT bez klinických příznaků).
Globoside kolekce (ISBT 209)
2 antigeny – Pk a LKE, uvedeny u příbuzného systému P1Pk (ISBT 003).
„Unnamed“ kolekce (ISBT 210)
Patří sem antigeny Lec a Led, jejichž označení je zavádějící, nejsou totiž syntetizovány Lewis transferázou, mají s Lewis antigeny společnou adsorpční cestu na membránu erytrocytu.
Vel kolekce (ISBT 211)
Kolekce obsahuje 2 HFA – Vel a ABTI.
Vel je prvním z popsaných tzv. „veřejných“ antigenů, přesto však patří k posledním klinicky významným hádankám. Některé studie naznačují vazbu na P systém, souvislosti s Gerbich systémem, ale biochemický a molekulárně biologický podklad dosud nebyl objeven. Protilátky anti-Vel jsou většinou třídy IgM a mají potenciál aktivace komplementu, byly popsány těžké akutní HTR, naopak nebyly uváděny v souvislosti s HON.
Raritní ABTI - erytrocyty mají slabou expresi Vel antigenu, o protilátkách anti-ABTI (ojedinělé případy byly IgG třídy) je málo informací.
Antigeny s nízkou frekvencí výskytu (série 700)
O podstatě těchto 18 antigenů a významnosti protilátek proti nim je zatím málo informací. Anti-JFV, anti-Kg, anti-JONES, anti-HJK a anti-REIT jsou popsány v souvislosti s HON [14,15].
Antigeny s vysokou frekvencí výskytu (série 901)
Tyto antigeny představují transfuzní riziko. Protilátky mají potenciál HTR, u anti-Ata a anti-AnWj jsou popsány těžké reakce. HON asociované s anti-HFA jsou vzácnější [14,15].
Bg – HLA asociované antigeny
U některých osob mohou být na membráně erytrocytů přítomné naadsorbované HLA antigeny I. třídy: Bga (HLA-B7), Bgb (HLA-B17) a Bgc (HLA-A28, zkříženě reagující s HLA-A2) a řada dalších. U osob s anti-HLA protilátkami mohou působit komplikace při screeningu a identifikaci protilátek a raritně být i příčinou HTR [14,15].
Polyaglutinabilita a kryptantigeny
Polyaglutinabilita je stav, kdy jsou krvinky určitých osob shlukovány séry jiných osob bez souvislosti s některými výše uvedenými antigeny. Na těchto krvinkách jsou totiž nalézány struktury, které za normálního stavu membrány nejsou dostupné (kryptantigeny). V séru většiny osob pak nalézáme protilátky (většinou IgM) proti těmto kryptantigenům, pravděpodobně jako anamnestické protilátky po běžných infekcích. Většinou jde o raritní případy.
Skupinu rozdělujeme na získané stavy [mikrobiální polyaglutinabilita – kryptantigeny T, Th, Tk, Tx (odkryté působením mikrobiálních enzymů při infekci, event. in vitro kontaminaci) a non-mikrobiální – kryptantigen Tn (defektní glykozylace při myelodysplaziích – susp. somatická mutace, preleukemický stav)], na stavy vrozené (Cad, HEMPAS, NOR, Hyde Park) a nejasné (VA, Tr). K rozlišování jednotlivých kryptantigenů jsou většinou používány různé typy aglutinujících lektinů (vzácněji monoklonální protilátky).
Některé kryptantigeny přítomné na epiteliálních tkáních mohou být nádorovými markery (T, Tn, Tk) [14,15].
Imunohematologie trombocytů
Antigeny trombocytů můžeme rozdělit do 2 skupin: antigeny sdílené s ostatními krevními buňkami a tkáněmi, ke kterým patří HLA systém a ABH systém; a antigeny, které jsou specifické pouze pro trombocyty.
Detekce a identifikace trombocytárních antigenů a protilátek je důležitá při diagnóze a léčbě novorozenecké aloimunitní trombocytopenie, refrakternosti při transfuzi trombocytárních koncentrátů, odhalení potransfuzní trombocytopenické purpury. Harrington et al v roce 1953 poprvé odhalili imunní příčinu idiopatické trombocytopenické purpury [17].
V současné době bialelický systém trombocytárních antigenů – HPA – obsahuje 18 antigenů. Protilátky proti oběma alelickým formám byly popsány zatím u 6 antigenů: HPA-1,2,3,4,5,15. HPA antigeny jsou lokalizovány na 3 glykoproteinech: integriny (αIIbβIII, α2β1), leucin-bohaté GP (GPIb/IX/V) a GP CD109. V současné době jsou trombocytární antigeny určovány výhradně genotypizací, nejčastěji PCR-SSP metodou. Nejvíce imunogenní trombocytární antigen je HPA-1a, protilátka proti tomuto antigenu je zjištěna v 75 % případů fetoneonatální aloimunitní trombocytopenie (FNAIT), dále HPA-5b (15 %), protilátky proti ostatním HPA antigenům jsou zachyceny v 10 % případů FNAIT.
HLA systém v imunohematologii [19–24]
HLA je zkratkou pro hlavní histokompatibilitní systém člověka (Human Leukocyte Antigens), nejsložitější systém lidských skupinových znaků. Jedná se o obranný systém zaměřený zejména vůči zevním patogenům, likviduje však všechny antigeny/tkáně, které nejsou tělu vlastní. HLA zaujímá oblast asi 1/1 000 lidského genomu, lokalizovanou na krátkém raménku 6. chromozomu. Podle struktury a funkce je HLA systém rozdělen do 3 tříd. Genové oblasti I. a II. třídy kódují povrchové HLA molekuly, jejichž základní funkcí je prezentace cizích nebo vlastních peptidů T buněčnému receptoru (TCR). Oblast HLA I. třídy obsahuje lokusy (geny) klasické A, B, C, neklasické E, F, G a pseudogeny. Oblast HLA II. třídy (D oblast) zahrnuje DR, DQ a DP podoblasti s řadou lokusů a pseudogenů. Mezi I. a II. třídu HLA je včleněna genová oblast III. třídy kódující non-HLA molekuly, mezi něž patří i některé složky komplementu.
HLA systém byl objeven teprve nedávno, v roce 1958 [18]. Klinicky se významně uplatňuje především v transplantologii. Výsledek transplantace zejména hematopoetických kmenových buněk je kriticky závislý na stupni HLA shody mezi dárcem a příjemcem. Screening a identifikace anti-HLA protilátek se využívá k diagnostice, prevenci a léčbě HLA alosensibilizace. Při vývoji refrakternosti na destičkové koncentráty se vybírá vhodný dárce krve na základě shody v HLA a/nebo pomocí lymfocytotoxického křížového testu (crossmatch) mezi sérem pacienta a lymfocyty dárce. HLA protilátky se vyšetřují při nejasných potransfuzních komplikacích, při prevenci a diagnostice TRALI, při zajišťování kompatibilních trombocytových a granulocytových koncentrátů. Typizace HLA antigenů se využívá rovněž při diferenciální diagnostice onemocnění asociovaných s HLA a při paternitních sporech.
Imunohematologie leukocytů
Antigeny specifické pro neutrofily – HNA – tvoří 5 systémů: HNA-1,2,3,4,5. Nejlépe je prozkoumán systém HNA-1, který má 3 alely: HNA-1a, 1b, 1c. První alelu identifikovali Lalezari a Bernard v roce 1966 a nazvali ji NA1 (nyní HNA-1a), NA2 (nyní HNA-1b) alelu identifikovali v roce 1972. HNA-1 antigeny jsou lokalizovány na Fc γ receptoru IIIb neutrofilů (CD16). HNA-2 systém má 1 alelu HNA-2a umístěnou na NB1 glykoproteinu kódovaném CD177 genem. Všechny další známé systémy mají také po 1 alele: HNA-3a (CD-CTL-2), HNA-4a (CD11b) a HNA-5a (CD11a). Screening protilátek proti neutrofilům je i v současné době technicky náročný, požívají se intaktní neutrofily s velmi omezeným přežíváním, proto je třeba pracovat vždy s čerstvými neutrofily.
Heparinem indukovaná trombocytopenie (HIT)
Na rozdíl od výše popsaných antigenů erytrocytů, trombocytů, leukocytů a HLA není při této imunitní cytopenii antigenem struktura membrány, ale komplex destičkového faktoru 4 s heparinem. HIT poprvé popsali Rhodes, Dixon a Silver v roce 1973 [24]. HIT je protrombotická poléková reakce objevující se obvykle 5–10 dní po začátku podávání heparinu [25]. Příčinou HIT je IgG protilátka proti komplexu destičkového faktoru 4 s heparinem (PF4/H), která silně aktivuje trombocyty přes jejich receptor FcγIIa [26]. HIT má typický časový průběh: HIT protilátky jsou tvořeny rychle (medián detekovatelnosti je 4 dny), bez předchozí tvorby IgM protilátky. Následuje specifický průběh událostí: přítomnost protilátky (den 4) vede k poklesu počtu trombocytů (medián 6 dní), který se dále prohlubuje na < 50 % hodnoty před začátkem podávání heparinu (medián 8 dní) a objevují se trombózy (medián 10 dní). HIT protilátky jsou detekovatelné již na začátku poklesu počtu trombocytů [27,28].
Warkertin, Chong a Greinacher vyslovili v roce 1998 „centrální paradigma“ HIT, které HIT definuje jako klinickopatologický syndrom vyžadující přítomnost jednoho nebo více klinických příznaků (zejména poklesu počtu trombocytů) a laboratorní průkaz HIT protilátky [29].
Principy imunohematologických technik – detekce antigenů a protilátek
K vyšetřování antigenů a protilátek se používají tzv. sérologické techniky. Rozvoj imunohematologie byl nastartován objevením hemaglutinace (dále zkráceně aglutinace), což je shlukování červených krvinek působením protilátek proti antigenům na těchto krvinkách přítomným. Pro vyšetřování antigenů používáme diagnostika se známými protilátkami a naopak – pro vyšetření protilátek se používají krvinky s jasně definovaným spektrem antigenů. Makroskopické aglutinační techniky jsou i po 100 letech základním postupem v erytrocytární imunohematologii pro svou jednoduchost a ekonomičnost (přítomnost, či absence aglutinace erytrocytů obsahujících hemoglobin je viditelná pouhým okem). Aglutinace může být jednak přímá – uplatňovaná v reakcích IgM protilátek a v enzymových testech – jednak nepřímá – při reakcích IgG protilátek dochází k aglutinaci až působením sekundární protilátky (v antiglobulinovém neboli Coombsově testu). Tato rozdílná reaktivita IgM (tzv. „kompletních“ protilátek) a IgG (tzv. „inkompletních“ protilátek) je dána elektrostatickým pólem kolem erytrocytu, který dovolí dvěma buňkám přiblížení na vzdálenost překlenutelnou imunoglobulinem IgM, nikoli však menší molekulou IgG. Původní sklíčkové a zkumavkové testy přímé aglutinace jsou v současné době nahrazovány provedením v mikrotitračních destičkách, zkumavkový antiglobulinový test je vytlačován robustními technikami testů sloupcové aglutinace a pevné fáze.
V imunohematologii ostatních krevních buněk jsou používány komplikovanější metody (mikroskopické, imunofluorescenční, ELISA aj.).
S rozvojem poznání na úrovni molekulárně biologické se stále častěji do diagnostiky v imunohematologii zapojují techniky DNA analýzy (PCR, microarraye). Tyto techniky nejsou již jen výsadou základního výzkumu, CE certifikované PCR kity a microarraye jsou již plnohodnotnými testy v rutinní klinické laboratoři a mají perspektivu komplementovat a v některých oblastech i nahradit sérologickou diagnostiku.
Na kvalitu základních imunohematologických vyšetření jsou kladeny vysoké nároky pro jejich přímý vliv na život a zdraví příjemců transfuze, proto je trendem vývoj a zavádění spolehlivých automatických imunohematologických analyzátorů a využití výpočetní techniky (databáze minulých vyšetření, registry vzácných dárců aj.).
Laboratorní diagnostika HIT
V laboratorní diagnostice HIT se používají 2 typy testů:
- sérologické (EIA) testy, které detekují protilátku proti komplexu PF4/H,
- funkční testy prokazující HIT protilátky na základě jejich schopnosti aktivovat trombocyty v přítomnosti heparinu.
Vysokou citlivost mají 3 typy testů:
- i) funkční testy používající promyté trombocyty: serotonin release assay (SRA) [30] a heparin-induced platelet activation assay HIPA [31],
- ii) IgG specifické EIA testy a
- iii) polyspecifické EIA testy, které detekují anti-PF4/H protilátky 3 hlavních imunoglobulinových tříd (IgG, IgA, IgM).
Diagnostická specificita těchto testů se různí: nejvyšší je pro funkční testy používající promyté trombocyty (SRA a HIPA) a nejnižší pro polyspecifické EIA testy [32]. Důvodem je skutečnost, že pouze malé procento anti-PF4/H protilátek detekovaných u HIT suspektních pacientů je schopno aktivovat trombocyty [33–37]. V mnohých centrech nicméně není běžně prováděný funkční test, místo něj se používá EIA, což vede k „naddiagnostikování“ HIT [32].
S rostoucí hodnotou optické husto-ty (OD) EIA testu roste riziko HIT. Byl pozorován vztah mezi hodnotou OD a pozitivitou funkčního testu s promytými trombocyty [38].
Ačkoli IgG specifické EIA testy mají vyšší diagnostickou specificitu než polyspecifické EIA metody detekující IgG, IgA, IgM, silně pozitivní polyspecifická EIA je daleko více HIT prediktivní než slabá pozitivita IgG-specifického testu [39].
Imunohematologie a ÚHKT
Oblast erytrocytů
Protože imunohematologická vyšetření mají vitální význam pro obě původní aktivity ÚHKT – jak pro výrobu transfuzních přípravků na části transfuzní, tak i pro jejich bezpečné použití k substituci u pacientů hematologické části – mělo oddělení imunohematologie od počátku důležité postavení a jeho rozvoji byla věnována velká pozornost. Brzy jeho význam přesáhl hranice ÚHKT a díky erudici a zkušenostem svých pracovníků se stalo nejprve neformálním a posléze i formálně jmenovaným lídrem tohoto oboru. Kromě imunohematologického servisu pro místní transfuzní i klinické oddělení totiž začalo oddělení imunohematologie ÚHKT poskytovat superkonziliární služby ostatním laboratořím československé transfuzní služby při řešení obtížných imunohematologických případů, jakými jsou atypické a slabé formy antigenů, vzácné protilátky a obtížně rozlišitelné směsi alo - a autoprotilátek. V Souboru závazných opatření a metodických pokynů pro Transfuzní službu (Dobrý, Novák et al, Avicenum 1976) je zmiňována možnost konzultace při řešení otázek specifity protilátek v Národní skupinové referenční laboratoři Ústavu hematologie a krevní transfuze. Tato referenční činnost byla formalizována v roce 1993 souhlasem Ministerstva zdravotnictví [PKP/2-210-8.1.93(5/8)] se zřízením Referenční laboratoře pro imunohematologii. Bohužel, i když tato činnost vyžaduje vyšší nároky na personální, přístrojové a materiální vybavení než u rutinních imunohematologických laboratoří, není nikterak zvláštně subvencovaná MZ a ani dosud není možné složitá imunohematologická vyšetření odlišit od rutinních stanovení při vykazování kódů dle Sazebníku zdravotních výkonů.
Ve vedení RL postupně působili MUDr. Miroslav Kout (oblast erytrocytů), MUDr. Alexej Májský, DrSc. (oblast HLA), RNDr. Pavel Herzog, CSc. (oblast sérových proteinů a erytrocytů), MUDr. Petra Kořínková, CSc. (oblast trombocytů a leukocytů); v současné době je vedoucím oddělení imunohematologie ÚHKT a Referenční laboratoře pro imunohematologii MUDr. Martin Písačka.
Oddělení imunohematologie a Referenční laboratoř pro imunohematologii jsou akreditovány ČIA a účastní se externí kontroly SEKK (rutinní oddělení) a WHO – Red Cross Bern (RL). Rutinní oddělení v oblasti imunohematologických vyšetření dárců je též kontrolováno SÚKL.
Při vyšetřování složitých imunohematologických případů se občas stává, že řešený problém je na hraně aktuálního poznání – buď jde o prioritně pozorovaný nález, nebo o raritně se vyskytující antigen či protilátku. V těchto případech je potřebné pokusit se problém dořešit a publikovat, a tím přispět do imunohematologické vědomostní mozaiky. Následně jsou uvedeny případy řešené a spoluřešené v RL a pro svůj význam pro imunohematologické poznání přijaté k publikování v mezinárodních imunohematologických časopisech. Jsou uváděny v pořadí podle systému krevních skupin, kterého se daný případ týkal, nikoli chronologicky.
V diagnostice ABO systému je maximálně důležitá kvalita používaných diagnostik. Proto je důležité informování o každé atypické reakci používaných (t. č. CE certifikovaných) diagnostik. V RL jsme analyzovali diskrepantní nález ABO určení a zjistili jsme, že šlo o silnou zkříženou reaktivitu specifické anti-A monoklonální protilátky obsažené v celosvětově rozšířeném diagnostickém systému, s krvinkami skupiny O nesoucími Tn kryptantigen. Obě struktury mají stejný imunodominantní monosacharid, protilátka tedy nebyla „čistá“ anti-A, ale spíše anti-N-acetylgalaktosamin-R. Přestože se jedná o raritní situaci, vyhodnotil výrobce tuto informaci jako závažnou a vzhledem k požadavku na 100% spolehlivost diagnostiky v ABO systému došlo ke změně ve výrobním postupu [40].
Atypický ABO fenotyp para-Bombay je klasicky charakterizován jen stopovou expresí A antigenu (u Ah), event. B antigenu (u Bh) a chyběním antigenu H. Na případech vyšetřovaných v RL byla ve spolupráci se švédskými autory popsána nová forma – tzv. super-para-Bombay se silnou expresí A a negativitou anti-A1 i anti-H (u super-Ah), event. se silnou expresí B a chyběním H antigenu (u super-Bh) [41].
Velká variabilita systému MNS je dána existencí blízce vázaných genů, čímž vzniká velký potenciál pro vznik hybridních genů, a tudíž nových typů glykoproteinů. Jednu z těchto variant jsme popsali u dárkyně krve z ÚHKT, když jsme pozorovali diskrepantní reakci při určování CW způsobenou příměsí anti-Hil/KI v polyklonálním diagnostiku [42,43].
Diagnostice RhD je v imunohematologii věnována velká pozornost. Naše RL úzce spolupracovala s předními pracovišti v oblasti výzkumu Rh systému a výsledkem byly prioritní publikace o nejvýznamnější variantě D VI [44], popis nového typu DCS, pravděpodobně úzce vázaného na českou populaci [45,46], charakteristika typu DOL [47], popis 3 nových genotypů v roce 2009 [48], atypického weak/variant typu „DFR-like“ [49] a posouzení imunogenicity R0Har [50]. Pro praxi je důležitá analýza velkého souboru slabých a variantních D antigenů umožňující posouzení vhodné kombinace diagnostik pro naši populaci [51].
V systému Kell bylo popsáno několik alel pro vzácný nulový fenotyp, proto je důležité podrobně vyšetřit každý další pozorovaný případ. V RL byly v poslední době řešeny 2 případy Kell-null s anti-Ku, ve spolupráci s IBGRL byl definován molekulární podklad [52]. Chybění Kell antigenů bylo prokázáno u jednoho atypického případu syndromu McLeod (na rozdíl od jiných však téměř bez akantocytózy), zde byl rovněž definován defekt na DNA úrovni [53].
K detekci antigenů systému Lewis se používají monoklonální protilátky. Prokázali jsme, že některé z klonů anti-Le(a) mohou reagovat falešně pozitivně s krvinkami, které mají působením neuraminidázy aktivovaný T kryptantigen (podobná struktura vazebného epitopu) [54].
V systému Duffy se vyskytuje nulový fenotyp, jeho výskyt v non-afrických populacích je raritní. V naší populaci byly opakované případy popsány v romském etniku [55]. Molekulárně genetickým vyšetřením se v RL podařilo potvrdit, že molekulární podklad (u více nepříbuzných případů) je identický s africkou GATA-1 mutací [56].
V systému Diego je známa řada antigenů s nízkou frekvencí výskytu. Jeden z nich – Jna – byl prvně detekován na erytrocytech dárce krve z ÚHKT [57]. Řada sérologicky známých antigenů byla do tohoto systému přiřazena po publikacích MUDr. RNDr. Petra Jarolíma et al [58] (na těchto pracích se nepodílela RL ÚHKT).
V systému Dombrock je více HFA. Jeden z nich, Gya (DO3) antigen, byl popsán v roce 1967 v USA v rodině českého původu. Nález další protilátky této specifity v ČR v nedávné době (identifikovaný ve spolupráci RL a IBGRL Bristol) vedl pracovníky českobudějovického TO k zajímavé laboratorně-geneticky-archivnicky detektivní studii naznačující možnou spojitost obou případů [59].
O klinické významnosti protilátek anti-Gerbich a o imunogenicitě Gerbich antigenů je vzhledem k vzácnosti případů málo informací, tudíž sledování každého případu a publikace případných reakcí jsou důležité informace. Při vyšetřování případu HTR s anti-Gerbich-HFA protilátkami bylo retrospektivně zjištěno, že z důvodu instrumentálního problému dostal již imunizovaný pacient s nízkotitrovou protilátkou 1 inkompatibilní TU a následně titr narostl na statisícové hodnoty. Po opakovaném problému s přístrojem došlo k další inkompatibilní transfuzi a již po několika desítkách ml nastala klinická reakce (dušnost, třesavka). Tato kazuistika ukazuje, že Gerbich antigeny mohou být významně imunogenní a inkompatibilita klinicky závažná [60].
Antigen Jra systému JR je HFA vyskytující se v téměř 100 % populace, častější výskyt osob negativního fenotypu [Jr(a-)] byl popsán v Japonsku. V nedávné době jsme opakovaně identifikovali tuto specifitu u osob romského etnika, nejprve ze Slovenska, potom i z různých míst ČR. Tato informace se ukázala jako důležitá v rozhodování o postupu při vyšetřování složitých případů anti-HFA, kdy etnický původ může být vodítkem k rychlejší a méně materiálově i časově náročné identifikaci a event. i k vyhledávání potenciálních dárců [61].
Dosud detailně neprozkoumaný HFA Vel je považován za klinicky významný. V nedávné době byla v RL vyšetřována poměrně silná anti-Vel protilátka, která z důvodu své převážně IgM povahy zcela unikla detekci systémem pevné fáze (reagujícím jen s IgG). Nález upozornil na nebezpečí u laboratoří pracujících tímto systémem a byl stimulem k diskuzi, jak toto riziko omezit [62].
Začátkem 21. století jsou do diagnostiky zaváděny výkonnější genotypovací postupy – od roku 2008 se používá CE certifikovaný kit BloodChip pro multiparametrové genotypování. U jeho zrodu byla RL ÚHKT, podílející se na grantu EU, řešeném konzorciem evropských laboratoří (projekt Blood-Gen) [63].
Kromě zmíněného zajišťování superkonziliárních analýz má Referenční laboratoř pro imunohematologii důležitou roli v zajišťování kvality imunohematologických vyšetření. V minulosti (až do konce 80. let minulého století) působila RL na poli zajištění kvality používaných diagnostik. V „předmonoklonální“ éře byla řada protilátkových polyklonálních diagnostik „in house“ původu, tedy vyráběná jednotlivými pracovišti československé transfuzní služby. K tomu, aby při tomto postupu byla zajištěna standardnost vyšetření ve všech laboratořích, musela vyráběná diagnostika splňovat požadavky československých státních norem co do specifičnosti, avidity a síly reakcí. Právě zajištění shody s ČSN u všech celostátně vyráběných diagnostik bylo laboratorně kontrolováno v RL a následně bylo udělováno povolení k použití v klinické diagnostice. Kromě kontroly „in house“ reagencií působila RL i v oblasti posuzování importovaných imunohematologických diagnostik. Aktivity RL v oblasti povolování a posuzování diagnostik po zavedení povinného používání reagencií s CE certifikací ustoupily do pozadí, nicméně stále většina distributorů imunohematologických diagnostik požaduje testování nově zaváděných reagencií a systémů v RL. To umožňuje RL získávat informace a vlastní zkušenosti s diagnostiky používanými v rutinních laboratořích naší transfuzní služby, a tím je zefektivňována její superkonziliární činnost.
Druhou oblastí na poli zajištění kvality v imunohematologii je činnost RL v externí kontrole imunohematologických vyšetření. V roce 1992 z iniciativy ÚHKT (prim. MUDr. Petr Turek, CSc.) byl zahájen projekt mezilaboratorního porovnávání základních laboratorních vyšetření v erytrocytární imunohematologii. Tyto cykly se nejprve odehrávaly kompletně v režii RL ÚHKT, od roku 1994 se přešlo na praktičtější uspořádání externí kontroly navázáním spolupráce se SEKK Pardubice. RL v současné době připravuje kontrolní vzorky a zajišťuje supervizi cyklů (kontrolu výsledků, komentáře k cyklům), SEKK distribuuje vzorky, shromažďuje a statisticky zpracovává výsledky a zajišťuje distribuci osvědčení o účasti a certifikátů úspěšnosti.
Důležitou úlohou ÚHKT je vedení Národního registru dárců vzácných krevních skupin. Pokyny k budování tohoto registru byly vydány Věstníkem MZ č. 30/1966. Regionální (krajské) registry vedly transfuzní zařízení krajských nemocnic (tehdy NsP III. typu) a národní registr byl shromažďován v RL v ÚHKT (tehdy pod názvem Národní skupinová laboratoř Ústavu hematologie a krevní transfuze). Registr byl veden nejprve formou jednotných děrovacích karet a poté na centrálním počítači v Plzni (v obou případech s roční „papírovou“ aktualizací v RL ÚHKT a tiskem distribuovaného seznamu), následně na počítačích Apple v krajských zařízeních transfuzní služby (každoroční aktualizace v RL ÚHKT prostřednictvím zasílání disket) a konečně formou elektronické komunikace (program Transnet přecházející v současné době na modernější a bezpečnější TransReg).
Oblast leukocytů a trombocytů
Brzy po vytvoření pracovní skupiny imunohematologického oddělení nově vzniklého ústavu se problematice vyšetřování trombocytárních protilátek – aloimunitní či autoimunitní příčiny trombocytopenie – začal věnovat dr. Májský. Nejprve byly detekovány aglutinačním testem, konsumpcí s AGH a vazbou komplementu [64]. Po roce 1985 se na zachycení trombocytárních protilátek začaly používat nepřímé testy imunofluorescenční a imunoenzymatické [65]. V současné době je v laboratoři vyšetřeno na přítomnost trombocytárních protilátek více než 2 000 vzorků ročně. K identifikaci zjištěných trombocytárních protilátek byl zaveden MAIPA test, který využívá přichycení antigenu pomocí specifické monoklonální protilátky proti trombocytárnímu glykoproteinu. Pro poměrnou složitost a časovou náročnost testu jsou nyní využívány k identifikaci protilátek komerčně nabízené testy využívající principu MAIPA testu.
V laboratoři byla podrobně rozpracována diagnostika fetoneonatální aloimunitní trombocytopenie, závažné příčiny krvácení u fétů či novorozenců ohrožených zejména intrakraniálním krvácením [66]. První případ byl v ÚHKT (a v celé ČSR) diagnostikován v roce 1989 [67]. Od té doby bylo pro podezření na FNAIT na našem pracovišti vyšetřeno více než 225 případů novorozenecké trombocytopenie, diagnóza FNAIT byla potvrzena u 35 % novorozenců s těžkou trombocytopenií. Trombocytární HPA antigeny byly určeny PCR-SSP metodou u více než 400 dárců krve. Pro potřeby zejména novorozeneckých pracovišť byl vytvořen panel dárců krve HPA-1a negativních, zastoupených ve všech ABO krevních skupinách okamžitě dostupných pro odběr trombocytů.
V 80. letech minulého století byly zavedeny do rutinního provozu imunohematologického oddělení citlivé metody na detekci leukocytárních protilátek – granuloaglutinační a granuloimunofluorescenční testy [68]. Podle doporučení Pracovní skupiny granulocytární imunobiologie ISBT jsou tyto testy jako „zlatý standard“, často však v novější modifikaci, stále používány při odhalování imunních příčin neutropenií, potransfuzních non-hemolytických reakcí – pyretických či TRALI. Ročně je v laboratoři provedeno více než 1 500 vyšetření na přítomnost protilátek proti neutrofilům.
Sérologické vyšetření HLA bylo v ÚHKT zavedeno v roce 1972 MUDr. Alexejem Májským, DrSc., tehdejším vedoucím oddělení imunohematologie [69]. První zkušenosti s HLA systémem získal MUDr. Májský při studijním pobytu v Paříži u prof. J. Dausseta, objevitele systému HLA. Základní sérologickou metodou v HLA problematice je standardizovaný mikrolymfocytotoxický test (NIH), který lze použít jak k sérotypizaci HLA antigenů I. i II. třídy, tak ke screeningu a identifikaci anti-HLA protilátek, včetně lymfocytotoxického crossmatch testu mezi lymfocyty dárce a sérem příjemce. HLA laboratoř při oddělení imunohematologie (tehdy transplantační oddělení ÚHKT) byla v roce 1976 v Souboru závazných opatření a metodických pokynů pro Transfuzní službu (Dobrý, Novák et al, Avicenum 1976) ustanovena HLA referenční laboratoří Transfuzní služby. Screeningově zde byla vyšetřována séra těhotných žen na přítomnost HLA protilátek, které byly pomocí panelu lymfocytů otypovaných na HLA specifikovány a následně mohly být využity k typizaci HLA antigenů. Součástí pracovní náplně laboratoře byla HLA typizace při paternitních sporech. Vedením HLA laboratoře byla v roce 1991 pověřena MUDr. Eva Matějková, CSc. K analýze HLA sér byl v roce 1992 zakoupen poloautomatický analyzátor firmy OneLambda, který vyšetřování sér velmi zracionalizoval a umožnil vydávat TO, která využívala služeb referenční laboratoře ke konfirmaci, dotypování a/nebo specifikaci HLA sér, komplexní certifikát kvality.
Vzhledem k enormnímu polymorfizmu povrchových HLA antigenů, který nelze sérologickými metodami obsáhnout, docházelo postupně k rozvoji metod genotypizačních. K překlenutí prostoru do zavedení rutinních DNA metod byla za podpory grantu MZ a ve spolupráci s oddělením biochemie zavedena jednodimenzní izoelektrická fokusace, která polymorfizmus HLA I. třídy definovala v širším rozsahu. V roce 1992 byla na oddělení imunohematologie zavedena metoda RFLP pro analýzu alel HLA I. třídy (RNDr. M. Loudová, CSc.). Další metody DNA analýzy – PCR-SSP, PCR-SSOP a přímé sekvenování (SBT) – pak již byly realizovány vzhledem k nutnosti speciálního technického vybavení v rámci oddělení molekulární genetiky (prof. MUDr. Radim Brdička, DrSc.).
Laboratoř HLA sérologie spolupracovala s klinickými pracovišti na studiích sledujících asociace HLA s chorobami (HUS, diabetes mellitus, myasthenia gravis, psoriasis vulgaris, MDS, leukemie a další) [70]. Za podpory VZ ÚHKT byla sledována frekvence HLA antigenů a HLA haplotypů v populaci pacientů i dárců krve, ve spolupráci s klinickým úsekem se vyvíjela strategie výběru dárců kostní dřeně mezi pokrevními příbuznými i v nepříbuzenské populaci. Sledován byl vliv transfuzních přípravků na vývoj HLA alosenzibilizace.
V rámci zavádění senzitivních metodik byly ověřovány nové metody detekce a specifikace HLA aloprotilátek na přístroji LUMINEX (kity OneLambda), FAX a metodami ELISA (IgG i IgM protilátky, porovnání kitů firem Biotest a GTI) (Mgr. Petra Kovářová, Mgr. Hana Tereza Bolcková).
V rámci profylaxe TRALI byl zaveden screening dárkyň krve s imunizačním podnětem v anamnéze (těhotenství, případně transfuze) na přítomnost HLA protilátek I. a II. třídy pomocí citlivého ELISA testu (GTI Quickscreen).
Laboratoř HLA sérologie je akreditována ČIA a pracuje v režimu náročných EFI (The European Federation for Immunogenetics) standardů.
V roce 1999 zavedla dr. Stehlíková na oddělení imunohematologie ÚHKT vyšetřování HIT protilátek EIA testem. Ing. Suttnar z oddělení biochemie ÚHKT ve stejném roce zavedl funkční SRA s detekcí uvolněného serotoninu pomocí HPLC.
Výuka imunohematologie a ÚHKT
Pracovníci oddělení imunohematologie ÚHKT a RL se od počátku existence ústavu podíleli na postgraduální výuce imunohematologie a na zajišťování předatestačních příprav a atestačních zkoušek. Praktická zkouška z imunohematologie je součástí specializační atestace z hematologie a transfuzní služby.
Od roku 2003 byla zahájena úzká spolupráce ÚHKT a 1. lékařské fakulty UK a pracovníci ÚHKT se stali současně zaměstnanci Ústavu klinické a experimentální hematologie 1. lékařské fakulty UK a podílejí se i na pregraduální výuce.
Pracovníci oddělení se podíleli a podílejí na vydávání Doporučení Společnosti pro transfuzní lékařství v oblasti imunohematologie, dále na vydávání imunohematologických monografií (Kout M, Májský A, Herzog P: Sérologické vyšetřovací metody v imunohematologii, SZN 1964, vydáno opakovaně), imunohematologických kapitol učebnic Vnitřního lékařství a Repetitoria a kapitoly Imunohematologie připravované učebnice Transfuzního lékařství (Grada, editoři Masopust J, Řeháček V, vyjde v roce 2012).
Pracovníci oddělení imunohematologie ÚHKT působili a působí v řadě odborných společností a komisí [výbor STL ČLS JEP, RAKL ČLS JEP, redakční rada Transfuze a hematologie dnes, Vědecká rada SEKK, Project Visit/Audit EDQM CE (Rada Evropy)].
MUDr. Martin Písačka
www.uhkt.cz
e-mail: martin.pisacka@uhkt.cz
Doručeno do redakce: 4. 6. 2012
Sources
1. Landsteiner K. Zur Kenntnis der antifermentativen, lytischen und agglutinietenden Wirkungen des Blut-serums und der Lymphe. Zentralbl Bakt 1900; 27 : 357–366.
2. Helias V, Saison C, Ballif BA et al. ABCB6 is dispensable for erythropoiesis and specifies the new blood group system Langereis. Nat Genet 2012; 44 : 170–173.
3. Saison C, Helias V, Ballif BA et al. Null alleles of ABCG2 encoding the breast cancer resistance protein define the new blood group system Junior. Nat Genet 2012; 44 : 174–177.
4. Landsteiner K. Uber Agglutinationserscheinungen normalen menschlichen Blutes. Wien Klin Wochenschr 1901; 14 : 1132–1134.
5. von Decastello A, Sturli A. Uber die Isoagglutinine im Serum gesunder und kranker Menschen. Munchen Med Wochenschr 1902; 49 : 1090–1095.
6. Landsteiner K, Levine P. Further observations on individual differences of human blood. Proc Soc Exp Biol NY 1927; 24 : 941–942.
7. Levine P, Stetson RE. An unusual case of intra-group agglutination. JAMA 1939; 113 : 126–127.
8. Landsteiner K, Wiener AS. An agglutinable factor in human blood recognized by immune sera for Rhesus blood. Proc Soc Exp Biol NY 1940; 43 : 223–224.
9. Callender S, Race RR, Paykoc ZV. Hypersensitivity to transfused blood. Br Med J 1945; 2 : 83–84.
10. Coombs RR, Mourant AE, Race RR. In-vivo isosensitisation of red cells in babies with haemolytic disease. Lancet 1946; 1 : 264–266.
11. Mourant AE. A new human blood group antigen of frequent occurrence. Nature 1946; 158 : 237–238.
12. Cutbush M, Mollison PL. The Duffy blood group system. Heredity 1950; 4 : 383–389.
13. Allen FH, Diamond LK, Niedziela B. A new blood-group antigen. Nature 1951; 167 : 482.
14. Daniels G. Human Blood Groups. 2nd ed. Oxford: Blackwell Science Ltd 2002.
15. Reid M, Lomas-Francis C. The Blood Group Antigen FactsBook. 2nd ed. London: Elsevier Ltd 2004.
16. Hult AK, Svensson L, Stamps R et al. Forssman expression on human red cells: biochemical and genetic basis of a novel histo-blood group system candidate. Transfusion 2011; 51 (Suppl): 1A.
17. Harrington WJ, Sprague CC, Minnich V et al. Immunologic mechanism in idiopathic and neonatal thrombocytopenic purpura. Ann Intern Med 1953; 38 : 433–469.
18. Dausset J. Iso-leuko-anticorps. Acta Haematol 1958; 20 : 156–166.
19. Terasaki PI, McClelland JD. Microdroplet assay of human serum cytotoxins. Nature 1964; 204 : 998–1000.
20. Buc M, Ferenčík M. Imunogenetika. Bratislava: Alfa plus 1994.
21. Rodey GE. HLA Beyond Tears. 2nd ed. Colorado: De Novo Inc 2000.
22. Thorsby E. A short history of HLA. Tissue Antigens 2009; 74 : 101–116.
23. Narinder K Mehra. The HLA Complex in Biology and Medicine: A Resource Book. Darya Ganj: Jaypee Brothers Medical Publishers Ltd 2010.
24. Rhodes GR, Dixon RH, Silver D. Heparin induced thrombocytopenia with thrombotic and hemorrhagic manifestations. Surg Gynecol Obstet 1973; 136 : 409–416.
25. Warkentin TE, Kelton JG. Temporal aspects of heparin-induced thrombocytopenia. N Engl J Med 2001; 344 : 1286–1292.
26. Warkertin TE. HIT paradigms and paradoxes. J Thromb Haemost 2011; 9 (Suppl 1): 105–117.
27. Warkentin TE, Sheppard JA, Moore JC et al. Studies of the immune response in heparin-induced thrombocytopenia. Blood 2009; 113 : 4963–4969.
28. Greinacher A, Kohlmann T, Strobel U et al. The temporal profile of the anti-PF4/heparin immune response. Blood 2009; 113 : 4970–4976.
29. Warkertin TE, Chong BH, Greinacher A. Heparin-induced thrombocytopenia: towards consensus. Thromb Haemost 1998; 79 : 1–7.
30. Sheridan D, Carter C, Kelton JG. A diagnostic test for heparin-induced thrombocytopenia. Blood 1986; 67 : 27–30.
31. Greinacher A, Michels I, Kiefel V et al. A rapid and sensitive test for diagnosing heparin-associated thrombocytopenia. Thromb Haemost 1991; 66 : 734–736.
32. Warkentin TE. How I diagnose and manage HIT. Hematology Am Soc Hematol Educ Program 2011; 2011 : 143–149.
33. Amiral J, Peynaud-Debayle E, Wolf M et al. Generation of antibodies to heparin-PF4 complexes without thrombocytopenia in patients treated with unfractionated or low-molecular-weight heparin. Am J Hematol 1996; 52 : 90–95.
34. Warkentin TE, Sheppard JI, Horsewood P et al. Impact of the patient population on the risk for heparin-induced thrombocytopenia. Blood 2000; 96 : 1703–1708.
35. Warkentin TE, Sheppard JA, Moore JC et al. Laboratory testing for the antibodies that cause heparin-induced thrombocytopenia: how much class do we need? J Lab Clin Med 2005; 146 : 341–346.
36. Greinacher A, Eichler P, Lietz T et al. Replacement of unfractionated heparin by low-molecular-weight heparin for postorthopedic surgery antithrombotic prophylaxis lowers the overall risk of symptomatic thrombosis because of a lower frequency of heparin-induced thrombocytopenia. Blood 2005; 106 : 2921–2922.
37. Backhoul T, Griptner A, Najaoui A et al. Prospective evaluation of PF4/heparin immunoassays for the diagnosis of heparin-induced thrombocytopenia. J Thromb Haemost 2009; 7 : 1260–1265.
38. Greinacher A, Ittermann T, Bagemühl J et al. Heparin-induced thrombocytopenia: towards standardization of platelet factor 4/heparin antigen tests. J Thromb Haemost 2010; 8 : 2025–2031.
39. Bakchoul T, Giptner A, Najaoui A et al. Prospective evaluation of PF4/heparin immunoassays for the diagnosis of heparin-induced thrombocytopenia. J Thromb Haemost 2009; 7 : 1260–1265.
40. Pisacka M, Kralova M, Vytiskova J et al. Group A or 0? Discrepancy in AB0 grouping caused by monoclonal anti-A cross-reacting with Tn polyaglutinable red cells. Vox Sanguinis 2008; 95 (Suppl 1): 173–174.
41. Storry JR, Pisacka M, Pejchalova A et al. Heterozygosity for consensus FUT1 associated with a new ABH phenotype challenging current dogma: H-negative group A and B. Vox Sanguinis 2010; 99 (Suppl 1): 379–380.
42. Pisacka M, Poole J, Rodrigues M et al. Serological Basis of a New Variant Glycophorin. 24th World Congress of ISBT in Tokyo, Japan. Tokyo: Makuhari Messe 1996.Abstract 147.
43. Poole J, Bruce LJ, Tanner MJ et al. Novel molecular basis for the Hil (MNS20) antigen. Transfusion 1998; 38 (Suppl): 103S.
44. Avent ND, Liu W, Jones JW et al. Molecular analysis of Rh transcripts and polypeptides from individuals expressing the DVI variant phenotype: an RHD gene deletion event does not generate All DVIccEe phenotype. Blood 1997; 89 : 1779–1786.
45. Pisacka M, Vytiskova J, Hejna J et al. A new variant of Rh(D) antigen – revealed by reactions of anti-ep12 monoclonal antibodies and lacking exon 5 D-specific reaction of exon-scanning RHD/CE PCR-SSP. Vox Sanguinis 1998; 74 : 1332.
46. Flegel WA, von Zabern I, Doescher A et al. DCS-1, DCS-2 and DFV share amino acid substitutions at the extracellular RhD protein vestibule. Transfusion 2008; 48 : 25–33.
47. Flegel WA, von Zabern I, Doescher A et al. D variants at the RhD vestibule in the weak D type 4 and Eurasian D clusters. Transfusion 2009; 49 : 1059–1069.
48. Pisacka M. Three new RHD genotypes found in Czech population in 2009 – single point mutations in exon 1 /48G>C/ and exon 5 /787G>A/ and hybrid gene RHD(1/8)-CE(9)-D(10). Vox Sanguinis 2010; 99 (Suppl 1): 83.
49. Pisacka M, Vytiskova J, Kralova M et al. Atypical pattern of a partial/weak D case: DFR-like serology but D cat III type 7 PCR-SSP. Transfusion 2010; 50 (Suppl): 147–148.
50. Pisacka M,Vytiskova J, Kralova M et al. Immunogenic potential of RhD variant RoHar. Vox Sanguinis 2005; 89 : 148.
51. Pisacka M, Vytiskova J, Kralova M et al. Variant D antigens and weak D types in the Czech Republic. Transfusion 2005; 45 : 120A.
52. Pisacka M, Kralova M, Galuszkova D et al. First Czech case of K(null) phenotype – serologic characteristics and genetic basis. Vox Sanguinis 2007; 93 (Suppl 2): 64–65.
53. Klempir J, Roth J, Zarubova K et al. The McLeod syndrome without acanthocytes. Parkinsonism Relat Disord 2008; 14 : 364–366.
54. Pisacka M, Suttnar J, Stambergova M. Activation of Thomsen-Friedenreich Antigen Causing False Positive Antigen Typing with Monoclonal Anti-Le(a). XXIIIrd ISBT Congress Amsterdam 1994 – abstract. Vox Sanguinis 1994; 67 : 73.
55. Libich M, Kout M, Giles CM. Fy(a-b-) phenotype in Czechoslovakia. Vox Sang 1978; 35 : 423–425.
56. Pisacka M, Vytiskova J, Latinakova A et al. Molecular background of the Fy(a-b-) phenotype in gypsy population living in the Czech and Slovak Republic. Transfusion 2001; 41 : 15S.
57. Kornstad L, Kout M, Larsen AM et al. A rare blood group antigen, Jna. Vox Sang 1967; 13 : 165–170.
58. Jarolim P, Rubin HL, Zakova D et al. Characterization of seven low incidence blood group antigens carried by erythrocyte band 3 protein. Blood 1998; 92 : 4836–4843.
59. Banzetova H, Bystricka D, Cerna O et al. First finding of Gy(a-) phenotype in the Czech Republic since its discovery in 1967. Possible relationship to original probands found in the USA in 1967–1968. Vox Sanguinis 2006; 91 : 102–103.
60. Pisacka M, Kralova M, Prochazkova R. Anti-Ge antibodies – enormous titre increase and mild acute reaction after transfusion of crossmatch negative units. Transfusion 2007; 47 (Suppl): 166A.
61. Pisacka M, Prosicka M, Kralova M et al. Six cases of anti-Jr(a) antibody detected in one year – a probable relation with gipsy ethnic minority from Central Slovakia. Vox Sang 2000; 78: P146.
62. Pisacka M, Kralova M, Kucerakova M. Anti-Vel missed in IgG-based solid phase test. Transfusion 2009. Ahead of print.
63. Avent N, Martinez A, Flegel W et al. The Bloodgen Project: towards mass scale genotyping for human blood group antigens. Vox Sanguinis 2006; 91 (Suppl 3): 33–34.
64. Majsky A. Die verwendung von formalinisierten trombozyten als antigen für den nachweis von trombozytenantikörpern mittels des agglutinationstestes, derkomplement-bindungsreaktion und der antihumanglobulin-ablenkungsmethode. Z Ges Inn Med 1960; 15 : 1117–1122.
65. Kořínková P, Majský A. Moderní metody v imunologii krevních destiček. Vnitř Lék 1985; 31 : 795–801.
66. Kořínková P, Suttnar J, Vytisková J et al. Fetomaternální aloimunní trombocytopenie – možnosti diagnózy a transfuzní léčby. Česk Gynekol 1999; 64 : 28–31.
67. Kořínková P, Holada K, Dyr JE. Aloimunní novorozenecká trombocytopenie způsobená anti-PlA1 trombocytární protilátkou. Česk Pediatr 1990; 45 : 399–401.
68. Korínková P, Vorlícek J, Majský A. A study of granulocyte cytotoxins and detection of granulocyte allospecific antigens. Transfusion 1982; 22 : 379–383.
69. Majsky A. Einige Bemerkungen zu den HL-A-Antigen und ihrer Bestimmung. Folia Haematol Leipzig 1947; 101 : 608–614.
70. Bláhová K, Bielaszewská M, Stejskal J et al. Hemolyticko-uremický syndrom. Praha: Triton 2000.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue Suppl 2-
All articles in this issue
- Myelodysplastic syndromes. Progress in diagnosis and treatment within 30 years of myelodysplastic syndromes registry in Institute of Hematology in Prague
- Acute myeloid leukaemia – the post and present of the treatment in the world and the Institute of Heamatology and Blood Transfusion in Prague
- Acute lymphoblastic leukemia: past and present
- Chronic myeloid leukaemia – a crucial change to the patient prognosis after an introduction of tyrosine kinase inhibitors
- Molecular genetics in the chronic myeloid leukemia diagnostics and therapy
- Transplantation of haematopoietic cells and its role in the treatment of haematopoiesis during the last 25 years
- Prevention and treatment of infectious complications in haematooncology
- Emergency situations in hematology
- Care for patients with haemophilia and their families at The Institute of Haematology and Blood Transfusion in Prague
- Studies of structural and functional changes of fibrinogen
- Use of label-free protein chips for proteomics of oncohematological diseases
- Hemapheresis – the efficient therapeutic technique in clinical practice
- Immunohaematology – the history, current knowledge and the role of The Institute of Haematology and Blood Transfusion in Prague
- Iron metabolism and its regulations
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Immunohaematology – the history, current knowledge and the role of The Institute of Haematology and Blood Transfusion in Prague
- Emergency situations in hematology
- Iron metabolism and its regulations
- Hemapheresis – the efficient therapeutic technique in clinical practice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

