-
Medical journals
- Career
Poruchy hemostázy u sepse
Authors: J. Novotný; M. Penka
Authors‘ workplace: Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Miroslav Penka, CSc.
Published in: Vnitř Lék 2012; 58(6): 439-447
Category: Reviews
Overview
Imunita a hemostáza představují vzájemně úzce provázané systémy, kdy při aktivaci imunity dochází i k aktivaci hemostázy a vice versa. Je to patrné zvláště u polytraumat, zánětů, šokových stavů a jiných etiologií aktivací obou dějů. Nejvýznamnějším aktivátorem zánětu i hemostázy je sepse. U sepse lze zaznamenat mohutnou stimulaci zánětlivé odpovědi v důsledku uvolňování mnoha cytokinů a prozánětlivých molekul, což může vést až obrazu systémového zánětlivého syndromu – SIRS (systemic inflammatory response syndrome). Uvolnění a exprese řady prozánětlivých molekul má za následek prokoagulační děje ve smyslu snížení (downregulace) antikoagulačních receptorů v podobě trombomodulinu a endoteliálního receptoru pro protein C na povrchu intaktních endotelií a stimulaci uvolňování tkáňového aktivátoru plazminogenu následným přesmykem k liberaci PAI-1 (plazminogen aktivátor inhibitoru-1). Oba děje způsobují snížení aktivace proteinu C a depresi fibrinolýzy. Zároveň následuje konzumpce koagulačních faktorů, inhibitorů (antitrombin, protein C, tissue factor pathway inhibitor), destiček a mikroangiopatická hemolýza s projevy diseminované intravaskulární koagulace. Diagnóza syndromu diseminované intravaskulární koagulace není sjednocena. Exprese tkáňového faktoru na povrchu monocytů i endotelu nadále umocňuje tento „circulus vitiosus“. Dalším zesilováním těchto dějů dochází k poruše mikrocirkulace až k obrazu MOF/MODS (multiorgan failure/multiorgan dysfunction syndrome). Z terapeutického hlediska je mimo léčbu základního onemocnění, stabilizaci oběhu a dýchání, glykemickou kontrolu apod. důležité snažit se o blokádu nežádoucí aktivace zánětu i hemostázy. V minulosti byly podávány minidávky heparinu, názory na tuto terapii nejsou jednotné. V současnosti probíhají terapeutické pokusy s vysokými dávkami přirozených, někdy rekombinantních inhibitorů (antitrombin, drotrecogin α activated, rekombinantní humánní aktivovaný PC, rhTFPI). Dosud nebyl přes velkou snahu prokázán jednoznačný benefit podávání těchto látek, a rekombinantní humánní aktivovaný protein C byl dokonce firmou Eli Lilly stažen z trhu.
Klíčová slova:
sepse – SIRS – systém proteinu C – diseminovaná intravaskulární koagulace – rekombinantní humánní aktivovaný PC – drotrecogin α activatedSepse
Sepse vzniká složitou interakcí invadujících mikroorganizmů s imunitním systémem hostitele.
U těžké sepse proto postupně dochází ke komplexní a neadekvátní systémové aktivaci imunitního systému i hemostázy s možností rozvoje diseminované intravaskulární koagulace (DIC), což může vyústit v multiorgánové selhání s vysokou mortalitou. V iniciální fázi septického pochodu nemusí být známky aktivace obou systémů zřetelně patrné, avšak lze je zachytit podrobnějším laboratorním vyšetřením, a hranice mezi adekvátní a neadekvátní stimulací nemusí proto být zcela ostrá. Existuje vztah mezi dynamikou rozvoje změn koagulace během 1. dne hospitalizace a mortalitou pacientů v sepsi a změny hemostázy mohou předcházet závažným orgánovým dysfunkcím [1]. Těžká sepse je definována v tab. 1 [2]. Je třeba zdůraznit, že v literatuře existují i mírně odlišná kritéria diagnostiky sepse a těžké sepse, do uvedeného schématu nebyly kupodivu zahrnuty známky selhávání jater a CNS. Vztahy mezi aktivací hemostázy a imunitního systému jsou velmi komplexní a pouze částečně známy [3,4], oba systémy jsou vzájemně těsně provázány a mohou se výrazně oboustranně ovlivňovat (obousměrný „crosstalk“ neboli bimodální interakce mezi oběma systémy) [5–7]. Fyziologický význam těchto vazeb spočívá nejspíše v koordinované obraně proti infekci a krvácení při narušení integrity organizmu. Např. u traumatu může imunitní systém eliminovat choroboplodné zárodky, zatímco hemostáza blokuje krvácení a zároveň vytváří fibrinový val ohraničující místo možné invaze mikroorganizmů, čímž může zabraňovat generalizaci procesu. Tyto obranné mechanizmy však při hyperaktivaci mohou organizmus poškozovat [8,9].
Table 1. Definice těžké sepse [2]. ![Definice těžké sepse [2].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/708471638c1fd3bf171772ea6b2ad495.png)
RTG – rentgenové vyšetření, SAP – střední arteriální tlak, SD – směrodatná odchylka Při sepsi jsou aktivovány celulární systémy krve – polymorfonukleární leukocyty, lymfatický systém, monocyty, destičky; navíc je aktivován i endotel, monocyto-makrofágový systém a hepatocyty. Aktivace T - i B-lymfocytů a monocytů má za následek produkci celé řady cytokinů (TNFα, IL1, IL6, IL 8, IL 12, interferonů, růstových faktorů aj.) a protilátek až k obrazu tzv. „cytokinové bouře“, vedoucí zpětnou aktivací imunitního systému až k stavu SIRS (systemic inflammatory response syndrom) [5,6,10,11] – tj. uvolněné cytokiny pozitivními zpětnými vazbami, a v mnoha případech i autoindukcí, dále prohlubují dysregulaci zánětlivé odpovědi [12]. Prozánětlivé cytokiny přispívají k další prokoagulační aktivaci endotelu s expresí tkáňového faktoru a depresí endogenní produkce aktivovaného proteinu C. Po počátečním povzbuzení (vzestup tPA) fibrinolýzy dochází k její následné protrahované depresi (vzestup PAI). Endotel rovněž produkuje řadu cytoadhezivních molekul, usnadňujících „rolling“ a pak i pevnou vazbu polymorfonukleárů na endotelie [7,13,14]. Hemokoagulace je aktivována expresí tkáňového faktoru (TF) na monocytech, endoteliích i v oblasti případného traumatu. Zároveň dochází k „downregulaci“ důležitých antitrombotických molekul TM (trombomodulinu) a EPCR (endoteliálního proteinu C receptoru). Vznikající trombin aktivuje trombocyty, endotelie i leukocyty a pozitivní zpětnou vazbou (aktivace faktorů V, VIII, XI) podporuje svou další generaci. Trombocyty jsou aktivovány i v místech traumatu a dále adherují na aktivovaný endotel se zvýšenou expresí cytoadhezivních molekul (např. P-selektin na endotelu i trombocytech). Aktivované buňky produkují prohemostatické mikrovesikuly, které vydatně přispívají k rozvoji hyperkoagulačního stavu [13]. Značný význam má i aktivace nespecifické imunitní odpovědi v podobě nastartování klasické i alternativní cesty stimulace komplementové kaskády. V pokusech na zvířatech byly blokací komplementu (blokáda C3 konvertázy – compstatin) zmírněny nejen koagulační změny, ale i pochody vedoucí k SIRS a MOF [15]. V literatuře je diskutována i otázka možné léčebné indikace C1-inhibitoru (C1INH), který kromě blokády klasické cesty aktivace komplementové kaskády inhibuje i aktivaci koagulace a fibrinolýzy a tlumí vliv endotoxinu v sepsi přímou interakcí s aktivací leukocytů tímto bakteriálním lipopolysacharidem [16]. Nelze nezmínit, že imunitní systém v sepsi generuje i řadu protizánětlivých cytokinů (např. IL4, IL10, IL13), což může paradoxně dysregulaci zánětlivé odpovědi dále prohloubit (navzdory systémové aktivaci imunitní odpovědi snížená obranyschopnost proti infekci) [17]. Podrobnější rozbor této zajímavé problematiky je mimo rámec tohoto sdělení.
Aktivaci imunitního systému s následným prokoagulačním přeladěním endotelu následuje další a hlubší aktivace hemostázy s potenciálně fatálním zhoršením mikrocirkulace v orgánovém oběhu (MOF nebo MODS – multiorgan failure nebo multiorgan dysfunction syndrome). Je dobré zde zmínit, že pacienti s DIC na bázi závažné sepse mohou mít jen mírné nebo téměř žádné krvácivé projevy a mohou umírat na MODS/MOF. Až u poloviny těchto nemocných lze detekovat normální nebo zvýšenou hladinu fibrinogenu, paralelně se vzestupem PAI (výrazná deprese fibrinolýzy)(obr. 1) [18].
Image 1. Patogeneze DIC a MOF. PC – protein C, AT – antitrombin, TFPI – tissue factor pathway inhibitor, SIRS – systemic inflammatory response syndrome, MODS – multiorgan dysfunction syndrome, TF – tkáňový faktor, PAI-1 – plazminogen aktivátor inhibitor-1 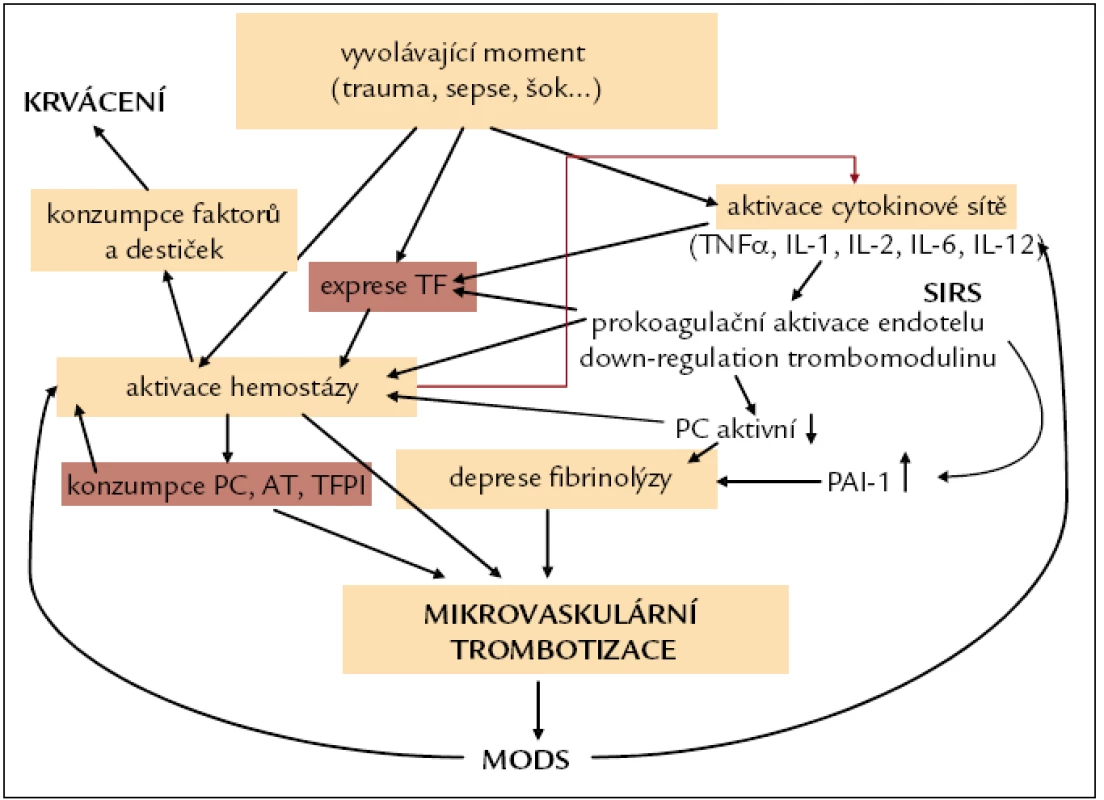
Diseminovaná intravaskulární koagulace
Diagnóza syndromu DIC je obtížná a není celosvětově sjednocena, existují různé skórovací systémy DIC [18–20]. Největší význam má přítomnost základního onemocnění (DIC je syndrom!), dynamické hodnocení změn krevního obrazu (včetně počtu trombocytů), základní koagulace (aPTT, PT, FBG, TT), aktivity antitrombinu a dynamiky koagulačních změn, včetně změn koncentrace molekulárních markerů koagulace (nejdostupněji D-dimerů, výzkumné laboratoře sledují i vývoj aktivace trombocytů, protrombinu, fibrinolýzy či štěpy související s působením trombinu na molekuly fibrinogenu apod.). Přehled molekulárních markerů hyperkoagulace přináší tab. 2, skórovaní systém ISTH z roku 2004 je zobrazen v tab. 3. Bick uvádí míru spolehlivosti jednotlivých laboratorních testů – testy jsou dle tohoto kritéria seřazeny v tab. 4. Stojí za zmínku, že globální koagulační testy jsou v tomto ohledu nejméně spolehlivé, ač na nich staví většina skórovacích schémat [21]. Nutno si dále uvědomit, že žádný jednotlivý laboratorní test není specifický pro DIC, vždy nutno hodnotit zároveň komplexně kliniku a sledovat dynamiku vývoje prováděných vyšetření.
Table 2. Molekulární markery hyperkoagulace. 
FM – fibrinové monomery, tPA – tkáňový aktivátor plazminogenu (tissue-type plasminogen activator), PAI – plasminogen activator inhibitor, FDP – fibrinogen/fibrin degradační produkty, GP – glykoprotein, CRP – C-reaktivní protein Table 3. Skóre pro diagnózu syndromu DIC [19]. ![Skóre pro diagnózu syndromu DIC [19].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/18ec65ee60b7bccca1173575f0709528.png)
Table 4. Senzitivita laboratorních testů pro diagnózu DIC [21]. ![Senzitivita laboratorních testů pro diagnózu DIC [21].](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/b8168ab941439049f1aa64a632435c77.png)
F 1 + 2 – protrombinvý fragment 1 + 2, DD – D-dimery, AT – antitrombin, FM – fibrinové monomery, SF – solubilní fibrin, FP A + B – fibrinopeptid A + B, PF4 – platelet factor 4, βTG – β-tromboglobulin, FDP – fibrinogen/fibrin degradační produkty, TT – trombin time, FBG – fibrinogen, PT – prothrombin time, aPTT – activated partial thromboplastin time, RT – reptilase time Pozor! Specifita všech testů je nízká, neexistuje žádný test, který by byl specifický pro DIC. Testy jsou seřazeny podle klesající míry senzitivity. Zcela schematicky lze rozvoj syndromu DIC rozdělit do několika fází, přičemž nutno zdůraznit, že názory jednotlivých autorit na toto třídění se mohou lišit. První fáze představuje iniciační nebo aktivační stadium DIC (někteří autoři zde hovoří o tzv. „pre-DIC, compensated DIC“) se subklinickým průběhem DIC, kdy jsou globální koagulační testy (aPTT, PT) a fibrinogen v normě, nebo mohou být tyto koagulační testy dokonce zkráceny (výraz hyperkoagulace) s reaktivně zvýšeným fibrinogenem a někdy i trombocytózou. V tomto stadiu v klinickém obraze dominují příznaky základního onemocnění, laboratorně lze zachytit pozitivitu molekulárních markerů hyperkoagulace, nejčastěji D-dimerů (DD) – téměř ve všech laboratořích dostupné vyšetření. Novou metodou k detekci DIC v aktivační fázi je sledování tzv. bifazické vlny při měření změn světelné transmitance, vyvolané koagulací na analyzátoru MDA 180 Organon Teknika. Progrese tohoto obrazu má negativní prognostickou hodnotu i při neprodlužování globálních koagulačních testů, měřených na tomto principu. Bifazická vlna je generována komplexem C-reaktivního proteinu s VLDL [22]. Iniciální stadium DIC může a nemusí přejít do „overt DIC“ – záleží zde na dynamice základního onemocnění [23]. Ve fázi manifestního DIC („overt DIC“) vídáme pestrý klinický a laboratorní obraz – pacienti mohou vykazovat trombohemoragické příznaky – vedle různě vyjádřených krvácivých projevů (petechie, sufuze, krvácení do hemoragických bul, slizniční krvácení, pooperační krvácení aj.) jsou známky mikroangiopatických trombotizací i makrotrombóz kdekoli v cirkulaci. Krvácivé projevy v tomto stadiu DIC mohou být způsobeny konzumpcí koagulačních faktorů, trombocytopenií a získanou trombocytopatií (degranulace trombocytů v mikrocirkulaci), antiagregačním a antipolymerizačním účinkem FDP, získanou vaskulopatií a poruchou endoteliální bariéry, krvácením do nekrotických ložisek a konečně hyperfibrinolýzou (plazminemie) a hyperproteolýzou (elastázy leukocytů) [24]. Lze však zdůraznit, že v sepsi dominuje spíše hypofibrinolýza (po počátečním zvýšení produkce tPA nastupuje protrahovaná syntéza a uvolňování PAI-1). Konzumpce přirozených inhibitorů (AT, PC/S) a prokoagulační přeladění endotelu (snížení exprese TM a EPCR, zvýšení exprese TF) a leukocytů (např. exprese TF na membránách monocytů) nadále zhoršuje poruchy mikrocirkulace s možností selhávání tkáňové perfuze s rozvojem orgánového selhávání (MODS, MOF). Laboratorně lze detekovat mikroangiopatickou anémii (schistocyty v nátěru), trombocytopenii, prodloužení globálních koagulačních testů (aPTT, PT, TT) – asi 50–60 % nemocných v tomto stadiu však nemusí vykazovat prodloužení globálních koagulačních testů, které mohou být i zkrácené [25]. Dále může být detekován pokles koncentrace fibrinogenu, snížení hladiny AT, zvýšení koncentrace FDP a/nebo DD. Změny krevního obrazu, počtu trombocytů a dynamiku výsledků globálních koagulačních testů a aktivitu AT nutno hodnotit v kontextu s klinickým obrazem a sledovat trendy těchto vyšetření v čase. Zvýšená generace trombinu může vést zpětnou aktivací hemostázy (trombin aktivuje faktory XI, VIII, V, leukocyty, endotelie i trombocyty – pozitivní zpětné vazby) k obrazu „circulus vitiosus“, kdy jsou nadále prohlubovány projevy hyperkoagulace i krvácení. Při další progresi poruch mikrocirkulace (pokračující závažný infekt s další aktivací zánětu i hemostázy) může SIRS s projevy DIC dospět do fáze ireverzibilních změn s katastrofálním vyústěním (i v současnosti na závažnou sepsi umírá 40–80 % pacientů). Jednotlivé fáze DIC se však mohou navzájem překrývat, navíc DIC může proběhnout fulminantně (fulminant DIC, catastrophic DIC) s rychlou progresí klinického i laboratorního obrazu. Velkou roli hrají i další onemocnění, která mohou DIC potencovat a/nebo výrazně přispívat k závažnosti klinického obrazu (polytrauma, velké operace, imunodeficity, preexistující hemoragické syndromy – např. cirhóza; dále těžký diabetes mellitus, malignity apod.). Jistý přínos v monitoraci DIC lze spatřit ve využití „bedside“ globálních testů, zejména v sériovém měření trombelastogramu (TEG), s možnou detekcí hyper - i hypokoagulace, podílu poruchy destičkové složky (trombocytopenie/-patie) a hyperfibrinolýzy a/nebo hyperproteolýzy [26,27].
Z terapeutického hlediska se zdá, že v iniciální fázi rozvoje DIC je indikována léčba hepariny k zabránění progrese poruch mikrocirkulace, samozřejmě spolu s léčbou infekce, podporou cirkulace aj. Problémem je, že tato fáze syndromu DIC často uniká pozornosti lékaře. Ve fázi manifestního DIC se snažíme zvládnout event. krvácivé projevy, a navíc přetnout výše popsaný „circulus vitiosus“ aktivace zánětu i hemostázy. Těžištěm léčby hemoragií je mimo zábranu další aktivace hemostázy (stopnutí konzumpce koagulačních faktorů i inhibitorů) substituční terapie – erytrocytární transfuze (těžší anémie podporuje krvácení), transfuze trombocytů při poklesu pod 50 × 109/l nebo 30 × 109/l, fibrinogen při poklesu pod 1,5 g/l, čerstvá mražená plazma v množství 10–30 ml/kg, event. kryoprotein (obsahuje komplex faktoru VIII/von Willebrandova faktoru, fibrinogen, faktor XIII). Obava z „přilévání oleje do ohně“ aplikací plazmy a krevních derivátů je dle současných znalostí nedostatečně potvrzována [19]. U život ohrožujících krvácení lze indikovat podání rekombinantního aktivovaného faktoru VII (rhFVIIa – NovoSeven). Indikaci však nutno pečlivě zvážit ve světle možné potenciace hyperkoagulace. Snahou o ovlivnění hyperkoagulace jsou motivovány přístupy indikující podávání přirozených inhibitorů hemostázy. Nejstarším postupem je aplikace koncentrátů AT, nověji rhAPC. Pokud podáváme AT, snažíme se hladinu navýšit alespoň na 80 %, při vysokodávkované léčbě až na 120 %. Poslouží zde výpočet, kdy 1 UI AT/kg zvýší koncentraci AT u DIC o asi 0,5–1 %. Poločas AT, který obnáší u zdravého člověka asi 2–3 dny, se u DIC zkracuje na 6–12 hod, nutno tedy podávat udržovací dávky asi 500–1 000 UI po 6–12 hod při monitorování hladiny AT. Zatím největší multicentrická studie podání vysokých dávek AT (30 000 UI/4 dny) u závažné sepse (Kybersept) bohužel jednoznačně nepotvrdila benefit této léčby, při analýze podskupin se však zdá, že z této léčby mohou profitovat nemocní bez současného podávání heparinu [28]. Problematika podávání přirozených inhibitorů koagulace je rozvedena i níže (klinické studie). Laboratorní kontroly u DIC (KO + trombocyty, aPTT, FBG, PT AT, event. DD) nutno provádět minimálně 2krát denně a posuzovat dynamiku změn těchto parametrů. Souhrn terapeutických postupů ovlivňujících hemostázu u DIC je ilustrován v tab. 5.
Table 5. Terapeutické modality u DIC. 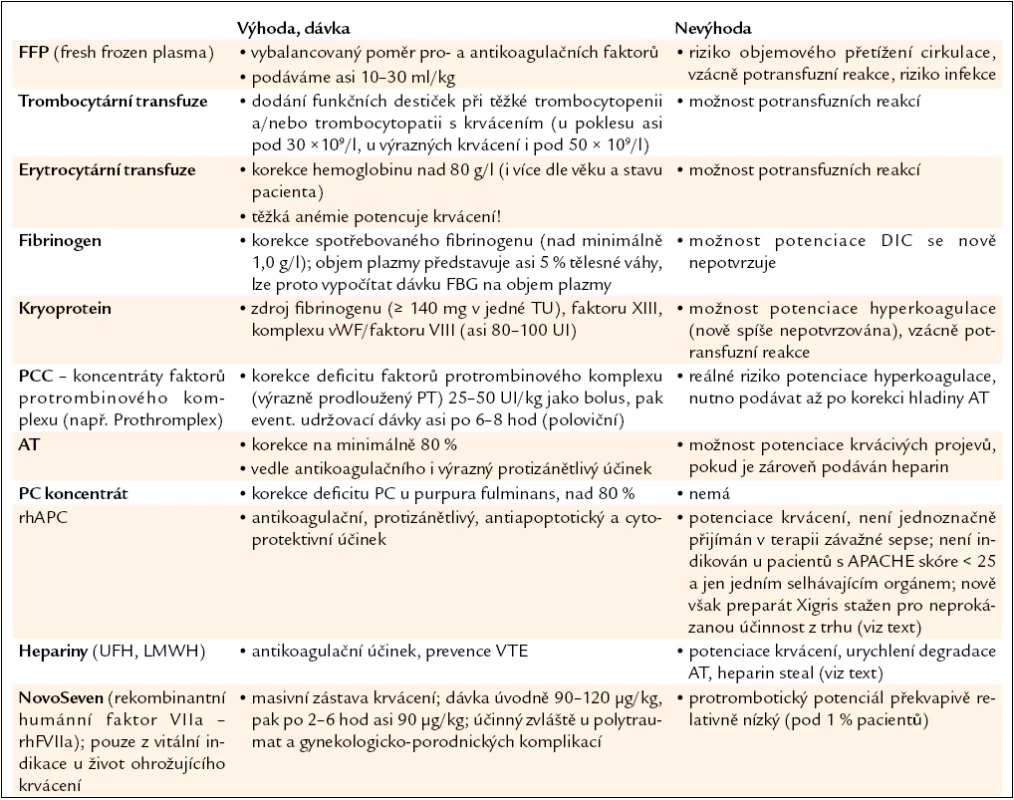
FFP – fresh frozen plasma, vWF – von Willebrandův faktor, TU (transfusion unit) – transfuzní jednotka, PCC – prothrombin complex concentrate, AT – antitrombin, PC – protein C, rhAPC – rekombinantní humánní aktivovaný PC, UH (unfractionated heparins) – nefrakcionované hepariny, LMWH (low molecular weight heparins) – nízkomolekulární hepariny, VTE – venózní tromboembolie Otázka indikace podávání nízkých dávek heparinu nebo nízkomolekulárních heparinů je dodnes široce diskutována. Mohlo by být indikováno v iniciální fázi DIC a/nebo u „low-grade“ subakutního nebo chronického DIC. Ve fázi manifestního DIC mohou hepariny potencovat krvácení a dále mohou zabraňovat vazbě AT na glykosaminoglykany endotelu („heparin steal effect“) s blokádou protizánětlivého efektu antitrombinu (AT potencuje liberaci prostacyklinu z endotelií). Hepariny navíc urychlují degradaci AT elastázami leukocytů. Řada autorů však hepariny u septických pacientů nadále indikuje (prevence venózní tromboembolie u těchto nemocných se sníženou mobilitou na JIP), včetně ACCP 2008 doporučení 1A [29]. Studie XPRESS neprokázala zhoršení přežívání u pacientů s kombinovanou léčbou rhAPC a LMWH (viz níže).
Zdravý organizmus disponuje několika obrannými mechanizmy proti rozvoji SIRS, DIC a MODS/MOF. Vedle produkce protizánětlivých cytokinů a řady jiných imunoregulačních molekul (např. IL4, IL10, IL13, monocyty/makrofágy inhibující faktor apod.) jsou to především přirozené inhibitory koagulace, které mimo inhibici koagulace vykazují i výrazné protizánětlivé a cytoprotektivní účinky. Snahy o ovlivnění SIRS podáváním biologicky aktivních molekul (přímé ovlivnění cytokinové sítě) zatím nebyly shledány jednoznačně přínosnými. Uvádí se, že v sepsi je uvolňováno do cirkulace a/nebo exprimováno na buněčných membránách více než 150 regulačních molekul.
Aktivovaný protein C (APC) je jedním z hlavních regulačních faktorů hemostázy s prokázaným protizánětlivým a antiapoptotickým účinkem [30,31]. Trombin po navázání na endoteliální receptor trombomodulin (TM) ztrácí většinu svých prohemostatických a prozánětlivých aktivit a je mnohonásobně urychlena jeho schopnost aktivovat protein C (PC). Tato reakce je dále urychlována vazbou PC na EPCR (endothelial PC receptor). APC ve spolupráci se svým kofaktorem protei-nem S (PS) enzymaticky štěpí aktivované faktory V a VIII na hemostaticky neúčinné fragmenty. APC navíc potencuje fibrinolýzu nejspíše vazbou plazminogen aktivátor inhibitoru-1 (PAI-1). Zvýšená aktivita PAI-1 je u závažné sepse běžná. Protizánětlivý a antiapoptotický účinek APC se uplatňuje jak nepřímo přes inhibici generace trombinu, tak i přímo nejpravděpodobněji ovlivněním trombinového receptoru PAR 1 (protease activated receptor 1) na povrchu granulocytů, monocytů a endotelií [32]. Pro štěpení PAR 1 aktivovaným proteinem C je nutná vazba APC na EPCR. Pokud je PAR 1 štěpen trombinem, dochází naopak k aktivaci buněk [31]. Trombomodulin obsahuje ve své molekule několik domén, hrajících důležitou roli jak v regulaci hemostázy, tak i zánětu. TM urychluje aktivaci TAFI (thrombin activatable fibrinolysis inhibitor) trombinem, jeho lektinu podobná doména (lectin-like domain) má výrazný protizánětlivý účinek. Aktivovaný TAFI tlumí fibrinolýzu odštěpením lyzinových a glutaminových zbytků z fibrinu (vazebná místa fibrinu pro tkáňový aktivátor plazminogenu a plazminogen) a tlumí i zánět štěpením bradykininu, C5a a osteopontinu [33]. TM navíc tlumí aktivaci komplementové kaskády [34]. Zajímavý je průkaz přechodného antibakteriálního efektu PC v modelu Escherichia coli vyvolané peritonitis myší [35]. Bylo prokázáno zvýšené riziko smrti u nemocných s poklesem PC pod 40 % normy (odds ratio 2,75) [36]. Liawová et al sledovali generaci endogenního APC u skupiny nemocných v sepsi a nalezli korelaci mezi hodnotami endogenního APC a přežíváním, přičemž pacienti se shodným celkovým PC se mnohdy lišili právě v hodnotách generovaného APC (obr. 2) [37].
Image 2. Systém proteinu C. PCa – protein C aktivovaný, VIIIa, Va – aktivované faktory VIII, V, VIIIi, Vi – rozštěpené (inhibované) faktory VIII, V, EPCR – endotelial PC receptor, PS – protein S, V – neaktivovaný faktor V 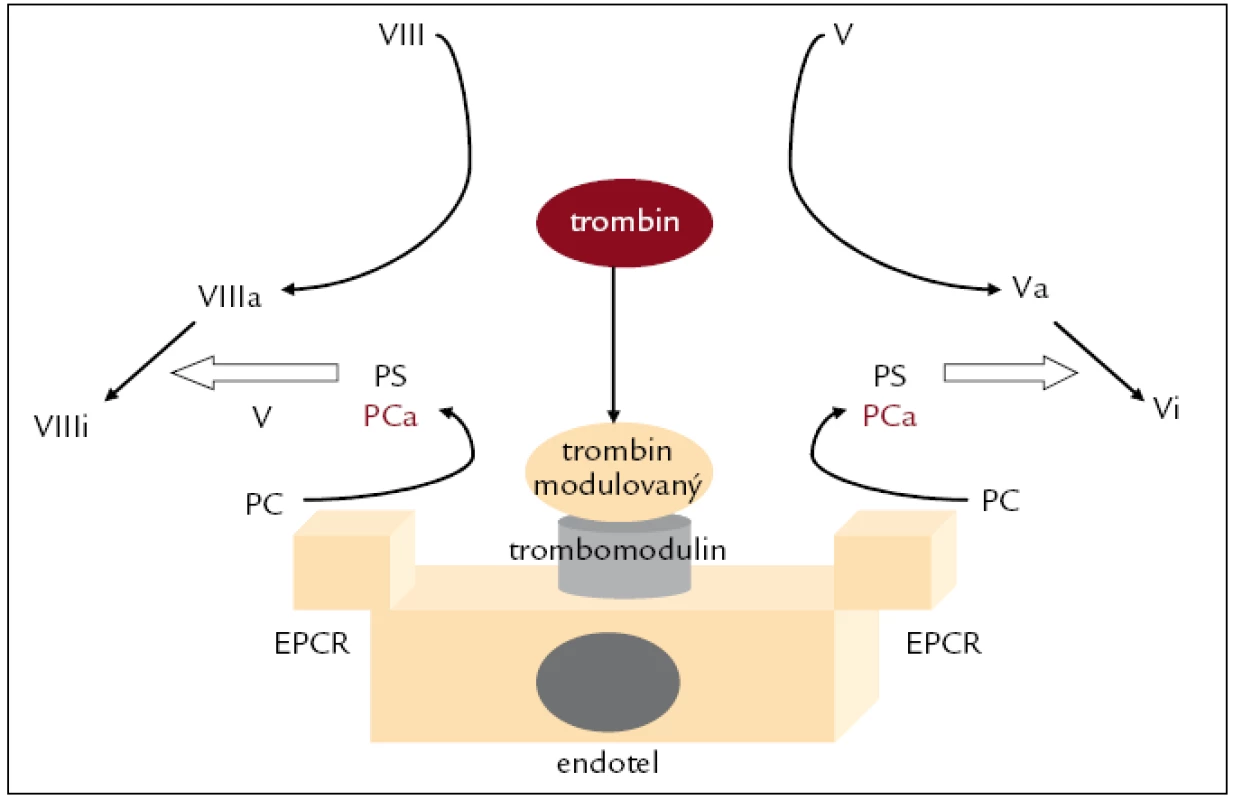
Antitrombin (AT) tvoří komplexy se serinovými proteázami koagulační kaskády. Tyto inhibiční reakce jsou mnohonásobně urychlovány pro vazbě AT na glykosaminoglykany (GAG) – endogenní GAG na povrchu endotelií nebo léčebně podané hepariny. AT vykazuje i protizánětlivý účinek (nepřímo přes inhibici hemostázy, přímo po navázání na GAG endotelu dochází ke zvýšené generaci prostacyklinu). Podávání heparinů urychluje destrukci AT elastázami leukocytů a neutralizuje protizánětlivý efekt AT zabráněním jeho vazbě na GAG endotelií (heparin steal effect) 38].
Logickou součástí komplexní péče o septické nemocné je tedy snaha o modulaci nežádoucí aktivace hemostázy. Multicentrická randomizovaná prospektivní studie PROWESS u 1 690 nemocných prokázala statisticky významně nižší „all cause“ mortalitu pacientů léčených kontinuální infuzí rekombinantního humánního APC (rhAPCC, drotrecogin α activated, 24 μg/kg/hod po 96 hod), studie byla předčasně ukončena pro jasný benefit ve skupině léčených rhAPC oproti placebu (mortalita 24,7 % vs 30,8 %, p = 0,006), zároveň došlo k poklesu hladiny DD a IL6 ve skupině s podaným rhAPC. Podávání rhAPC ale vyústilo v lehce vyšší frekvenci závažných krvácení (3,5 % vs 2 %, p = 0,06) [2].
Pozitivní výsledky PROWESS studie byly následně některými autory zpochybňovány [31,39,40], byly však v podstatě konfirmovány otevřenou „single-arm“ studií ENHANCE, která vykázala téměř shodnou mortalitu (25,3 %) se skupinou rhAPC léčených nemocných v PROWESS studii (24,7 %) [41]. Navíc se ve studii ENHANCE prokázalo, že pacienti léčení během prvých 24 hod od zařazení do studie měli nižší mortalitu než pacienti léčení později (do 48 hod od zařazení do studie) (22,9 % vs 27,4 %, p = 0,01). Zařazení pacientů po více než 24 hod (do 48 hod) však neovlivnilo celkové pozitivní vyznění studie.
ADRESS studie s podáním rhAPC nemocným s těžkou sepsí, avšak s nízkým rizikem smrti (APACHE II < 25, jen jeden orgán postižen) neprokázala benefit této léčby u takto vybraných pacientů, a proto se u této skupiny nedoporučuje [42]. Sepse je velmi komplexním syndromem u velmi heterogenních skupin pacientů, a proto je velmi obtížné dobře naplánovat intervenční klinické studie sepse a je rovněž velmi obtížné správně interpretovat jejich výsledky [43–47]. Zdá se však, že nejvíce by mohli z léčby rhAPC profitovat nemocní s vysokým rizikem smrti a pacienti s nízkou endogenní aktivací PC a/nebo nízkou hladinou PC [37,48,49]. RhAPC byl schválen ve více než 50 rozvinutých zemích jako vhodný lék u pacientů s těžkou sepsí a vysokým rizikem úmrtí na septické komplikace – APACHE II skóre > 25 (Acute Physiology and Chronic Health Evaluation) [50], 2 a více postižených orgánů – MOF; v této indikaci se zdá i ekonomicky výhodný [51].
XPRESS studie u 1 994 pacientů prokázala, že profylaktické podávání heparinů spolu s rhAPC nezvýšilo riziko úmrtí a vedlo k jen lehkému zvýšení frekvence nezávažných krvácivých komplikací. Autoři proto doporučují nepřerušovat medikaci hepariny u těchto nemocných [52].
Co se však týče obecné indikace rhAPC u závažné sepse, nejnověji studie PROWESS-SHOCK bohužel neprokázala zlepšení 28denní „all-cause mortality“ u nemocných léčených kontinuální infuzí rhAPC (26,4 % vs 24,2 % placebo), a preparát byl proto firmou Eli Lilly stažen z trhu [53].
U nemocných se sepsí doprovázenou závažnou trombocytopenií (počet destiček pod 30 × 109/l), závažnou koagulopatií a/nebo purpurou, kteří mohou krvácet po rhAPC, lze zvážit podání plazmatického neaktivovaného PC (Ceprotin®) [27,54] se sníženým rizikem krvácení (PC se aktivuje převážně v cirkulaci s neporušeným endotelem).
Multicentrická, dvojitě zaslepená, randomizovaná studie KyberSept, zkoumající efekt vysokodávkovaného AT oproti placebu, neprokázala benefit této léčby. Analýza skupiny pacientů nedostávajících po dobu podávání AT heparin však detekovala zřetelný trend ve prospěch léčených jen AT, tento trend byl statisticky významný po 90 dnech [28]. Heparin navíc významně zvýšil frekvenci závažných krvácení. Post hoc analýza naznačila možnost, že z léčby vysokodávkovaným AT mohou nejvíce profitovat nemocní s predikcí mortality mezi 30–60 % [16,38]. Tyto trendy bude však nutné konfirmovat v kvalitních multicentrických studiích. Problematika podávání heparinů (nefrakcionované hepariny, nízkomolekulární hepariny) u syndromu DIC však není, jak již bylo zmíněno, jednoznačně dořešena [27,52].
Multicentrická studie podání rekombinantního inhibitoru cesty tkáňového faktoru (rTFPI) u těžké sepse neprokázala benefit této léčby [28,55]. Nadějné se naopak zdá podání rekombinantní acetylhydrolázy inhibující PAF (platelet activating factor) [29,30,56,57].
Budoucnost léčby těžké sepse přirozenými inhibitory koagulace lze pravděpodobně spatřovat v přesnější definici skupin nemocných s profitem této terapie a v nových lécích (např. rekombinantní APC s potlačenou antikoagulační aktivitou, a proto s nižším výskytem krvácení, rekombinantní fragmenty TM aj.) [58,59], event. ve zhodnocení významu podání několika inhibitorů (AT, rhAPC, rhTFPI) [3,5]. Další zlepšení prognózy lze očekávat ve zlepšení diagnostiky SIRS (biologické markery, polymorfizmy genů, angažovaných v regulaci imunitní odpovědi) a nových možnostech jeho ovlivnění (protizánětlivé cytokiny, antagonisté TNFα a IL, blokáda receptorů pro cytokiny, snížení koncentrace cytokinů hemofiltrací apod.), i když prozatímní výsledky jsou méně přesvědčivé, než se od imunomodulační terapie očekávalo [60–62]. V neposlední řadě nutno rovněž zmínit zlepšení obecné péče o tyto nemocné (zlepšená diagnostika infekce, nová antibiotika, zpřesnění indikace podávání kortikosteroidů, těsná kontrola glykemie aj.) [63].
Seznam zkratek
- DIC – disseminated intravascular coagulation
- APC – activated protein C
- PC – protein C
- DAA – drotrecogin α activated
- TM – trombomodulin
- EPCR – endothelial protein C receptor
- PS – protein S
- PAI-1 – plazminogen activator inhibitor-1
- PAR 1 – protease activated receptor 1
- TAFI – thrombin activatable fibrinolysis inhibitor
- AT – antitrombin
- GAG – glykosaminoglykan
- rhAPC – rekombinantní humánní APC
- PAF – platelet activating factor
- rTFPI – recombinant tissue factor pathway inhibitor
- tPA – tkáňový aktivátor plazminogenu
- ACCP – American College of Chest Physicians
MUDr. Jan Novotný, Ph.D.
www.fnbrno.cz
e-mail: novotnyj@fnbrno.cz
Doručeno do redakce: 4. 1. 2011
Přijato po recenzi: 25. 1. 2012
Sources
1. Dhainaut JF, Shorr AF, Macias WL et al. Dynamic evolution of coagulopathy in the first day of severe sepsis: relationship with mortality and organ failure. Crit Care Med 2005; 33 : 341–348.
2. Bernard GR, Vincent JL, Laterre PF et al. Efficacy and safety of recombinant activated protein C for severe sepsis. N Engl J Med 2001; 344 : 699–710.
3. Niessen F, Schaffner F, Furlan-Freguia C et al. Dendritic cell PAR1-S1P3 signalling couples coagulation and inflammation. Nature 2008; 452 : 654–658.
4. Esmon CT. The interactions between inflammation and coagulation. Br J Haematol 2005; 131 : 417–430.
5. Levi M, Lowenberg E, Meijers JC. Recombinant anticoagulant factors for adjutant treatment of sepsis. Semin Thromb Hemost 2010; 36 : 550–557.
6. Diehl JL, Borgel D. Sepsis and coagulation. Curr Opin Crit Care 2005; 11 : 454–460.
7. Knoebl P. Blood coagulation disorders in septic patients. Wien Med Wochenschr 2010; 160 : 129–138.
8. Levi M. The coagulant response in sepsis and inflammation. Hamostaseologie 2010; 30 : 14–16.
9. Petäjä J. Inflammation and coagulation. An overview. Tromb Res 2011; 15 (Suppl 2): S34–S37.
10. Leon LR, Helwig BG. Role of endotoxin and cytokines in the systemic inflammatory response to heat injury. Front Biosci 2010; 2 : 910–938.
11. Burdette SD, Pario MA, Kaplan LJ et al. Systemic Inflammatory Response Syndrome. 2010 [online]. Available from: https://www.emedicine.medscape.com./crit.care.
12. Wang H, Ma S. The cytokine storm and factors determining the sequence and severity of organ dysfunction in MODS. Am J Emerg Med 2008; 26 : 711–715.
13. Cambien B, Wagner DD. A new role in hemostasis for the adhesion receptor P-selectin. Trends Mol Med 2004; 10 : 179–186.
14. Ait-Oufella H, Lehoux S, Guidet B et al. The endothelium: physiological functions and role in microcirculatory failure during severe sepsis. Intensive Care Med 2010; 36 : 1286–1298.
15. Silasi-Mansat R, Zhu H, Popescu NI et al. Complement inhibition decreases the procoagulant response and confers organ protection in a baboon model of Escherichia coli sepsis. Blood 2010; 116 : 1002–1010.
16. Davis AE 3rd, Lu F, Mejia P. C1 inhibitor, a multi-functional serin protease inhibitor. Thromb Haemost 2010; 104 : 886–893.
17. Anas AA, Wiersinga WJ, de Vos AF et al. Recent insights into the pathogenesis of bacterial sepsis. Neth J Med 2010; 68 : 147–152.
18. Wada H, Gabazza EC, Asakura H et al. Comparison of diagnostic criteria for DIC: diagnostic criteria of the International Society of Thrombosis and Hemostasis and of the Japanese Ministry of Health and Welfare for overt DIC. Am J Hematol 2003; 74 : 17–22.
19. Levi M. Current understanding of disseminated intravascular coagulation. Br J Haematol 2004; 124 : 567–576.
20. Gris JC, Faillie LJ, Cochery-Nouvellon E et al. ISTH overt intravascular coagulation score in patients with septic shock: automated immunoturbidimetric solubile fibrin assay vs. D-dimer assay. J Thromb Haemost 2011; 9 : 1252–1255.
21. Bick RL. Disseminated intravascular coagulation: a review of etiology, pathophysiology, diagnosis, and management: guidelines for care. Clin Appl Thromb Hemost 2002; 8 : 1–31.
22. Toh CH, Samis J, Downey C et al. Biphasic transmittance waveform in the APTT coagulation assay is due to the formation of a Ca(++)-dependent complex of CRP with VLD lipoprotein and is a novel marker of impeding DIC. Blood 2002; 100 : 2522–2529.
23. Gando S. Disseminated intravascular coagulation in trauma patients. Semin Thromb Hemost 2001; 27 : 585–592.
24. Madoiwa S, Tanaka H, Nagahama Y et al. Degradation of cross-linked fibrin by leukocyte elastase as alternative pathway for plasmin-mediated fibrinolysis in sepsis-induced DIC. Thromb Res 2011; 127 : 349–355.
25. Levi M, Toh CH, Thachil J et al. Guidelines for the diagnosis and management of DIC. British Committee for Standards in Haematology. Br J Haematol 2009; 145 : 24–33.
26. Schöchl H, Solomon C, Schulz A et al. Thromboelastometry (TEM) findings in DIC in a pig model of endotoxinemia. Mol Med 2011; 17 : 266–272.
27. Durila M, Bureš J, Pelichovská M et al. Hypocoagulation state in severe systemic inflammatory response syndrome/sepsis is consistent with endogenous heparinoid effect as detected by TEG. Anaesth Intensive Care 2011; 39 : 508–509.
28. Kienast J, Juers M, Wiedermann CJ et al. Treatments effects of high-dose antithrombin without concomitant heparin in patients with severe sepsis with or without disseminated intravascular coagulation. J Thromb Haemost 2005; 4 : 90–97.
29. Hirsh J, Guyatt G, Albers GW et al. Executive summary: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (8th Edition). Chest 2008; 133 (Suppl 6): 71S–109S.
30. Joyce DE, Nelson DR, Grinnell BW. Leukocyte and endothelial cell interaction in sepsis: relevance of the protein C pathway. Crit Care Med 2004; 32 (Suppl 5): S280–S286.
31. Levi M. Activated protein C in sepsis: a critical review. Curr Opin Hematol 2008; 15 : 481–486.
32. Rezaie AR. Regulation of the protein C anticoagulant and antiinflammatory pathways. Curr Med Chem 2010; 17 : 2059–2069.
33. Levi M, van der Poll T, Büller HR. Bidirectional relation between inflammation and coagulation. Circulation 2004; 109 : 2698–2704.
34. Weiler H. Regulation of inflammation by the protein C system. Crit Care Med 2010; 38 (Suppl 2): S18–S25.
35. Schouten M, van’t Veer C, Levi M et al. Endogenous protein C inhibits activation of coagulation and transiently lowers bacterial outgrowth in murine Escherichia coli peritonitis. J Thromb Haemost 2011; 9 : 1072–1075.
36. Camporota L, Wyncoll D. Practical aspects of treatment with drotrecogin alfa (activated). Crit Care 2007; 11 (Suppl 5): S7.
37. Liaw PC, Esmon CT, Kahnamoui R et al. Patients with severe sepsis vary markedly in their ability to generate activated protein C. Blood 2004; 104 : 3958–3964.
38. Warren BL, Eid A, Singer P et al. Caring for the critically ill patient. High-dose antithrombin III in severe sepsis: a randomized controlled trial. JAMA 2001; 286 : 1869–1878.
39. Gårlund B. Activated protein C (Xigris) treatment in sepsis: a drug in trouble. Acta Anaesthesiol Scand 2006; 50 : 907–910.
40. Hecksher CH, Lacerda HR, Maciel MA. Characteristics and outcomes of patients treated with drotrecogin alfa activated and other interventions of the „Surviving Sepsis“ campaign in clinical practice. Revista Brasieila de Terapia Intensive 2008; 20 : 135–143.
41. Vincent JL, Bernard GR, Beale R et al. Drotrecogin alfa (activated) treatment in severe sepsis from the global open-label trial ENHANCE: further evidence for survival and safety and implications for early treatment. Crit Care Med 2005; 33 : 2266–2277.
42. Abraham E, Laterre PF, Garg R et al. Drotrecogin alfa (activated) for adults with severe sepsis and a low risk of death. N Engl J Med 2005; 353 : 1332–1341.
43. Short MA, Schlichting D, Qualy RL. From bench to bedside: a review of the clinical trial development plan of drotrecogin alfa (activated). Curr Med Res Opin 2006; 22 : 2525–2540.
44. Kula R, Chylek V, Szturz P et al. A response to infection in patients with severe sepsis – do we need a “stage-directed therapy concept“? Bratisl Lék Listy 2009; 110 : 459–464.
45. Muriová K, Maláska J, Otevřel F et al. Myokardiální dysfunkce v sepsi – charakteristika a patogenetické mechanizmy. Vnitř Lék 2010; 56 : 220–225.
46. Maláska J, Slezák M, Muriová K et al. Myokardiální dysfunkce v sepsi – diagnostika a terapie. Vnitř Lék 2010; 56 : 226–232.
47. Navrátil M, Tomíška M, Kořístek Z et al. Sepse a septický šok u onkologických a imunokompromitovaných pacientů – diagnostika, terapie. Vnitř Lék 2010; 56 : 557–569.
48. Shorr AF, Nelson DR, Wyncoll DL et al. Protein C: a potential biomarker in severe sepsis and a possible tool for monitoring treatment with drotrecogin alfa (activated). Crit Care 2008; 12: R45.
49. Macias WL, Nelson DR. Severe protein C deficiently predicts early death in severe sepsis. Crit Care Med 2004; 32 (Suppl 5): S223–S228.
50. Knaus WA, Draper EA, Wagner DP et al. APACHE II: a severity of disease classification system. Crit Care Med 1985; 10 : 818–829.
51. Riou Franca L, Launois R, Le Lay K et al. Cost-effectiveness of drotrecogin alfa (activated) in the treatment of severe sepsis with multiple organ failure. Int J Technol Assess Health Care 2006; 22 : 101–108.
52. Levi M, Levy M, Williams MD et al. Prophylactic heparin in patients with severe sepsis treated with drotrecogin alfa (activated). Am J Respir Crit Care Med 2007; 176 : 483–490.
53. Lowes R. Sepsis drug Xigris pulled from worldwide market. Medscape Medical News [online]. Available from: https://www.medscape.com/viewarticle/752169.
54. Schellongowski P, Bauer P, Holzinger U et al. Treatment of adult with sepsis-induced coagulopathy and purpura fulminans using a plasma-derived protein C concentrate (Ceprotin). Vox Sang 2006; 90 : 294–301.
55. Abraham E, Reinhart K, Opal S et al. Efficacy and safety of tifacogin (recombinant tissue factor pathway inhibitor) in severe sepsis: a randomized controlled trial. JAMA 2003; 290 : 238–247.
56. Schuster DP, Metzler M, Opal S et al. Recombinant platelet-activating factor acetylhydrolase to prevent acute respiratory distress syndrome and mortality in severe sepsis: phase IIb, multicenter, randomized, placebo-controlled, clinical trial. Crit Care Med 2003; 31 : 1612–1619.
57. Grypioti AD, Mykoniatis M, Demopoulos CA et al. Recombinant PAF-acetylhydrolase attenuates paracetamol-induced liver oxidative stress, injury and regeneration. Digest Dis Sci 2007; 52 : 192–199.
58. Mosnier LO, Gale AJ, Yegneswaran S et al. Activated protein C variants with normal cytoprotective but reduced anticoagulant activity. Blood 2004; 104 : 1740–1744.
59. Saito H, Maruyama I, Shimazaki S et al. Efficacy and safety of recombinant soluble thrombomodulin (ART-123) in DIC: results of a phase III, randomized, double-blind clinical trial. J Thromb Haemost 2007; 5 : 31–41.
60. Nakamura M, Oda S, Sadahiro T et al. Treatment of severe sepsis and septic shock by CHDF using a PMMA membrane hemofilter as a cytokine modulator. Contrib Nephrol 2010; 166 : 73–82.
61. Deasy A, Read RC. Genetic variations in pro-inflammatory cytokines and meningococcal sepsis. Curr Opin Infect Dis 2010; 23 : 255–258.
62. Chylek V, Kula R, Holub M et al. Anticytokine therapy in sepsis and why it fails. Klin Mikrobiol Infekc Lek 2008; 14 : 209–212.
63. Leone M, Textoris J, Michel F et al. Emerging drugs in sepsis. Expert Opin Emerg Drugs 2010; 15 : 41–52.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 6-
All articles in this issue
- Kardiální projevy u pacienta s Addisonovou chorobou a hypotyreózou při autoimunitním polyglandulárním syndromu II. typu
- Teleangiectasia hereditaria haemorrhagica – syndrom Osler-Weber-Rendu. Popis případu a zkušeností s léčbou
- Pohľad internistu na problematiku aortoenterálnej fistuly
- Recidivujúca protetická endokarditída u 21-ročného pacienta s transplantovanou obličkou riešená alogénnym homograftom
- Rezervy v hypolipidemické terapii a dosažení cílových koncentrací lipidů u pacientů s vysokým rizikem kardiovaskulárních příhod
- Katetrová ablace atrioventrikulárních přídatných drah v éře ablační léčby komplexních arytmií: měnící se perspektiva pro nastupující generaci elektrofyziologů
- Poruchy hemostázy u sepse
- Vliv kontinuální a intermitentní náhrady renálních funkcí na antibiotickou léčbu u kriticky nemocných v sepsi – praktický pohled na léčbu vankomycinem a gentamicinem
- Kladribin je velmi účinným lékem pro léčbu histiocytózy z Langerhansových buněk a vzácných histiocytárních nemocí ze skupiny juvenilního xantogranulomu
- Oxidační stres u pacientů s náhradou funkce ledvin hemodialýzou a peritoneální dialýzou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Teleangiectasia hereditaria haemorrhagica – syndrom Osler-Weber-Rendu. Popis případu a zkušeností s léčbou
- Poruchy hemostázy u sepse
- Kladribin je velmi účinným lékem pro léčbu histiocytózy z Langerhansových buněk a vzácných histiocytárních nemocí ze skupiny juvenilního xantogranulomu
- Vliv kontinuální a intermitentní náhrady renálních funkcí na antibiotickou léčbu u kriticky nemocných v sepsi – praktický pohled na léčbu vankomycinem a gentamicinem
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

