-
Medical journals
- Career
Kladribin je velmi účinným lékem pro léčbu histiocytózy z Langerhansových buněk a vzácných histiocytárních nemocí ze skupiny juvenilního xantogranulomu
: Z. Adam 1; P. Szturz 1; L. Pour 1; M. Krejčí 1; L. Zahradová 1; M. Tomíška 1; Z. Král 1; R. Koukalová 2; Z. Řehák 2; J. Mayer 1
: Interní hematoonkologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 1; PET-CT oddělení Masarykova onkologického ústavu Brno, přednosta prim. MUDr. Karol Bolčák 2
: Vnitř Lék 2012; 58(6): 455-465
: Reviews
Kladribin (2-chlorodeoxyadenosin) je v buňce metabolizován a fosforylován až na 2-chloroadenosintrifosfát, který je vlastní účinnou formou léku. Akumulace 2-chloroadenosintrifosfátu je největší v buňkách, jejichž aktivační (fosforylační) enzym, deoxycytidinkináza, má největší aktivitu, zatímco inaktivační (defosforylační) enzym, cytoplazmatická 5-nukleotidáza, má nejmenší aktivitu. Velmi příznivý poměr uvedených 2 enzymů pro vysokou účinnost kladribinu je v klidových a proliferujících lymfocytech. Proto je kladribin účinným lékem pro pacienty s vlasatobuněčnou leukemií, Waldenströmovou makroglobulinemií, ale i chronickou B-lymfocytární leukemií. Podobně vysoké koncentrace 2-chloroadenosintrifosfátu jsou však dosahovány v některých buňkách histiocytární řady, v monocytech a také v Langerhansových dendritických buňkách. Proto je kladribin vysoce účinným lékem pro léčbu histiocytózy z Langerhansových buněk a také pro léčbu nemocí ze skupiny juvenilního xantogranulomu. Autoři si dali za cíl sumarizovat publikované zkušenosti s kladribinem u histiocytárních chorob. Účinnost kladribinu zkoumala pouze 1 multicentrická klinická studie u dětské formy histiocytózy z Langerhansových buněk, ostatní údaje o účinnosti kladribinu u histiocytózy z Langerhansových buněk jsou z publikovaných popisů jednotlivých pacientů či menších kolektivů. V odborné literatuře evidované v databázi PUBMED-MEDLINE bylo popsáno celkem 60 pacientů dospělého věku s histiocytózou z Langerhansových buněk, kteří byli léčení kladribinem. Léčebné odpovědi (CR + PR) bylo dosaženo u 51 (85 %) z 60 léčených. U dětských pacientů s histiocytózou z Langerhansových buněk byl kladribin použit u 182 nemocných. U 110 (60,4 %) ze 182 bylo dosaženo léčebné odpovědi (CR + PR). Jedním z vysvětlení vyššího počtu léčebných odpovědí u dospělých může být menší míra agresivity histiocytózy z Langerhansových buněk u dospělých než u dětí. Dalším vysvětlením je fakt, že součet léčebných odpovědí je u dospělých získán jen z popisu případů a menších souborů, zatímco u dětí jsou zahrnuty jak popisy případů, tak i výsledky prospektivní klinické studie. Choroby ze skupiny juvenilního xantogranulomu jsou podstatně vzácnější než histiocytóza z Langerhansových buněk, a tak i počet publikací je menší. Celkem 7 publikací popisuje léčebnou účinnost kladribinu u některé z forem juvenilního xantogranulomu (Erdheimovy-Chesterovy nemoci, diseminovaného juvenilního xantogranulomu i u lokalizované formy typu xanthoma planum). Kladribin byl účinný také v případě infiltrace CNS jak buňkami histiocytózy z Langerhansových buněk, tak buňkami juvenilního xantogranulomu. V monoterapii je u pacientů s histiocytózou z Langerhansových buněk velmi dobře tolerován bez závažnější myelosuprese.
Závěr:
Kladribin je vysoce účinným lékem pro léčbu histiocytózy z Langerhansových buněk s velmi dobrou tolerancí u těchto pacientů, u nichž obvykle není infiltrována kostní dřeň. Proto je vhodný pro iniciální léčbu dospělých osob s multifokální a multisystémovou formou histiocytózy z Langerhansových buněk. Své místo má dále v léčbě relapsů histiocytózy z Langerhansových buněk po jiné iniciální léčbě. Dle publikovaných zkušeností je účinným lékem pro choroby ze skupiny juvenilního xantogranulomu, ale také u Rosai-Dorfmanovy choroby.Klíčová slova:
kladribin – 2-chlorodeoxyadenosin – histiocytóza z Langerhansových buněk – diabetes insipidus – juvenilní xantogranulom – xanthoma planum – Erdheimova-Chesterova choroba – Rosai-Dorfmanova choroba – sinusová histiocytóza s masivní lymfadenopatiíCharakteristika histiocytózy z Langerhansových buněk
Histiocytóza z Langerhansových bu-něk (LCH) je nemoc způsobená proliferací a akumulací dendritických Langerhansových buněk. V mnoha případech byla prokázána klonalita těchto buněk. WHO klasifikace krevních chorob z roku 2008 řadí LCH do skupiny maligních krevních chorob, přesto trvá diskuze o tom, zda jde o maligní klonální proliferaci, nebo o reaktivní projev neznámé příčiny [1].
Nemoc se častěji vyskytuje v dětském věku [2]. Přesnou incidenci LCH u dospělých v ČR nemáme zmapovanou, zatím nebyl založen žádný registr těchto nemocných v ČR. WHO klasifikace krevních chorob z roku 2008 uvádí incidenci 5/1 milion všech osob (dětí i dospělých). Němečtí autoři uvádí u dospělých incidenci LCH 1–2 případy/1 milion obyvatel. Připouštějí, že nemoc nebývá vždy správně diagnostikována, takže její incidence může být vyšší [3,4]. Pokud by byla incidence v ČR stejná jako v sousedním Německu, tak by mělo být v ČR ročně diagnostikováno u dospělých 10–20 nových případů.
Klinicky se onemocnění manifestuje širokou škálou příznaků, počínaje RTG nálezem izolovaného ložiskového lytického procesu v kosti, který způsobuje bolest (označovaného též termínem eozinofilní kostní granulom), až po generalizované multisystémové (multiorgánové) postižení.
Pokud se nemoc projeví až v dospělosti, dominuje kostní manifestace. Méně častý je souběh kostního a plicního postižení. Při analýze projevů této nemoci u dospělých byla získána následující čísla: v 80 % bývá alespoň jedno ložisko ve skeletu, v 60 % bývá ložiskem kůže, ve 33 % játra, slezina a uzliny, ve 30 % kostní dřeň, ve 25 % plíce, ve 25 % měkké a kostěné části orbity, ve 20 % měkké a kostěné části orodentální a otologické oblasti, kde může způsobit uvolňování zubů, proces podobný paradentóze. Diabetes insipidus, způsobený infiltrací stopky hypofýzy či hypotalamu, bývá vyjádřen u méně než 15 % pacientů [5,6].
U dospělých pacientů má onemocnění velmi různorodý průběh. U některých postihne jenom jedno ložisko a po léčbě se již neobjeví, u jiných má recidivující charakter, u pacientů vznikají stále nová a nová ložiska a choroba může být příčinou omezené hybnosti, či může dokonce přivodit smrt [3].
Pro rozsah choroby se v případě LCH nepoužívá TNM klasifikace. V hematologii byly vytvořeny pro jednotlivá onemocnění speciální klasifikace, které vypovídají jednak o prognóze a jednak pomáhají ke stanovení optimální léčby. A tak současná klasifikace rozsahu LCH (vytvořená mezinárodní histiocytární společností – Histiocyte Society) [3,4] rozeznává 3 formy LCH:
- formu solitární – pouze jedno ložisko v organizmu,
- formu multifokální – omezena pouze na 1 orgán či systém, ale s více ložisky v rámci této tkáně či orgánu, např. multifokální kostní postižení nebo multifokální plicní postižení,
- formu multisystémovou (multiorgánová) – postihuje současně 2 a více orgánů anebo tkání [3–5,59].
V případě solitárních ložisek se používá cílená léčba ložiska, která je rozvedena jinde [3]. V případně multifokálních či multiorgánových forem onemocnění se používá chemoterapie.
Klasické pediatrické léčebné protokoly jsou založeny na vinblastinu, prednisonu a merkaptopurinu. Dalšími účinnými medikamenty pro léčbu LCH jsou etoposid a metotrexát, oba však mají intenzivnější nežádoucí účinky než vinblastin, a proto vinblastinové režimy zůstávají zlatým standardem pro léčbu LCH [7].
U dospělých pacientů s LCH nelze léčbu odvozovat od randomizovaných klinických studií, protože u dospělých nebyla dokončena ani jedna randomizovaná klinická studie, v rámci níž by byly srovnány odlišné léčebné postupy. Studie, která měla za cíl ověřit účinek vinblastinu u dospělých, nebyla dokončena.
Proto se léčba dospělých pacientů odvíjí od zkušeností získaných v pediatrických studiích a dále od zkušeností vyplývajících z popisů jednotlivých případů či menších souborů dospělých nemocných.
Léčba dle pediatrických protokolů trvá dlouho, může trvat až rok [7]. Při použití pediatrických protokolů u dospělých osob bývá často závažným problémem neurotoxicita vinblastinu, v případě aplikace mimo žílu komplikace způsobené paravazací. Nepřehlédnutelným problémem u dospělých pacientů jsou komplikace způsobené dlouhodobým podáváním kortikoidů (diabetes mellitus 2. typu, trombózy apod.).
Vysoce pozitivní zkušenosti s kladribinem u relabujících forem a známé nežádoucí účinky vinblastinu u dospělých pacientů vedly lékaře na Mayo Clinic (USA) k preferenci kladribinu před vinblastinem u dospělých pacientů s LCH v rámci léčby první linie. Jejich publikace z roku 2003 jako první popisuje excelentní účinnost kladribinu, aplikovaného u dospělých pacientů s LCH v rámci léčby první linie [8]. Od té doby se rozšířilo v zahraničí používání kladribinu v rámci iniciální léčby multisystémové či multifokální formy LCH u dospělých. Proto předkládáme přehled recentních zkušeností s kladribinem v této indikaci.
Farmakokinetika a farmakodynamika kladribinu
Kladribin, synonymem 2-chlorodeoxyadenosin, se dostal do klinické praxe počátkem 90. let minulého století zároveň s fludarabinem. Příchod obou léků do praxe však provázela odlišná firemní politika. Fludarabin byl vpuštěn do mnoha klinických studií, a stal se tak základem pro četné, stále používané léčebné režimy. Kladribin nebyl tak intenzivně testován v rámci randomizovaných klinických studií a měl zpočátku i vyšší cenu než fludarabin. S kladribinem proběhly klinické studie ve stejných indikacích jako s fludarabinem, jejich přehled jsme již dříve uvedli [9]. Jednalo se však vždy o menší klinické studie, které nebyly dostatečné pro registrační řízení. Proto jeho základní registrace zůstala omezena na vlasatobuněčnou leukemii. Existuje pouze jedna randomizovaná studie s cílem srovnat účinnost fludarabinu a kladribinu. V rámci této studie nebyl nalezen rozdíl v účinnosti kladribinu a fludarabinu u chronické lymfatické leukemie [10].
Přesto kladribin nedoznal širšího standardního použití, zřejmě díky menší propagaci výrobců této substance.
Nicméně kladribin má excelentní výsledky u histiocytárních chorob, jak u histiocytózy z Langerhansových buněk, tak u nemocí ze skupiny juvenilního xantogranulomu. Na tyto vzácné a často k jiným léčebným postupům rezistentní histiocytární choroby je kladribin nejúčinnějším lékem.
Kladribin je derivát adenosinu, u něhož na 2. uhlíku purinového kruhu byl vodík substituován chlórem. Tato změna je dostatečná, aby zabránila deaminaci 2-chlorodeoxyadenosinu. Kladribin je v buňce metabolizován, fosforylován až na 2-chloroadenosintrifosfát, který je vlastní účinnou formou léku. Akumulace 2-chloroadenosintrifosfátu je největší v buňkách, jejichž aktivační (fosforylační) enzymy (klíčovou roli hraje deoxycytidinkináza) mají největší aktivitu, zatímco inaktivační (defosforylační) enzym, cytoplazmatická 5-nukleotidáza, má nejmenší aktivitu [11,12].
Velmi příznivý poměr uvedených dvou enzymů pro účinnost kladribinu je v klidových a proliferujících lymfocytech, v monocytech, v histiocytech a také v Langerhansových buňkách. V nich dosahují nitrobuněčné koncentrace 2-chloroadenosintrifosfátů několiksetkrát vyšší hladiny, než je jeho plazmatická koncentrace. Bylo prokázáno, že kladribin je vysoce toxický pro monocyty, a to jak in vivo, tak in vitro [13,14]. Díky této vlastnosti je kladribin vysoce selektivním cytostatikem. Kladribin má intenzivní cytotoxický účinek na pomalu proliferující buňky lymfatické řady, ale i na některé buňky z histiocytární řady, na Langerhansovy dendritické buňky a na fagocytující histiocyty (makrofágy), které vytvářejí onemocnění řazená do skupiny juvenilního xantogranulomu [15]. V buňkách ostatních tkání je akumulace 2-chlorodeoxyadenosintrifosfátu malá, takže na ně cytotoxicky nepůsobí.
Kladribin proniká v účinné dávce do CNS, intratekální koncentrace kladribinu dosahuje 25 % plazmatické koncentrace. Tumoricidní účinek se odvíjí od nitrobuněčné koncentrace 2-chlorodeoxyadenosintrifosfátu, a ta závisí hlavně na poměru aktivujícího a deaktivujícího enzymu. A u Langerhansových buněk a pěnitých histiocytů je tento poměr vysoký, takže koncentrace kladribinu, dosahovaná v mozkomíšním moku po nitrožilním či subkutánním podání, vede k vytvoření účinné intracelulární koncentrace 2-chlorodeoxyadenosintrifosfátu v infiltrátech tvořených Langerhansovými buňkami nebo pěnitými histiocyty.
Proto je léčba kladribinem účinná i při infiltraci CNS buňkami LCH či buňkami xantogranulomu [14].
Biologická dostupnost kladribinu, podaného formou podkožní aplikace, je 100 %, takže je možné jak nitrožilní, tak podkožní podání. Farmakologické vlastnosti kladribinu (100% resorpce z podkoží, několikasetnásobná akumulace v cílových senzitivních buňkách a 15–30hodinový intracelulární poločas) umožňují aplikaci formou podkožních injekcí. Na 2 pracovištích bylo prokázáno, že plochy pod křivkou průběhu plazmatické koncentrace v čase (area under curve – AUC) jsou shodné při aplikaci formou kontinuální infuze a podkožní injekce, liší se však průběh křivky v čase [15–17].
Kladribin má své standardní místo v léčbě vlasatobuněčné leukemie a Waldenströmovy makroglobulinemie, kde je jeho aplikace uvedená v mezinárodních léčebných doporučeních [73]. Používá se také pro léčbu chronické lymfatické leukemie, protože jeho účinek je shodný s fludarabinem, byť více klinických studií testovalo v této indikaci fludarabin [9]. Od roku 1993 je známo, že je účinným lékem i pro LCH [7,10,18].
Publikované zkušenosti s kladribinem u LCH
Od roku 1993 se objevují četné zprávy o výborné účinnosti kladribinu u LCH, obvykle ve formě popisu případu. V prvních publikovaných případech byl kladribin použit v rámci léčby 2. či vyšší linie. Přehled publikovaných zkušeností s kladribinem u pacientů s LCH uvádíme v tab. 1 a 2. Z přehledu informací, které jsou uvedeny v tabulkách, vyplývá, že většina publikací popisuje ojedinělé pacienty či velmi malé kolektivy, menší než 10 pacientů. V odborné literatuře jsme našli pouze 4 publikace, které popisují zkušenosti s kladribinem v souborech obsahujících 10 a více nemocných.
1. Publikované zkušenosti s kladribinem (synonymem 2-chlorodeoxyadenosinem, zkratkou 2-CDA) u nemocných s LCH v dospělém věku. 
E-C – Erdheimova-Chesterova nemoc, CFA – cyklofosfamid, CR (complete response) – kompletní léčebná odpověď, PR – parciální léčebná odpověď, s.c. – subkutánně, i.v. – nitrožilně 2. Publikované zkušenosti s kladribinem (2-chlorodeoxyadenosinem, zkratkou 2-CDA) u nemocných s LCH v dětském věku. 
ARA-C – cytosin-arabinosid V citovaných popisech případů byl kladribin použit celkem u 60 pacientů dospělého věku, přičemž léčebné odpovědi (kompletní remise – CR + parciálních remise – PR) bylo dosaženo u 51 (85 %) léčených.
U pacientů dětského věku byl kladribin použit u 182 nemocných a u 110 (60,4 %) z nich bylo dosaženo léčebné odpovědi (CR + PR).
Jak je zřetelné, tak více publikovaných zkušeností je s kladribinem u dětí než u dospělých. Součet léčebných odpovědí všech publikovaných zkušeností je o něco vyšší u dospělých (85 %) než u dětí (60,4 %). Proč takový rozdíl? Vysvětlení je více. Domníváme se, že u dětí bývá více agresivních forem než u dospělých, tuto domněnku však nemůžeme podložit žádnou studií. Dalším a také velmi pravděpodobným vysvětlením je skutečnost, že v součtu léčebných odpovědí u dětí jsou zahrnuty jak popisy případů a menších souborů, tak i výsledky velké prospektivní studie obsahující 83 dětí, zatímco součet léčebných odpovědí u dospělých je vytvořen pouze ze součtu publikovaných popisů případů a malých souborů. A jak je známo, pro publikaci popisu případů bývají upřednostňovány pozitivní zkušenosti před negativními. Rozdíly v počtu léčebných odpovědí u dětí a dospělých mohly být také ovlivněny touto skutečností.
Faktem je, že kladribin dosahuje jak u dospělých, tak u dětí vysokého počtu léčebných odpovědí. V dalším textu si podrobněji všimneme pouze těch publikací, které obsahují 10 a více nemocných.
Zkušenosti ze Scripps Clinic v USA
První prací s počtem pacientů vyšším než 10 jsou zkušenosti ze Scripps Clinic. Tato práce hodnotí léčbu celkem 13 dospělých pacientů s LCH pomocí kladribinu, podávaného v dávce 0,14 mg/kg ve 2hodinových infuzích po dobu 5 dnů ve 4týdenních intervalech. Medián počtu aplikovaných cyklů pro dosažení CR byl 3 (1–6). U 7 (58 %) z 12 hodnotitelných nemocných bylo dosaženo kompletní remise a 2 (17 %) pacienti dosáhli parciální remise při nezávažných nežádoucích účincích [19].
Shrnutí publikovaných zkušeností Sheilou Weitzmanovou
V roce 1999 shrnula Sheila Weitzmanová v kritickém přehledu publikované zkušenosti. V té době měla k dispozici zprávy od 23 pacientů léčených kladribinem a od 4 pacientů léčených 2-deoxycoformycinem. Věk těchto pacientů se pohyboval od 2 měsíců do 49 let. Konstatovala, že nejčastěji byla použita dávka 0,1 mg/kg v infuzi po dobu 5–7 dnů. Počet aplikovaných cyklů se pohyboval mezi 1 až 6. Dosaženo bylo 13 (56 %) kompletních remisí u 23 pacientů léčených kladribinem. U 4 pacientů léčených deoxycoformycinem bylo dosaženo 2 kompletních a 2 parciálních remisí. Nežádoucí účinky byly zanedbatelné, a tak v závěru svého přehledu doporučuje tuto léčbu [20]. Tuto práce neuvádíme v naší tabulce, protože vychází z již publikovaných prací.
Japonská retrospektivní studie
Podobné retrospektivní shrnutí zkušeností z Japonska se objevilo až v roce 2010. Autoři shrnuli zprávy od 17 dětí, které byly léčeny kladribinem v dávce 4–9 mg/m2/den, 2–5 dní po sobě. U 9 dětí byla nemoc hodnocena jako riziková (postižení alespoň jednoho rizikového orgánu) a z těchto 9 dětí byla léčebná odpověď dosažena u 5. Celkem 8 dětí mělo multisystémovou formu LCH, ale bez postižení rizikových orgánů. V této podskupině bylo zaznamenáno 5 léčebných odpovědí [21].
Prospektivní studie Mezinárodní společnosti pro studium histiocytárních chorob
Aplikaci kladribinu (5 mg/m2 dvouhodinová infuze 5 dní po sobě) u pacientů s LCH hodnotí pouze jedna prospektivní multicentrická studie, organizovaná Mezinárodní společností pro studium histiocytárních chorob (Histiocyte Society). Do studie bylo zařazeno 92 dětí s rezistentní či relabující formou LCH. V rámci hodnocení léčebné odpovědi byly děti rozděleny do dvou skupin – s vysokým rizikem (46 hodnocených pacientů) a s nízkým rizikem (37 pacientů). Ve skupině s vysokým rizikem bylo přítomno postižení alespoň jednoho rizikového orgánu, mezi něž u dětí patřily: plíce, játra, slezina a hematopoetický systém. Ve skupině s nízkým rizikem nebyl postižen žádný rizikový orgán. Hodnoceni byli pacienti, kteří dostali 2–6 cyklů chemoterapie.
V nízce rizikové skupině (37 pacientů) bylo popsáno 23 (62 %) léčebných odpovědí. Ve vysoce rizikové skupině (46 pacientů) byla léčebná odpověď zaznamenána pouze u 10 (22 %) léčených [22].
Ze souhrnu všech publikovaných zkušeností (tab. 1 a 2) lze usoudit, že kladribin je pro nemocné s LCH velmi účinným lékem.
Ostatní purinové analogy
Zcela ojedinělé jsou zprávy popisující účinek clofarabinu [23] a 2-deoxycoformycinu [24].
Kladribin podávaný v rámci první linie léčby
U dospělých pacientů s LCH nelze léčbu odvozovat od randomizovaných klinických studií, protože u dospělých nebyla ani jedna studie dokončena. Studie, která měla za cíl ověřit účinek vinblastinu u dospělých, nebyla dokončena, snad pro problémy s nežádoucími účinky tohoto léku. Proto se léčba dospělých odvíjí od zkušeností získaných v pediatrických studiích a dále od publikovaných popisů jednotlivých případů či menších souborů nemocných.
Vysoce pozitivní zkušenosti s kladribinem a známé nežádoucí účinky vinblastinu vedly lékaře na Mayo Clinic (USA) k jeho použití v rámci léčby první linie. Jejich publikace z roku 2003 jako první popisuje účinnost kladribinu aplikovaného u dospělých pacientů s LCH v rámci léčby první linie [8].
Vlastní zkušenosti
Na základě excelentních publikovaných zkušeností s kladribinem, použitým pro léčbu první linie anebo pro léčbu recidivy LCH, a na základě vlastních zkušeností s použitím kladribinu u pacienta s dříve opakovaně relabující chorobou jsme podávali pacientům s agresivní multifokální nebo multiorgánovou chorobou kladribin v rámci první linie léčby. Celkem jsme léčili kladribinem 10 pacientů, u nichž bylo dosaženo 9 (90 %) dlouhodobých kompletních remisí. Kladribin jsme podali 8 pacientům v rámci léčby první linie a 2 pacientům v rámci léčby opakovaných relapsů nemoci. Pouze u 1 pacienta, u něhož byl kladribin použit v rámci první linie, byla nemoc na tuto léčbu rezistentní, nemoc relabovala 60 dní po ukončení léčby kladribinem [25].
Zkušenosti s aplikací kladribinu při mozkové formě LCH
Kladribin je považován za nejvhodnější lék při postižení mozku LCH. Z léků, které působí na tuto nemoc, dosahuje nejvyšších intratekálních koncentrací. Proto je pro tuto podskupinu nemocných považován za optimální lék. Jeho účinnost potvrzují i četné popisy případů, u nichž léčba vedla k vymizení LCH ložiska v mozku [8,26–29]. Ottaviano et al v roce 2003 dokonce popsali reverzibilitu diabetes insipidus při časně zahájené léčbě infiltrátu v oblasti hypotalamo-hypofyzární [28]. Velmi dobrý efekt kladribinu byl popsán i u dalšího histiocytárního onemocnění postihujícího CNS, u juvenilní xantogranulomatózy v CNS, jak bude uvedeno dále.
Regresi infiltrátů ve stopce hypofýzy můžeme potvrdit na základně vlastních zkušeností u 2 pacientů, u nichž po léčbě kladribinem zcela vymizela infiltrace stopky hypofýzy, diabetes insipidus však zůstal [25].
Zkušenosti s aplikací kladribinu u pacientů s plicní formou LCH
Izolovaná plicní forma LCH se obvykle vyskytuje pouze u kuřáků a její průběh, pokud se podaří překonat závislost na cigaretách a ukončit kouření, bývá příznivý. V případě, že plicní postižení je součástí multiorgánového poškození, je spontánní vymizení aktivity nemoci po ukončení kouření málo pravděpodobné. Klasicky se používají kortikoidy, případně vinblastin. V literatuře však byla na více případech dokumentována účinnost kladribinu u pacientů s plicní formou postižení [30,31]. Také u našich pacientů s plicním postižením při multiorgánové formě LCH jsme pozorovali léčebnou odpověď, dokumentovanou PET-CT a HRCT vyšetřením.
Kombinace kladribinu s dalšími léky při léčbě LCH
Počet informací o potenciaci účinku kladribinu kombinací s jiným lékem u pacientů s LCH je malý. Pilotní studie (10 dětí) testovala léčebný protokol pro děti, který obsahoval 9 mg/m2/den kladribinu 5 dní po sobě a 1 000 mg/m2/den cytosinarabinosidu 5 dní po sobě. Medián věku v době stanovení diagnózy byl 0,5 roku. U 7 nemocných, kteří dostali alespoň 2 cykly této léčby, poklesla aktivita nemoci. Tento léčebný protokol je zatížen závažnou neutropenií, takže není divu, že 2 děti zemřely na septický šok [32]. Zda kombinace kladribinu s cytosinarabinosidem u LCH bude úspěšná a jaké dávky budou optimální, to ukážou teprve další studie.
Účinek adenosinových analogů je potencován alkylačními cytostatiky, která poškozují nukleovou kyselinu, a adenosinové analogy blokují opravu těchto poškození. Proto u nízce agresivních lymfoproliferativních onemocnění dosáhla kombinace adenosinového analogu a alkylačního cytostatika vyššího počtu léčebných odpovědí než adenosinový analog v monoterapii. Proto Robak et al použili tuto léčbu také u dospělé pacientky s velmi agresivní formou LCH postihující játra, slezinu a břišní lymfatické uzliny. Onemocnění bylo refrakterní na vinblastin a uvedenou kombinací bylo dosaženo kompletní remise [33].
Na našem pracovišti jsme podávali kombinaci 2-chlorodeoxyadenosinu 5 mg/m2 subkutánně 5 dní po sobě s malou dávkou cyklofosfamidu 150 mg/m2 intravenózně a s dexametazonem. Touto kombinací jsme léčili 2 pacienty s LCH a 2 pacienty s Erdheimovou-Chesterovou chorobou. U pacientů s LCH, kteří nedostatečně reagovali na monoterapii kladribinem, došlo po přidání cyklofosfamidu k výraznější léčebné odpovědi. Ze 2 pacientů s Erdheimovou-Chesterovou nemocí jsme u jednoho dosáhli vymizení příznaků nemoci a dle PET-CT hodnocení parciální remise.
Kombinace purinových analogů a alkylačních cytostatik má však své limity, v závislosti na dávce byl po této léčbě u nízce agresivních lymfoproliferací popsán vyšší výskyt myelodysplastického syndromu a akutních leukemií [34–36], ale také vyšší výskyt infekčních komplikací [38,60–62].
Zda by kombinace kladribinu s jinými léky byla přínosem pro léčbu sarkomu z Langerhansových buněk, který je podstatně vzácnější než LCH, není známo. Tato choroba bývá velmi rezistentní a pouze v 1 případě byl popsán léčebný efekt agresivní polychemoterapie [36].
Nežádoucí účinky kladribinu
Na základě našich zkušeností s monoterapií kladribinem a s kombinovanou léčbou kladribin + cyklofosfamid můžeme potvrdit, že monoterapie kladribinem ve standardní dávce nevedla u žádného léčeného pacienta s LCH k poklesu neutrofilů pod 1,0 × 109/l. Při léčbě kombinací kladribinu s cyklofosfamidem jsme pozorovali myelotoxicitu III. stupně dle WHO.
S kladribinem máme zkušenosti u pacientů s vlasatobuněčnou leukemií a dále u pacientů s lymfoplazmocytárním lymfomem – Waldenströmovou makroglobulinemií. Dle našich zkušeností je hematologická tolerance kladribinu podstatně lepší u pacientů s LCH než u pacientů s výše uvedenými lymfoproliferacemi. Vysvětlujeme si to tím, že u pacientů s vlasatobuněčnou leukemií anebo lymfoplazmocytárním lymfomem způsobuje stávající infiltrace kostní dřeně patologickými buňkami snížení aktivity krvetvorby, což souvisí s častější myelosupresí při léčbě kladribinem než u pacientů s LCH, u nichž kostní dřeň nebývá nemocí difuzně infiltrována.
Účinnost kladribinu u chorob ze skupiny juvenilního xantogranulomu
Charakteristika nemocí ze skupiny juvenilního xantogranulomu
V tab. 3 uvádíme v levém sloupci klasifikaci maligních chorob odvozených od histiocytů dle Mezinárodní klasifikace krevních chorob z roku 2008. Z těchto histiocytárních chorob je snad nejčastější histiocytóza z Langerhansových buněk, ostatní choroby jsou ještě vzácnější. Jako poslední v tab. 3 je uvedena nosologická jednotka juvenilní xantogranulom. Do této skupiny se řadí neoplazie tvořené fagocytujícími histiocyty, které mají při mikroskopickém zobrazení pěnitý charakter, a proto se jim říká neoplazie z pěnitých histiocytů (foamy cells) [1,63]. Tyto neoplazie se vyskytují jak u dětí, tak u dospělých. Pěnité histiocyty obsahující lipidové inkluze žlutavé barvy, od čehož je odvozen jejich název xantogranulom neboli žlutý granulom (xanthos je řecky žlutý). Neoplazie z pěnitých histiocytů mohou nabývat z pohledu klinické manifestace hodně divergentních forem a ze samotného histologického obrazu pěnitého histiocytu či celého xantogranulomu není patolog schopen specifikovat klinickou formu [63]. Současné poznání neoplazií z pěnitých histiocytů totiž neobjasňuje, proč pěnité histiocyty tvoří jednotlivé klinické formy onemocnění [64–66].
3. Přehled všech histiocytárních forem a dále přehled forem onemocnění, které mohou způsobovat pěnité histiocyty, jejichž ložiska histologickým popisem odpovídají juvenilnímu xantogranulomu. 
Stanovení přesné klinické diagnózy neoplazie z pěnitých histiocytů vychází z popisu patologa, který obvykle ve zvýšené míře nalézá pěnité histiocyty, často i další buňky, lymfocyty, eozinofily, granulocyty, ale také obrovské mnohojaderné Toutonovy buňky. V některých místech pak nekrobiózu. V některých xantogranulomech byla prokazatelná klonalita histiocytů [63,67,68].
Tato základní informace již musí klinickému lékaři říci, že se bude asi jednat o některou z četných forem xantomatózních či xantogranulomatózních onemocnění, a je na klinikovi, aby porovnal klinické a zobrazovací nálezy u svého pacienta s informacemi z odborné literatury o těchto chorobách a stanovil pak ve spolupráci s patologem popisnou diagnózu.
Pro choroby obsahující pěnité histiocytární buňky lze v literatuře nalézt podstatně více popisných názvů, než uvádí pravý sloupec tab. 3. Terminologie dermatologické odborné literatury je velmi divergentní (xantogranulom, eruptivní xantogranulom, nekrobiotický xantogranulom, xanthoma disseminatum, papulární xantom, generalizovaný eruptivní histiocytom, progresivní nodulární histiocytom). Jejich diferenciální diagnostiku popisují četní autoři [67–72], ačkoli tyto termíny nejsou obsaženy v WHO klasifikaci krevních chorob z roku 2008.
Některé formy jsou ložiskové, omezené na kůži, jiné jsou sice ložiskové, ale postihují vnitřní orgány a případně i CNS. Neoplazie z pěnitých buněk mohou mít i multifokální a multiorgánový charakter. Generalizované onemocnění u dětí se nazývá diseminovaný juvenilní xantogranulom, u dospělých pak Erdheimova-Chesterova nemoc. I ta může být provázena periorbitálními xantelesmaty či xantogranulomy. Protože případy juvenilního xantogranulomu se vyskytují velmi vzácně, uvádíme několik obrázků (obr. 1–7), neboť zobrazení se pamatuje lépe než strohý popis případu.
1. Difuzní plošná normolipemická xantomatóza, která je u tohoto pacienta provázena monoklonální gamapataií s nízkou koncentrací monoklonálního imunoglobulinu. Xantomatóza postihuje v tomto případě pouze plošně kůži. 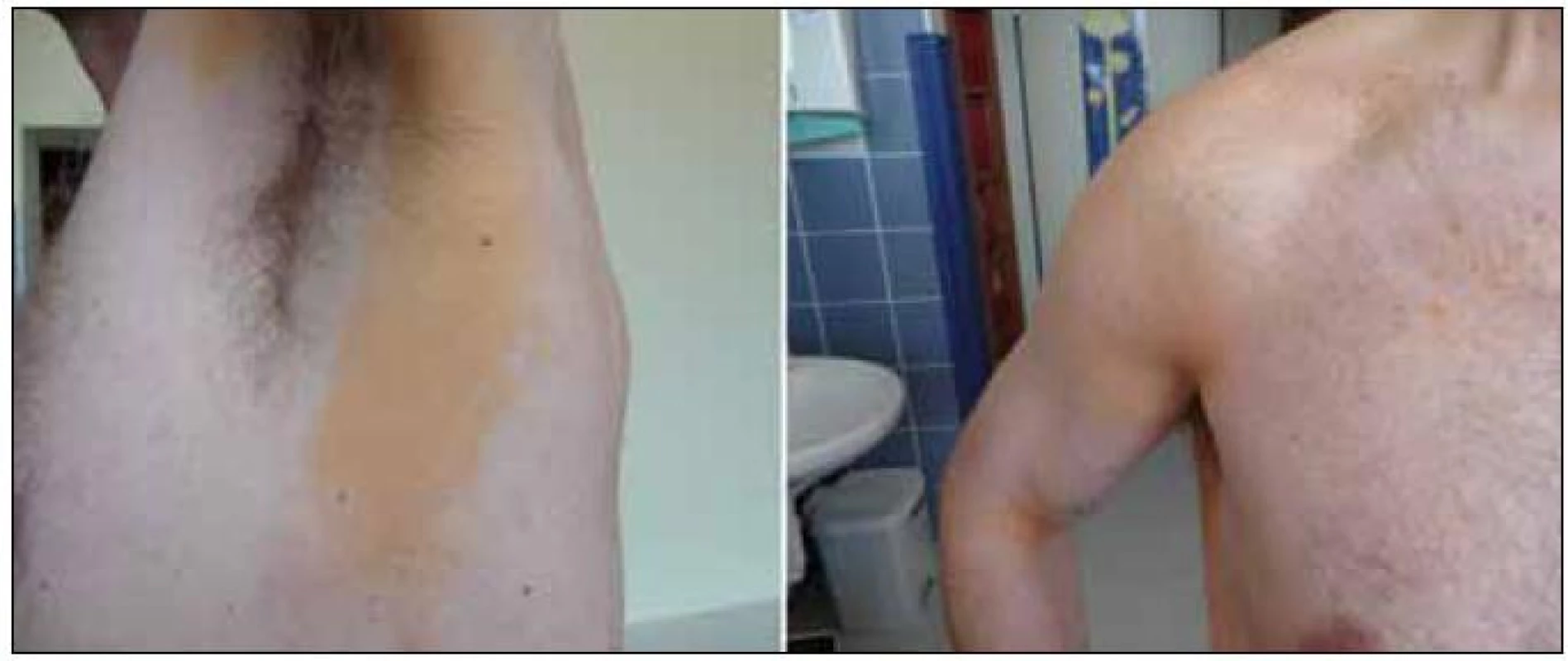
2. Periokulární xantogranulom. Na rozdíl od případu zobrazeného na obr. 1 zde tvoří xantomové buňky žlutavé granulomy, které však nezůstávající pouze na povrchu kůže, ale zasahují i do nitra orbity, jak ukazuje obr. 3, a mohou zhoršovat zrak. 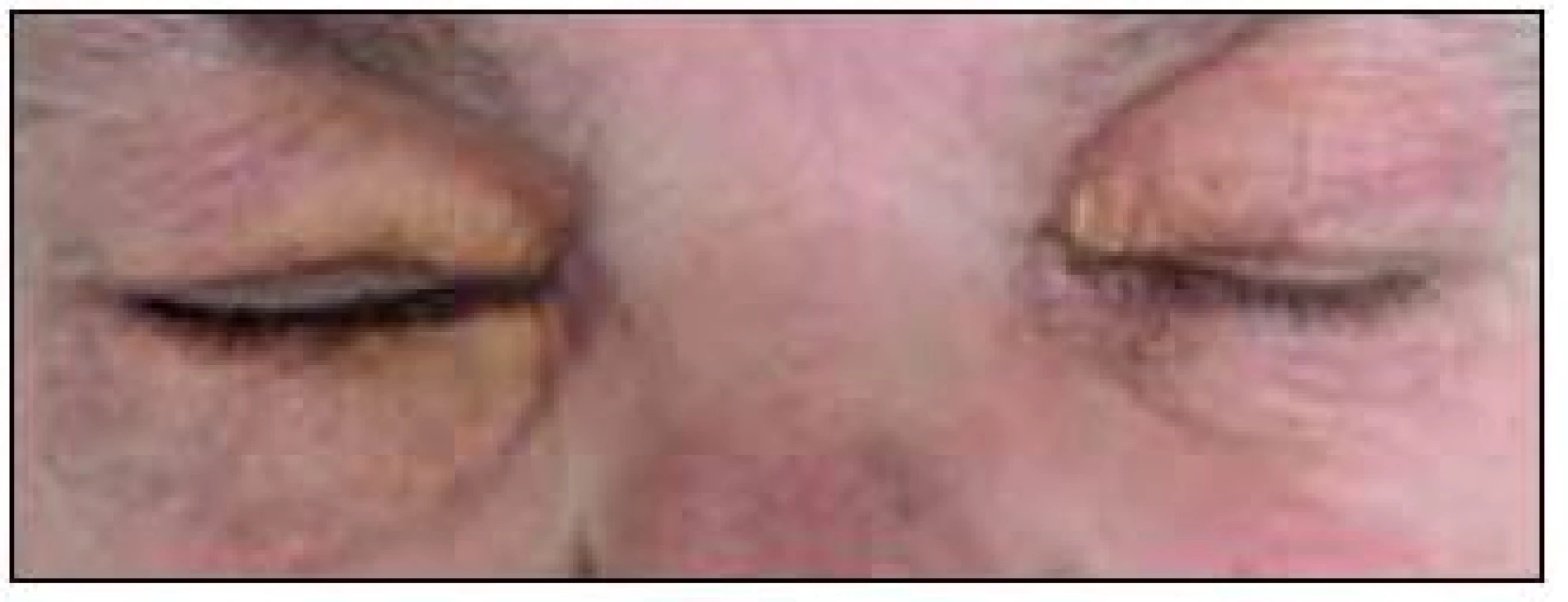
3. CT u pacientky s nekrobiotickým xantogranulomem, které prokazuje zesílení, tedy infiltraci očních svalů, neboli fakt, že proces zasahuje i do nitra orbity. 
4. Typický scintigrafický obraz pro Erdheimovu-Chesterovu chorobu, zvýšení akumulace Tc pyrofosfátů v dlouhých končetinách. V jejich kostní dřeni je infiltrace z pěnitých histiocytů a cytokiny jimi produkované stimulují vychatávání Tc, proto tento typický obraz. RTG a CT zobrazení prokáže zesílení kortikalis v těchto oblastech a případně fibrózu v retroperitoneu. 
5. Xantalasmata u pacienta s Erdheimovou-Chesterovou nemocí postihující skelet, retroperitoneum, CNS, paranazální sinus a s normálními lipidy. 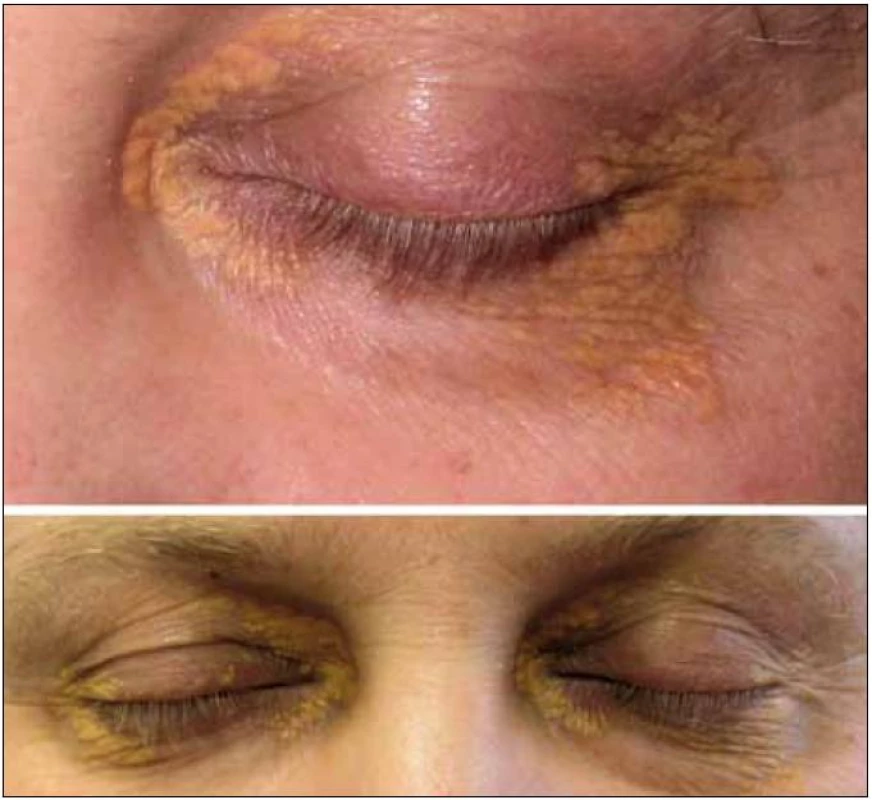
6. Bolestivá nažloutlá indurace, které dle histologického hodnocení splňovala kritéria xantogranulomu. Jde o metabolicky velmi aktivní neoplazii, jak ukazuje obr. 7. 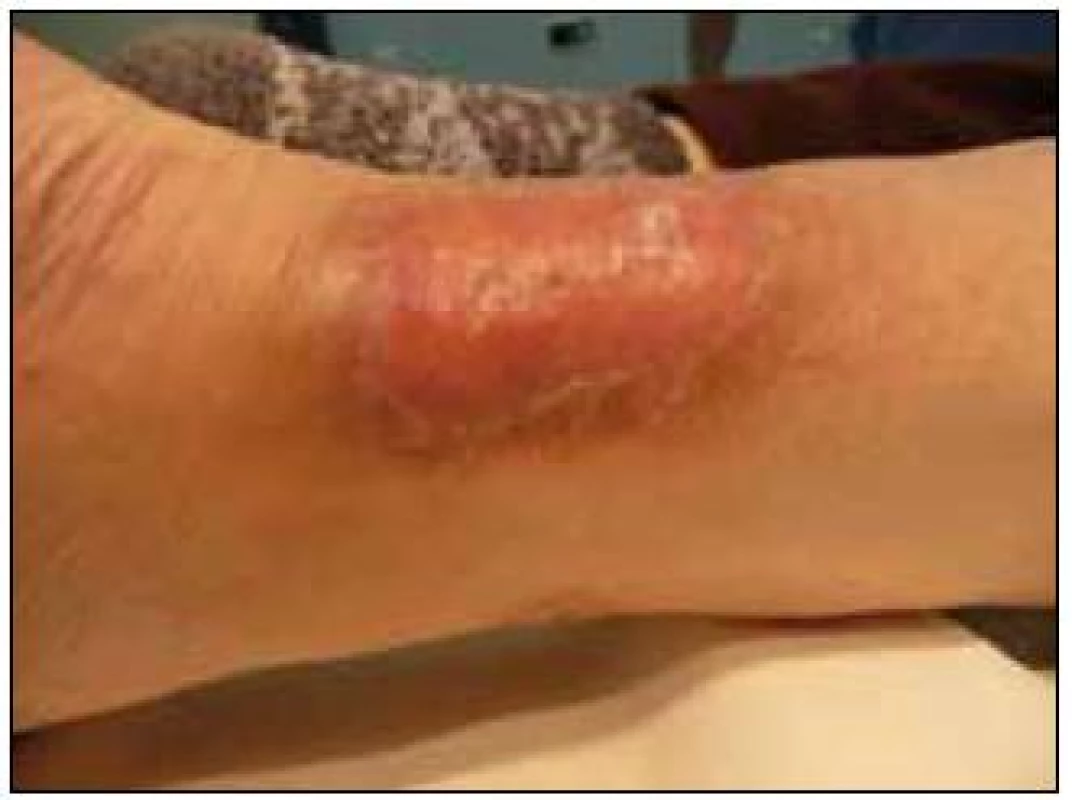
7. PET CT obraz xantogranulomu dolní končetiny s vysokou akumulací fluorodeoxyglukózy. 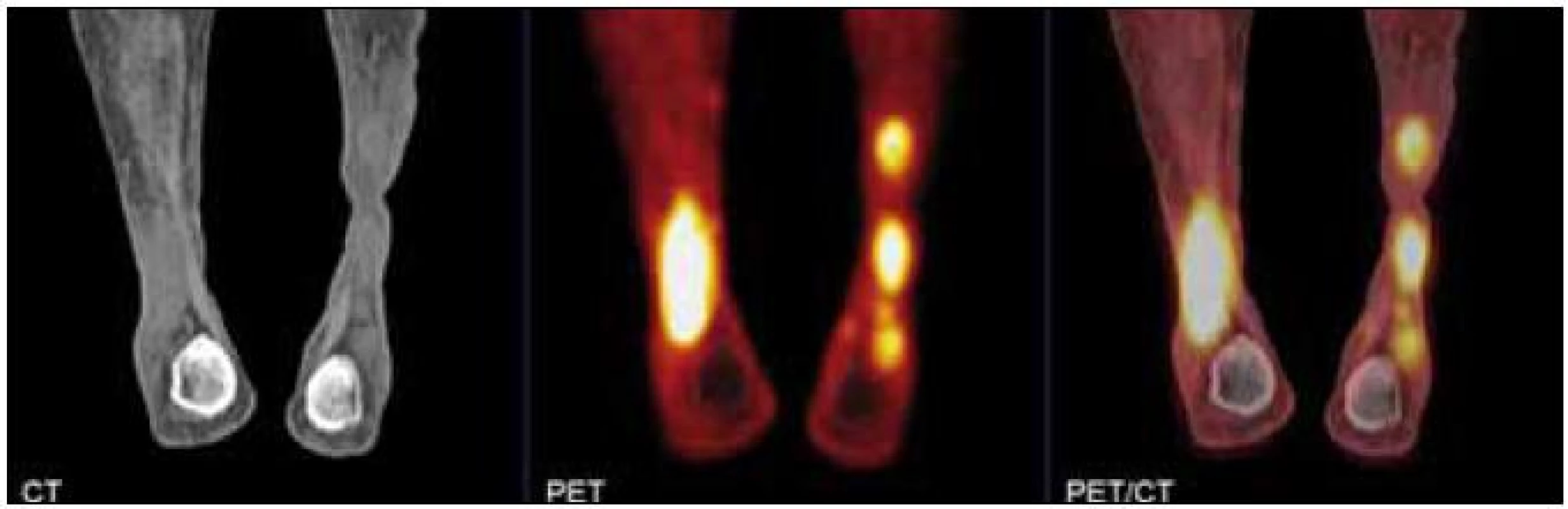
Léčba neoplazií ze skupiny juvenilního xantogranulomu
V literatuře lze nalézt četné léčebné postupy, které však byly jen výjimečně úspěšné. Nekrobiotický xantogranulom i difuzní ploché xantomy představují chronické, pomalu progredující onemocnění. Operační léčba nebyla nikdy dlouhodobě úspěšná. V literatuře lze nalézt popisy případů léčených alkylačními cytostatiky či antimetabolity, ale léčebný efekt těchto léčebných postupů nebyl velký. Poznání, že v monocytech je vysoká aktivita enzymu deoxycytidinkinázy a velmi nízká aktivita inaktivačního (defosforylačního) enzymu a že kladribin na tyto buňky toxicky působí jak in vivo, tak in vitro [13], rozšířila použití kladribinu i na tyto choroby, zcela odlišné od nemocí odvozených od klidových či pomalu proliferujících lymfocytů [38,58].
Dnes víme, že se kladribin osvědčil u dětí s juvenilním xantogranulomem a také u případů s Erdheimovou-Chesterovou nemocí.
První popsali podání kladribinu s dobrým léčebných úspěchem v této indikaci Sheidow et al v roce 2000 [74]. Na tuto zkušenost navázali Myra et al, kteří v rámci iniciální léčby svého pacienta podali etoposid, při absenci léčebné odpovědi pak cyklofosfamid a cyklosporin. Když uvedené 3 testované léčebné alternativy nebyly dostatečně účinné, tak jako 4. léčebnou linii podávali pacientovi kladribin v dávce 0,14 mg/kg/den 5 dní po sobě kontinuální infuzí Hickmanovým katetrem. Po 2 cyklech byla zřetelná léčebná odpověď. Celkem aplikovali 6 cyklů a uvádí, že při hodnocení po 2 letech stále trvala léčebná odpověď [75].
Pozitivní zkušenosti s kladribinem v této indikaci uvádí také Aouba et al a Reddy et al [49,76].
Blouin et al popisují podání 2-chlorodeoxyadenosinu a cytosin-arabinosidu po selhání předchozí léčby kombinací etoposidu, kortikoidu a vinblastinu. Tato léčba vedla u pacienta s juvenilním xantogranulomem ke kompletní remisi [77].
Podobně byla u dalšího dítěte s postižením CNS juvenilním xantogranulomem léčba zahájena prednisonem a vinblastinem, byla bez efektu a teprve až aplikace kladribinu v monoterapii navodila léčebnou odpověď [78].
Popsán je ale i případ, kdy byly buňky juvenilního xantogranulomu na tuto léčbu zcela rezistentní [79].
Velmi dobrý efekt 2-chlorodeoxyadenosinu u dospělého muže, trpícího generalizovanou formou juvenilního xantogranulomu – Erdheimovou-Chesterovou chorobou, jsme prokázali při opakovaném PET-CT vyšetření [80].
V roce 2011 se objevila první práce popisující účinek kladribinu při léčbě plošných normolipemických xantomů [81], pro něž do té doby nebyla známa účinná léčba.
Léčba sinusové histiocytózy s masivní lymfadenopatií (Rosaiovy-Dorfmanovy choroby)
Rosaiova-Dorfmanova choroba je další z raritních chorob z velké skupiny histiocytárních onemocnění. Typicky postihuje děti a adolescenty. Typická je masivní krční lymfadenopatie způsobená akumulací lymfocytů a histiocytů v sinech lymfatických uzlin. Mnohé z těchto histiocytů obsahují uvnitř buňky intaktní lymfocyty. Tento jev byl nazván emperipolesis neboli lymphophagocytosis. Tato fagocytóza však může postihnout i další buňky. Tyto histiocyty exprimují S-100 protein a četné další monocyto-makrofágové antigeny. Krční lymfadenopatie je obvykle nebolestivá, bývá provázena zvýšenou rychlostí sedimentace erytrocytů, polyklonální gamapatií a leukocytózou s neutrofilií. V některých případech však dochází k postižení i dalších uzlin a byly popsány případně i mimouzlinové infiltráty. V diferenciální diagnostice je vždy nutné vyloučit maligní histiocytózu a hemofagocytární syndrom.
Sinusová histiocytóza s masivní lymfadenopatií je, podobně jako nemoci ze skupiny juvenilního xantogranulomu, podstatně vzácnější než LCH. Proto i publikací o této nemoci je podstatné méně. Na tomto místě bychom chtěli pouze zdůraznit, že dle popisů případů pacientů s touto chorobou dosahuje kladribin u těchto pacientů velmi dobré léčebné odpovědi [82–86].
Závěry pro praxi
- Klasickou léčbou pro multifokální formu a multiorgánovou formu LCH je kombinace vinblastinu, merkaptopurinu a prednisonu [58]. Novou alternativu představuje kladribin v monoterapii, aplikovaný maximálně v 6 cyklech. V dávce 5 mg/m2/den subkutánně 5 dní po sobě v měsíčních intervalech je tato léčba velmi dobře tolerována. Domníváme se, že tato léčba má u dospělých pacientů přednost před léčbou vinblastinem při multifokální a multiorgánové formě LCH.
- Cyklofosfamid a dexametazon potencují účinek kladribinu při léčbě nízce agresivních lymfoproliferativních onemocnění, zdá se, že to platí i pro léčbu LCH u dospělých. Tato léčba je však zatím u dospělých velmi málo prozkoumána. Zkušenosti získané u lymfoproliferativních onemocnění však hovoří o podstatně vyšším počtu pozdních nežádoucích účinků typu sekundárního MDS.
- V případě neúspěchu kladribinu lze použít léčebné postupy obvyklé při léčbě maligních lymfomů obsahující etoposid, zakončené případně vysokodávkovanou chemoterapií s transplantací autologní krvetvorné tkáně.
- S léčbou extrémně vzácných chorob ze skupiny juvenilního xantogranulomu je málo zkušeností, nicméně i u těchto nemocných byla prokázána účinnost kladribinu, a proto by měl být použit, pokud neoplazie z pěnitých buněk vyžadují systémovou léčbu.
Práce byla vypracována v rámci aktivity následujících grantů: výzkumného záměru MZ ČR: FUNDIN MZ0MOU2005, výzkumného záměru MŠMT MSM0021622434, specifického výzkumu MUNI/A/0784/2011 a grantů IGA MZd NT11154, NT12130 a NT12215.
prof. MUDr. Zdeněk Adam, CSc.
www.fnbrno.cz
e-mail: z.adam@fnbrno.cz
Doručeno do redakce: 31. 10. 2011
Přijato po recenzi: 14. 2. 2012
Sources
1. Kodet R, Mrhalová M. Histiocytóza z Langerhansových buněk z pohledu patologa. Vnitř Lék 2010; 56 (Suppl 2): 27–38.
2. Mottl M. Histiocytóza z Langerhansových buněk u dětí a dospívajících. Vnitř Lék 2010; 56 (Suppl 2): 64–73.
3. Doberauer C. Langerhans cell histiocytosis in adults. Vnitř Lék 2010; 56 (Suppl 2): 22–26.
4. Fichter J, Doberauer C, Seegenschmiedt H. Langerhans cell histiocytosis in adults: An interdisciplinary challenge. Dtsch Arztebl 2007; 104: A2347–A2353.
5. Aricò M, Girschikofsky M, Généreau T et al. Langerhans cell histiocytosis in adults. Report from the International Registry of the Histiocyte Society. Eur J Cancer 2003; 39 : 2341–2348.
6. Haupt R, Nanduri V, Calevo MG. Permanent consequences in Langerhans cell histiocytosis patients: a pilot study from the Histiocyte Society-Late Effects Study Group. Pediatr Blood Cancer 2004; 42 : 438–444.
7. Allen CE, McClain KL. Langerhans cell histiocytosis: a review of past, current and future therapies. Drugs Today 2007; 43 : 627–643.
8. Pardanani A, Phyliky RL, Li CY et al. 2-Chlorodeoxyadenosine therapy for disseminated Langerhans cell histiocytosis. Mayo Clin Proc 2003; 78 : 301–306.
9. Adam Z. Hematologické choroby nízkého stupně malignity. Standardní léčebné postupy a zhodnocení účinnosti 2-chlorodeoxyadenosinu. Brno: Lékařská fakulta MU 1998.
10. Robak T, Jamroziak K, Gora-Tybor J et al. Comparison of cladribine plus cyclophosphamide with fludarabine plus cyclophosphamide as first-line therapy for chronic lymphocytic leukemia: a phase III randomized study by the Polish Adult Leukemia Group (PALG-CLL3 Study). J Clin Oncol 2010; 28 : 1863–1869.
11. Arnér ES, Spasokoukotskaja T, Juliusson G et al. Phosphorylation of 2-chlorodeoxyadenosine (CdA) in extracts of peripheral blood mononuclear cells of leukaemic patients. Br J Haematol 1994; 87 : 715–718.
12. Kawasaki H, Carrera CJ, Piro LD et al. Relationship of deoxycytidine kinase and cytoplasmic 5‘-nucleotidase to the chemotherapeutic efficacy of 2-chlorodeoxyadenosine. Blood 1993; 81 : 597–601.
13. Carrera CJ, Terai C, Piro LD et al. Potent toxicity of 2-chlorodeoxyadenosine toward human monocytes in vitro and in vivo. A novel approach to immunosupressive therapy. J Clin Invest 1996; 86 : 1480–1488.
14. Liliemark J. The clinical pharmacokinetics of cladribine. Clin Pharmacokinet 1997; 32 : 120–131.
15. Bryson MH, Sorkin EM. Cladribine: A review of its pharmacodynamics and pharmacokinetics properties and therapeutic potential in haematologic malignancies. Drugs 1993; 46 : 872–894.
16. Liliemark J, Albertioni F, Hassan M et al. On the bioavailability of oral and subcutaneous 2-chloro-2‘-deoxadenosine in human: alternative routes of administration. J Clin Oncol 1992; 10 : 1514–1518.
17. Robak T, Lech-Maranda E, Korycka A et al. Purine nucleoside analogs as immunosuppressive and antineoplastic agents: mechanism of action and clinical activity. Curr Med Chem 2006; 13 : 3165–3189.
18. McClain KL. Drug therapy for the treatment of Langerhans cell histiocytosis. Expert Opin Pharmacother 2005; 6 : 2435–2441.
19. Saven A, Burian C. Cladribine activity in adult Langerhans-cell histiocytosis. Blood 1999; 93 : 4125–4130.
20. Weitzman S, Wayne AS, Arceci R at al. Nucleoside analogues in the therapy of Langerhans cell histiocytosis: a survey of members of the histiocyte society and review of the literature. Med Pediatr Oncol 1999; 33 : 476–481.
21. Imamura T, Sato T, Shiota Y et al. Outcome of pediatric patients with Langerhans cell histiocytosis treated with 2 chlorodeoxyadenosine: a nationwide survey in Japan. Int J Hematol 2010; 91 : 646–651.
22. Weitzman S, Braier J, Donadieu J et al. 2‘-Chlorodeoxyadenosine (2-CdA) as salvage therapy for Langerhans cell histiocytosis (LCH). Results of the LCH-S-98 protocol of the Histiocyte Society. Pediatr Blood Cancer 2009; 53 : 1271–1276.
23. Rodriguez-Galindo C, Jeng M, Khuu P et al. Clofarabine in refractory Langerhans cell histiocytosis. Pediatr Blood Cancer 2008; 51 : 703–706.
24. McCowage GB, Frush DP, Kurtzberg J. Successful treatment of two children with Langerhans‘ cell histiocytosis with 2‘-deoxycoformycin. J Pediatr Hematol Oncol 1996; 18 : 154–158.
25. Adam Z, Szturz P, Ďuraš J et al. Použití kladribinu v první linii léčby multifokální nebo multiorgánové formy histiocytózy z Langerhansových buněk u dospělých osob. Vnitř Lék 2010; 56 (Suppl 2): 141–150.
26. Watts J, Files B. Langerhans cell histiocytosis: central nervous system involvement treated successfully with 2-chlorodeoxyadenosine. Pediatr Hematol Oncol 2001; 18 : 199–204.
27. Dhall G, Finlay JL, Dunkel IJ et al. Analysis of outcome for patients with mass lesions of the central nervous system due to Langerhans cell histiocytosis treated with 2-chlorodeoxyadenosine. Pediatr Blood Cancer 2008; 50 : 72–79.
28. Ottaviano F, Finlay JL. Diabetes insipidus and Langerhans cell histiocytosis: a case report of reversibility with 2-chlorodeoxyadenosine. J Pediatr Hematol Oncol 2003; 25 : 575–577.
29. Stine KC, Saylors RL, Saccente S et al. Efficacy of continuous infusion 2-CDA (cladribine) in pediatric patients with Langerhans cell histiocytosis. Pediatr Blood Cancer 2004; 43 : 81–84.
30. Aerni MR, Aubry MC, Myers JL et al. R. Complete remission of nodular pulmonary Langerhans cell histiocytosis lesions induced by 2-chlorodeoxyadenosine in a non-smoker. Respir Med 2008; 102 : 316–319.
31. Lazor R, Etienne-Mastroianni B, Khouatra C et al. Progressive diffuse pulmonary Langerhans cell histiocytosis improved by cladribine chemotherapy. Thorax 2009; 64 : 274–275.
32. Bernard F, Thomas C, Bertrand Y et al. Multi-centre pilot study of 2-chlorodeoxyadenosine and cytosine arabinoside combined chemotherapy in refractory Langerhans cell histiocytosis with haematological dysfunction. Eur J Cancer 2005; 41 : 2682–2689.
33. Robak T, Kordek R, Robak E et al. Langerhans cell histiocytosis in a patient with systemic lupus erythematosus: a clonal disease responding to treatment with cladribine, and cyclophosphamide. Leuk Lymphoma 2002; 43 : 2041–2046.
34. Tam CS, Seymour JF, Prince HM. Treatment--releated myelodysplasia following fludarabine combinations chemotherapy. Haematologica 2006; 91 : 1546–1550.
35. Bowcock SJ, Rassam SM, Lim Z et al. High incidence of therapy releated myelodysplasia and acute leukemia in general haematology clinic patients treated with fludarabine and cyclophosphamide for indolent lymphoproliferative disorders. Br J Haematol 2006; 134 : 242–243.
36. Yoshimi A, Kumano K, Motokura T et al. ESHAP therapy effective in patient with Langerhans cell sarcoma. Int J Hematol 2008; 87 : 532–537.
37. Saven A, Figueroa ML, Piro LD et al. 2-Chlorodeoxyadenosine to treat refractory histiocytosis X. N Engl J Med 1993; 329 : 734–735.
38. Saven A, Piro LD. 2-chlorodeoxyadenosine: a newer purine analog active in the treatment of indolent lymphoid malignancies. Ann Intern Med 1994; 120 : 784–791.
39. Saven A, Foon KA, Piro LD. 2-Chlorodeoxyadenosine-induced complete remissions in Langerhans-cell histiocytosis. Ann Intern Med 1994; 121 : 430–432.
40. Dallafior S, Pugin P, Cerny T et al. Successful treatment of a case of cutaneous Langerhans cell granulomatosis with 2-chlorodeoxyadenosine and thalidomide. Hautarzt 1995; 46 : 553–560.
41. Dimopoulos MA, Theodorakis M, Kostis E et al. Treatment of Langerhans cell histiocytosis with 2 chlorodeoxyadenosine. Leuk Lymphoma 1997; 25 : 187–189.
42. Conias S, Strutton G, Stephenson G. Adult cutaneous Langerhans cell histiocytosis. Australas J Dermatol 1998; 39 : 106–108.
43. Grau J, Ribera JM, Tormo M et al. Results of treatment with 2-chlorodeoxyadenosine in refractory or relapsed Langerhans cell histiocytosis. Study of 9 patients. Med Clin (Barc) 2001; 116 : 339–342.
44. Chang SE, Koh GJ, Choi JH et al. Widespread skin-limited adult Langerhans cell histiocytosis: long-term follow-up with good response to interferon alpha. Clin Exp Dermatol 2002; 27 : 135–137.
45. Rodriguez-Galindo C, Kelly P, Jeng M et al. Treatment of children with Langerhans cell histiocytosis with 2-chlorodeoxyadenosine. Am J Hematol 2002; 69 : 179–184.
46. Goh NS, McDonald CE, MacGregor DP et al. Successful treatment of Langerhans cell histiocytosis with 2-chlorodeoxyadenosine. Respirology 2003; 8 : 91–94.
47. Sander CS, Kaatz M, Elsner P. Successful treatment of cutaneous Langerhans cell histiocytosis with thalidomide. Dermatology 2004; 208 : 149–152.
48. Mottl H, Rob L, Stary J et al. Langerhans cell histiocytosis of vulva in adolescent. Int J Gynecol Cancer 2007; 17 : 520–524.
49. Aouba A, Larousserie F, Le Guern V et al. Spumous histiocytic oligoarthritis coexisting with systemic Langerhans‘ cell histiocytosis: case report and literature review. Joint Bone Spine 2009; 76 : 701–704.
50. Black A, Bershow A, Allen PS et al. Seventy-nine-year-old man with Langerhans cell histiocytosis treated with cladribine. J Am Acad Dermatol 2011; 65 : 681–683.
51. Baumann M, Cerny T, Sommacal A et al. Langerhans cell histiocytosis with central nervous system involvement-complete response to 2-chlorodeoxyadenosine after failure of tyrosine kinase inhibitor therapies with sorafenib and imatinib. Hematol Oncol 2011. doi: 10.1002//hon.1005. Epub ahead of print.
52. Frost JD, Wiersma SR. Progressive Langerhans cell histiocytosis in an infant with Klinefelter syndrome successfully treated with allogeneic bone marrow transplantation. J Pediatr Hematol Oncol 1996; 18 : 396–400.
53. Stine KC, Saylors RL, Williams LL et al. 2-Chlorodeoxyadenosine (2-CDA) for the treatment of refractory or recurrent Langerhans cell histiocytosis (LCH) in pediatric patients. Med Pediatr Oncol 1997; 29 : 288–292.
54. Choi SW, Bangaru BS, Wu CD et al. Gastrointestinal involvement in disseminated Langerhans cell histiocytosis (LCH) with durable complete response to 2-chlorodeoxyadenosine and high-dose cytarabine. J Pediatr Hematol Oncol 2003; 25 : 503–506.
55. Mottl H, Ganevová M, Radvanská J et al. Treatment results of Langerhans cell histiocytosis with LSH II protocol. Čas Lék Česk 2005; 144 : 753–755.
56. Mottl H, Starý J, Chánová M et al. Treatment of recurrent Langerhans cell histiocytosis in children with 2-chlorodeoxyadenosine. Leuk Lymphoma 2006; 47 : 1881–1884.
57. Biswas G, Khadwal A, Arora B et al. Activity and toxicity of 2-CDA in Langerhans cell histiocytosis: a single institutional experience. Indian J Cancer 2007; 44 : 137–141.
58. Apollonsky N, Lipton JM. Treatment of refractory Langerhans cell histiocytosis (LCH) with a combination of 2-chlorodeoxyadenosine and cytosine arabinoside. J Pediatr Hematol Oncol 2009; 31 : 53–56.
59. Pant C, Madonia P, Bahna SL et al. Langerhans cell histiocytosis, a case of Letterer Siwe disease. J La State Med Soc 2009; 161 : 211–212.
60. Betticher DC, Fey MF, von Rohr A et al. High incidence of infections after 2-chlorodeoxyadenosine (2-CDA) therapy in patients with malignant lymphomas and chronic and acute leukaemias. Ann Oncol 1994; 5 : 57–64.
61. Braiteh F, Kurzrock R. CASE 1. Langerhans cell histiocytosis of the thyroid. J Clin Oncol 2006; 24 : 522–523.
62. Dewan M, Al-Ghamdi AA, Zahrani MB. Lessons to be learned by Langerhans‘ cell histiocytosis. J R Soc Promot Health 2008; 128 : 41–46.
63. Plank L. Diagnostická patologie non-Langerhans cell histiocytóz. Vnitř Lék 2010; 56 (Suppl 2): 39–63.
64. Guo J, Wang J. Adult ortbital xanthogranulomatous disease: review of the literature. Arch Pathol Lab Med 2009; 133 : 1994–1997.
65. Sivak-Callcott JA, Rootman J, Rasmussen SL et al. Adult xanthogranulomatous disease of the orbit and ocular adnexa: new immunohistochemical findings and clinical review. Br J Ophthalmol 2006; 90 : 602–608.
66. Vick VL, Wilson MW, Fleming JC et al. Orbital and eyelid manifestations of xanthogranulomatous diseases. Orbit 2006; 25 : 221–225.
67. Janssen D, Fölster-Holst R, Harms D et al. Clonality in juvenile xanthogranuloma. Am J Surg Pathol 2007; 31 : 812–813.
68. Decaux O, Laurat E, Perlat A et al. Systemic manifestations of monoclonal gammopathy. Eur J Intern Med 2009; 20 : 457–461.
69. Alexander AS, Turner R, Uniate L et al. Xanthoma disseminatum: a case report and literature review. Br J Radiol 2005; 78 : 153–157.
70. Vick VL, Wilson MW, Fleming JC et al. Orbital and eyelid manifestations of xanthogranulomatous diseases. Orbit 2006; 25 : 221–225.
71. Asarch A, Thiele JJ, Ashby-Richardson H et al. Cutaneous disseminated xantogranuloma in adult: case report and review of the literature. Cutis 2009; 83 : 243–249.
72. Altman J, Winkelmann RK. Diffuse normolipemic plane xanthoma. Generalized xanthelasma. Arch Dermatol 1962; 85 : 633–640.
73. Saven A, Piro LD. 2-Chlorodeoxyadenosine: a potent antimetabolite with major activity in the treatment of indolent lymphoproliferative disorders. Hematol Cell Ther 1996; 38 (Suppl 2): S93–S101.
74. Sheidow TG, Nicolle DA, Heathcote JG. Erdheim-Chester disease: two cases of orbital involvement. Eye (Lond) 2000; 14 : 606–612.
75. Myra C, Sloper L, Tighe PJ et al. Treatment of Erdheim-Chester disease with cladribine: a rational approach. Br J Ophthalmol 2004; 88 : 844–847.
76. Reddy VC, Salomão DR, Garrity JA et al. Periorbital and ocular necrobiotic xanthogranuloma leading to perforation. Arch Ophthalmol 2010; 128 : 1493–1494.
77. Blouin P, Yvert M, Arbion F et al. Juvenile xanthogranuloma with hematological dysfunction treated with 2CDA-AraC. Pediatr Blood Cancer 2010; 55 : 757–760.
78. Rajendra B, Duncan A, Parslew R et al. Successful treatment of central nervous system juvenile xanthogranulomatosis with cladribine. Pediatr Blood Cancer 2009; 52 : 413–415.
79. Orsey A, Paessler M, Lange BJ et al. Central nervous system juvenile xanthogranuloma with malignant transformation. Pediatr Blood Cancer 2008; 50 : 927–930.
80. Adam Z, Koukalová R, Šprláková A et al. Úspěšná léčba Erdheimovy Chesterova nemoci chemoterapií obsahující 2-chlorodeoxyadenosine. Popis dvou případů a přehled literatury. Vnitř Lék 2011; 57 : 576–589.
81. Khezri F, Gibson LE, Tefferi A. Xanthoma disseminatum: effective therapy with 2-chlorodeoxyadenosine in a case series. Arch Dermatol 2011; 147 : 459–464.
82. Rosai J, Dorfman R. Sinus histiocytosis with massive lymphadenopathy. A newly recognized benign clinicopathological entity. Arch Pathol 1969; 87 : 63–70.
83. Konca C, Ozkurt ZN, Deger M et al. Extranodal multifocal Rosai-Dorfman disease: response to 2-chlorodeoxyadenosine treatment. Int J Hematol 2009; 89 : 58–62.
84. Aouba A, Terrier B, Vasiliu V et al. Dramatic clinical efficacy of cladribine in Rosai-Dorfman disease and evolution of the cytokine profile: towards a new therapeutic approach. Haematologica 2006; 91 (Suppl 12): ECR52.
85. Tasso M, Esquembre C, Blanco E et al. Sinus histiocytosis with massive lymphadenopathy (Rosai-Dorfman disease) treated with 2-chlorodeoxyadenosine. Pediatr Blood Cancer 2006; 47 : 612–615.
86. Williams W, Craver RD, Correa H et al. Use of 2-chlorodeoxyadenosine to treat infantile myofibromatosis. J Pediatr Hematol Oncol 2002; 24 : 59–63.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 6-
All articles in this issue
- Cardiac symptoms in a patient with Addison’s disease and hypothyreosis on the basis of autoimmune polyglandular syndrome type II
- Teleangiectasia hereditaria haemorrhagica –Osler-Weber-Rendu syndrome. Case study and treatment experience
- The viewpoint of an internal medicine at the issue of an aortoenteric fistula
- Recurrent prosthetic endocarditis in a 21-year old patient with renal transplantation treated with allogeneic homograft
- Deficits in lipid lowering therapy and achieving target lipid concentrations in patients with high risk of a cardiovascular event
- Catheter ablation of atrio-ventricular accessory pathways in the era of ablation therapy of complex arrhythmias: a changing perspective for oncoming generation of electrophysiologists
- Disturbances of hemostasis in sepsis
- An effect of continuous and intermittent renal replacement therapy on antibiotic treatment in critically ill patients with sepsis – a practice-based perspective of vancomycin and gentamycin therapies
- Cladribine is highly effective in the treatment of Langerhans cell histiocytosis and rare histiocytic disorders of the juvenile xanthogranuloma group
- Oxidative stress in patients on regular hemodialysis and peritoneal dialysis
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Teleangiectasia hereditaria haemorrhagica –Osler-Weber-Rendu syndrome. Case study and treatment experience
- Disturbances of hemostasis in sepsis
- Cladribine is highly effective in the treatment of Langerhans cell histiocytosis and rare histiocytic disorders of the juvenile xanthogranuloma group
- An effect of continuous and intermittent renal replacement therapy on antibiotic treatment in critically ill patients with sepsis – a practice-based perspective of vancomycin and gentamycin therapies
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

