-
Medical journals
- Career
Metabolizmus vitaminu D
Authors: V. Kulda
Authors‘ workplace: Ústav lékařské chemie a biochemie Lékařské fakulty UK Plzeň, přednosta prof. MUDr. Jaroslav Racek, DrSc.
Published in: Vnitř Lék 2012; 58(5): 400-404
Category: Appendix: Vitamin D
Overview
Vitamin D je souhrnný název pro cholekalciferol (vitamin D3) a ergokalciferol (vitamin D2), což jsou prekurzory hormonů hrajících důležitou roli v regulaci metabolizmu vápníku a fosfátů. V tomto přehledném článku je popsána tvorba vitaminu D3 v kůži působením slunečního světla, transport vitaminu D a jeho metabolitů v krvi, tvorba aktivní hormonální formy – kalcitriolu (1,25-dihydroxyvitaminu D) hydroxylací v játrech a ledvinách a ukončení jeho účinku vznikem inaktivních metabolitů.
Klíčová slova:
vitamin D – UVB – ergokalciferol – cholekalciferol – kalcitriol – vitamin D vázající proteinVitamin D se historicky řadí do skupiny vitaminů rozpustných v tucích, ale už v 70. letech 20. století výzkum odhalil, že se vlastně jedná o velice důležitý a fylogeneticky velmi starý prekurzor hormonů, jejichž hlavní fyziologickou funkcí je regulace metabolizmu vápníku a fosfátů [1,2]. Vitamin D patří chemicky mezi sekosteroidy, což jsou steroidy, u kterých je jeden z cyklů cyklopentanoperhydrofenantrenového skeletu neuzavřený, v případě vitaminu D je otevřený kruh „B“. Způsob označování cyklů a číslování atomů [3] je ukázán na základní struktuře cholestanu (obr. 1).
Image 1. Označování cyklů a číslování atomů (cholestan). 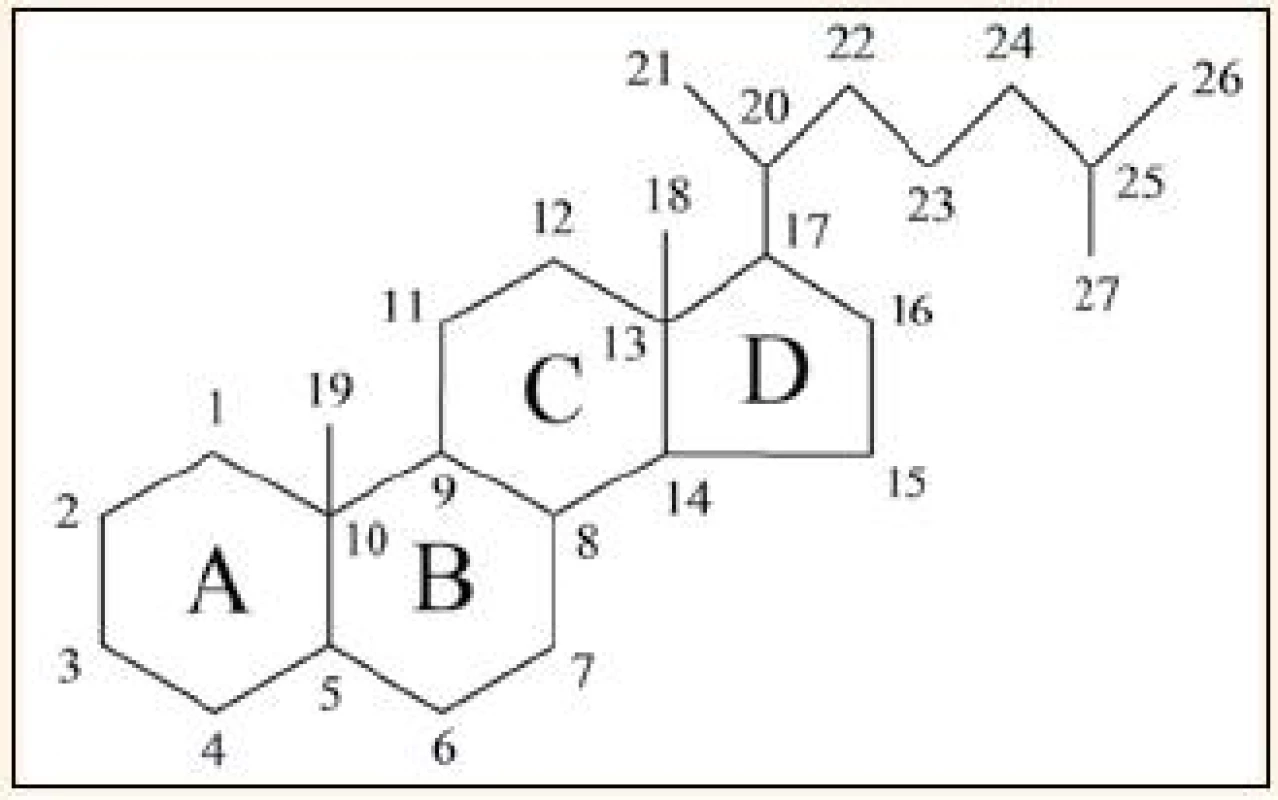
Rozlišují se 2 hlavní formy vitaminu D: vitamin D2 (ergokalciferol) a vitamin D3 (cholekalciferol), lišící se v postranním řetězci, kde je u ergokalciferolu navíc jedna metylová skupina a dvojná vazba. Metabolizmus obou látek je obdobný, proto termín „vitamin D“ bez bližší specifikace odkazuje na obě formy, ať už D2, nebo D3. Vitamin D je jednak přijímán potravou, ale za normálních okolností je jeho hlavním zdrojem endogenní produkce v kůži vystavené slunečnímu světlu [4]. Vitamin D2 vzniká z ergosterolu, který se vyskytuje jen u hub a rostlin. Vyšší organizmy produkují vitamin D3, pro jehož vznik je výchozím metabolitem 7-dehydrocholesterol (7-DHC), což je jeden z přirozených meziproduktů biosyntézy cholesterolu. 7-DHC se vyskytuje ve významném množství v kůži, přičemž asi 65 % kožního 7-DHC se nachází v epidermis, zbylých 35 % v dermis. Buněčná lokalizace je následující: většina 7-DHC je soustředěna v buněčných membránách (80 %), volně v cytosolu je jen asi 20 %. Hladinu 7-DHC udržuje enzym 7-DHC NADPH reduktáza, enzym katalyzující přeměnu 7-DHC na cholesterol a naopak [5]. 7-DHC podléhá neenzymové fotolytické reakci, při které se štěpí kruh „B“ a vzniká previtamin D3, který se při tělesné teplotě relativně pomalu přeměňuje na vitamin D3 (poločas izomerace je asi 2,5 hod). Pro tuto fotochemickou konverzi je účinná UVB složka záření (vlnové délky 280–320 nm). Účinnost syntézy vitaminu D v kůži vlivem slunečního záření nezávisí jen na době expozice, ale záleží i na zeměpisné šířce, ročním období, denní době, pigmentaci kůže, používání opalovacích krémů a povrchu těla krytém oblečením [6–8]. Zajímavé je, že tvorba vitaminu D v kůži vykazuje jisté autoregulační prvky. Déle trvající expozice UVB záření vede k přeměně previtaminu D3 na biologicky inaktivní izomery tachysterol a lumisterol, i vitamin D3 se dále může měnit na různé inaktivní produkty (suprasterol I, suprasterol II, 5,6-trans vitamin D3). To vysvětluje, proč nedochází k intoxikaci vitaminem D ani při dlouhodobém vystavení kůže slunečnímu záření [9]. Pochody vedoucí ke vzniku vitaminu D jsou znázorněny v obr. 2.
Image 2. Biosyntéza vitaminu D. 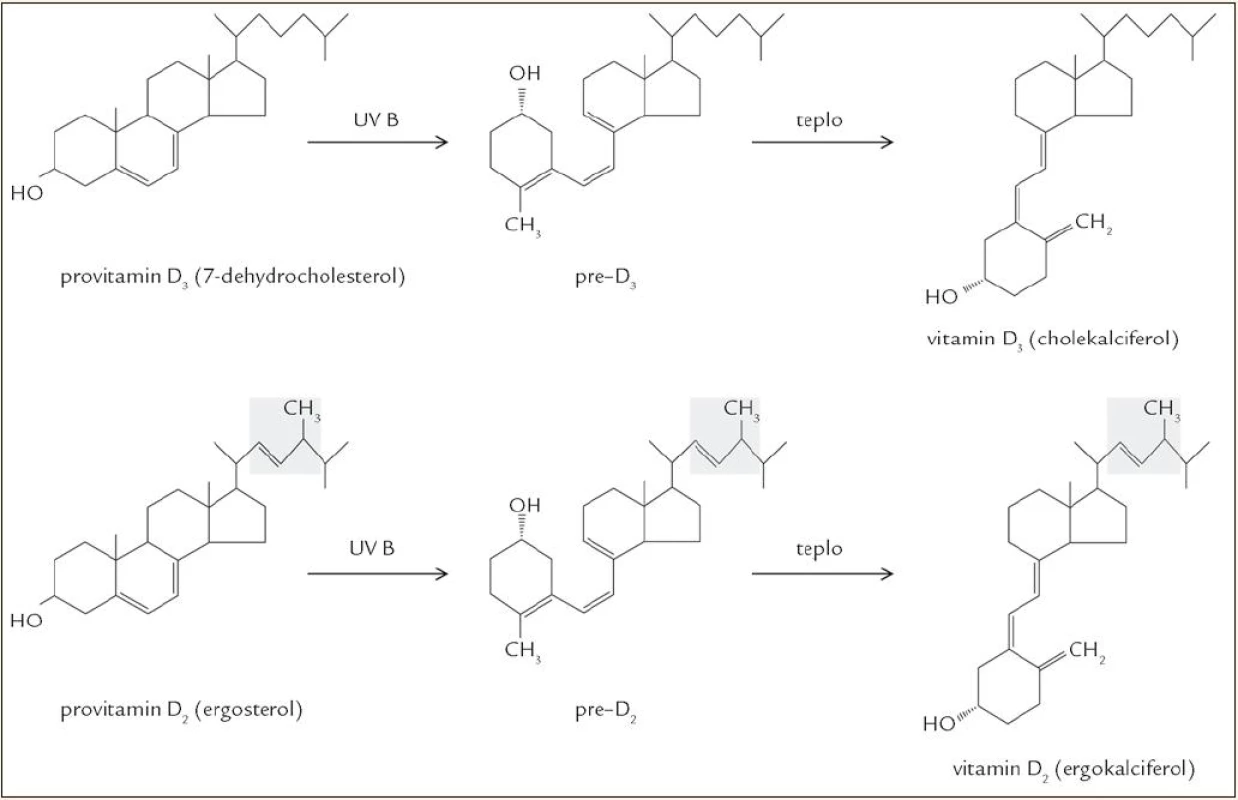
Paradoxní je, že expozice UVB záření má na jedné straně příznivé účinky (syntéza vitaminu D), na druhé straně stojí ale i mnohé nežádoucí účinky (kožní erytém, poškození DNA tvorbou pyrimidinových dimerů vedoucí za určitých okolností až ke vzniku kožních nádorů), přičemž tyto účinky od sebe nelze oddělit. V poslední době je hodně diskutováno o tom, že snaha předcházet kožním nádorům vyhýbáním se slunci a používáním ochranných krémů může vést k nedostatečné tvorbě vitaminu D [10–12].
Tvorba vitaminu D je fylogeneticky velmi stará, už i fytoplankton a zooplankton obsahuje významná množství vitaminu D2, D3 a jejich prekurzorů. Funkce vitaminu D u těchto primitivních organizmů je neznámá. Vysoká koncentrace vitaminu D v tukové tkáni a játrech ryb je vysvětlitelná právě jeho bohatým příjmem z těchto potravních zdrojů. Ačkoli produkce v kůži ryb je možná, bude pravděpodobně zanedbatelná, protože jen málo UVB záření proniká pod vodu do hloubky, kde žije většina ryb [13].
Obě formy vitaminu D, ergokalciferol i cholekalciferol, jsou biologicky inaktivní a vyžadují dvoukrokovou aktivaci hydroxylací v játrech a následně v ledvinách. V játrech dochází k hydroxylaci na uhlíku 25, a vzniká tak 25(OH)D (25-hydroxyvitamin D, kalcidiol). Druhá hydroxylace probíhá v ledvinách, kde se v játrech vzniklý 25(OH)D hydroxyluje na uhlíku 1, a výsledkem je hormonálně aktivní forma 1,25(OH)2D (1,25-dihydroxyvitamin D, kalcitriol), která je zodpovědná za biologické funkce vitaminu D [14,15]. Hydroxylace vedoucí k aktivaci a reakce katabolizmu vedoucí k inaktivním produktům jsou ukázány na obr. 3.
Image 3. Metabolizmus vitaminu D. 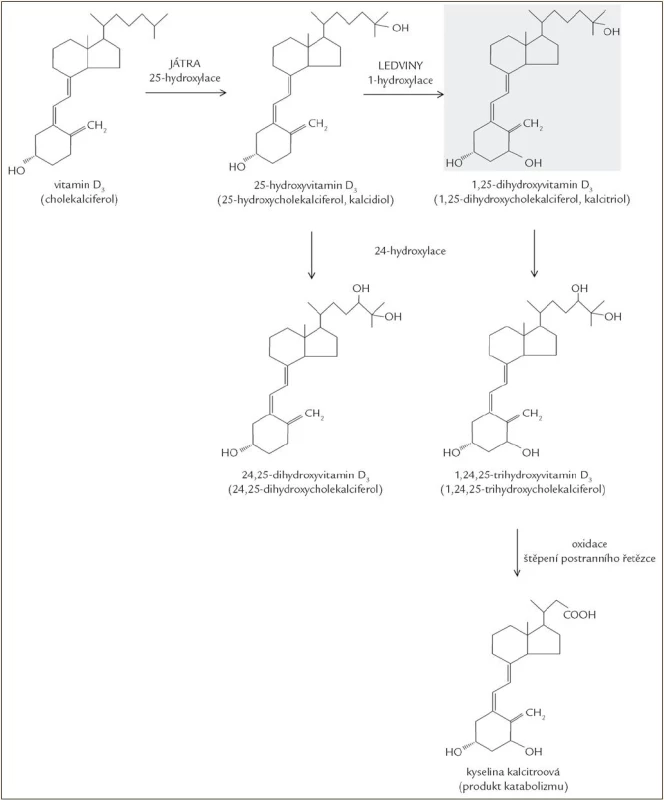
Vitamin D3 vzniklý v kůži v membránách buněk epidermis je uvolňován do krve, kde je transportován vázaný na vitamin D vázající protein (DBP – vitamin D binding protein), jen malá část je přenášena na albuminu a v lipoproteinech. DBP patří do stejné genové rodiny jako albumin a α-fetoprotein, se kterými je strukturou příbuzný. Genomová analýza ukázala, že DBP je nejstarší člen této genové rodiny [16]. DBP je, stejně tak jako albumin a další bílkoviny krevní plazmy, tvořen v játrech. Při elektroforetickém dělení plazmatických bílkovin se pohybuje ve frakci α-globulinů. Biologický poločas je krátký (2,5–3 dny), s tím souvisí i jeho relativně vysoká denní produkce (10 mg/kg) [17]. Plazmatická koncentrace DBP se zvyšuje v těhotenství a při podávání estrogenů, ke snížení dochází při jaterních onemocněních, malnutrici a nefrotickém syndromu [18].
DBP limituje dostupnost a prodlužuje biologický poločas vitaminu D a jeho metabolitů. Jednotlivé metabolity se liší afinitou, nejvyšší afinitu vykazuje 25(OH)D a produkt katabolizmu 24,25(OH)2D, zatímco účinná forma 1,25(OH)2D má afinitu k tomuto transportnímu proteinu 10–100krát nižší. Pro intracelulární receptor vitaminu D (VDR) platí opak, vykazuje vysokou afinitu pro 1,25(OH)2D a jen velmi nízkou pro 25(OH)D. Proto je také možný přechod účinné formy,tj. 1,25(OH)2D dovnitř do buněk, kde se snadno váže na svůj receptor (VDR).
DBP je menší protein s molekulovou hmotností 58 kDa, v ledvinách částečně prochází glomerulem a pro metabolizmus vitaminu D je velice důležité, že je v proximálním tubulu resorbován za účasti proteinu megalinu. Megalin (označovaný také jako glykoprotein 330 nebo LDL receptor related protein-2) je velký glykoprotein (600 kDa), který hraje klíčovou roli v reabsorpci nízkomolekulárních proteinů profiltrovaných v glomerulu. Megalin je hojný v kartáčkovém lemu luminálního povrchu buněk proximálního tubulu, zodpovídá za zachycení širokého spektra ligandů a jejich směrování do nitra buněk procesem endocytózy. Megalin obsahuje řadu domén, kromě transmembránové domény zajišťující zakotvení v membráně, ligandy vážících domén a domén zodpovědných za internalizaci jsou to domény způsobující uvolnění navázaných ligandů v lysozomech, které je závislé na pH [19].
Hydroxylace vitaminu D v játrech vedoucí ke vzniku 25(OH)D je katalyzována cytochrom-P450-vita-min D-25-hydroxylázami, z nichž fyziologicky nejvýznamnější je mikrozomální CYP2R1, která je vysoce specifická pro hydroxylaci vitaminu D na pozici 25. Mutace genu pro tento enzym byla nalezena u pacientů s nízkými hladinami cirkulujícího 25(OH)D a klasickými příznaky deficitu vitaminu D [20]. Na tvorbě 25(OH)D se snad mohou podílet i jiné jaterní cytochromy P450, např. mitochondriální CYP27A1, ale ne všechny cytochromy P450 schopné hydroxylovat vitamin D při vysokých koncentracích in vitro se mohou uplatňovat při nízkých fyziologických koncentracích in vivo [21].
25(OH)D je nejlepším ukazatelem stavu metabolizmu vitaminu D v těle, jedná se o nejhojnější metabolit vitaminu D v krevním séru, který navíc zohledňuje jak vitamin D vytvořený endogenně v kůži, tak i exogenní přívod vitaminu D potravou [22].
25(OH)D je transportován v krvi ve vazbě na DBP, v proximálním tubulu ledvin je za pomoci megalinu endocytózou vychytáván a hydroxylován na pozici 1 za vzniku 1,25(OH)2D (kalcitriolu). Enzym zodpovědný za tuto přeměnu je mitochondriální cytochrom-P450-monooxygenáza 25(OH)D-1-α-hydroxyláza (CYP27B1), aktivita tohoto enzymu je přísně regulována [23], jedná se o klíčové místo rozhodující o vznikajícím množství aktivní hormonálně působící formy.
1,25(OH)2D se váže intracelulárně na receptor vitaminu D (VDR – vitamin D receptor), který je zodpovědný za většinu, ne-li všechny biologické účinky. Aktivovaný VDR působí jako specifický transkripční faktor, který ovlivňuje expresi genů regulovaných vitaminem D. V současné době je VDR intenzivně studován, ukazuje se, že kromě regulace genové exprese může přímo aktivovat některé buněčné signální dráhy [24].
V katabolizmu 1,25(OH)2D je důležitý mitochondriální cytochrom P450 enzym CYP24A1. Zajímavé je, že tento enzym provádí hydroxylace nejen na uhlíku C24, ale je schopen hydroxylovat i uhlík C23. C24 hydroxylací vzniká 1,24,25(OH)3D, jehož katabolizmus pokračuje štěpením postranního řetězce a následuje oxidace na karboxylovou kyselinu (kalcitroová kyselina). C23 hydroxylace vede k tvorbě laktonu v postranním řetězci. Vzniká tak řada různých inaktivních metabolitů. Hydroxylaci na pozici 24 může podléhat i 25(OH)D, ze kterého je tvořen relativně neaktivní 24,25(OH)2D, snižuje se tak pool 25(OH)D dostupného pro 1-hydroxylaci [25].
Intenzivní klinický výzkum vitaminu D v posledních letech ukázal na celosvětový problém nízkých hladin vitaminu D v populaci, které jsou signifikantně asociované s nepříznivými dopady na zdravotní stav [26,27]. Znalost metabolizmu vitaminu D má zásadní význam pro hledání nejvhodnějších cest k řešení tohoto problému.
Poděkování
Tato práce byla podpořena projektem LF UK Plzeň SVV-2012-264806.
Seznam zkratek a synonym
- D2 – vitamin D2; ergokalciferol
- D3 – vitamin D3; cholekalciferol
- 7-DHC – 7-dehydrocholesterol
- 25(OH)D – 25-hydroxyvitamin D; 25-hydroxycholekalciferol; kalcidiol
- 1,25(OH)2D – 1,25-dihydroxyvitamin D; 1,25-dihydroxycholekalciferol; kalcitriol
- 24,25(OH)2D – 24,25-dihydroxyvitamin D; 24,25-dihydroxycholekalciferol
- 1,24,25(OH)3D – 1,24,25-trihydroxyvitamin D; 1,24,25-trihydroxycholekalciferol
- DBP – vitamin D vázající protein; vitamin D binding protein
- VDR – receptor pro vitamin D; vitamin D receptor
MUDr. Vlastimil Kulda
www.lfp.cuni.cz/biochemie
e-mail: Vlastimil.Kulda@lfp.cuni.cz
Doručeno do redakce: 29. 11. 2011
Sources
1. Holick MF. McCollum Award Lecture, 1994: vitamin D – new horizons for the 21st century. Am J Clin Nutr 1994; 60 : 619–630.
2. Mohr SB. A brief history of vitamin D and cancer prevention. Ann Epidemiol 2009; 19 : 79–83.
3. Waisser K. Nové české názvosloví organické chemie. Praha: Karolinum 2002 : 147–158.
4. Chiellini G, DeLuca HF. The importance of stereochemistry on the actions of vitamin D. Curr Top Med Chem 2011; 11 : 840–859.
5. Lehmann B, Meurer M. Vitamin D metabolism. Dermatol Ther 2010; 23 : 2–12.
6. Webb AR, Kline L, Holick MF. Influence of season and latitude on the cutaneous synthesis of vitamin D3: exposure to winter sunlight in Boston and Edmonton will not promote vitamin D3 synthesis in human skin. J Clin Endocrinol Metab 1988; 67 : 373–378.
7. Armas LA, Dowell S, Akhter M et al. Ultraviolet-B radiation increases serum 25-hydroxyvitamin D levels: the effect of UVB dose and skin color. J Am Acad Dermatol 2007; 57 : 588–593.
8. Chen TC, Chimeh F, Lu Z et al. Factors that influence the cutaneous synthesis and dietary sources of vitamin D. Arch Biochem Biophys 2007; 460 : 213–217.
9. Webb AR, DeCosta BR, Holick MF. Sunlight regulates the cutaneous production of vitamin D3 by causing its photodegradation. J Clin Endocrinol Metab 1989; 68 : 882–887.
10. Wolpowitz D, Gilchrest BA. The vitamin D questions: how much do you need and how should you get it? J Am Acad Dermatol 2006; 54 : 301–317.
11. Rhodes LE, Webb AR, Fraser HI et al. Recommended summer sunlight exposure levels can produce sufficient [> or =20 ng ml(–1)] but not the proposed optimal [> or = 32 ng ml(–1)] 25(OH)D levels at UK latitudes. J Invest Dermatol 2010; 130 : 1411–1418.
12. Holick MF. Sunlight, UV-radiation, vitamin D and skin cancer: how much sunlight do we need? Adv Exp Med Biol 2008; 624 : 1–15.
13. Bikle DD. Vitamin D: an ancient hormone. Exp Dermatol 2011; 20 : 7–13.
14. Christakos S, Ajibade DV, Dhawan P et al. Vitamin D: metabolism. Endocrinol Metab Clin North Am 2010; 39 : 243–253.
15. Spustová V, Dzúrik R. Vitamin D: synthesis, metabolism, regulation, and an assessment of its deficiency in patients with chronic renal disease. Vnitř Lék 2004; 50 : 537–543.
16. Noël ES, Reis MD, Arain Z et al. Analysis of the Albumin/alpha-Fetoprotein/Afamin Group specific component gene family in the context of zebrafish liver differentiation. Gene Expr Patterns 2010; 10 : 237–243.
17. Kawakami M, Blum CB, Ramakrishnan R et al. Turnover of the plasma binding protein for vitamin D and its metabolites in normal human subjects. J Clin Endocrinol Metab 1981; 53 : 1110–1116.
18. Bikle DD, Gee E, Halloran B et al. Free 1,25-dihydroxyvitamin D levels in serum from normal subjects, pregnant subjects, and subjects with liver disease. J Clin Invest 1984; 74 : 1966–1971.
19. Kaseda R, Hosojima M, Sato H et al. Role of megalin and cubilin in the metabolism of vitamin D(3). Ther Apher Dial 2011; 15: (Suppl 1): 14–17.
20. Cheng JB, Levine MA, Bell NH et al. Genetic evidence that the human CYP2R1 enzyme is a key vitamin D 25-hydroxylase. Proc Natl Acad Sci USA 2004; 101 : 7711–7715.
21. Sakaki T, Sugimoto H, Hayashi K et al. Bioconversion of vitamin D to its active form by bacterial or mammalian cytochrome P450. Biochim Biophys Acta 2011; 1814 : 249–256.
22. Adams JS, Hewison M. Update in vitamin D. J Clin Endocrinol Metab 2010; 95 : 471–478.
23. Prosser DE, Jones G. Enzymes involved in the activation and inactivation of vitamin D. Trends Biochem Sci 2004; 29 : 664–673.
24. Haussler MR, Jurutka PW, Mizwicki M et al. Vitamin D receptor (VDR)-mediated actions of 1α,25(OH)2vitamin D3: genomic and non-genomic mechanisms. Best Pract Res Clin Endocrinol Metab 2011; 25 : 543–559.
25. Omdahl JL, Morris HA, May BK. Hydroxylase enzymes of the vitamin D pathway: expression, function, and regulation. Annu Rev Nutr 2002; 22 : 139–166.
26. Mithal A, Wahl DA, Bonjour JP et al. IOF Committee of Scientific Advisors (CSA) Nutrition Working Group. Global vitamin D status and determinants of hypovitaminosis D. Osteoporos Int 2009; 20 : 1807–1820.
27. Pazdiora P, Svobodova S, Fuchsova R et al. Vitamin D in colorectal, breast, prostate and lung cancer: a pilot study. Anticancer Res 2011; 31 : 3619–3621.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 5-
All articles in this issue
- Endoskopická retrográdní cholangiografie pomocí jednobalónkového enteroskopu u pacientů s Roux-Y hepatikojejunoanastomózou
- Interakce glukokortikoidů s warfarinem u chronických zánětlivých (autoimunitních) chorob
- Skórovací systémy hodnotící prognózu komunitních pneumonií
- Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie
- Význam vitaminu D – nové poznatky, které svědčí o jeho úloze v medicíně
- Polymorfizmus genu pro receptor vitaminu D
- Vitamin D a riziko kardiovaskulárních chorob
- Vitamin D a aortální stenóza
- Vitamin D a neurologická onemocnění
- Endokrinní mikrosystémy kalcitriolu – vývojové aspekty a předpoklady jejich celoživotní funkčnosti
- Metabolizmus vitaminu D
- D vitamin a imunita
- Stane se vitamin D novým antidiabetikem?
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metabolizmus vitaminu D
- Vitamin D a neurologická onemocnění
- Oční víčka se žlutými granulomy a kašel – periokulární xantogranulom dospělých spojený s astmatem. Popis případu a přehled klinických forem juvenilního xantogranulomu a terapie
- Skórovací systémy hodnotící prognózu komunitních pneumonií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

