-
Medical journals
- Career
Stratifikace rizika u pacientů s Brugada syndromem
Authors: M. Bébarová 1; P. Lokaj 1,2
Authors‘ workplace: Fyziologický ústav Lékařské fakulty MU Brno, přednostka prof. MUDr. Nataša Honzíková, CSc. 1; Interní kardiologická klinika Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jindřich Špinar, CSc., FESC 2
Published in: Vnitř Lék 2012; 58(4): 280-285
Category: Reviews
Overview
Brugada syndrom (BrS) coby jeden z nejčastěji diagnostikovaných geneticky podmíněných arytmogenních syndromů je zodpovědný za více než 4 % všech případů náhlé smrti a až za 20 % případů náhlé smrti u pacientů bez strukturálního poškození srdce. Náhlá smrt je často prvním příznakem tohoto onemocnění a nastává nejčastěji již ve 4. dekádě života pacientů s BrS. Jedinou prokazatelně účinnou metodou léčby BrS, např. prevence náhlé srdeční smrti, je implantace kardioverteru-defibrilátoru. Ta je jednoznačně metodou volby u symptomatických pacientů. Oproti tomu u asymptomatických pacientů je vzhledem k možným významným nežádoucím účinkům implantace kardioverteru-defibrilátoru nutné individuálně důkladně zvážit riziko vzniku život ohrožujících arytmií, tedy provést stratifikaci rizika. Tato přehledová práce podává přehled rizikových faktorů doporučených pro stratifikaci rizika u pacientů s BrS v roce 2005, a to včetně jejich podpory či odmítnutí ve studiích publikovaných v následujících letech. Dále jsme se zaměřili na výčet hlavních rizikových faktorů nově navržených po roce 2005.
Klíčová slova:
Brugada syndrom – náhlá smrt – stratifikace rizika – rizikové faktory – prognózaÚvod
Geneticky podmíněné syndromy vyznačující se poruchami elektrické činnosti srdce včetně život ohrožujících arytmií dnes představují neopominutelnou součást kardiologie. Vedle syndromu dlouhého intervalu QT je jedním z nejčastěji diagnostikovaných tzv. Brugada syndrom (BrS), který byl poprvé popsán v roce 1992 bratry Pedrem a Josepem Brugadovými [1]. Je definován jako primární porucha elektrické srdeční činnosti projevující se typickým elektrokardiografickým (EKG) obrazem, který se vyznačuje elevací úseku ST v pravém prekordiu. BrS je zodpovědný za více než 4 % všech případů náhlé srdeční smrti (NSS) a až za 20 % případů NSS u pacientů bez strukturálního poškození srdce [2]. NSS bývá přitom poměrně často prvním příznakem tohoto onemocnění [3]. Na druhé straně, implantace kardioverteru-defibrilátoru (ICD), která je u pacientů s BrS doposud jedinou prokazatelně účinnou prevencí NSS [4,5], s sebou nese nepříjemné vedlejší účinky zahrnující např. riziko infekční endokarditidy a perforace srdce [6] či neadekvátní výboje u tachykardií se širokým QRS [7–9]. Toto je zvláště alarmující vzhledem k tomu, že k NSS dochází u pacientů s BrS v poměrně nízkém věku, nejčastěji v období 4. dekády života [10], a pacienti tedy prožívají s ICD značnou část života. Po stanovení diagnózy BrS u doposud asymptomatického pacienta hraje proto zásadní roli zodpovědné posouzení rizika vzniku život ohrožujících arytmií, tzv. stratifikace rizika, u tohoto jedince. V české literatuře byla problematika BrS několikrát zpracována [11,12]. Zcela nedávno byla publikována práce, v níž jsem podala aktualizovaný přehled klinických a patofyziologických aspektů BrS [13], avšak s opominutím oblasti týkající se právě stratifikace rizika u pacientů s BrS. Tomuto významnému tématu je samostatně věnována tato přehledová práce.
Postup doporučený pro stratifikaci rizika u pacientů s BrS v roce 2005 a jeho podpora či zpochybnění v pozdějších pracích
V roce 2005 byla publikována rozsáhlá studie zpracovaná kolektivem Antzelevitch et al [2] představující souhrnnou zprávu z 2. konference podporované americkou Heart Rhythm Society a její evropskou obdobou European Heart Rhythm Association. Tato konference byla uspořádána v září roku 2003 za účelem dosažení jednotného aktuálního pohledu na diagnostiku, stratifikaci rizika a léčbu u pacientů s BrS, a to na základě dostupných dat z klinického i základního výzkumu. Z pokynů obsažených v tomto dokumentu lze vycházet při posuzování rizika vzniku život ohrožujících (neboli maligních) arytmií (komorová tachykardie, fibrilace komor), např. rizika NSS, u pacientů s BrS.
Jak ukazuje obr. 1, pacienty s BrS je možné rozdělit na 2 základní podskupiny. Jednak se jedná o pacienty symptomatické – ať už po prodělané příhodě NSS, ze které byli úspěšně resuscitováni, či s méně závažnými klinickými příznaky typu synkopy, u kterých však byla vyloučena nekardiální příčina – a pak o pacienty asymptomatické. V případě diagnózy BrS u symptomatického pacienta je, jak již bylo zmíněno, jediným prokazatelně efektivním způsobem léčby BrS, tedy v podstatě prevence NSS, implantace ICD [4,5]. Jde tedy o jednoznačně doporučený postup [2].
Image 1. Doporučený postup při indikaci implantace implantabilního kardioverteru-defibrilátoru u pacientů s Brugada syndromem. NSS – náhlá srdeční smrt, PSK – programovaná stimulace komor, ICD – implantabilní kardioverter-defibrilátor. 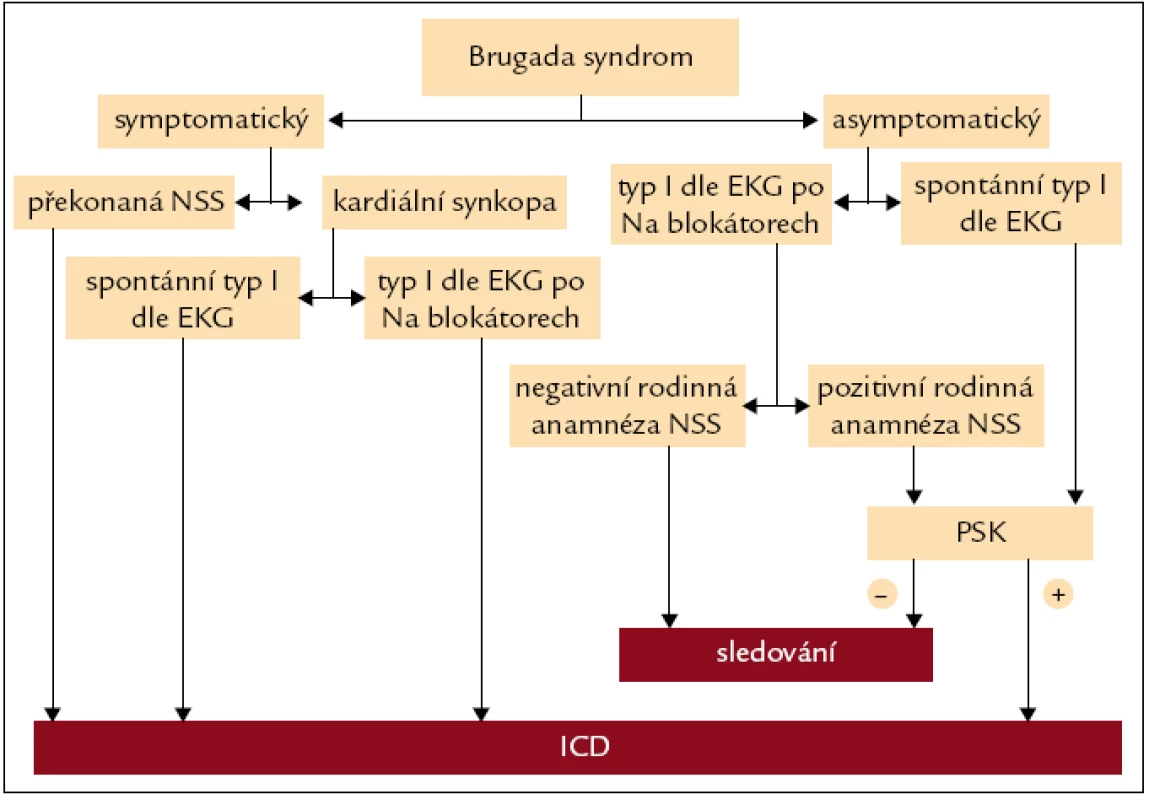
Mnoho pacientů s BrS zůstává bez zjevných klinických příznaků, zvláště pokud se vyvarují provokujících faktorů (např. horečka [14], aplikace určitých léčiv [15]). V některých pracích je frekvence výskytu příznaků u původně asymptomatických pacientů s BrS během dlouhodobého sledování prakticky nulová (Letsas et al [16] – 33 asymptomatických pacientů, průměrná délka sledování 5,3 let), jindy nízká až velmi nízká (Probst et al [17] – 0,5 % za rok sledování, 654 asymptomatických pacientů, 2,6 roku; Eckardt et al [18] – 0,8 % celkem, 123 asymptomatických pacientů, 3,3 roku; Sacher et al [7] – 4,3 % celkem, 114 asymptomatických pacientů, 2,6 roku). Vzhledem k tomu, že NSS bývá často prvním příznakem BrS [3], je však nutné asymptomatické pacienty podrobit důkladnému procesu stratifikace rizika, jak již bylo zmíněno.
Antzelevitch et al [2] zařadili mezi hlavní parametry určující riziko konkrétního pacienta s BrS osobní anamnézu NSS nebo synkopy, spontánní výskyt EKG obrazu typu I a komorovou fibrilaci vyvolanou během programované stimulace komor (PSK) z hrotu pravé komory (3 extrastimuly, délka cyklu ≥ 200 ms). Zdůraznili především výsledky studie zpracované kolektivem Brugada J et al [19], která poskytuje výstup z pozorování 547 pacientů s BrS, což představuje největší vzorek pacientů s BrS do té doby. Riziko NSS je podle těchto autorů významně vyšší u jedinců se spontánně se vyskytujícím EKG obrazem typu I (7,7krát), u mužů (5,5krát v porovnání s ženami) či po vyvolání trvalé komorové arytmie během PSK (8krát). V této studii nebyla naopak pozorována žádná závislost rizika na rodinné anamnéze BrS.
Význam mnohých výše uvedených rizikových faktorů byl potvrzen v pracích publikovaných po roce 2005. Např. významně horší prognózu mužů pozorovali v poměrně velké studii na 384 pacientech s BrS Benito et al [20]. Doposud asi nejrozsáhlejší studii věnující se dlouhodobé prognóze pacientů s BrS provedli Probst et al [17], kteří analyzovali klinická data 1 029 po sobě jdoucích pacientů z tzv. FINGER (France, Italy, Netherlands, Germany) registru pacientů s BrS. Tato práce, v souladu s doporučeními vydanými v roce 2005 [2], podpořila význam detekce spontánního výskytu EKG obrazu typu I a osobní anamnézy NSS a synkopy u pacientů s BrS pro stratifikaci jejich rizika. Nakano et al [21] rovněž pozorovali, že spontánní výskyt EKG obrazu typu I umožňuje předpovídat výskyt epizod komorové fibrilace u pacientů s BrS, avšak specificky pouze ve svodu V2. Mimocho-dem hlavní význam výskytu klinických příznaků a spontánního EKG obrazu typu I se zdá hrát zásadní roli i při stratifikaci rizika u pacientů s BrS v dětském věku [22]. Na základě získaných dat Probst et al [17] naopak zpochybnili roli mnohých uvažovaných rizikových faktorů (jako je pohlaví pacienta, pozitivní rodinná anamnéza NSS či přítomnost SCN5A mutace), a to včetně jednoho z hlavních parametrů doporučených pro stratifikaci rizika u pacientů s BrS Antzelevitchem et al [2], možnosti vyvolání komorových tachyarytmií během elektrofyziologického vyšetření, jelikož tyto faktory nevykazovaly významnou vazbu na zvýšené riziko vzniku arytmií.
Zcela nedávno byla publikována studie zpracovaná Delise et al [23], kteří na 320 pacientech s EKG obrazem typu I ukázali, že jednotlivý rizikový faktor není dostatečný k identifikaci nejrizikovějších pacientů s BrS. Doporučili použít přístup využívající více parametrů současně (a to předchozí výskyt synkopy, pozitivní rodinnou anamnézu NSS a pozitivní výsledek elektrofyziologického vyšetření). Pacienti s nejvyšším rizikem jsou podle nich ti, kteří vykazují EKG obraz typu I a minimálně 2 další rizikové faktory z této skupiny.
Význam PSK při stratifikaci rizika u pacientů s BrS
Již Antzelevitch et al ve své práci z roku 2005 [2] diskutovali prognostickou hodnotu zjištění možnosti vyvolat komorové arytmie během PSK u asymptomatických pacientů s BrS. Jak uvedli, publikovány byly doposud jak studie, které jeho význam podpořily [3,24], tak jiné, které ho popřely [25–27]. Komorovou fibrilaci je během PSK možné vyvolat i u 6–9 % zdravých jedinců [2]. Rozporné výsledky mohou pramenit z ne zcela standardizovaných, a tedy těžko srovnatelných stimulačních protokolů, které jsou občas možná až příliš agresivní [2].
Studie publikované po roce 2005 prozatím nepřinesly jednoznačnou odpověď týkající se užitečnosti PSK v procesu stratifikace rizika u pacientů s BrS. Delise et al [23] nedávno doporučili brát výsledky elektrofyziologického vyšetření v potaz jako součást přístupu využívajícího současnou detekci několika rizikových faktorů najednou. Oproti tomu jiné studie dokumentovaly velmi nízkou pozitivní prediktivní hodnotu možnosti vyvolat komorovou tachykardii/fibrilaci během PSK při stratifikaci rizika u pacientů s BrS, např. studie zpracovaná kolektivem Eckardt et al [18] a také 2 studie zahrnující skutečně vysoké počty pacientů s BrS (Paul et al [28] – 1 217 pacientů; Probst et al [17] – 1 029 pacientů). Lze předpokládat, že u asymptomatických pacientů je přítomen arytmogenní substrát, ale chybí spouštěcí impulz pro vyvolání maligní arytmie. Již v roce 2002 Gasparini et al [29] uvedli, že PSK u BrS by měla sloužit spíše k odhalení arytmogenního substrátu než k predikci výskytu maligní arytmie. Otázkou zůstává, zda pacienty s BrS vystavovat nesporně rizikovému vyšetření, které navíc, jak se zdá, nepřináší relevantní informace pro další léčebný postup. Kromě pozitivní prediktivní hodnoty možnosti vyvolat maligní arytmie, která se zdá být u PSK poměrně nízká, je však toto vyšetření v klinické praxi ceněno pro svoji významnou negativní prediktivní hodnotu.
Rizikové faktory nově navržené po roce 2005
Rizikové faktory odhalitelné pomocí základního EKG vyšetření a jeho modifikací
První skupina těchto rizikových faktorů se vztahuje k narušenému průběhu srdeční depolarizace (tab. 1). Není to překvapivé vzhledem ke známé roli poruch srdečního sodíkového kanálu u BrS (podrobně popsáno v [13]) a nezastupitelné úloze sodíkového proudu INa na fyziologickém průběhu vedení vzruchu srdcem. Zpoždění vedení vzruchu srdcem bylo zmíněno již v článku poprvé popisujícím BrS [1] a u pacientů s BrS bylo i později opakovaně pozorováno, zejména ve výtokovém traktu pravé komory (right ventricular outflow tract – RVOT) [30,31]. Doi et al [32] nedávno ukázali, že detekce zpoždění vedení srdečního vzruchu v RVOT může u BrS pomoci identifikovat pacienty s vyšším rizikem život ohrožujících komplikací. Obdobně bylo prokázáno, že vyšší riziko je u pacientů s BrS možné předpokládat na základě zjištění některých abnormit EKG parametrů, konkrétně prodlouženého komplexu QRS v pravém prekordiu [33,34], fragmentovaného komplexu QRS [35] a pozdních potenciálů (LP) na zprůměrovaném EKG záznamu [36]. To je zvláště významné vzhledem k neinvazivnímu charakteru EKG vyšetření. Již v roce 2001 Ikeda et al [37] v retrospektivní studii zaměřené na pacienty s BrS a anamnézou NSS prokázali vysoké procento pozitivních výsledků LP (92,6 %) s relativně vysokou pozitivní i negativní předpovědní hodnotou rizika NSS přesahující 70 %. Na druhé straně pozitivita LP ve skupině pacientů s asymptomatickou formou BrS nepřevyšuje 50 %. Proto byla snaha nalézt další přesvědčivější parametry zprůměrovaného EKG záznamu. Jak ukázali Tatsumi et al [38], denní kolísání parametrů popisujících srdeční depolarizaci (EKG: interval r-J – interval od začátku QRS komplexu po vlnu J; zprůměrované EKG: filtrovaná délka komplexu QRS a LAS40 – délka signálů o nízké amplitudě < 40 µV v terminální části filtrovaného komplexu QRS) je významně vyšší u symptomatických pacientů s BrS, a jeho detekce by tedy rovněž mohla pomoci identifikovat rizikové pacienty. Obdobně pozorovali vztah mezi spontánním kolísáním změn na EKG záznamu a výskytem epizod komorové fibrilace u pacientů s BrS i Take et al [39]. Na tkáňovém modelu BrS tito autoři současně prokázali, že pozorovaným spontánním změnám EKG odpovídá nárůst heterogenity konfigurace akčního napětí, která může vést ke vzniku reentry ve fázi 2 akčního napětí, jak je pro BrS typické, a tedy ke vzniku komorové tachykardie/fibrilace.
Table 1. Nově navržené rizikové faktory u BrS vycházející z EKG vyšetření. 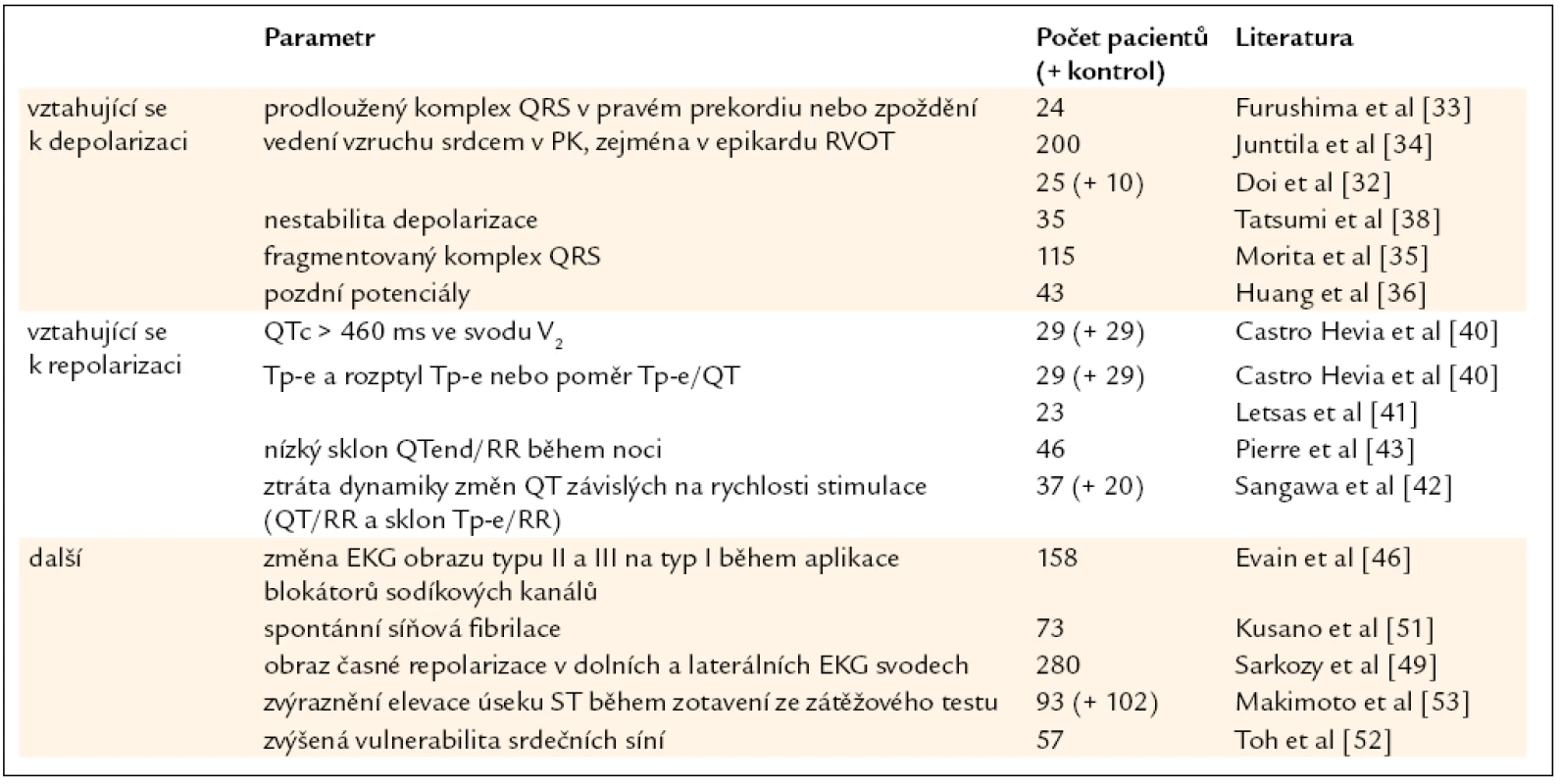
Jak je dobře známo, v mechanizmu vzniku arytmií u BrS hrají významnou roli i poruchy srdeční repolarizace (podrobně popsáno v [13]). Z parametrů vztahujících se k průběhu repolarizace byly jako rizikové z hlediska možnosti vzniku arytmií identifikovány např. prodloužený interval QT korigovaný na srdeční frekvenci (QTc; použita Bazettova korekce), prodloužený interval mezi vrcholem a koncem vlny T (Tp-e) a zvýšený rozptyl hodnot intervalu Tp-e. Významný nárůst těchto parametrů byl totiž pozorován u 9 symptomatických pacientů s BrS a opakujícími se záchvaty arytmií ve srovnání s pacienty bez těchto opakovaných záchvatů a kontrolní skupinou [40]. Kromě již zmíněného prodloužení Tp-e, Letsas et al [41] navrhli jako nový parametr poměr Tp-e/QT, protože byl zvýšen u 17 pacientů s vyvolatelnou komorovou tachykardií, případně fibrilací. Vzhledem k výše diskutovanému spornému významu výsledků PSK pro stratifikaci rizika u pacientů s BrS bude však nutné použitelnost tohoto parametru ověřit. Rovněž byla popsána ztráta dynamiky změn délky intervalu QT v závislosti na rychlosti stimulace u pacientů s dokumentovanými epizodami komorové fibrilace [42], případně její snížení, zejména v noci, u pacientů se spontánně se vyskytujícím obrazem typu I [43]. Další možnost neinvazivní stratifikace rizika NSS u pacientů s BrS odhalující poruchu repolarizace na základě kolísání amplitu-dy a/nebo morfologie vlny T během bicyklové ergometrie je mikrovolt T wave alternans (MTWA). MTWA je na rozdíl od dosud používaných parametrů spojena s vysokou negativní předpovědní hodnotou rizika NSS dosahující téměř 98 % [44]. Tato neinvazivní metoda prokázala vynikající výsledky v negativní predikci rizika NSS u pacientů s dysfunkcí levé komory, bez ohledu na etiologii. Kirchof et al [45] bohužel neprokázali možnost detekce výskytu maligní arytmie u rizikových pacientů s BrS pomocí této metody, včetně negativní predikce rizika NSS, avšak pouze na malém souboru pacientů.
Kromě již zmíněného a dávno známého významu spontánního výskytu EKG obrazu typu I pro prognózu pacientů s BrS [2] byly nově navrženy i některé další rizikové faktory vycházející z EKG křivky, ale bez izolované souvislosti pouze s poruchou depolarizace či repolarizace srdeční svaloviny. Jde např. o změnu EKG obrazu typu II a III v typ I po aplikaci blokátorů sodíkových kanálů [46]. Richter et al [47] zase ukázali, že klinické projevy a riziko arytmií se významně neliší u pacientů s BrS vykazujících diagnostické EKG změny v jednom a ve více prekordiálních svodech. V posledních letech se objevilo několik studií popisujících u pacientů s BrS poměrně častý výskyt obrazu časné repolarizace v dolních a laterálních svodech. Rozcházejí se však ve svých závěrech ohledně významu tohoto EKG nálezu pro prognózu pacientů. Zatímco Letsas et al [48] nepozorovali jeho spojení s častějším spontánním výskytem EKG obrazu typu I či klinických příznaků, Sarkozy et al [49] zjistili, že jeho výskyt byl u pacientů s BrS spojen s výraznějšími klinickými příznaky.
Co se týká srdečních arytmií, je známo, že u pacientů s BrS se ve zvýšené míře vyskytují nejen komorové, ale rovněž supraventrikulární arytmie, z nich nejčastěji paroxyzmální fibrilace síní (v průměru u 24 % pacientů) [50]. V posledních letech byl dokonce dokumentován významně vyšší výskyt paroxyzmální fibrilace síní [51] a zvýšená vulnerabilita srdečních síní bez detekované síňové fibrilace [52] u pacientů s BrS a výskytem komorové fibrilace.
Kromě využití nejrůznějších parametrů klidového EKG vyšetření byla nedávno v rámci stratifikace rizika u pacientů s BrS popsána i možnost analýzy EKG záznamu během zátěžového testu. Makimoto et al [53] totiž pozorovali zvýraznění elevace úseku ST během časné fáze zotavení ze zátěžového testu u skupiny 34 pacientů s BrS vykazujících významně vyšší výskyt epizod komorové fibrilace během následného v průměru více než 6letého sledování těchto pacientů oproti dalším 59 pacientům s BrS bez tohoto navýšení elevace úseku ST a 102 kontrolním jedincům.
Další nově navržené rizikové faktory u BrS
Nedávno byla jako významný indikátor zvýšeného rizika vzniku arytmií u BrS označena i srdeční autonomní neuropatie. Bigi et al [54] totiž detekovali její příznaky výhradně u pacientů s BrS vykazujících EKG obraz typu I (mimochodem pouze u mužů); 84 % z nich bylo symptomatických.
Babaee Bigi et al [55] zase navrhli využití Dopplerovy echokardiografie a parametrů popisujících mechanickou činnost srdce. Konkrétně pozorovali tzv. interventrikulární dyssynchronii, tedy významně delší zpoždění začátku kontrakce mezi pravou a levou srdeční komorou, u pacientů s BrS a spontánním EKG obrazem typu I, a to zejména u těch, u kterých byly dokumentovány opakované srdeční příhody.
Původně se předpokládalo, že výsledky genetické analýzy nemají u pacientů s BrS velkou prognostickou hodnotu [2]. V roce 2009 však Meregalli et al [56] ve své studii zahrnující 147 pacientů s BrS a 32 různými mutacemi v genu SCN5A kódujícím strukturu α-podjednotky srdečních sodíkových kanálů prokázali, že závažnější klinické příznaky včetně výraznějších poruch vedení vzruchu srdcem jsou přítomny u pacientů s mutacemi způsobujícími > 90% snížení či úplnou absenci INa vedeného mutovanými sodíkovými kanály (v případě absence INa díky předčasnému ukončení tvorby bílkoviny tvořící α-podjednotku sodíkového kanálu).
Závěr
Z této přehledové práce je zřejmé, že základní rizikové faktory doporučené pro stratifikaci rizika u pacientů s BrS v roce 2005 kolektivem Antzelevitch et al [2] se v podstatě nemění. S výjimkou sporného významu výsledků PSK je tedy možné i nadále brát v úvahu zejména osobní anamnézu NSS či synkopy a spontánní výskyt EKG obrazu typu I. Každopádně můžeme pozorovat odklon stratifikace rizika NSS od invazivních vyšetřovacích metod k neinvazivním parametrům, poskytující stejnou, ne-li vyšší pozitivní, a především vyšší negativní předpovědní hodnotu k vyloučení těch pacientů, kteří pro nízké riziko NSS z implantace ICD profitovat nebudou. Skutečný význam nově navržených rizikových faktorů bude nutné prověřit ve studiích zahrnujících rozsáhlejší populaci pacientů s BrS. Atraktivní budou jistě zejména parametry vycházející ze základního klidového EKG vyšetření vzhledem k tomu, že toto je u každého pacienta s BrS k dispozici, a je ho tedy jednoduché získat bez další zátěže pacienta.
Práce vznikla za podpory výzkumného záměru Ministerstva školství, mládeže a tělovýchovy MSM0021622402.
MUDr. Markéta Bébarová, Ph.D.
www.med.muni.cz
e-mail: bebarova.lfmu@centrum.cz
Doručeno do redakce: 2. 8. 2011
Přijato po recenzi: 12. 10. 2011
Sources
1. Brugada P, Brugada J. Right bundle branch block, persistent ST segment elevation and sudden cardiac death: a distinct clinical and electrocardiographic syndrome. A multicenter report.J Am Coll Cardiol 1992; 20 : 1391–1396.
2. Antzelevitch C, Brugada P, Borggrefe M et al. Brugada syndrome: report of the second consensus conference: endorsed by the Heart Rhythm Society and the European Heart Rhythm Association. Circulation 2005; 111 : 659–670.
3. Brugada J, Brugada R, Antzelevitch C et al. Long-term follow-up of individuals with the electrocardiographic pattern of right bundle--branch block and ST-segment elevation in precordial leads V1 to V3. Circulation 2002; 105 : 73–78.
4. Brugada J, Brugada R, Brugada P. Pharmacological and device approach to therapy of inherited cardiac diseases associated with cardiac arrhythmias and sudden death. J Electrocardiol 2000; 33 (Suppl): 41–47.
5. Nademanee K, Veerakul G, Mower M et al. Defibrillator Versus beta-Blockers for Unexplained Death in Thailand (DEBUT): a randomized clinical trial. Circulation 2003; 107 : 2221–2226.
6. Bailey SM, Wilkoff BL. Complications of pacemakers and defibrillators in the elderly. Am J Geriatr Cardiol 2006; 15 : 102–107.
7. Sacher F, Probst V, Iesaka Y et al. Outcome after implantation of a cardioverter-defibrillator in patients with Brugada syndrome: a multicenter study. Circulation 2006; 114 : 2317–2324.
8. Sarkozy A, Boussy T, Kourgiannides G et al. Long-term follow-up of primary prophylactic implantable cardioverter-defibrillator therapy in Brugada syndrome. Eur Heart J 2007; 28 : 334–344.
9. Rosso R, Glick A, Glikson M et al. Israeli Working Group on Cardiac Pacing and Electrophysiology. Outcome after implantation of cardioverter defibrillator in patients with Brugada syndrome: a multicenter Israeli study (ISRABRU). Isr Med Assoc J 2008; 10 : 435–439.
10. Benito B, Brugada J, Brugada R et al. Brugada syndrome. Rev Esp Cardiol 2009; 62 : 1297–1315.
11. Mádle A, Kratochvíl Z, Polívková A. The Brugada syndrome. Vnitř Lék 2002; 48 : 255–258.
12. Veiser T, Laurent G, Wolf JE. Brugada syndrome. Čas Lék Česk 2005; 144 : 219–223.
13. Bébarová M. Brugada syndrom. Vnitř Lék 2011; 57 : 551–560.
14. Amin AS, Klemens CA, Verkerk AO et al. Fever-triggered ventricular arrhythmias in Brugada syndrome and type 2 long-QT syndrome. Neth Heart J 2010; 18 : 165–169.
15. Postema PG, Wolpert C, Amin AS et al. Drugs and Brugada syndrome patients: review of the literature, recommendations, and an up-to-date website (www.brugadadrugs.org). Heart Rhythm 2009; 6 : 1335–1341.
16. Letsas KP, Weber R, Efremidis M et al. Long-term prognosis of asymptomatic individuals with spontaneous or drug-induced type 1 electrocardiographic phenotype of Brugada syndrome. J Electrocardiol 2011; 44 : 346–349.
17. Probst V, Veltmann C, Eckardt L et al. Long--term prognosis of patients diagnosed with Brugada syndrome: Results from the FINGER Brugada Syndrome Registry. Circulation 2010; 121 : 635–643.
18. Eckardt L, Probst V, Smits JP et al. Long-term prognosis of individuals with right precordial ST-segment-elevation Brugada syndrome. Circulation 2005; 111 : 257–263.
19. Brugada J, Brugada R, Brugada P. Determinants of sudden cardiac death in individuals with the electrocardiographic pattern of Brugada syndrome and no previous cardiac arrest. Circulation 2003; 108 : 3092–3096.
20. Benito B, Sarkozy A, Mont L et al. Gender differences in clinical manifestations of Brugada syndrome. J Am Coll Cardiol 2008; 52 : 1567–1573.
21. Nakano Y, Shimizu W, Ogi H et al. A spontaneous Type 1 electrocardiogram pattern in lead V2 is an independent predictor of ventricular fibrillation in Brugada syndrome. Europace 2010; 12 : 410–416.
22. Probst V, Denjoy I, Meregalli PG et al. Clinical aspects and prognosis of Brugada syndrome in children. Circulation 2007; 115 : 2042–2048.
23. Delise P, Allocca G, Marras E et al. Risk stratification in individuals with the Brugada type 1 ECG pattern without previous cardiac arrest: usefulness of a combined clinical and electrophysiologic approach. Eur Heart J 2011; 32 : 169–176.
24. Brugada P, Brugada R, Mont L et al. Natural history of Brugada syndrome: the prognostic value of programmed electrical stimulation of the heart. J Cardiovasc Electrophysiol 2003; 14 : 455–457.
25. Priori SG, Napolitano C, Gasparini M et al. Natural history of Brugada syndrome: insights for risk stratification and management. Circulation 2002; 105 : 1342–1347.
26. Kanda M, Shimizu W, Matsuo K et al. Electrophysiologic characteristics and implications of induced ventricular fibrillation in symptomatic patients with Brugada syndrome. J Am Coll Cardiol 2002; 39 : 1799–1805.
27. Eckardt L, Kirchhof P, Schulze-Bahr E et al. Electrophysiologic investigation in Brugada syndrome; yield of programmed ventricular stimulation at two ventricular sites with up to three premature beats. Eur Heart J 2002; 23 : 1394–1401.
28. Paul M, Gerss J, Schulze-Bahr E et al. Role of programmed ventricular stimulation in patients with Brugada syndrome: a meta-analysis of worldwide published data. Eur Heart J 2007; 28 : 2126–2133.
29. Gasparini M, Priori SG, Mantica M et al. Programmed electrical stimulation in Brugada syndrome: How reproducible are the results? J Cardiovasc Electrophysiol 2002; 13 : 880–887.
30. Nagase S, Kusano KF, Morita H et al. Epicardial electrogram of the right ventricular outflow tract in patients with the Brugada syndrome: using the epicardial lead. J Am Coll Cardiol 2002; 39 : 1992–1995.
31. Tukkie R, Sogaard P, Vleugels J et al. Delay in right ventricular activation contributes to Brugada syndrome. Circulation 2004; 109 : 1272–1277.
32. Doi A, Takagi M, Maeda K et al. Conduction delay in right ventricle as a marker for identifying high-risk patients with Brugada syndrome. J Cardiovasc Electrophysiol 2010; 21 : 688–696.
33. Furushima H, Chinushi M, Hirono T et al. Relationship between dominant prolongation of the filtered QRS duration in the right precordial leads and clinical characteristics in Brugada syndrome. J Cardiovasc Electrophysiol 2005; 16 : 1311–1317.
34. Junttila MJ, Brugada P, Hong K et al. Differences in 12-lead electrocardiogram between symptomatic and asymptomatic Brugada syndrome patients. J Cardiovasc Electrophysiol 2008; 19 : 380–383.
35. Morita H, Kusano KF, Miura D et al. Fragmented QRS as a marker of conduction abnormality and a predictor of prognosis of Brugada syndrome. Circulation 2008; 118 : 1697–1704.
36. Huang Z, Patel C, Li W et al. Role of signal-averaged electrocardiograms in arrhythmic risk stratification of patients with Brugada syndrome: a prospective study. Heart Rhythm 2009; 6 : 1156–1162.
37. Ikeda T, Sakurada H, Sakabe K et al. Assessment of noninvasive markers in identifying patients at risk in the Brugada syndrome: Insight into risk stratification. J Am Coll Cardiol 2001; 37 : 1628–1634.
38. Tatsumi H, Takagi M, Nakagawa E et al. Risk stratification in patients with Brugada syndrome: analysis of daily fluctuations in 12-lead electrocardiogram (ECG) and signal-averaged electrocardiogram (SAECG). J Cardiovasc Electrophysiol 2006; 17 : 705–711.
39. Take Y, Morita H, Wu J et al. Spontaneous ECG alterations predict ventricular fibrillation in Brugada syndrome. Heart Rhythm 2011; 8 : 1014–1021.
40. Castro Hevia J, Antzelevitch C, Tornés Bárzaga F et al. Tpeak-Tend and Tpeak-Tend dispersion as risk factors for ventricular tachycardia//ventricular fibrillation in patients with the Brugada syndrome. J Am Coll Cardiol 2006; 47 : 1828–1834.
41. Letsas KP, Weber R, Astheimer K et al. Tpeak-Tend interval and Tpeak-Tend/QT ratio as markers of ventricular tachycardia inducibility in subjects with Brugada ECG phenotype. Europace 2010; 12 : 271–274.
42. Sangawa M, Morita H, Nakatsu T et al. Abnormal transmural repolarization process in patients with Brugada syndrome. Heart Rhythm 2009; 6 : 1163–1169.
43. Pierre B, Babuty D, Poret P et al. Abnormal nocturnal heart rate variability and QT dynamics in patients with Brugada syndrome. Pacing Clin Electrophysiol 2007; 30 (Suppl 1): S188–S191.
44. Rosenbaum DC, Jackson LE, Smith JH et al. Electrical alternans and vulnerability to ventricular arrhythmias. N Engl J Med 1994; 330 : 235–241.
45. Kirchof P, Eckardt L, Rolf S et al. T Wave Alternans Does Not Assess Arrhythmic Risk in Patients with Brugada Syndrome. Ann Noninvas Electrophysiol 2004; 9 : 162–165.
46. Evain S, Briec F, Kyndt F et al. Sodium channel blocker tests allow a clear distinction of electrophysiological characteristics and prognosis in patients with a type 2 or 3 Brugada electrocardiogram pattern. Heart Rhythm 2008; 5 : 1561–1564.
47. Richter S, Sarkozy A, Paparella G et al. Number of electrocardiogram leads displaying the diagnostic coved-type pattern in Brugada syndrome: a diagnostic consensus criterion to be revised. Eur Heart J 2010; 31 : 1357–1364.
48. Letsas KP, Sacher F, Probst V et al. Prevalence of early repolarization pattern in inferolateral leads in patients with Brugada syndrome. Heart Rhythm 2008; 5 : 1685–1689.
49. Sarkozy A, Chierchia GB, Paparella G et al. Inferior and lateral electrocardiographic repolarization abnormalities in Brugada syndrome. Circ Arrhythm Electrophysiol 2009; 2 : 154–161.
50. Francis J, Antzelevitch C. Atrial fibrillation and Brugada syndrome. J Am Coll Cardiol 2008; 51 : 1149–1153.
51. Kusano KF, Taniyama M, Nakamura K et al. Atrial fibrillation in patients with Brugada syndrome relationships of gene mutation, electrophysiology, and clinical backgrounds. J Am Coll Cardiol 2008; 51 : 1169–1175.
52. Toh N, Morita H, Nagase S et al. Atrial electrophysiological and structural remodeling in high-risk patients with Brugada syndrome: assessment with electrophysiology and echocardiography. Heart Rhythm 2010; 7 : 218–224.
53. Makimoto H, Nakagawa E, Takaki H et al. Augmented ST-segment elevation during recovery from exercise predicts cardiac events in patients with Brugada syndrome. J Am Coll Cardiol 2010; 56 : 1576–1584.
54. Bigi MA, Aslani A, Aslani A. Significance of cardiac autonomic neuropathy in risk stratification of Brugada syndrome. Europace 2008; 10 : 821–824.
55. Babaee Bigi MA, Moaref AR, Aslani A. Interventricular mechanical dyssynchrony: a novel marker of cardiac events in Brugada syndrome. Heart Rhythm 2008; 5 : 79–82.
56. Meregalli PG, Tan HL, Probst V et al. Type of SCN5A mutation determines clinical severity and degree of conduction slowing in loss-of-function sodium channelopathies. Heart Rhythm 2009; 6 : 341–348.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2012 Issue 4-
All articles in this issue
- Elevace proteinu S-100B u pacientů s akutním koronárním syndromem po resuscitaci je prediktorem nepříznivé neurologické prognózy
- Krátkodobá prognóza a léčba pacientů hospitalizovaných pro akutní srdeční selhání v regionální nemocnici bez kardiocentra
- Stratifikace rizika u pacientů s Brugada syndromem
- Význam biomarkerů NGAL a cystatinu C u kardiovaskulárních onemocnění
- Nové poznatky v patogenezi Crohnovy choroby
- Lékové interakce u starších diabetiků
- Diabetes mellitus a demence
- Specifika diabetické edukace u dětí
- Blokáda receptoru pro interleukin-1 preparátem anakinra vedla u pacienta s Erdheimovou-Chesterovou nemocí k vymizení patologické únavy, k poklesu markerů zánětu a ústupu fibrózy v retroperitoneu – popis případu a přehled literárních údajů
- Akutní infarkt myokardu navozený požitím drogy pervitin
- Hypergastrinemie bez detekce gastrinomu
- Akutní intoxikace mědí při suicidiálním pokusu
- Skrytá cystická fibróza u nemocného se sarkoidózou
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akutní infarkt myokardu navozený požitím drogy pervitin
- Význam biomarkerů NGAL a cystatinu C u kardiovaskulárních onemocnění
- Akutní intoxikace mědí při suicidiálním pokusu
- Nové poznatky v patogenezi Crohnovy choroby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

