-
Medical journals
- Career
Změny krevních lipidů při dlouhodobé antiretrovirové léčbě
Authors: S. Snopková 1; Jiří Jarkovský 2; M. Matýšková 3; K. Povolná 1; P. Polák 1; M. Cvanová 2; P. Husa 1
Authors‘ workplace: Klinika infekčních chorob Lékařské fakulty MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Petr Husa, CSc. 1; Institut biostatistiky a analýz Lékařské a Přírodovědecké fakulty MU Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D. 2; Oddělení klinické hematologie FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Miroslav Penka, CSc. 3
Published in: Vnitř Lék 2011; 57(5): 463-471
Category: Original Contributions
Overview
Cílem studie bylo zjistit, jaký je trend vývoje koncentrace krevních lipidů u souboru HIV pozitivních pacientů léčených režimy kombinované antiretrovirové terapie (cART) a jestli mají tyto změny aterogenní charakter.
Metodika:
Soubor zahrnoval 118 pacientů, kteří byli postupně dispenzarizováni v AIDS centru FN Brno, s minimální délkou sledování 1 měsíc a maximální 17 let. Pacienti byli rozděleni na pacienty léčené cART a pacienty bez terapie. Byly analyzovány následující parametry: celkový cholesterol, triglyceridy, HDL-cholesterol, apolipoprotein B, index celkový cholesterol/HDL-cholesterol a non-HDL-cholesterol.Výsledky:
Statisticky významná elevace celkového cholesterolu (T-Ch) byla zjištěna již v prvních měsících po zahájení cART a kontinuálně tato hodnota stoupala i v dalších letech. Cílová hodnota T-Ch 5 mmol/ l byla překročena ve skupině, která užívala cART 3–4 roky. Statisticky významná elevace triglyceridů (Tg) byla rovněž zjištěna již v prvních měsících po zahájení cART. V dalších letech se průměrná koncentrace již nezvyšovala. Průměrná koncentrace Tg se pohybovala kolem optimální hodnoty 1,7 mmol/ l (či mírně nad ní). Ke statisticky významnému nárůstu koncentrace HDL-cholesterolu (HDL-Ch) došlo během prvních 2 let léčby cART. V dalších letech se koncentrace HDL-Ch statistiky významně neměnila. Kromě výchozí kategorie (do 1 měsíce) byly průměrné hodnoty ve všech ostatních kategoriích nad optimální hodnotou HDL-Ch pro muže > 1,0 mmol/ l. Statisticky významná změna koncentrace apolipoproteinu B (apo B) byla pozorována po 3–4 letech užívání cART. Průměrná hodnota apo B nepřesáhla cílovou hodnotu < 1 g/ l v žádné sledované kategorii. Nebyly zjištěny žádné statisticky významné změny indexu celkový cholesterol/HDL-cholesterol. Ve všech sledovaných kategoriích byla výsledná hodnota nižší než 5. Statisticky významné změny koncentrace non-HDL-cholesterolu byly zjištěny u pacientů s cART několik měsíců po zahájení léčby. Tato hodnota byla v následujících letech víceméně stabilizovaná až do dalšího statisticky významného zvýšení, které bylo zaznamenáno (izolovaně) v kategorii 4–5 let. V této jediné kategorii byla překročena cílová hodnota 3,8 mmol/ l. Vývoj hodnot CD4+ lymfocytů a počtu HIV-1 RNA kopií prokázal vysokou účinnost cART z hlediska imunologické regenerace (počet CD4+ lymfocytů) a virové suprese (počet kopií HIV-1 RNA) i v kategoriích nejdéle sledovaných pacientů (max. 5–6 let).Závěr:
V sledovaném souboru jsme zjistili, že u HIV-pozitivních pacientů léčených cART dochází v průběhu léčby ke statisticky významnému zvýšení koncentrací krevních lipidů (včetně HDL-cholesterolu). Tyto změny však nemají jednoznačně aterogenní charakter ani v nejdéle sledované skupině léčených pacientů.Klíčová slova:
HIV – kombinovaná antiretrovirová terapie – celkový cholesterol – triglyceridy – apolipoprotein B – index celkový cholesterol/HDL-cholesterol – non-HDL-cholesterol – CD4+ lymfocyty – HIV-1 RNAÚvod
Moderní farmakoterapie onemocnění HIV/AIDS (HIV – human immunodeficiency virus, virus lidského imunodeficitu, AIDS – acquired immunodeficiency syndrom, syndrom získaného imunodeficitu) je spojena s významným snížením morbidity a mortality HIV infikovaných a s nově popsaným syndromem HIV lipodystrofie [1]. Tento syndrom je dáván do kauzální souvislosti se sekundárními účinky antiretrovirových léčiv i vlastního HIV [2–4] a má několik významných společných rysů s metabolickým syndromem – inzulinová rezistence, dyslipidemie a redistribuce tělesného tuku [5]. Podrobněji bylo o jeho charakteru referováno v článku HIV lipodystrofie.
Předpokládá se, že některé morfologické, metabolické a hemokoagulační změny, které jsou pozorovány při kombinované antiretrovirové terapii (cART) a HIV infekci mohou nést potenciál k akceleraci předčasné aterosklerózy a zvýšení kardiovaskulárního rizika u HIV pozitivních [6,7]. Vzhledem k podstatně nižšímu průměrnému věku HIV pozitivních pacientů by to znamenalo velmi nepříznivý prognostický faktor pro další vývoj onemocnění HIV/AIDS, které je dnes považováno za chronickou chorobu s mnohaletým průběhem. Závěry dosud prezentovaných studií zaměřených na vyšší kardiovaskulární riziko u HIV pozitivních jsou však nejednoznačné [8,9]. Nejvýznamnější studie jsou také zmíněny v článku HIV lipodystrofie. Rovněž je otázkou, zda mají metabolické změny indukované antiretrovirovými léčivy u HIV pozitivních stejné patofyziologické a klinické konsekvence jako nefarmakologicky indukované obdobné metabolické poruchy u všeobecné populace [10,11].
Jedním z jevů, objevujícím se již několik týdnů po zahájení kombinované antiretrovirové terapie, je změna koncentrace některých frakcí krevních lipidů [12]. Jsou popisovány izolovaná hypercholesterolemie, izolovaná hypertriglyceridemie, smíšená hyperlipidemie [10] nebo LDL-hypercholesterolemie a další [13]. Velké intervenční studie prokázaly u všeobecné populace jednoznačný vztah mezi hladinou krevních lipidů a akcelerací aterosklerotického procesu. U HIV pozitivních vztah mezi farmakologicky navozenou dyslipidemií a následným kardiovaskulárním rizikem vyřešen není.
Cílem níže prezentované studie bylo zjistit, jaký je trend vývoje koncentrace krevních lipidů u souboru HIV pozitivních pacientů léčených režimy kombinované antiretrovirové terapie (cART) a jestli mají tyto změny aterogenní charakter.
Soubor nemocných, metodika, statistické zhodnocení
U souboru HIV pozitivních pacientů byla analyzována koncentrace krevních lipidů – celkový cholesterol (T-Ch), triglyceridy (Tg), HDL-cholesterol (HDL-Ch), apolipoprotein B (apo B), index celkový cholesterol//HDL-cholesterol (index T-Ch/HDL-Ch) a non-HDL-cholesterol (non-HDL-Ch).
Kompletní soubor zahrnoval 118 pacientů, kteří byli postupně dispenzarizováni v AIDS centru FN Brno, s 2 105 návštěvami lékaře, minimální délkou sledování pacienta 1 měsíc a maximální délkou 17 let – tab. 1.
Table 1. Celková délka sledování pacientů (follow-up). 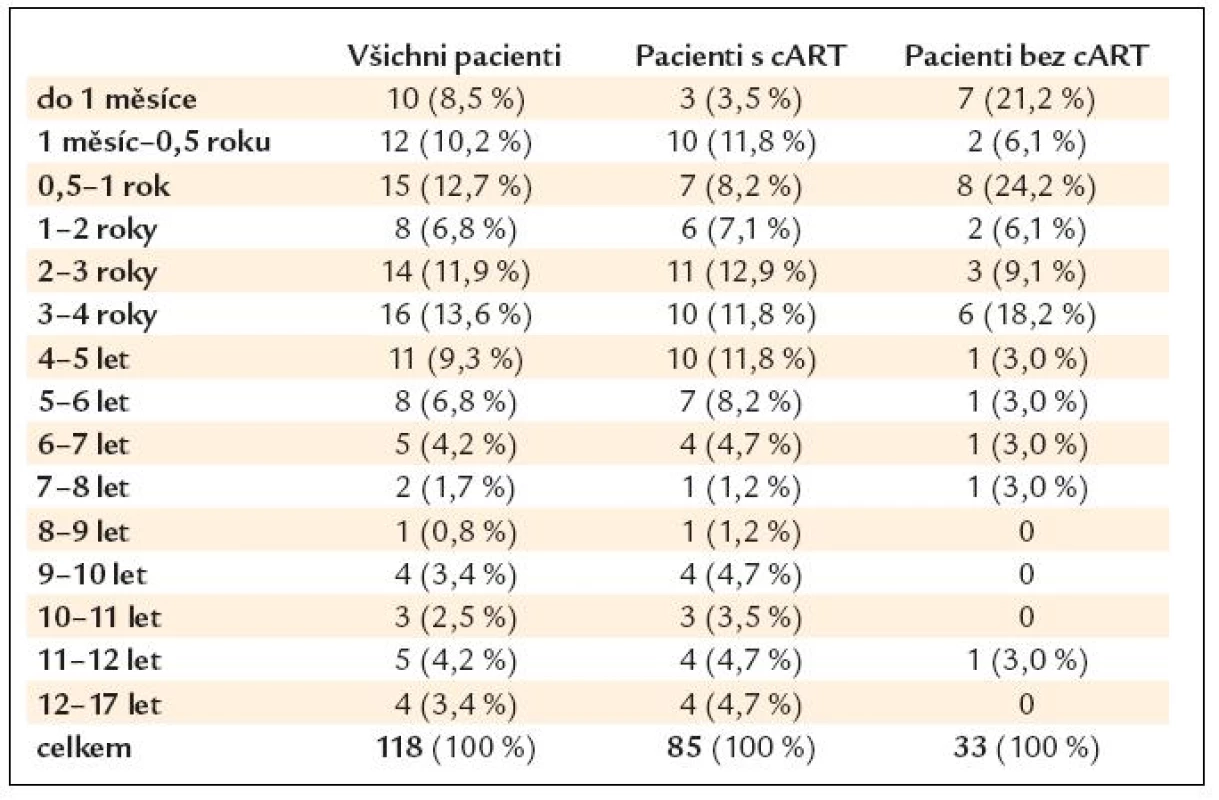
Soubor byl rozdělen na pacienty s léčbou (kombinovaná antiretrovirová terapie – cART) a bez léčby. Zastoupení pohlaví, follow-up, věk a BMI pacientů při vstupu do studie uvádí tab. 2.
Table 2. Pohlaví, follow-up, věk a BMI pacientů při vstupu do studie. 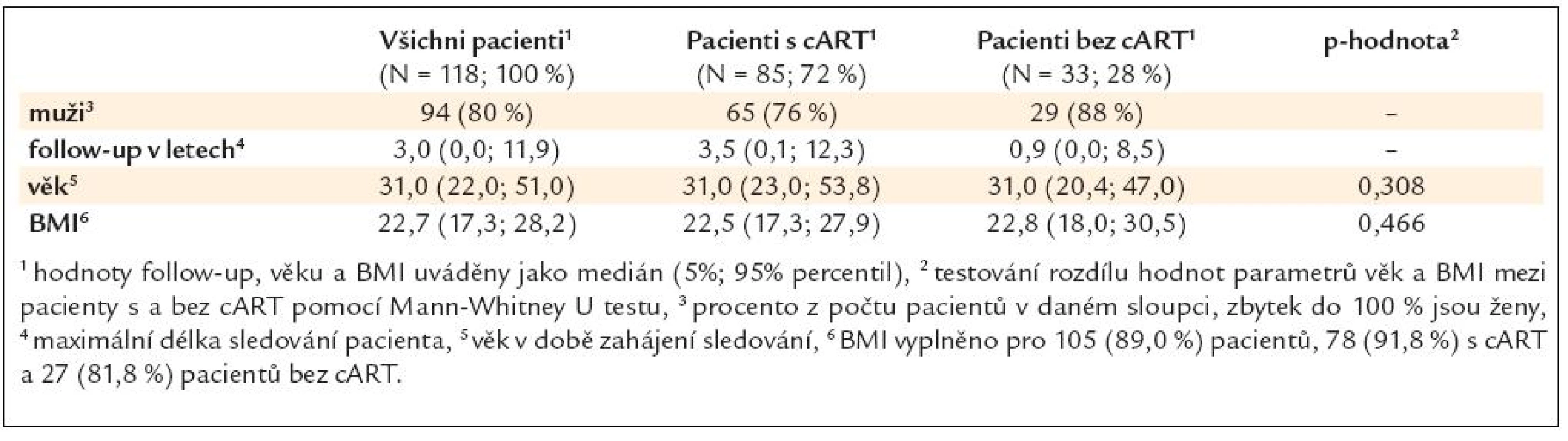
Před rokem 1996 byli pacienti léčeni monoterapií nebo dvojkombinací nukleosidových inhibitorů reverzní transkriptázy. Po roce 1996, kdy byla zavedena cART, měli všichni pacienti ve svém léčebném režimu trojkombinaci antiretrovirových léčiv. Nejčastější kombinací byly 2 nukleosidové inhibitory reverzní transkriptázy a jeden nenukleosidový inhibitor reverzní transkriptázy nebo 2 nukleosidové inhibitory reverzní transkriptázy a jeden proteázový inhibitor. Pacienti s hypolipidemickou léčbou nebyli do souboru zahrnuti.
Odběry byly prováděny ráno nalačno po 10–12 hodinách bez jídla. Laboratorní vyšetření krevních lipidů a apolipoproteinu B byla zpracována v laboratoři Oddělení klinické biochemie FN Brno. Koncentrace krevních lipidů byla stanovena enzymovou reakcí s oxidační kopulací, výsledný produkt fotometricky. Apolipoprotein B byl stanoven imunoturbidimetricky. Non-HDL-cholesterol byl vypočítán odečtením HDL-cholesterolu od celkového cholesterolu. U některých vyšetření nebyla vždy splněna kritéria pro výpočet LDL-cholesterolu podle Friedewalda. Podrobněji jsme vývoj tohoto parametru ve sledovaném souboru neanalyzovali, protože aktuální doporučení se obejdou bez stanovení LDL-cholesterolu přímým měřením [14]. Pravidelně byly sledovány základní imunologické a virologické parametry – absolutní počet CD4+ lymfocytů/μl a počet HIV-1 RNA kopií/ ml.
Pro další analýzu bylo využito kategorií doby sledování pacienta – tab. 3. Na rozdíl od tab. 1 se nejedná o maximální délku sledování pacienta, ale jsou zde již zahrnuty všechny návštěvy během celé doby sledování pacienta. Kategorizace na časová období byla zvolena na základě počtu vyšetření pacientů tak, aby byla každá časová kategorie reprezentována přibližně stejným počtem vyšetřených pacientů. Každá návštěva pacienta byla zařazena do konkrétní kategorie. Následně byla provedena mediánová agregace na pacienta a kategorii doby sledování, aby měl jeden pacient v jedné kategorii vždy jen jednu hodnotu měření. Pacient je tedy zařazen do každé kategorie doby sledování, ve které přišel minimálně 1krát ke kontrole. Postup byl zvolen z důvodu nedostatečného datového souboru pro klasickou párovou analýzu dat a jednotlivá časová období jsou v následných analýzách považována za nezávislá.
Table 3. Počet pacientů v kategoriích doby sledování. 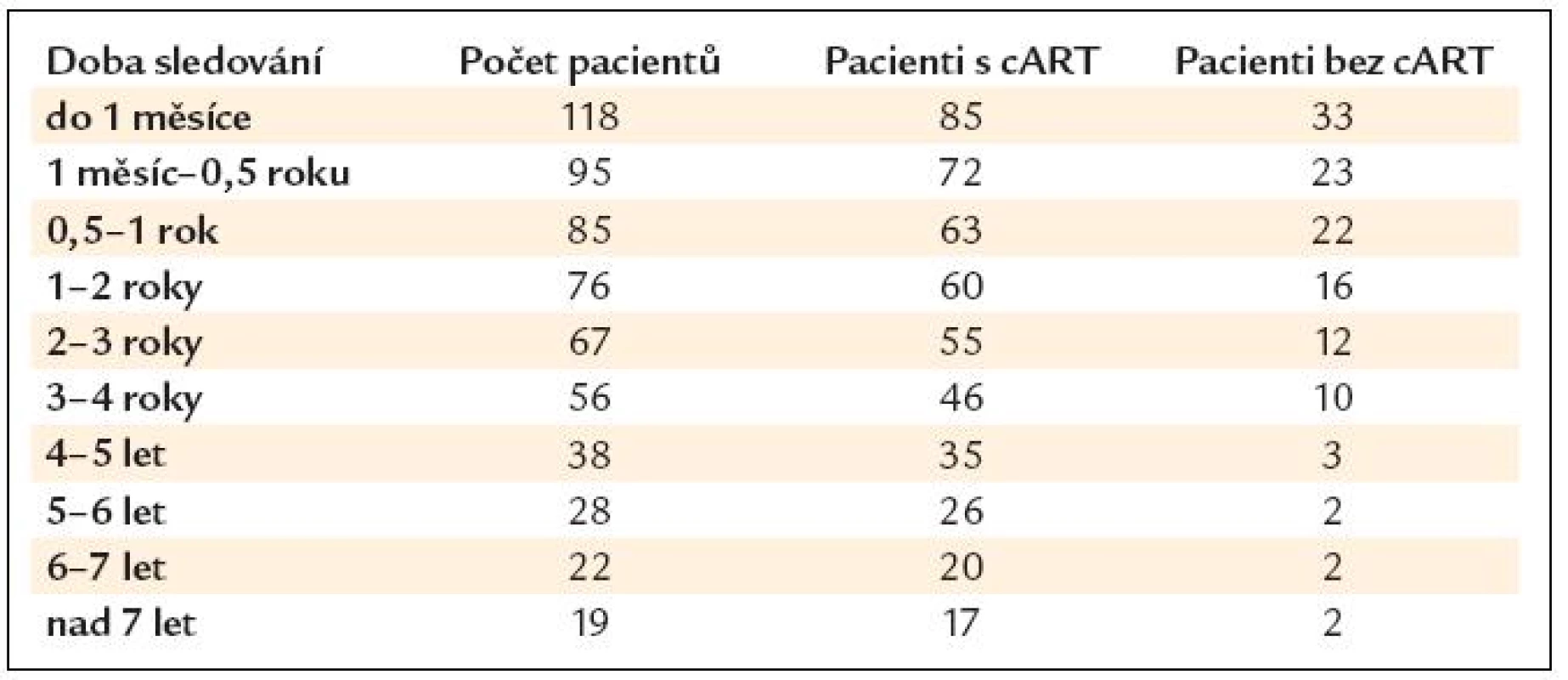
V dalších analýzách jsou využita vyšetření pouze do doby sledování 5–6 let u pacientů s léčbou, u pacientů bez léčby pak vyšetření jen do doby sledování 2–3 roky kvůli malému počtu pacientů v dalších skupinách, neboť většina pacientů po 2–3 letech splňuje aktuálně platná kritéria pro zahájení cART.
Srovnání bazálních hodnot zjištěných u pacientů s léčbou a bez léčby bylo testováno Mann-Whitney U testem. Rozdíl mezi hodnotami parametrů v jednotlivých časových obdobích byl testován ANOVA testem. Zvlášť byli hodnoceni pacienti s léčbou a bez léčby. Byly-li výsledky ANOVA testu významné, byl následně použit post-hoc Fisherův LSD test pro mnohonásobné porovnání. Homogenní skupiny jsou v grafech vyznačeny shodnými písmeny. Pro použití ANOVA testu byly splněny předpoklady homogenity rozptylu a normality dat v jednotlivých časových obdobích pro obě skupiny pacientů. Normalita dat byla pro celkový cholesterol, triglyceridy a non-HDL-cholesterol dosažena logaritmickou transformací. Pro tyto parametry je pak v grafech uváděn geometrický průměr. Pro zbylé parametry byla normalita splněna. Další předpoklad nezávislosti pozorování v jednotlivých časových obdobích lze akceptovat v případě, že považujeme pacienta v každém časovém období za oddělenou jednotku. Dále byly nepárovým t-testem hodnoceny rozdíly mezi pacienty s léčbou a bez léčby v daném období sledování.
Výsledky
Zjištěné hodnoty sledovaných parametrů lipidového metabolizmu, CD4+ lymfocytů a počtu HIV-1 RNA kopií ve všech vyšetřeních (celkem 2 105 návštěv) s popisem jejich celkové variability ukazuje tab. 4.
Table 4. Přehled sledovaných parametrů ve všech vyšetřeních (celkem 2 105 návštěv) s popisem jejich celkové variability. 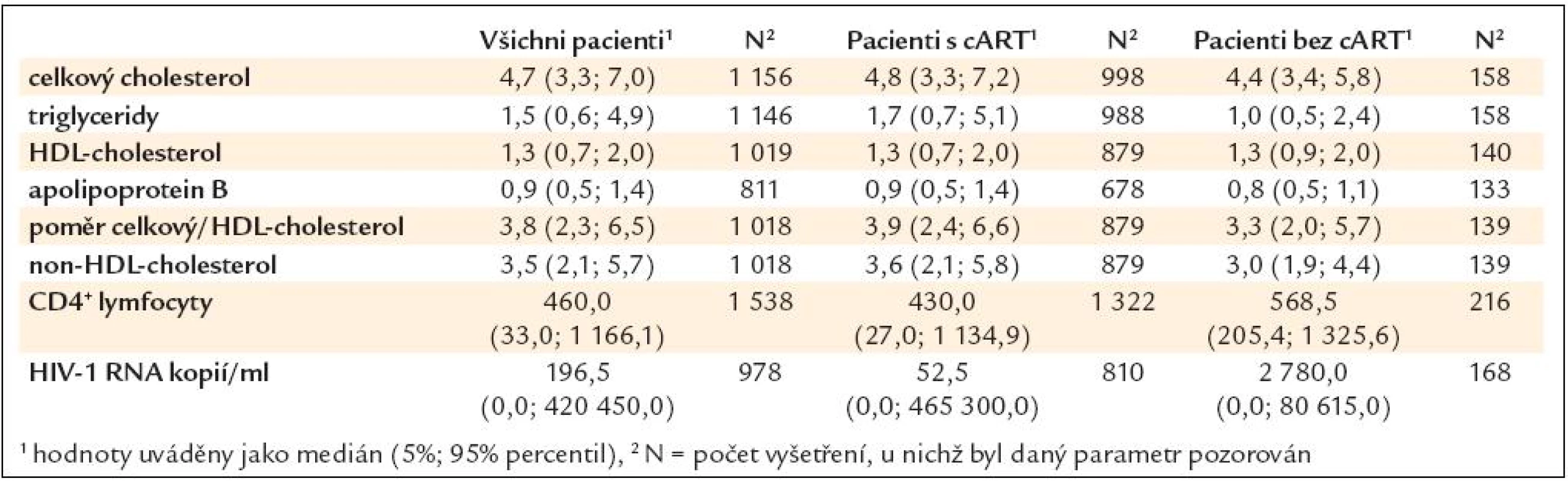
Zjištěné hodnoty jednotlivých sledovaných parametrů a jejich vývoj v čase je uveden v tab. 5.
Table 5. Hodnoty sledovaných parametrů v čase. 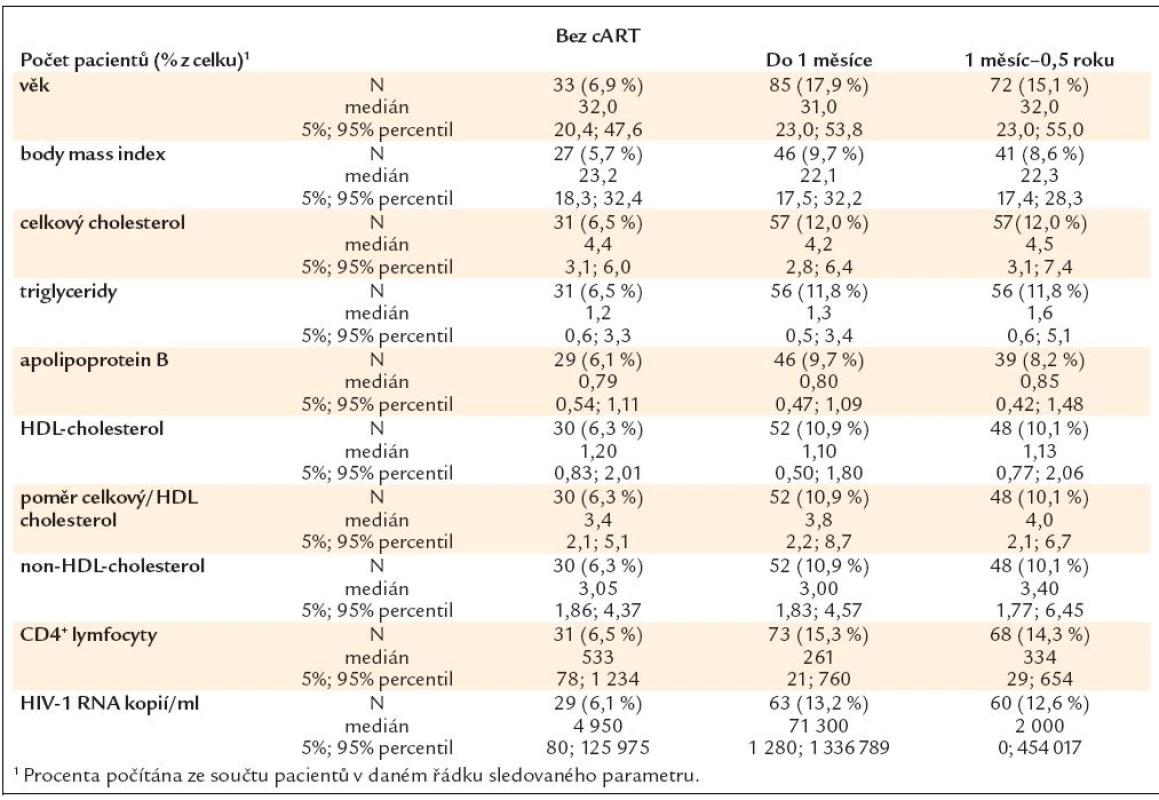
Průměrné hodnoty koncentrace celkového cholesterolu v závislosti na době sledování pacienta ukazuje graf 1.
Graph 1. Průměrné hodnoty koncentrace celkového cholesterolu. 
Post-hoc Fisherův LSD test pro pacienty s léčbou (s cART) ukázal statisticky významný rozdíl mezi skupinou sledovanou do 1 měsíce a všemi následujícími skupinami – 1 měsíc – 0,5 roku (p = 0,005), 0,5 – 1 rok (p = 0,011), 1–2 roky (p < 0,001), 2–3 roky (p < 0,001), 3–4 roky (p < 0,001), 4–5 let (p < 0,001) a 5–6 let (p < 0,001).
Nejnižší koncentrace T-Ch byla zaznamenána u pacientů s aktuálně zahájenou cART, tzn. u pacientů s floridní nekontrolovanou HIV infekcí (s nejnižším počtem CD4+ lymfocytů a nejvyšším počtem kopií HIV-1 RNA).
V průběhu dalších let byl pozorován trend ke kontinuálnímu zvyšování průměrné koncentrace T-Ch.
Cílová hodnota T-Ch, 5 mmol/ l, byla většinově (více než z 50 %) překročena ve skupinách pacientů, kteří užívali cART 3 a více let.
Průměrné hodnoty koncentrace triglyceridů v závislosti na době sledování pacienta ukazuje graf 2.
Graph 2. Průměrné hodnoty koncentrace triglyceridů. 
Post-hoc Fisherův LSD test pro pacienty s léčbou ukázal statisticky významný rozdíl mezi skupinou sledovanou do 1 měsíce a skupinami následujícími – 1 měsíc – 0,5 roku (p = 0,028), 0,5–1 rok (p = 0,004), 2–3 roky (p = 0,008), 3–4 roky (p = 0,013), 4–5 let (p = 0,002) a 5–6 let (p = 0,023), u kterých již ale nebyl zaznamenán trend k dalšímu zvyšování průměrné koncentrace.
Ta se pohybovala i v dalších letech kolem optimální koncentrace 1,7 mmol/ l (či mírně nad ní).
Průměrné hodnoty koncentrace HDL-cholesterolu v závislosti na době sledování ukazuje graf 3. Výsledky byly zpracovány pouze pro muže, neboť optimální hodnoty HDL-Ch jsou pro jednotlivá pohlaví rozdílné a počet žen byl v jednotlivých časových obdobích příliš malý.
Graph 3. Průměrné hodnoty koncentrace HDL-cholesterolu. 
Post-hoc Fisherův LSD test pro pacienty s léčbou ukázal statisticky významný nárůst koncentrace HDL-Ch ve skupině 0,5–1 rok (p = 0,007) po zahájení cART. Tato koncentrace se dále již významně neměnila. Kromě výchozí kategorie (do 1 měsíce) byly průměrné hodnoty ve všech ostatních kategoriích nad optimální hodnotou HDL-Ch pro muže > 1,0 mmol/ l.
Průměrné hodnoty koncentrace apolipoproteinu B v závislosti na době sledování pacienta ukazuje graf 4.
Graph 4. Průměrné hodnoty koncentrace apolipoproteinu. 
Post-hoc Fisherův LSD test pro pacienty s léčbou ukázal statisticky významný rozdíl mezi skupinou sledovanou do 1 měsíce a skupinami sledovanými 3–4 roky (p = 0,005), 4–5 let (p < 0,001) a 5–6 let (p = 0,003).
To znamená, že statisticky významná změna koncentrace apo B byla zjištěna až ve skupině pacientů užívajících cART 3 a více let. Průměrná hodnota apo B však nepřesáhla cílovou hodnotu < 1,0 g/ l v žádné sledované kategorii.
Průměrné hodnoty indexu celkový cholesterol/HDL-cholesterol v závislosti na době sledování pacienta ukazuje graf 5. Statisticky významné změny daného parametru v čase nebyly zjištěny.
Graph 5. Průměrné hodnoty indexu celkový cholesterol/HDL-cholesterol.) 
Ve všech kategoriích byly průměrné hodnoty pod doporučenou hodnotou < 5.
Průměrné hodnoty koncentrace non-HDL-cholesterolu v závislosti na době sledování pacienta ukazuje graf 6.
Graph 6. Průměrné hodnoty koncentrace non-HDL-cholesterolu. 
Post-hoc Fisherův LSD test pro pacienty s léčbou ukázal statisticky významný rozdíl mezi skupinou sledovanou do 1 měsíce a skupinami sledovanými 1 měsíc – 0,5 roku (p = 0,024), 0,5–1 rok (p = 0,027), 1–2 roky (p = 0,016), 2–3 roky (p = 0,001), 3–4 roky (p < 0,001), 4–5 let (p < 0,001) a 5–6 let (p = 0,001).
Statisticky významný nárůst koncentrace byl zaznamenán již v prvním půlroce po zahájení cART. Tato hodnota byla v následujících letech víceméně stabilizovaná až do dalšího statisticky významného zvýšení, které bylo zaznamenáno (izolovaně) v kategorii 4–5 let. V této jediné kategorii byla také překročena cílová hodnota 3,8 mmol/ l.
Diskuze
Chronická zánětlivá reakce při floridní nekontrolované HIV infekci je obecně spojena s tendencí k poklesu T-Ch. Statisticky významná elevace T-Ch po zahájení léčby a potlačení virové replikace může být „návratem k normálu“ [15] a známkou určité metabolické stabilizace.
Stejné mechanizmy by mohly vést také ke statisticky významné elevaci HDL-Ch v prvních 2 letech po zahájení cART. To je doba, která odpovídá postupnému potlačování virové replikace (snižování počtu kopií HIV-1 RNA) a nastupující regeneraci imunologických funkcí (zvyšování počtu CD4+ lymfocytů).
Index T-Ch/HDL-Ch zohledňuje fakt, že na výši individuálního rizika se významně podílí nejen koncentrace T-Ch, ale také HDL-Ch. Současné zvýšení T-Ch i HDL-Ch nemusí riziko ICHS zvyšovat [16]. U sledovaného souboru nebyly zjištěny žádné statisticky významné změny indexu T-Ch/HDL-Ch ani v závislosti na délce užívání cART, ani v závislosti na přítomnosti či nepřítomnosti cART. Obdobný závěr byl stanoven i ve studii SMART [17]. Naopak v DAD studii bylo zjištěno signifikantní zvýšení tohoto indexu u pacientů s cART [11].
Statisticky významné zvýšení HDL-Ch, který nese silný antiaterogenní potenciál, koresponduje s hypotézou, že nejrizikovější z hlediska aterogenního lipidového profilu je intenzivní virová replikace s vysokým počtem kopií HIV-1 RNA a hluboký imunodeficit s nízkým počtem CD4+ lymfocytů. Tuto teorii podporují také studie ACTG 5078, ACTG 5152, MACS, WIHS, SMART, STACCATO [18–24].
Elevace HDL-Ch byla pozorována i v jiných studiích [1,11,25], ve kterých byla uváděna určitá možnost protektivního vlivu některých nenukleosidových inhibitorů reverzní transkriptázy, zejména nevirapinu [26,27]. Naše studie toto vysvětlení nepodporuje, protože zastoupení nevirapinu, na rozdíl od jiných léčiv s antiretrovirovou aktivitou, bylo v léčebných schématech minimální. Jiné studie naopak prezentují signifikantní snížení HDL-Ch v souvislosti s léčbou cART [28].
Aterogenní dyslipidemie je charakterizována vyšší koncentrací triglyceridů, nízkou koncentrací HDL-cholesterolu [29], vyšší koncentrací apolipoproteinu B a také vyšší koncentrací non-HDL-cholesterolu [30].
V prezentované studii byla zjištěna statisticky významná elevace koncentrace lipidových frakcí (T-Ch, Tg, apo B, non-HDL-Ch). Kromě triglyceridů byly optimální nebo cílové hodnoty překročeny až po 3 a více letech užívání cART a cílová hodnota pro apolipoprotein B nebyla překročena v žádné sledované kategorii.
Jak ukazuje tab. 5, vývoj hodnot CD4+ lymfocytů a počtu HIV-1 RNA kopií znamená vysokou účinnost cART z hlediska imunologické regenerace (počet CD4+ lymfocytů) a virové suprese (počet kopií HIV-1 RNA) i v kategoriích nejdéle sledovaných pacientů. Při hodnotách, kdy je počet kopií HIV-1 RNA pod hladinou detekovatelnosti a počet CD4+ lymfocytů se pohybuje nad 500 buněk/μl, je negativní vliv imunodeficitu a floridní nekontrolované HIV replikace na akceleraci preklinické aterosklerózy podstatně méně pravděpodobný [31].
Většina studií sleduje změny koncentrace pouze některých krevních lipidů (T-Ch, Tg, event. LDL-Ch, HDL-Ch) po zahájení určitých léčebných režimů (studie KLEAN, ALERT, ARTEMIS, TITAN atd.), kdy je doba sledování obvykle 48–96 týdnů [32]. V dlouhodobějších observačních studiích jsou pacienti zařazováni a sledováni podle různých kritérií (studie FRAM, MESA, SMART, DAD atd.) preklinických, klinických i laboratorních, takže vzájemné srovnávání je velmi problematické až nemožné. Sledované soubory jsou velmi heterogenní a prezentované závěry mají limitovanou výpovědní hodnotu [9,33].
Uvedená observační studie má rovněž řadu limitů a výsledky nelze generalizovat. Pacienti nebyli diferencováni podle jednotlivých typů antiretrovirových režimů, nebyli rozděleni na skupinu mužů a žen, sledování bylo provedeno s relativně malým počtem pacientů a vzhledem k charakteru studie nebylo možné vytvořit kontrolní HIV negativní skupinu. Vyšetření pacientů nebyla prováděna v pravidelných intervalech, takže nemohla být použita klasická párová analýza dat.
Cílem studie bylo zjistit globální informaci o trendu vývoje koncentrace krevních lipidů u pacientů léčených cART od začátku jejich dispenzarizace v AIDS centru FN Brno. Obdobně koncipovaná studie s podobnou délkou sledování není v odborné literatuře k dispozici.
Řada studií z poslední doby se přiklání k názoru, že kromě tradičních rizikových faktorů budou hrát důležitou roli při eventuální akceleraci preklinické aterosklerózy u HIV pozitivních také netradiční rizikové faktory spojené s biologickými vlastnostmi HIV, aktivací CD8+ lymfocytů, přítomností anti-CMV IgG protilátek, celkovou délkou HIV pozitivity, subakutního chronického zánětu, který alteruje imunitní funkce, aktivitou chemokinů a dalšími faktory [34]. Stále významnější role se připisuje také změnám hemokoagulačních faktorů při chronické HIV infekci [7,35,36].
I přes zvýšenou pozornost, která je v posledních letech věnována možnosti akcelerace preklinické aterosklerózy a dalším metabolickým a nádorovým chorobám u HIV pozitivních pacientů, zůstává nadále nezpochybnitelným faktem, že morbidita a mortalita je prioritně závislá na závažnosti imunodeficitu a absolutním počtu CD4+ lymfocytů [37].
Závěr
Trend ke konstituci aterogenní dyslipidemie jsme jednoznačně neprokázali ani v nejdéle sledovaných kategoriích pacientů. Přesto nelze vyloučit, že bude v dalším vývoji potvrzena hypotéza vlivu a významu celkové délky užívání cART na aterogenní dyslipidemii i kardiovaskulární riziko [38]. Délka sledování dosud prezentovaných studií (i výše uvedené) je, zejména z hlediska vlivu alterace lipidového spektra na aterogenezi, velmi krátká.
MUDr. Svatava Snopková, Ph.D.
www.fnbrno.cz
e-mail: svatava.snopkova@fnbrno.czDoručeno do redakce: 31. 3. 2010
Přijato po recenzi: 10. 1. 2011
Sources
1. Ranade K, Geese WJ, Noor M et al. Genetic analysis implicates resistin in HIV lipodystrophy. AIDS 2008; 22 : 1561–1568.
2. Miller J, Carr A, Emery S et al. HIV lipodystrophy: prevalence, severity and correlates of risk in Australia. HIV Med 2003; 4 : 293–301.
3. Martinez E, Visnegarwala F, Grund B et al. The effects of intermittent, CD4-guided antiretroviral therapy on body composition and metabolic parameters. AIDS 2010; 24 : 353–363.
4. Worm SW, Friis-Moller N, Bruyand M et al. High prevalence of the metabolic syndrome in HIV-infected patients: impact of different definitions of the metabolic syndrome. AIDS 2010; 24 : 427–435.
5. Grinspoon SK Metabolic syndrome and cardiovascular disease in patients with human immunodeficiency virus. Am J Med 2005; 118: (Suppl. 2): 23S–28S.
6. Grinspoon S, Carr A Cardiovascular risk and body fat abnormalities in HIV infected individuals. N Engl J Med 2005; 352 : 48–62.
7. Satchell CS, Cotter AG, O´Connor EF et al. Platelet function and HIV: a case-control study. AIDS 2010; 24 : 649–657.
8. Murphy R, Costagliola D Increased cardiovascular risk in HIV infection: drugs, virus and immunity. AIDS 2008; 22 : 1625–1627.
9. Calza L, Manfredi R, Verucchi G Myocardial infarction risk in HIV-infected patients: epidemiology, pathogenesis, and clinical management. AIDS 2010; 24 : 789–802.
10. Aslangul E, Assoumou L, Bittar R et al. Rosuvastatin versus pravastatin in dyslipidemic HIV-1-infected patients receiving protease inhibitors: a randomized trial. AIDS 2010; 24 : 77–83.
11. Fontas E, Van Leth F, Sabin CA et al. Lipid profiles in HIV-Infected patients Receiving Combination Antiretroviral Therapy: Are Different Antiretroviral Drugs Associated with Different Lipid Profiles? J Infect Dis 2004; 189 : 1056–1074.
12. Martinez E, Leyes P, Ros E. Effectiveness of lipid-lowering therapy in HIV patients. Curr Opin HIV AIDS 2008; 3 : 240–246.
13. Chow D, Chen H, Glesby MJ et al. Short-term ezetimibe is well tolerated and effective in combination with statin therapy to treat elevated LDL cholesterol in HIV-infected patients. AIDS 2009; 23 : 2133–2141.
14. Soška V. Stanovení LDL-cholesterolu – stále nevyřešený problém: vypočíst, nebo změřit? – editorial. Vnitř Lék 2008; 54 : 943–944.
15. Soška V. Je dyslipidemie rizikovým faktorem pro nemocné léčené antiretrovirovými léky? – editorial. Vnitř Lék 2008; 54 : 135–136.
16. Lemieux I, Lamarche B, Couillard C et al. Total cholesterol/HDL cholesterol ratio vs. LDL cholesterol/HDL cholesterol ratio as indices of ischemic heart disease risk in men: the Quebec Cardiovascular Study. Arch Intern Med 2001; 161 : 2685–2692.
17. Philips AN, Carr A, Neuhaus J et al. Interruption of antiretroviral therapy and risk of cardiovascular disease in person with HIV-1 infection: exploratory analyses from the SMART trial. Antivir Ther 2008; 13 : 177–187.
18. Mangili A, Gerrior J, Tang AM et al. Risk of cardiovascular disease in a cohort of HIV-infected adults: a study using carotid intima-media thickness and coronary calcium score. Clin Infect Dis 2006; 43 : 1482–1489.
19. Murphy R, Costagliola D. Increased cardiovascular risk in HIV infection: drugs, virus and immunity. AIDS 2008; 22 : 1625–1627.
20. Kaplan RC, Kingsley LA, Gange SJ et al. Low CD4+ T-cell count as a major atherosclerosis risk factor in HIV-infected women and men. AIDS 2008; 22 : 1615–1624.
21. Hirschel B, Flanigan T. Is it smart to continue to study treatment interruptions? AIDS 2009; 23 : 757–759.
22. Van Leuven SI, Franssen R, Kastelein JJ et al. Systemic inflammation as a risk factor for atherothrombosis. Rheumatology 2008; 47 : 3–7.
23. Maggiolo F, Airoldi M, Callegaro A et al. CD4 cell-guided scheduled treatment interruptions in HIV-infected patients with sustained immunologic response to HAART. AIDS 2009; 23 : 799–807.
24. Calmy A, Gayet-Ageron A, Montecucco F et al on behalf of the STACCATO Study Group. HIV increases markers of cardiovascular risk: results from a randomized, treatment interruption trial. AIDS 2009; 23 : 929–939.
25. The Writing Committee of the DAD Study Group. Cardio - and cerebrovascular events in HIV-infected persons. AIDS 2004; 13 : 1811–1817.
26. Sankatsing R, Franssen R, Hassink E et al. Nevirapine increases high-density lipoprotein cholesterol concentration by stimulation of apolipoprotein A-I production. Arterioscler Tromb Vasc Biol 2009; 29 : 1336–1341.
27. Phillips AN, Carr A, Neuhaus J et al. Interruption of antiretroviral therapy and risk of cardiovascular disease in person with HIV-1 infection: exploratory analyses from the SMART trial. Antivir Ther 2008; 13 : 177–187.
28. Riddler SA, Xiuhong L, Otvos J et al. Antiretroviral Therapy Is Associated With an Atherogenic Lipoprotein Phenotype Among HIV-1 – Infected Man un th multicenter AIDS Cohort Study. J Acquir Immune Defic Syndr 2008; 48 : 281–288.
29. Rosolová H. Snížení reziduálního vaskulárního rizika bude hlavní cíl preventivní kardiologie ve 21. století. Cor Vasa 2010; 52 : 209–211.
30. Fruchart JC, Sacks FM, Hermans MP et al. Residual risk reduction initiative: výzva ke snížení reziduálního vaskulárního rizika u pacientů s dyslipidemií. Cor Vasa 2010; 52 : 212–228.
31. Torre D, Pugliese A. Interleukin 18 and cardiovascular disease in HIV-1 infection: a partner in crime? AIDS Rev 2010; 12 : 31–39.
32. Gallant J. Timing and Choice of First-Line Antiretroviral Therapy. 43–76. In: HIV/AIDS Annual Update 2009. Clinical care options HIV, Miami, 2009, 197.
33. Grunfeld C, Delanez A, Wanke Ch et al. Preclinical atherosclerosis due to HIV infection: carotid intima-medial thickness measurements from the FRAM study. AIDS 2009; 23 : 1841–1849.
34. Lo J, Abbara S, Shturman L et al. Increased prevalence of subclinical coronary atherosclerosis detected by coronary computed tomography angiography in HIV-infected men. AIDS 2010; 24 : 243–253.
35. Chaipan C, Soilleux E, Simpson P et al. DC-SIGN and CLEC-2 mediate human immunodeficiency virus type 1 capture by platelets. J Virol 2006; 80 : 8951–8960.
36. Madden E, Lee G, Kotler DP et al. Association of antiretroviral therapy with fibrinogen levels in HIV-infection. AIDS 2008; 22 : 707–715.
37. The HIV-CAUSAL Collaboration. The effect of combined antiretroviral therapy on the overall mortality of HIV-infected individuals. AIDS 2010; 24 : 123–137.
38. Friis-Moller N, Sabin CA, Weber R et al. Combination antiretroviral therapy and the risk of myocardial infarction. N Engl J Med 2003; 349 : 1993–2003.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 5-
All articles in this issue
- Terapie kritické končetinové ischemie u pacientů se syndromem diabetické nohy pomocí autologních kmenových buněk
- Zlepšení kvality života po ablaci dlouhodobě perzistentní versus paroxysmální fibrilace síní: výsledky dvouletého sledování
- Změny krevních lipidů při dlouhodobé antiretrovirové léčbě
- Kardiotoxicita onkologické léčby
- Sorafenib v léčbě hepatocelulárního karcinomu
- Infekční komplikace u pacientů po srdeční zástavě při terapeutické hypotermii
- Snížení morbidity a mortality nemocných s chronickými formami ischemické choroby srdeční je výsledkem konzervativní léčby
- Faktory ovlivňující vznik a průběh kognitivních poruch u seniorů
- Sulodexid a nefrotický syndróm pri diabetickej nefropatii
- Ormondova choroba (idiopatická retroperitoneálna fibróza)
- Porucha syntézy cholesterolu a jeho prekurzorů u klinicky závažných stavů
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ormondova choroba (idiopatická retroperitoneálna fibróza)
- Kardiotoxicita onkologické léčby
- Faktory ovlivňující vznik a průběh kognitivních poruch u seniorů
- Porucha syntézy cholesterolu a jeho prekurzorů u klinicky závažných stavů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


