-
Medical journals
- Career
Ormondova choroba (idiopatická retroperitoneálna fibróza)
: A. Michaligová 1; L. Plank 2; A. Ježíková 1; V. Maňka 1; P. Makovický 1; M. Mokáň 1
: I. Interná klinika Jesseniovej lekárskej fakulty UK a Univerzitnej nemocnice Martin, Slovenská republika, prednosta prof. MUDr. Marián Mokáň, DrSc., FRCP Edin 1; Ústav patologickej anatómie Jesseniovej lekárskej fakulty UK a Univerzitnej nemocnice Martin, Slovenská republika, prednosta prof. MUDr. Lukáš Plank, CSc. 2
: Vnitř Lék 2011; 57(5): 511-515
: Case Reports
Idiopatická retroperitoneálna fibróza (IRF) je zriedkavé ochorenie charakterizované vývojom sklerotického tkaniva okolo aorty, ilických ciev a často obrastá štruktúry ako uretery a v. cava inferior. Najčastejšie sa prejavuje vo veku 40–60 rokov, dominuje mužské pohlavie. Vo väčšine prípadov sa klinický obraz prejavuje ako kompresívny syndróm ureterov, preto aj prvé známe prípady boli opísané urológmi. V tejto kazuistike prezentujeme prípad 37-ročného pacienta vyšetrovaného pre pretrvávajúce febrility do 38 °C a vysokú zápalovú aktivitu, napriek empiricky nasadenej antibiotickej liečbe. Pozitrónová emisná tomografia (PET) ukázala miesto zvýšenej metabolizácie fluorodeoxyglukózy s maximom paraaortálne vľavo. Pri mikroskopickom vyšetrení odobratého ložiska boli nájdené zmeny, ktoré pri komplexnom zhodnotení klinického obrazu, zobrazovacích vyšetrovacích metód a histologického nálezu umožnili stanoviť diagnózu – idiopatická retroperitoneálna fibróza – Ormondova choroba.
Kľúčové slová:
idiopatická retroperitoneálna fibróza – Ormondova choroba – febrilityÚvod
Idiopatická retroperitoneálna fibróza (IRF) je zriedkavé ochorenie charakterizované vývojom sklerotického tkaniva okolo aorty, ilických ciev a často obrastá štruktúry ako uretery a v. cava inferior [1].
Prvý prípad idiopatickej retroperitoneálnej fibrózy opísal v roku 1905 urológ Joaquin Albarran [2]. Ako klinickú jednotku ju v roku 1948 uviedol urológ John Ormond [3].
Pri 2/3 prípadov zostáva etiológia retroperitoneálnej fibrózy neobjasnená, v 1/3 je sekundárna ako sprievodný znak iného ochorenia (malignity, infekcie) alebo užívania niektorých liekov (metylsergid).
Podľa epidemiologickej štúdie uskutočnenej v roku 2004 vo Fínsku je incidencia IRF 0,1 na 100 000 obyvateľov a prevalencia 1,4 na 100 000 obyvateľov. Incidencia stúpa u pacientov vo veku 40–60 rokov. Vyskytuje sa častejšie u mužov ako u žien v pomere 2–3 : 1 [4,5].
Ochorenie môžu sprevádzať nešpecifické príznaky ako tupá bolesť lokalizovaná v oblasti chrbta, brucha, únava, strata telesnej hmotnosti, mierne zvýšená telesná teplota, alebo sa prejavuje ako kompresívny syndróm okolitých štruktúr – ureterov, v. cava inferior, aorty a jej vetiev, alebo ciev zásobujúcich pohlavné orgány. Najčastejšie komprimované štruktúry sú močovody.
Kazuistika
V marci roku 2008 bol na I. internej klinike Univerzitnej nemocnice v Martine hospitalizovaný 37-ročný pacient, predtým opakovane vyšetrovaný na viacerých pracoviskách pre pretrvávajúce febrility do 38 °C a vysokú zápalovú aktivitu, napriek empiricky nasadenej antibiotickej liečbe.
Anamnesticky pacient nemal žiadne zdravotné ťažkosti, trvale neužíval žiadne lieky, v čase výstupu telesnej teploty nad 38 °C pociťoval celkovú slabosť a bolesti kĺbov. Po poklese telesnej teploty sa cítil dobre.
Fyzikálnym vyšetrením sme zistili normostenický habitus (BMI = 25 kg/m2). Dostupné lymfatické uzliny neboli zväčšené, ostatné vyšetrené systémy bez patologickej odchýlky.
V laboratórnom obraze bola prítomná zrýchlená sedimentácia (FW 100/110), aktivita zápalových parametrov bola vyššia (C-reaktívny proteín 154 mg/ l – norma ≤ 5, mukoproteíny 849 μmol/ l – norma < 386), v krvnom obraze bola normocytárna normochrómna anémia (hemoglobín 108 g/ l), leukocyty, trombocyty, imunoglobulíny boli v medziach normy, spektrum orgánových protilátok vrátane ANA, ANCA protilátok bolo negatívne.
V rámci diferenciálnej diagnostiky sme vylúčili fokálnu infekciu (negatívne nálezy výterov z tonzíl, nosa, negatívne výsledky hemokultúr, pri zubnom, krčnom vyšetrení, transezofageálnom vyšetrení oddielov srdca) a pátrali sme po malignite s negatívnym výsledkom. Pre anémiu a sonograficky verifikovanú, hranične zväčšenú slezinu a pečeň sme doplnili trepanobiopsiu kostnej drene. V nej, popri náleze prevládajúcej fyziologicky vyzrievajúcej normocelulárnej krvotvorby, bolo prítomné rozsahovo malé ložisko (pod 5 %) atypickej lymfohistiocytovej a plazmocytovej proliferácie s prevahou účasti CD3+ T buniek. Pre pretrvávajúci febrilný stav s negatívnymi závermi zobrazovacích vyšetrení sme doplnili pozitrónovú emisnú tomografiu (PET) v štandardnom snímaní do polovice stehien, kde sa v zobrazených sekvenciách zobrazilo miesto s vysokou metabolizáciou 18fluorodeoxyglukózy (FDG) s maximom paraaortálne vľavo (obr. 1). Laparotomicky bola extirpovaná masa adherujúca k brušnej aorte a venóznym štruktúram, infiltrujúca retroperitoneum, ako aj malé ložisko pečene. V histologicky vyšetrených vzorkách retroperitoneálnej masy (obr. 2 a 3) dominovali známky fibrotizujúceho chronického zápalového, ale histocytologicky nápadne pleomorfného procesu s ložiskovo rozdielne pokročilou sklerotizáciou, bez známok vaskulitídy. Rovnaká zápalová populácia bola prítomná aj v excízii z pečene, chirurgom označenej ako „fibrózny uzlík pečene“. Na základe komplexného zhodnotenia histologických nálezov v korelácii s klinickým obrazom bola stanovená diagnóza Ormondovej choroby. Aj napriek extirpácii masy zvýšená teplota pretrváva, preto sme chirurgickú liečbu kombinovali s farmakologickou (Prednison v dávke 0,5 mg/kg telesnej hmotnosti).
1. PET vyšetrenie – miesto s vysokou metabolizáciou 18FDG s maximom paraaortálne vľavo. 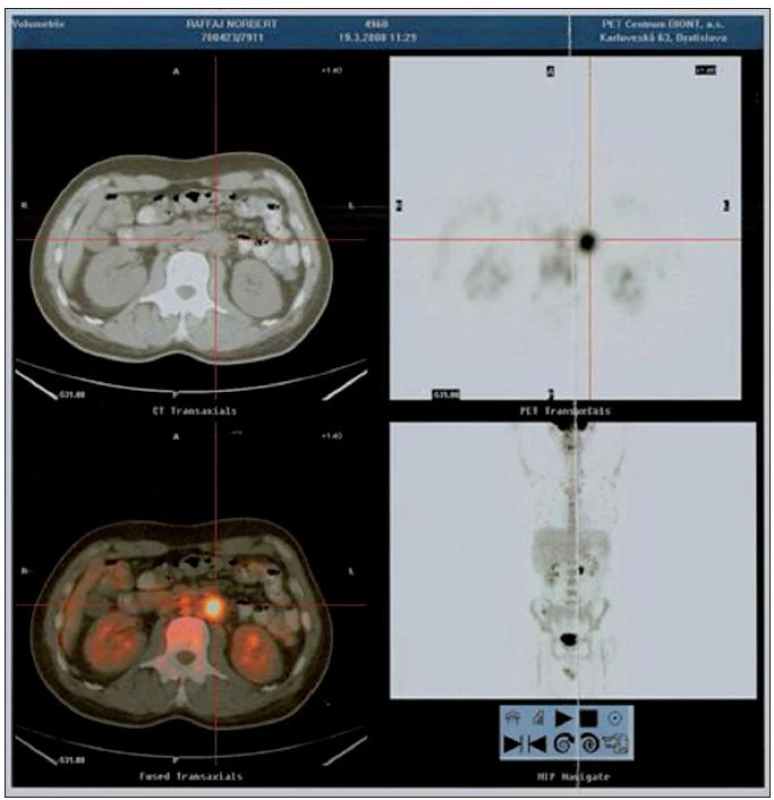
2. Prehľad rozsiahleho chronického fibrotizujúceho zápalu retroperitoneálneho fibrolipomatózneho spojiva (HE, 2krát). 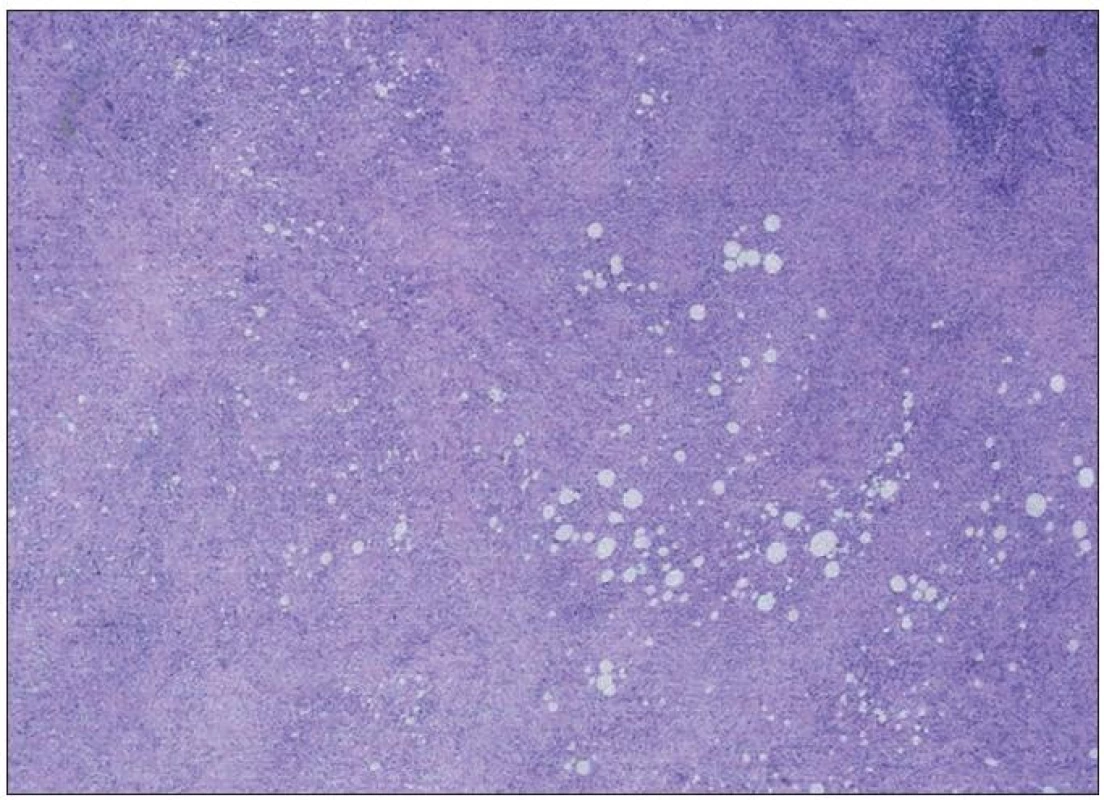
3. Detail predošlého obrazu: nápadne pleomorfná lymfohistiocytová populácia na pozadí chronického fibrotizujúceho zápalu (HE, 40krát). 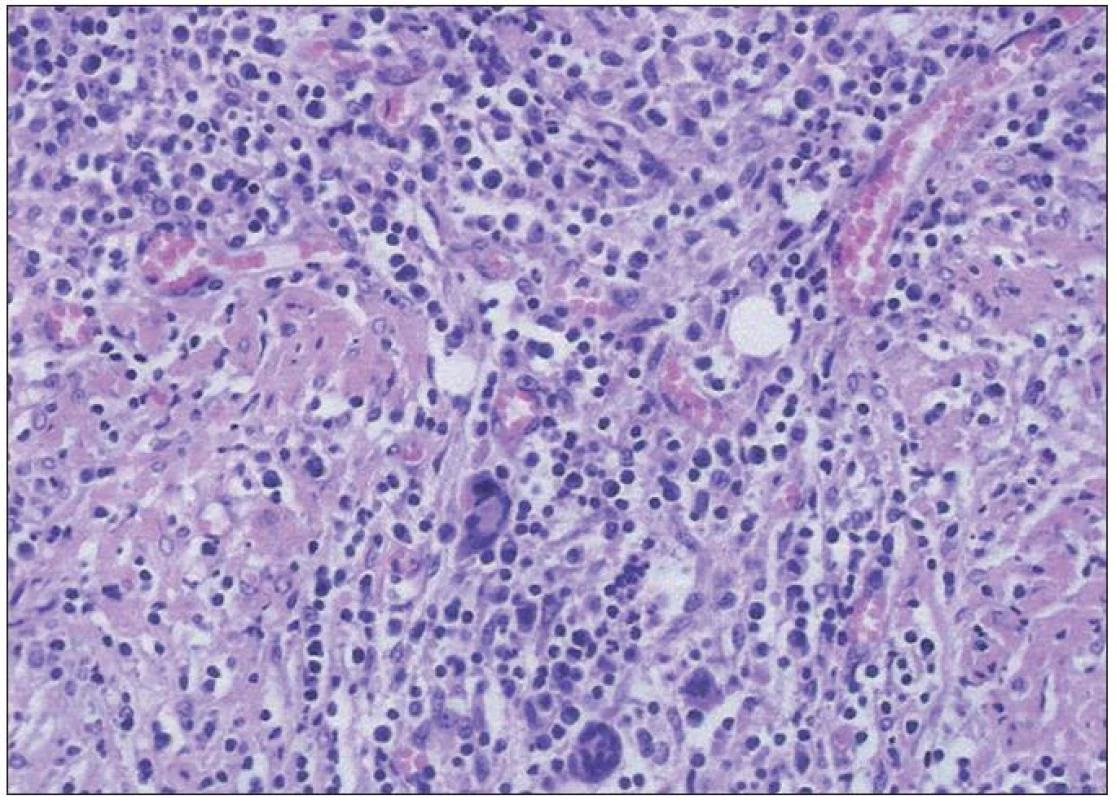
Po liečbe došlo k zlepšeniu stavu, pacient je ďalej sledovaný ambulantne. Pri kontrolnom vyšetrení po 6 mesiacoch bol bez zvýšenej teploty, v laboratórnom obraze sme zaznamenali pokles zápalových parametrov, kontrolné vyšetrenie PET bolo bez známok zvýšenej metabolizácie fluorodeoxyglukózy.
Diskusia
Idiopatická retroperitoneálna fibróza (Ormondova choroba) sa zaraďuje medzi „orphan disease“. Charakterizuje ju rast sklerotického tkaniva okolo aorty, ilických ciev a často aj okolo ureterov a v. cava inferior. Častejšie postihuje mužov vo veku 40–60 rokov. Klinický obraz sa prejavuje ako kompresívny syndróm okolitých štruktúr – najčastejšie ureterov, preto aj prvé známe prípady boli opísané urológmi.
Menej ako 15 % pacientov má podobný fibrotický proces mimo peritonea. Najčastejšie sú to mediastinálna fibróza, Riedlova fibrotizujúca tyreoiditída, sklerotizujúca cholangitída a fibrotický orbitálny pseudotumor [6]. V abdominálnej dutine môže retroperitoneálna fibróza prerastať kontinuálne a zavzať štruktúry v retroperitoneu a peritoneálnej dutine. Fibrotické lézie vo všetkých lokalizáciách majú rovnaký histologický základ, a teda patria k rovnakému zdroju.
Etiológia ochorenia nie je známa. Existuje niekoľko teórií vzniku fibrózy. Niektoré práce hovoria o súvislosti s vaskulitídou, pretože vo včasnom štádiu ochorenia sa objavuje perivaskulárny zápal [7], iné považujú idiopatickú retroperitoneálnu fibrózu za manifestáciu systémového ochorenia [8].
Idiopatická retroperitoneálna fibróza sa často objavuje v mieste, kde obsahuje stena artérie (najčastejšie aorty) aterosklerotické pláty a oslabenú mediu. Vznik fibrózy súvisí s prechodom nerozpustného lipidu (ceroidu) z aterómu do periaortálneho tkaniva. Ceroid sa často nachádza v makrofágoch adventicie aorty a môže indukovať imunitnú reakciu. Predpokladá sa, že všetky formy fibrózy v tele sú výsledkom hypersenzitivity k takýmto antigénom v aterómových plakoch, a preto by mali byť pomenované ako chronická periaortitída respektíve periarteritída [9,10]. Toto však nevysvetľuje prítomnosť fibrózy u detí.
Asi 5–10 % aortoilických aneuryziem formuje perivaskulárny obal, ktorý obaľuje iba aneuryzmu, alebo rastie laterálne, kde obaľuje a obturuje uretery [11]. Niektorí autori predpokladajú, že IRF a perianeuryzmatická fibróza sú dve rozdielne jednotky, ale ich klinická manifestácia môže byť rovnaká [12].
IRF bola opísaná aj pri užívaní niektorých liekov. V 12 % prípadov pri užívaní metylsergidu – ergotamínového derivátu používaného v liečbe migrény [13].
Aj niektoré iné liečivá môžu indukovať IRF, ako napr. beta-blokátory, metyldopa, hydralazin, rôzne analgetiká, antibiotiká.
Špecifické infekcie ako tuberkulóza, syfilis, aktinomykóza a rôzne mykotické infekcie boli zvažované ako jedna z možných príčin IRF podobne ako nešpecifické zápalové procesy (divertikulitída, apendicitída).
O ďalšom patogenetickom faktore môže svedčiť asociácia fibrosklerotizujúcich ochorení s eleváciou sérovej hladiny IgG4, ktorá bola najprv popísaná u autoimunitnej pankreatitídy a neskôr aj u ďalších idiopatických fibrosklerotizujúcich ochorení (napr. fibroskleróza žlčových ciest, slinných vývodov). IgG4 pozitívne plazmocyty boli nájdené taktiež v histologických vzorkách pacientov s IRF.
Hemorágia, spontánna alebo traumatická, môže taktiež indukovať vznik IRF, pričom sa našli hemosiderinové depozitá v niektorých vzorkách fibrózy. Malé metastatické ohniská v retroperitoneu pri malignitách vyvolávajú desmoplastickú reakciu vyúsťujúcu do tvorby fibrotického plaku, ktorý je ťažko klinicky diferencovateľný od IRF, hlavne u pacientov, u ktorých sa o primárnej malignite nevie [14]. Diferenciálna diagnostika IRF vyžaduje aj odlíšenie celého radu zápalových fibrotizujúcich procesov, vrátane tzv. Erdheimovej-Chesterovej choroby [15] (tab. 1).
1. Príčiny retroperitoneálnej fibrózy. 
Klinicky sa fibróza najčastejšie prejavuje ako kompresívny syndróm. Najčastejšie komprimované štruktúry sú uretery. Obštrukcia obidvoch utererov sa vyskytuje vo vysokom percente prípadov (až 50 %) [16]. Je charakterizovaná bolesťou a citlivosťou v boku alebo kostovertebrálnom uhle, ureterálnou kolikou, oligoúriou až anúriou alebo renálnou insuficienciou. Kompresia dolnej dutej žily môže vyústiť do edému dolných končatín, skróta alebo trombózy vén dolných končatín. Postihnutie ciev gonád môže vyústiť do hydrokély. Kompresia renálnych ciev môže viesť k vývoju renovaskulárnej hypertenzie a oklúzia mezenterických ciev môže viesť k intestinálnej ischémii.
Pri vzniku mediastinálnej fibrózy sa môžu objaviť príznaky kompresie hornej dutej žily, konstriktívnej perikarditídy.
Pacient môže trpieť taktiež nešpecifickými príznakmi ako sú tupá bolesť lokalizovaná v oblasti chrbta, brucha, únava, úbytok telesnej hmotnosti a zvýšená telesná teplota. Laboratórny nález je nešpecifický – moč je sterilný, častým príznakom je anémia ľahkého stupňa. Zrýchlená sedimentácia pri vstupnom vyšetrení je prítomná vo viac ako 90 % prípadov [17].
Makroskopicky má fibrotický plak „drevitú“ konzistenciu a je šedobiely. Predný okraj vo všeobecnosti kopíruje zadnú peritoneálnu hranicu a je dobre ohraničený, zadný okraj je vyznačený horšie a ťažko sa oddeľuje od okolitých štruktúr. Je obyčajne centrovaný na predný povrch 4.–5. lumbálneho stavca obklopený aortou, dutou žilou, ilickými cievami a zvyčajne neprerastá laterálne viac ako 1 cm za uretery. V skorom štádiu ochorenia má tkanivo vysoký podiel tekutiny, pretože novovytvorené cievy majú stenu priepustnú pre proteíny a leukocyty do extravaskulárneho priestoru. Ako plak vyzrieva, kolagén hyalinizuje a bunková aktivita klesá. Vyzretý plak pozostáva z hyalinizovaného kolagénu, ktorý obsahuje malé množstvo buniek.
V minulosti sa diagnostika ochorenia opierala o príznaky kompresie ureterov. Vylučovacia urografia bola vyšetrením prvej voľby. Bilaterálne poškodenie obidvoch ureterov býva v 2/3 prípadov, v detskom veku v 1/2 prípadov [18].
Podobné rádiologické obrazy vidíme aj pri ureterálnych tumoroch, periureterálnej adenopatii, postoperačných a pozápalových striktúrach ureterov.
Vo všeobecnosti nemôžeme jednoznačne využiť sonografiu alebo počítačovú tomografiu v prípadoch diferenciálnej diagnostiky IRF, hybridná metóda PET/CT vyšetrenie umožňuje zobrazenie metabolických zmien v tkanive spolu s ich presnou anatomickou lokalizáciou a morfologickou špecifikáciou, zvyšuje senzitivitu a špecificitu samostatne realizovaného PET a CT vyšetrenia [19]. Finálnu diagnózu určí až histologické vyšetrenie po chirurgickom vybratí ložiska. Biopsia tenkou ihlou s aspiráciou je menej efektívna.
U pacientov s obštrukciou ureterov liečba spočíva v kombinácii farmakologickej liečby so zavedením stentu v mieste kompresie alebo chirurgickej liečbe. Pri rezistencii na liečbu kortikoidmi sa skúša pridať do kombinácie azatioprin alebo mykofenolát mofetil [20]. Pri sekundárnej retroperitoneálnej fibróze je základom liečby primárne ochorenie.
U prezentovaného pacienta sa neobjavil typický obraz kompresie ureterov. Prijatý bol za účelom diferenciálnej diagnostiky pretrvávajúcich febrilít. Po doplnení série laboratórnych a zobrazovacích vyšetrení sme nakoniec pristúpili k histologickému vyšetreniu masy z retroperitonea. Diagnóza Ormondovej choroby bola stanovená histologicky. Pri diferenciálnej diagnostike nešpecifických príznakov, ako bola v tomto prípade pretrvávajúca zvýšená teplota, by sme mali myslieť aj na toto ochorenie.
Záver
Idiopatická retroperitoneálna fibróza (Ormondova choroba) je charakterizovaná vývojom sklerotického tkaniva okolo aorty, ilických ciev a často obrastá štruktúry ako uretery a v. cava inferior. Častejšie postihuje mužov vo veku 40–60 rokov. Klinicky sa prejavuje ako kompresívny syndróm okolitých štruktúr – najčastejšie ureterov. Finálnu diagnózu určí až histologické vyšetrenie. Vzhľadom k tomu, že klinický obraz môže byť variabilný, mali by sme v rámci diferenciálnej diagnostiky myslieť aj na toto vzácne ochorenie.
MUDr. Anna Michaligová
www.mfn.sk
e-mail: michaligova@gmail.comDoručeno do redakce: 9. 6. 2010
Přijato po recenzi: 6. 12. 2010
Sources
1. Vaglio A, Salvarani C, Buzio C. Retroperitoneal fibrosis. Lancet 2006; 367 : 241–251.
2. Albarran J. Rétention rénale par périurétérite. Libération externe de l’uretère. Assoc Fr Urol 1905; 9 : 511–517.
3. Ormond JK. Bilateral ureteral obstruction due to envelopment and compression by an inflammatory retroperitoneal process. J Urol 1948; 59 : 1072–1079.
4. Uibu T, Oksa P, Auvinen A et al. Asbestos exposure as a risk factor for retroperitoneal fibrosis. Lancet 2004; 363 : 1422–1426.
5. Gilkeson GS, Allen NB. Retroperitoneal fibrosis. A true connective tissue disease. Rheum Dis Clin North Am 1996; 22 : 356–364.
6. Armigliato M, Paolini R, Bianchini E et al. Hashimoto’s thyroiditis and Graves’ disease associated with retroperitoneal fibrosis. Thyroid 2002; 12 : 829–831.
7. Littlejohn GO, Keystone EC. The association of retroperitoneal fibrosis with systemic vasculitis and HLA-B27: a case report and review of the literature. J Rheumatol 1981; 8 : 665–669.
8. Vaglio A, Greco P, Corradi D et al. Autoimmune aspect of chronic periaortitis. Autoimmun Rev 2006; 5 : 458–464.
9. Vaglio A, Corradi D, Manenti L et al. Evidence of autoimmunity in chronic periaortitis: a prospective study. Am J Med 2003; 114 : 454–462.
10. Martorana D, Vaglio A, Greco D et al. Chronic periaortitis and HLA-DRB1*03: another clue to an autoimmune origin. Arthritis Rheum 2006; 55 : 126–130.
11. Allibone GW, Saxton HM. The association of aorto-iliac aneurysms with ureteral obstruction. Urol Radiol 1980; 1 : 205–210.
12. Lorentzen JE, Sørensen IN, Brun B et al. Abdominal aortic aneurysm in combination with retroperitoneal fibrosis. Acta Chir Scand Suppl 1980; 502 : 94–97.
13. Stewart TW jr. Idiopathic retroperitoneal fibrosis – past and present. NY State J Med 1989; 89 : 503–504.
14. Wu J, Catalano E, Coppola D. Retroperitoneal fibrosis (Ormond’s disease): clinical pathologic study of eight cases. Cancer Control 2002; 9 : 432–437.
15. Serratrice J, Granel B, De Roux B et al. „Coated aorta“: a new sign of Erdheim-Chester disease. J Rheumatol 2000; 6 : 1550–1553.
16. van Bommel EF, Siemes C, Hak LE et al. Long-term renal and patient outcome in idiopathic retroperitoneal fibrosis treated with prednison. Am J Kidney Dis 2007; 49 : 615–625.
17. Lepor H, Walsh PC. Idiopathic retroperitoneal fibrosis. J Urol 1979; 122 : 1–6.
18. Miller OF, Smith LJ, Ferrara EX et al. Presentation of idiopathic retroperitoneal fibrosis in the pediatric population. J Pediatr Surg 2003; 38 : 1685–1688.
19. Průcha M, Beňo P, Bartůňek M et al. Idiopatická retroperitoneálna fibróza – Ormondova choroba: kazuistika. Vnitř Lék 2008; 54 : 282–286.
20. Jois RN, Kerrigan N, Scott DG. Mycophenolate mofetil for maintenance of remision in idiopathic retroperitoneal fibrosis. Rheumatology (Oxford) 2007; 46 : 717–718.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 5-
All articles in this issue
- Treatment of critical limb ischemia and diabetic foot disease by the use of autologous stem cells
- Improvement of quality of life after ablation of longstanding persistent versus paroxysmal atrial fibrillation: results of 2-year follow-up
- Blood lipid changes at long-term antiretroviral treatment
- Cardiotoxicity of cancer therapy
- Sorafenib in the treatment of hepatocellular carcinoma
- Infectious complications in patients after cardiac arrest undergoing therapeutic hypothermia
- The decrease in morbidity and mortality of patients with chronic forms of ischemic heart disease is the result of conservative treatment
- Internal medicine and cognitive decline in seniors
- Sulodexid and nephrotic syndrome in patients with diabetic nephropathy
- Morbus Ormond (idiopatic retroperitoneal fibrosis)
- Disturbance of synthesis of cholesterol and its precursors in clinically serious conditions
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Morbus Ormond (idiopatic retroperitoneal fibrosis)
- Cardiotoxicity of cancer therapy
- Internal medicine and cognitive decline in seniors
- Disturbance of synthesis of cholesterol and its precursors in clinically serious conditions
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

