Screening celiakie u pacientů s osteoporózou a osteopenií
Authors:
P. Fojtík 1; P. Novosad 2; M. Kliment 1; P. Hrdý 2; Á. Bóday 3; R. Richterová 3; O. Urban 1,4
Authors‘ workplace:
Centrum péče o zažívací trakt, Vítkovická nemocnice, a. s., Ostrava-Vítkovice, přednosta MUDr. Ondřej Urban, Ph. D.
1; Osteologické centrum Mediekos Labor, a. s., Zlín, přednosta MUDr. Pavel Novosad
2; Laboratoř molekulární biologie, vedoucí RNDr. Radmila Richterová, P&R Lab, a. s., Nový Jičín, ředitelka RNDr. Magdalena Uvírová
3; Lékařská fakulta Ostravské univerzity Ostrava, děkan doc. MUDr. Arnošt Martínek, CSc.
4
Published in:
Vnitř Lék 2011; 57(12): 1000-1005
Category:
70th birthday of prof. MUDr. Petr Dítě, DrSc.
Overview
Celiakie je tradičně vnímána jako onemocnění dětského věku s typickou formou provázenou hlavně střevními symptomy a projevy malabsorpce. Tento názor je dosud všeobecně přijímán i lékařskou veřejností. Z výsledků celoplošného screeningu v evropských zemích a USA plyne zjištění, že prevalence vzrostla z původních 1 : 1 000–1 500 na 1 : 70–550. V průměru se prevalence v západních zemích blíží 1 : 100. V České republice je odhad prevalence celiakie kolem 1 : 200–250. V ČR je tedy pravděpodobně postiženo kolem 40 000–50 000 osob. V současnosti je však diagnostikováno a sledováno jen 10–15 % z celkového počtu nemocných. Dospělí představují hlavní diagnostický problém, neboť obraz nemoci je u nich individuální a hlavními příznaky jsou příznaky atypické (mimostřevní). Jsou to anémie (převážně sideropenická), předčasná osteoporóza, herpetiformní (Duhringova) dermatitida, polyneuritidy, ataxie, deprese, poruchy chování, poruchy menstruačního cyklu a infertilita. Proto je v současnosti zaměřena pozornost na screening v těchto skupinách. Cílem naší studie bylo ověřit četnost celiakie u nemocných s již potvrzenou osteoporózou a osteopenií. Ve studii jsme potvrdili, že prevalence celiakie u studovaného souboru byla 1 : 50, tedy 2,2 %, a proto se domníváme, že je vhodné provádět screeningové vyšetření u těchto pacientů s následnou kauzální léčbou (bezlepkovou dietou).
Klíčová slova:
celiakie – cílený screening – rizikové skupiny a choroby – osteoporóza – osteopenie – sekundární osteoporóza
Úvod
Celiakie (CS, celiakální sprue, gluten senzitivní enteropatie, netropická sprue) je celoživotní geneticky podmíněné autoimunitní onemocnění. Manifestuje se u geneticky vnímavého jedince (asociace HLA-DQ2, HLA-DQ8) po různě dlouhé době konzumace obilovin s obsahem lepku (glutenu). Gliadinové peptidy (štěpné produkty lepku) po prezentaci HLA-DQ2 a HLA-DQ8 pozitivním buňkám spouští ve sliznici tenkého střeva nepřiměřenou imunitní odpověď zprostředkovanou T-buňkami. Současně dochází k produkci vysoce specifických autoprotilátek (protilátky proti tkáňové transglutamináze – AtTGA). Konečným důsledkem reakce na lepek je poškození sliznice tenkého střeva (převážně duodena a jejuna) s různým stupněm atrofie a zánětlivých změn [1,2]. V současné době jsou překonána 2 dogmata, a to, že celiakie je onemocnění dětského věku a že je to onemocnění jen mírného klimatu.
Osteoporóza (OP) je progresivní systémové onemocnění skeletu charakterizované úbytkem kostní hmoty a poruchami mikroarchitektury kostní tkáně s následným zvýšením fragility kostí a zvýšeným rizikem zlomenin. Zlomeniny obratlových těl vedou k poklesu výšky nemocných, zhoršení fyzických funkcí, poruchám hybnosti, zhoršení schopnosti starat se o sebe. Odhaduje se, že v ČR trpí osteoporózou okolo 600 000 osob. Zlomeniny obratlových těl jsou nečastější klinickou manifestací OP. Předpokládá se, že více než 30 % žen mladších 75 let a 50 % žen starších 75 let má netraumatické zlomeniny obratlových těl. Zlomeniny krčku stehenní kosti jsou zase nejzávažnější komplikací OP. Vyžadují hospitalizaci, způsobují závažnou imobilitu a mohou vést k 10–20% zvýšení mortality během 1. roku po zlomenině [3]. Osteopenie se vyskytuje u 18–24 % pacientů s celiakií. U postmenopauzálních žen s celiakií je potvrzena OP u 34 % v lumbální oblasti a ve 27 % v oblasti krčku stehenní kosti. Periferní fraktury (předloktí a zápěstí) jsou nejčastější zlomeninou u 25 % ve věku 38–50 let. Hlavní skupinou běžně diagnostikované OP je postmenopauzální a senilní [4]. Část pacientů léčených pro osteoporózu má i osteoporózu sekundární, jejíž incidence je poměrně veliká. U mužů je to kolem 30–60 %. U perimenopauzálních žen je to až 50 %. Hlavním problémem se tedy stává kombinace sekundární osteoporózy a nejběžnější osteoporózy postmenopauzální. Osteoporózu a osteopenii v rámci celiakie také nazýváme metabolickým onemocněním skeletu. Ze sekundárních příčin osteoporózy je nejčastější gastrointestinální, jak pro svoji četnost, tak důsledky ve spojení s poruchou nutrice. Jsou to zánětlivé onemocnění střev (morbus Crohn a ulcerózní kolitida), léčba glukokortikosteroidy, celiakální sprue, laktózová intolerance, jaterní onemocnění, žaludeční a střevní resekce, pankreatická insuficience a všechny typy malabsorpce. Diagnostika těchto onemocnění spadá do péče gastroenterologů, ale léčba osteoporózy zde má svá specifika, která zase spadají do péče osteologů. Proto je nutný mezioborový přístup. U celiakie je vliv na kost a vznik OP založen na malabsorpci živin s následnou poruchou pasivního i aktivního transportu Ca, snížení hladiny regulačního proteinu vitaminu D, sníženou hladinou vitaminu D, růstového hormonu (GSF), inzulinu podobného růstového faktoru 1 (IGF-I) [5].
Podle kritérií Světové zdravotnické organizace pro screening jakékoli choroby by měly být splněny tyto předpoklady:
- choroba je léčitelná a neléčení má závažné důsledky;
- úvodní metoda má být jednoduchá, levná a přijatelná pro probanda i poskytovatele;
- pokud jde o metodu nepřímou, má vykazovat málo falešně pozitivních výsledků [6].
Celkový počet celiaků v Evropě se odhaduje asi na 3 miliony. Kvalifikovaný odhad prevalence celiakiální sprue (CS) v ČR je na podkladě publikovaných studií 1 : 200–250 (0,4–0,5 %), což odpovídá celkovému počtu 40 000–50 000 celiaků. V současnosti je však diagnostikováno pouze 10–15 % z celkového počtu nemocných. Celiakie se tedy diagnostikuje v ČR nedostatečně a pozdě z mnoha důvodů. Příčinou je všeobecně malé povědomí o atypických formách celiakie u medicínské veřejnosti, ale také změna fenotypu celiakie s častějšími atypickými (mimostřevními) projevy [7]. Jedním z atypických projevů je osteoporóza, na kterou jsme se v našem souboru zaměřili. Screening celiakie by se měl provádět u rizikových osob, rizikových chorob a podezřelých symptomů u autoimunitních chorob asociovaných s celiakií. Rizikové osoby jsou především rodinní příslušníci 1. stupně (děti, sourozenci, rodiče), zejména v přítomnosti podezřelých symptomů či autoimunitních onemocnění. Pokud je první výsledek sérologického vyšetření negativní, pak je doporučeno opakovat sérologické vyšetření v průběhu 2–3 let [8–10]. Rizikové choroby jsou anémie, většinou sideropenická, dermatitis herpetiformis (Duhring), již zmíněná osteoporóza, pak infertilita a poruchy menstruace a neuropsychické abnormality s polyneuropatií či ataxií a také deprese a poruchy chování. Autoimunitní choroby se vyskytují u celiaků 10–30krát častěji než u ostatní populace, pak mohou být příznaky překryty přidruženou chorobou. Rozpoznání celiakie a zahájení dietního opatření může zlepšit stav autoimunitní choroby. Podezřelé symptomy jsou anémie, úbytek tělesné hmotnosti a průjem (3 a více řídkých stolic denně). Jsou považovány za vysoce rizikové s doporučením vyšetřit biopticky [11].
Cíl studie
Cílem naší studie bylo ověřit předpoklad, že prevalence celiakie ve skupině pacientů léčených pro osteoporózu a osteopenii je vyšší než prevalence v běžné populaci 1 : 200–250 (0,4–0,5 %).
Metodika
Do studie byli zařazeni pacienti ze 2 osteologických pracovišť (Zlín a Ostrava – Osteologické centrum Mediekos Labor, a. s.). Zařazení pacienti již byli léčeni pro osteoporózu nebo osteopenii, nebo byli nově vyšetřeni denzitometricky s nově zavedenou léčbou. Screening byl prováděn od června roku 2006 do září roku 2009. Vyřazeni byli pacienti s již známou celiakií. Do studie byli zařazeni jen pacienti s verifikovanou osteoporózou a osteopenií denzitometricky dle kritérií WHO na denzitometru Lunar (GE). Pacienti podepsali informovaný souhlas o screeningu. Všem bylo provedeno sérologické vyšetření na tkáňovou transglutaminázu (AtTGA) ve třídě IgA metodou ELISA v laboratoři P&R Lab Nový Jičín. Laboratorní hodnoty tkáňové transglutaminázy v IgA i IgG mělo rozmezí negativní od 0,0 do 0,8 U/ml, pozitivní v rozmezí > 5 U/ml. Pro EMA stanované pomocí imunofluorescence bylo rozmezí negativní, hraniční, slabě pozitivní, pozitivní, silně pozitivní. Antigliadinové protilátky se hodnotily jako negativní v rozmezí 0–0,89, hraniční 0,9–1,0 a pozitivní > 1,0 IP (index pozitivity) [12]. Pacientům s pozitivitou protilátek AtTGA bylo navrženo endoskopické dovyšetření s odběrem biopsie z duodena pod vaterskou papilou (4–6 vzorků) [13]. Endoskopické vyšetření bylo prováděno jedním endoskopistou, a to na pracovišti gastroenterologické ambulance Mediekos Labor, a. s., Zlín a endoskopickém pracovišti Centra péče o zažívací trakt Vítkovické nemocnice, a. s., Ostrava. Bioptické vzorky byly hodnoceny na patologii Onkologického centra Nový Jičín a patologii Mediekos Labor, a. s., Zlín dle doporučené Marschovy klasifikace [14]. Metodika diagnostiky celiakie byla převzata ze směrnice Evropské společnosti pro pediatrickou gastroenterologii, hematologii a výživu (ESPGHAN), revidované v roce 1990 s následujícími kritérii:
- anamnéza a klinické příznaky kompatibilní s CS,
- pozitivní sérologické testování markerů na celiakii,
- biopsie – histologie s kompatibilním nálezem s CS,
- zřetelná klinická a sérologická odpověď na bezlepkovou dietu,
- vyloučení onemocnění s podobnými klinickými projevy,
- jde o probanda staršího 2 let [15].
Diagnostika OP je založena na hodnocení kostní minerální denzity (BMD) pomocí dvouenergiové absorpciometrie (DXA) s rozdělením do 3 skupin. Normální BMD: je definována jako T-skóre v rozsahu hodnot nižších než +2,5 a vyšších než –1,0 SD. Osteopenie: je definována jako T-skóre v rozmezí –1,0 až –2,5 SD včetně. Osteoporóza: je definována jako T-skóre nižší než –2,5 SD [3,4]. Pacienti sérologicky pozitivní byli vyšetřeni v gastroenterologické ambulanci Mediekos Labor, a. s., Zlín a Centra péče o zažívací trakt Vítkovické nemocnice Ostrava. Zde bylo provedeno klinické vyšetření dle protokolu se změřením hmotnosti, výšky, zhodnocením typických příznaků celiakie, atypických příznaků a asociovaných autoimunních chorob, byla odebrána anamnéza na medikaci steroidů a na toleranci mléka. Dále bylo provedeno genetické dovyšetření HLA DQ2 a DQ8 a genetika na laktózovou intoleranci LCT: C/T-13910 a G/A-22018. Pak bylo doplněno roztestování na endomysiální protilátky (EMA), protilátky proti gliadinu (AGA) a sérologie na potravinové alergie – mléko.
Výsledky
Sérologicky bylo na tkáňovou transglutaminázu (AtTGA) vyšetřeno celkem 2 245 pacientů s osteoporózou a osteopenií. Celkově bylo ve skupině sérologicky pozitivních na AtTGA 50 pacientů (2,2 %), z toho 5 pacientů odmítlo endoskopické dovyšetření a další 2 pacienti byli vyšetřeni v této době na celiakii s pozitivitou EMA při negativním AtTGA. Verifikováno histologicky bylo 45 screenovaných pacientů (2 %). Ve skupině jen s osteoporózou bylo sérologicky vyšetřeno 1 584 pacientů a pozitivních na AtTG bylo 34 pacientů (2,14 %), z toho 4 pacienti odmítli bioptické dovyšetření. Histologicky bylo tedy verifikováno ve skupině s osteoporózou celkem 30 pacientů (1,89 %). Ve skupině s osteopenií bylo sérologicky vyšetřeno 661 pacientů a pozitivních na AtTGA bylo celkem 16 (2,42 %) pacientů. Jedna pacientka odmítla endoskopické dovyšetření a u jedné pacientky byla verifikována celiakie dle EMA a histologie. Histologicky verifikováno bylo 15 pacientů (2,26 %). Dalších celkem 6 pacientů s celiakií, kteří byli histologicky verifikováni, nebylo do skupiny zařazeno, protože byli diagnostikováni mimo období screeningu a byli vyšetřeni pro rezistentní osteoporózu. Dalších 5 pacientů nesplnilo kritéria aktivní a atypické celiakie dle ESPGHAN – byli zařazeni do skupiny potenciální celiakie.
Charakteristika skupiny
Soubor pacientů s osteoporózou a osteopenií tvořilo 2 245 pacientů, z toho 2 128 (95 %) žen a 117 (5 %) mužů. Průměrný věk celkové skupiny pacientů s osteoporózou, osteopenií a celiakií byl 47 let. U skupiny s osteoporózou byl průměrný věk 54 let a s osteopenií 40 let. Nejmladší pacientka ve sledované skupině byla s Downovým syndromem a diagnostikovanou osteoporózou ve 12 letech. Nejstarší pacientce bylo 77 let, ale odmítla endoskopické dovyšetření pro špatnou mobilitu. Průměrný věk stanovení diagnózy celiakie v celé skupině byl 51 let, ve skupině s osteoporózou to bylo 57 let a ve skupině s osteopenií 40 let. Celkový poměr ženy/muži byl 46/6, ve skupině s osteoporózou 29/6 a ve skupině s osteopenií 17/0 (tab. 1).
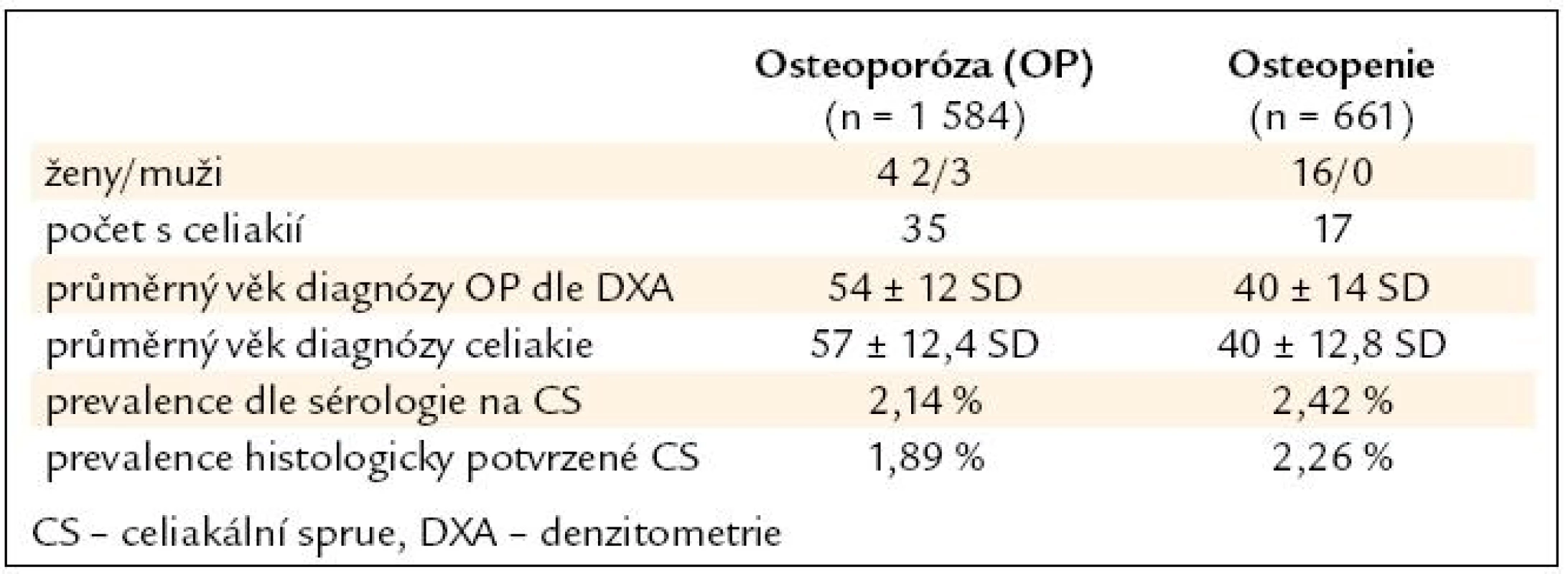
Pozitivita protilátek proti tkáňové transglutamináze ve třídě IgA metodou ELISA byla u 50 pacientů. Další 2 pacienti zařazení do souboru měli pozitivitu EMA a potvrzenou atrofii sliznice histologicky. Negativní EMA při jasné pozitivitě AtTGA bylo celkem 4krát. U 2 pacientů jsme prokázali selektivní imunodeficit IgA. Tito pacienti měli hraničně pozitivní AtTG ve skupině IgA, ale pozitivní sérologii AtTG ve skupině IgG (tab. 2).

Genetické vyšetření bylo provedeno u 47 pacientů. Potvrdili jsme převahu polymorfizmu HLA DQ2 v našem souboru, odpovídající literatuře. U jednoho pacienta byla genetika negativní, přesto měl vysokou pozitivitu titru AtTGA a potvrzenou atrofii sliznice histologicky. Genetické vyšetření na laktózovou intoleranci – LCT bylo vyšetřeno jen u 35 pacientů, z toho bylo pozitivních (homozygot a složený heterozygot) 27 (83 %) pacientů (tab. 3).
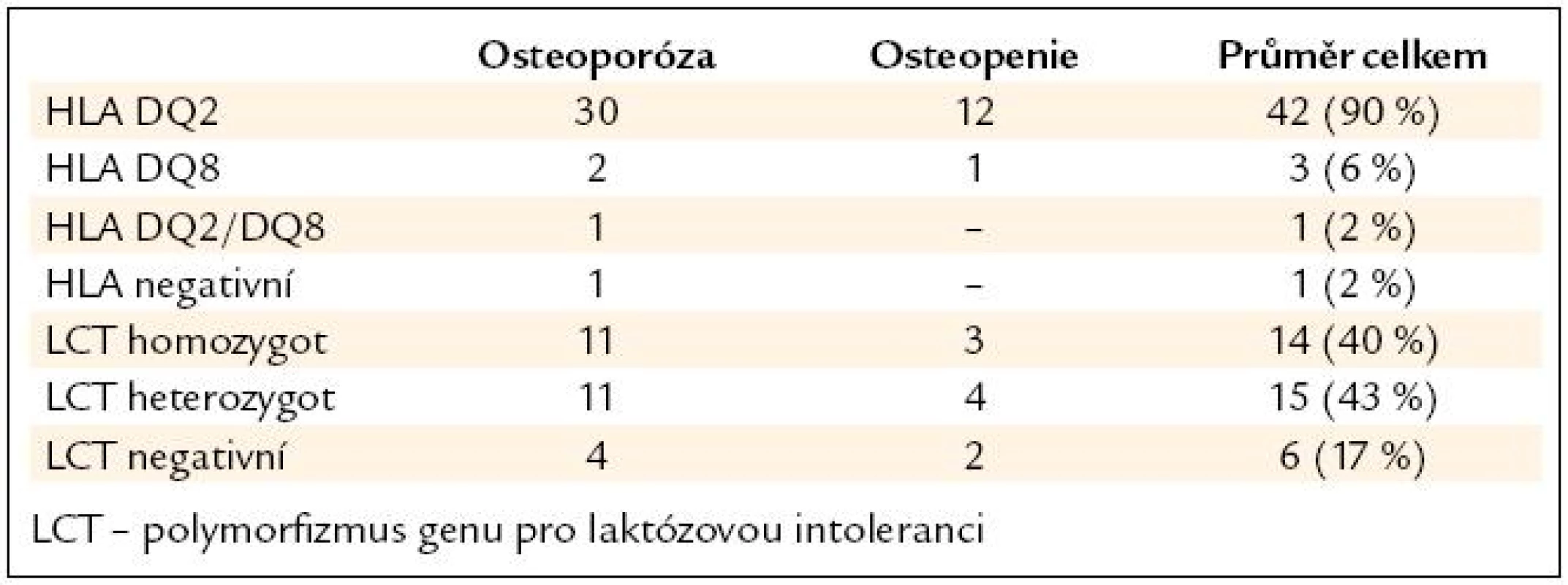
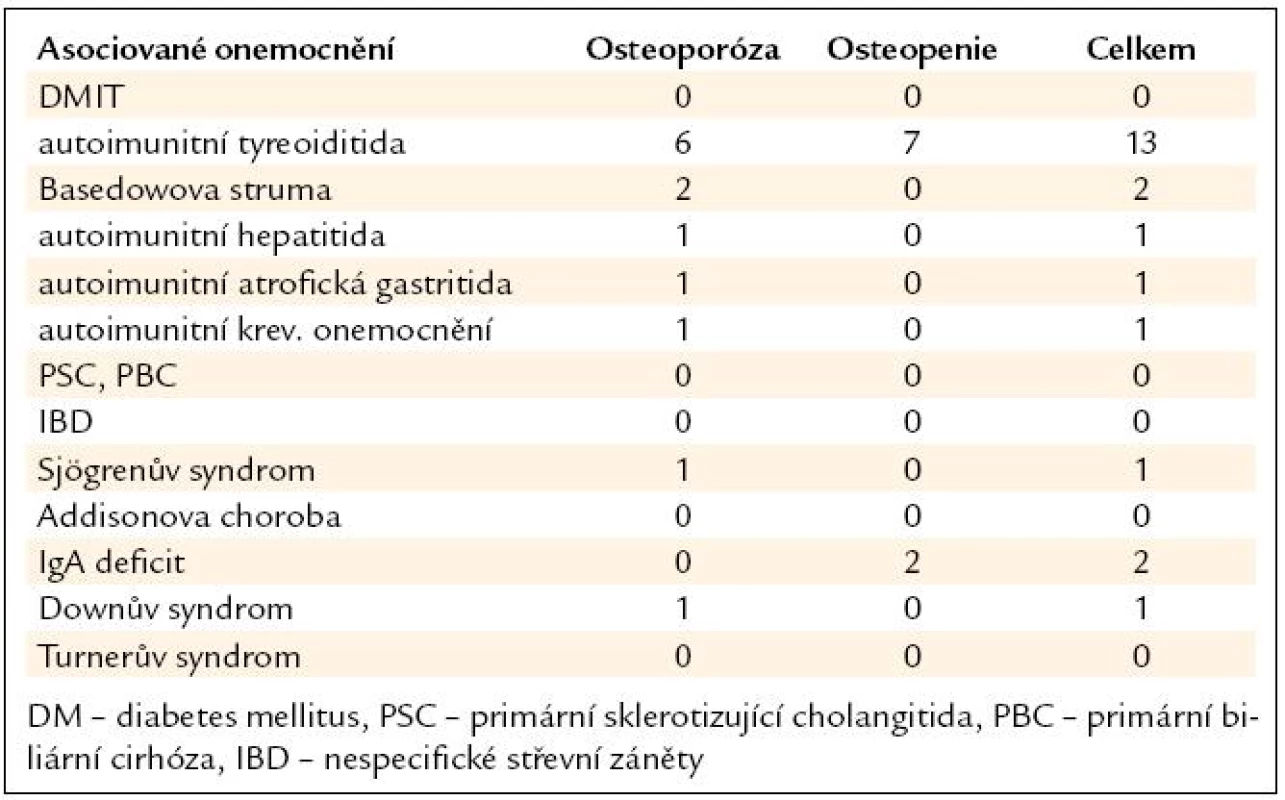
Z asociovaných chorob (tab. 4) byla nejčastější autoimunitní tyreoiditida u 13 pacientů (26 %). Další nejčetnější chorobou byla Basedowova hypertyreóza u 2 pacientů (4 %) a selektivní imunodeficit IgA u 2 pacientů (4 %).
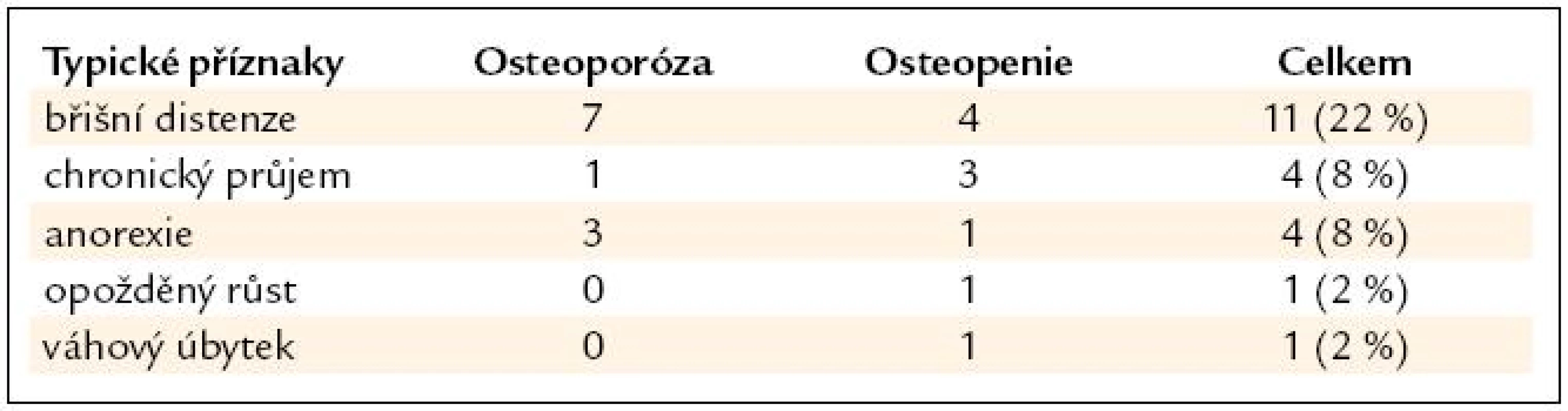
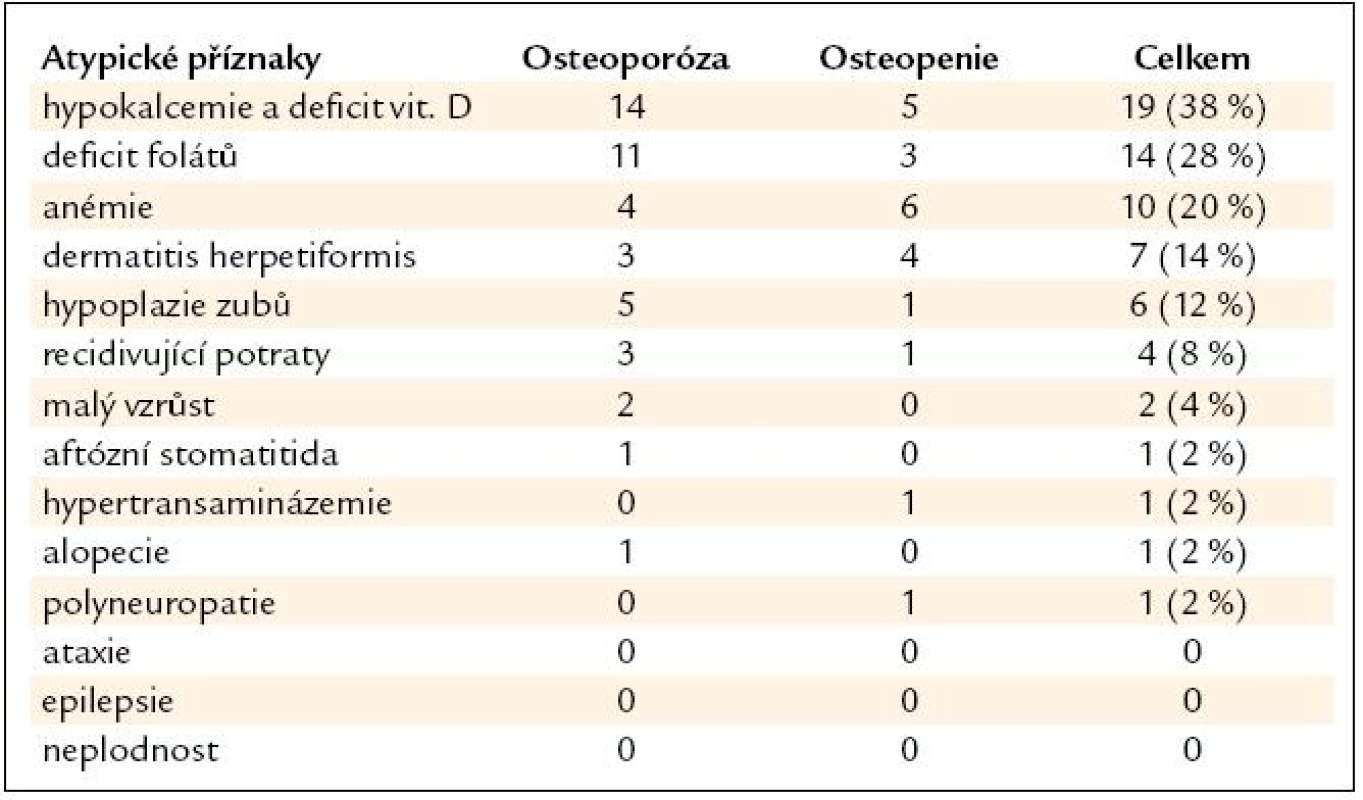
Z nejčastějších zažívacích příznaků v souboru byla břišní distenze u 13 osob (22 %). Z atypických (mimostřevních) příznaků byla nejčastější hypokalcemie a hypovitaminóza vitaminu D u 19 pacientů (38 %), pak hypovitaminóza kyseliny listové u 14 pacientů (28 %) a anémie u 10 osob (20 %) (tab. 5 a 6).
Diskuze
Panuje shoda v názoru, že bezlepková dieta u pacientů s celiakií a osteoporózou má jasný vliv na zvýšení BMD již po roce dodržování diety. Dosud vládla polemika o tom, zda ve skupině pacientů s osteoporózou má cenu provádět cílený screening na celiakii. Již práce Stensona [16] prokazuje prevalenci v této cílové skupině 3,4 %. K testování byla použita tkáňová transglutamináza a verifikace celiakie byla histologická. Doporučuje se kvantitativní stanovení protilátek proti tkáňové transglutamináze (AtTGA), které jsou vysoce senzitivní (90–98 %) i specifické (95–97 %). Vyšetření ELISA metodou je relativně levné a vhodné pro screeningové programy. Negativita prakticky vylučuje celiakii, pozitivní predikční hodnota je nižší než u EMA. Pozitivita AtTGA by měla být ověřena biopticky ze sliznice tenkého střeva. Falešně pozitivní mohou být AtTGA u chronických jaterních onemocnění a ledvinných onemocnění, monoklonální gamapatie a u další autoimunit. Antiendomysiální protilátky (EMA) vykazují senzitivitu 75–98 % a jsou vysoce specifické a patognomické v 97–100 %. Metoda je imunofluorescenční, vyšetření je dražší než AtTGA. Vyšetření je zatíženo individuální chybou, naproti tomu jsou i nízké hladiny EMA specifické pro celiakii. Antigliadinové protilátky (AGA) v obou třídách IgA i IgG mají široké rozmezí hodnot senzitivity i specificity a mohou být pozitivní u mnoha jiných onemocnění. Mají nízkou pozitivní predikční hodnotu. Proto se při screeningu již nepoužívají [12]. Je vhodné stanovit i celkovou hodnotu IgA, protože se v populaci celiaků vyskytuje současný selektivní deficit IgA ve 2–3 % [17], což jsme potvrdili i v našem souboru. Biopsie sliznice tenkého střeva je dalším krokem k potvrzení diagnózy celiakie. Provedená biopsie z oblasti aborálního duodena (pod Vaterovou papilou) z Kerkringových řas bioptickými kleštěmi s 4–5 vzorky. Provádí ji gastroenterolog při gastroskopii či enteroskopii u pacientů se sérologickou pozitivitou. Standardním zhodnocením histologického nálezu je grading histologických změn podle Marsche a Oberhubera [14,15], které popisují typ 0: normální; typ I: infiltrativní; typ II: hyperplastický; typ III: destruktivní a typ IV: s vyhlazenou sliznicí. Typ III a–c je charakteristický pro celiakii, se 3 podskupinami podle stupně atrofie klků. Všichni pacienti v souboru měli potvrzen typ III. Z odběrů na genetiku HLA DQ2/DQ2 jsme potvrdili dominantní roli HLADQ2 v našem souboru. Překvapením byl 1 pacient s negativní genetikou obou alel, přesto vysoce pozitivním nálezem v protilátkách AtTGA a atrofií sliznice duodena. Tento nález si nedovedeme vysvětlit. Je asi pravděpodobná i jiná predispozice k rozvoji celiakie v non HLA genech. Potvrdili jsme i vysokou asociaci s autoimunitními onemocněními, hlavně s autoimunitní tyreoiditidou (13 %), Basedowovou strumou a selektivním imunodeficitem ve 2 %. To rovněž potvrzuje literární údaje o vyšší prevalenci autoimunitních onemocnění s celiakií, kdy je vyšší 10–30krát. Klasická (typická) forma: má obraz plně rozvinuté celiakie s projevy malabsorpce, pozitivní sérologií (AtTG, EMA) i verifikovanou totální nebo subtotální atrofií sliznice v biopsii. Subklinická (atypická) forma: typické příznaky gastrointestinální chybí, v klinickém obraze převažují mimostřední (extraintestinální) projevy. Týká se hlavně osob s podezřelými symptomy a rizikovými chorobami. Histologicky se v biopsii nachází totální a subtotální atrofie a pozitivita sérologických testů (AtTG, EMA). Pacienti v souboru měli atypické (mimostřevní) příznaky celiakie, a to metabolickou kostní chorobu. S největší četností střevních projevů byla přítomna břišní distenze u 11 osob (22 %). Tyto příznaky lze lehce zaměnit za projevy dráždivého střeva. Silentní (němá): klinicky jsou pacienti asymptomatičtí, bývá pozitivní rodinná anamnéza. Histologicky v biopsii nacházíme totální nebo subtotální atrofii, sérologicky s pozitivitou testů (AtTG, EMA) [1,17]. U dalších 5 pacientů jsme potvrdili latentní a potenciální celiakii. Tito pacienti nebyli zařazeni do souboru. Latentní forma: klinicky jsou to asymptomatičtí pacienti, mají pozitivní sérologii (AtTG, EMA), ale histologicky z biopsie nacházíme jen zvýšený počet IEL (intraepiteliálních lymfocytů). Tento nález můžeme nalézt u pacientů na dietě nebo u časných stadií ne plně vyjádřené celiakie. Potenciální forma: klinicky pacienti asymptomatičtí, histologicky můžeme nalézt normální sliznici či typ I dle Marsche nebo také zvýšený počet IEL, sérologicky bez pozitivity protilátek, nebo jen pozitivní EMA. Tyto pacienty je vhodné sledovat s kontrolními sérologickými odběry po 1–2 letech, řadí se sem příbuzní pacientů s celiakií I. stupně nebo pacienti s asociovanými chorobami [14]. Podobně jsme potvrdili vysokou prevalenci herpetiformní dermatitidy ve sledovaném souboru (14 %). Dle výsledků průměrného věku rozvoje osteoporózy a osteopenie v souboru vyplývá, že se metabolické kostní postižení projevuje o 10–15 let dříve než v běžné postmenopauzální populaci. Pokud bychom zařadili do souboru i 6 pacientů diagnostikovaných mimo screening, zvýšila by se prevalence celiakie z 2,2 na 2,49 %. Problémem léčby osteoporózy u pacientů s celiakií je kombinace běžné léčby převážně postmenopauzální osteoporózy a sekundární osteoporózy způsobené celiakií. Tito pacienti, pokud není diagnostikována celiakie, nereagují na léčbu OP. Proto je včasná diagnostika celiakie se započetím bezlepkové diety kauzální v léčbě jak CS, tak OP [18]. Celoživotní bezlepková dieta je pilířem léčby CS. Dále je v dietě vhodné od počátku dostatečně doplňovat jak kalcium (1 000 mg/d), tak vitamin D v dávce až 1 600 IU/d [19]. Atrofie sliznice je také spojena se sekundární laktózovou intolerancí. V úvodu bezlepkové diety je proto vhodná kombinace s dietou na laktózovou intoleranci. Překvapením bylo potvrzení vysoké prevalence (83 %) primární laktózové intolerance ve skupině, což neodpovídá prevalenci v celkové populaci v ČR, která je udávána kolem 20 %. V České republice byl Fričem doporučen cílený screeningový program u rizikových skupin, rizikových chorob a podezřelých symptomů [2]. Doporučen byl dvoustupňový screening. V 1. etapě stanovení sérových protilátek proti tkáňové transglutamináze (AtTG) ve třídě IgA a celkové stanovení IgA. Pozitivní sérologie je indikací ke vstupu do 2. etapy screeningu, a to histologickému dovyšetření. Slabinou práce je, že nemáme kontrolní skupinu k posouzení celkové prevalence. Dále je v souboru převaha žen, což odpovídá poměru osteoporózy v populaci.
Závěry
Uvádíme výsledky první české studie zabývající se screeningem celiakie v populaci osteoporotických a osteopenických pacientů. Potvrdili jsme, že prevalence celiakie v této cílové skupině populace střední a severní Moravy je 2,2–2,49 %, oproti běžné populaci v ČR, kde je předpokládaná prevalence 0,4–0,5 %. Je tedy 4krát vyšší než v běžné populaci. Z toho usuzujeme, že screening v této populaci má smysl a měl by být zavedeno do běžné praxe, jak doporučuje Frič [2]. Tento screening je ekonomicky přijatelný, pacienti s potvrzenou celiakií mohou být kauzálně léčeni bezlepkovou dietou, která může zlepšit minerální kostní denzitu (BMD), sníží náklady léčby osteoporózy, zlepší kvalitu života a sníží následné komplikace v podobě zlomenin vertebrálních i zlomenin femuru.
MUDr. Petr Fojtík
www.nemvitkovice.cz
e-mail: petr.fojtik@nemvitkovice.cz
Doručeno do redakce: 3. 10. 2011
Sources
1. Green P, Cellier CH et al. Celiac Disease. N Engl J Med 2007; 357: 1731–1743.
2. Frič P, Nevoral J. Cílený screening celiakie. Interní Med 2009; 11: 484–487.
3. Vyskočil V. Osteoporóza a ostatní nejčastější metabolická onemocnění skeletu. Praha: Galén 2009: 1–14.
4. Broulík P. Osteoporóza a její léčba. Praha: Jessenius Maxdorf 2009: 9–21.
5. Bureš J. Metabolická kostní nemoc u chorob gastrointestinálního traktu. Postgrad Med 2009; 11: 76–78.
6. Gnauck R. World Health Organization criteria for screening. New York: Raven Press 1980: 175–180.
7. Vančíková Z, Chlumecký V, Sokol D et al. The serologic screening for celiac disease in the general population(Blood donors) and in some high- risk groups of adults (patients with autoimmune disease, osteoporosis and infertility) in the Czech Republic. Fol Microbiol 2002; 47: 753–758.
8. Kotalová R, Nevoral J, Valtrová V et al. Prevalence celiakie mezi rodiči a sourozenci dětí s celiakií. Čes Slov Pediat 2002; 57: 415–418.
9. Kolek A, Vospělová J, Hermanová Z et al. Celiac disease – incidence in children and adolescents in Moravia, Czech Republic. J Pediatr Gastroenterol Nutr 2003; 36: 506–507.
10. Goldberg D, Krasyak D, Fasano A et al. Screening for celiac disease in family members: is follow up testing necesary? Dig Dis Sci 2007; 52: 1082–1086.
11. Prokopová L. Celiakie – co má vědět ambulantní internista. Interní Med 2008; 10: 233–239.
12. Rostom A, Dubé C, Cranney A et al. The diagnostic accuracy of serologic tests for celiac disease: a systematic review. Gastroenterology 2005; 128 (Suppl 1): S38–S46.
13. Frič P. Endoskopická diagnostika celiakální sprue. Endoskopie 2002; 11: 69–73.
14. Marsh MN. Gluten major histocompatibillity complex and the small intestine: a moleculare and immunobiologic approach to the spectrum of gluten sensitivity (celiac sprue). Gastroenteology 1992; 102: 330–354.
15. Hill ID, Dirks MH, Liptak GS et al. North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. Guideline for the diagnosis and treatment of celiac disease in children recomendations of the North American Society for Pediatric Gastroenterology, Hepatology and Nutrition. J Pediatr Gastroenterol Nutr 2005; 40: 1–12.
16. Stenson WF, Newberry R, Lorenz R. Increase Prevalence of Celiac Disease and Need for Routine Screening among Patients With Osteoporosis. Arch Intern Med 2005; 165: 393–399.
17. Ferguson A, Arranz E, O’Mahoney S. Clinical and pathological spectrum of coeliac disease – active, silent, latent, potencial. Gut 1993; 34: 150–151.
18. Lewis NR, Scott BB. Guidelines for osteoporosis in inflammatory bowel disease and coeliac disease. BSG 2007. http://www.bsg.org.uk/clinical-guidelines/ibd/guidelines-for-osteoporosis-in-inflammatory-bowel-disease-and-coeliac-disease.html.
19. Nieves J. Osteoporosis: The role of micronutrients. Clinical Nutrion 2005; 81: 1232S–1239S.
Labels
Diabetology Endocrinology Internal medicineArticle was published in
Internal Medicine

2011 Issue 12
Most read in this issue
- Neuroendokrinné nádory horného tráviaceho traktu, charakteristika a porovnanie efektivity lokalizačnej diagnostiky
- Komplikácie endoskopickej retrográdnej cholangiopankreatikografie alebo ako ich znížiť na najmenšiu možnú mieru
- Aldosteron jako endogenní kardiovaskulární toxin a možnosti jeho terapeutického ovlivnění
- Potrebujeme ešte endoskopickú skleroterapiu pažerákových varixov alebo posledný nech zhasne svetlo
