-
Medical journals
- Career
Nedostatečný screening a malá informovanost o rizikových faktorech u příbuzných I. stupně nemocných s kolorektálním karcinomem
Authors: P. Vítek 1, 2; I. M. Kajzrlíková 2; J. Bureš 3; J. Chalupa 2
Authors‘ workplace: Lékařská fakulta Ostravské Univerzity v Ostravě, děkan doc. MUDr. Arnošt Martínek, CSc. 1; Beskydské Gastrocentrum, Interní oddělení, Nemocnice Frýdek-Místek, p. o., primář MUDr. Petr Vítek 2; II. interní klinika Lékařské fakulty UK a FN Hradec Králové, přednosta prof. MUDr. Jaroslav Malý, CSc. 3
Published in: Vnitř Lék 2011; 57(12): 1057-1061
Category: 70th birthday of prof. MUDr. Petr Dítě, DrSc.
Overview
Úvod:
Příbuzní I. stupně nemocných s kolorektálním karcinomem (KRK) mají vyšší riziko tohoto onemocnění, a proto je u nich indikováno kolonoskopické vyšetření v 40 letech. Cílem práce bylo posoudit jejich informovanost o riziku onemocnění, přítomnost dalších rizikových faktorů a jejich zapojení do screeningového programu.Soubor nemocných a metodika:
Soubor tvoří 62 nemocných po resekci KRK a 67 jejich příbuzných prvního stupně (42 % ze 160 oslovených). Ti vyplnili strukturovaný dotazník zaměřený na rizikové faktory KRK a zapojení do screeningu. Data byla statisticky zhodnocena.Výsledky:
O rizikových faktorech KRK a prevenci jeho vzniku bylo před diagnózou KRK dostatečně informováno pouze 18 % nemocných (11/62) a před dotazníkem 46 % příbuzných (31/67). Po diagnóze, respektive oslovení dotazníkem informovanost stoupla na 65 % nemocných (40/62, p < 0,001) a 66 % příbuzných (44/67, p = 0,024). Celkem 79 % příbuzných I. stupně (53/67) vědělo, že jejich příbuzenský vztah k nemocnému je spojen s vyšším rizikem KRK. Do screeningu KRK se v době obdržení dotazníku zapojilo 28 % příbuzných I. stupně (19/67). Nejčastější screeningovou metodou byl test na okultní krvacení ve stolici (TOKS) v 21 % případů (14/67), kolonoskopie byla provedena pouze u 7 % příbuzných (5/67). Průměrný věk zapojení do screeningového programu byl 53 let. 22 % příbuzných I. stupně (15/67) se do screeningového programu nehodlá zapojit ani v budoucnu.Závěry:
Informovanost nemocných po resekci KRK a jejich příbuzných I. stupně o rizikových faktorech vzniku KRK je poměrně nízká a významně stoupá až po diagnóze onemocnění (nemocní s KRK) nebo při aktivním oslovení formou dotazníku. Příbuzní I. stupně si jsou vědomi svého vyššího rizika onemocnění KRK, vyplývajícího z onemocnění jejich příbuzného, jejich sledování je však nedostatečné. Screening je prováděn pouze u malé části příbuzných, ve většině případů pak nevhodnými nástroji (TOKS) a rovněž v pozdějším věku, než je doporučeno. Téměř 1/4 příbuzných nemá ani v budoucnu zájem o žádnou formu screeningu KRK bez ohledu na své osobní riziko.Klíčová slova:
kolorektální karcinom – screening – rizikové faktory – rodinná anamnézaÚvod
Kolorektální karcinom (KRK) je nejčastějším dědičně se vyskytujícím nádorovým onemocněním. Nemocní s rodinnou anamnézou příbuzného s diagnózou KRK nebo pokročilého adenomu před 60. rokem věku mají 2krát vyšší riziko onemocnění než běžná populace [1]. Výše rizika přímo souvisí s počtem členů rodiny s KRK a jejich věkem v době diagnózy. Dle metaanalýzy Johnse je riziko více než 2krát vyšší pro příbuzného I. stupně s KRK, více než 4krát vyšší pro více příbuzných a asi 4krát vyšší pro příbuzného s věkem pod 45 let v době diagnózy KRK. Nemocní s příbuzným s pokročilým adenomem pak mají rovněž dvojnásobné riziko KRK oproti průměrné populaci [2]. Na rozdíl od definovaných syndromů se zvýšeným rizikem kolorektálního karcinomu (familiární adenomatózní polypóza, Lynchův syndrom) není v současném celopopulačním screeningu KRK v ČR pro příbuzné I. stupně (PPS) vyhrazen zvláštní screeningový protokol [3,4].
Máme již dostatek důkazů pro tvrzení, že preventivní kolonoskopické vyšetření přímých rodinných příslušníků je součástí správné klinické praxe. Právě mezi příbuznými nemocných s kolorektálním karcinomem bychom měli o implementaci screeningových metod co nejvíce usilovat. Přestože se jedná o zdánlivě jednoduché opatření, klinická realita je velmi často odlišná.
Vznik kolorektálního karcinomu je ovšem také vždy výsledkem interakce genomu pacienta a rizikových faktorů jeho životního stylu. Pozitivní změny životního stylu občanů jsou celospolečensky žádoucí a jejich ovlivnění je do značné míry mimo možnosti zdravotnických pracovníků. Je však pravděpodobné, že u pacientů se zvýšeným rizikem je jejich klinický význam větší než u zbytku populace, a pokus o jejich ovlivnění by proto měl být součástí preventivně léčebné intervence.
Cílem naší práce bylo posoudit a srovnat výskyt rizikových faktorů KRK a jejich znalost u nemocných po resekci KRK a jejich příbuzných I. stupně. Současně jsme se zaměřili na zhodnocení současného stavu screeningu KRK u příbuzných I. stupně nemocných s KRK a jejich ochoty zapojit se do tohoto screeningu v budoucnu.
Soubor nemocných a metodika
Zkoumaný soubor sestává z 2 samostatných částí: nemocní po resekci KRK a jejich příbuzní I. stupně (PPS).
Nemocní po resekci KRK: soubor tvoří celkem 62 nemocných po resekci KRK, kteří byli v rámci dispenzárního sledování odesláni v období od října roku 2005 do července roku 2007 ke kolonoskopickému vyšetření na endoskopické pracoviště Beskydského gastrocentra Nemocnice ve Frýdku-Místku. Se všemi nemocnými byl vypracován rodokmen a vyplněn dotazník se zaměřením na diagnózu KRK, rizika KRK a jejich znalost. Všem nemocným byly vydány dotazníky pro všechny jejich příbuzné I. stupně (PPS) k předání uvnitř rodiny. Celkem tak bylo vydáno 160 dotazníků (53 pro sourozence, 107 pro děti). Všichni nemocní po resekci KRK souhlasili s doručením dotazníků svým PPS, nejvíce bylo vydáno celkem 6 dotazníků u 2 nemocných po resekci KRK. Dotazníky byly kromě rizik KRK zaměřeny i na dosavadní screening KRK u PPS. Dotazníky pro PPS byly vydávány s průvodním vysvětlujícím dopisem a názorným návodem k vyplnění. K dotazníkům byla přiložena obálka s předepsanou zpětnou adresou pracoviště a nalepenou platnou známkou.
Příbuzní I. stupně (PPS): soubor tvoří celkem 67 PPS (26 sourozenců, 41 potomků) nemocných po resekci KRK, kteří vyplnili příslušný dotazník a odeslali jej poštou k vyhodnocení.
Oba soubory byly posouzeny metodami deskriptivní statistiky a k posouzení významnosti rozdílů mezi skupinami byly použity χ2 test a oboustranný Fischerův exaktní test. Analýzy byly provedeny s pomocí programů SPSS verze 19 a Statistica verze 9.
Výsledky
Z oslovených pacientů po resekci KRK dotazník vyplnilo všech 62 nemocných. U příbuzných I. stupně dotazník vyplnilo celkem 42 % oslovených (67/160). Compliance s vyplněním dotazníku byla u sourozenců (49 %, 26 z 53 oslovených) mírně vyšší než u potomků (38 %, 41 ze 107 oslovených). Základní charakteristika obou souborů je uvedena v tab. 1.
Table 1. Základní charakteristika souboru nemocných po resekci KRK a jejich PPS. 
O rizikových faktorech KRK a prevenci jeho vzniku bylo před diagnózou KRK dostatečně informováno pouze 18 % nemocných (11/62). V pooperačním období ještě před zařazením do studie informovanost nemocných stoupla na 65 % (40/62), což je statisticky významné (χ2 p < 0,001). Celkem 12 pacientů (19,4 %) mělo v rodině pokrevního příbuzného s KRK (11 jed-noho, 1 dva). Dle provedeného rodokmenu nesplňoval žádný nemocný diagnostická kritéria Lynchova syndromu (Amsterdam II). Z nehereditárních rizikových faktorů byl u nemocných po resekci KRK přítomen diabetes mellitus u 19 nemocných (31 %), idiopatický střevní zánět u 3 (5 %, 1krát Crohnova choroba, 2krát ulcerózní kolitida). 50 % aktivních kuřáků přestalo kouřit po operaci, 26 % nemocných provedlo pozitivní změny diety (zvýšení množství ovoce a zeleniny, vlákniny, redukce červeného masa). Pohybová aktivita po operaci byla zvýšená proti období před diagnózou u 10 (16 %) nemocných, ke snížení po operaci naopak došlo u 29 (47 %) nemocných. 23 (37 %) nemocných pak udalo pohybovou aktivitu před operací i po ní stejnou. Nemocní užívali kyselinu acetylsalicylovou v 23 případech (37 %) a nesteroidní antirevmatika v 20 případech (32 %).
Výsledky srovnání vybraných parametrů životního stylu nemocných po resekci KRK a jejich příbuzných I. stupně jsou uvedeny v tab. 2. V tab. 3 a 4 je pak uvedeno samostatné srovnání s příbuznými I. stupně – sourozenci a příbuznými I. stupně – potomky.
Table 2. Srovnání skupiny nemocných po resekci KRK a skupiny PPS. 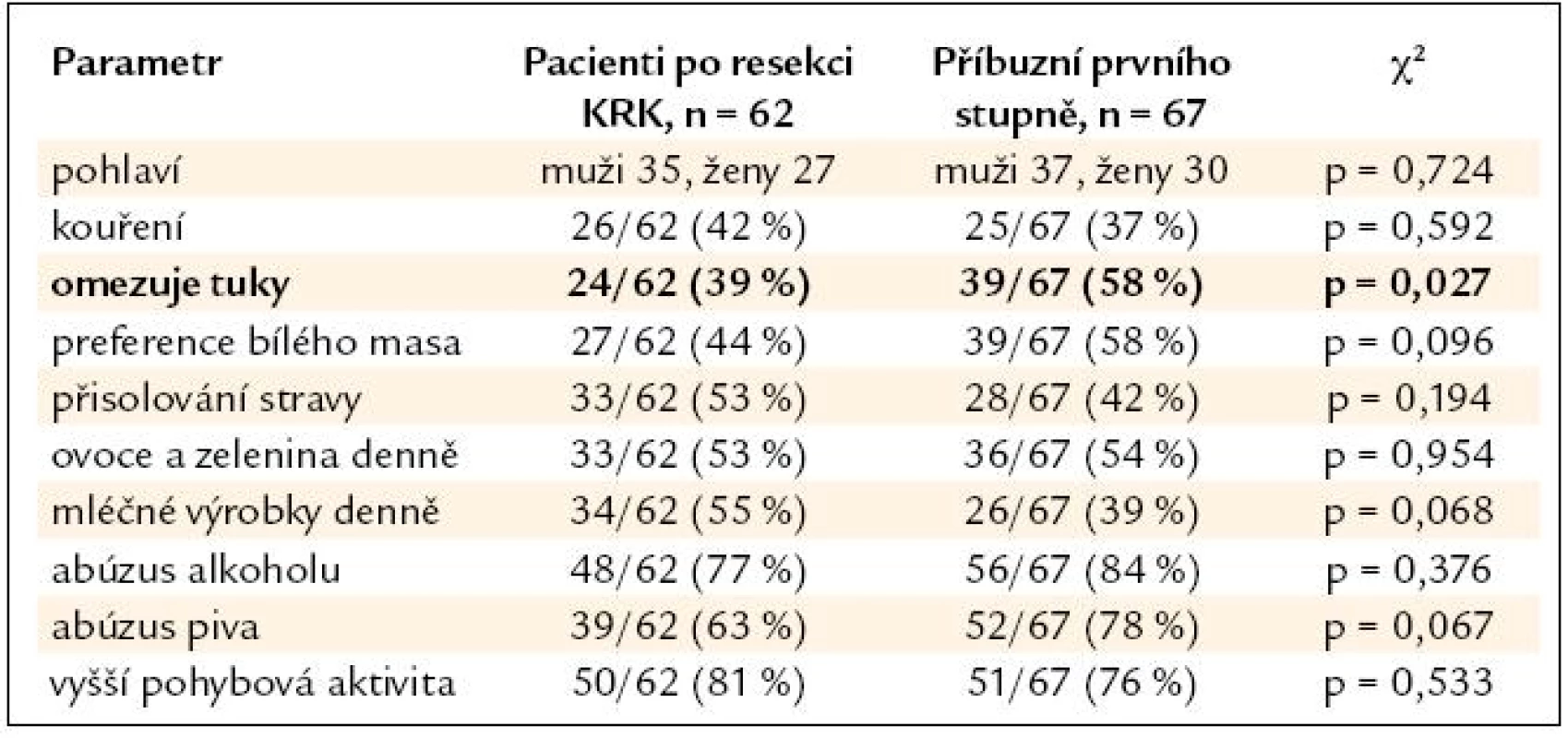
Table 3. Srovnání skupiny nemocných po resekci KRK a podskupiny PPS – sourozenců. 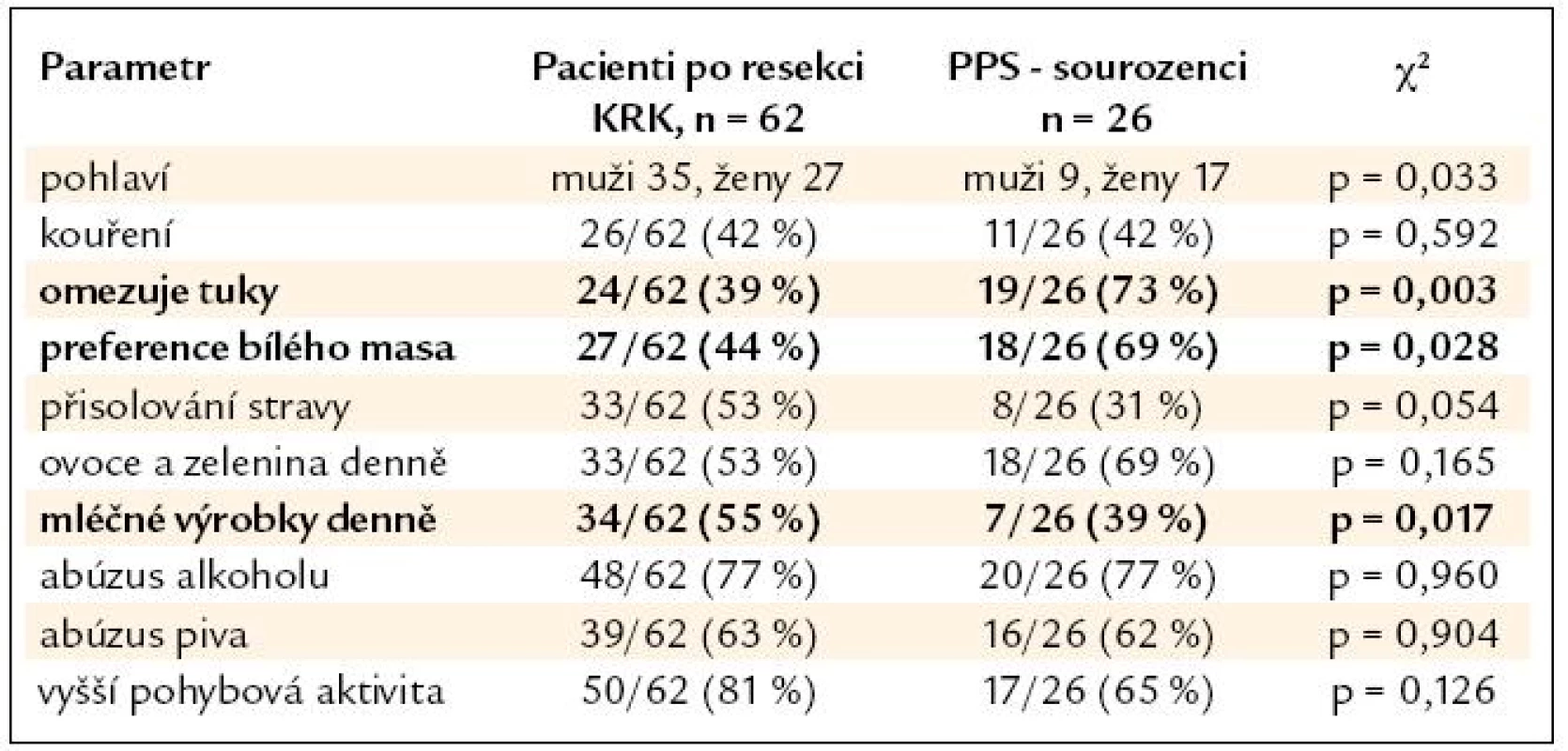
Table 4. Srovnání skupiny nemocných po resekci KRK a podskupiny PPS – potomků. 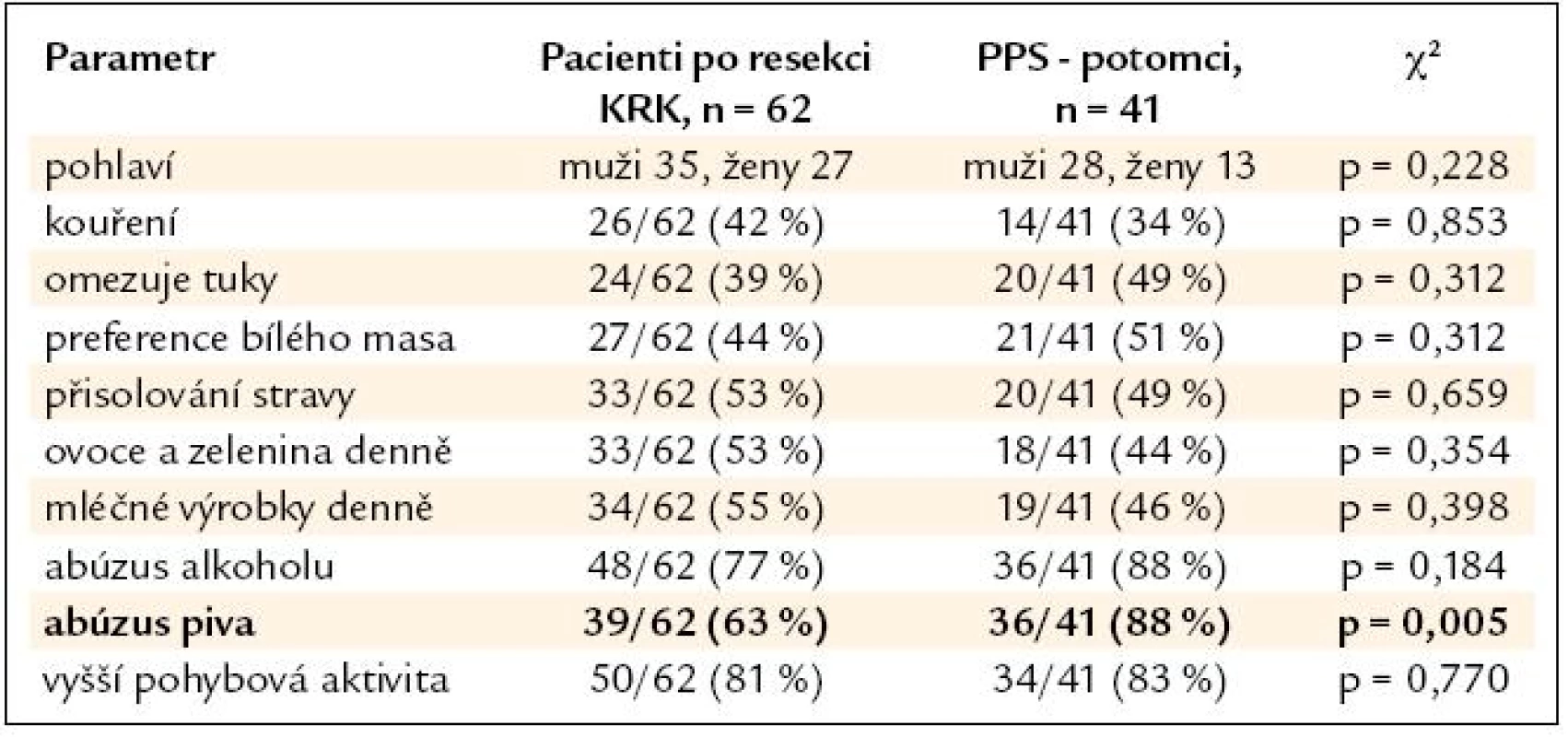
Celkem 79 % PPS (53/67) vědělo, že jejich příbuzenský vztah k nemocnému je spojen s vyšším rizikem kolorektálního karcinomu. O rizikových faktorech KRK a prevenci jeho vzniku bylo před obdržením dotazníku dostatečně informováno 46 % PPS (31/67). Po přečtení průvodního dopisu a vyplnění dotazníku informovanost stoupla na 66 % (44/67), což je statisticky významné (χ2 p = 0,024). Do screeningu KRK se v době obdržení dotazníku již zapojilo 19 PPS (28 %). Průměrný věk zapojení do screeningového programu byl 53 let (minimální 18, maximální 73, SD ± 13,05). Metody použité ve screeningu a posouzení podskupiny ve věku nad 40 let jsou uvedeny v tab. 5.
Table 5. Použité metody screeningu u PPS. 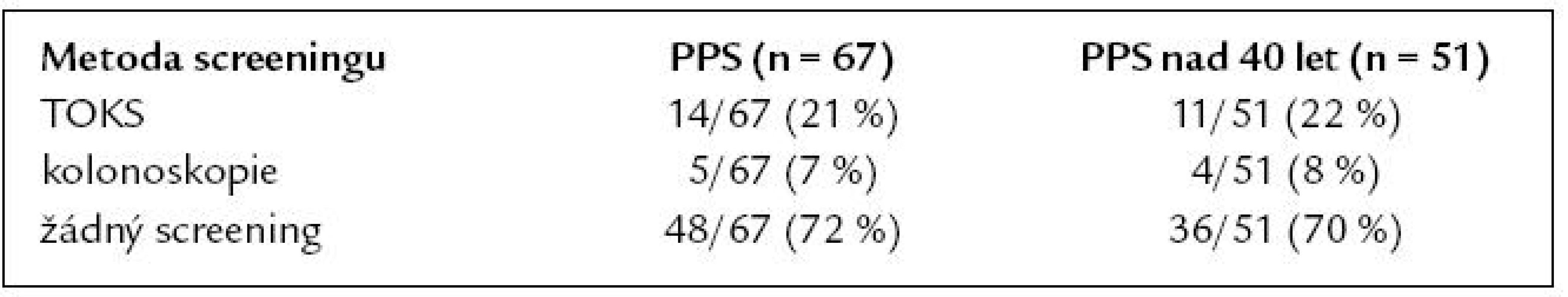
Na základě informací z dotazníku a průvodního dopisu uvedlo dalších 33 (49 %) PPS, že se aktivně zapojí do screeningového programu. Zbývajících 15 PPS (23 %) se do screeningového programu nehodlá zapojit ani v budoucnu. Postoje ke screeningu u všech PPS a u PPS nad 40 let jsou uvedeny v tab. 6. Při porovnání podskupin PPS dle věkové hranice 40 a 50 let nebyl prokázán statisticky významný rozdíl v compliance se screeningem mezi mladšími a staršími PPS (pro věkovou hranici 40 let p = 0,743 – oboustranný Fisherův exaktní test, pro věkovou hranici 50 let p = 0,664 – χ2).
Table 6. Compliance PPS se screeningem KRK. 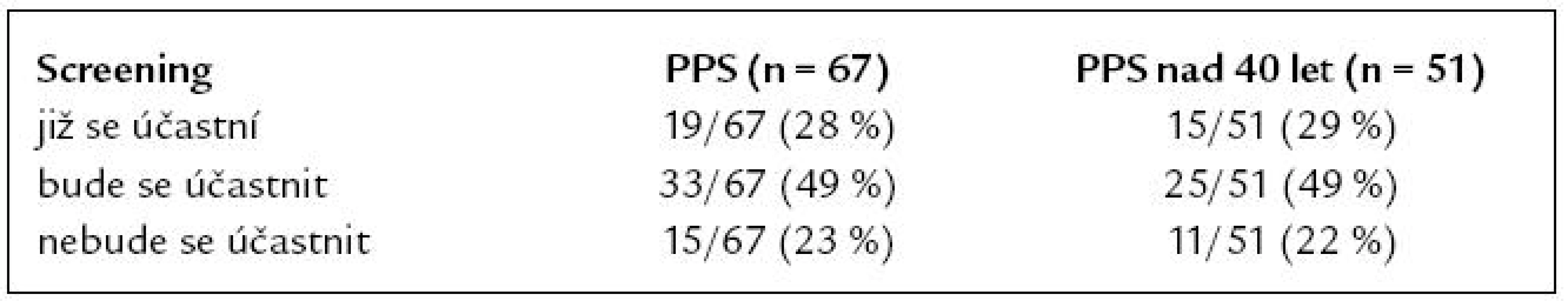
Diskuze
Rodinná anamnéza je kromě věku nejvýznamnějším a současně jedním z nejběžnějších rizikových faktorů KRK. Odhaduje se, že asi 10 % populace má v rodině přímého příbuzného s KRK, a tedy nejméně 2–3násobně vyšší riziko KRK [2,5]. Je prokázáno, že u příbuzných nemocných s KRK je vnímání rizika KRK zvýšeno, tato skutečnost platí především pro ženy [6]. V naší studii tuto skutečnost potvrzujeme. Zvýšeného rizika vyplývajícího z rodinné anamnézy si bylo vědomo 79 % PPS, což představuje téměř dvojnásobek respondentů při srovnání s všeobecnou populací v ČR (44 % zná familiární riziko) [7]. Odlišná je ovšem situace v případě ostatních nehereditárních rizikových faktorů KRK. Nemocní s KRK v dotazníku udávali poznání nehereditárních rizik KRK až v souvislosti s diagnózou onemocnění, PPS pak potvrdili významné zlepšení informovanosti až v souvislosti s oslovením prostřednictvím studie.
V nehereditárních rizikových faktorech se skupiny nemocných po resekci KRK a jejich příbuzných I. stupně významně lišily pouze u sourozenců, jejichž odpovědi naznačují významný posun k zdravějšímu životnímu stylu (nižší příjem tuků, preference bílého masa), u potomků byl naopak zjištěn významně vyšší abúzus piva. Nemocní po resekci KRK a jejich PPS se významně nelišili v BMI (průměr v pásmu nadváhy v obou skupinách) ani v zastoupení kuřáků (více než 1/3 v obou skupinách). Je tedy pravděpodobné, že kromě sdílení familiárního rizika se na celkovém riziku onemocnění KRK u PPS významně podílí i sdílení rizikových faktorů životního stylu uvnitř jednotlivých rodin. Přínos intervence životního stylu je pravděpodobný u zdravých PPS, kdy můžeme předpokládat minimalizaci nehereditárního rizika. Intervence životního stylu je ovšem doporučena American Cancer Society i u nemocných po resekci KRK během léčby a v následujícím období dispenzarizace. Vyšší fyzická aktivita a nepřítomnost obezity jsou u nemocných s KRK spojeny s delším přežitím [8]. Dle Meyehardtovy studie z roku 2007 bylo přežití nemocných po resekci KRK ve stadiu III významně negativně asociováno s přetrvávajícím dodržováním tzv. „západní“ diety [9]. V našem souboru nemocných po resekci KRK provedlo pozitivní změny diety po operaci 26 % pacientů, u 47 % nemocných však po operaci došlo ke snížení pohybové aktivity. Užívání kyseliny acetylsalicylové ani nesteroidních antirevmatik není u nemocných po resekci KRK ani jejich PPS z indikace prevence KRK doporučeno. Potenciální přínos převyšují rizika dlouhodobé terapie [10]. V našem souboru užívala tyto léky 1/3 nemocných, vždy z jiné (kardiovaskulární) indikace.
U PPS je doporučeno zahájit kolonoskopický screening již ve 40 letech nebo 10 let před věkem diagnostikovaného nemocného v rodině [11]. Mladší věk je doporučen proto, že riziko KRK u PPS ve 40 letech je zhruba stejné jako riziko KRK u populace s průměrným rizikem v 50 letech věku [5]. V případě negativního nálezu při kolonoskopickém vyšetření je u asymptomatického nemocného doporučena další kolonoskopie v 5letém intervalu. Studie prokázaly až dvojnásobnou prevalenci adenomů u PPS ve věku 50 let proti populaci s průměrným rizikem (27–39 % vs 13–26 %) [12,13]. Menges ve své studii v roce 2006 prokázal významně vyšší prevalenci adenomů u PPS již ve věku 40–50 let při porovnání s běžnou populací (18,9 % vs 8,2 %, p = 0,001). Byla rovněž prokázána tendence k proximální lokalizaci neoplazií u PPS, kdy 52 % neoplastických lézí bylo lokalizováno proximálně od sigmoidea [14]. U PPS proto nelze použít sigmoideoskopii jako akceptovatelnou metodu screeningu. U PPS je dále prokázán až 4krát rychlejší růst adenomů [15], což ospravedlňuje kratší screeningové intervaly.
Některou z forem screeningu absolvovalo v naší studii pouze 30 % PPS, kterým bylo v době vyplnění dotazníku 40 a více let (15/51). Převažoval screening formou testu na okultní krvácení do stolice (TOKS) u 11 PPS, pouze u 4 PPS byla použita kolonoskopie jako správná screeningová metoda. Jako adekvátní můžeme tedy hodnotit sledování PPS pouze v 8 % případů (4/51). Jako nevhodné se rovněž jeví pozdní načasování screeningu, průměrný věk nemocných v době vstupu do screeningového programu byl 53 let, tedy o 13 let vyšší, než je doporučeno. U PPS nemocných s KRK je prokázána téměř dvojnásobná compliance se screeningem KRK proti běžné populaci [16]. V našem souboru rozhodnutí zúčastnit se screeningu projevilo 78 % PPS (52/67). Zajímavou skutečností je, že zbývajících 22 % PPS se nehodlá screeningu v budoucnu účastnit, bez ohledu na znalost svého zvýšeného rizika. V tomto negativním stanovisku nebyl významný rozdíl mezi mladšími a staršími PPS.
Zjevným limitem validity získaných epidemiologických informací od PPS je nízká návratnost dotazníků. Zatímco nemocní po resekci KRK souhlasili s poskytnutím odpovědí při osobní intervenci ve 100 % případů, jejich PPS odeslali vyplněný dotazník pouze v 42 % (67/160). Hlavatý et al ve své práci s PPS z roku 2006 dosáhli návratnosti pouze 17,3 % [17]. Určitou bariérou intervence uvnitř rodiny může být předávání dotazníků a informací prostřednictvím nemocného s KRK, který se obvykle spíše zaměřuje na řešení vlastního zdravotního stavu. V naší studii předání dotazníků všem PPS deklarovalo 100 % nemocných po resekci KRK. Pokud jsme zpětně analyzovali návratnost dotazníků pouze z rodin, kde jsme obdrželi odpověď alespoň jednoho PPS, tak byla významně vyšší (66 %). Je tedy možné, že někteří nemocní s KRK dotazníky svým příbuzným vůbec nepředali. Na základě těchto výsledků se přikláníme k přímému oslovení PPS, např. prostřednictvím telefonického rozhovoru [18]. Na základě výsledků této studie byl v Beskydském Gastrocentru, Interním oddělení Nemocnice ve Frýdku-Místku v 2. pololetí roku 2008 zahájen prospektivní projekt JAKO JEDNA RODINA, zaměřený na aktivní přímé telefonické oslovení všech PPS nemocných s KRK a nemocných s pokročilým adenomem [18]. Cílem projektu je kromě adekvátního screeningu a komplexní intervence životního stylu nemocných i jejich příbuzných také identifikace části PPS, kteří mohou mít z dispenzárního programu největší benefit.
Závěry
- Informovanost nemocných po resekci KRK a jejich příbuzných I. stupně o rizikových faktorech vzniku KRK je poměrně nízká a významně stoupá až po diagnóze onemocnění (nemocní s KRK) nebo při aktivním oslovení formou dotazníku (příbuzní I. stupně).
- Sourozenci nemocných s KRK ve své stravě významně více omezují tuky, preferují bílé maso a přijímají méně mléčných výrobků při srovnání se stravovacími zvyky nemocných s KRK. U potomků nemocných s KRK je pak významně více zastoupen abúzus piva. V ostatních sledovaných parametrech se skupiny nemocných a jejich příbuzných I. stupně významně nelišily, u obou skupin je vysoká prevalence nadváhy a kouření. Zjištěná data podtrhují nutnost komplexní intervence životního stylu v rámci celé rodiny nemocného s KRK, tedy včetně jeho příbuzných I. stupně.
- Příbuzní I. stupně si jsou vědomi svého vyššího rizika onemocnění KRK, vyplývajícího z onemocnění jejich příbuzného. Jejich sledování je však nedostatečné. Screening je prováděn pouze u malé části příbuzných, ve většině případů pak nevhodnými nástroji (test na okultní krvácení do stolice – TOKS) a rovněž v pozdějším věku, než je doporučeno. Téměř 1/4 příbuzných nemá ani v budoucnu zájem o žádnou formu screeningu KRK bez ohledu na své osobní riziko.
MUDr. Petr Vítek
www.kolonoskopie.cz
e-mail: vitek@kolonoskopie.cz
Doručeno do redakce: 29. 9. 2011
Sources
1. Routine aspirin or nonsteroidal anti-inflammatory drugs for the primary prevention of colorectal cancer: U.S. Preventive Services Task Force recommendation statement. Ann Intern Med 2007; 146 : 361–364.
2. Almendingen K, Hofstad B, Vatn MH. Does a family history of cancer increase the risk of occurrence, growth, and recurrence of colorectal adenomas? Gut 2003; 52 : 747–751.
3. Burt RW. Impact of family history on screening and surveillance. Gastrointest Endosc 1999; 49: S41–S44.
4. Doyle C, Kushi LH, Byers T et al. 2006 Nutrition, Physical Activity and Cancer Survivorship Advisory Committee; American Cancer Society. Nutrition and physical activity during and after cancer treatment: an American Cancer Society guide for informed choices. CA Cancer J Clin 2006; 56 : 323–353.
5. Guillem JG, Forde KA, Treat MR et al. Colonoscopic screening for neoplasms in asymptomatic first-degree relatives of colon cancer patients. A controlled, prospective study. Dis Colon Rectu 1992; 35 : 523–529.
6. Hlavatý T, Lukáč L, Huorka M et al. Rodinný výskyt kolorektálnych karcinómov a ich skríning medzi prvostupňovými príbuznými pacientov s rakovinou hrubého čreva a konečníka. Čes a Slov Gastroent a Hepatol 2005; 59 : 285–292.
7. Johns LE, Houlston RS. A systematic review and meta-analysis of familial colorectal cancer risk. Am J Gastroenterol 2001; 96 : 2992–3003.
8. Kajzrlikova I, Vitek P, Chalupa J et al. Direct counselling program for first-degree relatives of colorectal cancer and advanced adenoma patients is effective. Gut 2009; 58 (Suppl II): A144.
9. Menges M, Fischinger J, Gärtner B et al. Screening colonoscopy in 40 - to 50-year-old first-degree relatives of patients with colorectal cancer is efficient: a controlled multicentre study. Int J Colorectal Dis 2006; 21 : 301–307.
10. Meyerhardt JA, Niedzwiecki D, Hollis D et al. Association of dietary patterns with cancer recurrence and survival in patients with stage III colon cancer. JAMA 2007; 298 : 754–764.
11. Montgomery GH, Erblich J, DiLorenzo T et al. Family and friends with disease: their impact on perceived risk. Prev Med 2003; 37 : 242–249.
12. Pariente A, Milan C, Lafon J et al. Colonoscopic screening in first-degree relatives of patients with „sporadic“ colorectal cancer: a case-control study. The Association Nationale des Gastroenterologues des Hôpitaux and Registre Bourguignon des Cancers Digestifs (INSERM CRI 9505). Gastroenterology 1998; 115 : 7–12.
13. Rex DK, Johnson DA, Anderson JC et al. American College of Gastroenterology. American College of Gastroenterology guidelines for colorectal cancer screening 2009. Am J Gastroenterol 2009; 104 : 739–750.
14. Thrasher JF, Cummings KM, Michalek AM et al. Colorectal cancer screening among individuals with and without a family history. J Public Health Manag Pract 2002; 8 : 1–9.
15. UEGF Public Awareness of Colorectal Cancer in Europe. A Summary Report Prepared for the UEGF Public Affairs Committee by IPSOS Research 2003.
16. Winawer SJ, Zauber AG, Gerdes H et al. Risk of colorectal cancer in the families of patients with adenomatous polyps. National Polyp Study Workgroup. N Engl J Med 1996; 334 : 82–87.
17. Zavoral M. The screening of sporadic colorectal cancer. Vnitř Lék 2004; 50 (Suppl 1): S103–S106.
18. Zavoral M, Suchanek S, Majek O et al. Population screening of colorectal carcinoma in the Czech Republic. Rozhl Chir 2009; 88 : 292–294.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2011 Issue 12-
All articles in this issue
- Potrebujeme ešte endoskopickú skleroterapiu pažerákových varixov alebo posledný nech zhasne svetlo
- Epidemiologie Helicobacter pylori
- Screening celiakie u pacientů s osteoporózou a osteopenií
- Očekávaná zátěž nádory jícnu, žaludku a kolorekta ve světě
- Aldosteron jako endogenní kardiovaskulární toxin a možnosti jeho terapeutického ovlivnění
- Neuroendokrinné nádory horného tráviaceho traktu, charakteristika a porovnanie efektivity lokalizačnej diagnostiky
- Keratinové fragmenty jako sérologický ukazatel u nemocných s jaterní chorobou
- Existuje racionální terapie Crohnovy nemoci a ulcerózní kolitidy?
- Ablatívna liečba rektosigmoideálnych prekanceróz a včasných karcinómov
- Přežívání nemocných po TIPS ve Fakultní nemocnici Hradec Králové
- Souběžný výskyt alkoholické jaterní cirhózy a chronické pankreatitidy
- Komplikácie endoskopickej retrográdnej cholangiopankreatikografie alebo ako ich znížiť na najmenšiu možnú mieru
- Nedostatečný screening a malá informovanost o rizikových faktorech u příbuzných I. stupně nemocných s kolorektálním karcinomem
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neuroendokrinné nádory horného tráviaceho traktu, charakteristika a porovnanie efektivity lokalizačnej diagnostiky
- Komplikácie endoskopickej retrográdnej cholangiopankreatikografie alebo ako ich znížiť na najmenšiu možnú mieru
- Aldosteron jako endogenní kardiovaskulární toxin a možnosti jeho terapeutického ovlivnění
- Potrebujeme ešte endoskopickú skleroterapiu pažerákových varixov alebo posledný nech zhasne svetlo
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

