-
Medical journals
- Career
Transplantace jater a perioperační změny renálních funkcí
Authors: E. Kieslichová 1; O. Schück 2; I. Smrčková 3; J. Granátová 5; J. Skibová 1; D. Merta 1; P. Trunečka 4
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzivní péče IKEM Praha, přednostka MU Dr. Eva Kieslichová 1; Klinika nefrologie IKEM Praha, přednosta prof. MU Dr. Ondřej Viklický, CSc. 2; Oddělení klinické biochemie IKEM Praha, přednosta prof. MU Dr. Antonín Jabor, CSc. 3; Transplantcentrum IKEM Praha, přednosta prim. MU Dr. Pavel Trunečka, CSc. 4; Oddělení klinické biochemie Fakultní Thomayerovy nemocnice Praha, prim. MU Dr. Zora Hamrlová 5
Published in: Vnitř Lék 2009; 55(12): 1126-1134
Category: Original Contributions
Overview
Cílem studie byla analýza perioperačních změn renálních funkcí při ortotopické transplantaci jater (OTJ) a identifikace rizikových faktorů pro potřebu náhrady funkce ledvin (RRT) v 1. týdnu po OTJ. Metodika: Do prospektivní studie bylo zařazeno 50 konsekutivních pacientů, kteří podstoupili OTJ. Před operací, po reperfuzi, na konci operace a 12 hod po ní byly sledovány vybrané laboratorní a klinické parametry. První týden po OTJ byla sledována četnost zavedení RRT pro akutní poškození ledvin a analyzovány rizikové faktory pro potřebu RRT. Jeden rok po OTJ bylo hodnoceno přežívání pacientů, funkce štěpu, potřeba dialyzační léčby a vybrané laboratorní parametry. Výsledky: Během OTJ došlo ke zvýšení Skr a Surea a vzestup hodnot byl patrný ještě 12 hod po operaci. Byl zaznamenán pokles Ukr a Uurea a nárůst SNa a SK. Hodnoty Scyst se během operace významně neměnily, zvýšení hodnot bylo zaznamenáno 12 hod po OTJ. Hodnoty Sbili poklesly. Došlo k vzestupu močové koncentrace celkové bílkoviny, albuminu a β2 - mikroglobulinu. Hodnoty Uprot Ukr se zvýšily po reperfuzi s maximem po výkonu. Po 12 hod po OTJ došlo k poklesu Uprot/ Ukr, ale na hodnoty vyšší než předoperační. RRT byla zavedena u 14 % pacientů. Rizikovými faktory pro akutní poškození ledvin s potřebou RRT byly: vyšší APACHE skóre, vyšší BMI, vyšší předoperační hodnoty Skr a Surea, hepatorenální syndrom v anamnéze, krevní ztráty a hemodynamická nestabilita během operace, pooperační komplikace a dysfunkce jaterního štěpu. Jeden rok po OTJ nebyl zaznamenán rozdíl ve sledovaných laboratorních hodnotách mezi pacienty, u nichž bylo časně po výkonu indikováno zavedení RRT a ostatními, žádný z pacientů nebyl rok po transplantaci léčen dialýzou. Závěr: OTJ významně ovlivňuje glomerulární a tubulární funkce ledvin. Na základě získaných dat je možno usuzovat, že pacienti, kteří přežijí akutní poškození ledvin s RRT v časném pooperačním období, mají vysokou pravděpodobnost obnovení funkce ledvin. Citlivým markerem poškození funkce ledvin během OTJ by mohlo být perioperační sledování proteinurie.
Klíčová slova:
transplantace jater – akutní poškození ledvin – náhrada funkce ledvinÚvod
Ortotopická transplantace jater (OTJ) je v současné době standardní metodou terapie selhání jater u pacientů v konečném stadiu jaterního onemocnění. Při podrobnějších analýzách faktorů, které ovlivňují dlouhodobé přežívání a dobrou funkci transplantovaných jater bylo opakovaně zjištěno, že významnou roli z tohoto hlediska hraje úroveň funkce ledvin [1,2]. Řada onemocnění postihuje současně játra a ledviny, některá primární onemocnění jater jsou spojena se sekundárním postižením ledvin [3,4]. Onemocnění ledvin se mohou vyvinout v průběhu jaterního postižení různé etiologie, např. u virových hepatitid, deficience α1-antitrypsinu a autoimunitní hepatitidy. Podíl na renální dysfunkci mohou mít i některá metabolická a strukturální onemocnění jako tyrozinemie a polycystóza. Patofyziologickým důsledkem jaterní dysfunkce je intrarenální vazokonstrikce, která může vést k ischemickému selhání ledvin. Hepatorenální syndrom (HRS) je definován jako funkční selhání ledvin, které doprovází jaterní onemocnění s portální hypertenzí, organické poškození ledvin přitom není přítomno [5]. U pacientů před OTJ bývá HRS často přítomen, po úspěšné transplantaci odeznívá [6]. Závažnost postižení ledvin při pokročilých jaterních onemocněních je v některých případech důvodem k provedení současné transplantace jater a ledviny. Zásadní význam má odlišení pacientů s funkční renální poruchou od nemocných s pokročilým ireverzibilním renálním onemocněním. Častou komplikací po OTJ je rozvoj akutního poškození ledvin (AKI – Acute Kidney Injury) v časném pooperačním období a chronické onemocnění ledvin v dlouhodobém průběhu po OTJ [7]. AKI postihuje 12–64% pacientů po OTJ [8,9], přičemž řada studií ukazuje souvislost AKI se zvýšenou potransplantační mortalitou [10]. Údaje o incidenci AKI se liší v různých transplantačních centrech, což souvisí s problémem konsenzuální definice a s výběrem pacientů. Do budoucna by měla být v tomto směru přínosná kritéria RIFLE (Risk – Injury – Failure – Loss – End stage kidneydisease), zveřejněná v roce 2004 a založená na změnách sérové koncentrace kreatininu a výdeji moče, která umožňují standardizovanou klasifikaci renální dysfunkce [11]. V literatuře je výskyt renální dysfunkce po OTJ často zmiňován, pouze výjimečně je však věnována pozornost změnám renálních funkcí v perioperačním období, většina studií je retrospektivních.
Cílem prospektivní studie bylo sledování perioperačních změn renálních funkcí v souboru 50 pacientů, kterým byla provedena OTJ, identifikace rizikových faktorů pro potřebu náhrady funkce ledvin (RRT – Renal Replacement Therapy) časně po OTJ a hodnocení renálních funkcí po jednom roce po transplantaci.
Soubor a metodika
Do prospektivní studie bylo zařazeno 50 konsekutivních pacientů, kteří podstoupili v Institutu klinické a experimentální medicíny v Praze OTJ standardní technikou bez veno venózního bypassu. Do souboru nebyli zařazeni pacienti, kterým byla provedena kombinovaná transplantace jater a ledviny, pacienti, kteří zemřeli bezprostředně po OTJ a pacienti mladší než 15 let. Při reperfuzi byl všem pacientům podán bolus metylprednisolonu, imunosupresivní protokol po výkonu sestával z kombinace kalcineurinového inhibitoru (takrolimus nebo cyklosporin), kortikoidu a antimetabolitu (mykofenolát mofetil). Plazmatické koncentrace kalcineurinových inhibitorů byly v prvních pěti dnech po OTJ kontrolovány denně. Parametry zaznamenané před OTJ byly: pohlaví, věk, body mass index (BMI), doba na čekací listině (WL), indikace k transplantaci jater, pokročilost jaterního onemocnění dle Child-Pugh klasifikace a CTP skóre (Child-Turcotte-Pugh), hypertenze, diabetes mellitus a onemocnění ledvin v anamnéze. Peroperačně byla sledována délka anestezie, délka anhepatické fáze (AHF), čas studené ischemie (CIT – Cold Ischemic Time), velikost krevní ztráty, počet podaných jednotek čerstvě zmrazené plazmy (FFP), počet podaných erytrocytárních koncentrátů (EK) peroperační komplikace (hemodynamická nestabilita s podáváním inotropik) a objem odsáté ascitické tekutiny. Pooperačně sledované parametry zahrnovaly počet dnů na resuscitačním oddělení (LOS – Length Of Stay), délku umělé plicní ventilace (UPV) a APACHE skóre (Acute Physiology and Chronic Health Evaluation). V prvním týdnu po OTJ byly sledovány pooperační komplikace (krvácení s podáváním krevních derivátů, event. s nutností operační revize, oběhová nestabilita), funkce štěpu jater, zvýšená plazmatická koncentrace kalcineurinového inhibitoru a výskyt akutního poškození ledvin stupně F dle kritérií RIFLE se zavedením RRT. Byly porovnány vybrané klinické a laboratorní parametry ve skupině s RRT a bez RRT. Jeden rok po OTJ bylo hodnoceno přežívání pacientů, potřeba dialyzační léčby, funkce štěpu jater a vybrané laboratorní hodnoty (Skr, Surea, SNa, SK, Sbili, Ukreat a Uprot).
Popis sledování a biochemické metody
Biochemická vyšetření vzorků plazmy a moče byla provedena těsně před chirurgickým výkonem (čas T1), po reperfuzi štěpu (čas T2), bezprostředně po operaci (čas T3) a 12 hod po ukončení výkonu (čas T4). Moč byla sbírána katétrem zavedeným do močového měchýře. Ve vzorcích plazmy a moče byla stanovena koncentrace kreatininu enzymatickou metodou „Crea plus“ (Roche). Ve vzorcích plazmy byla stanovena koncentrace bilirubinu DPD metodou (s diazočinidlem za tvorby azobilirubinu). Koncentrace močoviny, sodíku a draslíku byla stanovena pomocí autoanalyzátoru (Hitachi 912). Močová koncentrace albuminu byla stanovena imunoturbimetricky (Roche, Modular). Koncentrace β2-mikroglobulinu byla stanovena na podkladě chemiluminiscence (kity BioVendor, Immulite 1000). Celková močová bílkovina byla vyšetřována turbidimetricky s benzethonium chloridem (Roche, Modular). Koncentrace cystatinu byla vyšetřena imunonefelometricky (N Latex Cystatin C, Behring).
Statistické hodnocení
Sledované veličiny byly vyjádřeny v průměrech ± směrodatná odchylka a v mediánech, s udáním minimální a maximální hodnoty. Porovnání změn vybraných laboratorních hodnot v čase a srovnání předoperačních laboratorních parametrů s parametry při jednoroční kontrole bylo provedeno pomocí Wilcoxonova párového testu. Porovnávání sledovaných kvantitativních a kvalitativních parametrů mezi skupinami s RRT a bez RRT bylo provedeno pomocí Mann Whitneyova testu a χ2 testu. Byl užit výpočet Pearsonova nebo Spearmanova korelačního koeficientu (r), výpočet AUC (Area Under Curve) – plochy pod křivkou. K porovnání diurézy mezi skupinou s RRT a bez RRT byl užit Mann Whitneyův test a analýza rozptylu (analysis of variance – ANOVA). Logistické krokové regrese bylo užito k hodnocení rizikových faktorů pro zavedení RRT. Za statisticky významnou byla považována hodnota p < 0,05.
Výsledky
Klinické charakteristiky
Soubor pacientů tvořilo 28 mužů (56%) a 22 žen (44%), v tab. 1 a grafu 1 jsou znázorněny předoperační parametry a indikace k OTJ, 2 pacienti v souboru podstupovali retransplantaci jater. Anamnestické údaje jsou zobrazeny v grafu 2, pozitivní nefrologická anamnéza byla zaznamenána u 17 pacientů, u 11 z nich byl diagnostikován HRS, v 10 případech se jednalo o HRS typu II a v jednom případě o HRS typu I při akutním selhání jater. Dále šlo o recidivující infekci močových cest (n = 1), pyelonefritidu (n = 1), nefrolitiázu (n = 2), cystu ledviny (n = 1), diabetickou nefropatii (n = 2), glomerulonefritidu při hepatitidě typu B (n = 1) a chronické onemocnění ledvin při kalcineurinové nefrotoxicitě u pacienta indikovaného k retransplantaci jater (n = 1). Podle pokročilosti jaterního onemocnění byli pacienti zařazeni dle klasifikace Child-Pugh, do skupiny A (n = 6), B (n = 17) a C (n = 27).
Table 1. Charakteristika souboru: vstupní parametry před OTJ. 
Graph 1. Indikace k transplantaci jater. 
ETOH – alkoholická nemoc jater, HCV – posthepatitická cirhóza C, PSC + SSC – primární a sekundární sklerotizující cholangoitida, ASJ – akutní selhání jater, PBC + SBC – primární a sekundární biliární cirhóza, HBV – posthepatitická cirhóza B, AICH – autoimunitní choroba, jiné – m. Wilson, HCC, Budd-Chiari syndrom, defi cit α1- antitrypsinu Graph 2. Anamnestické údaje. 
HT – hypertenze, DM – diabetes mellitus, PNA – pozitivní nefrologická anamnéza, HRS – hepatorenální syndrom, PHT – portální hypertenze, TIPS – transjugulární intrahepatální portosystémová spojka Intraoperačně a pooperačně sledované parametry jsou uvedeny v přehledu v tab. 2 a 3. Peroperační oběhová nestabilita s podáváním inotropik byla zaznamenána u 18 pacientů (36 %). U 43 pacientů (86%) došlo v 1. týdnu po OTJ k časnému rozvoji funkce štěpu, opožděný rozvoj funkce štěpu byl zaznamenán u 6 pacientů, a těžká dysfunkce štěpu u 1 pacienta. Takrolimus byl podáván 42 pacientům (84%), cyklosporin 8 pacientům (16%). Zvýšená plazmatická koncentrace kalcineurinového inhibitoru byla v 1. pooperačním týdnu zachycena u 23 pacientů (46%). Pooperační komplikace se vyskytly u 29 pacientů (58%). RRT byla zavedena u 7 pacientů (14%), jednalo se o metodu kontinuální s regionální antikoagulací. Indikací k zavedení RRT bylo těžké tekutinové přetížení při digonurii. RRT byla ukončena při reparaci renálních funkcí, napojení trvalo v průměru 4,8 dne (min. 2, max. 13, medián dva dny).
Table 2. Intraoperační parametry (CIT – doba studené ischemie, AHF – čas anhepatické fáze). 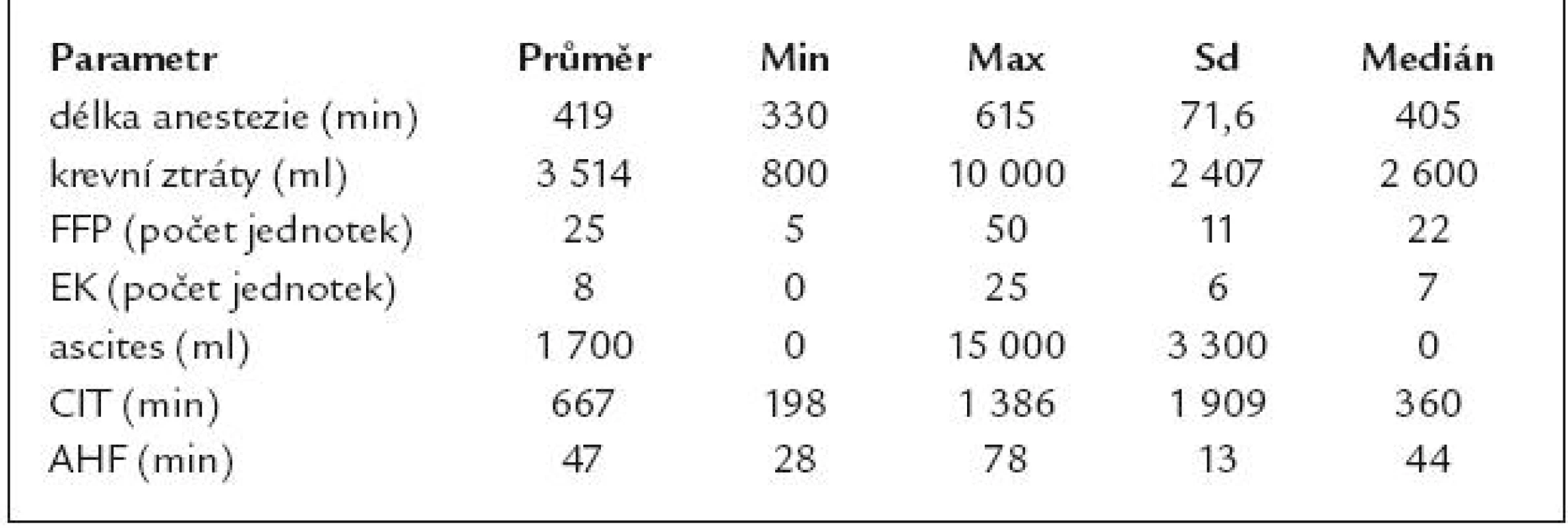
Table 3. Pooperační parametry. 
Klinické charakteristiky po jednom roce po OTJ
Roční kontrola byla provedena u 49 pa-cientů, 1 pacientka, transplantovanápro akutní selhání jater na podkladě Wilsonovy choroby, zemřela v důsledku multiorgánové dysfunkce. V průběhu jednoho roku po OTJ podstoupili 2 pacienti ze souboru retransplantaci jater, 1 pacient byl pro dysfunkci štěpu indikován k retransplantaci. Žádný pacient při roční kontrole nevyžadoval dialyzační léčbu.
Laboratorní parametry
Ve sledovaném souboru vzrostly během OTJ hodnoty Skr (graf 3) a Surea (graf 4) a vzestup bylo možno zaznamenat ještě 12 hod po operaci. V časovém intervalu T1–T4 došlo k nárůstu hodnot Skr a Surea (obojí p < 0,001). Hodnoty Scyst (graf 5) se v čase T1–T3 nezvyšovaly, nárůst Scyst byl zaznamenán po 12 hod po operaci. V intervalu T1–T4 vzrostly hodnoty SNa (p < 0,001) a SK (p < 0,01). Hodnoty SNa, posuzovány z hlediska průměru i mediánu, se před OTJ nejčastěji pohybovaly při dolní hranici normy. Předoperační hodnota SNa ≤ 135 mmol/l byla zjištěna u 24 pacientů, SNa ≤ 130 mmol/l u 8 pacientů. Předoperačně byl přítomen velký rozptyl hodnot Sbili, průměrné hodnoty Sbili v čase T1–T4 poklesly (p < 0,05). Během OTJ klesly hodnoty Ukr (graf 6) a Uurea (graf 7), po 12 hod po operaci se oba parametry zvýšily, ale na hodnoty nižší než předoperační. V intervalu T1–T4 byl zaznamenán pokles hodnot Ukr i Uurea (p < 0,001). Během OTJ došlo k vzestupu močové koncentrace celkové bílkoviny, albuminu a β2-mikroglobulinu. Hodnoty poměru Uprot/Ukr (graf 8) se zvýšily po reperfuzi a dosáhly maxima po operaci. Po 12 hod po výkonu došlo sice k poklesu Uprot/Ukr, nicméně na hodnoty mnohonásobně převyšující hodnoty předoperační, nárůst hodnot byl zaznamenán v intervalu T1–T4 (p < 0,001). Hodnoty poměru Ualb/Ukr (graf 9) se rovněž zvýšily, maximální nárůst byl zaznamenán po reperfuzi. Hodnoty Ub2m/Ukr (graf 10) se významně zvýšily s maximálním nárůstem na konci operace. Diuréza v čase T3 zvýšená oproti T2 (p < 0,001), v čase T4 poklesla (p < 0,001). Vybrané laboratorní parametry po jednom roce po OTJ jsou znázorněny v tab. 4. Neprokázala se souvislost mezi hodnotami laboratorních parametrů při jednoroční kontrole s hodnotami vstupních laboratorních parametrů.
Graph 3. Časový průběh Skr (μmol/l). 
*p < 0,05, **p < 0,01, ***p < 0,001 Graph 4. Časový průběh Surea (mmol/l). 
*p < 0,05, **p < 0,01, ***p < 0,001 Graph 5. Časový průběh Scyst C (mg/l). 
*p < 0,05, **p < 0,01, ***p < 0,001 Graph 6. Časový průběh Ukr (mmol/l). 
*p < 0,05, **p < 0,01, ***p < 0,001 Graph 7. Časový průběh Uurea (mmol/l). 
*p < 0,05, **p < 0,01, ***p < 0,001 Graph 8. Časový průběh Uprot/Ukr (g/l). 
*p < 0,05, **p < 0,01, ***p < 0,001 Graph 9. Časový průběh Ualb/Ukr (mg/mmol). 
*p < 0,05, **p < 0,01, ***p < 0,001 Graph 10. Časový průběh Ub2m/Ukr (mg/mmol). 
*p < 0,05, **p < 0,01, ***p < 0,001 Table 4. Laboratorní hodnoty po jednom roce po OTJ (počet, medián, minimální a maximální hodnota, průměr a sd). 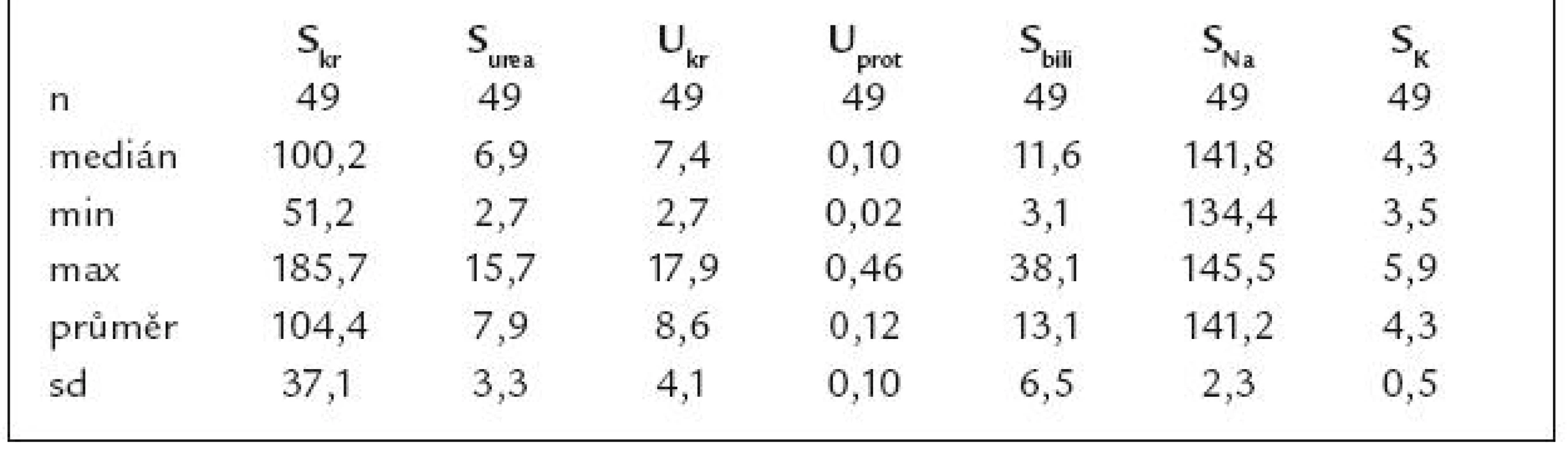
Statisticky významné rozdíly mezi skupinou pacientů s RRT a bez RRT byly nalezeny v následujících parametrech: APACHE skóre, BMI, předtransplantační hodnoty Skr a Surea, hepatorenální syndrom před OTJ, peroperační komplikace, krevní ztráty, počet podaných EK, pooperační komplikace a funkce jaterního štěpu (tab. 5). Ve skupině pacientů, u nichž bylo indikováno zavedení RRT, byla produkce moče nižší oproti skupině bez RRT, statisticky významný rozdíl v diuréze mezi oběma skupinami prokázán nebyl. Do modelu logistické krokové regrese jsme zařadili následující rizikové faktory pro potřebu RRT: APACHE skóre, komplikace na operačním sále, pooperační komplikace a funkce štěpu. Byl nalezen statisticky významný regresní koeficient pro velikost APACHE skóre (koeficient 0,647; OR 1,91; 95% CI 1,17–3,13). Při jednoroční kontrole nebyly mezi skupinami s RRT a bez RRT prokázány rozdíly v hodnotách vybraných laboratorních parametrů.
Table 5. Parametry, u nichž byly shledány statisticky významné rozdíly mezi skupinou pacientů se zavedením RRT a skupinou bez RRT v 1. týdnu po OTJ (parametry bez prokázané statistické významnosti nejsou uvedeny). 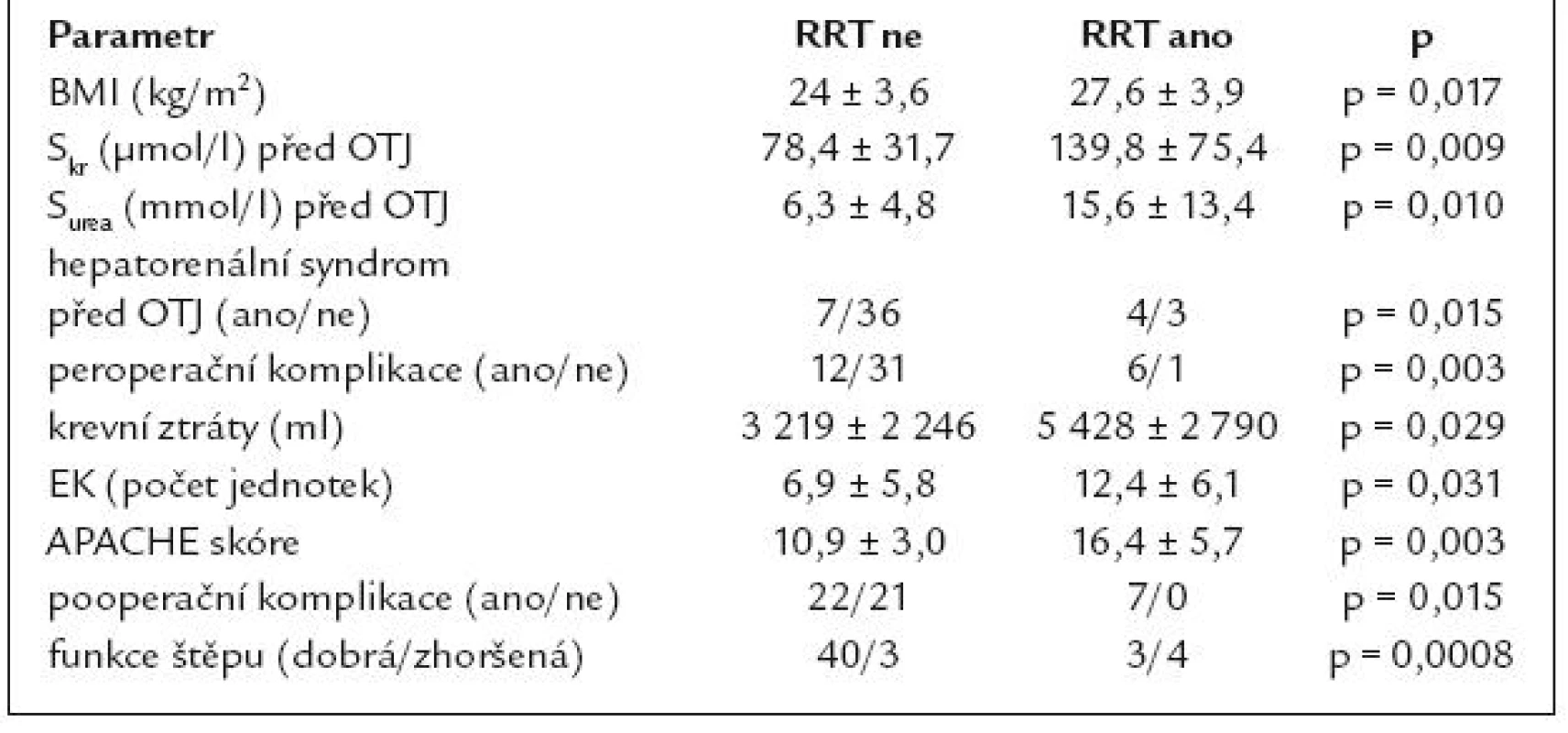
Nebyla prokázána souvislost mezi velikostí proteinurie v časovém intervalu T1–T4 (AUC) a vstupními parametry včetně hodnot laboratorních. Nebyla prokázána souvislost mezi velikostí proteinurie v časovém intervalu T1–T4 (AUC) a počtem peroperačně podaných jednotek FFP (r = –0,0703). Velikost proteinurie v časovém intervalu T1–T4 (AUC) nesouvisela s laboratorními parametry po jednom roce po OTJ.
Diskuze
Etiologie AKI po OTJ je multifaktoriální. Pacienti podstupující OTJ se v řadě aspektů podobají pacientům, u nichž je prováděn velký břišní výkon, v některých aspektech se však zásadně liší. Onemocnění jater má souvislost s poškozením renálních funkcí, rozvoj HRS významně ovlivňuje přežití pacientů v konečném stadiu onemocnění jater. Kromě faktorů působících na ledviny v průběhu intraabdominálního výkonu [12] se v průběhu OTJ uplatňuje omezení průtoku krve v ledvinách v průběhu anhepatické fáze operace. Po OTJ jsou navíc pacienti standardně vystaveni nefrotoxickému působení kalcineurinových inhibitorů. OTJ prováděná standardní technikou je spojena s významnými hemodynamickými změnami v ledvinách. Během anhepatické fáze při naložení svorky na dolní dutou žílu a portální žílu je omezen průtok krve ve splanchnické oblasti a zvýšen venózní tlak. Za účelem snížení hemodynamické nestability během anhepatické fáze byly zavedeny modifikace chirurgické techniky, a to veno venózní bypass (VVB), který odvádí krev z povodí portální a dolní duté žíly do horní duté žíly a technika piggy-back, při níž je provedena hepatektomie u příjemce s ponecháním dolní duté žíly. Porovnáním renálních funkcí pacientů, kterým byl při OTJ zaveden VVB a pacientů, u nichž tato technika použita nebyla, se zabývá práce, která hodnotí úroveň glomerulární filtrace, proteinurii a některé tubulární funkce v perioperačním období [13]. Tato studie zaznamenala menší pokles glomerulární filtrace během OTJ v anhepatické fázi u jedinců s VVB než u jedinců, u kterých bypass použit nebyl, avšak úroveň renální funkce 7. den po chirurgickém zákroku nejevila prokazatelný rozdíl. Předpokládaný protektivní účinek VVB na renální funkce nebyl prokázán a jeho systematické používání není v současné době doporučováno [13–15]. Podle některých autorů je užití techniky piggy-back spojeno s nižší incidencí pooperačního akutního selhání ledvin [16], tento nález však nebyl bez výhrad potvrzen [17]. Vzhledem ke značné variabilitě chirurgické techniky OTJ je hodnocení vlivu určitého typu užité techniky na pooperační renální dysfunkci nesnadné. Souvislost mezi typem chirurgické techniky a pooperační renální dysfunkcí nebyla jednoznačně prokázána [17,18].
Změny sérových koncentrací perioperačně sledovaných parametrů je třeba interpretovat velmi zdrženlivě, protože v průběhu OTJ dochází k velkým změnám vnitřního prostředí a výměně tekutin a iontů. Koncentrace Skr nemusí být citlivým indikátorem změn renálních funkcí, protože může být ovlivněna relativně velkým objemem podávaných tekutin, které neobsahují kreatinin. Přesto byl v našem sledování zaznamenán významný nárůst Skr a Surea. Enyzmatická metoda stanovení kreatininu byla zvolena pro vyloučení interference s bilirubinem při stanovení Skr kinetickou Jaffé reakcí s alkalickým pikrátem [19]. Změny Scyst v průběhu OTJ budou vyžadovat další analýzu. V souladu s řadou nálezů o metabolizmu sodíku u pacientů s jaterní cirhózou byl v předoperačním období patrný sklon k hyponatremii [4]. Nárůst SNa a SK nepochybně souvisí s podáváním infuzních roztoků a s metabolickými změnami po reperfuzi jaterního štěpu [20].
Domníváme se, že důležité nálezy byly získány při sledování změn renálního vylučování bílkovin během OTJ. Je zřejmé, že omezení cirkulace krve v ledvinách bylo spojeno se zvýšením proteinurie (Uprot/Ukr). Bližší analýza této proteinurie ukazuje, že na jejím rozvoji se podílí albumin a β2-mikroglobulin. Zvýšení poměru Ualb/Ukr by bylo možno vysvětlit poškozením permeability glomerulárních kapilár v souvislosti se zvýšením intraglomerulárního tlaku a hypoxií při omezené renální cirkulaci. S ohledem na současné znalosti renálního vylučování β2-mikroglobulinu lze soudit, že jeho zvýšené vylučování během OTJ je projevem postižení tubulárních buněk s následným snížením jeho tubulární resorpce. Tento nález je v souladu se zjištěním Grande et al [13]. Pokles Ukr a Uurea nasvědčuje tomu, že v průběhu OTJ dochází k významnému snížení tubulární resorpce vody. Na této změně se může uplatňovat expanze extracelulární tekutiny během OTJ. Neprokázali jsme statisticky významný rozdíl v diuréze mezi skupinou s RRT a bez RRT. Produkce moče je citlivým markerem renální dysfunkce, avšak senzitivita a specificita tohoto údaje klesá při snížené diuréze a při užití diuretik. Naproti tomu závažné poškození ledvin může být přítomno i při zachované diuréze [11].
Zavedení RRT v prvním týdnu po OTJ bylo indikováno u 14% pacientů. Neprokázali jsme souvislost potřeby RRT s vyšší hladinou kalcineurinových inhibitorů v prvním týdnu po OTJ přes jejich prokázanou nefrotoxicitu [21]. Jejich dávkování vycházelo z denní monitorace sérových koncentrací a bylo redukováno dle aktuálních hodnot a při známkách poruchy funkce ledvin. Rovněž nebyla prokázána souvislost RRT s délkou anhepatické fáze operace. Oproti některým literárním zdrojům jsme neprokázali souvislost mezi potřebou RRT a špatnou prognózou [26–28].
V literatuře je zavedení RRT udáváno u 8–19% pacientů [22–28]. Rozdíly v publikovaných údajích jsou dány absencí jednotných kritérií a kontraindikací k zavedení RRT a souvisí s nejednotným časovým intervalem, který je považován za časné potransplantační období. Práce týkající se této problematiky jsou většinou retrospektivní někdy vycházejí z databází propuštěných pacientů podle diagnóz [23], ve studiích jsou hodnoceny metody intermitentní i kontinuální. Srovnávání incidence RRT je proto problematické, stejně tak i rozbor rizikových faktorů. Jako rizikové faktory pro potřebu RRT jsou uváděny např. Skr, Surea, délka hospitalizace na JIP nad tři dny, MELD skóre nad 21 při potřebě RRT u 12% pacientů [24] nebo Skr, Surea a výdej moče při zavedení RRT u 11% pacientů [15]. V jiné studii bylo pozorováno akutní selhání ledvin po OTJ s potřebou RRT u 13% pacientů, byla prokázána souvislost s předoperační hodnotou Skr, počtem podaných EK a intraoperační diurézou, korelace s MELD skóre prokázána nebyla [25]. V retrospektivní studii z roku 2007 s využitím RIFLE kritérií pro akutní poškození ledvin je udáváno zavedení RRT u 19% pacientů, akutní selhání ledvin souviselo s předoperační hodnotou Skr, užitím inotropik a aminoglykosidů [26].
Provedená prospektivní studie poukazuje na dramatické změny vybraných parametrů v průběhu OTJ a hodnotí rizikové faktory závažné dysfunkce ledvin v časném potransplantačním období. Limitace studie spočívá v malém souboru pacientů, který je nehomogenní z hlediska vstupních parametrů, včetně úrovně předoperačního postižení ledvin.
Závěr
Na základě námi dosažených výsledků lze soudit, že transplantace jater významně ovlivňuje glomerulární a tubulární funkce ledvin. Rizikovými faktory pro potřebu RRT v časném potransplantačním období byly: vyšší APACHE skóre, vyšší předoperační hodnoty Skr a Surea, hepatorenální syndrom před OTJ, vyšší BMI, krevní ztráty a hemodynamická nestabilita během operace, pooperační komplikace a dysfunkce jaterního štěpu. Na základě skutečnosti, že mezi skupinou pacientů se zavedením RRT a skupinou bez RRT nebyl po jednom roce po OTJ zaznamenán statisticky významný rozdíl ve sledovaných laboratorních parametrech a že žádný z pacientů při jednoroční kontrole nevyžadoval terapii dialýzou, lze usuzovat, že pacienti, kteří přežijí AKI se zavedením RRT v časném potransplantačním období, mají šanci na obnovení funkce ledvin.
MUDr. Eva Kieslichová
www.ikem.cz
e mail: evki@ikem.cz
Sources
1. Pham PT, Pham PC, Wilkinson AH. The kidney in liver transplantation. Clin Liver Dis 2000; 4 : 576 – 590.
2. Neau - Cransac M, Morel D, Merville P et al. Renal failure after liver transplantation: outcome after calcineurin inhibitor withdrawal. Clin Transplant 2002; 16 : 368 – 373.
3. Davis CL, Gonwa TA, Wilkinson AH. Pathophysiology of renal disease associated with liver disorders: Implications for liver transplantation. Part I. Liver Transpl 2002; 8 : 91 – 109.
4. Gines P, Arroyo V, Rodes J. Renal fuction in cirrhosis: pathophysiology and clinical features. In: Zakim D, Boyer TD (eds). Hepatology: a textbook of liver disease. 4th ed. Philadelphia: Elsevier 2003 : 497 – 516.
5. Ginès P, Guevara M, Arroyo V. Hepatorenal syndrome. Lancet 2003; 362 : 1819 – 1827.
6. Marik PE, Wood K, Starzl T. The course of type 1 hepato - renal syndrome post liver transplantation. Nephrol Dial Transpl 2006; 21 : 478 – 482.
7. Yalavarthy R, Edelstein CL, Teitelbaum I. Acute renal failure and chronic kidney disease following liver transplantation. Hemodial Int 2007; 11 (Suppl 3): 7 – 12.
8. Chuang FR, Lin CC, Wang PH et al. Acute renal failure after cadaveric related liver transplantation. Transplant Proc 2004; 36 : 2328 – 2330.
9. Junge G, Schewior LV, Kohler S et al. Acute renal failure after liver transplantation: incidence, etiology, therapy, and outcome. Transplant Proc 2006; 38 : 723 – 724.
10. Gainza FJ, Valdivieso A, Quintanilla N et al. Evaluation of acute renal failure in the liver transplantation period. Incidence and impact. Transplant Proc 2002; 34 : 250 – 251.
11. Bellomo R, Ronco C, Kellum JA et al. Acute Dialysis Quality Initiative Workgroup. Acute renal failure – definition, outcome, measures, animal models, fluid therapy and information technology needs: the second international consensus conference of the Acute Dialysis Quality Initiative Group. Crit Care 2004; 8: R204 – R212.
12. Reddy VG. Prevention of postoperative acute renal failure. J Postgrad Med 2002; 48 : 64 – 70.
13. Grande L, Rimola A, Cugat E et al. Effect of venovenous bypass on perioperative renal function in liver transplantation: result of a randomized, controlled trial. Hepatology 1996; 23 : 1418 – 1428.
14. Reddy K, Mallet S, Peachey T. Venovenous bypass in orthotopic liver transplantation: time for rethink? Liver Transplant 2005; 11 : 741 – 749.
15. Contreras G, Garces G, Quartin AA et al. An epidemiologic study of early renal replacement therapy after orthotopic liver transplantation. J Am Soc Nephrol 2002; 13 : 228 – 233.
16. Cabezuelo JB, Ramirez P, Acosta F et al. Does the surgical technique used (standard vs Piggy Back) have an effect on development of early acute renal failure after orthotopic liver transplantation? Transplant Proc 2003; 35 : 1913 – 1914.
17. Cabezuelo JB, Ramírez P, Ríos A et al. Risk factors of acute renal failure after liver transplantation. Kidney Int 2006; 69 : 1073 – 1080.
18. Lima EQ, Zanetta DM, Castro I et al. Risk factors for development of acute renal failure after liver transplantation. Ren Fail 2003; 25 : 553 – 560.
19. Mazzachi BC, Peake MJ, Ehrhardt V. Reference range and method comparison studies for enzymatic and Jaffé creatinine assays in plasma and serum and early morning urine. Clin Lab 2000; 46 : 53 – 55.
20. Schroeder RA, Collins BH, Tuttle - Newhall E et al. Intraoperative fluid management during orthotopic liver transplantation. J Cardiothoracic Vasc Anesth 2004; 18 : 438 – 441.
21. Nankivell BJ, Borrows RJ, Fung CL et al. Calcineurin inhibitor nephrotoxicity: Longitudinal assessment by protocol histology. Transplantation 2004; 78 : 557 – 565.
22. Gonwa TA, Mai ML, Melton LB et al. Renal replacement therapy and orthotopic liver transplantation: the role of continuous veno‑venous hemodialysis. Transplantation 2001; 71 : 1424 – 1428.
23. Wyatt CM, Arons RR. The burden of acute renal failure in nonrenal solid organ transplantation. Transplantation 2004; 78 : 1351 – 1355.
24. Sanchez EQ, Gonwa TA, Levy MF et al. Preoperative and perioperative predictors of the need for renal replacement therapy after orthotopic liver transplantation. Transplantation 2004; 78 : 1048 – 1054.
25. Faenza S, Bernardi E, Cimatti M et al. Acute renal failure after liver transplantation in MELD era. Transplant Proc 2007; 39 : 1945 – 1946.
26. O’Riordan A, Wong W, McQuillan R et al. Acute renal disease, as defined by the RIFLE criteria, post – liver transplantation. Am J Transplant 2007; 7 : 168 – 176.
27. Pawarode A, Fine DM, Thuluvath PJ. Independent risk factors and natural history of renal dysfunction in liver transplant recipients. Liver Transpl 2003; 9 : 741 – 747.
28. Faenza S, Santoro A, Mancini E et al. Acute renal failure requiring renal replacement therapy after orthotopic liver transplantation. Transplant Proc 2006; 38 : 1141 – 1142.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2009 Issue 12-
All articles in this issue
- Program řízené ambulantní rehabilitace u pacientů po operaci chlopenních srdečních vad
- Transplantace jater a perioperační změny renálních funkcí
- Onemocnění pandemickým chřipkovým virem H1N1 2009 vyžadující intenzivní péči: soubor nemocných z jednoho centra v Austrálii
- Komplexita interakcií nádorového procesu
- Komplexita interakcií nádorového procesu
- Preeklampsie z hlediska mezioborové spolupráce
- Rozdiely medzi pohlaviami vo farmakoterapii chronického srdcového zlyhávania
- Diabetes insipidus, následovaný po 4 letech dysartrií a lehkou pravostrannou hemiparézou – první klinické příznaky Erdheimovy‑ Chesterovy nemoci. Popis a zobrazení případu s přehledem informací o této nemoci
- Obojstranná flebotrombóza dolných končatín zapríčinená vrodenou malformáciou dolnej dutej žily
- Polymorfizmy v genech pro nukleární receptory a riziko restenózy a klinických příhod po koronárním stentingu
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Preeklampsie z hlediska mezioborové spolupráce
- Program řízené ambulantní rehabilitace u pacientů po operaci chlopenních srdečních vad
- Komplexita interakcií nádorového procesu
- Obojstranná flebotrombóza dolných končatín zapríčinená vrodenou malformáciou dolnej dutej žily
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

