-
Medical journals
- Career
Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob II.
Sumoylace a neddylace jako posttranslační modifikace proteinů podobné ubikvitinylaci a jejich význam
Authors: O. Fuchs 1; R. Neuwirtová 2
Authors‘ workplace: Ústav hematologie a krevní transfuze, Praha, ředitel prof. MUDr. Pavel Klener, DrSc. 1; I. interní klinika 1. lékařské fakulty UK a VFN, Praha, přednosta prof. MUDr. Pavel Klener, DrSc. 2
Published in: Vnitř Lék 2006; 52(6): 619-627
Category: Review
Overview
Posttranslační modifikace proteinů jsou účinnými nástroji, které buňky používají k určení funkce proteinů. Modifikátory proteinů podobné ubikvitinu (Ubl, „ubiquitin-like“) jsou posttranslačně připojeny k proteinům enzymatickými reakcemi, které jsou podobné jako při připojení ubikvitinu. Mezi nejvíce pozoruhodné Ubl patří rodina proteinů SUMO („small ubiquitin-related modifier“). Sumoylace je připojení SUMO k cílovému proteinu kovalentní vazbou. Neddylace je proces, který připojí polypeptid Nedd8 k určitým lyzinovým zbytkům cullinů. Culliny jsou rodina proteinů, která je složkou ubikvitinligázových komplexů pro polyubikvitinylaci a následnou degradaci řady buněčných proteinů v proteazomech. Přes podobnost ve struktuře a enzymatických reakcích Ubl mají jiné funkce než ubikvitin. Na rozdíl od polyubikvitinylace, která označuje proteiny pro degradaci v proteazomech, spočívají biologické důsledky sumoylace ve zvýšení stability proteinu. Dále sumoylace pomáhá transportu proteinu z cytoplazmy do jádra buňky, reguluje transkripční aktivity proteinu a ovlivňuje vazbu proteinu k jiným proteinům. Neddylace má důležitou úlohu v regulaci buněčného cyklu, v přenosu signálu, diferenciaci buněk a také v opravě DNA. Nedávné studie ukázaly na význam sumoylace a neddylace řady proteinů v důležitých chorobách (neurodegenerativní choroby, akutní promyelocytární leukemie, diabetes mellitus 1. typu a další onemocnění). Regulace těchto posttranslačních modifikací může poskytnout nové cíle pro terapeutické ovlivnění u řady onemocnění.
Klíčová slova:
modifikátory proteinů podobné k ubikvitinu - SUMO - Nedd8 - sumoylace - neddylaceÚvod
V letech 1996-1997 byla objevena jedna ze skupin polypeptidů podobných ubikvitinu (Ubl, ubiquitin like), která byla pojmenována SUMO (small ubiquitin-related modifier) [1,2]. Ve starší literatuře bylo místo názvu SUMO-1 použito i dalších pojmenování (GMP1, PIC1, sentrin, Smt3p, Pmt2p a Ubl1) [3-8]. Další typ Ubl, zastoupený lidským polypeptidem Nedd8 (neural precursor cell-expressed developmentally down regulated protein) byl objeven v roce 1993 [9] a podrobněji charakterizován až v roce 1997 [10]. Nedd8 vykazuje poměrně velkou shodu primární struktury s ubikvitinem (asi 55% shoda sekvence aminokyselin). Trojrozměrná struktura SUMO se podobá odpovídající struktuře ubikvitinu, ale primární struktura obou proteinů se významně liší (pouze 18% shoda sekvencí aminokyselin).
Vazba Ubl na proteiny, tedy jejich posttranslační modifikace, byla detekována na základě posunu odpovídajícího pruhu na gelu při elektroforéze o asi 15 kDa k větší molekulární hmotnosti. Použitím kombinace dalších metod, kterými jsou kapalinová chromatografie za vysokých tlaků (HPLC) a hmotová spektrometrie, případně magnetická rezonanční spektroskopie, je potom proveden přímo průkaz SUMO.
Enzymatický mechanizmus sumoylace a neddylace se podobá ubikvitinylaci, ale enzymy účastnící se na aktivaci těchto dvou Ubl se liší. U ubikvitinylace rozhoduje o výběru substrátového proteinu pouze ubikvitinligáza, tedy enzym E3 (obr. 1). O výběr substrátu u sumoylace se stará kromě enzymu E3 i konjugační enzym E2. Obě uvedené posttranslační modifikace proteinu (sumoylace i neddylace) jsou reverzibilními procesy podobně jako ubikvitinylace. Modifikace může být odstraněna specifickými peptidázami (desumoylační nebo deneddylační enzymy).
Biologické funkce jednotlivých posttranslačních modifikací proteinů se liší. Polyubikvitinylace předurčuje protein k rozkladu v proteazomu, zatímco sumoylace vedle řady dalších funkcí většinou zvyšuje stabilitu proteinu. Neddylace reguluje aktivitu jedné ze skupin ubikvitinligáz obsahujících proteiny rodiny cullinů. Monoubikvitinylace transkripčních faktorů a regulátorů stimuluje transkripci. Sumoylace těchto proteinů naopak inhibuje transkripci. Sumoylace hraje úlohu v transportu mezi cytoplazmou a jádrem, v udržení integrity chromozomů a stability genomu. Neddylace ubikvitinligáz obsahujících cullin je nezbytná pro ubikvitinylaci a degradaci řady proteinů důležitých pro regulaci buněčného cyklu, jako jsou c-myc, cyklin E, inhibitory cdk (cyklin-dependentní kinázy) p21CIP1/WAF1 a p27KIP1. Neddylace rodiny cullinů je proto důležitá pro proliferaci buněk většiny organizmů. Poruchy v neddylaci cullinů vedou k poruchám buněčného cyklu.
Izoformy proteinu SUMO
Zatímco u kvasinek a bezobratlých živočichů existuje 1 forma proteinu SUMO, u člověka nacházíme 4 izoformy (SUMO-1, velmi podobné SUMO-2 a SUMO-3 a nedávno objevenou izoformu SUMO-4) [11,12]. Za fyziologických podmínek se k proteinům nejvíce připojuje SUMO-1. Za stresových podmínek, např. při působení zvýšené teploty, tedy při tepelném šoku, dochází k sumoylaci proteinů izoformami SUMO-2/3. Některé proteiny, např. topoizomeráza II, jsou však i za normálních podmínek sumoylovány, a tím stabilizovány izoformami SUMO-2/3 [13]. Exprese SUMO-4 probíhá pouze v ledvinách, zatímco ostatní izoformy nacházíme ve všech tkáních [14].
U izoformy SUMO-4 se setkáváme s jednonukleotidovým polymorfizmem, kdy v poloze 55 této izoformy je methioninový nebo valinový zbytek [14-16]. Izoforma SUMO-4 s valinem v poloze 55 je spojena s větší pravděpodobností výskytu diabetes mellitus 1. typu v příslušných rodinách, a je tedy zřejmě zahrnuta v patogeneze tohoto onemocnění [14-16]. I když sumoylace obvykle snižuje aktivitu transkripčních faktorů, izoforma SUMO-4 s valinem v poloze 55 je spojena se zvýšenou aktivitou transkripčních faktorů NF-κB, STAT (signal transducers and activators of transcription) a AP-1 [17]. Právě zvýšení aktivity uvedených transkripčních faktorů se podílí na destrukci pankreatických β-buněk při diabetes mellitus 1. typu.
Syntéza SUMO a výběr substrátu pro sumoylaci
SUMO je syntetizován podobně jako ubikvitin jako delší prekurzor a ten je štěpen na výslednou formu specifickými proteázami (C-koncové hydrolázy) za vzniku C-koncového motivu dvou glycinových zbytků (obr. 1). Například prekurzor SUMO-1 obsahuje 101 aminokyselin a je proteolyticky zkrácen na 97 aminokyselin. Tato forma SUMO je potom aktivována v kaskádě enzymatických reakcí pro sumoylaci cílových proteinů (obr. 1). Při sumoylaci je C-koncový glycin proteinu SUMO vázán k lyzinovému zbytku cílového proteinu podobně jako při ubikvitinylaci. Analýzou cílových proteinů sumoylace bylo zjištěno, že akceptorový lyzin (K), na který se naváže protein SUMO, leží uvnitř všeobecně shodné sekvence aminokyselin pro sumoylaci (ΨKXE) u těchto substrátových proteinů. Tato sekvence se skládá z velkého hydrofobního aminokyselinového zbytku Ψ, lyzinu K, jakékoliv aminokyseliny X a glutamové kyseliny E [18].
Image 1. Schéma enzymatické kaskády sumoylace a desumoylace. 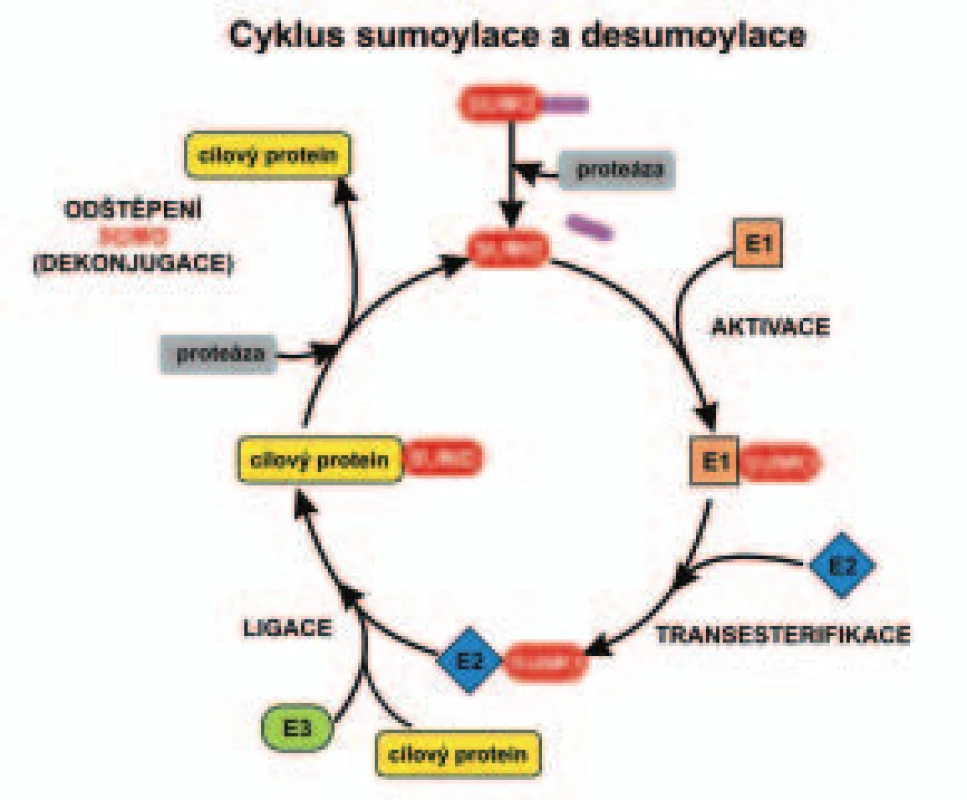
Průběh sumoylace a desumoylace proteinu je popsán v textu. Enzymy zahrnuté v sumoylaci a desumoylaci
Mechanizmus post-translační modifikace cílových proteinů (substrátů) sumoylací se podobá ubikvitinylaci [19-22]. Na sumoylaci cílového proteinu se podílí kaskáda enzymů (obr. 1), které ale nejsou totožné s enzymy ubikvitinylace. SUMO-aktivující enzym (E1) je jeden stejně jako u ubikvitinylace. Při ubikvitinylaci různých substrátů funguje celá řada enzymů E2, zatímco sumoylace si vystačí s jedním enzymem E2 [23]. Na rozdíl od ubikvitinylace, kde se o specifický výběr substrátu stará až enzym E3 (ubikvitinligáza), u sumoylace se na výběru substrátu podílí také enzym E2, jak již bylo zmíněno v úvodu. Konjugační enzym E2 se váže k substrátovým proteinům na základě přítomnosti všeobecně shodné aminokyselinové sekvence pro sumoylaci (ΨKXE), popsané v předchozí kapitole. Lyzinový zbytek v uvedeném sekvenčním motivu je právě místem připojení SUMO.
Existují tři hlavní skupiny ligáz pro SUMO (enzymy E3). První skupinou těchto ligáz jsou proteiny PIAS („protein inhibitor of activated STAT“) [24,25]. Transkripční faktory STAT účinkují v signální dráze Janus kinázy (JAK). Druhou skupinu enzymů E3 představuje protein RanBP2 („Ran binding protein 2“). RanBP2 se váže ke GTPáze, která se nazývá Ran („Ras-related nuclear protein“) [26,27]. Třetí skupinu zastupuje protein PC2 (součást komplexu zvaného „polycomb“, který působí kondenzaci chromatinu s negativním vlivem na transkripci) [28,29].
Nyní se budeme zabývat funkční úlohou uvedených 3 skupin E3 ligáz účinkujících v sumoylaci proteinů. Proteiny PIAS účinkují jako enzymy E3 při sumoylaci nádorového supresoru p53, dále regulátoru jeho odbourání - proteinu mdm2 (původně nalezen na „mouse double minute chromosomes“), protoonkoproteinů c-jun a c-fos (složky transkripčního faktoru AP1) a řady dalších proteinů. Nádorový supresor, protein p53, hraje důležitou funkci v onkogeneze, protože reguluje proliferaci buněk, opravu DNA a apoptózu buněk. Velký význam, který má protein p53, je doložen tím, že existují posttranslační modifikace (fosforylace a acetylace), které zvyšují jeho stabilitu i aktivitu. Stabilita proteinu p53 je regulována onkoproteinem mdm2. Mdm2 je vlastně E3 ubikvitinligáza, která ubikvitinyluje transkripční faktor p53. Při poškození DNA je p53 fosforylován a mdm2 se nemůže navázat na fosforylovaný p53. Protein p53 se tím stává stabilnější, nemůže být ubikvitinylován a rozložen v proteazomech a může plnit svou funkci nádorového supresoru. Mdm2 je sumoylován v sekvenci signálu pro umístění v jádře buňky. Tato sumoylace je nezbytná pro přemístění mdm2 z cytoplazmy do jádra buňky. Sumoylací modifikované proteiny p53 a mdm2 mohou být ubikvitinylovány a sumoylace zde nebrání jejich rozkladu v proteazomech.
Druhá skupina E3 ligáz v sumoylaci, zastoupená proteinem RanBP2, se účastní např. sumoylace histondeacetylázy 4.
Třetí skupina E3 ligáz reprezentovaná proteinem PC2 účinkuje při sumoylaci histonů (podrobněji je probráno níže). Všechny 3 typy enzymů E3 jsou také samy cílem sumoylace (autosumoylace).
Sedm SUMO proteáz bylo zatím popsáno u člověka [30,31]. Byly označeny SENP 1-7 (sentrin-specifické proteázy) [32]. SUMO proteázy mají 2 základní funkce. Vedle již uvedeného štěpení prekurzoru SUMO na výslednou formu jsou také schopny odštěpit SUMO vázané izopeptidovou vazbou k proteinu (desumoylace) [7,22,30]. Sumoylace je tedy podobně jako jiné posttranslační modifikace proteinu, např. fosforylace a ubikvitinylace, vratným procesem.
Co zatím víme o důsledcích sumoylace proteinů
K sumoylaci dochází často na stejném lyzinovém zbytku proteinu (substrátu) jako k ubikvitinylaci. Sumoylace v těchto případech soutěží o tento lyzinový zbytek v sekvenci proteinu s ubikvitinylací. Zatímco polyubikvitinylace označí protein k degradaci, sumoylace proteinu vede většinou ke zvýšení jeho stability (obr. 2, část a). Příkladem je sumoylace faktoru IκB, která ho stabilizuje, a brání tak jeho rozkladu. Způsobí tím, že transkripční faktor NF-κB je blokován v cytoplazmě buňky (viz kapitola Ubikvitin a ubikvitinylace a obr. 2 v I. části článku: Vnitř Lék 2006; 52(4): 371-378) a nemůže dojít k jeho aktivaci. NF-κB nemůže přejít do jádra buňky a stimulovat jako transkripční faktor expresi cílových genů pro řadu antiapoptotických proteinů (např. bcl 2, bcl-XL, buněčné inhibitory apoptózy IAP1, IAP2 a další), pro cytokiny (např. interleukiny IL1β, IL2, IL6 a IL8, TNFα a další), pro proteiny ovlivňující proliferaci buněk (např. c-myc, cyklin D1 a další), pro receptory (např. receptor pro IL 2, receptor T lymfocytů a další), pro adhezní molekuly [např. ICAM-1 (intercellular cell adhesion molecule-1) a VCAM-1 (vascular cell adhesion molecule-1)], pro vlastní inhibitor IκB a pro enzymy zúčastněné v zánětlivém procesu [např. iNOS (indukovatelná forma NO syntézy), COX2 (cyklooxygenáza 2) a další]. Sumoylace IκB má tedy vlastně protizánětlivý účinek, stimuluje apoptózu buněk a snižuje proliferaci buněk.
Image 2. Schéma účinku sumoylace proteinu na jeho stabilitu a interakce s jinými proteiny. 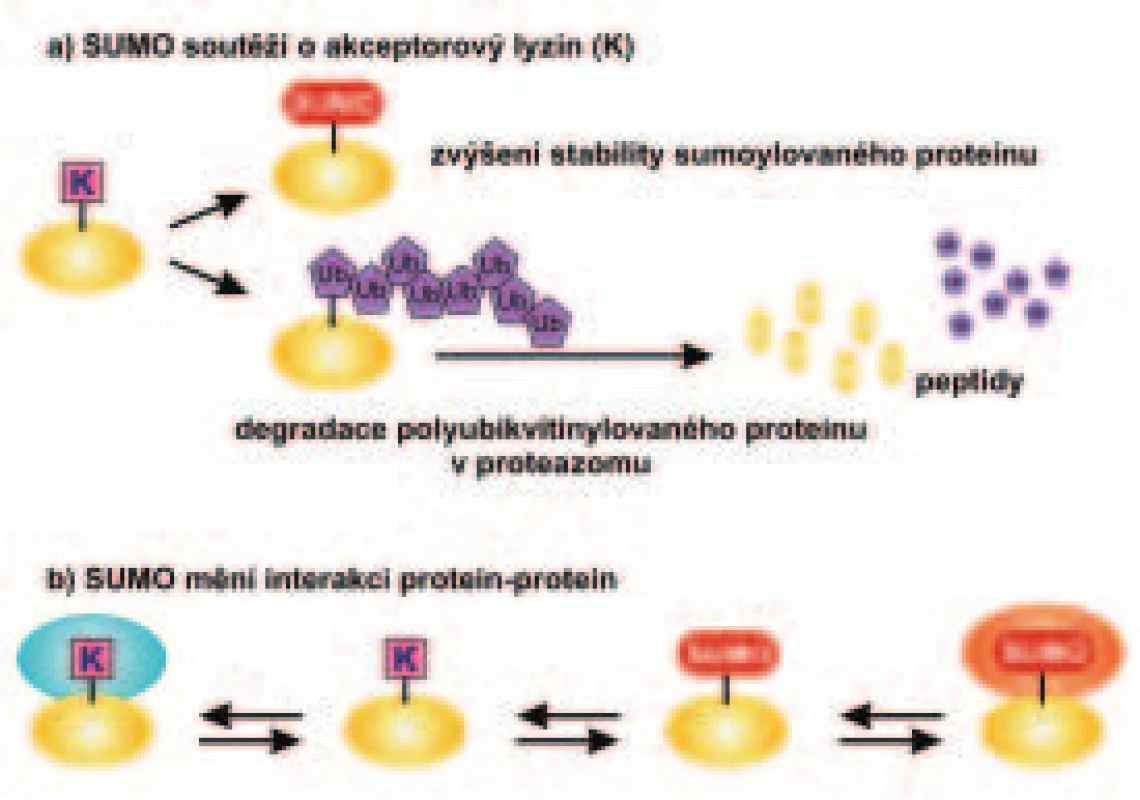
V části a) je ukázán rozdílný vliv sumoylace a ubikvitinylace proteinu na jeho stabilitu a v části b) je znázorněn vliv sumoylace proteinu na jeho interakci s jinými proteiny. Kromě stability proteinu mění sumoylace řadu různých funkčních vlastností proteinu. Tyto vlastnosti určují lokalizaci sumoylovaného proteinu v buňce, jeho interakce s dalšími proteiny nebo s DNA a jeho aktivitu ve funkci transkripčního faktoru. Na obr. 2 je v části b ukázán příklad vlivu sumoylace proteinu na jeho interakci s jinými proteiny. Zatímco nemodifikovaný protein interaguje s určitým proteinem, jeho sumoylovaná forma interaguje silněji s jiným proteinem. Na obr. 3 je v části b znázorněn vliv sumoylace na aktivitu transkripčního faktoru. Zatímco monoubikvitinylace transkripčního faktoru (obr. 3a) vede k vazbě koaktivátoru transkripce a zvyšuje aktivitu transkripčního faktoru, sumoylace transkripčního faktoru (obr. 3b) vede naopak k inhibici aktivity transkripčního faktoru v důsledku navázání korepresoru transkripce.
Image 3. Schematické znázornění vliv monoubikvitinylace a sumoylace transkripčního faktoru na transkripci genu. 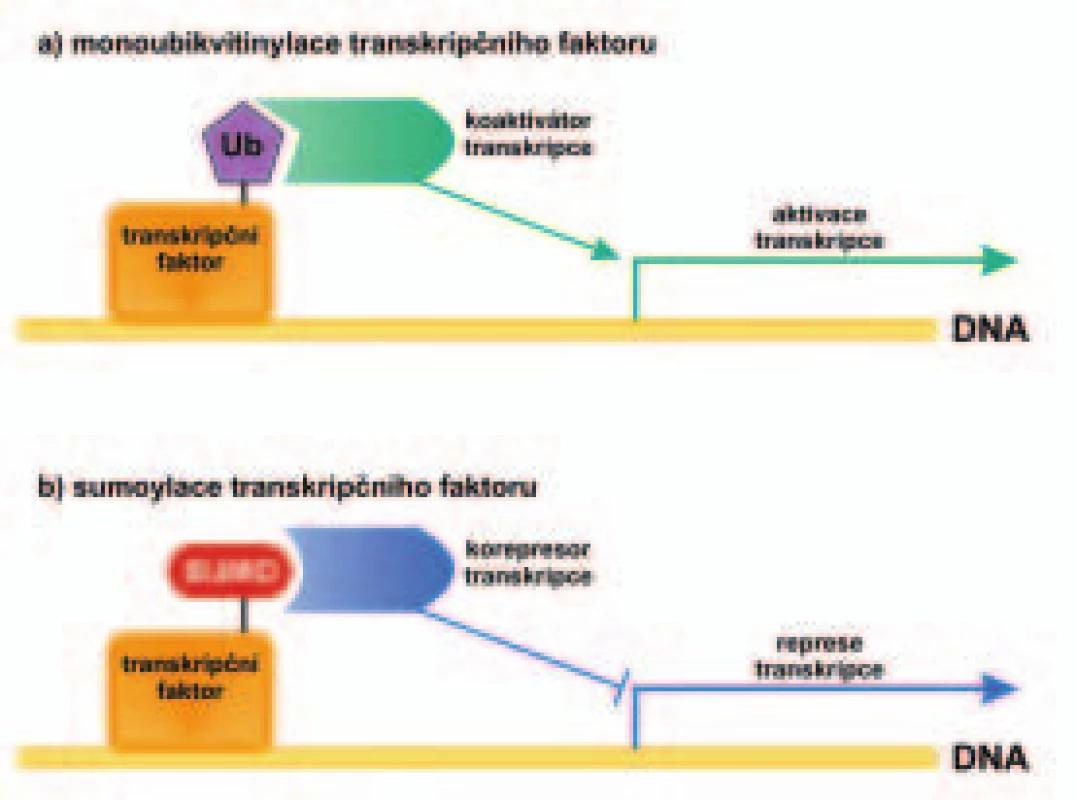
Monoubikvitinylace transkripčního faktoru způsobí vazbu koaktivátoru transkripce a aktivaci transkripce (a), zatímco sumoylace transkripčního faktoru je doprovázena vazbou korepresoru transkripce a inhibicí transkripce (b). Úloha sumoylace v transportu mezi cytoplazmou a jádrem buňky
Objev SUMO-1 je spojen s výzkumem transportu makromolekul do jádra v savčích buňkách. SUMO1 byl poprvé prokázán ve vazbě na cytoplazmatický protein RanGAP1 (protein 1 aktivující GTPázu Ran). Ran („Ras-related nuclear protein“) je proteinem s klíčovou úlohou v transportu mezi cytoplazmou a jádrem a obráceně. Jedná se o protein, který je schopen vázat GDP nebo GTP a cykluje mezi těmito dvěma formami, které určují jeho lokalizaci v cytoplazmě nebo jádře buněk. Ve formě Ran-GTP se většinou vyskytuje v jádře buněk a ve formě Ran-GDP v cytoplazmě buněk. V cytoplazmě je stimulována aktivita GTPázy cytoplazmatickými proteiny RanBP1 a RanBP2 („Ran binding proteins“, viz též kapitola o enzymech zahrnutých v sumoylaci) a dále proteinem RanGAP1. Gradient koncentrací Ran-GTP mezi jádrem buňky a cytoplazmou buňky určuje směr transportu makromolekul [proteinů, RNA a ribonukleoproteinových částic (RNP)] mezi jádrem a cytoplazmou buňky. Proteiny RanGAP1 a RanBP2 jsou sumoylovány a po sumoylaci se stávají součástí komplexu jaderných pórů na cytoplazmatické straně a stimulují přenos makromolekul z cytoplazmy do jádra buněk [1,2,26,27,33-35].
Role sumoylace v transportu iontů přes buněčnou membránu
Nedávno byla popsána i sumoylace membránového proteinu draslíkového kanálu K2P1 [36]. Sumoylace inhibuje funkci tohoto kanálu pro ionty K+ a naopak desumoylace otevře kanál pro specifický a na pH závislý transport iontů K+.
Vliv sumoylace proteinu na funkci proteinu a na jeho umístění v buňce
Sumoylace probíhá v závislosti na cílovém proteinu jak v cytoplazmě, tak i v jádře buněk. Předurčuje buněčnou lokalizaci sumoylovaného proteinu většinou do jádra buněk, např. do jaderných tělísek („nuclear bodies“), o kterých se podrobněji zmíníme níže v souvislosti s akutní promyelocytární leukemií. V jaderných tělíscích se nachází řada sumoylovaných proteinů s důležitými funkcemi. Jedná se o již uvedené proteiny p53 a mdm2, dále o protein Daxx, který účinkuje jako korepresor transkripce a hraje též úlohu v apoptóze. V jaderných tělíscích se nachází i další sumoylované transkripční regulátory lef1 („lymphocyte enhancer factor 1“) a Tcf-4 („T-cell factor-4“). Oba uvedené regulátory transkripce účinkují v signální dráze wnt. Wnt je rodina sekretovaných glykoproteinů, jejichž signální dráha hraje významnou úlohu během embryonálního vývoje a při zvýšené expresi regulátorů této dráhy při tvorbě nádorů.
Vliv sumoylace transkripčních faktorů na transkripci genů
Sumoylace transkripčních faktorů většinou hraje negativní úlohu v regulaci transkripce (obr. 3b). Sumoylace častěji inhibuje aktivitu řady transkripčních faktorů, a to hlavně mechanizmem interakce sumoylovaných transkripčních faktorů s korepresory transkripce [37-39]. Sumoylace má však naopak pozitivní vliv na hladinu a aktivitu faktorů tepelného šoku (HSF1 a HSF2; „heat shock factor“) a na aktivitu transkripčních faktorů Tcf-4 nebo Ikaros [12,40-42]. V posledním uvedeném příkladu nejde o přímé zvýšení aktivity transkripčního faktoru Ikaros, ale o inhibici jeho represe. Transkripční faktory Ikaros jsou důležité při diferenciaci hematopoetických buněk, vývoji a funkci imunitního systému. Vliv sumoylace na transkripci je dále ovlivněn sumoylací koaktivátorů [např. histonacetyltransferázy CBP („cyclic AMP response element binding protein“) a p300] a korepresorů transkripce (histondeacetylázy HDAC1 a HDAC4) [40-44]. Sumoylovaný koaktivátor se chová jako korepresor, např. p300 po sumoylaci váže HDAC6 [43].
Vliv sumoylace histonů na transkripci genů
Sumoylace histonu H4 způsobí vazbu histondeacetylázy HDAC1 a proteinu heterochromatinu 1 k transkribovanému genu. Sumoylace histonu H4 a následující vazba histondeacetylázy a proteinu heterochromatinu 1 k transkribovanému genu vede ke kondenzaci chromatinu, a tím k inhibici transkripce dotyčného genu [45,46,47]. Sumoylace ostatních histonů (H2A, H2B a H3), zahrnutých s histonem H4 v opakující se jednotce chromatinu (nukleozomu) u eukaryont, nebyla zatím prozkoumána.
Úloha sumoylace ve stabilitě genomové DNA a při opravě chybného párování bází a zlomů poškozené DNA
Sumoylace hraje úlohu ve stabilitě genomu a ve správné distribuci chromozomů pro dělení buněk, v opravě chybného párování bází DNA a zlomů poškozené DNA. Řada klíčových proteinů v těchto procesech je sumoylována jako proteiny p53 a mdm2, složky signální dráhy Wnt (β-katenin, lef1, Tcf-4), topoizomeráza II a další [37].
Jaderný antigen proliferujících buněk (PCNA, „proliferating cell nuclear antigen“) je během fáze S buněčného cyklu sumoylován. Sumoylace PCNA však naopak potlačuje schopnost PCNA účinkovat v opravě chybného párování bází DNA a zlomů poškozené DNA. Po poškození DNA UV zářením nebo chemikáliemi je pro opravu DNA nezbytná záměna SUMO navázaného k PCNA za ubikvitin nebo polyubikvitin. PCNA totiž může být na stejném místě sumoylován nebo ubikvitinylován. Zatímco ubikvitinylace PCNA stimuluje jeho aktivitu v opravě poškozené DNA, sumoylace PCNA tuto aktivitu inhibuje [48-50].
Vliv sumoylace proteinů virů na jejich replikaci v buňkách hostitele
Skupina DNA virů, jejichž replikace probíhá výlučně v jádře hostitelské buňky, využívá k replikaci aparát hostitelské buňky. Patří sem papovaviry, herpesviry a adenoviry. Bezprostředně po infekci buňky se virové geny přepisují na mRNA, jejíž translace vede k proteinům rané fáze. Některé z proteinů rané fáze katalyzují replikaci virové DNA a expresi proteinů pozdní fáze, které potom slouží jako stavební kameny virionů.
Sumoylace dvou hlavních proteinů rané fáze (IE1 a IE2, „immediate early“) je nezbytná pro replikační cyklus lidského cytomegaloviru a herpesvirů [51,52]. Také protein BZLF1 („b-zip lytic factor“) je proteinem rané fáze po infekci buňky virem Eppsteina a Barrové (EBV), který patří mezi herpesviry. Protein BZLF1 je sumoylován na lyzinu uvnitř transaktivační oblasti. Zeslabí tím sumoylaci proteinu promyelocytární leukemie (PML), s kterým soutěží o volné SUMO. Inhibice sumoylace PML způsobí rozpad jaderných tělísek a umožní účinnou replikaci EBV [37]. Později na příkladu lidské promyelocytární leukemie ukážeme na význam sumoylace proteinu PML. Řada proteinů adenovirů, nezbytných pro jejich replikaci, je také sumoylována [37]. Většinou tedy sumoylace virových proteinů vede ke stimulaci replikace virů v hostitelských buňkách až na výjimky, jako je tomu u viru HIV-1. Sumoylace proteinu p6 u tohoto viru lidského imunodeficitu brání jeho replikaci [53].
Možné využití inhibice sumoylace v oblasti virů v humánní medicíně
Ptačí adenovir CELO („chicken embryo lethal orphan”) kóduje protein rané fáze, označený Gam1 („Gallus anti morte“). Tento protein je nezbytný pro další replikaci viru v hostitelské buňce. Gam1 je antiapoptotický protein, který nevykazuje žádnou shodu sekvencí se známými proteiny eukaryotických organizmů [54]. Gam1 má další zajímavé funkce, významné u eukaryotických buněk. Je to jednak inhibice histondeacetyláz, enzymů aktivních zejména v nádorových buňkách, jednak schopnost nespecificky inhibovat sumoylaci [55]. Mechanizmus této inhibice je daný interakcí Gam1 s enzymem E1 enzymatické kaskády sumoylace [56]. Gam1 brání aktivaci E1 enzymu (viz obr. 1). Objev proteinu Gam1 bude mít jistě vliv na vývoj nových účinných inhibitorů sumoylace tam, kde sumoylace vede k patologickým následkům.
Sumoylace proteinů v patologii různých chorob
Sumoylace a desumoylace je zahrnuta v širokém spektru buněčných pochodů a dnes se začíná odhalovat účast sumoylace v patologii různých onemocnění. Jde především o neurodegenerativní choroby, například Huntingtonovu chorobu, spinocerebelární ataxii a spinální svalovou atrofii [57-59]. Sumoylace huntingtinu v modelovém pokuse zvýšila jeho neurotoxicitu, zatímco polyubikvitinylace huntingtinu ji snížila. Huntingtin je sumoylací stabilizován a tvoří rozpustné toxické oligomery, které způsobují degeneraci neuronů. Polyubikvitinylace huntingtinu vede naopak k jeho degradaci. Sumoylace proteinů se také podílí na vzniku jaderných inkluzí v neuronech u jiných neurodegenerativních chorob [60] a na tvorbě β-amyloidu z odpovídajícího prekurzorového proteinu u Alzheimerovy choroby [61].
Také antionkogeny a onkogeny jsou často modifikovány sumoylací. Sumoylace proteinu promyelocytární leukemie (PML) hraje úlohu v transportu tohoto proteinu do jádra. PML je umístěn v jaderných tělískách (nuclear bodies) v normálních buňkách [62-64]. PML jaderná tělíska jsou organizované komplexy proteinů včetně proteinu PML, asociované s jadernou matrix. Jejich význam není zatím jasný, uvažuje se o úloze v apoptóze a senescenci buňky. Fúzní protein PML-RARα u promyelocytární leukemie, vzniklý translokací mezi 15. a 17. chromozomem, není sumoylován. Interaguje s volným proteinem PML a způsobí jeho přemístění z jaderných tělísek. V leukemických buňkách pak dochází ke ztrátě celistvosti těchto tělísek a k rozkladu uvolněných proteinů včetně PML v proteazomech. Oxid arzenitý, který je úspěšně používán k léčbě akutní promyelocytární leukemie, indukuje degradaci fúzního proteinu a stimuluje sumoylaci PML, a tím jeho umístění do jaderných tělísek a udržení jejich celistvosti [65].
Lepší pochopení sumoylace a desumoylace přispěje k objasnění patogenetických aspektů některých patologických stavů a podle prvních zpráv lze předpokládat, že dojde i k ovlivnění terapie řady onemocnění.
Neddylace proteinů a její propojení s ubikvitinylací proteinů
Neddylace proteinů je proces, kterým je připojen polypeptid Nedd8 ke konzervativnímu lyzinovému zbytku poblíž C-konce specifické rodiny proteinů, zvaných culliny (vysvětlení tohoto termínu viz dále) [66-69]. Připojení Nedd8 na cullin vyžaduje vstup do několikastupňového enzymatického procesu podobného jako ubikvitinylace a sumoylace, jak ukazuje obr. 4. Enzymatické kaskádě neddylace předchází zkrácení C-konce prekurzoru Nedd8 pomocí specifické izopeptidázy. Enzymy zahrnuté v enzymatickém procesu neddylace se liší od enzymů účastnících se ubikvitinylace nebo sumoylace. Protein Nedd8 je podobný ubikvitinu s asi 60% shodou sekvence aminokyselin, je přítomný hlavně v jádře buňky a patří stejně jako SUMO ke skupině malých polypeptidů podobných ubikvitinu (Ubl), jak bylo výše zmíněno. Neddylované culliny jsou složkou jedné ze skupin E3 ubikvitinylačních enzymů, zvaných ubikvitinligázy (viz kapitola Ubikvitin a ubikvitinylace a obr. 1 v I. části tohoto přehledného referátu). Tyto ubikvitinligázy si specificky vybírají substrát, tedy protein určený k degradaci v proteazomu. Anglické slovo „to cull“, což znamená vybrat, vyhledat, vysvětluje termín culliny. E3 ubikvitinligázy obsahující neddylované culliny rozpoznávají fosforylovaný motiv (fosfodegron), sekvenci obsahující fosforylované seriny nebo fosforylovaný threonin v proteinu určeném k degradaci (např. IκB, inhibitor NFκB, viz I. část referátu).
Image 4. Schéma enzymatické kaskády neddylace a deneddylace. 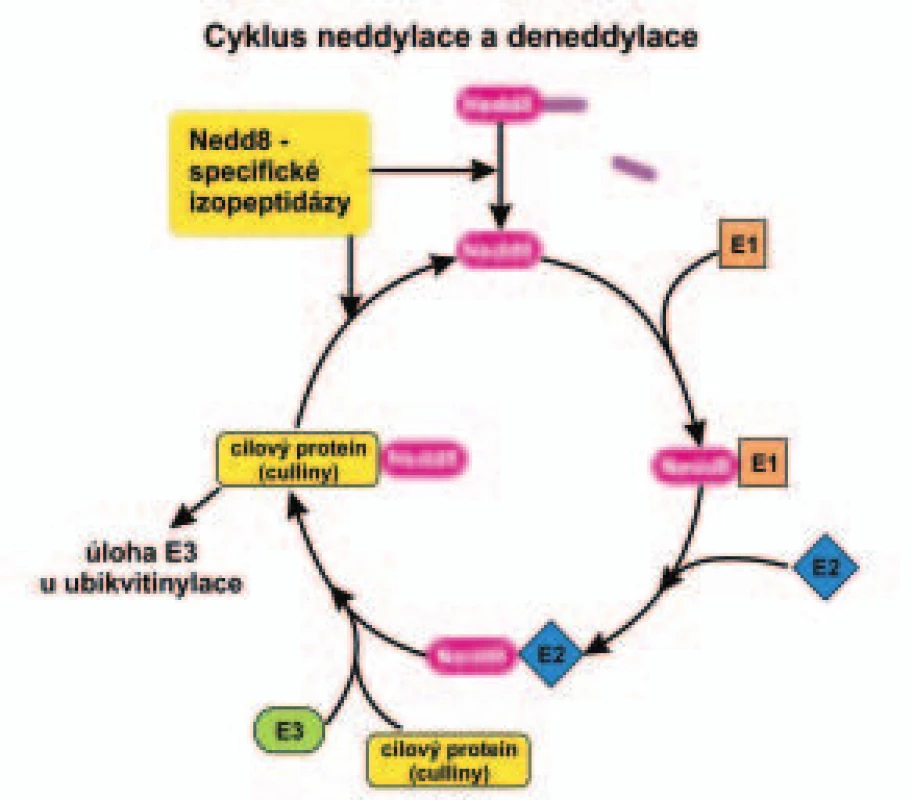
Průběh neddylace a deneddylace cílových proteinů (cullinů) je popsán v textu. Vedle připojení proteinu Nedd8 k substrátu existuje i opačná reakce, a to odstranění Nedd8 z proteinu - deneddylace pomocí multiproteinového komplexu COP9 („constitutive photomorphogenesis“) signalosomu (CSN) s aktivitou izopeptidázy. CSN se strukturou podobá víčku 26S proteazomu [70-72]. Neddylace ubikvitinligáz obsahujících cullin má význam pro ubikvitinylaci a degradaci řady proteinů účastnících se regulace buněčného cyklu [c-myc, cyklin E, inhibitory cdk (cyklin-dependentní kinázy) p21CIP1/WAF1 a p27KIP1 a jiné], diferenciace buněk (Hoxa9; „homeobox A9“), opravy DNA (p53) a přenosu signálu v signálních drahách (β-katenin, IκB, transmembránové receptory Notch) [73-76].
Za patologických okolností (mutace nebo zvýšená exprese E3 enzymů) dochází k nenormální aktivitě ubikvitinligáz obsahujících neddylované culliny. Je to patologický zásah do regulace buněčného cyklu, který hraje důležitou úlohu při vzniku nádorů. Ubikvitinligázy obsahující cullin, a tedy i proces neddylace cullinu budou tedy v budoucnosti vhodným cílem pro terapeutické ovlivnění degradace proteinů v léčbě nádorových onemocnění.
Závěr
Sumoylace a neddylace jsou vedle ubikvitinylace důležitými posttranslačními modifikacemi proteinů. Další výzkum mechanizmu i úlohy těchto modifikací a možností jejich inhibice umožní nové terapeutické přístupy u chorob, u kterých tyto modifikace klíčových proteinů hrají důležitou úlohu. Objevení dalších substrátů, proteinů podléhajících těmto modifikacím, je dnes usnadněno účinnou kombinací metod kapalinové chromatografie za vysokých tlaků (HPLC) a hmotové spektrometrie. Tyto metody a zvláště pro ně nezbytné přístroje byly v posledním období silně zdokonaleny vzhledem k intenzivnímu rozmachu proteomického výzkumu.
Práce vznikla za podpory grantu NC/7605-3 Interní grantové agentury Ministerstva zdravotnictví České republiky, VZ MSM 0021620808 a VZ MZ ČR 00023736.
Ing. Ota Fuchs, CSc.
www.uhkt.cz
e-mail: Ota.Fuchs@uhkt.cz
Doručeno do redakce: 9. 12. 2005
Přijato po recenzi: 26. 1. 2007
Sources
1. Matunis MJ, Coutavas E, Blobel G. A novel ubiquitin-like modification modulates the partitioning of the Ran-GTPase-activating protein RanGAP1 between the cytosol and the nuclear pore complex. J Cell Biol 1996; 135 : 1457-1470.
2. Mahajan R, Delphin C, Guan T et al. A small-ubiquitin related polypeptide involved in targeting Ran-GAP1 to nuclear pore complex protein RanBP2. Cell 1997; 88 : 97-107.
3. Boddy MN, Howe K, Etkin LD et al. PIC1, a novel ubiquitin-like protein which interacts with the PML component of multiprotein complex that is disrupted in acute promyelocytic leukaemia. Oncogene 1996; 13 : 971-982.
4. Okura T, Gong L, Kamitani T et al. Protection against Fas/APO-1 and tumor necrosis factor-mediated cell death by a novel protein, sentrin. J Immunol 1966; 157 : 4277-4281.
5. Mannen H, Tseng HM, Cho CL et al. Cloning and expression of human homolog HSMT3 to yeast SMT3 suppressor of MIF2 mutations in a centromere protein gene. Biochem Biophys Res Commun 1966; 222 : 178-180.
6. Shen Z, Pardington-Purtymun PE, Comeaux JC et al. UBL1, a human ubiquitin-like protein associating with human RAD51/RAD52 proteins. Genomics 1966; 36 : 271-279.
7. Dohmen RJ. SUMO protein modification. Biochim Biophys Acta 2004; 1695 : 113-131.
8. Hilgarth RS, Murphy LA, Skaggs HS et al. Regulation and function of SUMO modification. J Biol Chem 2004; 279 : 53899-53902.
9. Kumar S, Yoshida Y, Noda M. Cloning of a cDNA which encodes a novel ubiquitin-like protein. Biochem Biophys Res Commun 1993; 195 : 393-399.
10. Kamitani T, Kito K, Nguyen HP et al. Characterization of NEDD8, a developmentally down-regulated ubiquitin-like protein. J Biol Chem 1997; 272 : 28557-28562.
11. Saitoh H, Hinchey J. Functional heterogeneity of small ubiquitin-related protein modifiers SUMO-1 versus SUMO-2/3. J Biol Chem 2000; 275 : 6252-6258.
12. Dohmen RJ. SUMO protein modification. Biochim Biophys Acta 2004; 1695 : 113-131.
13. Azuma Y, Arnaoutov A, Dasso M. SUMO-2/3 regulates topoisomerase II in mitosis. J Cell Biol 2003; 163 : 477-487.
14. Bohren KM, Nadkarni V, Song JH et al. A M55V polymorphism in a novel SUMO gene (SUMO-4) differentially activates heat shock transcription factors and is associated with susceptibility to type I diabetes mellitus. J Biol Chem 2004; 279 : 27233-27238.
15. Guo D, Li M, Zhang Y et al. A functional variant of SUMO-4, a new IκBα moldifier, is associated with type 1 diabetes. Nat Genet 2004; 36 : 837-841.
16. Owerbach D, Pina L, Gabbay KH. A 212-kb region on chromosome 6q25 containing TAB2 gene is associated with susceptibility to type 1 diabetes. Diabetes 2004; 53 : 1890-1893.
17. Li M, Guo D, Isales CM et al. SUMO wrestling with type 1 diabetes. J Mol Med 2005; 83 : 504-513.
18. Johnson ES. Protein modification by SUMO. Annu Rev Biochem 2004; 73 : 355-382.
19. Schwartz DC, Hochstrasser M. A superfamily of protein tags: ubiquitin, SUMO and related modifiers. Trends Biochem Sci 2003; 28 : 321-328.
20. Gill G. SUMO and ubiquitin in the nucleus: different functions, similar mechanisms? Genes Dev 2004; 18 : 2046-2059.
21. Hay RT. SUMO: a history of modification. Mol Cell 2005; 18 : 1-12.
22. Melchior F, Schergaut M., Pichler A. SUMO: ligases, isopeptidases and nuclear pores. Trends Biochem Sci 2003; 28 : 612-616.
23. Desterro JM, Thomson J, Hay RT. Ubch9 conjugates SUMO but not ubiquitin. FEBS Lett 1997; 417 : 297-300.
24. Kahyo T, Nishida T, Yasuda H. Involvement of PIAS1 in the sumoylation of tumor suppressor p53. Mol Cell 2001; 8 : 713-718.
25. Sachdev S, Bruhn L, Sieber H et al. PIASy, a nuclear matrix-associated SUMO E3 ligase, represses LEF1 activity by sequestration into nuclear bodies. Genes Dev 2001; 15 : 3088-3103.
26. Pichler A, Gast A, Seeler JS et al. The nucleoporin Ran BP2 has SUMO1 E3 ligase activity. Cell 2002; 108 : 109-120.
27. Pichler A, Knipscheer P, Saitoh H et al. The Ran-BP2 SUMO E3 ligase is neither HECT - nor RING - type. Nat Struct Mol Biol 2004; 11 : 984-991.
28. Kagey MH, Melhuish TA, Powers SE et al. Multiple activities contribute to Pc2 E3 function. EMBO J 2005; 24 : 108-119.
29. Verger A, Perdomo J, Crossley M. Modification with SUMO. A role in transcriptional regulation. EMBO Rep 2003; 48 : 137-142.
30. Hay RT. Protein modification by SUMO. Trends Biochem Sci 2001; 26 : 332-333.
31. Kim KI, Baek SH, Chung CH. Versatile protein tag, SUMO: its enzymology and biological function. J Cell Physiol 2002; 191 : 257-268.
32. Xu Z, Au SWN. Mapping residues of SUMO precursors essential in differential maturation by SUMO-specific protease, SENP1. Biochem J 2005; 386 : 325-330.
33. Stewart M. Nuclear trafficking. Science 2003; 302 : 1513-1514.
34. Fahrenkrog B, Köser J, Aebi U. The nuclear pore complex: a jack of all trades? Trends Biochem Sci 2004; 29 : 175-182.
35. Lee SJ, Matsuura Y, Man Liu S et al. Structural basis for nuclear import complex dissociation by RanGTP. Nature 2005; 435 : 693-696.
36. Rajan S, Plant LD, Rabin ML et al. Sumoylation silences the plasma membrane leak K+ channel K2p1. Cell 2005; 121 : 37-47.
37. Gill G. Post-translational modification by the small ubiquitin-related modifier SUMO has big effects on transcription factor activity.Curr Opin Genet Dev 2003; 13 : 108-113.
38. Verger A, Perdomo J, Crossley M. Modification with SUMO. A role in transcriptional regulation. EMBO Rep 2003; 48 : 137-142.
39. Gill G. Something about SUMO inhibits transcription. Curr Opin Genet Dev 2005; 15 : 1-6.
40. Hilgarth RS, Murphy LA, Skaggs HS et al. Regulation and function of SUMO modification. J Biol Chem 2004; 279 : 53899-53902.
41. Yamamoto H, Ihara M, Matsuura Y et al. Sumoylation is involved in β-catenin-dependent activation of Tcf-4. EMBO J 2003; 22 : 2047-2059.
42. Gomez-del Arco P, Koipally J, Georgopoulos K. Ikaros SUMOylation: switching out of repression. Mol Cell Biol 2005; 25 : 2688-2697.
43. Girdwood D, Bumpass D, Vaughan OA et al. P300 transcriptional repression is mediated by SUMO modification. Mol Cell 2003; 11 : 1043-1054.
44. David G, Neptune MA, DePinho RA. SUMO-1 modification of histone deacetylase 1 (HDAC 1) modulates its biological activities. J Biol Chem 2002; 277 : 23658-23663.
45. Zhang Y. Transcriptional regulation by histone ubiquitination and deubiquitination. Genes Dev 2003; 17 : 2733-2740.
46. Nathan D, Sterner DE, Berger SL. Histone modifications: Now summoning sumoylation. Proc Natl Acad Sci USA 2003; 100 : 13118-13120.
47. Shiio Y, Eisenman RN. Histone sumoylation is associated with transcriptional repression. Proc Natl Acad Sci USA 2003; 100 : 13225-13230.
48. Hoege C, Pfander B, Moldavan GL et al. RAD6-dependent DNA repair is linked to modification of PCNA by ubiquitin and SUMO. Nature 2002; 419 : 135-141.
49. Stelter P, Ulrich HD. Control of spontaneous and damage-induced mutagenesis by SUMO and ubiquitin conjugation. Nature 2003; 425 : 188-191.
50. Papouli E, Chen S, Davies AA et al. Crosstalk between SUMO and ubiquitin on PCNA is mediated by recruitment of the helicase Srs2p. Mol Cell 2005; 19 : 123-133.
51. Nevels M, Brune W, Shenk T. Sumoylation of the human cytomegalovirus 72-kilodalton IE1 protein facilitates expression of the 86-kilodalton IE2 protein and promotes viral replication. J Virol 2004; 78 : 7803-7812.
52. Gravel A, Don V, Cloutier N et al. Characterization of human herpesvirus 6 variant B immediate-early 1 protein modifications by small ubiquitin-related modifiers. J Gen Virol 2004; 85 : 1319-1328.
53. Gurer C, Berthoux L, Luban J. Covalent modification of human immunodeficiency virus type 1 p6 by SUMO-1. J Virol 2005; 79 : 910-917.
54. Glotzer JB, Saltik M, Chiocca S et al. Activation of heat-shock response by an adenovirus is essential for virus replication. Nature 2000; 407 : 207-211.
55. Colombo R, Boggio R, Seiser C et al. The adenovirus protein Gam1 interferes with sumoylation of histone deacetylase 1. EMBO Rep 2002; 3 : 1062-1068.
56. Boggio R, Colombo R, Hay RT et al. A mechanism for inhibiting the SUMO pathway. Mol Cell 2004; 16 : 549-561.
57. Steffan JS, Agrawal N, Pallos J et al. SUMO modification of Huntingtin and Huntington´s disease pathology. Science 2004; 304 : 100-104.
58. Ueda H, Goto J, Hashida J et al. Enhanced SUMOylation in polyglutamine diseases. Biochem Biophys Res Commun 2002; 293 : 307-313.
59. Chan HY, Warrick JM, Andriola I et al. Genetic modulation of polyglutamine toxicity by protein conjugation pathways in Drosophila. Hum Mol Genet 2002; 11 : 2895-2904.
60. Poutney DL, Huang Y, Burns RJ et al. SUMO-1 marks the nuclear inclusions in familial neuronal intranuclear inclusion disease. Exp Neurol 2003; 184 : 436-446.
61. Li Z, Wang H, Wang S et al. Positive and negative regulation of APP amyloidogenesis by sumoylation. Proc Natl Acad Sci USA 2003; 100 : 259-264.
62. Kamitani T, Kito K, Nguyen HP et al. Identification of three major sentinization sites in PML. J Biol Chem 1998; 273 : 26675-26682.
63. Duprez E, Saurin AJ, Desterro JM et al. SUMO-1 modification of the acute promyelocytic leukaemia protein PML: implications for nuclear localisation. J Cell Sci 1999; 112 : 381-393.
64. Zhong S, Muller S, Ronchetti S et al. Role of SUMO-1 modified PML in nuclear body formation. Blood 2000; 95 : 2748-2753.
65. Müller S, Matunis MJ, Dejean A. Conjugation with the ubiquitin-related modifier SUMO-1 regulates the partitioning of PML within the nucleus. EMBO J 1998; 17 : 61-70.
66. Osaka F, Kawasaki H, Aida N et al. A new NEDD8-ligating system for cullin 4A. Genes Dev 1998; 12 : 2263-2268.
67. Morimoto M, Nishida T, Nagayama Y et al. Nedd8 - modification of Cul1 is promoted by Roc1 as a Nedd8-E3 ligase and regulates its stability. Biochem Biophys Res Commun 2003; 301 : 392-398.
68. Pan ZQ, Kentis A, Dias DC et al. Nedd8 on cullin: building an expressway to protein destruction. Oncogene 2004; 23 : 1985-1997.
69. Regulation of cullin-based ubiquitin ligases by the Nedd8/RUB ubiquitin-like proteins. Semin Cell Dev Biol 2004; 15 : 221-229.
70. Wei N, Deng XW. The COP9 signalosome. Annu Rev Cell Dev Biol 2003; 19 : 261-286.
71. Schwechheimer C. The COP9 signalosome (CSN): an evolutionary conserved proteolysis regulator in eukaryotic development. Biochim Biophys Acta 2004; 1695 : 45-54.
72. Min KW, Kwon MJ, Park HS et al. CAND1 enhances deneddylation of CUL1 by COP9 signalosome. Biochem Biopys Res Commun 2005; 334 : 867-874.
73. Ohh M, Kim WZ, Moslehi JJ et al. An intact NEDD8 pathway is required for cullin-dependent ubiquitylation in mammalian cells. EMBO Rep 2002; 3 : 177-182.
74. Guardavaccoro D, Pagano M. Oncogenic aberrations of cullin-dependent ubiquitin ligases. Oncogene 2004; 23 : 2037-2049.
75. Ang XL, Harper JW. SCF-mediated protein degradation and cell cycle control. Oncogene 2005; 24 : 2860-2870.
76. Busino L, Chiesa M, Draetta GF et al. Cdc25A phosphatase: combinatorial phosphorylation, ubiquitylation and proteolysis. Oncogene 2004; 23 : 2050-2056.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 6-
All articles in this issue
- Srovnání plazmatických hladin B-natriuretického peptidu s echokardiografickými ukazateli funkce levé komory srdeční po léčbě doxorubicinem
- Obezita a progrese chronické renální insuficience: česká dlouhodobá prospektivní randomizovaná dvojitě slepá multicentrická studie
- Molekulovo-genetická diagnostika a skríning hereditárnej hemochromatózy
- Jaderné receptory PPARα
- Biologická terapie revmatických onemocnění
- Chronické ochorenie obličiek a gravidita: kazuistika
- Posttransplantační lymfoproliferace u nemocného s intenzivní imunosupresí: kazuistika
-
Doporučený postup pro diagnostiku a léčbu hepatorenálního syndromu
Doporučený postup vypracovaný skupinou pro portální hypertenzi při České hepatologické společnosti České lékařské společnosti J. E. Purkyně a schválený výborem České hepatologické společnosti České lékařské společnosti J. E.Purkyně - Setrvalá monomorfní komorová tachykardie u pacientů se strukturálním postižením srdce. Různé arytmogenní substráty, různé možnosti paliativní nebo kurativní léčby katetrovou ablací v éře trojrozměrného mapování
- Prevalence a příčiny refluxu v hlubokém žilním systému dolních končetin s insuficiencí povrchových žil
- Trimetazidin v léčbě stabilní anginy pectoris. TRIADA - (TRImetazidine in stable Angina twice DAily)
- Význam endokanabinoidního systému v modulaci kardiometabolických rizikových faktorů
-
Ubikvitiny, proteazomy, sumoylace a použití dnes a zítra v terapii nádorů i jiných chorob II.
Sumoylace a neddylace jako posttranslační modifikace proteinů podobné ubikvitinylaci a jejich význam
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaderné receptory PPARα
- Prevalence a příčiny refluxu v hlubokém žilním systému dolních končetin s insuficiencí povrchových žil
- Setrvalá monomorfní komorová tachykardie u pacientů se strukturálním postižením srdce. Různé arytmogenní substráty, různé možnosti paliativní nebo kurativní léčby katetrovou ablací v éře trojrozměrného mapování
- Molekulovo-genetická diagnostika a skríning hereditárnej hemochromatózy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

