-
Medical journals
- Career
Testosteron v léčbě svalové slabosti
Authors: L. Stárka
Authors‘ workplace: Endokrinologický ústav, Praha, ředitel doc. MUDr. Vojtěch Hainer, CSc.
Published in: Vnitř Lék 2006; 52(10): 909-911
Category: Review
Overview
Testosteron zvyšuje svalovou hmotu a snižuje tukovou hmotu mechanizmem působení přes androgenní receptory. Testosteron indukuje hypertrofii svalových vláken a zvyšuje počet satelitních buněk. Vyvolává také diferenciaci mezenchymových kmenových buněk směrem myogenní linie a inhibuje diferenciaci na adipogenní linii. Metaanalýza klinických studií poskytuje důkaz, že léčba testosteronem zvyšuje v závislosti na dávce hmotu kosterního svalstva, a do jisté míry i svalovou sílu. Nejčastějším nežádoucím účinkem podávání testosteronu stárnoucím mužům je vzestup hematokritu a zvršené riziko změn na prostatě.
Klíčová slova:
testosteron - svalová hmota - svalová síla - nežádoucí účinky - sarkopenieÚvod
Poznatky o použití anabolik jako dopingu v různých sportovních disciplinách mohou vést k přesvědčení, že pro zlepšení svalové síly a zvýšení svalové hmoty jsou androgenně-anabolické steroidy významným pomocníkem. V těchto případech jsou však většinou androgeny užívány ve výrazně suprafyziologických dávkách a popis jejich účinků obvykle nevychází ze studií, které by splňovaly všechna potřebná kritéria pro medicínu založenou na důkazech.
Předpokládá se, že suplementace testosteronem může upravit alespoň částečně libido, vazomotorické a neurovegetativní příznaky, zlepšit některé parametry známé jako rizikové faktory onemocnění kardiovaskulárního systému, ale za hlavní důvod androgenní terapie je zřejmě nutno považovat zlepšení svalové síly, poměru tukové a netukové tělesné hmoty, prevenci nebo léčbu osteoporózy a zlepšování paměti, nálady a pocitu pohody [1,3,12].
Jak to vypadá ve skutečnosti s efektem testosteronu nebo blízkých androgenů používaných v léčbě sarkopenie spojené se stárnutím nebo při léčbě svalové slabosti při chronických onemocněních, jako je HIV infekce, chronická obstrukční plicní onemocnění, konečná stadia nefropatií nebo nádorových onemocnění, je obtížné odvodit z letmého nahlédnutí do současné literatury zabývající se touto otázkou. Přesnější informaci přináší metaanlýza, kterou provedl Bhasin et al [3,4].
Mechanizmus působení testosteronu na sval
Testosteron vyvolává hypertrofii svalových vláken I. i II. typu a zvyšuje počet jader ve svalových vláknech a satelitních buňkách mezenchymového původu [10,11]. Testosteron podporuje diferenciaci mezenchymových multipotentních kmenových buněk na buňky myogenní linie a inhibuje jejich diferenciaci na adipogenní linii [2,8]. Buněčný mechanizmus působení androgenů na tyto organizační změny vychází z vazby androgenů na androgenní receptor umožňující další vazbu androgenního receptoru na β-katenin. Translokace komplexu androgenního receptoru s kateninem aktivuje transkripční faktor 4 (TCF-4), který řídí celou řadu wnt-genů, které jsou právě těmi řídícími faktory, které rozhodují o myogenní diferenciaci resp. inhibici adipogenní diferenciace [9]. Dalším účinkem testosteronu je také inhibice diferenciace preadipocytů na adipocyty. Tyto mechanizmy na molekulární úrovni blokují některé antiandrogeny, jako např. bikalutamid.
Testosteron v konečném výsledku zvyšuje proteosyntézu ve svalu a využití volných aminokyselin pro ni, je tedy přirozeným anabolikem.
Pro myotrofní působení testosteronu není zřejmě potřebná jeho konverze na dihydrotestosteron působením steroidní 5-α-reduktázy. Svědčí pro to skutečnost, že jedinci s vrozenou nedostatečností tohoto enzymu (syndrom Imperato-McGinleyové) mají normální vývoj svalstva. Na druhé straně bude asi hrát roli aromatizace testosteronu na estrogeny, protože jak experimentální zvířata, tak lidé s chyběním genu pro aromatázu mají vyšší tukovou a nižší svalovou hmotu.
Účinky léčebného podávání testosteronu
Bhasin et al [4] shrnuli výsledky randomizovaných kontrolovaných studií, které trvaly déle než 3 měsíce a byly uveřejněny na Medline a PubMed. Testosteron byl podáván v obvyklých dávkách. Studie se poněkud lišily v inkluzních kritériích, vstupních hladinách androgenů, dávce androgenu, trvání studie a metodách pro měření výsledků. Přesto však přehled dává poměrně dobrý pohled na to, co můžeme očekávat od testosteronové terapie ve smyslu změn tělesného složení a zlepšení svalového aparátu. Výsledky této metaanalýzy byly vybrány z uvedených prací a jsou shrnuty v tab. 1.
Table 1. Výsledky meta-analýzy účinku testosteronu proti placebu na tělesné složení a svalový aparát. 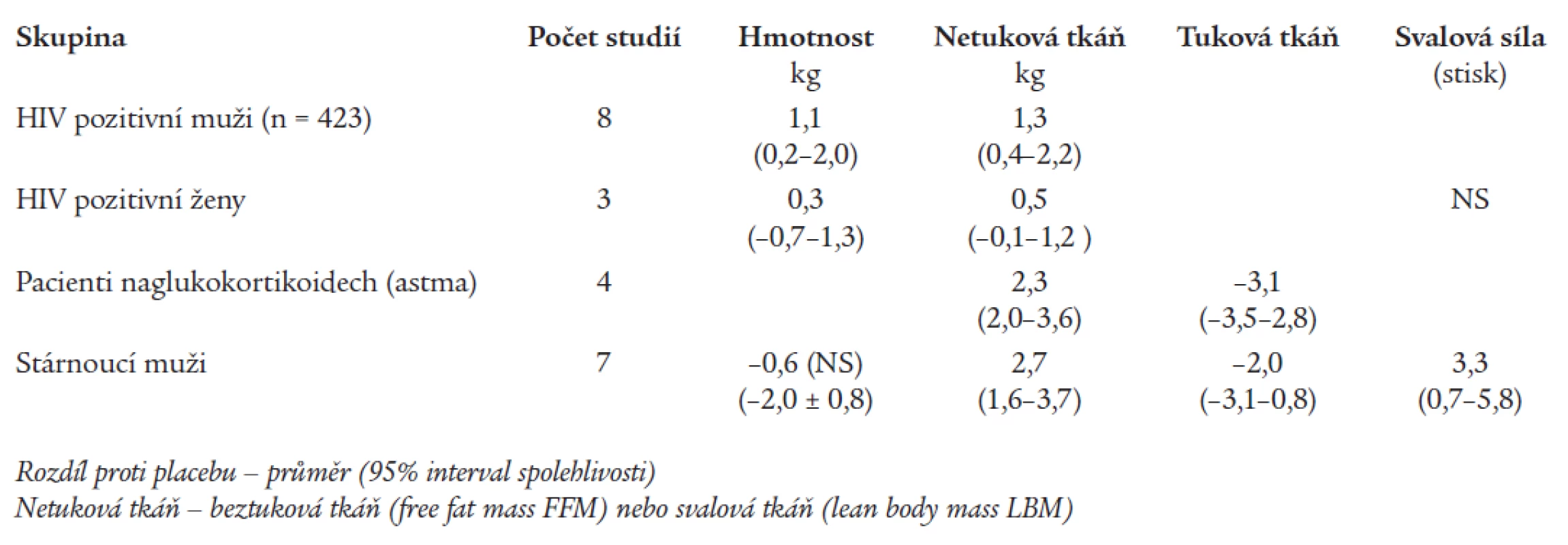
Metaanalýza prokázala příznivý účinek testosteronu na tělesné složení zvýšením obsahu svalové hmoty a snížením tukové hmoty. To se do jisté míry projevuje i na méně zřetelném zvýšení svalové síly. Účinek však není příliš dramatický a svou velikostí nijak nepřekračuje efekt intenzivnějšího fyzického cvičení.
Větší počet studií bylo možno použít na vyhodnocení výskytu nežádoucích účinků testosteronové terapie u mužů středního věku a starších mužů. Calofová et al [5] provedla metaanalýzu 19 studií a výsledky jsou uvedeny v tab. 2. Jediným signifikantním rozdílem se vyznačoval hematokrit. U mužů léčených testosteronem bylo také provedeno více biopsií prostaty, důvody však lze hledat také v jiných faktorech, než je vlastní hormonální terapie.
Table 2. Relativní riziko podávání testosteronu u mužů středního a vyššího věku. Počet případů na 1 000 mužů; pravděpodobnostní poměr = odds ratio. 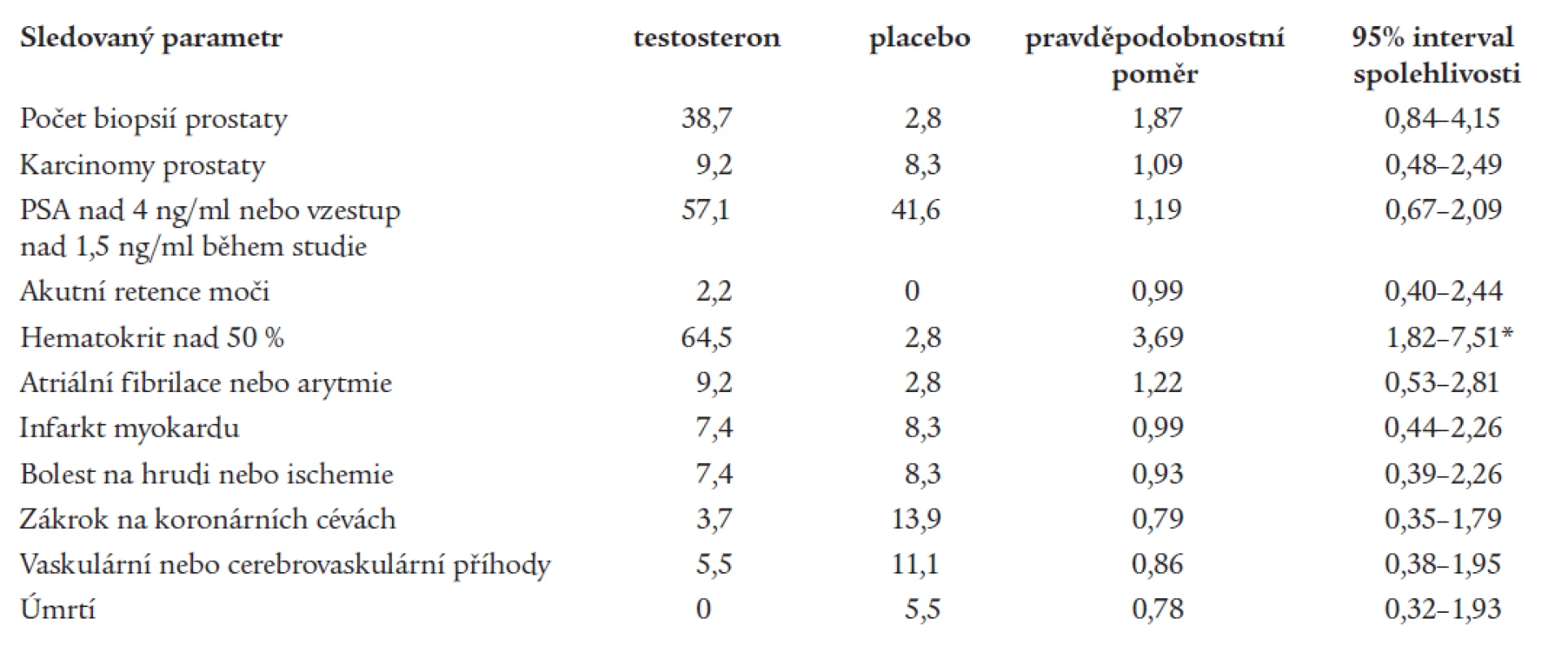
Léčba sarkopenie testosteronem má své racionální zdůvodnění, ale jednoznačná kritéria pro podávání testosteronu dosud vypracována a odsouhlasena nebyla. Dosavadní studie ukazují, že trofické účinky testosteronu u starších mužů, zejména u těch, u kterých se prokazuje hypogonadizmus s pozdním nástupem, mají příznivý účinek na zmírnění sarkopenie, ale zatím nejvhodnější intervenční metodou na jejich zvýšení svalové hmoty a síly je silový fyzický trénink [6,7]. Anabolická léčba má jistě své opodstatnění v některých situacích, z nichž nejčastější je právě vyšší věk. U starších mužů však je stále předmětem námitek výskyt nežádoucích účinků. Z nich zvýšení hematokritu nad žádoucí úroveň lze jistě snadno korigovat snížením dávky testosteronu, zůstávají však rozpaky nad možným vlivem na hypertrofii nebo karcinom prostaty. Snad lze v tomto směru očekávat bezpečnější léčbu s vývojem selektivních modulátorů androgenních receptorů [4].
Poděkování
Studie vznikla za podpory projektu IGA č. NR/8525-5.
prof. MUDr. RNDr. Luboslav Stárka, DrSc.
www.endo.cz
e-mail: lstarka@endo.cz
Doručeno do redakce: 1. 6. 2006
Sources
1. Basaria S, Dobs A. Andropause: to treat or not to treat? J Endocrinol Invest 2003; 26 : 693-697.
2 Bhasin S, Taylor WE, Singh RL et al. The mechanismus of androgen effects on body composition: mesenchymal pluripotent cell as the target of androgen action. J Gerontol A Biol Sci Med Sci 2003; 58: M1103-M1110.
3. Bhasin S. Regulation of body composition by androgens. J Endocrinol Invest 2003; 26 : 814-822.
4. Bhasin S, Calof OM, Storer TW et al. Drug insight: testosterone and selective androgen receptor modulators as anabolic therapies for chronic illness and aging. Nature Clin Pract Endcor Metab 2006; 2 : 146-159.
5. Calof OM, Singh AB, Lee MI et al. Adverse events associted with testosterone replacement in middle-aged and older men: a meta-analysis of randomized, placebo-controlled trials. J Gerontol A Biol Med Sci 2005; 60 : 1451-1457.
6. Chaloupka V, Elbl L, Nehyba S. Silový trénink u nemocných po infarktu myokardu. Vnitř Lék 2000; 46 : 829-838.
7. Kamel HK. Sarcopenia and aging. Nutr Rev 2003; 61 : 157-167.
8. Singh R, Artraza JW, Taylor WE et al. Androgens stimulate myogenic differentiation and inhibit adipogenesis in C3H 10T1/2 pluripotent cells through an androgen receptor-mediated pathway. Endocrinology 2003; 144 : 5081-5088.
9. Singh R, Artraza JW, Taylor WE et al. Testosterone inhibits adipogenic differentiation in 3T3-L1 cells. Nuclear translocation of androgen receptor complex with β-catenin and TCF4 may bypass canonical Wnt signaling to downregulate adipogenics transcription factors. Endocrinology 2006; 147 : 141-154.
10. Sinha-Hikim I, Artraza J, Woodhouse L et al. Testosterone-induced increase in muscle size in healthy young men is associated with muscle fiber hypertrophy. Am J Physiol Endocrinol Metab 2002; 283: E154-E164.
11. Sinha-Hikim I, Roth SM, Lee MI et al. Testosterone-induced muscle hypertrophy is associated with an increase in satellite cell number in healthy, young men. Am J Physiol Endocrinol Metab 2003; 285: E197-E205.
12. Stárka LCo lze očekávat od léčby andropauzy testosteronem? DMEV 2004; 7(Suppl 2): 49-52.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2006 Issue 10-
All articles in this issue
-
Změny v zásobení jodem české dospělé populace po eradikaci jodového deficitu a jejich příčiny
Randomizovaná studie dospělé populace dvou regionů České republiky s odstupem 5 let - Tyreoidální autoimunita u dospělých diabetiků 1. typu. Vlastní zkušenosti z 11letého sledování
- Jod a tyreoidální hormony
- Autoimunitní tyreoiditida: vybrané etiopatogenetické mechanizmy
- Mechanizmus vnútrobunkového pôsobenia hormónov štítnej žľazy
- Hormonální poruchy po úrazu mozku
- Hashimotova encefalopatie
- Kongenitální adrenální hyperplazie na podkladě deficitu 3-β-hydroxysteroidní dehydrogenázy
- Subklinické tyreopatie
- Radionuklidové zobrazovací metody používané v endokrinologii
- Přirozené antiglukokortikoidy
- Příspěvek k diskusi o vzájemném vztahu mezi onemocněním mléčné a štítné žlázy
- Testosteron v léčbě svalové slabosti
- Nádory štítné žlázy a Hirschsprungova choroba: desetileté zkušenosti s molekulárně genetickou diagnostikou RET proto-onkogenu
-
Změny v zásobení jodem české dospělé populace po eradikaci jodového deficitu a jejich příčiny
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Hashimotova encefalopatie
- Radionuklidové zobrazovací metody používané v endokrinologii
- Kongenitální adrenální hyperplazie na podkladě deficitu 3-β-hydroxysteroidní dehydrogenázy
- Autoimunitní tyreoiditida: vybrané etiopatogenetické mechanizmy
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

