-
Medical journals
- Career
Zánětlivá onemocnění močových cest v geriatrické populaci
Authors: M. Fedorko; D. Pacík
Published in: Geriatrie a Gerontologie 2015, 4, č. 4: 181-186
Category: Review Article
Overview
Infekce močových cest jsou v populaci starších pacientů časté. Výskyt bakteriurie se zvyšuje se zvyšujícím se věkem, většinou se však jedná o asymptomatickou bakteriurii, která nevyžaduje léčbu. Specifikem geriatrické populace je četná skupina pacientů umístěných v zařízeních dlouhodobé péče a pacientů s katetrizací močového měchýře. Stanovení diagnózy symptomatické infekce, která vyžaduje antibiotickou léčbu, může být v této populaci obtížné a vede často k nadměrnému užívání antibiotik. Článek přináší přehledné informace o terminologii, diagnostice a léčbě jednotlivých typů infekcí močových cest u starších pacientů obou pohlaví. Uvedené léčebné režimy a způsoby prevence odkazují na platná doporučení odborných společností.
Klíčová slova:
asymptomatická bakteriurie – infekce močových cest – starší pacientiÚvod
Infekce močových cest (IMC) jsou jedny z nejčastěji diagnostikovaných infekcí geriatrické populace. Výskyt komunitních infekcí se mění v závislosti na věku a pohlaví, údaje jsou do značné míry ovlivněny i různými definicemi symptomatické IMC. Po infekcích dolních cest dýchacích jsou druhou nejčastější příčinou hospitalizace pro infekční onemocnění(1) a tvoří 5 % všech akutních ošetření v rámci pohotovosti u pacientů nad 65 let(2). V zařízeních dlouhodobé péče tvoří IMC 30–40 % všech infekcí(3). Prevalence IMC u žen starších 65 let během 6měsíčního období je 16,5 %, u žen starších 85 let má až 30 % alespoň jednu IMC během 12 měsíců(4, 5). Bakteriurie se vyskytuje u 15–20 % žen ve věku 65–70 let a 20–50 % žen starších 80 let, ve většině případů se jedná o tzv. asymptomatickou bakteriurii(6). Infekce močových cest u mužů vznikají prakticky vždy na podkladě komplikujícího faktoru, jakým je zbytnění prostaty či instrumentace v močových cestách, jejich výskyt tedy s věkem rovněž narůstá, u pacientů starších 65, 75 a 85 let je roční incidence IMC 5,3, resp. 6,7, resp. 7,7 případu na 100 tis. jedinců (celkově v mužské populaci 2,3 na 100 tis.)(7).
Rizikové faktory vzniku IMC u starších žen
Je známo několik rizikových faktorů uplatňujících se při vzniku a recidivách IMC u premenopauzálních žen, jako jsou sexuální aktivita, používání spermicidních látek, předchozí IMC, IMC v dětství, pozitivní rodinná anamnéza (matka) či nonsekrece antigenů krevních skupin do tělních tekutin(8). U postmenopauzálních žen se uplatňují nedostatek estrogenů, močová inkontinence, cystokéla, postmikční reziduum, nonsekrece antigenů krevních skupin, předchozí IMC, urogenitální operace. Ani v této kategorii nelze opomenout pohlavní styk(9). U starších žen umístěných v zařízeních dlouhodobé péče jsou nejdůležitějšími faktory katetrizace močového měchýře a zhoršený funkční a mentální stav (tab. 1). Snížení ovariální sekrece estrogenů po menopauze je často spojeno s rozvojem atrofie vaginální sliznice, která se klinicky manifestuje poševní suchostí, svěděním, dyspareunií a močovou inkontinencí, což může imitovat infekci močových cest. Estrogeny stimulují proliferaci laktobacilů v poševním epitelu, snižují pH pochvy a brání tak vaginální kolonizaci střevními patogeny, které jsou hlavními původci IMC. Pokles hladin estrogenu tak vede ke zvýšení rizika ascendentní IMC (obr. 1). Dalším důsledkem poklesu estrogenů je oslabení závěsného aparátu pánevního dna a vznik prolapsů pánevních orgánů, přičemž cystokéla je prokázaným rizikovým faktorem pro vznik IMC.
Table 1. Rizikové faktory pro vznik IMC u žen v závislosti na věku (10) 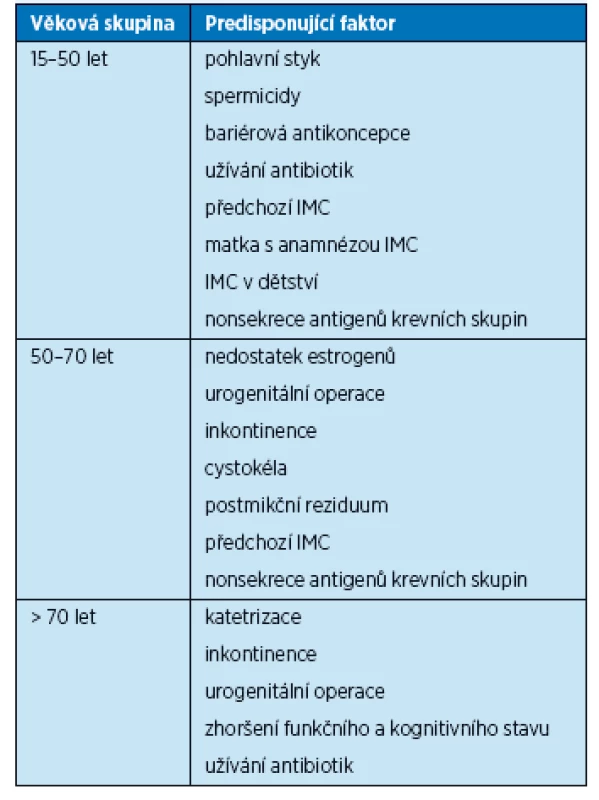
Image 1. Vztah mezi poklesem estrogenů a vznikem infekce močových cest 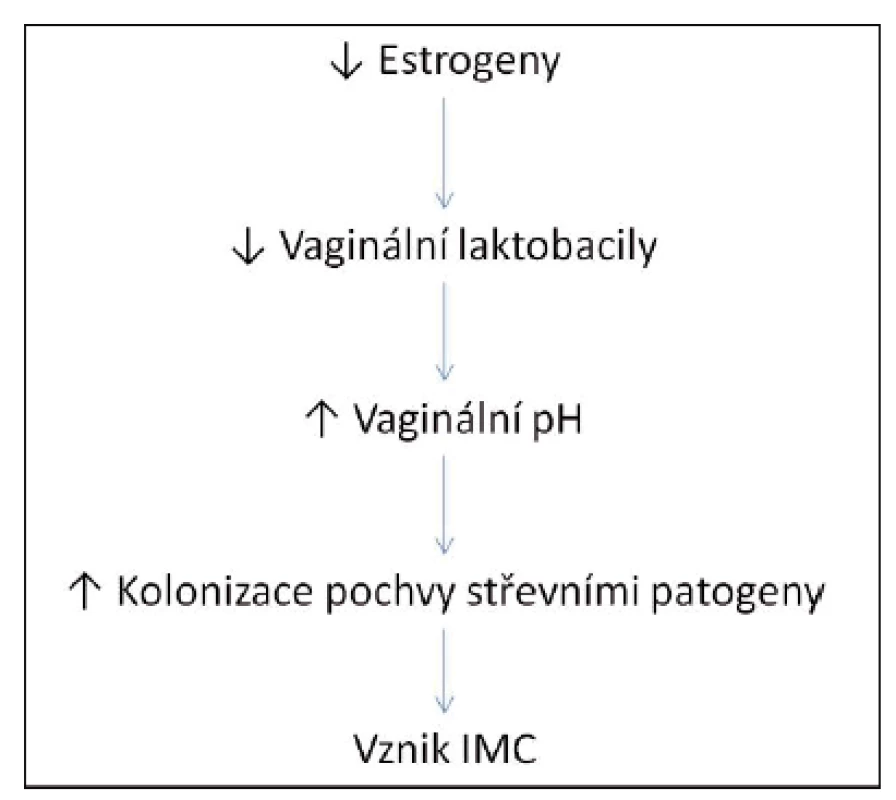
Rizikové faktory vzniku IMC u starších mužů
Výrazně nižší incidence IMC u mužů je vysvětlována větší vzdáleností ústí uretry a análního otvoru než u žen, delší uretrou, sušším prostředím zevního ústí uretry i antibakteriálními účinky prostatického sekretu(11). Prostatický specifický antigen (PSA) přispívá k vyplavování, ale i samotnému usmrcení Escherichia coli a má tak obranný vliv vůči IMC, vyšší hladiny PSA jsou z hlediska recidivujících IMC u mužů protektivní(12). Hlavním rizikovým faktorem pro vznik IMC u starší mužské populace je nedostatečné vyprazdňování močového měchýře vedoucí k postmikčnímu reziduu. Nejčastější příčinou je benigní hyperplazie prostaty(13). Nehledě na to, že muži po 50. roce života (s genetickou zátěží již po 45. roce) by měli být urologicky vyšetřeni v rámci časné detekce karcinomu prostaty(14), zjištění infekce močových cest u předtím urologicky nesledovaného pacienta je pak zcela jistě důvodem k urologickému vyšetření. Dalším důležitým rizikovým faktorem jsou urologické intervenční výkony, zejména biopsie prostaty, u kterých je globálně pozorován nárůst infekčních komplikací, hlavně kvůli stoupající rezistenci Escherichia coli na fluorochinolony(11).
Spektrum patogenů
Eschericha coli (E. coli) je nejčastějším původcem IMC v geriatrické populaci. U komunitních infekcí tvoří 75–82 % IMC, dalšími patogeny jsou Klebsiella spp., Proteus spp. a Enterococcus spp.(4). V zařízeních dlouhodobé péče je E. coli identifikována ve více než 50 % případů, jiné gramnegativní bakterie (Proteus, Klebsiella, Providentia) asi v 1/3 případů, grampozitivní bakterie (Enterococcus, Staphylococcus) se vyskytují do 10 %(15).
Klasifikace IMC
IMC lze klasifikovat na základě jejich lokalizace, stupně závažnosti, přítomnosti rizikových faktorů nebo mikrobiálních nálezů. Z klinického hlediska je důležité rozlišení komplikovaných a nekomplikovaných infekcí. Za nekomplikované IMC považujeme sporadické nebo rekurentní epizody akutní cystitidy nebo akutní pyelonefritidy u jinak zdravých jedinců. Komplikované infekce jsou spojeny se stavem (jako je funkční nebo strukturální abnormalita urogenitálního traktu) nebo onemocněním, které zvyšují riziko vážnějších následků infekce nebo selhání léčby(16). Tyto stavy jsou shrnuty v tabulce 2.
Table 2. Stavy a onemocnění podmiňující komplikované IMC 
Stanovení diagnózy IMC
Diagnóza infekce močových cest vyžaduje splnění těchto základních kritérií:
- klinické příznaky
- výsledky laboratorních vyšetření (krev, moč, prostatický sekret)
- potvrzení přítomnosti mikroorganismu kultivací nebo jiným speciálním vyšetřením.
- Počet bakterií je relevantním faktorem pro diagnózu IMC, ačkoli nelze stanovit fixní počet, který by byl použitelný u všech infekcí a za jakýchkoli okolností. Za klinicky relevantní (signifikantní) bakteriurii jsou považovány tyto nálezy:
- ≥ 103 cfu/ml uropatogenů ve středním proudu moči (SPM) u ženy s akutní nekomplikovanou cystitidou
- ≥ 104 cfu/ml uropatogenů ve SPM u ženy s akutní nekomplikovanou pyelonefritidou
- ≥ 105 cfu/ml uropatogenů ve SPM nebo ≥ 104 cfu/ml v cévkované moči u ženy s komplikovanou IMC
- ≥ 104 cfu/ml ve SPM u muže s komplikovanou IMC
- jakýkoli počet bakterií v moči získané suprapubickou punkcí močového měchýře.
Asymptomatická bakteriurie
Asymptomatická bakteriurie (ABU) je definovaná jako přítomnost > 105 cfu/ml bakterií ve dvou vzorcích MSU u ženy nebo v jednom vzorku moči u muže, přičemž daná osoba nemá příznaky onemocnění dolních močových cest(16). U mladých lidí je neobvyklá (s výjimkou gravidity), její prevalence se u obou pohlaví zvyšuje se zvyšujícím se věkem – u žen starších 60 let je 6–10 %, u mužů starších 65 let přibližně 5 %. U institucionalizovaných starších jedinců dosahuje dokonce 25–50 % u žen a 15–35 % u mužů(17). Zvýšená náchylnost seniorů k ABU je vysvětlována kromě poklesu estrogenů u žen i sníženou baktericidní aktivitou prostatického sekretu u mužů, různými komorbiditami (zejména diabetem mellitem, je-li komplikován autonomní neuropatií a neurogenní dysfunkcí močového měchýře) nebo inkontinencí moči a stolice(18). ABU nevede k renálnímu poškození a je prokázáno, že může bránit superinfekci symptomatickou IMC, a ATB léčba tedy kromě rizika vzniku rezistence může vést k eradikaci potenciálně protektivního kmene(19). Screening ani léčba ABU se u starších pacientů nedoporučují(16). Výjimkou jsou pacienti, kteří mají podstoupit operační výkon na močových cestách. Přítomnost bakteriurie je v tomto případě rizikovým faktorem (mění čistou kontaminovanou operaci na kontaminovanou) a předoperační kultivace a následně eradikace bakteriurie je nutností. Samotný režim léčby se neliší od léčby symptomatických infekcí. Problémem pacientů v zařízeních dlouhodobé péče je obtížná diferenciální diagnostika symptomatických infekcí kvůli signifikantním komorbiditám, zhoršené schopnosti komunikovat a atypickým či nespecifickým příznakům(20). Odlišení ABU a symptomatické IMC je proto mnohdy obtížné. Ačkoli existují kritéria pro zahájení ATB léčby (tab. 3) a jsou široce akceptována(21), problémem je slabá adherence zařízení k těmto doporučením. Konkrétně lze uvést studii ze čtyř pečovatelských domovů v okolí Texasu, která prokázala až v 80 % preskripci antibiotik u katetrizovaných pacientů kvůli ABU a u pacientů bez katétru až 50 % předpisů bez dokumentovaných příznaků IMC(22).
Table 3. Minimální kritéria pro zahájení antibiotické léčby u rezidentů bez močového katétru podle Loeba (21) 
U pacientů s nespecifickými příznaky je právě pro problematickou identifikaci pacientů, kteří by měli dostat antibiotika, často volena empirická léčba. Jednou z možností, jak se vyhnout nadměrné preskripci antibiotik, může být v těchto případech hydratace pacientky (uvedená studie byla provedena na ženách) a odložení ATB léčby do došetření stavu (vyšetření moči, mikroskopie, případně kultivace). Více než polovina pacientek, které zvolily tuto strategii, nemusela užívat ATB ani po týdnu, u 71 % došlo ke zlepšení příznaků. U žádné z 51 žen nedošlo k rozvoji pyelonefritidy(23).
Léčba nekomplikovaných IMC
Terapie nekomplikovaných infekcí močových cest (akutní cystitida, akutní pyelonefritida) je obdobná jako u premenopauzálních žen. Krátkodobé antibiotické režimy u starších žen však nejsou ve studiích tak dobře zdokumentovány jako u mladších žen, a zejména u části pacientů ve špatném celkovém stavu a se signifikantními komorbiditami je tendence k prolongované léčbě jako u komplikovaných infekcí. Kvůli vyššímu výskytu renální insuficience různého stupně v geriatrické populaci je častěji nutná úprava dávkování(24). Režimy vhodné pro léčbu starších pacientů jsou uvedeny v tabulce 4. Prodlužování léčby (> 7 dnů) u mužů s IMC se nejeví jako opodstatněné, v rozsáhlé studii (více než 30 tisíc případů) na válečných veteránech s průměrným věkem 67,9 let nebyl mezi skupinou s ATB ≤ 7 dnů a skupinou s ATB 7–14 dnů prokázán rozdíl ve výskytu časné nebo pozdní recidivy IMC (25).
Table 4. Doporučení pro léčbu cystitidy (16). Upraveno podle dostupnosti v ČR 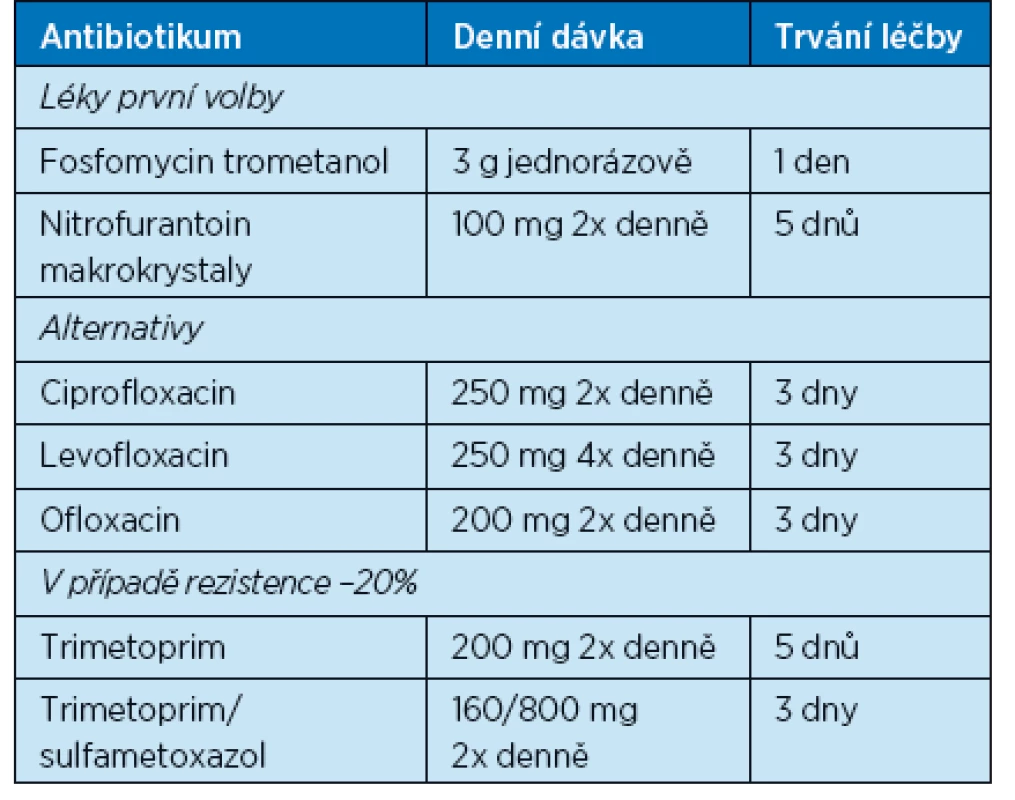
Nekomplikované pyelonefritidy s mírným nebo středně závažným klinickým průběhem lze léčit perorálními režimy léčby (tab. 5). V případě závažnějšího průběhu probíhá léčba za hospitalizace, iniciálně parenterálními ATB, doporučené režimy zahrnují ciprofloxacin a levofloxacin, dále cefalosporiny 3. generace, amoksiklav, piperacilin/tazobaktam, aminoglykosidy, ertapenem, imipenem nebo meropenem. V případě zlepšení stavu léčba pokračuje perorálně, celková doba je 1–2 týdny.
Table 5. Možnosti perorální léčby nekomplikované pyelonefritidy (16) 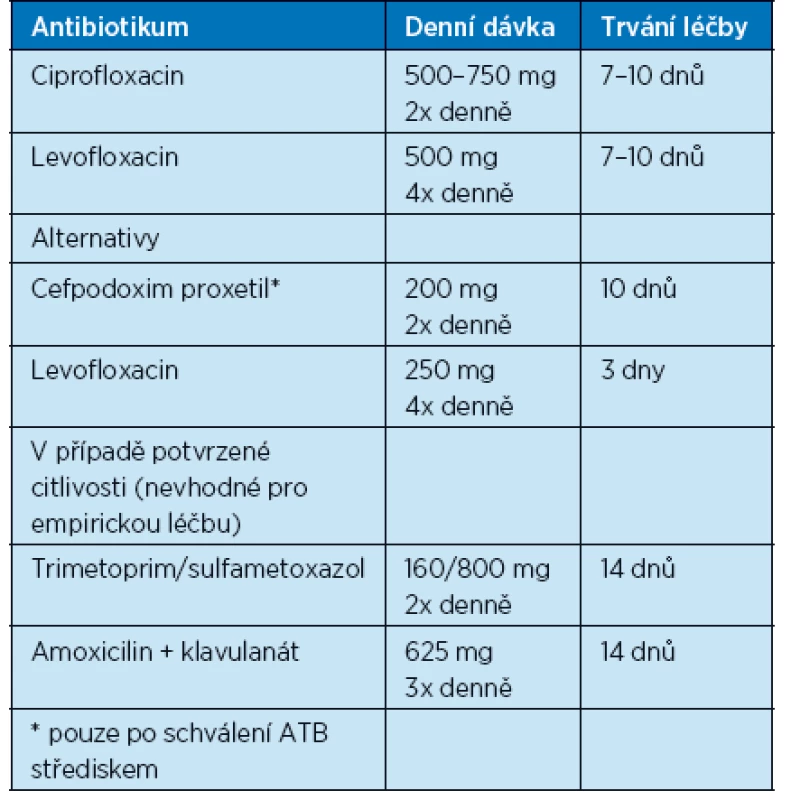
Léčba komplikovaných infekcí
Jakmile je to možné, měla by být empirická léčba nahrazena léčbou cílenou, proto musí být vzorek moči na kultivaci odebrán ještě před zahájením léčby. Empirická léčba musí zohledňovat stav rezistence v dané lokalitě. Délky léčby je obvykle 7–14 dnů, v závislosti na klinické situaci až 21 dnů. Antibiotika pro empirickou léčbu komplikovaných IMC jsou uvedena v tabulce 6.
Table 6. Antibiotika pro empirickou léčbu komplikovaných IMC (16) 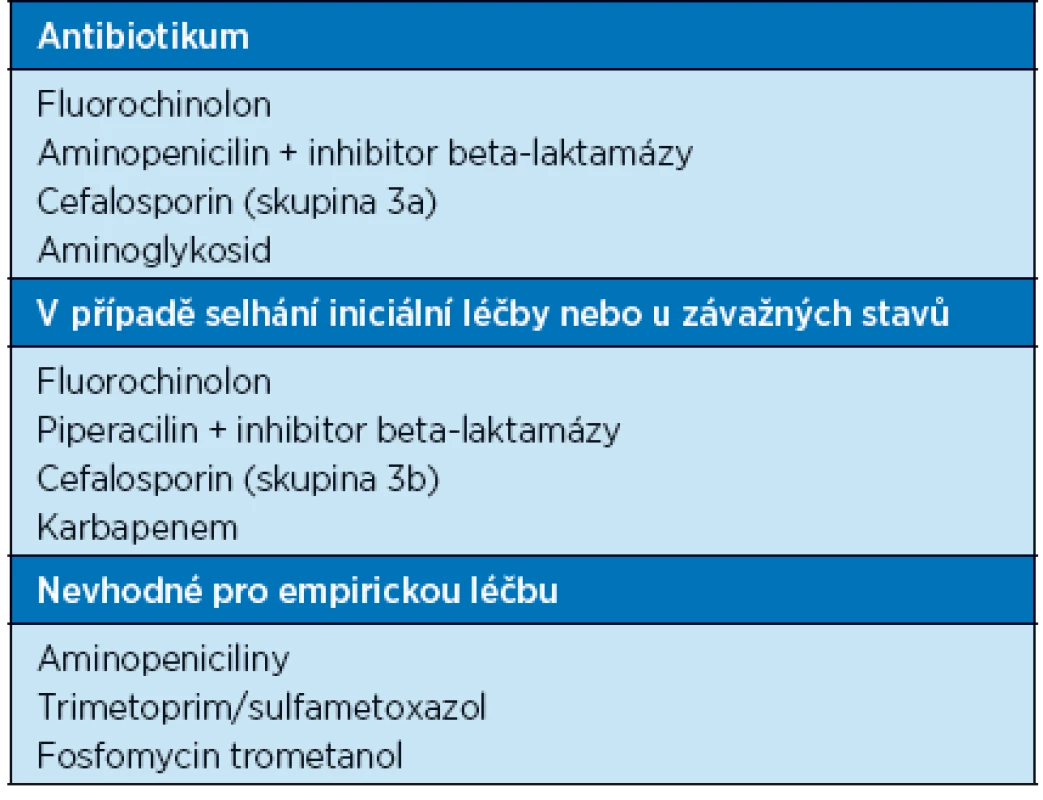
Infekce v souvislosti s katetrizací
Přítomnost močového katétru umožňuje kontinuální vstup mikroorganismů do močových cest. Nejdůležitějším faktorem pro rozvoj bakteriurie v souvislosti s katetrizací je doba katetrizace. Již samotná jednorázová katetrizace vede ke vzniku bakteriurie v 1–5 % případů, v případě krátkodobé katetrizace (do 7 dnů) je to 10–30 % a při dlouhodobé katetrizaci (déle než 28 dnů) mají bakteriurii prakticky všichni pacienti, přičemž až v 95 % se jedná o polymikrobiální bakteriurii(26). Dále se jako rizikové faktory uplatňují kolonizace drenážního sáčku, katétru nebo periuretrálního prostoru, diabetes, ženské pohlaví, zhoršená funkce ledvin, nedostatečná péče včetně zavedení katétru a nedostatečná antimikrobiální léčba(27). Výsledkem spolupráce několika odborných společností je souhrn doporučení ohledně léčby a prevence infekcí spojených s katetrizací močového měchýře, na které odkazujeme čtenáře k získání podrobných informací(28). Zde uvádíme některá z nich:
- drenážní systém katétru by měl zůstat uzavřený
- doba katetrizace by měla být co nejkratší
- odstranění katétru po non-urologických výkonech ještě v den operace (pokud je to možné)
- antimikrobiální profylaxe není doporučena
- chronická antibiotická léčba není doporučena
- drenážní sáček by měl být vždy pod úrovní močového měchýře
- rutinní kultivace moči u asymptomatického pacienta se nedoporučuje
- horečky v souvislosti s katetrizací se vyskytují u < 10 % katetrizovaných pacientů v zařízeních dlouhodobé péče, je proto nutné pátrat po jiných možných příčinách
- antimikrobiální léčba asymptomatické bakteriurie ani kandidurie se nedoporučuje, výjimkou jsou plánované intervence na močových cestách
- antimikrobiální léčba je doporučena v případě symptomatické IMC.
Specifika infekcí u starších mužů
U starších mužů se jedná zejména o bakteriální prostatitidu a epididymitidu. V případě prostatitidy rozlišujeme její akutní a chronickou formu, v případě chronické prostatitidy přetrvávají příznaky déle než 3 měsíce. Nejčastějšími původci jsou enterobakterie, zejména E. coli. Hlavními příznaky jsou bolest popisovaná v různých lokalitách (prostata/perineum, šourek/varlata, penis, močový měchýř, dolní část zad) a potíže s močením (urgence, polakisurie, bolest při močení, slabý proud moči, obtížné močení, případně retence moči). Akutní bakteriální prostatitida je závažná infekce doprovázená febriliemi, intenzivní bolestí a celkovými příznaky, vyžaduje proto parenterální léčbu vysokými dávkami antibiotik, jako jsou širokospektrální peniciliny, cefalosporiny třetí generace nebo fluorochinolony, iniciálně i v kombinaci s aminoglykosidy. Po zlepšení stavu pokračuje perorální léčba, celková délka léčby je 2–4 týdny. Asi 10 % pacientů má akutní močovou retenci, nejvhodnější je v tomto případě zavedení epicystostomie, případně močového katétru. Pokud pacient nemá retenci moči, může naopak zavedení katétru zvyšovat riziko vzniku chronického zánětu(29). Pokud je akutní prostatitida komplikovaná vznikem abscesu, doporučuje se aspirace nebo kontinuální drenáž. Abscesy menší než 1 cm je možné léčit konzervativně. V případě chronické bakteriální prostatitidy je doporučována perorální ATB léčba celkově 4–6 týdnů, vzhledem k příznivé farmakokinetice jsou doporučovány zejména fluorochinolony (ciprofloxacin, levofloxacin)(16).
Na rozdíl od mladých mužů (do 35 let), kde epididymitida vzniká jako sexuálně přenosné onemocnění způsobené především Ch. trachomatis, u starších mužů je typická infekce běžnými uropatogeny (doprovázená bakteriurií) v návaznosti na obstrukci dolních močových cest. Infekce se šíří do nadvarlete z močového měchýře nebo močové trubice. Projevuje se náhle vzniklou bolestí a otokem zpravidla jedné poloviny šourku, přičemž zánětlivé postižení se může šířit i na varle (epididymo-orchitida). Z antibiotik jsou preferovány fluorochinolony (pokud je známá míra lokální rezistence E. coli pod 20 %) kvůli širokému spektru a dobré penetraci do tkání urogenitálního traktu, dále lze podávat cefalosporiny, aminoglykosidy nebo trimetoprim/sulfametoxazol (TMP/SMX) v případě prokázané citlivosti. Abscedující epididymitida nebo orchitida vyžaduje chirurgickou léčbu (incize a drenáž abscesů, epididymektomie, v případě postižení varlete orchiektomie). Podpůrná léčba zahrnuje klid na lůžku, elevaci šourku a antiflogistika.
Recidivující IMC u postmenopauzálních žen
Z hlediska věku je potřeba rozlišit tři skupiny žen s recidivujícími infekcemi močových cest: premenopauzální ženy, postmenopauzální ženy ve věku 50–70 let, které nejsou institucionalizovány ani katetrizovány a nemají jiné komorbidity, a nakonec ženy starší 70 let, které jsou umístěny v zařízeních dlouhodobé péče, často se zavedeným močovým katétrem(6). Ačkoli je ve srovnání s premenopauzálními ženami výskyt bakteriurie v populaci starších žen vyšší, většina studií týkajících se recidivujících IMC byla prováděna na mladých ženách. Běžně popisované rizikové faktory týkající se premenopauzálních žen nejsou z tohoto důvodu u starších žen tak důkladně prozkoumány. Studie srovnávající postmenopauzální ženy s anamnézou a bez anamnézy recidivujících IMC prokázala jako hlavní rizikové faktory inkontinenci, přítomnost cystokély, postmikční reziduum, výskyt IMC před menopauzou a nonsekrece antigenů krevních skupin do tělních tekutin(30). Prevence recidivujících IMC zahrnuje non-antimikrobiální postupy (behaviorální modifikace, topická léčba estrogeny, užívání brusinek, probiotika, imunoprofylaxe) a antimikrobiální profylaxi (kontinuální, postkoitální nebo intermitentní samoléčbu). Pro detailnější informace o těchto jednotlivých metodách i s doporučením pro každodenní praxi odkazujeme čtenáře na jinou práci(31). Režim antimikrobiální profylaxe je stejný jako u premenopauzálních žen, lze využít TMP/SMX 240 mg 1x denně nebo 3x týdně, nitrofurantoin 50 mg nebo 100 mg 1x denně či fosfomycin trometamol 3 g každých 10 dnů(16). Efekt estrogenů u postmenopauzálních žen je diskutabilní. Lze dohledat studie, které prokázaly významnou redukci urogenitálních symptomů i samotných IMC(32), jiné protektivní efekt neprokázaly(33). Vaginální estrogeny lze doporučit zejména u žen s multirezistentními patogeny, kde jsou možnosti antimikrobiální profylaxe omezené, a tam, kde je prokázána souvislost s atrofickou vaginitidou. Užívání brusinek (zejména ve formě kapslí kvůli compliance) se jeví jako vhodná metoda i u starších žen – ve srovnání s trimetoprimem není signifikantní rozdíl, co se týče času do první recidivy IMC(34). Pozitivní efekt kapslí na snížení výskytu bakteriurie a pyurie byl prokázán i v pilotní studii na ženách v zařízeních ošetřovatelské péče, průměrný věk studované populace byl 89 let(35).
Mobilita jako důležitý faktor prevence
Omezená mobilita stárnoucí populace zvyšuje riziko hospitalizace kvůli IMC. Poměrně rozsáhlá retrospektivní studie na populaci starší 65 let prokázala 69% snížení rizika hospitalizace kvůli IMC u chodících pacientů. U těch, kteří setrvali v zařízení dlouhodobé péče dostatečně dlouhou dobu, bylo prokázáno snížení rizika hospitalizace kvůli IMC o 39–76 %, pokud došlo k udržení nebo zlepšení mobility (a to i na lůžku nebo z lůžka do křesla)(36). Mechanismy, kterými zlepšení mobility ovlivňuje funkci močových cest, je zejména zkrácení doby stagnace moči v močových cestách, lepší schopnost ovládat močení samotné a předcházení úniku moči nebo jeho lepší zvládnutí.
Shrnutí
Infekce močových cest a asymptomatická bakteriurie jsou v geriatrické populaci častým jevem. Odlišení symptomatické IMC a asymptomatické bakteriurie je problematické v případě absence typických příznaků IMC, což v této věkové skupině pacientů není neobvyklé. Neuvážená preskripce a s tím spojené nadměrné užívání antibiotik vedou k selekci multirezistentních mikroorganismů a je problémem zejména v zařízeních dlouhodobé péče a u katetrizovaných pacientů. Algoritmy léčby jednotlivých zánětlivých onemocnění se v zásadě neliší od ostatní populace. U starších mužů je nutno zdůraznit roli urologa při diagnostice a léčbě příčin porušeného vyprazdňování močového měchýře, bez které je samotná léčba infekce pouze dočasným řešením. Racionální antimikrobiální léčba a dodržování platných doporučení pro léčbu infekcí a prevenci infekcí v souvislosti s katetrizací jsou nezbytnými předpoklady boje proti celosvětově narůstající rezistenci na antibiotika.
Autoři prohlašují, že v souvislosti s publikací článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny farmaceutickou firmou.
MUDr. Michal Fedorko, FEBU,
prof. MUDr. Dalibor Pacík, CSc.
Urologická klinika FN Brno a LF MU Brno
MUDr. Michal Fedorko, FEBU
e-mail.: michal.fedorko@fnbrno.cz
Pracuje jako lékař a odborný asistent Urologické kliniky FN Brno a LF MU Brno. Kromě pregraduální výuky se věnuje vzdělávání zdravotnických pracovníků a předatestační přípravě lékařů v oboru urologie. Je studentem postgraduálního studia. Jako urolog pracuje od roku 2004, je členem České urologické společnosti i Evropské urologické asociace.
Sources
1. Curns AT, Holman RC, Sejvar JJ, et al. Infectious disease hospitalizations among older adults in the United States from 1990 through 2002. Arch Intern Med 2005; 165(21): 2514–2520.
2. Caterino JM, Weed SG, Espinola JA, et al. National trends in emergency department antibiotic prescribing for elders with urinary tract infection, 1996–2005. Acad Emerg Med 2009; 16(6): 500–507.
3. Tsan L, Langberg R, Davis C, et al. Nursing home-associated infections in Department of Veterans Affairs community living centers. Am J Infect Control 2010; 38(6): 461–466.
4. Marques LP, Flores JT, Barros Junior OeO, et al. Epidemiological and clinical aspects of urinary tract infection in community-dwelling elderly women. Braz J Infect Dis 2012; 16(5): 436–441.
5. Eriksson I, Gustafson Y, Fagerström L, et al. Prevalence and factors associated with urinary tract infections (UTIs) in very old women. Arch Gerontol Geriatr 2010; 50(2): 132–135.
6. Raz R. Urinary tract infections in postmenopausal women. In: Naber K, Schaeffer, AJ, Heyns C, eds. Urogenital Infections. Arnhem, The Netherlands: European Association of Urology 2010; 225–234.
7. Griebling TL. Urologic diseases in america project: trends in resource use for urinary tract infections in men. J Urol 2005; 173(4): 1288–1294.
8. Hooton TM. Recurrent urinary tract infection in women. Int J Antimicrob Agents 2001; 17(4): 259–268.
9. Moore EE, Hawes SE, Scholes D, et al. Sexual intercourse and risk of symptomatic urinary tract infection in post–menopausal women. J Gen Intern Med 2008; 23(5): 595–599.
10. Stamm WE, Raz R. Factors contributing to susceptibility of postmenopausal women to recurrent urinary tract infections. Clin Infect Dis 1999; 28(4): 723–725.
11. Wagenlehner FM, Weidner W, Pilatz A, et al. Urinary tract infections and bacterial prostatitis in men. Curr Opin Infect Dis 2014; 27(1): 97–101.
12. Townes CL, Ali A, Gross N, et al. Prostate specific antigen enhances the innate defence of prostatic epithelium against Escherichia coli infection. Prostate 2013; 73(14): 1529–1537.
13. Nicolle LE. Urinary tract infections in the elderly. Clin Geriatr Med 2009; 25(3): 423–436.
14. Mottet N, Bellmunt J, Briers E, et al. Guidelines on Prostate Cancer. European Association of Urology Guidelines. 2015 ed. Arnhem, The Netherlands: European Association of Urology 2015 : 19–30.
15. Das R, Perrelli E, Towle V, et al. Antimicrobial susceptibility of bacteria isolated from urine samples obtained from nursing home residents. Infect Control Hosp Epidemiol 2009; 30(11): 1116–1119.
16. Grabe M, Bartoletti R, Bjerklund Johansen TE, et al. Guidelines on Urological Infections. European Association of Urology Guidelines 2015: ed. Arnhem, The Netherlands: European Association of Urology 2015 : 1–85.
17. Nicolle LE. Asymptomatic bacteriuria in the elderly. Infect Dis Clin North Am 1997; 11(3): 647–662.
18. Hájková B. Infekce močových cest u seniorů. Čes Ger Rev 2008; 6(1): 14–18.
19. Cai T, Mazzoli S, Mondaini N, et al. The role of asymptomatic bacteriuria in young women with recurrent urinary tract infections: to treat or not to treat? Clin Infect Dis 2012; 55(6): 771–777.
20. High KP, Bradley SF, Gravenstein S, et al. Clinical practice guideline for the evaluation of fever and infection in older adult residents of long-term care facilities: 2008 update by the Infectious Diseases Society of America. Clin Infect Dis 2009; 48(2): 149–171.
21. Loeb M, Bentley DW, Bradley S, et al. Development of minimum criteria for the initiation of antibiotics in residents of long-term-care facilities: results of a consensus conference. Infect Control Hosp Epidemiol 2001; 22(2): 120–124.
22. Phillips CD, Adepoju O, Stone N, et al. Asymptomatic bacteriuria, antibiotic use, and suspected urinary tract infections in four nursing homes. BMC Geriatr 2012; 12 : 73.
23. Knottnerus BJ, Geerlings SE, Moll van Charante EP, et al. Women with symptoms of uncomplicated urinary tract infection are often willing to delay antibiotic treatment: a prospective cohort study. BMC Fam Pract 2013; 14 : 71.
24. Rowe TA, Juthani-Mehta M. Diagnosis and management of urinary tract infection in older adults. Infect Dis Clin North Am 2014; 28(1): 75–89.
25. Drekonja DM, Rector TS, Cutting A, et al. Urinary tract infection in male veterans: treatment patterns and outcomes. JAMA Intern Med 2013; 173(1): 62–68.
26. Warren JW. Catheter-associated urinary tract infections. Int J Antimicrob Agents 2001; 17(4): 299–303.
27. Maki DG, Tambyah PA. Engineering out the risk for infection with urinary catheters. Emerg Infect Dis 2001; 7(2): 342–347.
28. Tenke P, Kovacs B, Bjerklund Johansen TE, et al. European and Asian guidelines on management and prevention of catheter-associated urinary tract infections. Int J Antimicrob Agents 2008; 31 (Suppl 1): S68–78.
29. Yoon BI, Kim S, Han DS, et al. Acute bacterial prostatitis: how to prevent and manage chronic infection? J Infect Chemother 2012; 18(4): 444–450.
30. Raz R, Gennesin Y, Wasser J, et al. Recurrent urinary tract infections in postmenopausal women. Clin Infect Dis 2000; 30(1): 152–156.
31. Fedorko M. Možnosti léčby a profylaxe recidivujících infekcí dolních močových cest. Urol List 2013; 11(2): 33–37.
32. Eriksen B. A randomized, open, parallel-group study on the preventive effect of an estradiol-releasing vaginal ring (Estring) on recurrent urinary tract infections in postmenopausal women. Am J Obstet Gynecol 1999; 180(5): 1072–1079.
33. Jackson SL, Boyko EJ, Scholes D, et al. Predictors of urinary tract infection after menopause: a prospective study. Am J Med 2004; 117(12): 903–911.
34. McMurdo ME, Argo I, Phillips G, et al. Cranberry or trimethoprim for the prevention of recurrent urinary tract infections? A randomized controlled trial in older women. J Antimicrob Chemother 2009; 63(2): 389–395.
35. Bianco L, Perrelli E, Towle V, et al. Pilot randomized controlled dosing study of cranberry capsules for reduction of bacteriuria plus pyuria in female nursing home residents. J Am Geriatr Soc 2012 ;60(6): 1180–1181.
36. Rogers MA, Fries BE, Kaufman SR, et al. Mobility and other predictors of hospitalization for urinary tract infection: a retrospective cohort study. BMC Geriatr 2008; 8 : 31.
Labels
Geriatrics General practitioner for adults Orthopaedic prosthetics
Article was published inGeriatrics and Gerontology

2015 Issue 4-
All articles in this issue
- Horečka jako častý symptom
- Průjmová onemocnění v ordinaci praktického lékaře
- Vředová choroba žaludku a dvanácterníku a infekce Helicobacter pylori u starší populace
- Zánětlivá onemocnění močových cest v geriatrické populaci
- Léčba nehojících se ran u geriatrických pacientů
- Cestování seniorů – prevence infekcí při cestách do exotických krajin
- Geriatrická péče jako impulz k zavedení nového konceptu prevence a kontroly infekcí
- Streptokokové a pneumokokové infekce z pohledu geriatra
-
Features of adherence to drug therapy elderly:the impact of the diseaseand form of the drug
(the results of research in the urban population of Ecuador)
- Geriatrics and Gerontology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Horečka jako častý symptom
- Průjmová onemocnění v ordinaci praktického lékaře
- Streptokokové a pneumokokové infekce z pohledu geriatra
- Léčba nehojících se ran u geriatrických pacientů
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


