-
Medical journals
- Career
Vývoj inzulinové rezistence po transplantaci jater – prospektivní studie
Authors: Irena Míková 1; Erhartová D. 1; K. Dvořáková 1; Šedivý P. 2; Drobný M. 2; M. Dezortová 2; M. Hájek 2; M. Cahová 3; H. Daňková 3; Sticová E. 4; V. Lánská 5; Pavel Trunečka 1
Authors‘ workplace: Klinika hepatogastroenterologie, Transplantcentrum, IKEM, Praha 1; Pracoviště radiodiagnostiky a intervenční radiologie, IKEM, Praha 2; Centrum experimentální medicíny, IKEM, Praha 3; Pracoviště klinické a experimentální patologie, IKEM, Praha 4; Oddělení lékařské statistiky, IKEM, Praha 5
Published in: Gastroent Hepatol 2019; 73(4): 287-295
Category: Clinical and Experimental Gastroenterology: Original Article
doi: https://doi.org/10.14735/amgh2019287Overview
Úvod: Inzulinová rezistence (IR) má velký význam v patogenezi nealkoholové tukové nemoci jater a dalších onemocnění. Údaje o prevalenci a vývoji IR u pacientů před transplantací jater (LT – liver transplantation) a po ní jsou omezené. Cílem naší prospektivní studie bylo zhodnocení prevalence a vývoje IR u pacientů před LT a v prvních 2 letech po LT.
Metody: U 77 pacientů zařazených na čekací listinu k LT v období 5/2015–4/2017 bylo před LT, 6 měsíců (M), 1 rok (R) a 2R po LT provedeno klinické a laboratorní vyšetření a elastografie jater, 1H magnetickou rezonanční (1H MR) spektroskopií byl stanoven obsah tuku v játrech. V 1 a 2 letech po LT byla provedena necílená biopsie jater.
Výsledky: IR definovanou jako HOMA-IR (Homeostasis Assessment Model) ≥ 3,0 mělo 26 pacientů (41,3 %) před LT, 16 pacientů (25,4 %) v 6M po LT, 22 pacientů (34,9 %) v 1R po LT a 29 pacientů (46,0 %) ve 2R po LT (p = 0,028 pro 2R vs. 6M). Předtransplantační IR korelovala s věkem, indikací k LT a přítomností metabolického syndromu. IR hodnocená 2R po LT korelovala s přítomností metabolického syndromu, hypertenze, diabetu, body mass indexu, gamaglutamyltransferázy, s množstvím jaterního tuku hodnoceného histologicky i 1H MR spektroskopií, se stupněm balonové degenerace v biopsii a se stupněm fibrózy dle shear wave elastografie.
Závěr: Prevalence IR je vysoká u pacientů před i po LT, významně stoupá s rostoucí dobou od LT. Výskytu potransplantační IR a souvisejících faktorů je třeba věnovat maximální péči.
Klíčová slova:
inzulinová resistence – magnetická rezonance – NAFLD
Úvod
Inzulinová resistence (IR) je patologický stav charakterizovaný nedostatečnou odpovědí tkání na inzulinovou signalizaci. IR přispívá k patofyziologii diabetes mellitus (DM), nealkoholové tukové nemoci jater (NAFLD – non-alcoholic fatty liver disease), je základním znakem metabolického syndromu a je přítomna u obezity a mnoha kardiovaskulárních chorob [1]. IR je jedním z hlavních faktorů vzniku a rozvoje jaterní steatózy. Neschopnost inhibovat glukoneogenezi zvyšuje glykemii a ta stimuluje de novo lipogenezi, ta je navíc inzulinem stimulována i přímo. Pacienti s NAFLD vykazují IR i v tukové tkáni a kosterním svalstvu (periferní IR). Tuková tkáň se stane rezistentní na antilipolytický účinek inzulinu, což zvyšuje dodávku volných mastných kyselin do jater. V důsledku IR v kosterním svalstvu je omezeno vychytávání glukózy [2].
Kvantifikace inzulinové senzitivity/rezistence má význam jak pro epidemiologické studie, tak i v klinické praxi. Přímé metody měření inzulinové senzitivity in vivo zahrnují metodu hyperinzulinemického euglykemického glukózového clampu a inzulinový supresní test. Tyto metody přímo hodnotí utilizaci glukózy zprostředkovanou inzulinem za ustálených podmínek, obě jsou nákladné a časově i organizačně značně náročné [1]. Pro účely větších epidemiologických studií lze IR snadno hodnotit pomocí HOMA-IR (Homeostasis Assessment Model) nebo inzulinovou senzitivitu pomocí QUICKI indexu (Quantitative Inzulin Senzitivity Check Index), oba indexy vycházejí z hodnot lačné inzulinemie a lačné glykemie. Inzulinovou senzitivitu je možné hodnotit i pomocí indexů lačná glykemie/inzulinemie nebo 1/lačná inzulinemie [1,3]. Hodnota HOMA-IR, která definuje IR, není ustálená, za hranici IR je používána hodnota HOMA-IR ≥ 2,5 [4], HOMA-IR ≥ 2,7 [5–9] nebo HOMA-IR ≥ 3,0 [10–12], ale lze se setkat i s hodnotou HOMA-IR > 1,64 [13] nebo HOMA-IR ≥ 2,0 [14]. Pacienti s hodnotou QUICKI indexu < 0,357 představují pacienty s typickou manifestací metabolického syndromu [15]. HOMA i QUICKI index jsou jednoduché indexy spolehlivě hodnotící IR u pacientů před transplantací jater (LT – liver transplantation) i po ní [16].
Vliv IR na patogenezi jaterního onemocnění není specifická pro NAFLD a nealkoholovou steatohepatitidu (NASH) [13,17], ale vyskytuje se např. i u cirhózy asociované s virovou hepatitidou C (HCV) [10,18]. U pacientů s cirhózou byla popsána souvislost IR se zvýšeným portosystémovým tlakovým gradientem [19,20], přítomností jícnových varixů (HVPG – hepatic venous pressure gradient) [19,21,22] a vyšším rizikem krvácení z jícnových varixů [19].
V prvních měsících po LT dochází ke zvýšení inzulinové senzitivity [16,23,24], nicméně data o prevalenci a vývoji IR pacientů po LT jsou velmi omezená. Vysoká prevalence DM (až 30 %) [25] a NAFLD (18–56,4 %) [26–29] po LT nasvědčují, že se IR týká velkého množství příjemců jaterního štěpu.
Cílem naší prospektivní studie bylo zhodnotit prevalenci a vývoj IR a souvisejících klinických, laboratorních, magneticko rezonančních (MR) a histologických parametrů u příjemců jaterního štěpu před a po LT.
Soubor pacientů a metodika
Soubor pacientů
Tato prospektivní studie zahrnula pacienty starší 18 let zařazené na čekací listině k LT, kteří podepsali informovaný souhlas se studií a MR vyšetřením. Mezi exclusion kritéria patřilo akutní jaterní selhání, přítomnost jaterní encefalopatie znemožňující podepsání informovaného souhlasu a kontraindikace MR vyšetření. Celkem bylo v období 5/2015–4/2017 do studie zařazeno 123 pacientů, 77 pacientů absolvovalo všechny 4 plánované kontroly: před LT v době zařazení na čekací listinu (V0), 6 měsíců (M) po LT (V1), 1 rok (R) po LT (V2) a 2R po LT (V3), ti tvořili soubor pacientů v této práci.
Klinická a laboratorní vyšetření
Při každé kontrole byla zhodnocena klinická data: výška, hmotnost, obvod pasu, kouření, konzumace alkoholu, přítomnost hypertenze, DM, u V0 Child-Pugh a MELD skóre. V průběhu všech kontrol byla zaznamenána podávaná medikace (statiny, antidiabetika), u V1–3 imunosupresivní léčba. Pacientům byla po celonočním lačnění odebrána krev na stanovení celkového bilirubinu, aspartátaminotransferázy (AST), alaninaminotransferázy (ALT), alkalické fosfatázy, gamaglutamyltransferázy (GGT), triglyceridů, celkového, HDL a LDL cholesterolu, glykemie, glykovaného hemoglobinu, C-peptidu a inzulinemie. Z hodnot lačné glykemie a lačné inzulinemie byl vypočten HOMA-IR (lačný inzulin (μU/ml) × lačná glykemie (mmol/l) / 22,5), QUICKI index (1/log lačný inzulin (μU/ml) + log lačná glykemie (mg/dl)), poměr G/I ratio (glukóza (mg/dl) /inzulin (μU/ml)) a dále 1/lačná inzulinemie (μIU/ml) [1]. U pacientů, kteří nebyli léčeni inzulinem, byl po celonočním lačnění proveden orální glukózový toleranční test (OGTT) s podáním roztoku 75g glukózy a byla hodnocena glykemie po 120 min.
Hypertenze byla definována jako krevní tlak ≥ 130/85 mm Hg nebo antihyper-tenzní léčba. DM byl definován jako koncentrace glukózy v plazmě na lačno ≥ 7,0 mmol/l (alespoň 2× v posledních 6M) nebo koncentrace glukózy v plazmě při OGTT po 120 min ≥ 11,1 mmol/l nebo léčený DM. Metabolický syndrom byl definován jako přítomnost ≥ 3 z 5 následujících faktorů: obvod pasu ≥ 102 cm u mužů a ≥ 88 cm u žen, hypertenze, glykemie na lačno ≥ 5,6 mmo/l nebo DM, hypertriglyceridemie ≥ 1,7 mmol/l, HDL cholesterol < 1,0 mmol/l u mužů a < 1,3 mmol/l u žen.
MR vyšetření a elastografie
Při každé kontrole bylo po alespoň 3hod lačnění stanoveno metodou 1H magnetické rezonační (1H MR) spektroskopie procento objemu tuku v játrech, toto měření bylo prováděno ve třech standardizovaných částech jater. Vyšetření se prováděla na 3T celotělovém tomografu Trio (Siemens, Německo). Při každé kontrole byla pacientům provedena shear wave elastografie s měřením tuhosti jater (kPa).
Biopsie jater
V 1R a 2R po LT byla v rámci standardního protokolu programu LT v Institutu klinické a experimentální medicíny (IKEM) provedena necílená biopsie jater. Vzorek biopsie jater byl získán Menghiniho technikou a zpracován standardním způsobem v naší laboratoři. Biopsie byly klasifikovány dle Kleinera [30] a steatóza rozdělena dle procenta postižených hepatocytů na stupeň 0 u < 5 %, stupeň 1 u 5–33 %, stupeň 2 u 33,1–66 % a stupeň 3 u > 66 %. V biopsiích byly hodnoceny i další složky NAFLD aktivity skóre (NAS) a stadium fibrózy [30].
Statistické hodnocení
Kategorické proměnné jsou udávány v absolutních počtech a procentech, spojité proměnné jako průměr a směrodatná odchylka. Hodnocení vývoje spojitých proměnných v čase bylo provedeno pro gaussovské veličiny párovým t-testem, pro negaussovské veličiny Wilcoxonovým neparametrickým testem a pro kategoriální jsme použili Stuartův test. Následně byla na hladiny významnosti použita Bonferroniho korekce pro mnohonásobná srovnání. Vztah HOMA indexu ke kategorickým proměnným byl hodnocen Kruskalovým-Wallisovým testem a vztah ke spojitým proměnným byl popsán Spearmanovým korelačním koeficientem. K hodnocení vývoje daného parametru byli použiti pacienti, u kterých byly veličiny k dispozici ve všech čtyřech kontrolách. Za statisticky významnou byla použita hodnota p < 0,05, všechny testy byly oboustranné. Pro statistické hodnocení jsme použili JMP 10.0.0 statistický software, SAS Institute Inc. 2012.
Výsledky
Vstupní charakteristika souboru je popsána v tab. 1. Soubor pacientů zahrnoval 77 pacientů (44 mužů) průměrného věku 56,75 ± 10,13 let, průměrné Child-Pugh skóre bylo 8,70 ± 2,25, průměrné MELD skóre 14,13 ± 4,27. Indikací k LT byla nejčastěji alkoholická cirhóza (29,9 %), biliární cirhóza (20,8 %), NASH (13,0 %) a HCV (13,0 %). 37 pacientů (48,1 %) mělo DM před LT, 33 pacientů (42,9 %) mělo v anamnéze hypertenzi. Iniciální imunosupresí po LT byla u všech pacientů kombinace tacrolimus, mykofenolát mofetil a kortikoidy, 14 pacientů (18,2 %) navíc dostalo iniciálně basiliximab.
Table 1. Vstupní charakteristika souboru (n = 77) před transplantací jater.
Tab. 7. Input characteristics of the group (n = 77) before liver transplantation.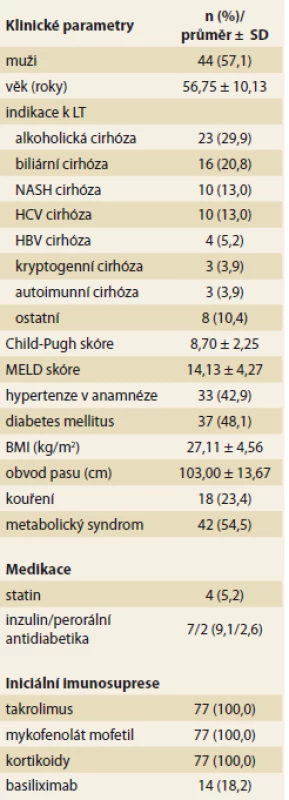
LT – transplantace jater, NASH – nealkoholová steatohepatitida, HCV – virus hepatitidy C, HBV – virus hepatitidy B, BMI – body mass index, SD – standardní odchylka Vývoj klinických a laboratorních parametrů v čase je uveden v tab. 2. Body mass index (BMI) a obvod pasu významně poklesly v prvních 6M po LT, do 2R po LT naopak významně stoupaly. Během prvních 6M po LT došlo k významnému nárůstu prevalence hypertenze (z 42,9 % před LT na 62,3 % 6M po LT), která dále byla stabilní. Prevalence DM byla stabilně vysoká (48,1 % před LT, 41,6 % 6M po LT, 44,2 % 1R po LT a 39,0 % 2R po LT). Prevalence metabolického syndromu byla vysoká před (54,5 %) i po LT (54,5 % v 6M; 64,9 % v 1R a 59,7 % ve 2R po LT). V prvních 6M po LT došlo v porovnání s obdobím před LT k významnému poklesu celkového bilirubinu, AST, GGT, lačné inzulinemie, naopak k významnému vzestupu došlo u hladiny celkového a LDL cholesterolu, triglyceridů, lačné glykemie a glykovaného hemoglobinu. Ve 2R po LT došlo v porovnání s obdobím 6M po LT k významnému poklesu ALT a GGT a k významnému vzestupu glykovaného hemoglobinu a lačné inzulinemie.
Z indexů IR (tab. 2) došlo v prvních 6M po LT k hraničně významnému poklesu průměrného HOMA-IR (p = 0,059). IR definovanou jako HOMA-IR ≥ 3,0 mělo 26 pacientů (41,3 %) před LT, 16 pacientů (25,4 %) v 6M po LT, 22 pacientů (34,9 %) v 1R po LT a 29 pacientů (46,0 %) v 2R po LT, vzestup mezi 6M a 2R po LT byl významný (p = 0,028). U QUICKI indexu inzulinové senzitivity jsme ve sledovaném období nezaznamenali významné změny, prevalence pacientů s nízkým QUICKI indexu (< 0,357) byla stabilně vysoká po celou dobu sledování. V souladu s poklesem HOMA-IR došlo v prvních 6M po LT ke vzestupu dalších indexů inzulinové senzitivity (lačná glykemie/inzulinemie a 1/lačná inzulinemie), které byly dále stabilní.
Table 2. Vývoj klinických a laboratorních parametrů a užívané medikace v čase (n = 77).
Tab. 2. Development of clinical and laboratory parameters and medication used over time (n = 77).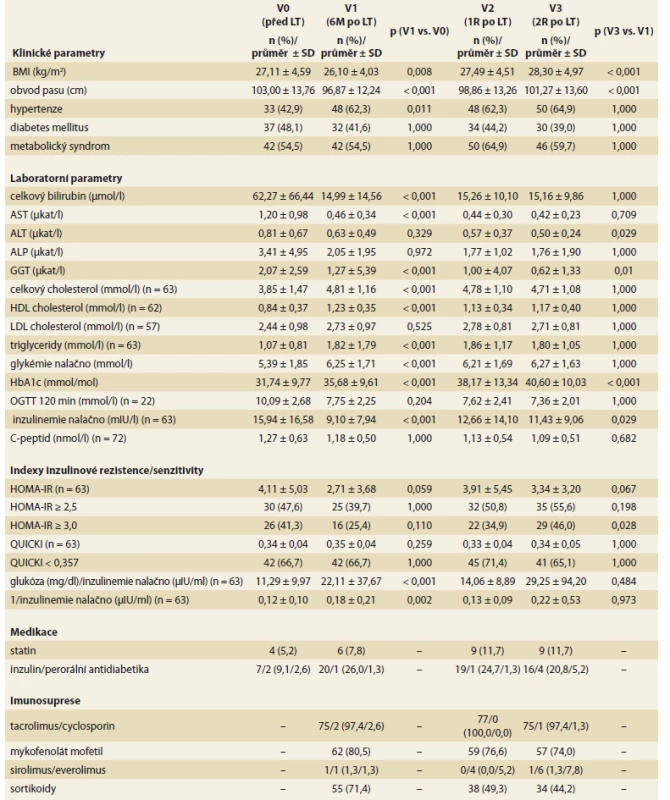
LT – transplantace jater, M – měsíc, R – rok, BMI – body mass index, AST – aspartátaminotransferáza, ALT – alaninaminotransferáza, ALP – alkalická fosfatáza, GGT – gamaglutamyltransferáza, OGTT – orální glukózový toleranční test, HOMA – Homeostasis Assessment Model, IR – inzulinová resistence, QUICKI – Quantitative Inzulin Senzitivity Check Index Procento objemu tuku v játrech stanovené 1H MR spektroskopií (tab. 3) se v čase významně zvyšovalo z průměrné hodnoty 1,25 % před LT, 1,88 % v 6M po LT, 2,61 % v 1R na 3,79 % ve 2R po LT. Tuhost jaterního štěpu hodnocená shear wave elastografií se v čase po LT neměnila. Steatózu jaterního štěpu (stupeň 1–3) stanovenou histologickým vyšetřením jaterního štěpu mělo 63,2 % pacientů v 1R po LT a 68,4 % pacientů ve 2R po LT, vývoj v čase nebyl signifikantní. Ostatní histologické znaky NAFLD konstituující aktivity skóre a stadium fibrózy rovněž nevykazovaly významné rozdíly mezi 1R a 2R po LT.
Table 3. Vývoj magnetické rezonance, elastografi ckých a histologických parametrů v čase.
Tab. 3. Evolution of magnetic resonance, elastographic and histological parameters over time.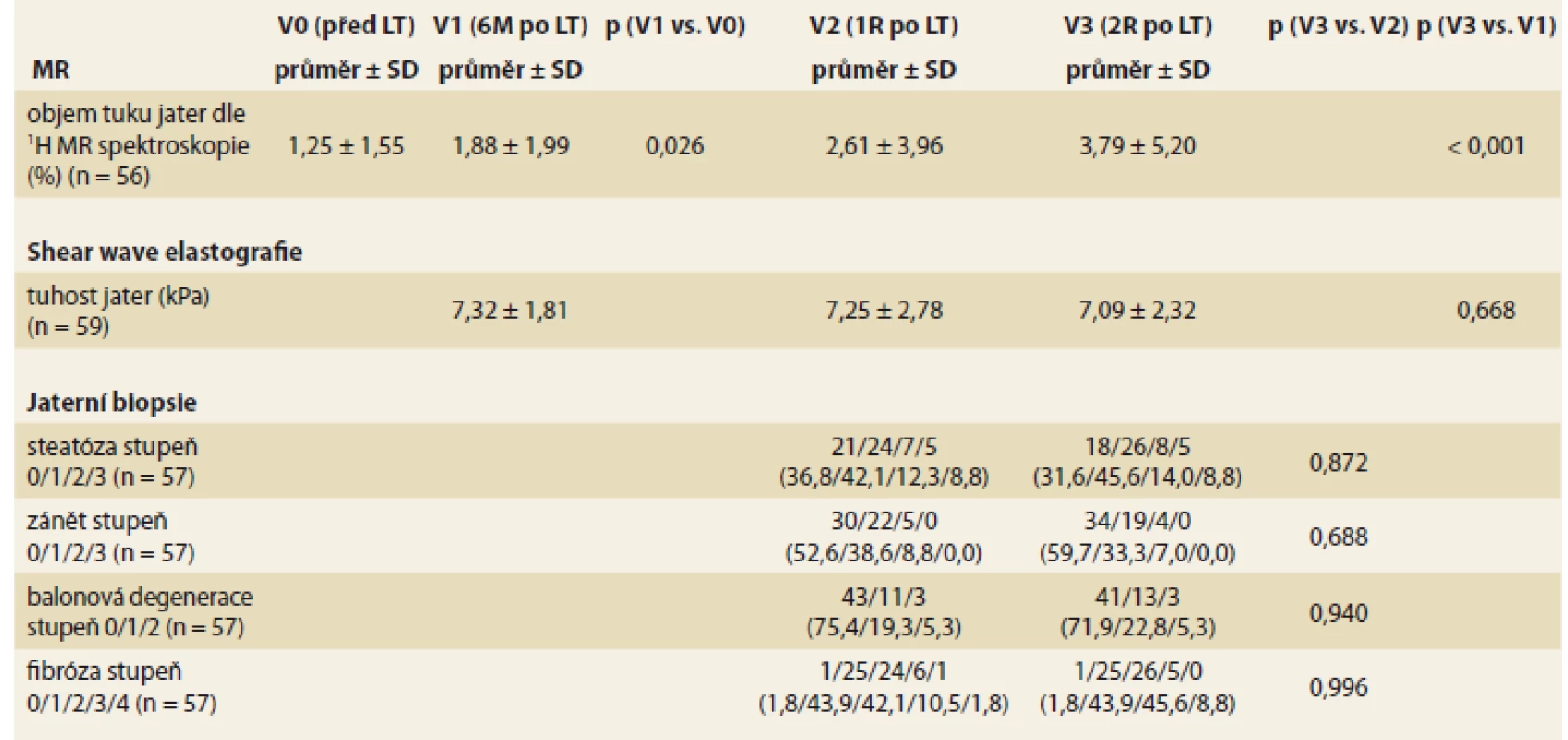
LT – transplantace jater, 1H MR – 1H magnetická rezonance, M – měsíc, R – rok, SD – směrodatná odchylka Předtransplantační HOMA-IR koreloval s věkem, přítomností metabolického syndromu a indikací k LT (tab. 4), přičemž nejvyšších průměrných hodnot HOMA-IR dosahovali pacienti s NASH a HCV cirhózou. HOMA-IR hodnocený 2R po LT (tab. 5) koreloval s přítomností hypertenze, diabetu, metabolického syndromu, BMI, GGT, stupněm steatózy a balonové degenerace v biopsii, tuhostí jater dle shear wave elastografie a objemem tuku v játrech dle 1H MR spektroskopie. Průměrné hodnoty HOMA-IR stoupaly s rostoucím stupněm fibrózy stanoveným histologickým vyšetřením (tab. 5), rozdíly však v našem souboru nebyly statisticky signifikantní.
Table 4. Korelace mezi HOMA-IR před transplantací jater s ostatními předtransplantačními faktory.
Tab. 4. Correlation between HOMA-IR before liver transplantation with other pre-transplant factors.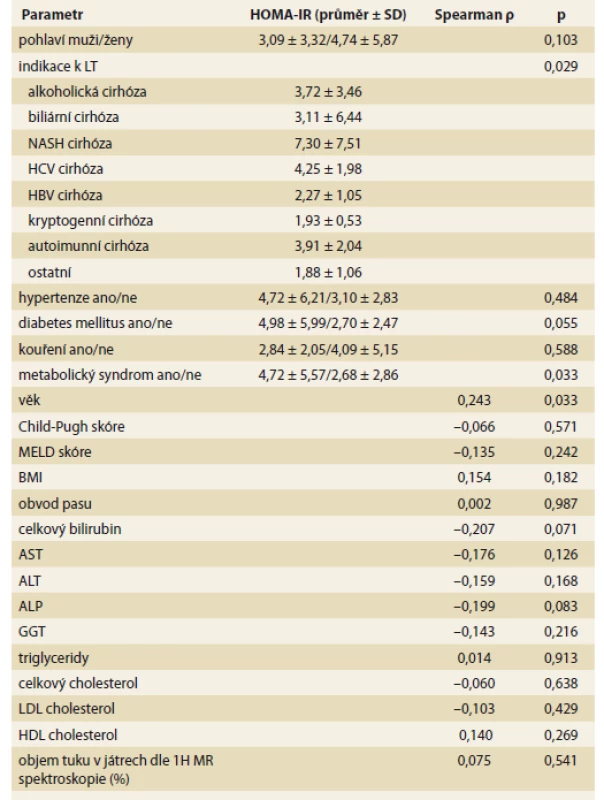
HOMA – Homeostasis Assessment Model, IR – inzulinová resistence, SD – směrodatná odchylka, LT – transplantace jater, NASH – nealkoholová steatohepatitida, HCV – virus hepatitidy C, HBV – virus hepatitidy B, BMI – body mass index, AST – aspartátaminotransferáza, ALT – alaninaminotransferázy, ALP – alkalická fosfatáza, GGT – gamaglutamyltransferáza, 1H MR – 1H magnetická rezonance Table 5. Korelace mezi HOMA-IR 2R po transplantaci jater a s ostatními faktory 2 roky po transplantaci jater.
Tab. 5. Correlation between HOMA-IR 2Y after liver transplantation and other factors two years after liver transplantation.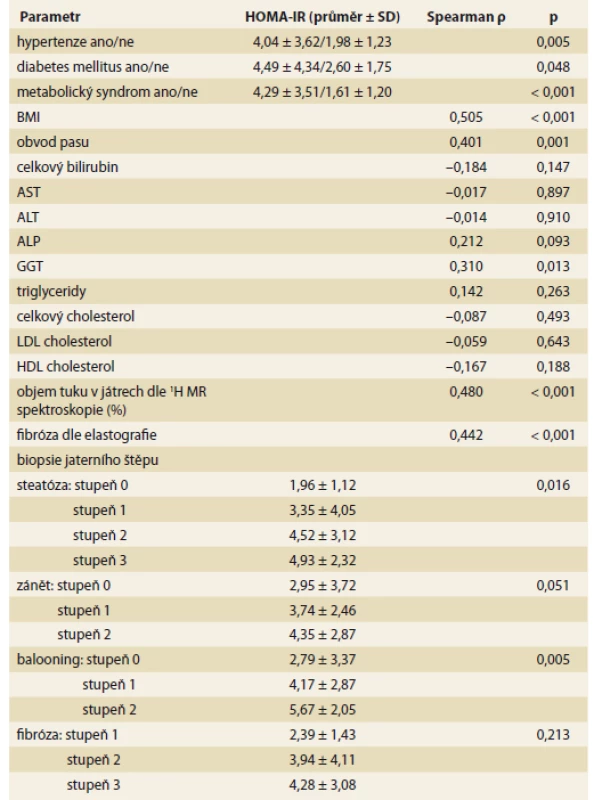
HOMA – Homeostasis Assessment Model, IR – inzulinová resistence, BMI – body mass index, AST – aspartátaminotransferáza, ALT – alaninaminotransferáza, ALP – alkalická fosfatáza, GGT – gamaglutamyltransferáza, 1H MR – 1H magnetická rezonance, SD – směrodatná odchylka, R – rok Diskuze
V naší práci jsme prospektivně sledovali příjemce jaterního štěpu před LT a 2R po LT a hodnotili prevalenci a vývoj IR a souvisejících klinických, laboratorních, MR a histologických parametrů. Zjistili jsme, že prevalence IR definované jako HOMA-IR ≥ 3,0 je před LT vysoká (41,3 %), během prvních 6M po LT vykazuje trend k poklesu na 25,4 % a po 2R od LT významně stoupne na 46,0 %.
Vysokou prevalenci IR definovanou jako HOMA-IR ≥ 3,0 u pacientů zařazených na čekací listinu k LT v naší studii (41,3 %) je obtížné srovnávat s literaturou, protože data o IR čekatelů na LT jsou velmi omezená, a navíc kritéria pro definici IR nejsou ustálená. Ve studii 53 pacientů s cirhózou a jícnovými varixy, která IR definovala jako HOMA-IR > 3,0, byla prevalence IR 56,6 % [11]. Ve studii s 280 pacienty s nově diagnostikovanou cirhózou bylo průměrné HOMA-IR skóre 5,8 [19]. Literární údaje svědčí o negativní prognostické hodnotě přítomnosti IR u pacientů s cirhózou. Ve studii 250 pacientů s kompenzovanou HCV cirhózou měli pacienti s HOMA-IR > 5,0 vyšší mortalitu a pacienti s HOMA-IR > 3,0 vyšší riziko jaterní dekompenzace [31]. V dalších studiích koreloval HOMA-IR s HVPG [19,20] a vyšším rizikem krvácení z jícnových varixů [19]. Jednou z příčin IR u pacientů s cirhózou je chronická hyperinzulinemie [32].
V naší skupině mělo před LT 48,1 % pacientů DM, přičemž k této vysoké prevalenci přispěla i systematická diagnostika DM s pomocí OGTT. Pacienti s tzv. hepatogenním diabetem, který je přímo vázán na ztrátu jaterní funkce, a vyvíjí se tedy až po rozvoji cirhózy, mají typicky normální hodnoty lačné glykemie a glykovaného hemoglobinu, ale abnormální odpověď na OGTT, který je nutný pro tuto diagnózu [33]. Je-li OGTT použit ke stanovení diagnózy DM u pacientů před LT, je prevalence DM vysoká (až 70,9 %) [23]. Vyšší hladiny glukózy pozorované u cirhotiků po perorálním podání glukózy jsou iniciálně způsobeny zvýšením množství požité glukózy, která se objeví v systémové cirkulaci a následně sníženým vychytáváním glukózy periferními tkáněmi v důsledku IR. Snížená suprese jaterní glukoneogeneze k orální glukózové intoleranci nepřispívá [34].
Pokles prevalence IR na 25,4 %, který jsme pozorovali v prvních 6M po LT, je v souladu s dalšími studiemi, které popsaly pokles IR po LT [16,23,24,35,36]. V naší práci i jiných studiích byl pozorován pokles inzulinemie [24,35], koncentrace C-peptidu [24] a normalizace nebo zlepšení glukózové tolerance [23,24]. Zlepšení glukózové tolerance a inzulinové senzitivity po LT je způsobeno zvýšenou jaterní clearance glukózy i zvýšenou utilizací glukózy periferními tkáněmi [24].
Významný nárůst prevalence IR s rostoucí dobou od LT (25,4 % v 6M, 34,9 % v 1R a 46,0 % ve 2R po LT) zjištěný v této studii byl doprovázen rostoucím objemem jaterního tuku stanovený 1H MR spektroskopií a je v souladu s naší předchozí studií, kde jsme pozorovali rostoucí prevalenci steatózy stanovené histologickým vyšetřením jaterního štěpu s rostoucí dobou od transplantace (30,3 % v 1R, 38,7 % v 5R a 47,6 % v 10R po LT) [29]. Jednou z příčin je pravděpodobně významný nárůst BMI v čase po LT pozorovaný v této studii. Ostatní klinické faktory související s IR (DM, hypertenze, metabolický syndrom) byly v průběhu potransplantačního sledování stabilní. Literární data o prevalenci IR pacientů po LT jsou omezená. Studie 119 pacientů z Brazílie průměrně 4R po LT udává prevalenci IR definovanou jako HOMA-IR ≥ 3,0 pouze 16 %, pacienti v této studii měli nižší BMI a nižší prevalenci DM, hypertenze a metabolického syndromu [12].
Předtransplantační IR korelovala s indikací k LT, přičemž nejvyšších hodnot HOMA-IR dosahovali dle očekávání pacienti s NASH a HCV cirhózou. IR je nezávislým prediktorem pokročilé fibrózy u pacientů s NASH [8,13,17] a HCV [8,10,37]. Dále v naší studii HOMA-IR koreloval s věkem a přítomností metabolického syndromu.
IR hodnocená 2R po LT korelovala s přítomností metabolického syndromu a jeho složek (hypertenze, DM, BMI). Dále výše IR korelovala s množstvím jaterního tuku hodnoceného jak histologicky, tak i 1H MR spektroskopií a dále i se stupněm balonové degenerace a hraničně i zánětlivých změn v biopsii štěpu, což potvrzuje vliv IR na rozvoj steatózy a NASH i u pacientů po LT, podobně jako tomu je u netransplantovaných pacientů [13]. Stupeň IR v naší studii koreloval se stupněm fibrózy dle shear wave elastografie, což je v souladu se studiemi u netransplantovaných pacientů, kde je IR prediktorem pokročilé fibrózy jater [8,10,13,17,37]. Pozorovali jsme i trend k vyššímu HOMA-IR v závislosti na stupni fibrózy stanoveném histologickým vyšetřením, rozdíly však v našem souboru nebyly statisticky signifikantní. Na rozdíl od biopsie jater, u které se hodnocení fibrózy provádí jen z malého vzorku jater a je jen semikvantitativní, je elastografické hodnocení prováděno z většího objemu jater a má charakter spojité veličiny, snáze tak může zaznamenat významné rozdíly v hodnocení fibrózy v relativně krátkém intervalu prvních 2R po transplantaci. Potransplantační IR navíc může být asociována s těžší rekurencí HCV, proto identifikace IR může pomoci identifikovat pacienty s rizikem rychlé progrese fibrózy po LT pro HCV [38].
V naší prospektivní studii jsme prokázali vysokou prevalenci IR u pacientů před i po LT a současně významný vzestup prevalence IR s rostoucí dobou od LT. Před LT koreloval HOMA-IR s věkem, indikací k LT a přítomností metabolického syndromu, po LT s přítomností metabolického syndromu a jeho složek (hypertenze, DM, BMI), GGT, s množstvím jaterního tuku hodnocené jak histologicky, tak i 1H MR spektroskopií, se stupněm nekroinflamatorních změn v biopsii a se stupněm fibrózy dle shear wave elastografie. Vzhledem k tomu, že literární údaje svědčí pro to, že může být potransplantační NASH/významná steatóza asociována s horším dlouhodobým přežíváním pacientů [29,39,40] a progredující fibrózou [39], je výskytu potransplantační IR a souvisejících faktorů (obezita, hypertenze, DM) třeba věnovat maximální péči ke zlepšení dlouhodobého přežívání pacientů i štěpů po LT.
Konflikt zájmů: Autoři deklarují, že text článku odpovídá etickým standardům, byla dodržena anonymita pacientů a prohlašují, že v souvislosti s předmětem článku nemají finanční, poradenské ani jiné komerční zájmy.
Publikační etika: Příspěvek nebyl dosud publikován ani není v současnosti zaslán do jiného časopisu pro posouzení.
Autoři souhlasí s uveřejněním svého jména a e-mailového kontaktu v publikovaném textu.
Dedikace: Tato práce byla finančně podpořena grantem č. 15-26906A Ministerstva zdravotnictví České republiky.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Doručeno: 23. 7. 2019
Přijato: 13. 8. 2019
MUDr. Mgr. Irena Míková
Klinika hepatogastroenterologie
Transplantcentrum, IKEM
Vídeňská 1958/9 140 21 Praha 4
Sources
1. Muniyappa R, Lee S, Chen H et al. Current approaches for assessing inzulin sensitivity and resistance in vivo: advantages, limitations, and appropriate usage. Am J Physiol Endocrinol Metab 2008; 294 (1): E15–E26. doi: 10.1152/ajpendo.00645.2007.
2. Than NN, Newsome PN. A concise review of non-alcoholic fatty liver disease. Atherosclerosis 2015; 239 (1): 192–202. doi: 10.1016/j.atherosclerosis.2015.01.001.
3. Wallace TM, Matthews DR. The assessment of insulin resistance in man. Diabet Med 2002; 19 (7): 527–534.
4. Magri CJ, Fava S, Galea J. Prediction of insulin resistance in type 2 diabetes mellitus using routinely available clinical parameters. Diabetes Metab Syndr 2016; 10 (2 Suppl 1): S96–S101. doi: 10.1016/j.dsx.2016.03.002.
5. Anastácio LR, Lima AS, Toulson Davisson Correia MI. Metabolic syndrome and its components after liver transplantation: incidence, prevalence, risk factors, and implications. Clin Nutr 2010; 29 (2): 175–179. doi: 10.1016/j.clnu.2009.08.008.
6. Petta S, Cammà C, Di Marco V et al. Insulin resistance and diabetes increase fibrosis in the liver of patients with genotype 1 HCV infection. Am J Gastroenterol 2008; 103 (5): 1136–1144. doi: 10.1111/j.1572-0241.2008.018 13.x.
7. Svegliati-Baroni G, Bugianesi E, Bouserhal T et al. Post-load insulin resistance is an independent predictor of hepatic fibrosis in virus C chronic hepatitis and in non-alcoholic fatty liver disease. Gut 2007; 56 (9): 1296–1301. doi: 10.1136/gut.2006.107946.
8. Bugianesi E, Marchesini G, Gentilcore E et al. Fibrosis in genotype 3 chronic hepatitis C and nonalcoholic fatty liver disease: role of insulin resistance and hepatic steatosis. Hepatology 2006; 44 (6): 1648–1655. doi: 10.1002/hep.21 429.
9. Pais R, Rusu E, Zilisteanu D et al. Prevalence of steatosis and insulin resistance in patients with chronic hepatitis B compared with chronic hepatitis C and non-alcoholic fatty liver disease. Eur J Intern Med 2015; 26 (1): 30–36. doi: 10.1016/j.ejim.2014.12.001.
10. Moucari R, Asselah T, Cazals-Hatem D et al. Insulin resistance in chronic hepatitis C: association with genotypes 1 and 4, serum HCV RNA level, and liver fibrosis. Gastroenterology 2008; 134 (2): 416–423. doi: 10.1053/j.gastro.2007.11.010.
11. Maruyama H, Kobayashi K, Kiyono S et al. Interrelationship between insulin resistance and portal haemodynamic abnormality in cirrhosis. Int J Med Sci 2017; 14 (3): 240–245. doi: 10.7150/ijms.17738.
12. Andrade AR, Bittencourt PL, Codes L et al. New Onset diabetes and non-alcoholic fatty liver disease after liver transplantation. Ann Hepatol 2017; 16 (6): 932–940. doi: 10.5604/01.3001.0010.5285.
13. Chitturi S, Abeygunasekera S, Farrell GC et al. NASH and insulin resistance: insulin hypersecretion and specific association with the insulin resistance syndrome. Hepatology 2002; 35 (2): 373–379. doi: 10.1053/jhep.2002.30 692.
14. Scalioni LP, da Silva AP, Miguel JC et al. Lack of association between hepatitis C virus core gene variation 70/91aa and insulin resistance. Int J Mol Sci 2017; 18 (7). doi: 10.3390/ijms18071 444.
15. Hrebicek J, Janout V, Malincikova J et al. Detection of insulin resistance by simple quantitative insulin sensitivity check index QUICKI for epidemiological assessment and prevention. J Clin Endocrinol Metab 2002; 87 (1): 144–147. doi: 10.1210/jcem.87.1.8292.
16. Perseghin G, Caumo A, Mazzaferro V et al. Assessment of insulin sensitivity based on a fasting blood sample in men with liver cirrhosis before and after liver transplantation. Transplantation 2003; 76 (4): 697–702. doi: 10.1097/ 01.TP.0000079252.94857.8D.
17. Bugianesi E, Manzini P, D’Antico S et al. Relative contribution of iron burden, HFE mutations, and insulin resistance to fibrosis in nonalcoholic fatty liver. Hepatology 2004; 39 (1): 179–187. doi: 10.1002/hep.20023.
18. Patel K, Thompson AJ, Chuang WL et al. Insulin resistance is independently associated with significant hepatic fibrosis in Asian chronic hepatitis C genotype 2 or 3 patients. J Gastroenterol Hepatol 2011; 26 (7): 1182–1188. doi: 10.1111/j.1440-1746.2011.06 722.x.
19. Eslam M, Ampuero J, Jover M et al. Predicting portal hypertension and variceal bleeding using non-invasive measurements of metabolic variables. Ann Hepatol 2013; 12 (4): 588–598.
20. Jeon HK, Kim MY, Baik SK et al. Hepatogenous diabetes in cirrhosis is related to portal pressure and variceal hemorrhage. Dig Dis Sci 2013; 58 (11): 3335–3341. doi: 10.1007/s10620-013-2802-y.
21. Cammà C, Petta S, Di Marco V et al. Insulin resistance is a risk factor for esophageal varices in hepatitis C virus cirrhosis. Hepatology 2009; 49 (1): 195–203. doi: 10.1002/hep.22 655.
22. Degré D, Gustot T, Gerkens A et al. Insulin resistance is associated with esophageal varices in alcoholic liver disease patients. Eur J Gastroenterol Hepatol 2016; 28 (7): 792–796. doi: 10.1097/MEG.0000000000000627.
23. Ramos-Prol A, Hervás-Marin D, Rodríguez-Medina B et al. Alterations in carbohydrate metabolism in cirrhotic patients before and after liver transplant. Diabetes Res Clin Pract 2015; 110 (2): 123–128. doi: 10.1016/j.diabres.2015.10.002.
24. Merli M, Leonetti F, Riggio O et al. Glucose intolerance and insulin resistance in cirrhosis are normalized after liver transplantation. Hepatology 1999; 30 (3): 649–654. doi: 10.1002/hep.510300306.
25. Peláez-Jaramillo MJ, Cárdenas-Mojica AA, Gaete PV et al. Post-liver transplantation diabetes mellitus: a review of relevance and approach to treatment. Diabetes Ther 2018; 9 (2): 521–543. doi: 10.1007/s13300-018-0374-8.
26. Seo S, Maganti K, Khehra M et al. De novo nonalcoholic fatty liver disease after liver transplantation. Liver Transpl 2007; 13 (6): 844–847. doi: 10.1002/lt.20932.
27. Lim LG, Cheng CL, Wee A et al. Prevalence and clinical associations of posttransplant fatty liver disease. Liver Int 2007; 27 (1): 76–80. doi: 10.1111/j.1478-3231.2006.0 1396.x.
28. Dumortier J, Giostra E, Belbouab S et al. Non-alcoholic fatty liver disease in liver transplant recipients: another story of seed and soil. Am J Gastroenterol 2010; 105 (3): 613–620. doi: 10.1038/ajg.2009.717.
29. Hejlova I, Honsova E, Sticova E et al. Prevalence and risk factors of steatosis after liver transplantation and patient outcomes. Liver Transplant 2016; 22 (5): 644–655. doi: 10.1002/lt.24393.
30. Kleiner DE, Brunt EM, Van Natta M et al. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005; 41 (6): 1313–1321. doi: 10.1002/hep.20701.
31. Calzadilla-Bertot L, Vilar-Gomez E, Torres-Gonzalez A et al. Impaired glucose metabolism increases risk of hepatic decompensation and death in patients with compensated hepatitis C virus-related cirrhosis. Dig Liver Dis 2016; 48 (3): 283–290. doi: 10.1016/j.dld.2015.12. 002.
32. Petrides AS, Stanley T, Matthews DE et al. Insulin resistance in cirrhosis: prolonged reduction of hyperinzulinemia normalizes insulin sensitivity. Hepatology 1998; 28 (1): 141–149. doi: 10.1002/hep.510280119.
33. Orsi E, Grancini V, Menini S et al. Hepatogenous diabetes: is it time to separate it from type 2 diabetes? Liver Int 2017; 37 (7): 950–962. doi: 10.1111/liv.13337.
34. Kruszynska YT, Meyer-Alber A, Darakhshan F et al. Metabolic handling of orally administered glucose in cirrhosis. J Clin Invest 1993; 91 (3): 1057–1066. doi: 10.1172/JCI116263.
35. Tietge UJ, Selberg O, Kreter A et al. Alterations in glucose metabolism associated with liver cirrhosis persist in the clinically stable long-term course after liver transplantation. Liver Transp 2004; 10 (8): 1030–1040. doi: 10.1002/lt.20147.
36. Cabré E, Gassull MA. Nutritional and metabolic issues in cirrhosis and liver transplantation. Curr Opin Clin Nutr Metab Care 2000; 3 (5): 345–354.
37. Hui JM, Sud A, Farrell GC et al. Insulin resistance is associated with chronic hepatitis C virus infection and fibrosis progression [corrected]. Gastroenterology 2003; 125 (6): 1695–1704. doi: 10.1053/j.gastro.2003.08.032.
38. Veldt BJ, Poterucha JJ, Watt KD et al. Insulin resistance, serum adipokines and risk of fibrosis progression in patients trans-planted for hepatitis C. Am J Transplant 2009; 9 (6): 1406–1413. doi: 10.1111/j.1600-6143.2009.026 42.x.
39. Narayanan P, Mara K, Izzy M et al. Recurrent or de novo allograft steatosis and long-term outcomes after liver transplantation. Transplantation 2019; 103 (1): 14–21. doi: 10.1097/TP.0000000000002317.
40. Gitto S, De Maria N, di Benedetto F et al. De-novo nonalcoholic steatohepatitis is associated with long-term increased mortality in liver transplant recipients. Eur J Gastroenterol Hepatol 2018; 30 (7): 766–773. doi: 10.1097/MEG.0000000000001105.
Labels
Paediatric gastroenterology Gastroenterology and hepatology Surgery
Article was published inGastroenterology and Hepatology
2019 Issue 4-
All articles in this issue
- Klinická a experimentální gastroenterologie
- Vývoj inzulinové rezistence po transplantaci jater – prospektivní studie
- Význam pH-metrie s impedanciou u pacientov s nadmernou supragastrickou eruktáciou
- Vizualizácia aktivity nervov bolesti z orgánov tráviaceho traktu
- Ovplyvňuje liečba inhibítormi protónovej pumpy riziko gastrointestinálneho krvácania u pacientov na liečbe novými orálnymi antitrombotikami?
- Nové perorálne antikoagulanciá a krvácanie do horného gastrointestinálneho traktu
- Inzulinom – příčina těžké hypoglykemie u pacientky s neurologickou symptomatikou
- Dysfagie jako projev nežádoucího účinku antikoagulační terapie
- Neobvyklá manifestace tuberkulózy u pacienta s ulcerózní kolitidou léčeného infliximabem
- Díl IV. – Mortalita a očekávaná doba dožití pacientů s IBD
- Dvě dekády endoskopické léčby časného karcinomu žaludku v České republice perspektivou kongresu IGCC 2019
- Tofacitinib – první JAK inhibitor v léčbě ulcerózní kolitidy. Začátek terapeutické éry „malých molekul“ u idiopatických střevních zánětů?
- Paměťové B lymfocyty v periferní krvi u celiakie – pilotní studie
- Cystická fibróza a exokrinní pankreatická insuficience
- Gastroenterology and Hepatology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Inzulinom – příčina těžké hypoglykemie u pacientky s neurologickou symptomatikou
- Díl IV. – Mortalita a očekávaná doba dožití pacientů s IBD
- Nové perorálne antikoagulanciá a krvácanie do horného gastrointestinálneho traktu
- Dysfagie jako projev nežádoucího účinku antikoagulační terapie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

