-
Medical journals
- Career
Peroperační biopsie plíce, pleury a mediastina: Retrospektivní analýza 5 let praktických zkušeností a přehled literatury
Authors: Zuzana Mouchová 1,2,3; Blanka Rosová 1,2; Radoslav Matěj 1,2,3
Authors‘ workplace: Oddělení patologie a molekulární medicíny, Thomayerova nemocnice, Praha 1; Ústav patologie, 3. lékařská fakulta Univerzity Karlovy a FNKV, Praha 2; Ústav patologie, 1. lékařská fakulta Univerzity Karlovy a VFN, Praha 3
Published in: Čes.-slov. Patol., 54, 2018, No. 3, p. 127-131
Category: Reviews Article
Overview
Peroperační biopsie nitrohrudí (plíce, pleura a mediastinum) má ve vyšetření plicní a mediastinální patologie nezastupitelnou roli. Slouží zejména v diferenciální diagnostice solitárních lézí, kdy rozdíl v terapeutickém managementu pacienta se zásadně liší, jedná-li se o primární zhoubný novotvar, metastázu či o ložisko nenádorové povahy. V přehledném článku shrnujeme současný stav využití peroperačních biopsií v oblasti hrudní chirurgie a zkušenosti Oddělení patologie a molekulární medicíny za posledních pět let.
Klíčová slova:
peroperační biopsie – plíce – mediastinum
Peroperační biopsie hrudníku má nezastupitelnou roli v diagnostice lézí plíce, pleury a mediastina. Její výsledek poskytuje chirurgovi rychlou zpětnou vazbu a rozhoduje o dalším operačním průběhu a o radikalitě výkonu. Peroperační vyšetření se provádí ze 3 nejdůležitějších důvodů:
- (a) Zjištění biologické povahy nádorové masy plíce či pleury, jejichž předchozí vyšetření (transthorakální či transbronchiální biopsie, vyšetření cytologické) nevedlo k jednoznačnému výsledku určení definitivní diagnózy primární nádorové léze či metastatického postižení a jejich odlišení od nenádorových afekcí;
- (b) u předem diagnostikovaných centrálně uložených plicních karcinomů ke zhodnocení nepřítomnosti nádoru v resekční linii bronchu;
- (c) u nádorových mas mediastina k zajištění dostatečného množství nádorové tkáně k definitivnímu histopatologickému vyšetření (1) včetně odběru na další molekulárně genetická vyšetření či průtokovou cytometrii u suspektních lymfoproliferativních onemocnění.
INDIKACE
Rychlá plicní biopsie je chirurgem vyžadována, pokud jsou zastižena klinicky nejasná suspektní plicní ložiska, jejichž biologická povaha nebyla ozřejmena jinými diagnostickými postupy a dále u pacientů se známým primárním maligním nádorovým ložiskem ke zhodnocení nově prokázaného plicního ložiska či při jeho progresi v čase. K vyšetření je operatérem nejčastěji dodána atypická plicní resekce. Pokud patolog diagnostikuje maligní onemocnění, je následně provedena lobektomie/pneumonektomie s regionální lymfadenektomií (hilové, subkarinální, paraaortální lymfatické uzliny). Pokud je atypická resekce maligní nádorové léze definitivním terapeutickým řešením, je doporučeno provést peroperační vyšetření z interlobárních, hilových nebo jiných suspektních lymfatických uzlin pro účely stagingu (1,2). Kompletní lobektomie není rutinně prováděna bez předchozí analýzy solitární plicní léze či masy (3).
K peroperačnímu vyšetření je patologem obvykle vybrán jeden blok z tumorózní léze se zachováním nezmražené nádorové tkáně pro imunohistochemickou analýzu a definitivní diagnózu. Jen zřídka je třeba více bloků a to zejména u resekčních okrajů bronchů a v případě, kdy původně odebraná tkáň z tumoru nevedla k definitivnímu závěru. Velmi důležité je pro kompletní diagnózu zachování a zjištění vztahu tumoru k povrchové pleuře, vzdálenost tumoru od kariny, identifikace event. dalších separátních nádorových ložisek v dodané lobektomii/pulmonektomii a s ohledem na 8. verzi TNM klasifikace je zásadní i co nejpřesnější změření nádorové masy.
V podstatně menší míře se peroperačně vyšetřují resekční okraje bronchů u lobektomií či pneumonektomií s centrálně uloženými známými tumory, dále u ložiskového postižení pleury a při postižení mediastina (1).
Limitací rychlé histologie, kromě někdy dosti výrazných hmoždících artefaktů zejména u odběrů z pleury a mediastina a všem známého omezeného hodnocení samotných zmražených řezů, bývají někdy dosti výrazné hyperregenerativní změny pneumonocytů, které mohou vést k falešně pozitivní diagnóze malignity.
SOLITÁRNÍ PLICNÍ LOŽISKA
Solitární plicní ložiska jsou často náhodným nálezem při rentgenovém vyšetření hrudníku. Nazývány bývají jako tzv. incidentalomy, jsou klinicky asymptomatické a definované jako oválné nebo okrouhlé dobře ohraničené uzly, v jejichž okolí plicní tkáň mívá normální vzhled, mohou však být přítomné úseky konsolidace plicního parenchymu či jiné intersticiální plicní procesy. Tato ložiska mohou nabývat různých velikostí od několika mm až po několik cm, mohou se však již v době diagnózy propagovat do okolních orgánů (hrudník, bránice, mediastinum). Marchevsky et al. ve své studii prokázali, že u ložisek o velikosti 11 až 15 mm v největším rozměru byla přesnost maligní diagnózy přes 90 % bez falešně pozitivních diagnóz, se 100 % specificitou, tedy celkově lepší než u ložisek o průměru menším než 10 mm, kde diagnostická senzitivita byla 86,4 % (4). U zastižených menších lézí může docházet k vykrájení ložiska při peroperačním zpracování či k falešně negativní diagnóze, kdy je při samotném samplingu patologem odebrána tkáň s peritumorózním jizvením či zánětlivým procesem. Jde o limitace peroperačních biopsií, se kterými musí počítat jak patologové, tak i klinici. Incidentalomy o průměru menším než 10 mm lze peroperačně vyšetřit, ale k vyšetření by se mělo přistupovat s nejvyšší opatrností.
Plicní léze lze dělit na nenádorové a nádorové léze, které ještě dál můžeme rozdělit na benigní a maligní tumory. Mezi maligní tumory patří zejména primárně plicní karcinomy se zastoupením nemalobuněčných (NSCLC) a malobuněčných (SCLC) plicních karcinomů a intrapulmonální metastázy či metastázy mimoplicních maligních nádorových procesů (5) (obr. 1). Diagnostika SCLC je v dnešní době předoperačně stanovena s vysokou pravděpodobností, a to s ohledem na dostupné biochemické markery – zejména stanovení sérové hladiny NSE a proGRP, a k peroperačnímu vyšetření se tyto léze dostávají velmi zřídka. Kromě primárně plicních malignit se často setkáváme s vyšetřením plicních ložisek při dispenzarizaci pacientů s jiným maligním onemocněním. Tyto léze, kromě metastáz primárních tumorů, bývají tvořeny intraparenchymatózními lymfatickými uzlinami, které mohou velice dobře simulovat malignitu (1), chondrohamartomy, ložisky jizvení (ať už v rámci postterapeutických změn či jako následek bronchopnemonie) (obr. 2).
Image 1. Maligní nádorová ložiska v peroperačním vyšetření. A, B: Primárně plicní adenokarcinom (zvětšení 40x, A HE, B Toluidinová modř). C: Peroperační imunohistochemický průkaz TTF-1 primárně plicního adenokarcinomu (zvětšení 100x, TTF-1). D: Metastáza kolorektálního karcinomu s komedo-like nekrózami (zvětšení 40x, HE). E: Negativní výsledek peroperačního imunohistochemického vyšetření TTF-1 (zvětšení 40x, TTF-1). F: Typický karcinoid (zvětšení 40x, HE). 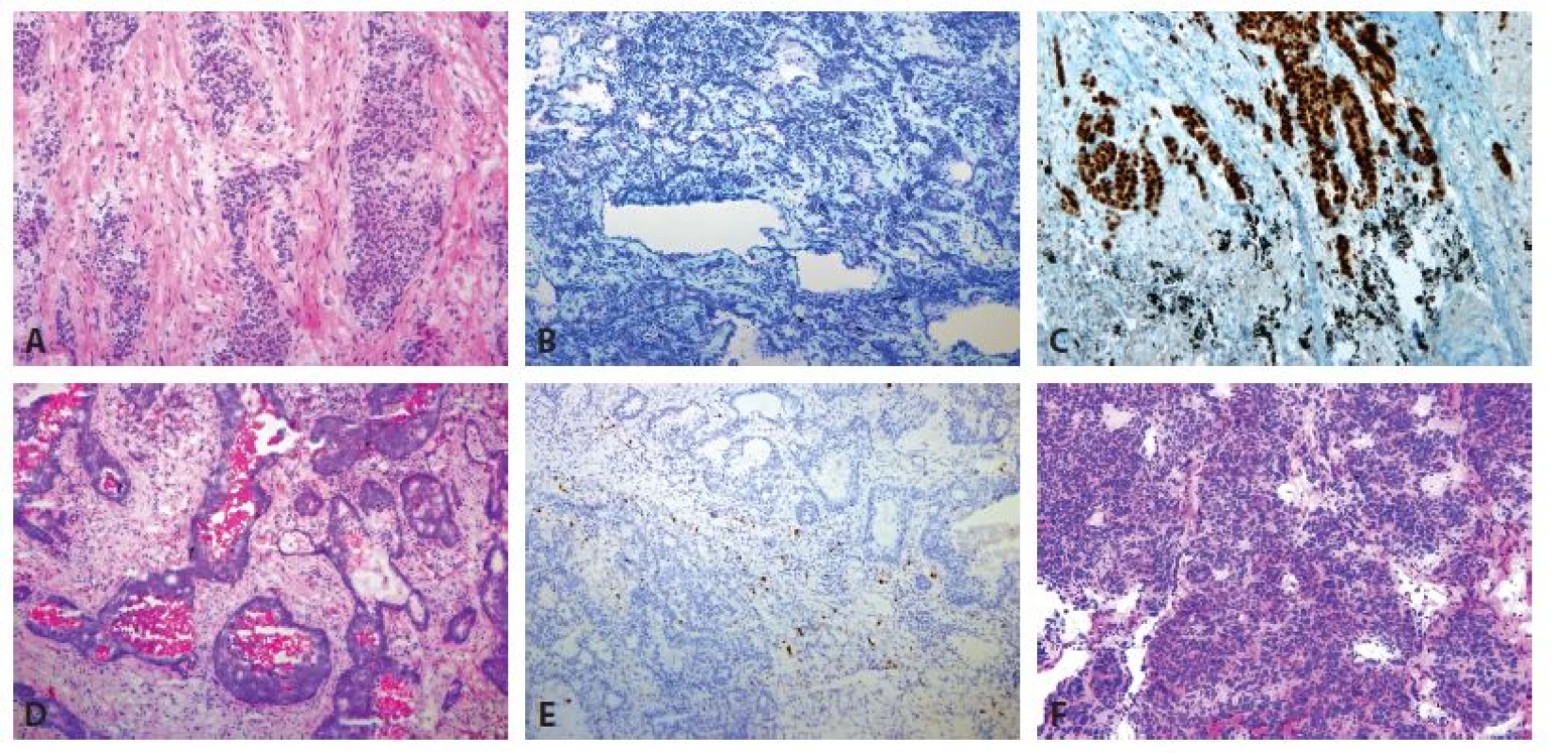
Image 2. Benigní nádorová ložiska. A: Pneumonocytom (zvětšení 40x, Toluidinová modř). B: Chondrohamartom (zvětšení 40x, HE). 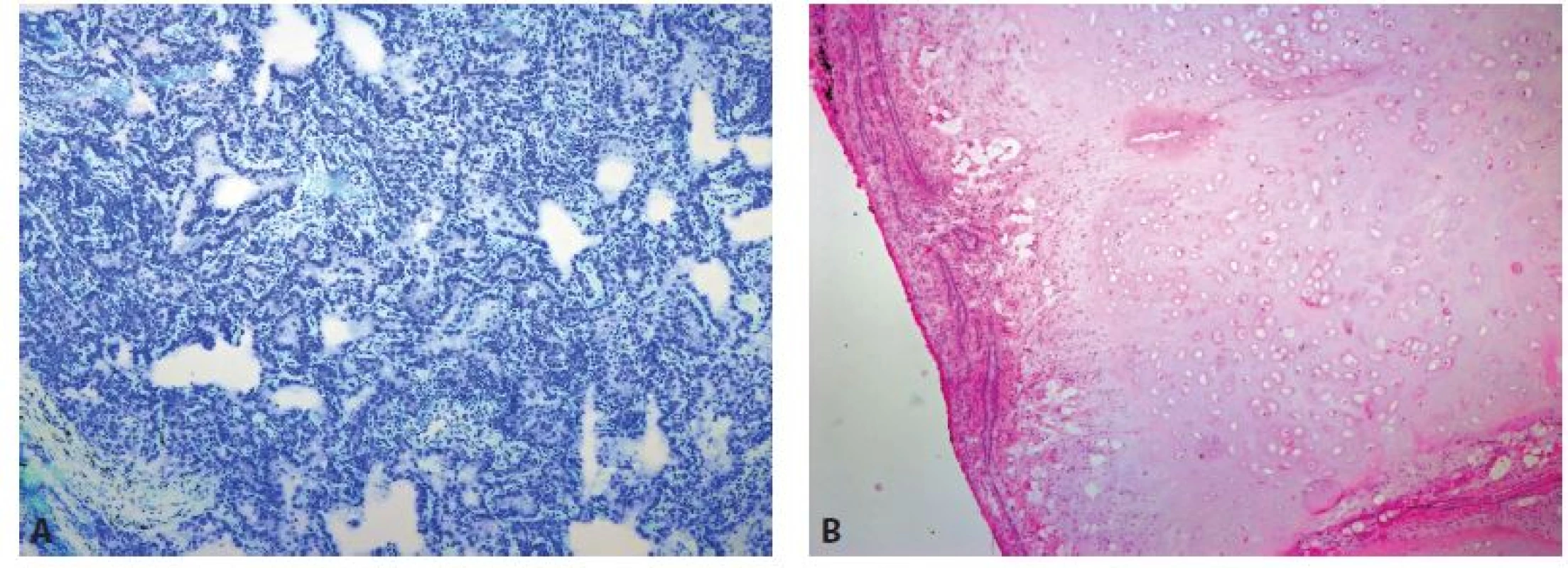
Samostatnou kapitolu tvoří ložiska nekrotizujících granulomatózních procesů (obr. 3), v našich podmínkách jde zejména o mykobakteriální postižení, méně často o plicní granulomatózu s polyangiitidou, se kterými se lze setkat u pacientů imunosuprimovaných při předchozí (chemo)terapii, nicméně se vyskytují i bez této vazby. Důležitým interdisciplinárním krokem je pak zajištění materiálu pro mikrobiologické a molekulárně genetické vyšetření, pokud možno nezmraženého materiálu, již během operace.
Image 3. Nekrotizující granulomatózní plicní procesy v peroperačním vyšetření. A, B: Tuberkulóza (zvětšení 40x, A HE, B Toluidinová modř). C: Revmatoidní uzel (zvětšení 40x, HE). D: Revmatoidní uzel (definitivní řez, zvětšení 40x, HE). 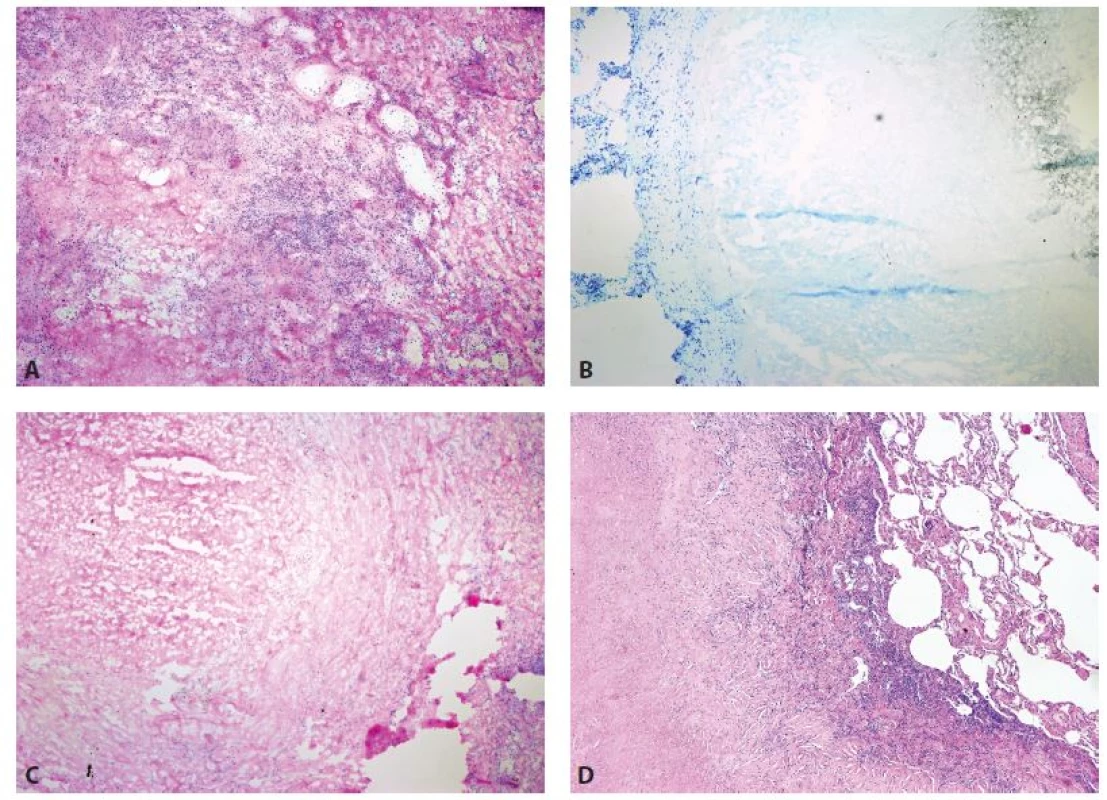
Peroperační zhotovení TTF-1
Pro zcela odlišný terapeutický management a prognózu pacienta se k rozlišení primárně plicních adenokarcinomů od metastáz adenokarcinomů jiných primárních lokalit (5) používá po dohodě s operatérem peroperační stanovení TTF-1 (6). TTF-1 je tkáňově specifický transkripční faktor, který je za fyziologických podmínek exprimován v první řadě alveolárními pneumonocyty II. typu a ve tkáni štítné žlázy (7,8) Pozitivita TTF-1, v případě vyloučení karcinomu štítné žlázy, svědčí s vysokou mírou senzitivity a specificity pro primárně plicní původ nádoru (1,9). Opatrnost v hodnocení TTF-1 je nutná zejména u mucinózních adenokarcinomů, u nichž TTF-1 bývá negativní a jejich diagnostika je obtížná i z definitivních nezmražených vzorků za použití širší škály imunohistochemických vyšetření.
V hodnocení peroperačních biopsií jsou kromě morfologie vlastního adenokarcinomu někdy nezbytná i anamnestická a klinická data a výsledky radiologických vyšetření (1). Pro primárně plicní původ adenokarcinomu svědčí smíšená architektura nádoru se solidními, acinárními, papilárními, mikropapilárními, lepidickými či jinými úseky. Pro metastázy naopak svědčí komplexní či kribriformní architektura, popřípadě nekrózy komedoniformního typu (kolorektální karcinom) (obr. 1) a monomorfní buněčná populace (karcinom mléčné žlázy) (1). V některých případech je přesné určení primární lokalizace adenokarcinomů i přes užití širokého spektra imunohistochemických metod obtížné i z definitivních parafínových řezů a diagnózu primárně plicního adenokarcinomu lze stanovit až po vyloučení možnosti metastazování z jiné primární lokality klinickými vyšetřeními (1,10).
Resekční linie bronchu
Resekční linie bronchu u lobektomií/pneumonektomií je vyšetřována u již dříve diagnostikovaných centrálně uložených tumorů (obr. 4). Residuální invazivní tumor v resekční linii výrazně ovlivňuje délku přežití pacienta (11) a je důvodem ke zkrácení zbylého bronchu. Pokud je v resekčním okraji přítomna high grade dysplázie, definitivní rozhodnutí o (ne)provedení reresekce je na operatérovi po konzultaci se zodpovědným pneumoonkologem.
Image 4. Peroperační bronchiální resekční linie. A: Normální nález (zvětšení 40x, HE). B: High grade dysplázie (zvětšení 40x, Toluidinová modř). C: Mikroinvazivní karcinom a karcinom in situ (zvětšení 40x, Toluidinová modř). 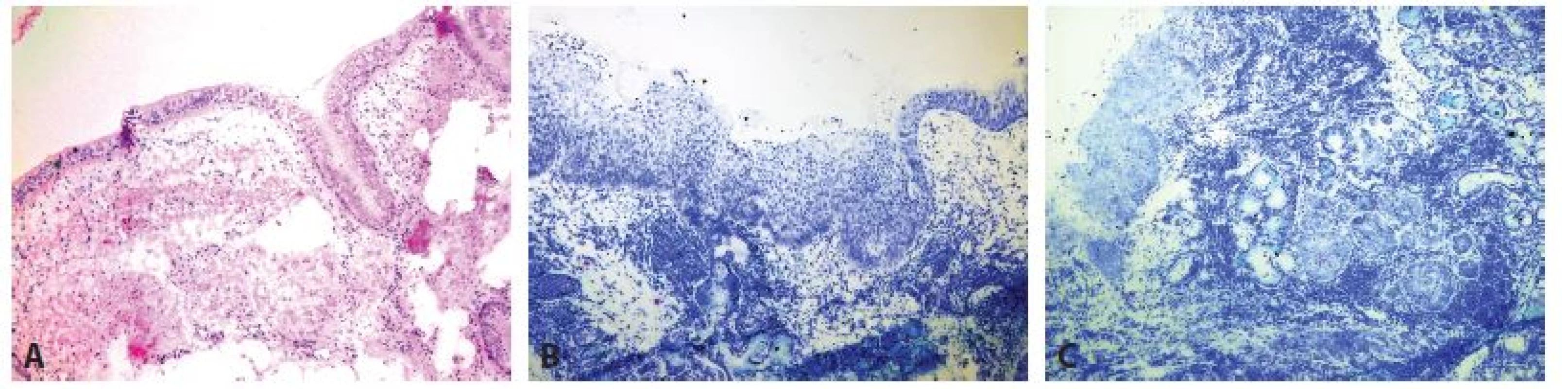
BIOPSIE MEDIASTINA
Tumory mediastina tvoří velice pestrou skupinu nádorů s různým přístupem k léčbě a různou prognózou (12). K peroperačnímu vyšetření je nezbytná znalost uložení nádorového procesu – přední či zadní mediastinum. Mediastinoskopie s odběrem tumorózní tkáně je zejména prováděna při nejasné mediastinální mase k potvrzení odběru dostatečného množství nádorové tkáně k definitivní morfologické diagnóze (jde zejména při podezření na lymfoproliferativní postižení předního mediastina) a k odlišení jiných primárních tumorů této lokalizace (tumory thymu, tumory z germinálních buněk, paragangliomy, thyroidní a parathyroidní tumory, schwannomy, vaskulární tumory atd.) či metastatický původ léze. Mediastinální uzliny jsou peroperačně vyšetřovány při pozitivních nálezech na PET CT vyšetření. PET pozitivní uzliny by měly být histologicky nebo cytologicky potvrzeny (13). Peroperační vyšetření mediastinálních uzlin tak může chirurgovi pomoct při rozhodování, jestli přistoupí posléze k plicní resekci či nikoliv a pacient tak prodělá pouze jednu anestezii a hospitalizaci (14). Při postižení kontralaterálních mediastinálních či supraklavikulárních lymfatických uzlin (N3) se odstupuje od dalšího chirurgického výkonu, protože takto postižení pacienti mají velmi špatnou dlouhodobou prognózou i přes probíhající multimodální léčbu (2).
Peroperační vyšetření parietální pleury nebo peroperační biopsie z měkkých tkání hrudní stěny či bránice jsou prováděny z důvodů potvrzení potencionální malignity či jako součást stagingu.
Zkušenosti s peroperační biopsií nitrohrudních lézí v Thomayerově nemocnici za uplynulých 5 let
V Thomayerově nemocnici v Praze z ročně provedených peroperačních biopsií pochází zhruba 40% z Oddělení hrudní chirurgie. Od ledna roku 2013 do konce září roku 2017 jsme na našem pracovišti provedli 894 těchto peroperačních biopsií. Nejvíce odběrů bylo provedeno z plic (n=691), dále jsme vyšetřovali tkáň z mediastina, pleury, hrudní stěny, bránice, lymfatické uzliny hilové, mediastinální, ale i nadklíčkové a krční uzliny. Samozřejmostí bylo i vyšetření resekční linie bronchů (tab. 1).
Table 1. Peroperační vyšetření. 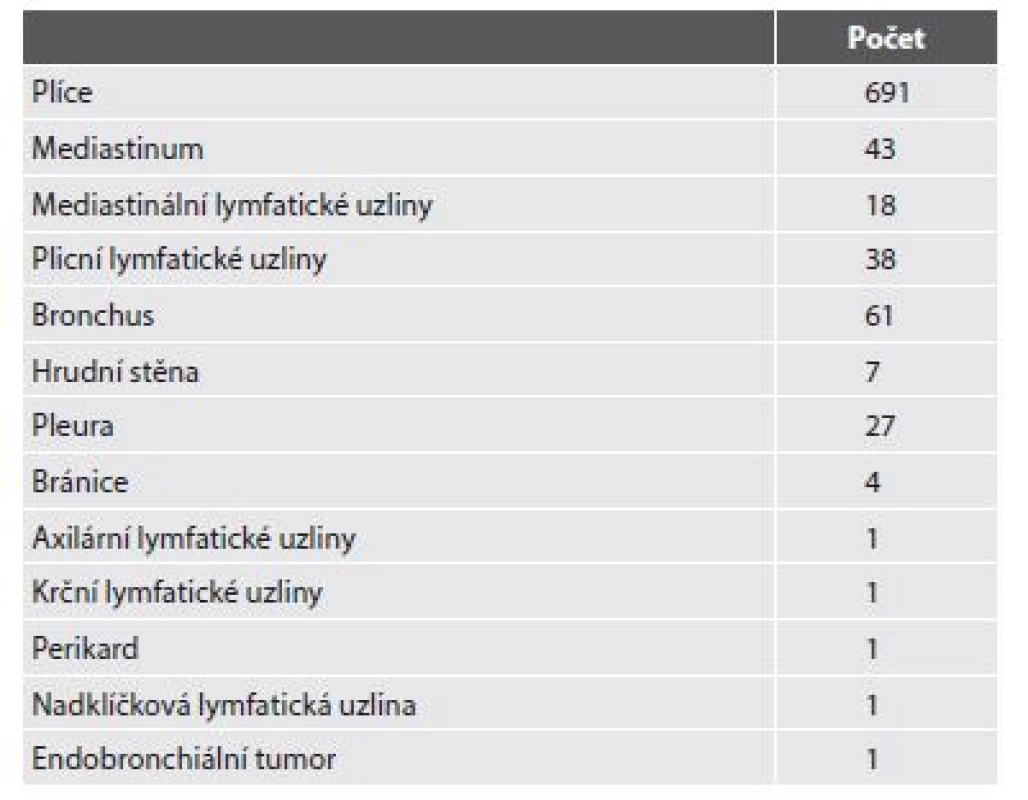
Co se týče odběrů z plic, tak zde převažovaly nádorové diagnózy (n=473) včetně chondrohamartomů (n=70). Nejvíce zastoupeny byly primárně plicní adenokarcinomy v počtu 161 a skvamocelulární karcinomy (n=62). Na peroperační vyšetření byly i indikovány metastázy nádorů z různých primárních lokalizací v plicním parenchymu, nejvíce jich bylo původem z gastrointestinálního traktu (n=32).
Nenádorová plicní ložiska byla ponejvíce podmíněná nekrotizujícími granulomatózními procesy (n=63), z nichž ve 14 případech byla potvrzena tuberkulóza a v 11 případech granulomatóza s polyangiitidou (dříve nazývaná Wegenerova granulomatóza). Ve 13 případech byla ložiska tvořená revmatoidními uzly, často šlo o primodiagnózu autoimunitního onemocnění. Nespecifické fibrotické změny plicního parenchymu či organizující (se) pneumonie podmiňovaly v 64 případech ložiskové léze v plicích viditelných na radiologických zobrazovacích metodách, kde však nádorový proces nebyl zastižen ani v definitivním vyšetření.
Resekční linie bronchu jsme vyšetřili celkově v 61 případech, z toho ve 2 byl nalezen mikroinvazivní skvamocelulární karcinom a odběr resekčního okraje se musel opakovat. V 21 resekčních liniích byla zaznamenána lehká až těžká dysplázie metaplastického dlaždicobuněčného epitelu bronchu.
Počet peroperačně zhotovených imunohistochemických průkazů TTF-1 exprese od roku 2007, kdy byla tato metoda zavedena, výrazně klesl. Z celkového počtu 691 plicních peroperačních vyšetřeních od roku 2013 do září roku 2017 byla metodika peroperačního imunohistochemického průkazu TTF-1 použita celkem u 24 případů. U 7 z těchto případů bylo TTF-1 peroperačně pozitivní. U dalších 3 případů jsme potvrdili primární původ z plic imunohistochemicky z definitivního materiálu, i když peroperační exprese TTF-1 byla u těchto vzorků zcela negativní, použitím dalších imunohistochemických markerů.
ZÁVĚR
Peroperační vyšetření nitrohrudních lézí hraje důležitou roli v léčebném procesu pacienta. Nezastupitelnou roli hraje zejména v oblasti plicních solitárních lézí, které nebylo možné diagnostikovat před operací a při peroperačním stagingu plicního tumoru. U centrálně uložených tumorů pak peroperační vyšetření slouží k vyšetření resekčních okrajů bronchů. Peroperační stanovení imunohistochemické exprese TTF-1 nám může pomoci rozhodnout, zda-li se jedná o primárně plicní nemalobuněčný karcinom či o metastázu z jiné primární lokalizace.
PODĚKOVÁNÍ
Práce podpořena částečně MZČR (projekt RVO-VFN 64165), Univerzitou Karlovou (projekt Progres Q28/LF1) a projektem OPPK (Výzkumné laboratoře nádorových onemocnění, CZ.2.16/3.1.00/24509).
PROHLÁŠENÍ
Autor práce prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i všech spoluautorů.
Adresa pro korespondenci:
Doc. MUDr. Radoslav Matěj, Ph.D.
Oddělení patologie a molekulární medicínyThomayerovy nemocnice
Vídeňská 800, Praha 4 – Krč, 140 59
tel.: 261083741
e-mail: radoslav.matej@ftn.cz
Sources
1. Sienko A, Allen TC, Zander DS, Cagle PT. Frozen section of lung specimens. Arch Pathol Lab Med 2005; 129(12): 1602-1609.
2. Van Schil PE, Balduyck B, De Waele M, Hendriks JM, Hertoghs M, Lauwers P. Surgical treatment of early-stage non-small-cell lung cancer. EJC Suppl 2013; 11(2): 110-122.
3. Sugarbaker DJ. Lung cancer. 6: The case for limited surgical resection in non-small cell lung cancer. Thorax 2003; 58(7): 639-641.
4. Marchevsky AM, Changsri C, Gupta I, Fuller C, Houck W, McKenna RJ, Jr. Frozen section diagnoses of small pulmonary nodules: accuracy and clinical implications. Ann Thorac Surg 2004; 78(5): 1755-1759.
5. Travis WD, Brambilla E, Burke AP, Marx A, Nicholson AG, eds. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart. IARC Lyon 2015; 4th ed.
6. Matěj R, Vedralová J, Koukolík F. Imunohistochemický průkaz TTF-1 v peroperačních bioptických vzorcích plicních adenokarcinomů: roční zkušenosti. Cesk Patol 2008; 44(2): 41-44.
7. Ikeda K, Clark JC, Shaw-White JR, Stahlman MT, Boutell CJ, Whitsett JA. Gene structure and expression of human thyroid transcription factor-1 in respiratory epithelial cells. J Biol Chem 1995; 270(14): 8108-8114.
8. Lazzaro D, Price M, de Felice M, Di Lauro R. The transcription factor TTF-1 is expressed at the onset of thyroid and lung morphogenesis and in restricted regions of the foetal brain. Development 1991; 113(4): 1093-1104.
9. Moldvay J, Jackel M, Bogos K, et al. The role of TTF-1 in differentiating primary and metastatic lung adenocarcinomas. Pathol Oncol Res 2004; 10(2): 85-88.
10. Zámečník J, Kodet R. Value of thyroid transcription factor-1 and surfactant apoprotein A in the differential diagnosis of pulmonary carcinomas: a study of 109 cases. Virchows Arch 2002; 440(4): 353-361.
11. Owen RM, Force SD, Gal AA, et al. Routine intraoperative frozen section analysis of bronchial margins is of limited utility in lung cancer resection. Ann Thorac Surg 2013; 95(6): 1859-1865; discussion 1865-1856.
12. Trousse D, Avaro JP. Mediastinal tumors: introduction. Rev Pneumol Clin 2010; 66(1): 3-16.
13. Lardinois D. Pre - and intra-operative mediastinal staging in non-small-cell lung cancer. Swiss Med Wkly 2011; 141w13168.
14. Attaran S, Jakaj G, Acharya M, Anderson JR. Are frozen sections of mediastinoscopy samples as effective as formal paraffin assessment of mediastinoscopy samples for a decision on a combined mediastinoscopy plus lobectomy? Interact Cardiovasc Thorac Surg 2013; 16(6): 872-874.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2018 Issue 3-
All articles in this issue
- Peroperační biopsie v gynekopatologii
- Peroperační biopsie plíce, pleury a mediastina: Retrospektivní analýza 5 let praktických zkušeností a přehled literatury
- Metody detekce molekulárních prognostických a prediktivních markerů v diagnostice adenoidně cystického karcinomu slinných žláz
- Klinicko-patologická analýza dôkazu ligandy proteínu 1 programovanej smrti v nádorových bunkách 325 pacientov s nemalobunkovým karcinómom pľúc: Prediktívny a potenciálny prognostický význam
- Aberantní axilární tkáň mléčné žlázy s pseudoangiomatózní stromální hyperplázií u muže
- JOSE VEROCAY - “Pražský patolog”.
- Pathology will stay as a cornerstone of personalized medicine
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Peroperační biopsie v gynekopatologii
- Aberantní axilární tkáň mléčné žlázy s pseudoangiomatózní stromální hyperplázií u muže
- Klinicko-patologická analýza dôkazu ligandy proteínu 1 programovanej smrti v nádorových bunkách 325 pacientov s nemalobunkovým karcinómom pľúc: Prediktívny a potenciálny prognostický význam
- Metody detekce molekulárních prognostických a prediktivních markerů v diagnostice adenoidně cystického karcinomu slinných žláz
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

