-
Medical journals
- Career
Klinicko-patologická analýza dôkazu ligandy proteínu 1 programovanej smrti v nádorových bunkách 325 pacientov s nemalobunkovým karcinómom pľúc: Prediktívny a potenciálny prognostický význam
: Anna Farkašová 1; Vladimír Tancoš 2; Zuzana Kviatkovská 1; Zdenko Huťka 1,2; Jozef Mičák 2; Karla Scheerová 1; Peter Szépe 1,2; Lukáš Plank 1,2
: Martinské bioptické centrum, s. r. o. v Martine 1; Ústav patologickej anatómie Jesseniovej lekárskej fakulty Univerzity Komenského a Univerzitnej nemocnice v Martine 2
: Čes.-slov. Patol., 54, 2018, No. 3, p. 137-142
: Original Articles
Úvod:
Vzhľadom k liečbe inhibítormi imunitných strážnych bodov, ktorá zlepšuje prognózu pacientov s pokročilým nemalobunkovým karcinómom pľúc, začína stúpať význam imunohistochemickej analýzy na dôkaz proteínového receptora programovanej smrti a jeho liganda, tzv. PD-L1 proteínu.
Materiál a metodika:
V našej práci prezentujeme výsledky analýzy imunohistochemickej expresie proteínu PD-L1 s použitím klónu 22C3 (na imunostaineri DAKO Link 48) na nádorových bunkách biopsií 325 pacientov s pľúcnym karcinómom. Hodnotenie expresie pomocou tzv. TPS skóre umožnilo rozdeliť súbor na negatívne prípady (žiadna pozitivita alebo menej ako 1 % pozitívnych buniek nádoru) verzus pozitívne, a to v kategóriách 1-9 %, 10-49 % a ≥ 50 % nádorových buniek.
Výsledky:
Pri porovnaní klinicko-patologických charakteristík podľa stupňa expresie sme zistili porovnateľnú pozitívnu expresiu u pacientov s adenokarcinómom (47,4 % prípadov) a so skvamocelulárnym karcinómom (44,4 %), pričom expresia sa nelíšila v závislosti od veľkosti vzorky pri delení na tzv. malé verzus veľké biopsie. U pacientov s adenokarcinómom sme pozorovali rozdiely expresie PD-L1 proteínu v podskupinách podľa predominantného histopatologického typu. V prípadoch s prevahou lepidického rastu sa pozitívna expresia vyskytla v 18,8 % prípadov, pri prevahe acinárneho a papilárneho rastu v 40,8 % a pri prevahe mikropapilárneho a solídneho rastu až v 74,1 % prípadov. Rohovatejúce skvamocelulárne karcinómy boli pozitívne v 38,5 % a nerohovatejúce v 53,8 % prípadov. Najčastejšia pozitivita vysokého stupňa bola pozorovaná v podskupine pacientov so sarkomatoidným karcinómom.
Diskusia a záver:
Imunohistochemicky verifikovaná expresia PD-L1 proteínu sa stala akceptovaným prediktívnym biomarkerom pre imunoterapiu pacientov s NSCLC. Naznačené rozdiely expresie podľa jednotlivých podtypov NSCLC vyžadujú verifikáciu vo väčších súboroch v korelácii s klinickými parametrami ochorenia v zmysle overenia jej použiteľnosti aj ako potenciálneho negatívneho prognostického faktora.
Kľúčové slová:
liganda proteínu 1 programovanej smrti – nemalobunkový karcinóm pľúc – imunoterapia – prognostický ukazovateľ
Pľúcny karcinóm je v našej populácii aj celosvetove jednou z najčastejších príčin úmrtia na nádorové ochorenie, pričom majoritnú časť prípadov predstavujú jeho typy (NSCLC). Ochorenie je v čase stanovenia diagnózy väčšinou pokročilé, metastatické a prognóza pacienta ostáva zlá. Používanie konvenčnej platinovej chemoterapie je spojené so závažnými vedľajšími účinkami, selekciou rezistentných klonov a neúspechmi v liečbe metastatického ochorenia. Rozvoj poznania molekulovej karcinogenézy NSCLC otvoril nové možnosti tzv. cielenej liečby istej podskupine pacientov so špecifickými genetickými alteráciami. Napriek jej klinickým benefitom u väčšiny pacientov po čase vzniká rezistencia na tieto terapeutické postupy. Aj preto je dopyt po nových liečebných modalitách vysoký.
NSCLC patrí biologicky medzi najkomplexnejšie formy rakoviny, ktorej bunky podliehajú početným genetickým a epigenetickým zmenám. Tie vedú k tvorbe tumor-asociovaných antigénov, potenciálne rozpoznateľných imunitným systémom. Nádorové bunky si však dokážu osvojiť špecifické mechanizmy imunitnej rezistencie. Jedným z nich je ich interferencia s tzv. imunitnými strážnymi bodmi, ktoré sprostredkúvajú fyziologickú imunitnú toleranciu (1). V kontexte liečby inhibítormi imunitných strážnych bodov sú dnes predmetom záujmu najmä signálne dráhy sprostredkované proteínovým receptorom programovanej smrti (ďalej PD-1, z angl. programmed death protein 1) a jeho ligandom (ďalej PD-L1). PD-1 je jeden z najdôležitejších inhibičných koreceptorov exprimovaných na aktivovaných T-lymfocytoch. Interakcia PD-1 s jeho hlavným ligandom PD-L1 (tiež označovaný ako B7-H1) spúšťa v T-lymfocytoch defosforylačnú dráhu, ktorá vedie k zníženiu signalizácie cez T-bunkový receptor, redukuje produkciu cytokínov a cytolytickú aktivitu T-buniek (2). Aberantná expresia PD-L1, pozorovaná v mnohých malignitách, predstavuje zásadný krok vo vývoji a progresii nádorového ochorenia (3,4). Pochopenie zvýšenej expresie PD-1 v nádor infiltrujúcich lymfocytoch a zvýšenej expresie PD-L1 v nádorových bunkách sa stalo podkladom úspechov anti-PD-1/PD-L1 imunoterapie v celom rade solídnych aj hematologických malignít (2).
Keďže aj NSCLC predstavuje imunologicky ovplyvniteľnú skupinu nádorov, podobné liečebné modality sa začali uplatňovať aj v liečbe pacientov s NSCLC (5,6). To viedlo k pátraniu po potenciálne prediktívnych biomarkerov použiteľných v dennej bioptickej praxi. Pre indikovanie anti-PD-1/PD-L1 imunoterapie sa tak ukázalo byť najužitočnejšie imunohistochemické (IHC) stanovenie expresie PD-L1 proteínu na membráne nádorových buniek (7,8), aj keď je spojené s pestrým komplexom problémov (9,10). V našej pilotnej štúdii sme analyzovali expresiu PD-L1 proteínu v sérii biopsií pacientov s NSCLC v snahe overiť možnosti jeho detekcie pre klinickú onkologickú prax a zistiť prevalenciu jeho expresie v jednotlivých podtypoch NSCLC pacientov v našej populácii.
MATERIÁL A METODIKA
Populácia vyšetrených pacientov
Analýza zahŕňa konzekutívnu sériu bioptických vyšetrení malých a veľkých biopsií 325 pacientov s NSCLC vyšetrených v období pribl. 11 mesiacov (1.9.2016-15.7.2017), pričom počas hodnoteného obdobia sa nevyskytol žiadny prípad opakovaného bioptického vyšetrenia toho istého pacienta. Biopsie fixované vo formalíne nám boli poslané buď priamo klinickým pracoviskom, alebo nepriamo (vo forme parafínových blokov) regionálnym patológom na diagnostické riešenie zahrňujúce molekulovo-genetické analýzy. Počas implementácie metodiky sme vyšetrovali expresiu PD-L1 v biopsiách pacientov s NSCLC typu adenokarcinómu (AC) reflexne súbežne s verifikáciou typizácie a s testovaním tzv. driver genetických alterácií na dôkaz mutácie génu EGFR, ako aj alterácie ALK, resp. ROS1 génov, vrátane IHC dôkazu im zodpovedajúcich proteínov. Po skončení implementácie sme v súlade s požiadavkou klinickej praxe reflexne vyšetrovali IHC expresiou PD-L1 proteínu len v prípadoch s diagnostikovaným AC, v ktorých sme nedokázali tzv. driver genetickú alteráciu. Na požiadanie klinického (pneumo-)onkológa sme potom vyšetrovali expresiu PD-L1 aj v prípadoch NSCLC typu skvamocelulárneho karcinómu (SCC), ojedinele aj s testovaním genetických alterácií.
Verifikácia histologického (pod-)typu a „grading“ NSCLC
Histopatologický typ a podtyp NSCLC bol určovaný v súlade s klasifikáciou pľúcnych nádorov podľa SZO (11), resp. s klasifikáciou podľa IASLC/ATS/ERS z r. 2011 (12), čo umožňuje aj rozdelenie nádorov do prognosticky rozdielnych skupín (11). Podľa uvedených princípov nádor diagnostikovaný vo veľkej biopsii ako predominantne lepidický AC zodpovedá G1, predominantne acinárny alebo predominantne papilárny podtyp AC G2, zatiaľčo predominantne solídny alebo predominantne mikropapilárny AC zodpovedajú G3. V prípade SCC sme v súlade s klasifikáciou SZO (11) použili rozdelenie prípadov na keratinizujúce verzus nekeratinizujúce. V prípadoch tzv. malých biopsií sme používali len skupinovú diagnózu NSCLC typu AC verzus SCC, resp. najskôr AC verzus najskôr SCC.
IHC dôkaz expresie PD-L1 proteínu
Na IHC analýzu expresie PD-L1 proteínu sme použili parafínové rezy bioptického materiálu a na revitalizáciu PT Link a roztok LpH (low pH) pri 96 ⁰C po dobu 20 minút. IHC reakcia prebiehala v automate Autostainer Link 48 s použitím kitu PD-L1 IHC 22C3 PharmDx (RTU) v súlade s protokolom kitu a po laboratórnej validácii od 1.12.2016 aj monoklonálnu protilátku anti-PD-L1 (klon 22C3) v riedení 1 : 50 s inkubáciou cez noc. Prevažná časť vyšetrení expresie PD-L1 proteínu nášho súboru (n=302) bola robená s použitím kitu a menšia (n=23) s použitím monoklonálnej protilátky. Vo vyššie uvedenom procese validácie boli súčasne obidvomi postupmi vyšetrené vzorky 20 pacientov s rôznou už známou expresiou PD-L1, pričom pri hodnotení oboch postupov každej zo vzoriek boli zistené identické výsledky. Detekcia reakcie prebehla pomocou detekčného kitu EnVision Flex. Všetky uvedené reagencie a platformy boli zakúpené od spoločnosti (Dako/Agilent, Dánsko). Iné anti-PD-L1 protilátky v rámci tejto štúdie neboli použité. Každý beh v staineri prebiehal súčasne s použitím pozitívnej bunkovej kultúry (súčasť kitu), ako aj pozitívnej a negatívnej kontroly vlastného predtým verifikovaného a validovaného prípadu z nášho registra, a to aj pri vyšetreniach s protilátkou anti-PD-L1.
Hodnotenie expresie PD-L1 proteínu
Hodnotenie výsledku sme vyjadrovali binárne (negatívny výsledok verzus pozitívny), s využitím skórovacieho systému podľa tzv. TPS („tumor proportion score“). Za pozitívny výsledok expresie bola považovaná prítomnosť membránového farbenia akejkoľvek intenzity vo viac ako 1 % nádorových buniek. Absencia tohto nálezu alebo pozitivita v menej ako 1 % nádorových buniek boli klasifikované ako negatívny nález. V skupine prípadov s pozitívnym výsledkom expresie PD-L1 proteínu sme rozlišovali podskupiny s expresiou PD-L1 proteínu v 1-9 %, 10-49 % nádorových buniek a s expresiou PD-L1 proteínu v ≥ 50 % nádorových buniek. Príklady IHC expresie podľa jednotlivých kategórií sú uvedené v obr. 1-10.
Obr. 1. Negatívny nález - absencia expresie PD-L1 proteínu v nádorových bunkách (pozitivita len v imunitných bunkách), zväčš. 10x, metodika je uvedená v texte.
Obr. 2. Detail z obr. 1, zväčš. 40x.
Obr. 3. Pozitívna expresia PD-L1 proteínu v rozsahu 1-9% nádorových buniek, zväčš. 10x
Obr. 4. Detail z obr. 3, zväčš. 40x.
Obr. 5. Pozitívna expresia PD-L1 proteínu v rozsahu 10-49% nádorových buniek, zväčš. 10x
Obr. 6. Detail z obr. 5, zväčš. 40x
Obr. 7. Pozitívna expresia PD-L1 proteínu v rozsahu ≥ 50% nádorových buniek, zväčš. 10x
Obr. 8. Detail z obr. 7, zväčš. 40x
Obr. 9. Pozitívna expresia PD-L1 proteínu v „100%“ (rozsahu ≥ 50%) nádorových buniek, zväčš. 10x
Obr. 10. Detail z obr. 9, zväčš. 40x
Pozn.: Za hodnotenie expresie každého prípadu zodpovedali AF a LP, na validácii expresie sa podieľal aj PS, pričom LP a PS získali európsky certifikát potvrdzujúci zaškolenie do uvedeného TPS hodnotenia expresie PD-L1 proteínu s klonom 22C3.
Klinicko-patologická analýza expresie PD-L1 proteínu
Klinicko-patologickú analýza predloženej série zahŕňa rozdelenie prípadov podľa typov, podtypov, stupňa diferenciácie, resp. výskytu genetickej alterácie, a to vždy vo vzťahu týchto parametrov ku expresii PD-L1 proteínu.
VÝSLEDKY
Celkový počet pacientov zahrnutých do našej štúdie bol 325 s nasledovným podielom jednotlivých typov pľúcneho karcinómu: a) prevládajúcu skupinu 71,4 % prípadov tvoria pacienti s NSCLC typu AC (n=232), b) pacienti s NSCLC typu SCC tvoria pribl. 1/5 súboru (63 prípadov = 19,4 %) a c) 9,2 % prípadov sú pacienti s iným typom karcinómu. Podrobné výsledky typizácie a incidencie jednotlivých typov, resp. podtypov vyšetrených prípadov pľúcnych karcinómov sú uvedené prehľadne v tab. č. 1. V súbore prevládajú vyšetrenia IHC expresie PD-L1 proteínu v prípadoch bez mutácie génu EGFR, resp. bez prestavby ALK a ROS1 génu (n=302). V biopsiách 23 pacientov s NSCLC bola dokázaná genetická „driver“ alterácia a súčasne vyšetrená aj IHC expresia PD-L1, tieto prípady sú uvedené v tab. č. 2.
1. Expresia PD-L1 v jednotlivých histologických podtypoch NSCLC. 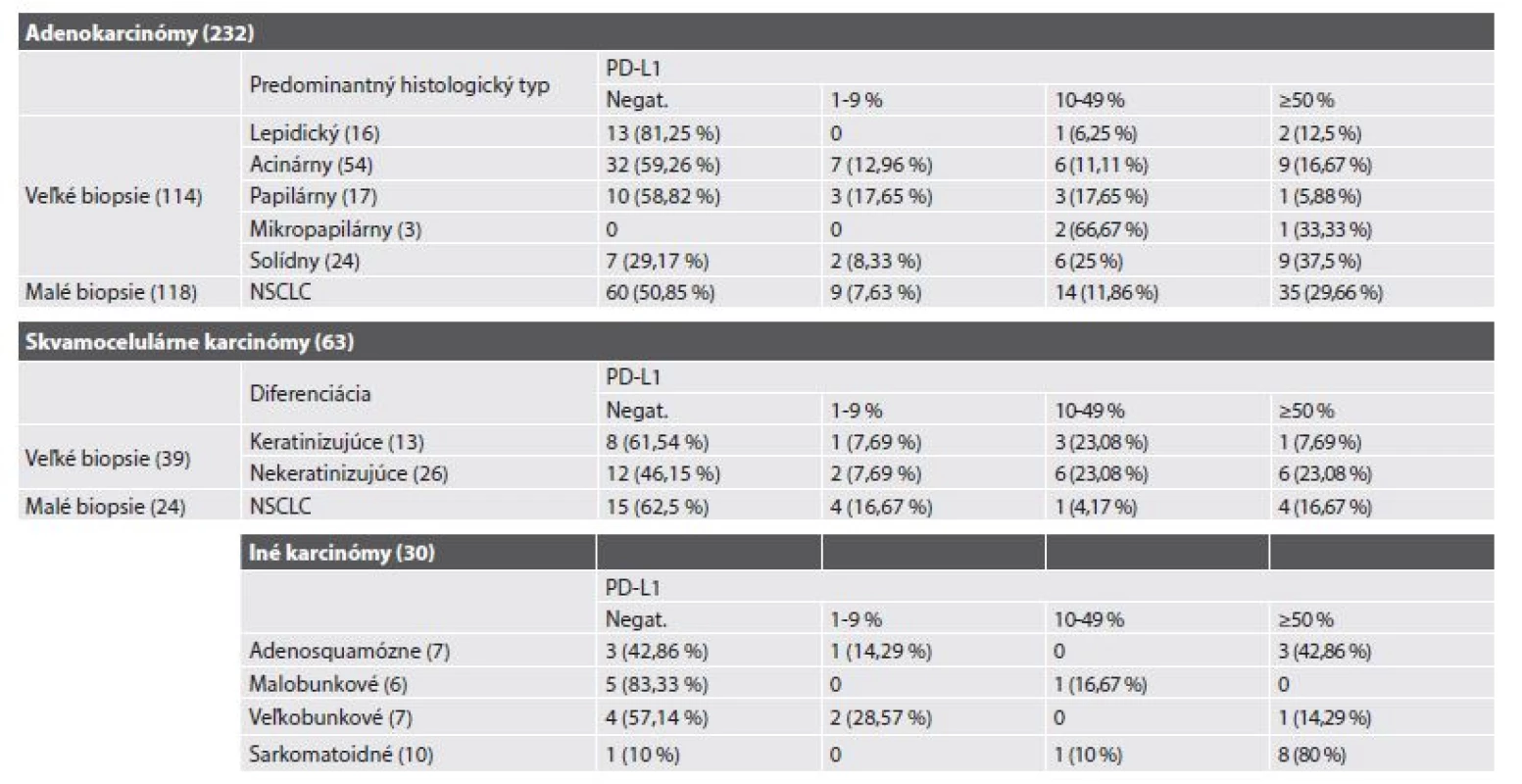
2. Expresia PD-L1 proteínu v biopsiách 23 pacientov s NSCLC s pozitívnou „driver“ genetickou alteráciou (mutáciou EGFR génu, resp. prestavbou ALK alebo ROS1 génu). 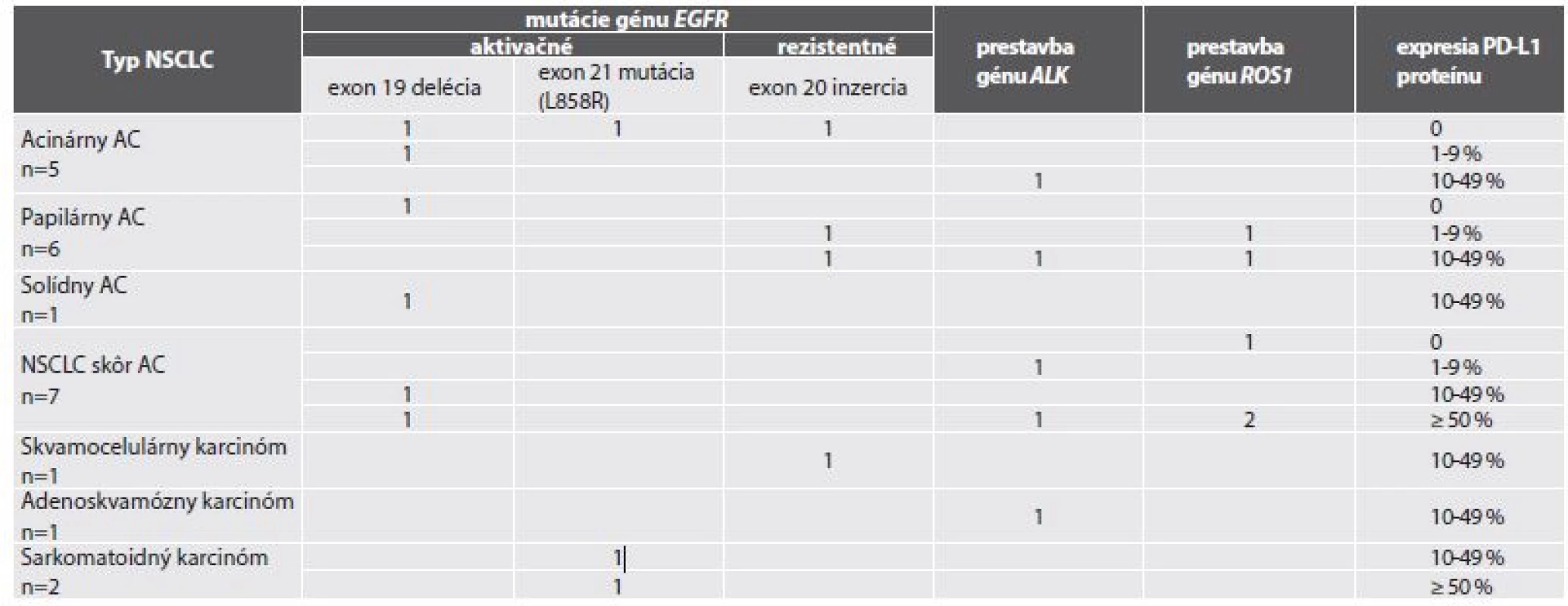
V celom analyzovanom súbore sme nezistili podstatné rozdiely:
- medzi pozitívnou expresiou PD-L1 proteínu v prípadoch AC verzus SCC, keď v skupine 232 pacientov s NSCLC typu AC bolo PD-L1 pozitívnych 47,4 % prípadov a v skupine 63 prípadov s SCC 44,4 % prípadov,
- takisto ani medzi expresiou PD-L1 proteínu v identických typoch NSCLC v závislosti od veľkosti analyzovanej vzorky: v podskupine 114 pacientov s NSCLC typu AC diagnostikovaným vo veľkej biopsii bola pozitivita zistená v 45,6 % prípadov (n=52/114) a v podskupine 118 pacientov s AC verifikovaným v malej biopsii v 49,1 % prípadov (n=58/118). V podskupine 39 pacientov s nádorom typu SCC diagnostikovaným v resekáte bola pozitivita zistená v 48,7 % prípadov (n=19/39) a v podskupine 24 pacientov s SCC zisteným v malej biopsii v 37,5 % prípadov (n=9/24).
Súčasne sme identifikovali nasledovné rozdiely expresie PD-L1 proteínu:
- a) pri binárnom rozlíšení, t.j. absencia PD-L1 pozitivity verzus pozitivita ľubovoľného stupňa expresie PD-L1 proteínu podľa predominantného typu AC, resp. keratinizácie SCC (len v prípadoch veľkých biopsií) a to nasledovne:
- - v prípadoch AC s prevahou lepidického rastu bolo PD-L1 pozitívnych 18,8 % prípadov, v prípadoch s prevahou acinárneho alebo papilárneho rastu (G2 AC) 40,8 % a v biopsiách s prevahou solídneho alebo mikropapilárneho typu (G3 AC) 74,1 % prípadov,
- - v prípadoch SCC bolo v skupine keratinizujúcich nádorov pozitívnych 38,5 % a v skupine nekeratinizujúcich SCC 53,8 % všetkých prípadov,
- b) pri porovnaní pozitivity s verifikovaným TPS ≥ 50 % nádorových bunkách podľa jednotlivých histopatologických typov: táto pozitivita bola prítomná v 24,6 % prípadov AC a v 17,5 % prípadov SCC,
- c) v 9 z 10 prípadoch zo skupiny sarkomatoidných karcinómov (90 %) bola PD-L1 pozitivita v 1 prípade v rozmedzí 10-49 % a v 8 prípadoch (80 % všetkých) išlo o silnú pozitivitu s TPS ≥ 50 %,
- d) v súbore 23 prípadov NSCLC s dokázanou genetickou „driver“ alteráciou (tab. č. 2) bolo 13 pacientov s mutáciou génu EGFR (9 s aktivačnou a 4 s tzv. rezistentnou): v 4 prípadoch bol výsledok expresie PD-L1 negatívny, v 2 bola pozitivita na úrovni 1-9 %, v 5 na úrovni 10-49 % a v dvoch bolo TPS ≥ 50 %. V skupine 10 pacientov s prestavbou génu ALK1 (n=5) alebo ROS1 (n=5) bol výsledok expresie PD-L1 negatívny v jednom prípade, v dvoch prípadoch bola pozitivita na úrovni 1-9 %, v štyroch bola expresia PD-L1 v rozmedzí 10-49 % a v troch v hodnote ≥ 50 % nádorových buniek.
DISKUSIA
V posledných rokoch imunoterapia preukázateľne prispela k zlepšeniu prognózy pacientov s pokročilým NSCLC a stala sa fakultatívnou liečebnou modalitou tohto ochorenia. Inhibítory anti-PD-1 (nivolumab a pembrolizumab) a najnovšie aj anti-PD-L1 (atezolizumab) boli najprv používané v druhej línii terapie, dnes už je pembrolizumab akceptovaný do prvolíniovej liečby pacientovs vysokou hodnotou PD-L1 pozitivity (TPS ≥ 50 %) (13-15). Tak sa zároveň preukázala dôležitosť IHC stanovenia hodnotyPD-L1 v bioptickom materiáli NSCLC, lebo expresia PD-L1 proteínu je dosiaľ v klinickej praxi jediným reálne využívaným prediktívnym biomarkerom. Pri aplikácii anti-PD-1/PD-L1 imunoterapie pacienti s PD-L1 pozitívnymi NSCLC vykazujú vyššiu celkovú odpoveď a dlhšie celkové prežívanie než PD-L1 negatívni pacienti (5,6,16). PD-L1 ale nie je dokonalý biomarker. Jeho negativita nevylučuje možnosť, že pacient bude profitovať z imunoterapie a naopak, približne polovica pacientov aj s vysokým stupňom PD-L1 pozitivity patrí v praxi medzi “non-responderov” (17). Je zrejmé, že sme na začiatku cesty hľadania a overovania ďalších biomarkerov. Už dnes sa uvažuje o korelácii produkcie PD-L1 proteínu s tvorbou neoantigénov pri stúpajúcom počte genetických zmien v nádorovej bunke, či o korelácii s tzv. mutačnou náložou nádoru (18). Nami analyzovaná podskupina pacientov s dokázanou genetickou driver alteráciou je primalá na závažnejšiu výpoveď, aj keď istá tendencia v tomto smere je zrejmá v podskupine NSCLC s prestavbou ALK, resp. ROS1 génov.
Celkove sme v rámci našej analýzy s použitím preddefinovanej IHC metodiky (klon 22C3) a kritérií hodnotenia (podľa odporúčaní výrobcu eseje) v súbore 325 vyšetrených prípadov pľúcneho karcinómu identifikovali 47,7 % (n=155) prípadov s pozitivitou a 52,3 % (n=170) prípadov bez expresie PD-L1 proteínu. Literárne sa pozitivita PD-L1 v NSCLC udáva v rozmedzí od 20 % do 70 % prípadov (19-23). Ideálna hranica hodnoty „cut-off“ pre pozitivitu tejto expresie stále nie je jednoznačne určená a v klinických štúdiách použité hodnoty predstavujú len arbitrárne číslo. Taktiež nie je spoľahlivo zodpovedaná otázka reprodukovateľnosti IHC expresie PD-L1 proteínu pri použití odlišných esejí od rôznych výrobcov pri hodnotení expresie PD-L1 v nádorových a ešte menej v imunitných bunkách. Predbežné výsledky projektu vedeného snahou o rozriešenie daného problému (tzv. Blueprint) ale poukazujú na skutočnosť, že zámenné používanie niektorých klonov (22C3, 28-8 a SP263) je pravdepodobne legitímne (9,10). Preto je celosvetove netrpezlivo očakávaná štandardizácia a unifikácia IHC metodík na dôkaz PD-L1 proteínu a jeho hodnotenia.
Ďalšie zložitosti vyšetrovania PD-L1 proteínu súvisia s dynamikou jeho expresie počas evolúcie ochorenia, vrátane fenoménu vnútronádorovej heterogenity. Aj keď to vedie k pochybnostiam o výpovednej hodnote malých biopsií (24), tak výsledky našej analýzy tu ponúkajú optimistickejší pohľad. Incidencia PD-L1 pozitívnych prípadov v kategórii NSCLC typu AC bola porovnateľná pri vyšetrovaní malých (49,1 %) a veľkých biopsií (45,6 %). Len v kategórii SCC bol záchyt pozitívnych prípadov menší v podskupine malých biopsií (37,5 % verzus 48,7 %), čo môže byť ovplyvnené menším počtom testovaných prípadov SCC v porovnaní s nádormi typu AC v dôsledku zvoleného algoritmu vyšetrení.
Klinicko-patologické charakteristiky PD-L1 exprimujúcich NSCLC nie sú stále dokonale objasnené. Recentné metaanalýzy nezistili signifikantný rozdiel v hodnote pozitívnej expresie PD-L1 proteínu v pľúcnych AC pri porovnaní so SCC (25,26). V absolútnom počte všetkých nami hodnotených AC a SCC sme dospeli k podobným výsledkom aj my. Incidencia prípadov našej série s TPS ≥ 50 % nádorových buniek však bola vyššia v kategórii AC, čo môže opäť súvisieť s už konštatovaným limitom podskupiny pacientov s SCC. Aj keď pľúcne AC predstavujú biologicky veľmi heterogénnu skupinu nádorov, tak väčšina prác pri hodnotení expresie PD-L1 proteínu ich uvádza ako celok bez ďalšieho typizačného delenia. Počet štúdií, ktoré sa zaoberajú expresiou PD-L1 v jednotlivých histologických podtypoch pľúcnych AC je tak relatívne obmedzený. Situáciu tu komplikuje aj skutočnosť, že subtypizácia NSCLC typu AC diagnostikovaného v resekčnej biopsii do piatich základných rastových vzorov vlastne nahrádza absenciu celosvetovo akceptovaného gradingu týchto nádorov (11). Pri známej vnútronádorovej heterogenite je pre prognosticky-asociovaný „grading“ rozhodujúci predominantný rastový vzor a nie (na rozdiel od princípov gradingu iných karcinómov) prítomnosť najmenej diferencovanej komponenty (11, 12).
V tomto kontexte naša analýza prípadov s použitím recentných klasifikácií NSCLC (11,12) umožňuje poukázať na trend stúpajúcej pozitivity PD-L1 od prípadov s prevahou vzoru typu lepšie diferencovaného AC až po prípady s prevahou menej diferencovaných foriem. PD-L1 pozitívne prípady pľúcnych AC v našej sérii prípadov boli menej časté v nádoroch predominantne lepidického podtypu a častejšie v nádoroch predominantne solídneho podtypu. Toto zistenie je podporované výsledkami iných autorov, ktorí diskutujú o asociácii pozitívnej expresie PD-L1 proteínu s vlastnosťami nádoru ako sú nízka diferenciácia a solídny rast AC (22,27-28). Podobný trend sme pozorovali aj v prípade SCC, kedy pozitivita bola vyznačená vo viac než ½ (53,8 %) menej diferencovaných a v 38,5 % prípadov dobre diferencovaných prípadov. Obzvlášť vysoká incidencia PD-L1 pozitivity bola pozorovaná v skupine sarkomatoidných karcinómov s prevahou silnej pozitivity (TPS ≥ 50 %) v prevažnej väčšine (80 %) prípadov. K podobným konštatovaniam o vyššej PD-L1 expresii (v rozmedzí 53-90 %) v sarkomatoidnom karcinóme v porovnaní s konvenčnými NSCLC dospeli aj viaceré publikované pozorovania (29,30,31). Tento jav môže súvisieť aj s asociáciou expresie PD-L1 so zvýšenou expresiou vimentínu a zníženou E-cadherínu, t.j. s fenotypom epitelovo-mezenchýmového prechodu (28). Induktorom uvedeného prechodu je aktivácia ZEB1 cestou supresie miR-200, čo súčasne zvyšuje expresiu PD-L1 a následne znižuje protinádorovú imunitu a dôsledkom je vyššia migrácia, metastatický potenciál a agresivita nádoru (32).
Ak sa trendy zvyšovania expresie PD-L1 v závislosti od stupňa diferenciácie a nadobúdania fenotypu epitelovo-mezenchýmového prechodu potvrdia na väčšom súbore prípadov, tak môžu prispieť k diskusii o potenciáli prognostického významu expresie PD-L1 v pľúcnych karcinómoch. Pri analýze literárnych údajov je totiž zrejmá protirečivosť údajov podľa rôznych autorov. Niektorí vyššiu expresiu PD-L1 v NSCLC považujú za negatívny (22,28,33), iní za pozitívny prognostický faktor (20,34) a časť autorov žiadny prognostický význam nepotvrdila (19,35). Rozdiely môžu súvisieť s už diskutovanými problémami vyšetrovania PD-L1 proteínu, s reprezentatívnosťou hodnotených súborov, s rozdielmi v ich populačných charakteristikách a pod. My sa na základe zistenia, že IHC pozitivita PD-L1 je častejšie a vyššie exprimovaná v menej diferencovaných prevládajúcich typoch pľúcneho karcinómu prikláňame k názoru o potrebe verifikácie tohto trendu vo väčších súboroch v korelácii s klinickými parametrami ochorenia. To by pripustilo možnosť selekcie pacientov pre indikovanie imunoterapie. Napríklad pre pacientov s predominantne solídnym AC, t.j. podtypom NSCLC s nepriaznivou prognózou a silno asociovaným s farmakologicky nenapadnuteľnými mutáciami génu KRAS (36) by sa anti–PD-1/PD-L1 imunoterapia mohla stať vhodnou liečebnou alternatívou.
Záverom možno zhrnúť, že expresia PD-L1 proteínu nádorovými bunkami odzrkadľuje potenciálne aktívne imunitné mikroprostredie. Napriek všetkým aj tu diskutovaným problémom dnes predstavuje nezávislý prediktívny parameter, ktorý dosiaľ najtesnejšie koreluje s úspechom anti–PD-1/PD-L1 imunoterapie (37,38). Hlbšie pochopenie imunitného profilu “responderov” a “non-responderov” IHC komplexnými anlýzami expresie génov nádoru a jeho mikroprostredia určite v blízkej budúcnosti objasnia protinádorové imunitné mechanizmy, prispejú k využitiu inhibítorov imunitných kontrolných bodov a potenciálne môžu viesť k objaveniu nových terapeutických metód. V predkladanej štúdii, ktorá je podľa našich znalostí prvá svojho druhu v rámci Česka a Slovenska, prezentujeme výsledky IHC analýzy expresie PD-L1 na 325 vzorkách pľúcnych karcinómoch v závislosti od typu a podtypu nádoru.
PREHLÁSENIE
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikovaním tohto článku nie je v konflikte záujmov a vznik ani publikovanie článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlasenie sa týka i všetkých spoluautorov.
Adresa pre korešpondenciu:
prof. MUDr. Lukáš Plank, CSc.
ÚPA JLF UK a UNM
Kollárova 2, 03659 Martin, Slovensko
tel.: +421-43-4133002,
e-mail: plank@jfmed.uniba.sk
Sources
1. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer 2012; 12(4): 252-264.
2. Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity 2013; 39(1):1-10.
3. Taube JM, Klein A, Brahmer JR, et al. Association of PD-1, PD-1 ligands, and other features of the tumor immune microenvironment with response to anti-PD-1 therapy. Clin Cancer Res 2014; 20(19): 5064–5074.
4. Patel SP, Kurzrock R. PD-L1 expression as a predictive biomarker in cancer immunotherapy. Mol Cancer Ther 2015; 14(4): 847-856.
5. Gettinger SN, Horn L, Gandhi L, et al. Overall survival and long-term safety of nivolumab (anti-programmed death 1 antibody, BMS-936558, ONO-4538) in patients with previously treated advanced non-small-cell lung cancer. J Clin Oncol 2015; 33(18): 2004-2012.
6. Fehrenbacher L, Spira A, Ballinger M, et al. Atezolizumab versus docetaxel for patients with previously treated non-small-cell lung cancer (POPLAR): a multicenter, open-label, phase 2 randomised controlled trial. Lancet 2016; 387(10030): 1837-1846.
7. Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012; 366(26): 2443-2454.
8. Taube JM, Klein A, Brahmer JR, et al. Association of PD-1, PD-1 ligands, and other features of the tumor immune microenvironment with response to anti-PD-1 therapy. Clin Cancer Res 2014; 20(19): 5064-5074.
9. Hirsch FR, McElhinny A, Stanforth D, et al. PD-L1 Immunohistochemistry Assays for Lung Cancer: Results from Phase 1 of the Blueprint PD-L1 IHC Assay Comparison Project. J Thorac Oncol 2017; 12(2): 208-222.
10. Matěj R. Hodnocení exprese PD-L1 u tzv. nemalobuněčných karcinomů plic je a bude složité. Cesk Patol 2017; 53(3): 113.
11. Travis WD, Brambilla E, Burke AP, Marx A, Nicholson AG, eds. WHO Classification of Tumours of the Lung, Pleura, Thymus and Heart (4th ed). Lyon, IARC; 2015.
12. Travis WD, Brambilla E, Noguchi M, et al. International association for the study of lung cancer/american thoracic society/european respiratory society international multidisciplinary classification of lung adenocarcinoma. J Thorac Oncol 2011; 6(2): 244–285.
13. Kazandjian D, Suzman DL, Blumenthal G, et al. FDA approval summary: nivolumab for the treatment of metastatic non-small cell lung cancer with progression on or after platinum-based chemotherapy. Oncologist 2016; 21(5): 634–642.
14. Sul J, Blumenthal GM, Jiang X, He K, Keegan P, Pazdur R. FDA approval summary: pembrolizumab for the treatment of patients with metastatic non-small cell lung cancer whose tumors express programmed death-ligand 1. Oncologist 2016; 21(5): 643–650.
15. Seetharamu N, Preeshagul IR, Sullivan KM. New PD-L1 inhibitors in non-small cell lung cancer - impact of atezolizumab. Lung Cancer 2017; 8 : 67-78.
16. Herbst RS, Baas P, Kim DW, et al. Pembrolizumab versus docetaxel for previously treated, PD-L1-positive, advanced non-small-cell lung cancer (KEYNOTE-010): a randomised controlled trial. Lancet 2016; 387(10027): 1540-1550.
17. Gridelli C, Ardizzoni A, Barberis M, et al. Predictive biomarkers of immunotherapy for non-small cell lung cancer: results from an Experts Panel Meeting of the Italian Association of Thoracic Oncology. Transl Lung Cancer Res 2017; 6(3): 373-386.
18. Rizvi NA, Hellmann MD, Snyder A, et al. Mutational landscape determines sensitivity to PD-1 blockade in non–small cell lung cancer. Science 2015; 348(6230): 124–128.
19. Boland JM, Kwon ED, Harrington SM, et al. Tumor B7-H1 and B7-H3 expression in squamous cell carcinoma of the lung. Clin Lung Cancer 2013; 14(2): 157-163.
20. Velcheti V, Schalper KA, Carvajal DE, et al.
Programmed death ligand-1 expression in non-small cell lung cancer. Lab Invest 2014; 94(1): 107-116.
21. Yang CY, Lin MW, Chang YL, Wu CT, Yang PC. Programmed cell death-ligand 1 expression in surgically resected stage I pulmonary adenocarcinoma and its correlation with driver mutations and clinical outcomes. Eur J Cancer 2014; 50(7): 1361-1369.
22. Zhang Y, Wang L, Li Y, et al. Protein expression of programmed death 1 ligand 1 and ligand 2 independently predict poor prognosis in surgically resected lung adenocarcinoma. Onco Targets Ther 2014; 7 : 567-573.
23. Mao Y, Li W, Chen K, et al. B7-H1 and B7-H3 are independent predictors of poor prognosis in patients with non-small cell lung cancer. Oncotarget 2015; 6(5): 3452-3461.
24. Ilie M, Long-Mira E, Bence C, et al. Comparative study of the PD-L1 status between surgically resected specimens and matched biopsies of NSCLC patients reveal major discordances: a potential issue for anti-PD-L1 therapeutic strategies. Ann Oncol 2016; 27 : 147-153.
25. Wang A, Wang HY, Liu Y, et al. The prognostic value of PD-L1 expression for non-small cell lung cancer patients: a meta-analysis. Eur J Surg Oncol 2015; 41(4): 450-456.
26. Pan ZK, Ye F, Wu X, An HX, Wu JX. Clinicopathological and prognostic significance of programmed cell death ligand1 (PD-L1) expression in patients with non-small cell lung cancer: a meta-analysis. J Thorac Dis 2015; 7(3): 462-470.
27. Koh J, Go H, Keam B, et al. Clinicopathologic analysis of programmed cell death-1 and programmed cell death ligand 1 and 2 expressions in pulmonary adenocarcinoma: comparison with histology and driver oncogenic alteration status. Mod Pathol 2015; 28(9): 1154-1166.
28. Shimoji M, Shimizu S, Sato K, et al. Clinical and pathologic features of lung cancer expressing programmed cell death ligand 1 (PD-L1). Lung Cancer 2016; 98 : 69-75.
29. Kim S, Kim MY, Koh J, et al. Programmed death-1 ligand 1 and 2 are highly expressed in pleomorphic carcinomas of the lung: Comparison of sarcomatous and carcinomatous areas. Eur J Cancer 2015; 51(17): 2698-2707.
30. Vieira T, Antoine M, Hamard C, et al. Sarcomatoid lung carcinomas show high levels of programmed death ligand-1 (PD-L1) and strong immune-cell infiltration by TCD3 cells and macrophages. Lung Cancer 2016; 98 : 51–58.
31. Chang YL, Yang CY, Lin MW, Wu CT, Yang PC. High co-expression of PD-L1 and HIF-1α correlates with tumour necrosis in pulmonary pleomorphic carcinoma. Eur J Cancer 2016; 60 : 125-135.
32. Chen L, Gibbons DL, Goswami S et al. Metastasis is regulated via microRNA-200/ZEB1 axis control of tumour cell PD-L1 expression and intratumoral immunosuppression. Nat Commun 2014; 5 : 5241.
33.Sun JM, Zhou W, Choi YL, et al. Prognostic Significance of PD-L1 in Patients with Non-Small Cell Lung Cancer: A Large Cohort Study of Surgically Resected Cases. J Thorac Oncol 2016; 11(7): 1003-1011.
34. Schmidt LH, Kümmel A, Görlich D, et al. PD-1 and PD-L1 Expression in NSCLC Indicate a Favorable Prognosis in Defined Subgroups. PLoS One 2015; 10(8): e0136023.
35. Kim MY, Koh J, Kim S, Go H, Jeon YK, Chung DH. Clinicopathological analysis of PD-L1 and PD-L2 expression in pulmonary squamous cell carcinoma: Comparison with tumor-infiltrating T cells and the status of oncogenic drivers. Lung Cancer 2015; 88 : 24-33.
36. Rekhtman N, Ang DC, Riely GJ, Ladanyi M, Moreira AL. KRAS mutations are associated with solid growth pattern and tumor-infiltrating leukocytes in lung adenocarcinoma. Mod Pathol 2013; 26(10): 1307-1319.
37. Abdel-Rahman O. Correlation between PD-L1 expression and outcome of NSCLC patients treated with anti-PD-1/PD-L1 agents: A meta-analysis. Crit Rev Oncol Hematol 2016; 101(1): 75-85.
38. Sacher AG, Gandhi L. Biomarkers for the clinical use of PD-1/PD-L1 inhibitors in non-small-cell lung cancer: A review. JAMA Oncol 2016; 2(9): 1217-1222.
Labels
Anatomical pathology Forensic medical examiner Toxicology
Article was published inCzecho-Slovak Pathology

2018 Issue 3-
All articles in this issue
- Intraoperative consultation in gynecologic pathology
- Frozen section of lung, pleura and mediastinum specimen: Retrospective analysis of 5-years practical experiences and review of the literature
- Molecular methods for detection of prognostic and predictive markers in diagnosis of adenoid cystic carcinoma of the salivary gland origin
- Clinicopathological analysis of programmed death-ligand 1 testing in tumor cells of 325 patients with non-small cell lung cancer: Its predictive and potential prognostic value
- Aberrant axillary breast tissue with pseudoangiomatous stromal hyperplasia in a man
- JOSE VEROCAY - “Prague’s pathologist”. The history of a Latin-American doctor
- Pathology will stay as a cornerstone of personalized medicine
- Czecho-Slovak Pathology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Intraoperative consultation in gynecologic pathology
- Aberrant axillary breast tissue with pseudoangiomatous stromal hyperplasia in a man
- Clinicopathological analysis of programmed death-ligand 1 testing in tumor cells of 325 patients with non-small cell lung cancer: Its predictive and potential prognostic value
- Molecular methods for detection of prognostic and predictive markers in diagnosis of adenoid cystic carcinoma of the salivary gland origin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

