-
Medical journals
- Career
Renální postižení u pediatrických pacientů se zánětlivým střevním onemocněním
Authors: Švábová Eva 1; Bauer David 2; Gonsorčíková Lucie 2; Zieg Jakub 1
Authors‘ workplace: Pediatrická klinika, 2. lékařská fakulta, Univerzita Karlova a FN Motol, Praha 1; Pediatrická klinika, 1. lékařská fakulta, Univerzita Karlova a Fakultní Thomayerova nemocnice 2
Published in: Čes-slov Pediat 2023; 78 (6): 330-334.
Category: Comprehensive Report
doi: https://doi.org/10.55095/CSPediatrie2023/053Overview
Incidence zánětlivých střevních onemocnění celosvětově stoupá, a to zejména v dětské populaci. Zánětlivá střevní onemocnění mohou být doprovázena extraintestinální manifestací. Nejčastěji jsou kromě střev postiženy klouby, kůže, žlučové cesty a oči. Dalším orgánem, který může být v rámci základního onemocnění zasažen, jsou ledviny. Nejobvyklejší renální projevy zánětlivých střevních onemocnění zahrnují nefrolitiázu a dále také onemocnění renálního parenchymu – tubulointersticiální nefritidu, glomerulonefritidu a amyloidózu. V našem přehledovém článku se zaměřujeme na spektrum renálních chorob asociovaných se zánětlivými střevními onemocněními.
Úvod
Zánětlivé střevní onemocnění (IBD – inflammatory bowel disease) je chronické onemocnění postihující trávicí trakt, zejména střevo. Pod pojmem IBD zpravidla rozumíme skupinu chronických zánětlivých střevních onemocnění zahrnujících Crohnovu nemoc – Crohn’s disease (CD), ulcerózní kolitidu – ulcerative colitis (UC) a tzv. neklasifikovatelné zánětlivé střevní onemocnění – unclassified IBD (IBD-U). Etiologie těchto onemocnění není dosud zcela objasněna, roli hrají faktory genetické, epigenetické, imunologické, faktory prostředí a střevní mikrobiota.(1) Incidence IBD celosvětově stoupá. Přibližně 25 % IBD pacientů je diagnostikováno během dětství či adolescence.(2) Incidence CD v pediatrické populaci činí cca 13 : 100 000 nových případů ročně, u UC je udávaná incidence 15 : 100 000 nových případů ročně.(3) IBD může být doprovázeno extraintestinálními projevy, které se dle dostupných literárních údajů vyskytují u 20–35 % pediatrických pacientů s CD a u 15 % pacientů s UC.(4) Mimostřevní projevy onemocnění mohou v některých případech předcházet manifestaci IBD a tím činit diagnostické rozpaky. Nejčastěji je postižen systém muskuloskeletální (artritida, osteoartritida, ankylozující spondylitida), kůže (erythema nodosum, pyoderma gangrenosum), oči (uveitida, konjunktivitida a glaukom), játra a žlučové cesty (autoimunní hepatitida, primární sklerózující cholangitida).(5) V našem přehledovém článku shrnujeme současné poznání o postižení ledvin u pacientů s IBD.
Renální manifestace IBD
Renální postižení se vyskytuje u 4–23 % dospělých pacientů s IBD.(6) Van Hoeve a kol.(7) v recentně publikovaném review upozorňují, že u 5–15 % pacientů s IBD se v průběhu nemoci rozvine chronické onemocnění ledvin. Incidence postižení ledvin u dětí se doposud udávala v porovnání s dospělými významně nižší – 1–2 %.(8) Nicméně recentní pediatrické studie IBD pacientů ukazují, že výskyt postižení ledvin u dětí je nejspíše podhodnocen. V korejské retrospektivní studii analyzovali Jang a kol.(9) kohortu 456 dětí s IBD, renální postižení identifikovali u 14,7 % z nich. V poslední publikované studii věnované tomuto tématu francouzští autoři popsali renální postižení u 9 z 228 pacientů, což odpovídá výskytu 3,9 %. Jeden z faktorů vysvětlujících variabilní incidenci v jednotlivých studiích jsou rozdílné definice postižení ledvin. Doposud navíc nebyly provedeny větší prospektivní studie, které by se problematice renálního postižení dětí s IBD věnovaly komplexněji.
Nejčastějším onemocněním ledvin v dospělém i dětském věku u pacientů s IBD jsou nefrolitiáza, píštěle mezi střevem a močovým traktem a ureterální obstrukce.(6) Dále se u pacientů s IBD vyskytují onemocnění renálního parenchymu – glomerulopatie (nejčastěji IgA nefropatie, nemoc minimálních změn), tubulointersticiální nefritida (TIN) a sekundární amyloidóza.(8)
Jak výstižně shrnuje Mutalib(10) ve svém přehledovém článku, mezi hlavní předpokládané mechanismy vedoucí k postižení ledvin u pacientů s IBD patří:
1. autoimunitně podmíněná dysfunkce ledvin nezávislá na aktivitě IBD – odráží sklon pacienta k rozvoji imunopatologického onemocnění na základě genetické predispozice a případně dysregulace imunitního systému;(11)
2. nefropatie asociovaná s aktivitou IBD;(12)
3. ukládání imunokomplexů, či přímo jejich tvorba v renální tkáni;(8)
4. metabolické komplikace vzniklé v souvislosti s malabsorpcí při postižení střeva, ev. po chirurgické resekci;(13)
5. medikací indukované onemocnění ledvin.(6)
V některých případech (hlavně u postižení renálních tubulů) je velmi obtížné odlišit, zda je postižení ledvin u pacienta způsobeno základním onemocněním, či medikací, kterou užívá.
Nefrolitiáza
Jak již bylo zmíněno, nefrolitiáza představuje nejčastější renální manifestaci IBD. Celoživotní riziko vzniku nefrolitiázy u pacienta s IBD představuje 9–18 %. Riziko vzniku litiázy je vyšší u pacientů s CD než s UC, dále u pacientů po resekci střeva, zejména terminálního ilea (až 28 %).(11,14) Složením se jedná hlavně o konkrementy kalcium oxalátové a urátové. Oxalátové kameny se častěji tvoří u pacientů s CD. Etiologie sekundární hyperoxalurie je multifaktoriální. Mohou se na ní podílet dietní faktory, jako je zvýšený příjem oxalátů či snížený příjem kalcia, častěji však u pacientů s IBD postižení ileokolické oblasti střeva, při kterém dochází k malabsorpci solí žlučových kyselin, což vede ke zhoršenému vstřebávání mastných kyselin. Méně kalcia se tak váže na oxalát a ten se ve větší míře resorbuje, vzniká stav označovaný pojmem střevní hyperoxalurie.(11) U pacientů s IBD je sliznice tlustého střeva obecně více propustná pro oxaláty. Dochází také k dekolonizaci Oxalobacter formigenes. Tato gramnegativní anaerobní bakterie je schopna oxalát použít jako substrát pro tvorbu adenosintrifosfátu.(15) Na vzniku urátových kamenů se podílí kyselé pH moči, které u pacientů s IBD a průjmovitými stolicemi vzniká v důsledku ztrát bikarbonátu stolicí. U jedinců po resekci tlustého střeva může docházet ke zvýšeným ztrátám vody, následně ke sníženému objemu moči, která je poté vysoce saturovaná kyselinou močovou, čímž opět narůstá riziko vzniku urátových kamenů. V prevenci vzniku nefrolitiázy se tedy mohou uplatnit následující opatření: zvýšená hydratace (> 1,5 l/d/m2), dietní opatření – strava s nízkým obsahem oxalátů, omezení živočišných bílkovin ve stravě, užívání preparátů s magneziem, alkalizace moči, případně další medikamentózní léčba v závislosti na etiologii litiázy.(16)
Mechanismy vzniku nefrolitiázy u pacientů s IBD jsou shrnuty na obrázku 1.
Image 1. Patogeneze nefrolitiázy u pacientů s IIBD, upraveno dle(17) 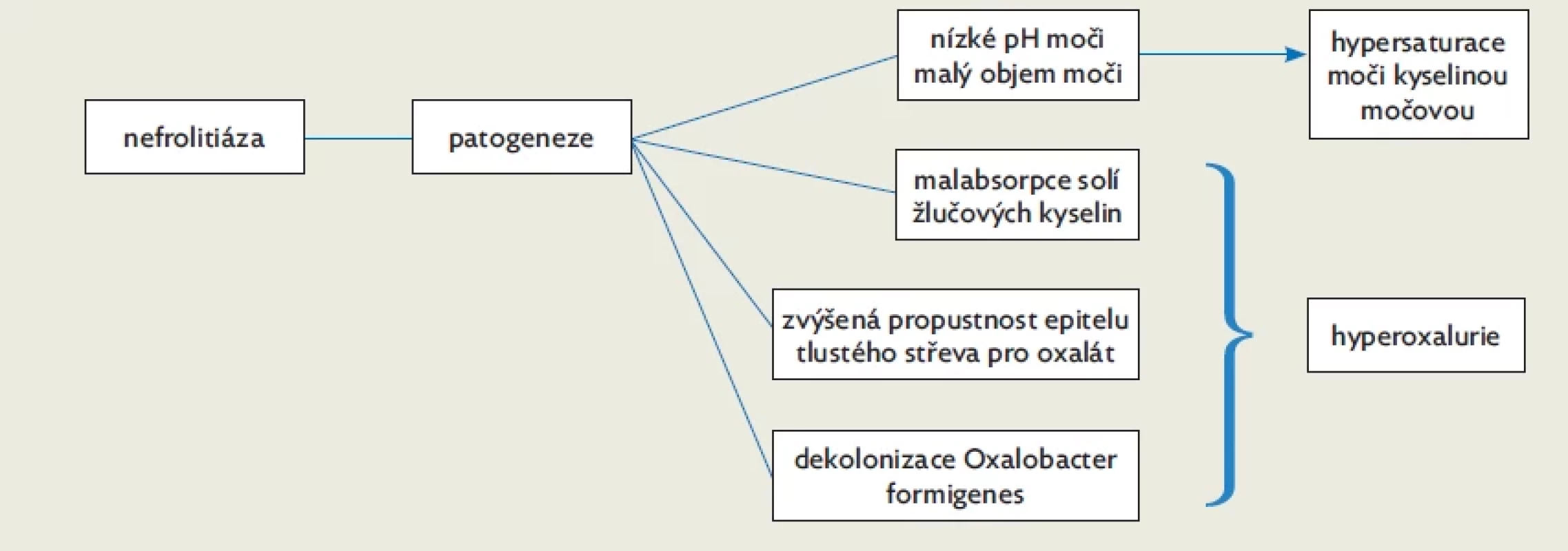
Glomerulonefritida
Dalším možným typem renálního postižení u pacientů s IBD je vznik glomerulonefritidy, jejíž etiologie u těchto pacientů nebyla doposud zcela objasněna. Zvažovány jsou společné patogenní mechanismy a genetické predispozice, dále ukládání imunokomplexů (vzniklých ve střevě) v ledvinných glomerulech. Tyto imunokomplexy pronikají snadněji přes více propustnou zánětlivě změněnou střevní sliznici.(14)
Nejčastějším typem glomerulonefritidy u IBD pacientů je IgA nefropatie. Vzácně byly u jedinců s IBD popsány i další typy glomerulonefritid – IgM nefropatie, membranózní nefropatie, membranoproliferativní glomerulonefritida a Goodpastureova nemoc.(17) Ambrusz a kol.(8) retrospektivně analyzovali více než třicet tisíc bioptických vzorků ledvin pacientů ze Spojených států. Mezi těmito vzorky identifikovali 83 dospělých pacientů s IBD. Nejčastější indikací k provedení biopsie ledviny bylo akutní či chronické renální selhání, na druhém místě byla nefrotická proteinurie. Nejčastěji zjištěnou patologií byla právě IgA nefropatie, která byla diagnostikována u 24 % pacientů s IBD. Pro srovnání, IgA nefropatie byla u ostatních pacientů identifikována pouze v 8 % případů. V již zmiňované korejské studii (Jang a kol.(9)) podstoupilo celkem sedm dětí renální biopsii – v pěti případech byla indikací biopsie mikroskopická hematurie a proteinurie, dvě děti měly mikroskopickou hematurii s atakami makroskopické hematurie bez patologické proteinurie. U pěti dětí byla histologicky potvrzena IgA nefropatie, u jednoho ze dvou zbývajících pacientů byla histologicky popsána nefritida při Henochově–Schönleinově purpuře, histologický obraz bioptického vzorku od posledního pacienta byl bez patologických odchylek.
Recentní studie u dospělých pacientů prokázala, že jedinci s IgA nefropatií mají zvýšené riziko vzniku IBD, což odráží významnou roli dysfunkce imunitního systému střevní mukózy v patogenezi této glomerulonefritidy. Diagnóza IBD u těchto pacientů zvyšovala riziko progrese do konečného stadia chronického onemocnění ledvin.(18) Také další studie ukázaly, že aktivita IBD je asociovaná se závažností průběhu IgA nefropatie. Opakovaně byly popsány případy, kdy došlo při remisi IBD u těchto pacientů zároveň ke zlepšení renálních funkcí.(19,20) V současné době také probíhá randomizovaná, dvojitě zaslepená, placebem kontrolovaná studie s podáváním budesonidu, glukokortikoidu s převážně lokálním působením v distálním ileu s přímým účinkem na lymfatickou tkáň tenkého střeva, nemocným s IgA nefropatií. Užívání tohoto preparátu vedlo k signifikantnímu poklesu proteinurie a stabilizaci funkce ledvin.(21)
Tubulointersticiální nefritida
Postižení renálních tubulů a intersticia je popisováno nejen jako extraintestinální manifestace IBD, ale také jako onemocnění indukované léky používanými v terapii IBD, ať už se jednalo o preparáty konvenční – 5-aminosalicyláty, či biologickou léčbu.
Izolovaná proteinurie způsobená dysfunkcí proximálního tubulu je popisována až u 6 % pacientů s IBD.(9,22) Přítomnost tubulointersticiálního postižení odráží zvýšená koncentrace tubulárních markerů v moči (α-1-mikroglobulin, β-2-mikroglobulin, N-acetyl-β-D-glukosaminidáza).
Marcus a kol.(23) popsali dva pediatrické pacienty, u nichž byla diagnostikována TIN v době diagnózy CD, nebyli tudíž vystaveni možnému nefrotoxickému účinku léků používaných v terapii IBD. Renální postižení se vyvíjelo nezávisle na aktivitě IBD, po dosažení remise IBD navíc nebylo patrné zlepšení renálních funkcí. Stejný klinický vývoj pozorovali Waters a kol.(24) u dvou dětských pacientů s CD, u nichž byla TIN diagnostikována před zahájením léčby IBD. Zmíněné případy jsou v rozporu s jinými sděleními, kdy při remisi IBD došlo k úpravě funkce ledvin. Jednalo se však o pacienty s IBD asociovanou IgA nefropatií.(19,20)
Amyloidóza
Sekundární amyloidóza je sice vzácnou, ale velmi závažnou komplikací IBD. U dospělých pacientů s CD dosahuje incidence sekundární amyloidózy až 10,9 %, u pacientů s UC je incidence tohoto postižení výrazně nižší – 0–0,7 %.(25–28) Nejčastěji se amyloid ukládá v ledvinách. Amyloidóza se zpravidla manifestuje 10–15 let po manifestaci IBD, z čehož vyplývá, že u dětských pacientů s IBD se s ní setkáme velmi vzácně.(25) Klinicky se renální amyloidóza projevuje proteinurií a nefrotickým syndromem. Poškození ledvin může progredovat až do konečné fáze chronického onemocnění ledvin s nutností zahájení dialýzy a následně transplantace ledviny. V terapii sekundární amyloidózy je na prvním místě léčba základního onemocnění. Jsou popsány případy, kdy po terapii infliximabem, chimérickou monoklonální protilátkou namířenou proti TNF-α, došlo ke zlepšení renálních funkcí, poklesu proteinurie a ke snížení hladiny sérového amyloidu. U těchto pacientů nedocházelo již k další progresi poškození ledvin.(29–33)
Léky indukované postižení ledvin u pacientů s IBD
V terapii IBD se používá celá škála léčiv, včetně biologik. U většiny je možný nefrotoxický potenciál. Největší pozornost je věnována aminosalicylátům. Rozvoj nefrotoxicity při podávání 5-aminosalicylátů u pacientů s IBD je popisován spíše vzácně, dle literatury maximálně u 2 % léčených.(34,35)
Postižení ledvin probíhá pod obrazem TIN. Patogeneze nefropatie v těchto případech není známá, předpokládá se idiosynkratická reakce, kdy rozvoj onemocnění není závislý ani na dávce, ani na době užívání medikace. Na základě recentně publikovaného systematického přehledového článku představují pediatričtí pacienti 19,5 % ze všech dosud publikovaných případů TIN asociované s užíváním 5-aminosalicylátů u pacientů s IBD. U dětí byla v porovnání s dospělými pacienty pozorována vyšší tendence k úpravě renálních funkcí, navzdory tomu u 62,5 % z nich přetrvávala porucha funkce ledvin i po ukončení léčby TIN. 78 % dětí bylo léčeno kortikosteroidy, v současnosti ale nemáme dostatek dat pro zvolení vhodné léčby dětí s TIN léčených 5-aminosalicyláty.(36)
Také léčba TNF-α inhibitory může být spojena s rozvojem renálního onemocnění. U těchto preparátů se předpokládá možný kauzální vliv na vznik glomerulonefritidy, vaskulitidy či lupusové nefritidy. Zmíněné renální komplikace byly ale zaznamenány pouze u pacientů léčených TNF-α inhibitory pro jiné onemocnění než IBD.(37–39) Možný vznik glomerulonefritidy při užívání TNF-α inhibitorů je dáván do souvislosti s podocyty, které produkují TNF-α, ten se v rámci aberantní imunitní odpovědi může v glomerulu uložit ve formě imunokomplexu s léčivem samotným nebo s protilátkami proti léčivu, a indukovat tak vznik glomerulonefritidy.(40) Anti-TNF-α terapie může navíc působit posun k Th-2 imunitní odpovědi, indukovat tak produkci protilátek, jako jsou ANA, anti-dsDNA a ANCA, a v konečném důsledku vést ke vzniku již zmiňované lupusové nefritidy či vaskulitidy. Jsou popsány také případy akutní TIN asociované s podáváním infliximabu.(41,42) Podobně byl také vedolizumab, humanizovaná monoklonální protilátka, která se specificky váže na integrin α4β7, v několika kazuistických sděleních označen za příčinu léky indukované TIN u pacienta s IBD.(43–45)Závěr
V současné době nemáme k dispozici dostatek dat zaměřených na problematiku s IBD asociovaného renálního postižení u dětí. IBD či jeho léčba u dětského pacienta mohou být příčinou vzniku nefropatie či nefrolitiázy a převážně v dospělosti mohou vést k výraznému zhoršení kvality života. Včasná diagnostika postižení ledvin, zahrnující pravidelné kontroly iontogramu, funkcí ledvin, vnitřního prostředí a močového nálezu, je proto velmi důležitá. Bohužel v současné době není k dispozici jednotné doporučení pro frekvenci monitorace renálních parametrů a vyšetření moče pro děti s IBD. Domníváme se, že toto laboratorní vyšetření je vhodné provádět v rámci pravidelných kontrol v ambulanci dětského gastroenterologa či při aplikaci biologické léčby. V případě patologického nálezu signalizujícího možný rozvoj postižení ledvin v rámci IBD je namístě multidisciplinární přístup zahrnující péči dětského nefrologa.
Grantová podpora:
grant MH CZ – DRO Thomayer University Hospital – TUH, 00064190Korespondenční adresa:
MUDr. Eva Švábová
V Úvalu 84
150 06 Praha 5
eva.svabova@fnmotol.cz
Sources
1. Béres NJ, Kiss Z, Sztupinszki Z, et al. Altered mucosal expression of microRNAs in pediatric patients with inflammatory bowel disease. Dig Liver Dis 2017; 49(4): 378–387.
2. Benchimol EI, Fortinsky K J, Gozdyra P, et al. Epidemiology of pediatric inflammatory bowel disease: a systematic review of international trends. Inflamm. Bowel Dis 2011; 17(1): 423–439.
3. Sýkora J, Pomahačová R. Current global trends in the incidence of pediatric-onset inflammatory bowel disease. World J Gastroenterol 2018; 24(25): 2741–2763.
4. Mamula P, Markowitz JE. Inflammatory bowel disease in early childhood and adolescence: special consideration. Gastroenterol. Clin. North Am 2003; 32 (3): 967–95.
5. Jang HJ, Kang B, Choe BH. The difference in extraintestinal manifestations of inflammatory bowel disease for children and adults. Transl Pediatr 2019; 8 (1): 4.
6. Ambruzs JM, Larsen CP. Renal manifestations of inflammatory bowel disease. Rheum Dis Clin North Am 2018; 44(4): 699–714.
7. van Hoeve K, Hoffman I. Renal manifestations in inflammatory bowel disease: a systematic review. J Gastroenterol 2022; 57(9): 619–629.
8. Ambruzs JM, Walker PD, Larsen CP. The histopathologic spectrum of kidney biopsies in patients with inflammatory bowel disease. Clin J Am Soc Nephrol 2014; 9(2): 265–270.
9. Jang HM, Baek HS, Kim JE, et al. Renal involvement in children and adolescents with inflammatory bowel disease. Korean J Pediatr 2018; 61(10): 327–331.
10. Mutalib M. Renal involvement in paediatric inflammatory bowel disease. Pediatr Nephrol 2021; 36(2): 279–285.
11. Rothfuss KS, Stange EF, Herrlinger KR. Extraintestinal manifestations and complications in inflammatory bowel diseases. World J Gastroenterol 2006; 12(30): 4819.
12. Ricart E, Sandborn WJ. Extraintestinal manifestations of inflammatory bowel disease. Inflamm. Bowel Dis 2003 : 257–277.
13. Oikonomou K, Kapsoritakis A, Eleftheriadis T, et al. Renal manifestations and complications of inflammatory bowel disease. Inflamm Bowel Dis 2011; 17(4): 1034–1045.
14. Gkentzis A, Kimuli M, Cartledge J, et al. Urolithiasis in inflammatory bowel disease and bariatric surgery. World J Nephrol 2016; 5(6): 538.
15. Stewart CS, Duncan SH, Cave DR. Oxalobacter formigenes and its role in oxalate metabolism in the human gut. FEMS Microbiol Lett 2004; 230(1): 1–7.
16. Chandhoke PS. When is medical prophylaxis cost-effective for recurrent calcium stones? J Urol 2002; 168(3): 937–940.
17. Corica D, Romano C. Renal Involvement in Inflammatory Bowel Diseases. J Crohns Colitis 2015; 10(2): 226–235.
18. Rehnberg J, Symreng A, Ludvigsson JF, Emilsson L. Inflammatory bowel disease is more common in patients with IgA nephropathy and predicts progression of ESKD: A Swedish population-based cohort study. J Am Soc Nephrol 2021; 32(2): 411–423.
19. Takemura T, Okada M, Yagi K, et al. An adolescent with IgA nephropathy and Crohn disease: pathogenetic implications. Pediatr Nephrol 2002; 17(10): 863–866.
20. Forshaw MJ, Guirguis O, Hennigan TW. IgA nephropathy in association with Crohn’s disease. Int J Colorectal Dis 2005; 20(5): 463–465.
21. Fellström BC, Barratt J, Cook H, et al. Targeted-release budesonide versus placebo in patients with IgA nephropathy (NEFIGAN): a double-blind, randomized, placebo-controlled phase 2b trial. Lancet 2017; 389(10084): 2117–2127.
22. Velciov S, Gluhovschi G, Sporea I, et al. Asymptomatic urinary anomalies, hematuria and proteinuria, in patients with inflammatory bowel disease. Preliminary study. Rom J Intern Med 2001; 49(2): 113–20.
23. Marcus SB, Brown JB. Tubulointerstitial nephritis: an extraintestinal manifestation of Crohn disease in children. J Pediatr Gastroenterol Nutr 2008; 46(3): 338–341.
24. Waters AM, Zachos M, Herzenberg A, et al. Tubulointerstitial nephritis as an extraintestinal manifestation of Crohn‘s disease. Nat Clin Pract Nephrol 2008; 4(12): 693–697.
25. Wester AL, Vatn MH, Fausa O. Secondary amyloidosis in inflammatory bowel disease: a study of 18 patients admitted to Rikshospitalet University Hospital, Oslo, from 1962 to 1998. Inflamm Bowel Dis 2001; 7(4): 295–300.
26. Tada Y, Ishihara S, Ito T, et al. Successful use of maintenance infliximab for nephropathy in a patient with secondary amyloidosis complicating Crohn’s disease. Intern Med J 2013; 52(17): 1899–1902.
27. Ebert EC, Nagar M. Gastrointestinal manifestations of amyloidosis. Am J Gastroenterol 2008; 103(3): 776–787.
28. Cucino C, Sonnenberg A. The comorbid occurrence of other diagnoses in patients with ulcerative colitis and Crohn’s disease. Am J Gastroenterol 2001; 96(7): 2107–2112.
29. Fernández-Nebro A, Ureña I, Irigoyen MV, García-Vicuña R. Anti-TNF-α for treatment of amyloidosis associated with Crohn’s disease. Gut 2006; 55(11): 1666–1667.
30. Park YK, Han DS, Eun CS. Systemic amyloidosis with Crohn’s disease treated with infliximab. Inflamm Bowel Dis 2008; 14 (3): 431–432.
31. Anelli MG, Torres DD, Manno C, et al. Improvement of renal function and disappearance of hepatitis B virus DNA in a patient with rheumatoid arthritis and renal amyloidosis following treatment with infliximab. Arthritis Rheumatol 2005; 52(8): 2519–2520.
32. Boscá MM, Pérez-Baylach CM, Solis MA, et al. Secondary amyloidosis in Crohn’s disease: treatment with tumor necrosis factor inhibitor. Gut 2006; 55(2): 294–295.
33. Iizuka M, Konno S, Horie Y, et al. Watanabe S. Infliximab as a treatment for systemic amyloidosis associated with Crohn’s disease. Gut 2006; 55(5): 744–745.
34. Gisbert JP, González-Lama Y, Maté J. 5-aminosalicylates and renal function in inflammatory bowel disease: a systematic review. Inflamm Bowel Dis 2007; 13 (5): 629–38.
35. Elseviers MM, D’Haens G, Lerebours E, et al. Renal impairment in patients with inflammatory bowel disease: association with aminosalicylate therapy? Clin Nephrol 2004; 61 : 83–9.
36. Moss JG, Parry CM, Holt RC, McWilliam SJ. 5-ASA induced interstitial nephritis in patients with inflammatory bowel disease: a systematic review. Eur J Med Res 2022; 27(1): 61.
37. Stokes MB, Foster K, Markowitz GS, et al. Development of glomerulonephritis during anti-TNF-α therapy for rheumatoid arthritis. Nephrol Dial Transplant 2005; 20(7): 1400–1406.
38. Nielsen H, Kemp E, Petersen LJ, et al. Newer immunomodulating drugs in rheumatoid arthritis may precipitate glomerulonephritis. Arthritis Res Ther 2001; 3 : 1.
39. Ramos-Casals M, Brito-Zerón P, Muñoz S, et al. Autoimmune diseases induced by TNF-targeted therapies: analysis of 233 cases. Medicine 2007; 86(4): 242–251.
40. Neale TJ, Rüger BM, Macaulay H, et al. Tumor necrosis factor-alpha is expressed by glomerular visceral epithelial cells in human membranous nephropathy. Am J Pathol 1995; 146 : 1444–54.
41. Ota M, Iwai H, Imai K, et al. Acute tubulointerstitial nephritis associated with infliximab in a patient with Crohn’s disease. Intern Med 2016; 55 : 1367–1370.
42. Yoo YJ, Chung SY, Gu DH, et al. A case of late onset-acute tubulointerstitial nephritis with infliximab and mesalazine treatment in a patient with Crohn’s disease. Korean J Gastroenterol 2014; 63 : 308–312.
43. Subhaharan D, Ramaswamy PK, et al. Vedolizumab-induced acute interstitial nephritis in ulcerative colitis. ACG Case Rep J 2022; 9(6).
44. Simpson N, Seenan JP, et al. Acute interstitial nephritis secondary to vedolizumab. BMJ Case Rep CP 2021; 14(11).
45. Bailly E, Von Tokarski F, et al. Interstitial nephritis secondary to vedolizumab treatment in Crohn disease and safe rechallenge using steroids: a case report. Am J Kidney Dis 2018; 71(1): 142–145.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2023 Issue 6-
All articles in this issue
- Ze sbírky moderního českého a slovenského umění
- Co jsme psali
- Editorial
- Krátká a spontánně ustupující nevysvětlitelná zdravotní událost u novorozence a kojence (BRUE)
- Emočně nestabilní adolescenti – současná výzva dětské psychiatrie i pediatrie
- Zlepšila se prenatální ultrazvuková diagnostika vrozených vad ledvin?
- Bezpečnosť a zmeny vybraných laboratórnych parametrov u detí s alergiou na jed blanokrídleho hmyzu liečených venómovou imunoterapiou
- Současný stav zobrazení plodu magnetickou rezonancí
- Hypofosfatázie: Vzácné onemocnění s jednoduchou diagnostikou a dostupnou terapií
- Renální postižení u pediatrických pacientů se zánětlivým střevním onemocněním
- Prehypertenze a hypertenze u dětí a dospělých: vliv nadměrné konzumace soli a cukru
- Udělení Brdlíkovy ceny 2023
- Vzpomínka na Zdenku Misařovou a její rodinu
- Rodiny dětí s postižením mohou využívat bezplatnou službu rané péče
- Pediatrická poezie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Krátká a spontánně ustupující nevysvětlitelná zdravotní událost u novorozence a kojence (BRUE)
- Emočně nestabilní adolescenti – současná výzva dětské psychiatrie i pediatrie
- Současný stav zobrazení plodu magnetickou rezonancí
- Hypofosfatázie: Vzácné onemocnění s jednoduchou diagnostikou a dostupnou terapií
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

