-
Medical journals
- Career
Technologická revoluce v léčbě diabetu 1. typu
Authors: Petruželková Lenka; Plachý Lukáš; Kajprová Marie; Neuman Vítek; Obermannová Barbora; Průhová Štěpánka; Lebl Jan; Koloušková Stanislava; Šumník Zdeněk
Authors‘ workplace: Pediatrická klinika FN Motol, a 2. LF UK, Praha
Published in: Čes-slov Pediat 2022; 77 (2): 78-85.
Category: Comprehensive Report
Overview
Diabetes 1. typu je chronické autoimunitní onemocnění vyžadující doživotní aplikaci inzulinu. Vzhledem k nárůstu počtu onemocnění především v nejmladší věkové kategorii je potřeba počítat s nárůstem celkového počtu pacientů a z toho plynoucí zvýšenou zátěží zdravotního systému. Neuspokojivá kompenzace diabetu je spojena s rozvojem dlouhodobých mikro - a makrovaskulárních komplikací, které výrazně ovlivňují kvalitu a délku života pacientů. Cílem léčby u dětských pacientů je dosáhnout optimální kontroly glykemie, tedy normoglykemie, která by měla výskyt sekundárních komplikací diabetu zcela eliminovat. K dosažení normoglykemie přispělo zařazení moderních technologií do standardní terapie diabetu 1. typu. Jejich přehled a cestu k našim pacientům přiblíží tento článek.
Klíčová slova:
technologie – diabetes 1. typu – uzavřená smyčka
Diabetes mellitus 1. typu (DM1) je závažné chronické autoimunitní onemocnění vedoucí k progresivní ztrátě β-buněk pankreatu a nutnosti doživotní aplikace inzulinu. K manifestaci onemocnění dochází nejčastěji během dětství a dospívání, v menší míře během dospělosti pod obrazem hyperglykemie.(1) V České republice je momentálně celkem 150 000 pacientů s DM1, z toho 4000 dětí. Incidence a prevalence diabetes mellitus však neustále stoupá a největší nárůst je pozorován u dětí mladších 15 let.(2–4) Během dvaceti let vzrostla incidence v České republice z 6,8/100 000 v roce 1989 až na 18,5/100 000 v roce 2009, a to hlavně v nejmladší věkové kategorii (0–4 roky). Průměrný meziroční nárůst tak činil 5,4 %.(5) Výskyt diabetu v dětském věku roste v celé Evropě v průměru asi o 3–4 % ročně, nicméně nárůst není shodný ve všech regionech.(2–4) Pokud bude současný trend pokračovat, bude náš zdravotní systém čelit až čtyřnásobnému nárůstu incidence nových případů DM1 mezi lety 2009 a 2025, a to s největší dynamikou přírůstku v nejmladší věkové kategorii (0–4 roky).(2–4)
DM1 je spojený s rizikem rozvoje akutních a chronických komplikací. Akutní komplikace se projevují při extrémních hodnotách koncentrace glukózy a souvisejí buď s chybějící nebo nedostatečnou léčbou (hyperglykemické stavy a ketoacidóza), nebo naopak s neadekvátně vysokým účinkem léčby (hypoglykemie, neadekvátní dávka inzulinu). Pozdní komplikace rozdělujeme podle postižení cév a orgánů na mikrovaskulární a makrovaskulární. Mezi mikrovaskulární komplikace patří diabetická retinopatie, neuropatie a diabetické onemocnění ledvin. Makrovaskulární komplikace představuje akcelerovaná ateroskleróza.(5) Akutní i pozdní komplikace negativně ovlivňují morbiditu a kvalitu života pacientů s DM1 a mají velmi významné dopady do socioekonomické sféry, protože jsou spojeny s vyššími náklady na léčbu.(6–8) Dlouhodobé epidemiologické studie navíc jasně ukazují, že riziko úmrtí je u mladých lidí s nedostatečnou kontrolou diabetu signifikantně vyšší než u osob s dobrou metabolickou kompenzací( 9–11) a jakákoliv delší doba strávená v hyperglykemii vede ke zvýšenému riziku rozvoje pozdních mikrovaskulárních i makrovaskulárních komplikací.(12,13)
Recentní studie ukazují, že více než obávaná hypoglykemie má na poškození centrální nervové soustavy vliv čas strávený v hyperglykemii a vysoká variabilita glykemie spojená právě s vyšší průměrnou glykemií.(14) Jedinou možností prevence chronických komplikací diabetu a zachování očekávané délky života pacientů s DM1 je tedy dostatečná kontrola hladiny cukru v krvi. Naším cílem je nyní úplná eliminace akutních i chronických komplikací diabetu, tedy dosažení co nejlepší kontroly glykemie, optimálně normoglykemie. Tento cíl reflektuje neustálé zpřísňování doporučovaných cílů léčby, kterých mají naši pacienti dosáhnout. Cílová hodnota glykovaného hemoglobinu (HbA1c) se podle aktuálních doporučení odborných společností snížila na 53 mmol/ mol (ISPAD 2019,(15) ADA 2019(16)), přičemž v případě dostatečné dostupnosti moderních technologií v léčbě je cílová hodnota HbA1c dále snížena na 48 mmol/ mol (ISPAD 2019, NICE 2018(17), Sweden guidlines 2019 (https://www.ndr.nu/). Všech těchto cílů bychom se měli snažit dosáhnout, ale nikoliv na úkor kvality života našich pacientů a jejich rodin, kteří jsou péčí o diabetes nepřiměřeně zatěžováni a mají pocit viny, že se jim nedaří léčebných cílů dosáhnout.(15)
V poslední dekádě došlo k technologické revoluci v léčbě DM1. První převratnou novinkou bylo zavedení kontinuální monitorace glykemie (continuous glucose monitoring, CGM) do standardů léčby. To vedlo k významnému zlepšení kompenzace diabetu.( 18–20) Senzor snímající aktuální hladinu glykemie z intersticiálního prostoru v podkoží kontinuálně informuje pacienta o aktuální hladině glykemie a o probíhajícím trendu. V případě rizikových hodnot glykemie (hypoglykemie, hyperglykemie) varuje pacienta pomocí nastavitelných alarmů (obr. 1). Bylo prokázáno, že dlouhodobé užívání CGM vede k signifikantnímu zlepšení výsledků léčby pacientů s DM1 – snížení hodnoty HbA1c a současnému poklesu výskytu těžkých hypoglykemií.(19,21–23) Zásadní je však správná implementace CGM do terapie pacienta – tj. dostatečná edukace, jak se senzorem pracovat a jak regovat na alarmy a aktuální trendy glykemie. 24hodinová kontrola glykemie s nutností neustálého vyhodnocování, jak na aktuální trend glykemie či na alarm reagovat, vede postupně k vyčerpání pacienta (tzv. alarm fatigue), které může vyústit v přání přerušit užívání CGM. Udržení zlepšené kompenzace však úzce souvisí s frekvencí používání CGM. Studie ukazují, že pacient musí využívat CGM alespoň 70 % času. Nejlepších výsledků pochopitelně dosahují ti pacienti, kteří využívají CGM trvale – tj. téměř 100 % času.(20,24) Zavedení CGM do léčby DM1 s sebou přineslo další parametry hodnocení kompenzace diabetu získané pomocí CGM: čas strávený v cílovém rozmezí glykemie (tj. v pásmu glykemie 3,9–10 mmol/l), ve kterém by měl pacient strávit více než 70 % času, a čas strávený v hypoglykemii (glykemie pod 3,9 mmol/l), který by neměl přesáhnout 5 %. Dalším hodnoceným parametrem je čas strávený v hyperglykemii (glykemie nad 14 mmol/l) a tzv. glykemická variabilita. Uvedená doporučení pro léčbu CGM vycházejí z mezinárodního konsenzu ATTD z roku 2019.(25) Nové parametry pomáhají posoudit kontrolu glykemie, ale zároveň představují další cíle, kterých musí pacient dosáhnout.
Image 1. Přehled používaných CGM v léčbě diabetu 1. typu 
Další zlepšení přinesly inzulinové pumpy s automatickými funkcemi, které jsou propojeny s CGM. Na základě zpracování údajů z CGM automaticky dočasně přerušují dodávku inzulinu v případě hrozící hypoglykemie (obr. 2).(26) Tuto generaci inzulinových pump představuje pumpa Minimed G640 (Medtronic) s funkcí Predictive Low Suspend(27) či pumpa Tandem s funkcí Basal IQ.(28) Prospektivní i retrospektivní studie prokázaly účinnost těchto automatických funkcí v prevenci hypoglykemie.(28,29) Dočasné přerušení inzulinu však vede k následné hyperglykemii a signifikantnímu zvýšení průměrné glykemie.(28) Dále tato automatická funkce neřeší zásadní problém v léčbě diabetu, a to signifikantní proměnlivost inzulinové potřeby za den, která dosahuje až 30 % a u dětských pacientů se mění nejen ze dne na den, ale i několikrát během dne.(30) Dále v dětském věku bojujeme s proměnlivým a nepravidelným příjmem jídla a nepředvídatelnou fyzickou aktivitou.(31)
Image 2. Záznam glykemie a výdeje inzulinu dle typu užitého automatického systému ke kontrole glykemie. A – systém zastavení před nízkou „Predictive Low“ (MiniMed 640G). B – systém hybridní uzavřené smyčky (Tandem Control IQ). C – systém zcela uzavřené smyčky (AndroidAPS). 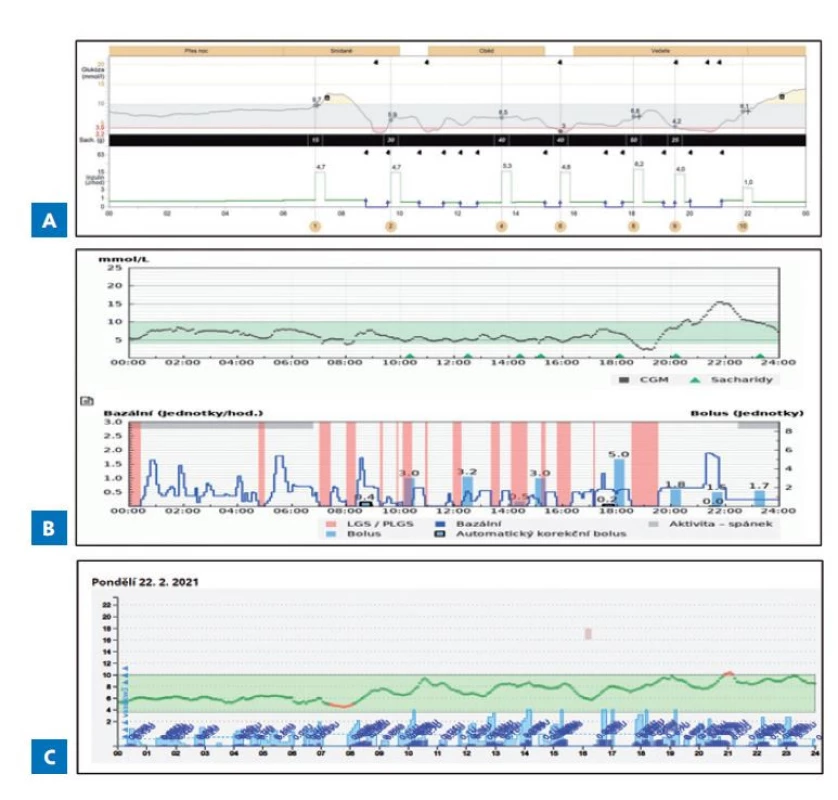
Přes signifikantní nárůst dostupnosti nových technologií širšímu okruhu pacientů a jejich prokazatelného benefitu na kompenzaci DM1 se nedostavilo očekávané plošné zlepšení kontroly glykemie.(20,32–34) Tento „technologický paradox“ reflektovaly především výsledky národních registrů, kdy doporučených cílů pro kompenzaci diabetu (HbA1c < 58 mmol/mol) podle českého národního registru ČENDA dosáhlo v roce 2018 pouze 40 % dětských pacientů.(20) Skotský registr, analyzující výsledky více než 30 tisíc pacientů s DM1 mezi roky 2004 až 2016 bez ohledu na věk, ukázal, že přes významné zlepšení kompenzace dosahuje cílového HbA1c pod 58 mmol/mol pouze 15 % pacientů.(34) V neposlední řadě americký registr T1D Exchange, kde cílové HbA1c dosahuje 17 %, ukázal, že se kompenzace diabetu mezi roky 2010–2012 a 2016–2018 nejen významně nezlepšila, ale u adolescentů se navzdory dostupnějším technologiím v léčbě diabetu dokonce zhoršila.(35)
Tato zjištění ještě prohloubila skepsi našich pacientů, že požadovaných cílů nelze dosáhnout, a vedla ke snaze urychlit technologický vývoj „umělé slinivky“, který mezi lety 2009 a 2016 nepřinesl žádné novinky. Právě pacientské sdružení „We are not waiting“, které sdružuje motivované pacienty s DM1 či jejich rodiče, nabídlo další technologický pokrok ve formě hybridní uzavřené smyčky. Tyto systémy (OpenAPS, Loop, AndroidAPS) se sdružují pod názvem „Do It Yourself“, dosud však nemají oficiální certifikaci, a tak si je uživatel musí sestrojit sám na základě open source kódu, který je k dispozici na internetu. Představují však další krok ke zlepšení kompenzace našich pacientů a otevřely dveře k urychlení certifikace systémům oficiálním.
Systém uzavřené smyčky se skládá ze senzoru CGM, který kontinuálně snímá hladinu glykemie a přes Bluetooth ji vysílá do inzulinové pumpy. Ta obsahuje algoritmus, který vyhodnocuje aktuální hodnotu glykemie, porovná ji s cílovou glykemií a na základě rozdílu určí změnu dávky inzulinu, který je do těla pacienta vydán inzulinovou pumpou. Tento uzavřený okruh se opakuje každých 5 minut – vždy, když senzor CGM vyšle informaci o aktuální glykemii. Kalkulace změny dávky inzulinu vycházejí z matematického modelu, který bere v úvahu nejen hodnoty glykemie, ale také množství inzulinu vydané systémem. Momentálně dostupné systémy pracují jako „hybridní uzavřené smyčky“, tj. algoritmus upravuje dávku inzulinu mezi jídly, ale prandiální inzulin (inzulin na pokrytí přijímaných sacharidů) si dále zajišťuje pacient sám pomocí tzv. bolusového kalkulátoru. Ten vypočítá bolus inzulinu na jídlo na základě aktuální glykemie a množství sacharidů zadaného pacientem.
Nedávno publikované studie přesvědčivě prokázaly signifikantní snížení HbA1c a prodloužení času v cílovém rozmezí bez nárůstu času stráveného v hypoglykemii v porovnání s použitím CGM samotného či při porovnání se systémy využívajícími pouze funkci „zastavení před nízkou glykemií“ (obr. 1).(36–42) Dostupná data z reálného života uživatelů po více než roce užívání těchto systémů ukazují desetiprocentní nárůst času v cílovém rozmezí během dne, což odpovídá více než dvěma a půl hodinám času navíc v cílové glykemii během dne.(43) Efektivita těchto systémů byla testována v téměř všech věkových skupinách – u předškolních dětí, školních dětí, adolescentů i u dospělých, nicméně studie na dětské populaci převažují.(36–42)
Přehled a popis jednotlivých systémů shrnuje tabulka 1. Liší se zabudovaným algoritmem, jednotlivými funkcemi a množstvím parametrů, které si uživatel může nastavit, a tím systém uzpůsobit své potřebě. Míra autonomie, která přímo koreluje s mírou nutnosti spolupráce pacienta se systémem, je asi nejvýznamnějším rozdílem mezi jednotlivými systémy. Budoucí uživatel by měl být seznámen s jednotlivými systémy včetně jejich výhod a nevýhod tak, aby si mohl zvolit systém na základě osobních preferencí. Nutné je však zdůraznit, že jakmile je systém hybridní slinivky předepsán, uživatelé by měli být o systému proškoleni. Edukace by měla obsahovat nejen terapii inzulinovou pumpou a CGM, ale i specifika jednotlivých systémů. Mnoho dospělých, ale především dospívajících v USA přestalo hybridní smyčky po roce využívat. Pravděpodobnou příčinou byl nejen nedostatečný trénink, ale také přehnaná očekávání, která současné systémy nemohou splnit.(44)
Table 1. Přehled systémů hybridní uzavřené smyčky dostupných v ČR 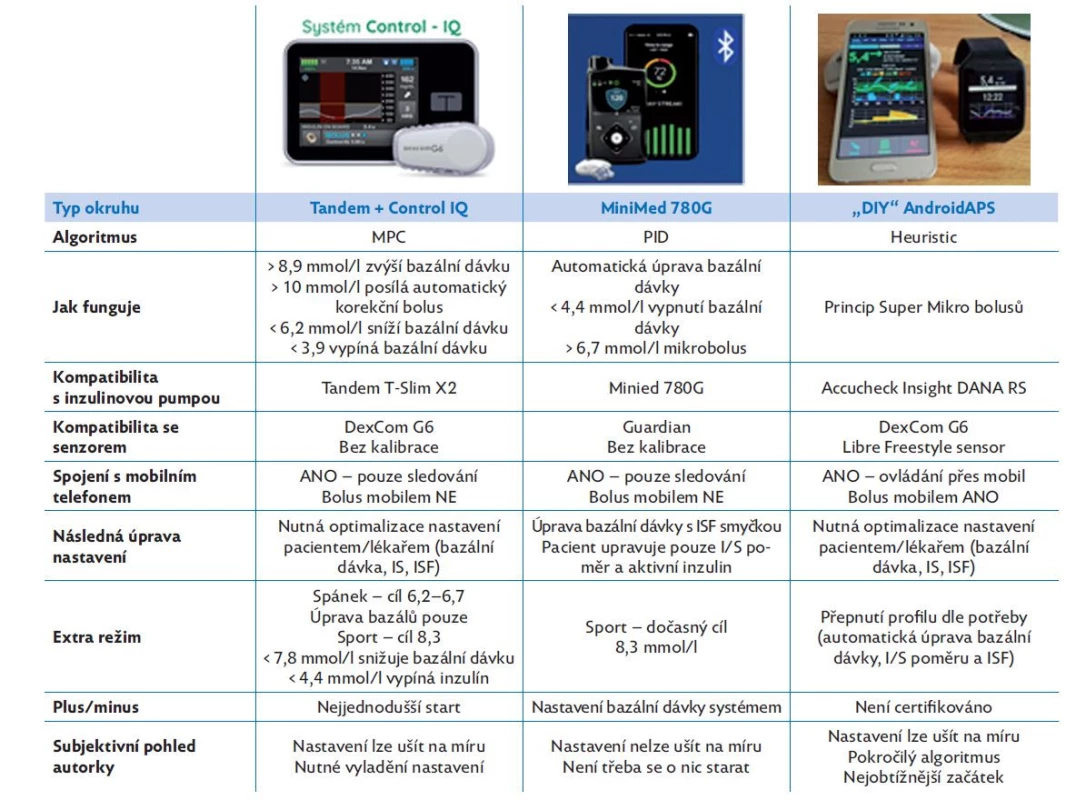
Dalším krokem technologického vývoje je „zcela uzavřená smyčka“, která by byla schopna pokrýt i postprandiální výkyvy glykemie bez nutnosti kalkulace sacharidů a bez manuálního podání bolusových dávek inzulinu před každým jídlem. Úskalím pro uzavření smyčky zůstává neuspokojivá kontrola glykemie po jídle a rychlá proměnlivost citlivosti na inzulin během fyzické aktivity. Tyto systémy jsou zatím ve fázi vývoje. Celosvětově první pilotní studie testující zcela uzavřený okruh proběhla v roce 2021 v našem dětském motolském dia-centru, kde jsme testovali algoritmus AndroidAPS (obr. 3). Ten je výsledkem již zmíněné pacientské iniciativy „We are not waiting“ a jeho efektivita se prokázala in silico či v retrospektivní studii.(45,46) Naše studie, která testovala různé scénáře této uzavřené smyčky, prokázala nejen bezpečnost, ale i efektivitu toho systému. Prokázala také, jak moc je přínosné, když svůj názor na léčbu chronického onemocnění vyjádří nejen lékař, ale i pacient, a to i při vývoji léčebné pomůcky. V dnešní hektické době jsme na komunikaci s pacientem pozapomněli a ten si nyní hledá svou cestu, často však bez konzultace lékaře. Snahou našeho centra je pacienta do léčebného procesu opět vrátit, a možná právě proto patří motolské dětské dia-centrum podle výsledků léčby dětského diabetu mezi absolutní světovou špičku.
Image 3. Automatický systém AndroidAPS testovaný jako „zcela uzavřená smyčka“ skládající se z telefonu s algoritmem umělé slinivky, CGM a inzulinové pumpy 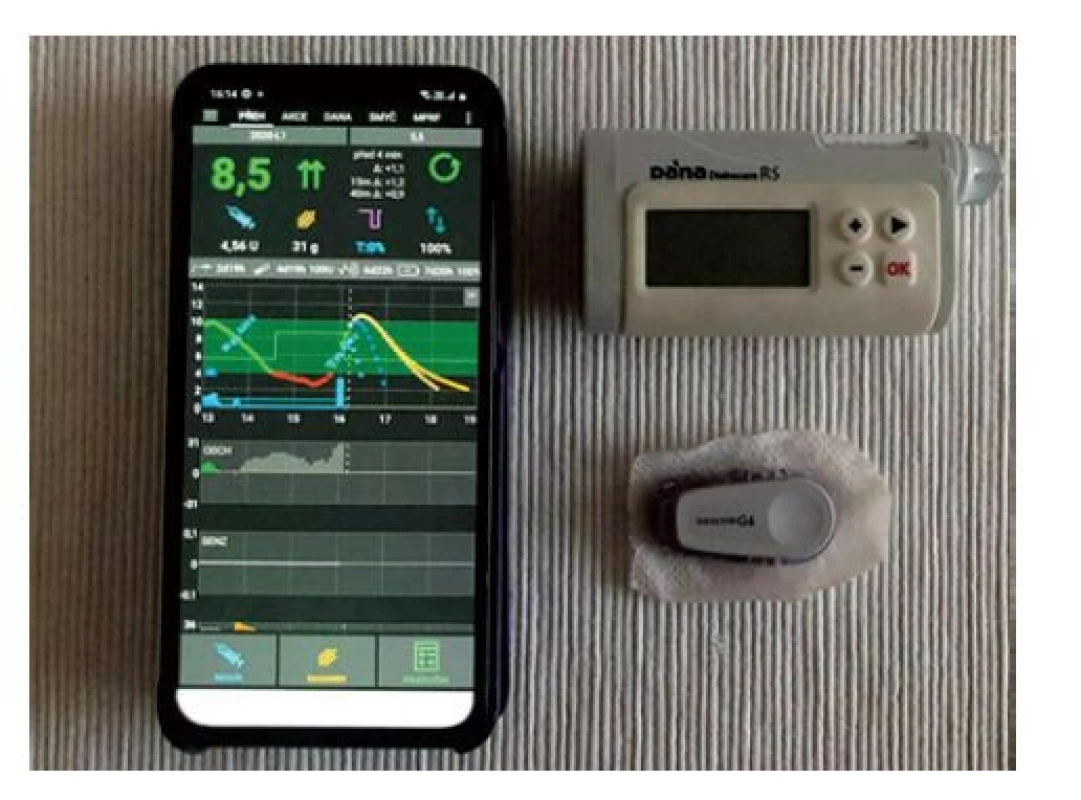
Korespondenční adresa:
MUDr. Lenka Petruželková, Ph.D.
Pediatrická klinika FN Motol a 2. LF UK
V Úvalu 84
Praha 5
150 06
Sources
1. Mayer-Davis EJ, Kahkoska AR, Jefferies C, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Definition, epidemiology, and classification of diabetes in children and adolescents. Pediatr Diabetes 2018; 19 Suppl 27 : 7–19.
2. Patterson CC, Harjutsalo V, Rosenbauer J, et al. Trends and cyclical variation in the incidence of childhood type 1 diabetes in 26 European centres in the 25 year period 1989–2013: a multicentre prospective registration study. Diabetologia 2019; 62(3): 408–417.
3. Jarosz-Chobot P, Polanska J, Szadkowska A, et al. Rapid increase in the incidence of type 1 diabetes in Polish children from 1989 to 2004, and predictions for 2010 to 2025. Diabetologia. 2011; 54(3): 508–15. doi: 10.1007/s00125 – 010–1993–4
4. Chobot A, Polanska J, Brandt A, et al. Updated 24-year trend of Type 1 diabetes incidence in children in Poland reveals a sinusoidal pattern and sustained increase. Diabet Med 2017; 34(9): 1252–1258.
5. Donaghue KC, Marcovecchio ML, Wadwa RP, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Microvascular and macrovascular complications in children and adolescents. Pediatr Diabetes 2018; 19 Suppl 27 : 262–274.
6. DCCT /EDIC research group. Effect of intensive diabetes treatment on albuminuria in type 1 diabetes: Long-term follow - up of the Diabetes Control and Complications Trial and Epidemiology of Diabetes Interventions and Complications study. Lancet Diabetes Endocrinol 2014; 2(10): 793–800.
7. Lachin M, White H, Hainsworth P, et al. Effect of intensive diabetes therapy on the progression of diabetic retinopathy in patients with type 1 diabetes: 18 years of follow-up in the DCCT/EDIC. Diabetes 2015; 64(2): 631–642.
8. Nordwall M, Arnqvis H, Bojestig M, et al. Good glycemic control remains crucial in prevention of late diabetic complications – The Linkoping Diabetes Complications Study. Pediatric Diabetes 2009; 10(3): 168–176.
9. Lind M, Svensson AM, Rosengren A. Glycemiccontrol and excess mortality in type 1 diabetes. N Engl J Med 2015; 372(9): 880–1.
10. Livingstone SJ, Levin D, Looker HC, et al. Estimated life expectancy in a Scottish cohort with type 1 diabetes, 2008 – 2010. JAMA 2015; 313 : 37–44.
11. Gagnum V, Stene LC, Sandvik L, et al. All-cause mortality in a nationwide cohort of childhood–onset diabetes in Norway 1973–2013. Diabetologia 2015; 58 : 1779–86.
12. Samuelsson U, Steineck I, Gubbjornsdottir S. A high mean - -HbA1c value 3-15 months after diagnosis of type 1 diabetes in childhood is related to metabolic control, macroalbuminuria, and retinopathy in early adulthood-A pilot study using two nation–wide population based quality registries. Pediatr Diabetes 2014; 15(3): 229–35.
13. Anderzén J, Samuelsson U, Gudbörnsdottir S, et al. Teenagers with poor metabolic control already have a higher risk of microvascular complications as young adults. J Diabetes Complications 2016; 30(3): 533–6.
14. Bizzarri C, Benevento D, CiampaliMarzelli MJ, et al. Neuroanatomical correlates of dysglycemia in young children with type 1 diabetes. Diabetes 2014; 63 : 343–53.
15. DiMeglio LA, Acerini CL, Codner E, er al. ISPAD Clinical Practice Consensus Guidelines 2018: Glycemic control targets and glucose monitoring for children, adolescents, and young adults with diabetes. Pediatr Diabetes 2018; 19 Suppl 27 : 105–114.
16. American Diabetes Association 6. Glycemic Targets: Standards of Medical Care in Diabetes–2019. Diabetes Care. 2019; 42(Suppl 1): S61–S70. doi: 10.2337/dc19–S006
17. Beckles ZL, Edge JA, Mugglestone MA, et al. Diagnosis and management of diabetes in children and young people: summary of updated NICE guidance. BMJ 2016; 352: i139.
18. Battelino T, Conget I, Olsen B, et al.; SWITCH Study Group. The use and efficacy of continuous glucose monitoring in type 1 diabetes treated with insulin pump therapy: a randomised controlled trial. Diabetologia 2012; 55(12): 3155 – 62. doi: 10.1007/s00125-012-2708-9
19. Šoupal J, Petruželková L, Grunberger G, et al. Glycemic outcomes in adults with t1d are impacted more by continuous glucose monitoring than by insulin delivery method: 3 years of follow-up from the COMISAIR Study. Diabetes Care 2019; pii: dc190888.
20. Šumník Z, Venháčová J, Škvor J, et al.; ČENDA Project Group. Five years of improving diabetes control in Czech children after the establishment of the population-based childhood diabetes register ČENDA. Pediatr Diabetes 2019.
21. Parkin CG, Graham C, Smolskis J. Continuous glucose monitoring use in type 1 diabetes: longitudinal analysis demonstrates meaningful improvements in HbA1c and reductions in health care utilization. J Diabetes Sci Technol 2017; 11(3): 522–528.
22. Beck RW, Riddlesworth TD, Ruedy KJ, et al.; DIAMOND Study Group. Effect of initiating use of an insulin pump in adults with type 1 diabetes using multiple daily insulin injections and continuous glucose monitoring (DIAMOND): a multicentre, randomised controlled trial. Lancet Diabetes Endocrinol 2017; 5(9): 700–708.
23. Heinemann L, Freckmann G, et al. Real time continuous glucose monitoring in adults with type 1 diabetes and impaired hypoglycaemia awareness or severe hypoglycaemia treated with multiple daily insulin injections (HypoDE): a multicentre, randomised controlled trial. Lancet 2018; 391(10128): 1367–1377.
24. Danne T, Nimri R, Battelino T, et al. International consensus on use of continuous glucose monitoring. Diabetes Care 2017; 40(12): 1631–1640.
25. Battelino T, Danne T, Bergenstal RM. Clinical targets for continuous glucose monitoring data interpretation: recommendations from the international consensus on time in range. Diabetes Care 2019; 42(8): 1593–1603. doi: 10.2337/dci19–0028
26. Forlenza GP, Li Z, Buckingham BA, et al. Predictive low - -glucose suspend reduces hypoglycemia in adults, adolescents, and children with type 1 diabetes in an at-home randomized crossover study: results of the PROLOG Trial. Diabetes Care 2018; 41(10): 2155–2161.
27. Biester T, Kordonouri O, Holder M, et al. „Let the algorithm do the work“: Reduction of hypoglycemia using sensor - augmented pump therapy with predictive insulin suspension (SmartGuard) in pediatric type 1 diabetes patients. Diabetes Technol Ther 2017; 19(3): 173–182.
28. Müller L, Habif S, Leas S, Aronoff-Spencer E. Reducing hypoglycemia in the real world: a retrospective analysis of predictive low-glucose suspend technology in an ambulatory insulin-dependent cohort. Diabetes Technol Ther 2019; 21(9): 478–484.
29. Battelino T, Nimri R, Dovc K, et al. Prevention of hypoglycemia with predictive low glucose insulin suspension in children with type 1 diabetes: a randomized controlled trial. diabetes care. 2017; 40(6): 764–770.
30. Petruzelkova L, Pickova K, Sumnik Z, et al. Effectiveness of SmartGuard Technology in the prevention of nocturnal hypoglycemia after prolonged physical activity. Diabetes Technol Ther 2017; 19(5): 299–304.
31. Dovc K, Boughton C, Tauschmann M, et al. Young children have higher variability of insulin requirements: observations during hybrid closed-loop insulin delivery. Diabetes Care 2019; 42(7): 1344–1347.
32. Ranjit U, Shah VN, Mohan V. Challenges in diagnosis and management of diabetes in the young. Clin Diabetes Endocrinol 2016; 2 : 18.
33. Sumnik Z, Szypowska A, Iotova V, et al.; SWEET study group. Persistent heterogeneity in diabetes technology reimbursement for children with type 1 diabetes: The SWEET perspective. Pediatr Diabetes 2019; 20(4): 434–443.
34. Mair C, Wulaningsih W, Jeyam A, et al. Glycaemic control trends in people with type 1 diabetes in Scotland 2004 – 2016. Diabetologia 2019; 62(8): 1375–1384.
35. Foster NC, Beck RW, Miller KM, et al. State of type 1 diabetes management and outcomes from the T1D Exchange in 2016–2018. Diabetes Technol Ther 2019; 21(2): 66–72.
36. Bally L, Thabit H, Kojzar H, et al. Day-and-night glycaemic control with closed-loop insulin delivery versus conventional insulin pump therapy in free-living adults with well controlled type 1 diabetes: an open-label, randomised, crossover study. Lancet Diabetes Endocrinol 2017; 5 : 261–270.
37. Tauschmann M, Allen JM, Wilinska ME, et al. Day-and-night hybrid closed-loop insulin delivery in adolescents with type 1 diabetes: a free-living, randomized clinical trial. Diabetes Care 2016; 39 : 1168–1174.
38. Tauschmann M, Thabit H, Bally L, et al.: Closed-loop insulin delivery in suboptimally controlled type 1 diabetes: a multicentre, 12-week randomised trial. Lancet 2018; 392(10155): 1321–1329.
39. Forlenza GP, Ekhlaspour L, Breton M, et al.Successful at - -home use of the tandem control-IQ artificial pancreas system in young children during a randomized controlled trial. Diabetes Technol Ther 2019; 21(4): 159–169.
40. Sherr JL, Buckingham BA, Forlenza GP, et al. Safety and performance of the Omnipod hybrid closed-loop system in adults, adolescents, and children with type 1 diabetes over 5 days under free-living conditions. Diabetes Technol Ther 2019.
41. Bergenstal RM, Garg S, Weinzimer SA, et al. Safety of a hybrid closed–loop insulin delivery system in patients with type 1 diabetes. JAMA 2016; 316(13): 1407–1408.
42. Garg SK, Weinzimer SA, Tamborlane WV, et al. Glucose outcomes with the in-home use of a hybrid closed-loop insulin delivery system in adolescents and adults with type 1 diabetes. Diabetes Technol Ther 2017; 19(3): 155 – 163.
43. Stone MP, Agrawal P, Chen X, et al. Retrospective analysis of 3-month real-world glucose data after the MiniMed 670G system commercial launch. Diabetes Technol Ther 2018; 20(10): 689–692.
44. Goodwin G, Waldman G, Lyons J, et al. OR14–5 Challenges in implementing hybrid closed loop insulin pump therapy (Medtronic 670g) in a ‚real world‘ clinical setting. Proc J Endocrine Soc 2019; 3(Suppl 1): OR14–5.
45. Toffanin C, Visentin R, Messori M, et al. Toward a run - -to-run adaptive artificial pancreas: In silico results. IEEE Transactions Biomed Eng 2018; 65(3): 479–488.
46. Petruzelkova L, Jiranova P, Soupal J, et al. Pre-school and school-aged children benefit from the switch from a sensor-augmented pump to an AndroidAPS hybrid closed loop: A retrospective analysis. Pediatr Diabetes 2021; 22(4): 594–604.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2022 Issue 2-
All articles in this issue
- Ze sbírky moderního českého a slovenského umění
- Co jsme psali
- Válka na Ukrajině očima kyjevské lékařky
- Editorial
- 100 let inzulinu: Příběh Elisabeth Hughesové a jednoho zázraku v medicíně
- Kompenzace diabetu 1. typu u českých dětí se dlouhodobě zlepšuje: data z národního registru ČENDA (2013–2020)
- Postiniciálna remisia u detí s diabetes mellitus 1. typu
- Technologická revoluce v léčbě diabetu 1. typu
- Glukokinázový diabetes u dětí
- Oxygenoterapie u akutních stavů v praxi
- Resuscitace novorozence, kardiopulmonální resuscitace dětí
- Pandemie covidu-19 v pediatrické populaci Ústeckého kraje
- Osobní zprávy
- Historický rozhovor s legendou: doc. MUDr. Alois Kopecký, CSc. (1920–2013)
- Pediatrická poezie
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Resuscitace novorozence, kardiopulmonální resuscitace dětí
- Oxygenoterapie u akutních stavů v praxi
- Technologická revoluce v léčbě diabetu 1. typu
- Kompenzace diabetu 1. typu u českých dětí se dlouhodobě zlepšuje: data z národního registru ČENDA (2013–2020)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

