-
Medical journals
- Career
Vrozené plicní malformace dýchacích cest a plicní sekvestrace na Dětské klinice FNHK za 15leté období
Authors: J. Micherová 1; P. Rejtar 2; B. Frýbová 3; Hubert Vaníček 1
Authors‘ workplace: Dětská klinika LF a FN Hradec Králové 1; Radiologická klinika LF a FN Hradec Králové 2; Klinika dětské chirurgie 2. LF UK a FN Motol, Praha 3
Published in: Čes-slov Pediat 2021; 76 (5): 267-275.
Category: Review
Overview
Úvod: Soubor pacientů Dětské kliniky FNHK s vrozenou plicní malformací dýchacích cest (CPAM) a plicní sekvestrací (PS) v letech 2006 až 2020.
Cíl: Zhodnocení výsledků řešení CPAM a PS s cílem shrnout stávající diagnostické a terapeutické postupy na našem pracovišti a porovnání s dostupnou literaturou.
Metodika: Na Dětské klinice FNHK bylo v letech 2006 až 2020 diagnostikováno 23 pacientů s kongenitální hrudní malformací (CPAM a PS). Byla provedena analýza základních údajů z dokumentace pacientů, shrnuty základní charakteristiky, jako je věk stanovení diagnózy, metoda zobrazení malformace, symptomy, způsob řešení, věk event. operačního řešení a případné komplikace.
Výsledky: Z 23 pacientů bylo 11 s diagnózou CPAM, 10 s PS a 2 s hybridními lézemi (CPAM/PS). Prenatálně bylo diagnostikováno 17 z 23 případů (74 %). Zobrazovací metodou volby bylo ve všech případech ultrazvukové vyšetření (UZ) a RTG hrudníku, před operačním řešením vždy CT hrudníku s angiografií. V 6 případech nebyly vady postnatálně detekovány pomocí UZ nebo RTG, ale až CT vyšetřením, 3x došlo ke spontánní involuci vady (2x CPAM, 1x PS). Symptomatické byly 4 z 11 dětí s CPAM a 3 z 10 s PS. Děti s hybridními lézemi byly asymptomatické. Tři z 11 dětí s CPAM podstoupily chirurgickou resekci. Věk pacientů v době operace byl 3 měsíce, 6 let a 7,5 let. Šest z 11 dětí s CPAM je zatím sledováno, věk nejstaršího dítěte je 4 roky, 2x došlo k involuci CPAM (vada nebyla detekovaná na CT). Pět z 10 dětí s PS je po lobektomii plic ve věku 5 až 15 let. Čtyři z 10 dětí s PS jsou zatím sledovány, nejstaršímu dítěti je 4,5 roku. Jednou došlo k involuci PS, pravděpodobně extralobární. Dvě děti měly hybridní léze, u jednoho byla tato léze odstraněna, druhé je zatím sledováno. Pooperační komplikace byla zaznamenána jedenkrát (pleurální výpotek), bez potřeby drenáže.
Závěr: Vrozenou plicní malformaci dýchacích cest a plicní sekvestraci lze dobře diagnostikovat již prenatálně. Asymptomatické vady představují leckdy terapeutický problém, kdy, jak a zda vůbec léčit. Stále chybí dostatek dat, díky nimž by se dalo předvídat chování malformace a optimalizovat tak naši léčbu.
Klíčová slova:
vrozená plicní malformace dýchacích cest – CPAM – CCAM – kongenitální hrudní malformace – CTM – kongenitální plicní masy – CLM – plicní sekvestrace – PS – vrozená cystická adenomatoidní malformace
ÚVOD
V letech 2006–2020 bylo na Dětské klinice FNHK diagnostikováno 23 dětských pacientů s vrozenou hrudní malformací (CPAM a PS). Autoři provedli retrospektivní zhodnocení dat těchto pacientů s cílem shrnout základní údaje, jako je věk, ve kterém byla stanovena diagnóza, metoda zobrazení malformace s ohledem na radiační zátěž (počet CT vyšetření), symptomy, způsob řešení, věk event. operačního řešení a případné komplikace (tab. 1).
Table 1. Soubor pacientů Dětské kliniky FNHK. 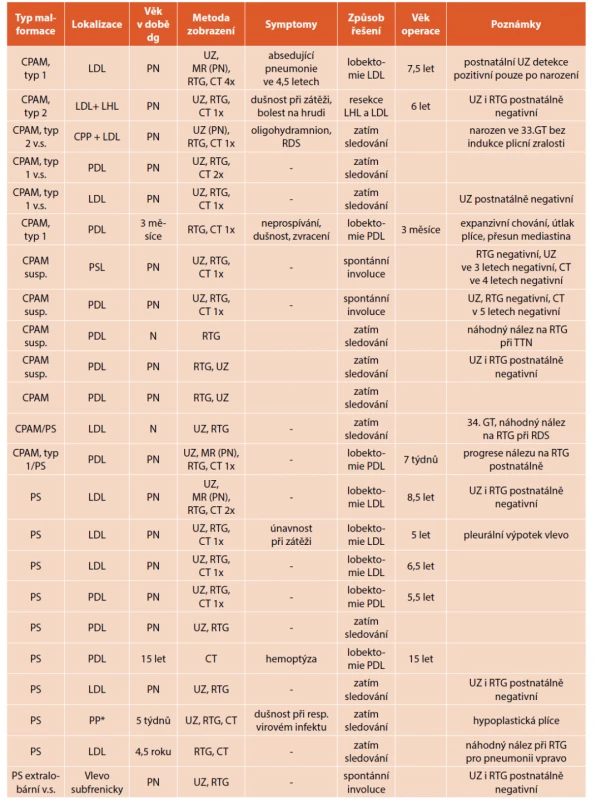
CPP – celá pravá plíce, PP – pravá plíce, PN – prenatálně, RDS – respiratory distress syndrome, TTN – tranzitorní tachypnoe novorozence, N – novorozenec SOUBOR PACIENTŮ A VÝSLEDKY
Z 23 pacientů bylo 11 dětí s diagnózou CPAM, ve 3 případech byla diagnóza histologicky ověřená, z toho 2 pacienti měli postižení typu 1 a jedno dítě typu 2. Deset pacientů mělo PS, z toho bylo 5 histologicky ověřených, intralobárních. Dva pacienti měli tzv. hybridní léze (CPAM/PS, z toho 1 byla histologicky ověřená).
Lokalizací byly 2 z 11 CPAM v levém dolním laloku (LDL), 1 v LDL i levém horním laloku (LHL), 1 v pravém středním laloku (PSL), 6 v pravém dolním laloku (PDL), 1 v celé pravé plíci a částečně v LDL. Šest z 10 pacientů s PS mělo malformaci v LDL, 3 v PDL a 1 v celé pravé plíci, která byla hypoplastická. Jedna hybridní léze byla v PDL a jedna v LDL.
Deset z 11 pacientů s CPAM bylo diagnostikováno prenatálně, 1 dítě ve 3 měsících věku. Sedm z 10 pacientů s PS bylo diagnostikováno prenatálně, 1 dítě v kojeneckém, 1 dítě v předškolním a 1 dítě v adolescentním věku. Z hybridních lézí byla jedna diagnostikována prenatálně a jedna v novorozeneckém věku.
Zobrazovací metodou volby bylo ve všech případech UZ i RTG vyšetření hrudníku, před operačním řešením vždy CT hrudníku s angiografií, v některých případech opakovaně i v rámci konzervativního postupu, max. 4x v 1 případě z důvodu komplikace ve vadě (infekce). Ve 3 případech bylo přistoupeno k provedení prenatální magnetické rezonance. V 6 případech nebyly vady postnatálně UZ ani RTG detekovány, ve 4 případech až CT vyšetřením, 3x došlo ke spontánní involuci, tedy ani CT vyšetření vady nezobrazilo (2x susp. CPAM, 1x PS).
Symptomatické byly 4 z 11 dětí s CPAM, u nich se 1x jednalo o infekci v předškolním věku (4,5 roku), 1x o dušnost u novorozence při malformaci v celé plíci při současném předčasném narození dítěte (34. týden gestace, prenatálně oligohydramnion, bez indukce plicní zralosti), 1x se dušnost manifestovala v časném kojeneckém věku zároveň s neprospíváním dítěte při expanzivně se chovající malformaci způsobující útlak celé plíce a přesun mediastina a 1x to byla dušnost a bolesti na hrudi při zátěži v předškolním věku. Tři z 10 dětí s PS byly symptomatické, 1x to byla únavnost při zátěži, při významném levo-levém zkratu a objemovém přetížení levé komory srdeční, 1x hemoptýza u adolescentní pacientky a 1x dušnost u kojence při virovém respiračním infektu u malformace v celé hypoplastické pravé plíci. Děti s hybridními lézemi byly asymptomatické.
Image 1. A. CT hrudníku, transverzální řez, CPAM typu 1 PDL s expanzivním chováním, přesunem mediastina u 3měsíčního kojence s projevy neprospívání, dušnosti a zvracení.
Fig. 1A. Chest CT scan, transversal cut, CPAM type 1 with expansion in the right lower lobe in a three-months old infant with failure to thrive, dyspnoe and vomiting.
Obr. 1B. CT hrudníku, koronární řez, patrné expanzivní chování s útlakem okolní plicní tkáně imitující CLO.
Fig. 1B. Chest CT scan, coronary cut, expansion of the malformation imitating CLO.
Obr. 1C. CT hrudníku, 3D rekonstrukce.
Fig. 1C. Chest CT scan, 3D reconstruction.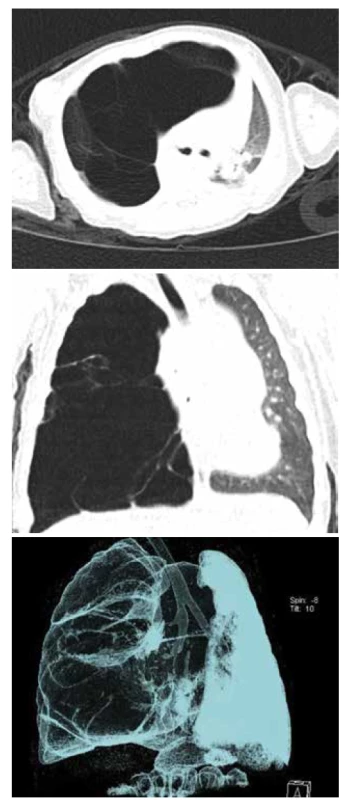
Tři z 11 CPAM byly chirurgicky odstraněny. U 2 dětí byla provedena lobektomie, u jednoho dítěte klínovitá resekce pro malformaci postihující 2 laloky. Věk v době operace byl 3 měsíce, 6 let a 7,5 let. Šest z 11 dětí s CPAM je zatím sledováno, nejstaršímu jsou 4 roky. Dvě děti s involucí CPAM byly ze sledování vyřazeny. Pět z 10 dětí s PS je po lobektomii plic ve věku 5 až 15 let. Čtyři z 10 dětí s PS jsou zatím sledovány, nejstaršímu je 4,5 let. Dítě se spontánní involucí PS bylo vyřazeno ze sledování. Jedno dítě ze dvou s hybridními lézemi je po lobektomii, druhé je zatím sledováno. U všech operačních řešení kromě jednoho dítěte s PS s pooperačním pleurálním výpotkem bez potřeby drenáže nejsou zaznamenány komplikace.
DISKUSE
CPAM a PS patří mezi nejčastější kongenitální hrudní malformace. Většina vad je diagnostikována prenatálně pomocí UZ, v našem souboru to bylo 17 z 23 pacientů, tj. 74 %. Postnatálně se zpravidla provádí skiagram hrudníku, který je pozitivní pouze v 60 % případů [1, 2] a současně UZ vyšetření hrudníku, které má nižší záchyt u cystických lézí [2]. U našich pacientů byl RTG záchyt vady v 68 % a UZ záchyt v 53 % případů, kde byla tato vyšetření realizována. Zlatým standardem je stále CT vyšetření hrudníku s angiografií se 100% záchytem vady, pokud nedojde ke spontánní involuci in utero, ojediněle postnatálně, nejčastěji u extralobárního typu PS. V našem souboru pacientů došlo ke spontánní involuci u 2 malformací (1x CPAM a 1x PS, pravděpodobně extralobární).
Co se týče typu vady, definitivním určením je histologická verifikace. Baird uvádí, že pouze 57 % predikovaných typů CTM dle CT určených jako CPAM se shodovalo se skutečností po histologickém vyšetření. V 7 % byl CT nález normální, v 7 % se jednalo o kongenitální lobární emfyzém a ve 29 % o PS [3]. Z našich pacientů, kteří podstoupili operační řešení, byl verifikován typ malformace určené zobrazením s 89% přesností (1x namísto CPAM se jednalo o PS). V případě CPAM je lokalizace vady náhodná, tak tomu bylo i v našem souboru, i když převažovalo umístění v PDL. U PS převažuje LDL, na našem pracovišti převažoval LDL (6 z 10) nad PDL (4 z 10). CPAM v četnosti nad PS významně dominuje. Tomu neodpovídal soubor našich pacientů, z celkem 23 pacientů mělo 11 CPAM, 10 PS a 2 hybridní léze. Nicméně méně než polovina jich byla zatím histologicky verifikována.
Rozvoj infekce v malformaci v dětském věku nelze predikovat, literární zdroje se liší v incidenci, s rozptylem 3–30 %. Vzhledem k časné resekci vad ve světě zůstane tento údaj zřejmě nadále nejasný. V Durellově retrospektivní studii 69 asymptomatických pacientů, operovaných do 1 roku života pro CPAM, PS nebo hybridní léze, mělo 16 (23 %) pacientů mikroskopické známky infekce v lézi [4]. V našem souboru byla infekce diagnostikována pouze u 1 ze 4 symptomatických případů CPAM v předškolním věku (4,5 roku), nikoli u PS či hybridních lézí. Věk zatím nejstaršího sledovaného dítěte je však teprve 4,5 roku. U žádné z odstraněných vad nebyla v histologickém nálezu infekce popisována.
Symptomatické vady se ve většině případů po iniciální stabilizaci stavu operují. Asymptomatické léze pracoviště v zahraničí operují převážně do 1 roku věku, nejčastěji kolem 6. měsíce života. Tři z 11 dětí s CPAM podstoupily chirurgickou resekci. Věk v době operace byl 3 měsíce, 6 let a 7,5 let. Šest z 11 dětí s CPAM je zatím sledováno, věk nejstaršího je 4 roky. Pět z 10 dětí s PS je po lobektomii plic ve věku 5 až 15 let. Čtyři z 10 dětí s PS jsou zatím sledovány, nejstaršímu je 4,5 let. Hybridní léze byly odstraněny. Kromě jednoho dítěte s PS s pooperačním pleurálním výpotkem nebyly po operačním řešení zaznamenány komplikace, což se shoduje s obecně velmi nízkou perioperační morbiditou a nulovou mortalitou. Vcelku ojedinělý postup časování operačního řešení asymptomatických vad do předškolního věku v ČR se v našem malém souboru pacientů jeví jako bezpečný a tudíž přijatelný. Ideální věkovou hranicí operačního řešení jsou 4 roky, v 1 případě došlo k rozvoji abscedující pneumonie ve vadě ve věku 4,5 let, její následné odstranění ale proběhlo bez komplikací. Na druhé straně časnější řešení se jeví jako zcela bezpečné, spolehlivě zamezující rozvoji komplikací a snad pro rodinu i dítě méně psychicky zatěžující.
Image 2. A. CT hrudníku, transverzální řez, asymptomatická CPAM PDL, prenatálně diagnostikovaná.
Fig. 2A. Chest CT scan, transversal cut, asymptomatic CPAM in right lower lobe, diagnosed prenatally.
Obr. 2B. CT hrudníku, koronární řez.
Fig. 2B. Chest CT scan, coronary cut.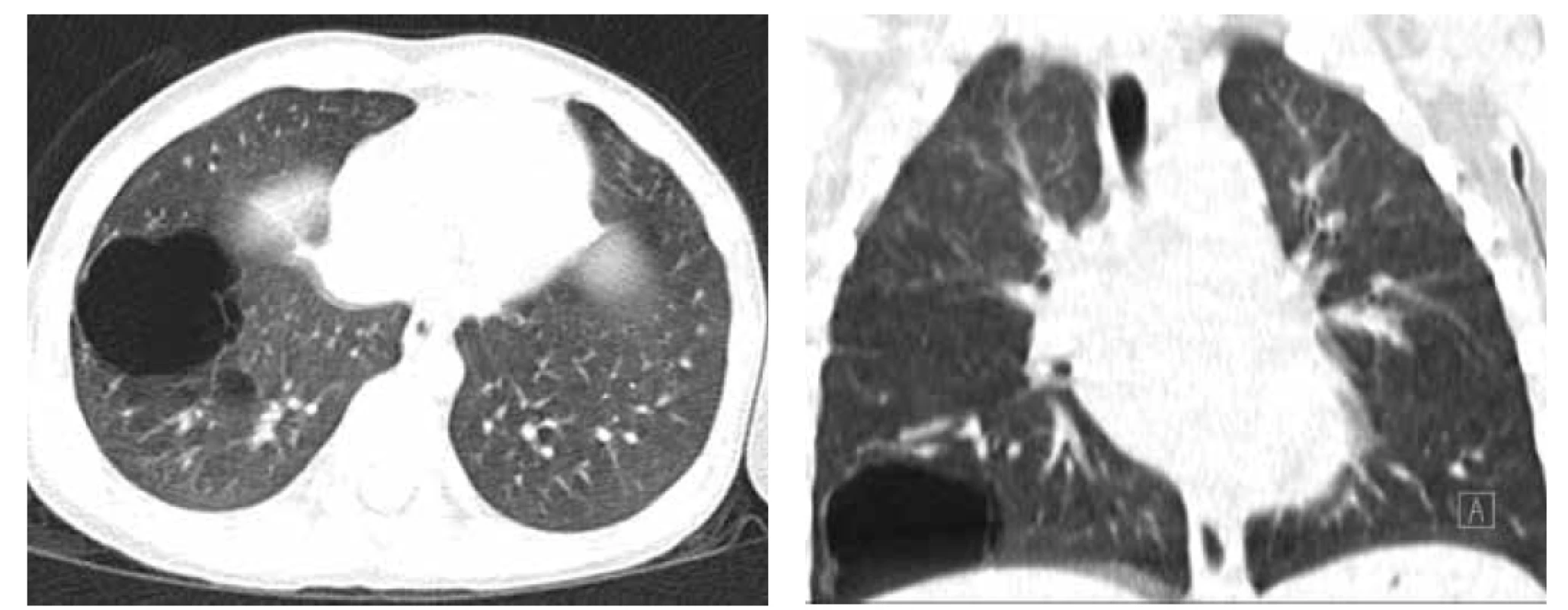
Při chirurgickém řešení malformace postihující jeden lalok se spíše volí lobektomie než resekce s ponecháním zdravé plicní tkáně v laloku. Nedochází tolik k air-leak syndromům a není riziko ponechání rezidua malformace. Naopak v Iowě, v USA, nezaznamenali rozdíl v perioperačních či pooperačních komplikacích a prognózou mezi segmentektomií a lobektomií s výhodou zachování více zdravé tkáně [5]. V individuálních případech stabilního pacienta, malé velikosti a příznivého umístění léze se k segmentální resekci kloní i autoři v Birminghamu [6].
Co se týče možné maligní transformace, ve světě jsou publikovány jen ojedinělé případy, ale i v časném dětském věku. Stále se diskutuje, zda se některé vady mohou vyvinout v pleuropulmonální blastom, či spíše představují jeho regresní podobu [3, 7, 8]. Bilaterální výskyt CPAM, rodinná anamnéza pleuropulmonálního blastomu, plicních cyst nebo renálních abnormalit, výskyt Wilmsova tumoru a/nebo meduloblastomu či karcinomu štítné žlázy jsou obzvláště rizikové. Zde je indikováno molekulárně genetické vyšetření k identifikaci zárodečné mutace v genu DICER1, která se pojí s pleuropulmonálním blastomem. Na druhé straně vada zjištěná prenatálně, cévní zásobení ze systémového oběhu a asymptomatický průběh svědčí spíše pro CPAM, nikoli pleuropulmonální blastom [7, 9]. Druhou a ještě vzácnější malignitou v místě CPAM je bronchoalveolární karcinom, což je adenokarcinom s leipidickým růstem, obvykle je náhodným nálezem při odstranění malformace v dospělosti. Výjimečně se vyskytují sarkomy. Ze studie italských autorů analyzující publikované případy malignit v místě CTM vyplývá, že průměrný věk diagnózy tumoru byl 3,68 ± 3,4 let, tedy velmi časně [9]. Zavedený timing operačního řešení asymptomatických vad v České republice kolem 4. roku věku se tedy z tohoto hlediska jeví jako hraničně postačující. Riziko maligního zvratu, byť velmi nízké (do 5 % celoživotně) [3], by také mohlo hrát roli v indikaci časnějšího operačního řešení.
V Durellově retrospektivní studii 69 asymptomatických pacientů operovaných do 1 roku života pro CPAM, PS nebo hybridní léze, měli 2 pacienti histologicky v lézi nádorové buňky pleuropulmonálního blastomu [4]. V našem souboru nebyly histologickým vyšetřením odstraněných vad nádorové buňky zachyceny. Dále z výše zmíněného článku vyplývá, že v dětském věku se jednalo pouze o pleuropulmonální blastom, v dospělosti to byly případy adenokarcinomu a karcinomu s leipidickým růstem, jejichž výskyt je ale popsán i v časném dětském věku v jiných zdrojích [3, 10, 11]. Nejčastější asociace tumoru v dětském věku je s CPAM typu 1, v dospělosti s bronchogenní cystou, na druhém místě s CPAM [9]. Nicméně vzhledem k tomu, že nelze bez histologického vyšetření jasně predikovat typ vady, nelze se z tohoto hlediska rozhodovat o konzervativním versus operačním postupu. Laberge et al. doporučují operovat všechny bronchogenní cysty, všechny „vzdušné“ PS (intralobární), všechny léze s cystami patrnými na CT vyšetření. Sledovat lze asymptomatické kongenitální lobární emfyzémy, extralobární PS bez významného zkratu [12]. To se prakticky shoduje s doporučením Kunisakiho, který navíc doporučuje operovat mikrocystické léze větší než 2 cm [2].
Image 3. A. RTG plic, CPAM pravé plíce prenatálně diagnostikovaná, známky RDS.
Fig. 3A. Chest X-ray, CPAM in the right lung, diagnosed prenatally, features of RDS.
Obr. 3B. CT hrudníku, transverzální řez, difuzní postižení pravé plíce při CPAM typu 2 v.s.
Fig. 3B. Chest CT scan, transversal cut, diffuse involvement of the right lung by CPAM type 2.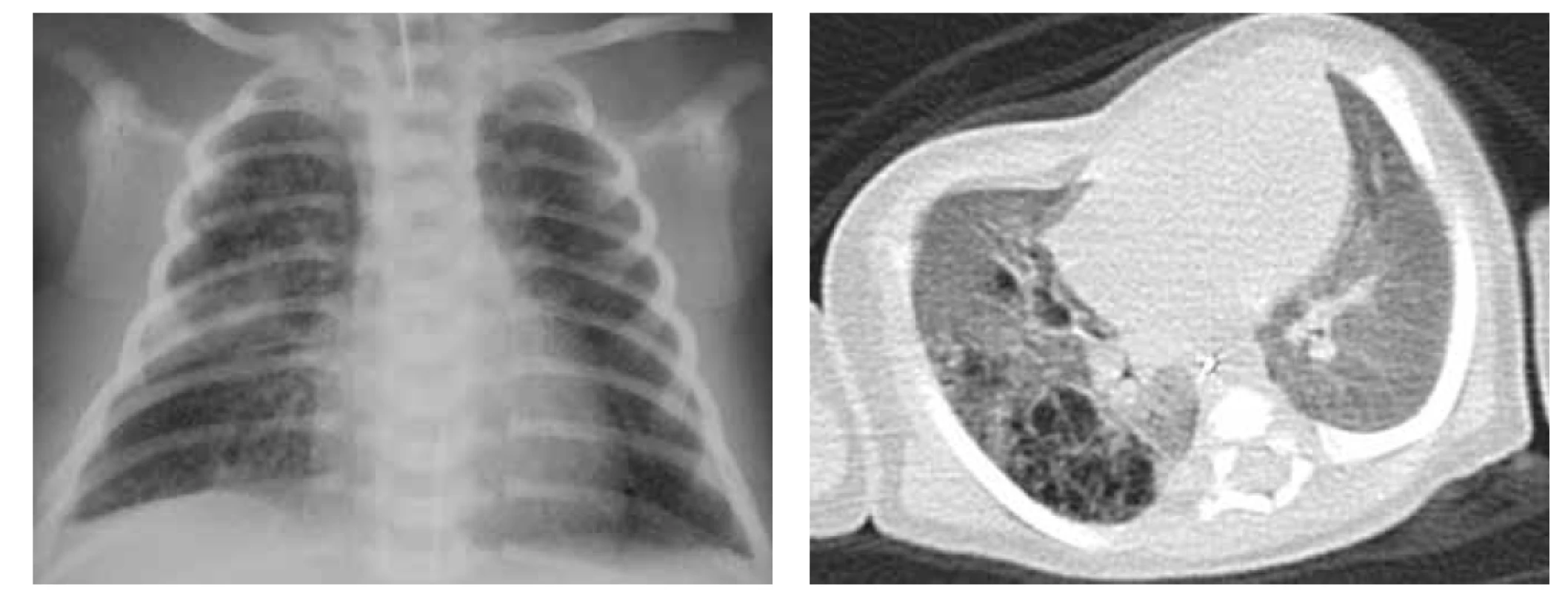
Image 4. A. CT hrudníku, transverzální řez, CPAM typu 1 v LDL.
Fig. 4A. Chest CT scan, transversal cut, CPAM type 1 in left lower lobe.
Obr. 4B. CT hrudníku, transverzální řez, pneumonie LDL v CPAM.
Fig. 4B. Chest CT scan, transversal cut, pneumonia in CPAM in left lower lobe.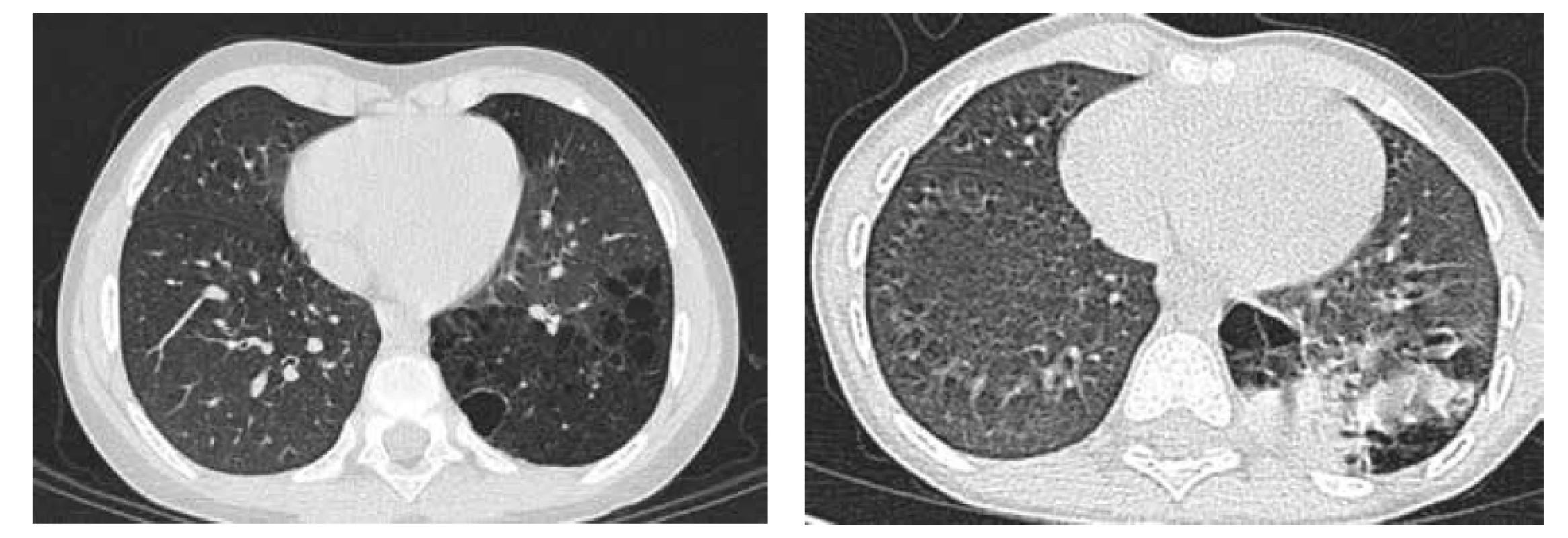
Image 5. A. CT hrudníku, koronární řez, hypoplastická pravá plíce s vadou sekvestračního spektra s projevy tachydyspnoe při virovém respiračním infektu.
Fig. 5A. Chest CT scan, coronary cut, hypoplastic right lung with pulmonary sequestration. An infant with tachydyspnea by having a common flu.
Obr. 5B. CT hrudníku, 3D rekonstrukce.
Fig. 5B. Chest CT scan, 3D reconstruction.
Obr. 5C. CT plic, angiografie, 3D rekonstrukce, systémové cévní zásobení pravé plíce.
Fig. 5C. CT of the lungs, angiography, 3D reconstruction, systemic vessel´s supply of the right lung.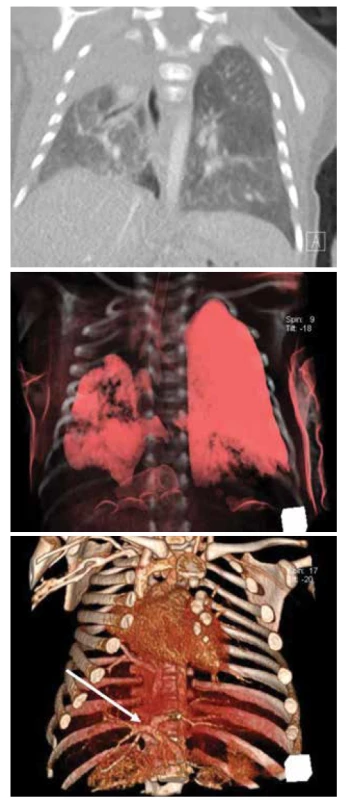
Image 6. A. RTG plic, PS LDL, náhodný nález při kontrolním snímku pro pravostrannou pneumonii.
Fig. 6A. X-ray of the lungs, PS in left lower lobe, accidental finding on control X-ray being done for the pneumonia in the other side.
Obr. 6B. CT plic, transverzální řez, PS LDL s mohutnou přívodnou tepnou odstupující z hrudní aorty.
Fig. 6B. CT of the lungs, transversal cut, PS in left lower lobe with a huge artery supply from the thoracic aorta.
Obr. 6C. CT plic, angiografie, 3D rekonstrukce.
Fig. 6C. CT of the lungs, angiography, 3D reconstruction.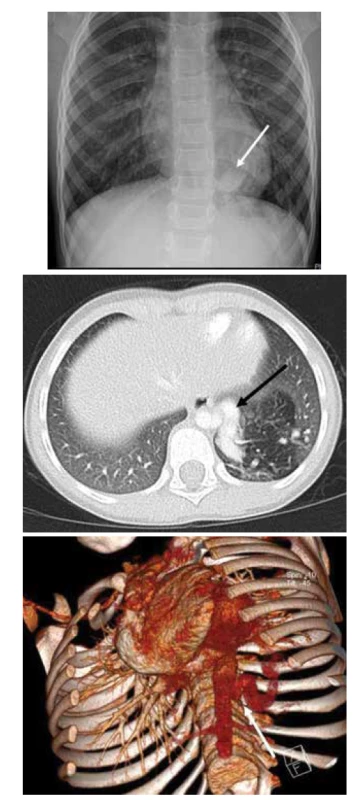
Oermann rozlišuje pacienty s vysokým a nízkým rizikem komplikací vady. Do rizikové skupiny se řadí velké léze přesahující 20 % hemithoraxu, oboustranné nebo multifokální cysty, pneumothorax, rodinná anamnéza pleuropulmonálního blastomu a sdružených chorob (viz výše). Tito pacienti jsou indikovaní k časnému zobrazení vady (CT hrudníku) a odstranění nejpozději do 6 měsíců věku. V nízkém riziku jsou pacienti asymptomatičtí bez výše zmíněných rizik. Zde se nabízí elektivní resekce nebo konzervativní postup, tedy observace. Pokud se zvolí chirurgické řešení, pak většinou operují kolem 1 roku věku, respektive i dříve. Pokud se postupuje konzervativně, dítě se zvýšeně monitoruje stran rozvoje infekce a každoročně se provádí zobrazovací vyšetření [13]. Je zvyklostí pracoviště, kterou zobrazovací metodu zvolí s ohledem na zkušenosti, věk dítěte, radiační zátěž a potřebu sedace [7].
V kanadské studii analyzující publikované případy zahrnující 168 pacientů s CPAM, 70 dětí bylo operováno před rozvinutím příznaků s 10% výskytem komplikací, 63 vyvinulo příznaky (max. věk 7 let) a následně bylo operováno s komplikacemi ve 32 % případů a 35 pacientů bylo nadále sledováno s časovým rozpětím 3 měsíců – 9 let, průměrně dle studií 17 měsíců až 3 roky [14]. Asi v nejrozsáhlejší studii konzervativně řešených pacientů s CTM na Mayo Clinic čítající soubor 110 pacientů, jich 8 mělo symptomy v novorozeneckém věku, pro které byli operováni. Zbylí pacienti byli sledováni s průměrným věkem 47 let (4–80), z nich 84 (82 %) vyvinulo infekci v malformaci a 18 z nich bylo řešeno s podezřením na tumor. Byla zaznamenána větší perioperační a pooperační morbidita, než je tomu při resekci asymptomatické vady s morbiditou do 9 % operovaných dětí v kojeneckém věku [3, 6].
Ve většině studií zabývajících se funkcemi plic u dětí s CPAM nebyl zaznamenán signifikantní rozdíl mezi časně operovanými dětmi do 2 let a později [14, 15], stejně tak mezi operovanými a sledovanými kojenci s ponechanou vadou. Vyšetřované plicní funkce po chirurgické resekci v dlouhodobém, minimálně 5letém sledování, vykazují normální hodnoty vzhledem k věku [3]. Na druhé straně pacienti, u kterých se rozvinuly symptomy z CPAM a byli operováni, měli následně snížené plicní funkce [14]. Jinde sledované děti s CTM bez rozdílu, zda byly operovány či se u nich vyvinuly příznaky, měly v 7 letech velmi mírnou redukci vitální kapacity, totální vitální kapacity a usilovného vteřinového výdechového objemu (FEV1) [15]. Chybí ale dostatek dat ohledně funkčního vyšetření plic u dětí s kongenitálními hrudními malformacemi. V našem souboru je limitovaný počet funkčního vyšetření plic pacientů pooperačně, ojediněle provedené spirometrie jsou s normálním nálezem.
Souhrnem lze říct, že pozdní komplikace asymptomatických kongenitálních hrudních malformací převáží „akceptovatelnou morbiditu“ resekcí. Z pooperačních komplikací se jedná nejčastěji o protrahovaný air-leak syndrom [3]. I přes dostupná publikovaná data neexistuje jasně daný návod, jak postupovat a je nutno volit individuální přístup.
Celková mortalita při prenatálně diagnostikované vadě se odhaduje na méně než 5 %, důležitým prediktorem mortality je přítomnost fetálního hydropsu. Morbidita je nízká. Po elektivním odstranění asymptomatické vady má přes 80 % dětí normální funkční vyšetření plic a jsou zcela bez potíží.
ZÁVĚR
Asymptomatické kongenitální hrudní malformace představují leckdy terapeutický problém, kdy, jak a jestli vůbec je léčit. Stále není dostatek dat, aby se dalo předvídat chování malformace a optimalizovat tak naši léčbu. Časné chirurgické řešení umožňuje adekvátní vývoj plic, snižuje výskyt respiračních a infekčních komplikací, eliminuje možnost rozvoje tumoru plic či jeho falešně pozitivní diagnózu v dospělém věku. Optimálnímu terapeutickému přístupu by napomohl vznik mezinárodního registru kongenitálních hrudních malformací a důsledné statistické zpracování dat.
Došlo: 19. 4. 2021
Přijato: 14. 5. 2021
Korespondující autorka:
MUDr. Jana Micherová
Dětská klinika LF a FN
Sokolská 581
500 05 Hradec Králové
e-mail: jana.micherova@fnhk.cz
Sources
1. Wilmott WR, Chernick V, Boat FT, et al. Kendig and Chernick‘s Disorders of the Respiratory Tract in Children. 8th ed. Philadelphia: Saunders, an imprint of Elsevier Inc., 2012 : 317–376. ISBN: 978-1-4377-1984-0.
2. Pohunek P, Koťátko P, Tuková J. Dětská pneumologie. Praha: Mladá fronta a.s., 2018 : 284–301. ISBN 978-80-204-4912-2.
3. Egloff A, Bulas D. Congenital pulmonary airway malformation: Prenatal diagnosis and management. UpToDate, 2020.
4. Bulas D, Egloff A. Prenatal diagnosis and management of bronchopulmonary sequestration. UpToDate, 2020.
5. Oermann Ch. Congenital pulmonary airway (cystic adenomatoid) malformation. UpToDate, 2020.
6. Mafalda D, Ruben L, Tiago H. Prenatal and postnatal management of congenital pulmonary airway malformation. Neonatology 2016; 110 : 101–115.
7. Oermann Ch. Bronchopulmonary sequestration. UpToDate, 2020.
8. Lau CT, Kan A, Shek N, et al. Is congenital pulmonary airway malformation really a rare disease? Result of prospective registry with universal antenatal screening program. Pediatr Surg Int 2017; 33 : 105–108.
9. Min JY, Won HS, Lee MY, et al. Intrauterine therapy for macrocystic congenital cystic adenomatoid malformation of the lung. Obstet Gynecol Sci 2014; 57 (2): 102–108.
10. Fievet L, Natale C, D´Journo XB, et al. Congenital pulmonary airway malformation and sequestration: Two standpoints for a single condition. J Minim Access Surg 2015; 11 (2): 129–133.
11. Casagrande A, Pederiva F. Association between congenital lung malformations and lung tumors in children and adults: a systematic review. J Thorac Oncol 2016; 11 : 1837–1845.
12. Balkanli S, Özturk A, Köse M, et al. A report of adenocarcinoma in situ and congenital pulmonary airaway malformation in a three-day-old infant with a review of the literature. Turk J Pediatr 2014; 56 : 299–302.
13. Bagrodia N, Cassel S, Liao J, et al. Segmental resection for the treatment of congenital pulmonary malformations. J Pediatr Surg 2014; 45 : 905–909.
14. Baird R, Puligandla P, Laberge J. Congenital lung malformations: Informing best practice. Semin Pediatr Surg 2014; 23 : 270–277.
15. Laberge J, Puligandla P, Flageole H. Asymptomatic congenital lung malformations. Semin Pediatr Surg 2005; 14 : 16–33.
Labels
Neonatology Paediatrics General practitioner for children and adolescents
Article was published inCzech-Slovak Pediatrics

2021 Issue 5-
All articles in this issue
- Congenital pulmonary airway malformation
- Postpartum mother-infant bonding from the aspect of preventing child maltreatment
- Bulky gastroduodenal trichobezoar (Rapunzel syndrome) causing abdominal pain and anorexia in a nine-year-old female
- Iron deficiency anemia caused by malnutrition – case report
- Congenital pulmonary airway malformation and pulmonary sequestration – 15 years of experience at the Department of Pediatrics, University Hospital in Hradec Králové
- The fatal consequences of CAN syndrome – scoping review
- Rozloučení s naším milovaným primářem
- Kniha: Předčasně narozené dítě
- Podíl českých dětských chirurgů na globální studii o přežití dětí s vrozenými vývojovými vadami
- Czech-Slovak Pediatrics
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Congenital pulmonary airway malformation
- Iron deficiency anemia caused by malnutrition – case report
- Bulky gastroduodenal trichobezoar (Rapunzel syndrome) causing abdominal pain and anorexia in a nine-year-old female
- Congenital pulmonary airway malformation and pulmonary sequestration – 15 years of experience at the Department of Pediatrics, University Hospital in Hradec Králové
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

